su uno stesso piano, a 0
|
|
|
- Giovanni Gattini
- 5 anni fa
- Visualizzazioni
Transcript
1 2 lezione Gli angoli e variano da 180 (+ o -) quando i piani della proteina sono allineati su uno stesso piano, a 0
2 L asse di legame C -C può compiere una rotazione completa da -180 a 0 ( ) Quando gli angoli e si mantengono invariati in un certo segmento della proteina avremo strutture regolari. Solo poche strutture secondarie sono stabili, le principali sono l a-elica e i filamenti. Se non è identificabile una struttura regolare si parla di random coil. (definizione impropria) Infatti la struttura delle proteine non è mai casuale. L' -elica si forma quando un certo numero di coppie successive degli angoli e assumono valori intorno a -60 e -50 rispettivamente. In questo modo i piani peptidici si dispongono in maniera elicoidale intorno ad un asse longitudinale. L' -elica ha un passo di 5.4 Å ed ogni spira dell'elica è costituita da 3.6 residui aminoacidici
3 Lo scheletro carbonioso polipeptico si avvolge intorno ad un asse immaginario longitudinale al centro della spirale. L unità che si ripete è il singolo giro dell elica elica di 5,4 A, ogni giro contiene 3,6 amminoacidi. I gruppi R sporgono in fuori e non partecipano alla formazione dei legami. MODELLO A NASTRO Strutture secondarie: l elica Filamento : conformazione ripetitiva, lo scheletro della proteina si dispone a zig-zag. I filamenti posti uno affianco all altro altro formano un foglietto pieghettato mantenuto da legami a H tra regioni adiacenti o anche molto distanti della stessa catena proteica, o tra filamenti appartenenti a proteine diverse. I guppi R sporgono in direzioni opposte. La direzione dei filamenti adiacenti che contraggono i legami a H possono essere orientati nella stessa direzione (paralleli) o in direzione opposta (antiparalleli) La struttura è identica anche se il periodo della parallela è leggermente più corto 6,5 rispetto a 7 A Le catene possono essere parallele o antiparallele
4 I ripiegamenti sono frequenti nelle proteine. Le proteine globulari presentano circa 1/3 dei residui aa sotto forma di ripiegamenti o anse, dove la catena proteica inverte la sua direzione, i ripiegamenti sono i più diffusi, collegano due estremità di un foglietto antiparallelo, 4 residui con un angolazione di 180 e formazione di un ponte di H tra il Carbonile del I a. e l H lh dell N del IV amminoacido. Gly e Pro sono frequenti in questa conformazione. Gly perché piccola e flessibile Pro perché l imminoacido promuove la forma cis degli aa. coinvolti nel legame In una proteina segmenti peptidici di varia lunghezza si dispongono a formare strutture regolari. Queste strutture sono molto diffuse in quanto stabili, poiché minimizzano le repulsioni steriche e rendono massima la potenzialità di formazione dei legami idrogeno. Le più comuni strutture secondarie sono le - eliche, mentre il secondo elemento strutturale tt principale i presente nelle proteine strutturali è il filamento che spesso si presenta sotto forma di foglietto costituito da due o più filamenti. La disposizione più comune di un - elica è all esterno della proteina con un lato rivolto verso il solvente e l altro laltro verso l interno della proteina stessa. In questo caso l elica si dice amfipatica e la sequenza primaria presenta un alternanza regolare di aminoacidi a carattere idrofilico e idrofobico. Il foglietto è una struttura stabile se costituito da più filamenti e può essere parallelo o antiparallelo a seconda della direzione in cui sono disposti i vari filamenti.
5 Le strutture secondarie sono mantenute da legami idrogeno tra atomi di residui aminoacidici.
6 Le strutture secondarie sono preferite Le strutture secondarie consentono, infatti, l'instaurarsi del maggior numero di legami a H tra i gruppi dello scheletro polipeptidico ed impediscono a quest'ultimo di interagire con l'ambiente acquoso Quattro livelli di struttura determinano la forma di una proteina alfa Beta Primaria: la sequenza lineare degli amino acidi tenuti insieme da legami peptidici. i Secondaria: l organizzazione di parti di una catena polipeptidica (es.: l elica o il foglietto ), tenute da legami a ponte di H. Terziaria: la struttura tridimensionale completa di una catena polipeptidica, con molti tipi di legami e interazioni di cui solo uno covalente il ponte ds. Quaternaria: l associazione di due o più polipeptidi in una struttura complessa multi-subunità
7 Struttura terziaria : relazione a lungo raggio tra amminoacidi anche molto distanti tra di loro, I protagonisti sono i gruppi R che possono appartenere anche a filamenti con diverse strutture secondarie. ORIGINE DELLA STRUTTURA TERZIARIA
8 L'effetto idrofobico è la forza motrice del ripiegamento di una proteina. La struttura terziaria si genera grazie alle interazioni tra i gruppi R. I quali si posizioneranno in risposta a attrazione o repulsione, generando la struttura tt finale. Le strutture terziarie sono sempre compatte La superficie delle proteine è polare mentre l'interno è prevalentemente t apolare
9 L'avvolgimento della catena deve essere tale da esporre sempre al solvente acquoso le catene laterali li idrofile. Catene laterali cariche possono trovarsi all'interno di una proteina solo se la loro carica netta viene neutralizzata. Legami responsabili della struttura terziaria Forze di Wan der Waals 1-2 Kcal/mole Legami a H 3-7Kcal/mole l Legami ionici 5 Kcal/mole Legami S-S 50 Kcal/mole
10
11 In alcune catene e polipeptidiche pept e particolarmente lunghe (più di 200 residui) si ritrovano 2 o più zone distinte ( residui) a struttura globulare e compatta, congiunte da segmenti di catena polipeptidica relativamente flessibili. Queste strutture si definiscono DOMINI
12 Se si separa, attraverso un idrolisi controllata, un dominio dal resto della catena polipeptidica di cui fa parte, la molecola corrispondente al domino mostra la capacità di ripiegarsi riassumendo nuovamente la struttura tt e spesso anche la funzione che aveva quando era unita al resto della catena polipeptidica. p p Nel 1974 è stato scoperto uno dei domini più ampiamente distribuito, formato da 70 residui che presenta una super struttura secondaria del tipo (ripiegamento di Rosman). Esso è presente in numerose proteine, enzimatiche, anche a struttura molto diversa, ma che hanno in comune la funzione di legare un coenzima nucleotidico (NAD )
13
14 E' stata avanzata l'ipotesi che questo dominio sia quello che resta di una primitiva proteina di epoche precellulari. Tutti gli organismi viventi discendono da pochi progenitori, così la grande maggioranza delle proteine deve essere derivata da un numero ristretto di archetipi I genomi eucariotici sono costruiti in modo da facilitare la riorganizzazione occasionale di sequenze di DNA atte a creare un gene che codifichi per nuove combinazioni di domini proteici
15 La struttura terziaria di una proteina globulare costituita da più domini i é la conseguenza della organizzazione dei vari domini e di tratti di struttura secondaria che li congiungono. Proteine che possiedono piu' siti di legame per ligandi distinti spesso presentano questi siti di legame localizzati su diversi domini. Domini diversi in proteine multifunzionali possono svolgere funzioni diverse. I vari domini presenti su una proteina mostrano talvolta spostamenti reciproci relativi, collegati all'attività della proteina. (Es. Esochinasi)
16
17 Nelle cellule le proteine si sintetizzano ad una velocità molto elevata. Le cellule di EColiproducono E.Coli una molecola proteica biologicamente attiva contenente 100 residui aminoacidici in 5 sec a37.
18 COME FANNO LE PROTEINE AD AVVOLGERSI NEL TEMPO DI POCHI SECONDI? Supponiamo che ciascuno dei 2 angoli di torsione, di una proteina con n residui possa assumere 3 conformazioni stabili, le conformazioni possibili per questa proteina saranno 3 2n Se la proteina può esplorare una conformazione ogni secondi Il tempo in sec necessario per esplorare tutte le conformazioni possibili sarà t = 10 n / Per n= 100 t = ( 20 miliardi di anni!)
19 Le proteine non ricercano casualmente la conformazione nativa fra le molte possibili si ripiegano i seguendo vie dirette PICCOLI TRATTI DI STRUTTURA SECONDARIA SERVONO DA MEDIATORI DEL PROCESSO DI AVVOLGIMENTO.
20 LA FORMAZIONE DI CORTI SEGMENTI DI STRUTTURA SECONDARIA È MOLTO VELOCE. Questi piccoli tratti (circa 15 residui) si stabilizzano formando dei complessi (es 2, 2 ) che si chiamano unità di avvolgimento. Intorno a questi centri si stabilizzano poi altri tratti di struttura secondaria
21 L'avvolgimento spontaneo delle catene polipeptidiche nella loro corretta struttura terziaria a è un processo altamente cooperativo, in cui la formazione di piccoli elementi accelera la produzione di altri più grandi
22 Il processo di ripiegamento di una proteina procede da uno stato ad alta energia ed alta entropia ad uno a bassa energia e bassa entropia IL processo di avvolgimento delle proteine può essere accelerato dall enzima proteina disolfuro isomerasi
23
24 Le proteine con peso molecolare l superiore a sono OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche p p PROTOMERI O SUBUNITÀ Le proteine oligomeriche presentano un ulteriore livello di organizzazione srutturale la struttura quaternaria LA STRUTTURA QUATERNARIA descrive il modo in cui le singole catene polipeptidiche sono disposte l'una rispetto all'altra.
25 Vantaggi della struttura quaternaria Risparmio di DNA Minimizzazione Mi i i i degli d li errorii casuali li durante la biosintesi proteica Presenza di interazioni allosteriche
26 Per la sintesi i di una catena polpeptidica di 4000 residui aminoacidici è necessario un gene che contenga almeno 4OOO x 3 = basi azotate. Per la sintesi di 2O copie di una stessa catena polipeptidica di 200 residui è sufficiente un gene che contenga solo 200 x 3 = 600 basi La Ferritina ha un peso molecolare di circa daltons. Non è costituita da una sola catena polipeptidica di 400 a.a. ma di 20 catene identiche di circa 200 residui ciascuna.
27 LA GLICERALDEIDE-3-FOSFATO DEIDROGENASI È COSTITUITA DA 4 SUBUNITÀ IDENTICHE DI 330 RESIDUI (330 X 3 = 990 NUCLEOTIDI) SE LA PROTEINA CONSISTESSE IN 1 CATENA DI (330 X 4) 1320 RESIDUI OCCORREREBBE UN GENOMA DI 3 X 1320=3960 NUCLEOTIDI.
28 Generalmente nella formazione delle proteine oligomeriche le subunità difettose sono scartate.
29 LA STRUTTURA QUATERNARIA DI UNA PROTEINA PUÒ SUBIRE MODIFICHE CONFORMA ZIONALI REVERSIBILI AD OPERA DI LIGANDI, DEFINITI EFFETTORI ALLOSTERICI. LE MODIFICHE CONFORMAZIONALI POSSONO ALTERARE LA FUNZIONE DI UNA PROTEINA, REALIZZANDO IN TAL MODO UN IMPORTANTE MECCANISMO DI CONTROLLO DELLA SUA ATTIVITÀ BIOLOGICA.
30
31 I residui di cisteina possono formare ponti disolfuro intra o extra catena Classificazione generale delle strutture terziarie Proteine con predominanza di elica Proteine miste Proteine con predominanza di sheets Biofisica
32 La struttura quaternaria delle proteine La struttura quaternaria riguarda proteine costituite da 2 o più catene polipeptidiche o da più domini strutturali (es. proteine regolatrici). E possibile classificare le proteine in due gruppi: Proteine fibrose con catene dispostest in lunghi fasci o foglietti e Proteine globulari con catene polipeptidiche ripiegate a formare forme globulari o sferiche Esempio: la emoglobina Le interazioni tra le subunità consentono grandi variazioni nell attività catalitica Biofisica La struttura terziaria è generata dal ripiegamento e dalla conformazione one della catena polipeptidica. pept La struttura quaternaria è l organizzazione di polipeptidi in un unica unità funzionale che consiste di più di una subunità polipeptidica.
33 Rappresentazioni grafiche differenti della stessa proteina
34 Conformazione, modificazione e degradazione delle proteine Una catena polipeptidica pept appena sintetizzata deve e conformarsi e spesso subire modificazioni chimiche per generare la proteina finale Tutti i polipeptidi con la stessa sequenza amminoacidica idi assumono, in condizioni standard, la stessa conformazione (lo stato nativo), che è la più stabile conformazione one che la molecola può assumere. 3 lezione
35 Per alcune proteine a tale processo partecipano gli chaperoni molecolari che : contribuiscono al corretto avvolgimento di una proteina nascente consentono alle proteine ripiegate in modo non corretto di raggiungere la conformazione nativa Esistono due classi di chaperoni molecolari :la famiglia Hsp70 e le chaperonine (Hps60 o GroEL ed o Hsp10 GroES )
36 Le chaperonine sono costituite da due tipi di proteine HP60 (GroEL) e HP10 (GroES) GroEL 14 subunità identiche (549 aa) disposte in due anelli sovrapposti (7+7) GroES 7 subunità identiche (97aa) formano un anello eptamerico
37 L informazione per il folding della proteina è contenuta nella sequenza Proteine denaturare al calore, con acidi, o chimici perdono la struttura terziaria e secondaria e la funzione biologica. Il processo è reversibile
38 Le chaperonine assistono le proteine nella fase di folding, prevenendo il legame con ligandi inappropriati.
39 Molte malattie sono dovute al difettoso ripiegamento di una proteina Alcune patologie derivano da proteine che non sono in grado di raggiungere la loro struttura funzionale e che tendono a formare grossi aggregati (fibrille o forme amiloidi): Alzheimer, Parkinson, encefalopatia spongiforme, diabete di tipo II. In altri casi mutazioni puntiformi generano proteine che non raggiungono la loro locazione finale o che non sono più in grado di svolgere la loro funzione perché incapaci di legare i loro substrati. La fibrosi cistica è un difetto nella proteina transmembrana che agisce come un canale degli ioni cloro nelle cellule epiteliali (CFTR: 1480 amminoacidi). La mutazione più comune è la delezione di un amminoacido (Phe 508) e la proteina mutata non si avvolge correttamente. Proteine conformate in modo aberrante sono implicate nello sviluppo di patologie Una placca amiloide nella malattia di Alzheimer è un agglomerato di filamenti proteici
40 Comparazione sequenze Hum globina: Bovis: Pig: mvlspadktn vkaawgkvga hageygaeal mvlsaadkgn g vkaawgkvgg gg haaeygaeal vlsaadkan vkaawgkvgg qagahgaeal ermflsfptt ktyfphfdls hgsaqvkghg kkvadaltna vahvddmpna ermflsfptt ktyfphfdls hgsaqvkghg akvaaaltka vehlddlpga ermflgfptt ktyfphfnls hgsdqvkahg kvadaltka vghlddlpga lsalsdlhahl h klrvdpvnfk llshcllvtl aahlpaeftp avhasldkfl lselsdlhah klrvdpvnfk llshsllvtl ashlpsdftp avhasldkfl lsalsdlhah klrvdpvnfk llshcllvtl aahhpddfnp svhasldkfl asvstvltsk yr anvstvltsk yr anvstvltsk yr L omologia delle sequenze suggerisce relazioni i funzionali ed evolutive tra le proteine
41 Degradazione Proteica Regolata Sistema autofagico lisosomiale Sistema Calpaina-CalpastatinaCalpastatina Sistema Ubiquitina-Proteasoma
42 Il sistema proteolitico calpaina/calpastatina è espresso nel citosol di tutte le cellule di mammifero ed è costituito da uno o più membri della famiglia delle calpaine e da una o più forme dell'inibitore calpastatina. La famiglia della calpaine è costituita da circa 15 membri bi che hanno in comune una serie di proprietà catalitiche e regolatrici. Una delle caratteristiche comune a tutte le forme di calpaina è la suddivisione del dominio catalitico in due sottodomini.
43 Modificato da: La Stampa, 7 ottobre 2004 Il premio Nobel per la Chimica 2004 è stato attribuito ai tre ricercatori che più hanno contribuito alla scoperta della«catena di smontaggio» delle proteine: sono l americano Irwin Rose, Università della California, e gli israeliani Aaron Ciechanover e Avram Hershko, entrambi dell Institute of Technology di Haifa. Il ruolo chiave nella demolizione delle proteine è affidato a una molecola relativamente piccola e semplice, un polipeptide chiamato «ubiquitina» (deriva dal latino, significa «sostanza che si trova dappertutto»). Quando una proteina deve essere rottamata - spiegano i vincitori - riceve una specie di bacio mortale. A baciare la proteina da demolire è appunto l ubiquitina, la cui scoperta risale al Si tratta di un bacio molto audace, perché questa molecola si lega alla proteina da distruggere in modo indissolubile con un meccanismo del tipo chiaveserratura molto diffuso nella chimica degli organismi viventi. Ricevuto il bacio letale, la proteina da rottamare finisce nel proteosoma, il tritatutto delle cellule, che in pochissimo tempo la ridurrà in minuti pezzetti, poi eliminati o riciclati.
44 In realtà l operazione è più complessa e richiede l intervento di tre enzimi. Il primo, chiamato E1, attiva la molecola di ubiquitina, e questa reazione richiede energia, liberata da una molecola di ATP. Il secondo enzima, E2, si lega all ubiquitina attivata e il terzo, E3, individua l oggetto da demolire. Il complesso ubiquitina-e2 aderisce strettamente alla proteina ed E3 rilascia la proteina marcata con l ubiquitina. L operazione o e si ripete finché si apre il proteosoma, cioè il tritatutto, tatutto che staccando l ubiquitina (che sarà di nuovo disponibile per il suo lavoro), smonterà la proteina pezzo a pezzo. Il meccanismo è stato chiarito da Rose, Ciechanover ed Hershko nel 1983 con esperimenti su topi transgenici. La demolizione delle proteine è fondamentale quanto la loro costruzione: la pepsina, la tripsina, insieme ad altri enzimi proteolitici ad esempio, spezzettano le proteine complesse del cibo in amminoacidi, passaggio indispensabile per farci assimilare il cibo, che avviene nello stomaco e intestino. L eliminazione delle proteine è essenziale anche nel ciclo riproduttivo delle cellule, nella riparazione degli errori di copiatura del DNA e nelle reazioni del sistema immunitario che ci difendono dalle infezioni e dalle aggressioni dell ambiente. Anche in malattie come il cancro e la fibrosi cistica il ruolo dell ubiquitina è determinante. Errori nella demolizione di proteine alterate sono all origine di molte malattie, ed è per questo motivo che le scoperte compiute dai tre ricercatori premiati con il Nobel possono aprire la strada a nuovi farmaci, in grado di curarle alla radice.
45
46
47
48 FINE
49
50
51
52 Le proteine comunicano tra di loro e con altre molecole. Questo comportamento è alla base della scelta dei partner e della costruzione dei pathway. La superficie determinata dalle catene laterali degli aa. è alla base di questa proprietà Esempi di modalità di interazione ALLOSTERIA (ad es. nei recettori, nei canali ionici, nella contrazione). MOVIMENTO (ad es. il colpo generato dalla miosina a seguito dell azione ATPasica delle 2 teste, e dell actina che dopo il legame con l ATP polimerizza consentendo alla miosina di attaccarsi) TRASFORMAZIONE (Gli Enzimi che trasformano il ligando Substrato in Prodotto) FOSFORILAZIONI (legame covalente con il ligando PO 4 che modifica la struttura e quindi le interazioni successive)
53
Riepilogo 1^ lezione
 Riepilogo 1^ lezione I 20 amminoacidi che si trovano comunemente nelle proteine sono uniti l uno all altro da legami peptidici. La sequenza lineare degli amminoacidi legati contiene l informazione necessaria
Riepilogo 1^ lezione I 20 amminoacidi che si trovano comunemente nelle proteine sono uniti l uno all altro da legami peptidici. La sequenza lineare degli amminoacidi legati contiene l informazione necessaria
SOSTEGNO proteine strutturali (collagene, cheratina, elastina, fibroina) CATALISI (enzimi)
 PROTEINE STRUTTURA E FUNZIONE DELLE PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica
PROTEINE STRUTTURA E FUNZIONE DELLE PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
La demolizione delle proteine è fondamentale quanto la loro costruzione:
 La demolizione delle proteine è fondamentale quanto la loro costruzione: la pepsina, la tripsina, insieme ad altri enzimi proteolitici, spezzettano le proteine complesse del cibo in amminoacidi, passaggio
La demolizione delle proteine è fondamentale quanto la loro costruzione: la pepsina, la tripsina, insieme ad altri enzimi proteolitici, spezzettano le proteine complesse del cibo in amminoacidi, passaggio
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
30/10/2015. Molte proteine sono. intrinsecamente disordinate. o destrutturate (IDP/IUP), cioè non hanno una struttura
 Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
LE PROTEINE -struttura tridimensionale-
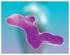 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
Le Biomolecole II parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole II parte Lezioni d'autore di Giorgio Benedetti LA STRUTTURA TERZIARIA DI UNA PROTEINA La struttura tridimensionale adottata da una proteina è detta struttura terziaria. Essa prende in considerazione
Le Biomolecole II parte Lezioni d'autore di Giorgio Benedetti LA STRUTTURA TERZIARIA DI UNA PROTEINA La struttura tridimensionale adottata da una proteina è detta struttura terziaria. Essa prende in considerazione
COMPOSTI AZOTATI. derivanti dall ammoniaca AMMINE. desinenza -INA AMMIDE
 COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
dominio strutturale dominio modulo
 Riepilogo 2^lezione DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali
Riepilogo 2^lezione DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali
Il legame peptidico è polare
 Scaricato da Il legame peptidico è polare SONO FAVORITE QUELLE CONFIGURAZIONI CHE CONSENTONO IL MAGGIOR NUMERO DI INTERAZIONI TRA LE PARTI DELLA CATENA POLIPEPTIDICA. A CAUSA DELLA POLARITA' DEL LEGAME
Scaricato da Il legame peptidico è polare SONO FAVORITE QUELLE CONFIGURAZIONI CHE CONSENTONO IL MAGGIOR NUMERO DI INTERAZIONI TRA LE PARTI DELLA CATENA POLIPEPTIDICA. A CAUSA DELLA POLARITA' DEL LEGAME
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH
 Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA
 PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
30/10/2015 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE
 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Parametri dell α-elica. residui/giro 3.6. passo dell elica
 GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
Dall RNA alle proteine. La traduzione nei procarioti e negli eucarioti
 Dall RNA alle proteine La traduzione nei procarioti e negli eucarioti Codice genetico La sequenza dell mrna viene decodificata a gruppi di tre nucleotidi, e tradotta in una sequenza di amminoacidi 4 x
Dall RNA alle proteine La traduzione nei procarioti e negli eucarioti Codice genetico La sequenza dell mrna viene decodificata a gruppi di tre nucleotidi, e tradotta in una sequenza di amminoacidi 4 x
OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ
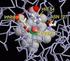 Scaricato da Le proteine con peso molecolare superiore a 50.000 sono OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ SunHope.it 1 Scaricato da Le proteine oligomeriche
Scaricato da Le proteine con peso molecolare superiore a 50.000 sono OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ SunHope.it 1 Scaricato da Le proteine oligomeriche
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Le biomolecole si trovano negli organismi viventi
 Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi
 POTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,, O, N) macromolecole organiche, molecole informazionali, polimeri
POTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,, O, N) macromolecole organiche, molecole informazionali, polimeri
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura terziaria delle proteine
 La struttura terziaria delle proteine 1 La struttura terziaria L arrangiamento spaziale degli aminoacidi di una singola catena polipeptidica a formare la sua struttura tridimensionale a domini viene chiamata
La struttura terziaria delle proteine 1 La struttura terziaria L arrangiamento spaziale degli aminoacidi di una singola catena polipeptidica a formare la sua struttura tridimensionale a domini viene chiamata
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
lati esterni altamente Idrofilici
 I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Sequenza di Kozak Inizio della TRADUZIONE Nucleotidi in blod 100% conservati, sequenza consensus (GCC) G(-6) CC A/G(-3) CC ATG G(+4)
 Sequenza di Kozak Inizio della TRADUZIONE Nucleotidi in blod 100% conservati, sequenza consensus (GCC) G(-6) CC A/G(-3) CC ATG G(+4) Proteine maggior parte della massa cellulare esclusa l acqua ATP utilizzato
Sequenza di Kozak Inizio della TRADUZIONE Nucleotidi in blod 100% conservati, sequenza consensus (GCC) G(-6) CC A/G(-3) CC ATG G(+4) Proteine maggior parte della massa cellulare esclusa l acqua ATP utilizzato
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Proteine. Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana)
 Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
STRUTTURA E FUNZIONE DELLE
 STRUTTURA E FUNZIONE DELLE PROTEINE Compongono la STRUTTURA della cellula ma hanno anche altre FUNZIONI intelaiatura citoscheletrica strutture cellulari (organelli) impalcatura di sostegno extracellulare
STRUTTURA E FUNZIONE DELLE PROTEINE Compongono la STRUTTURA della cellula ma hanno anche altre FUNZIONI intelaiatura citoscheletrica strutture cellulari (organelli) impalcatura di sostegno extracellulare
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
Fondamentali in ogni organismo, hanno molteplici ruoli:
 Le proteine Fondamentali in ogni organismo, hanno molteplici ruoli: Componenti strutturali (collagene, tessuto connettivo, citoscheletro, pelle) Trasportatori (emoglobina, albumina) Trasmettitori di messaggi
Le proteine Fondamentali in ogni organismo, hanno molteplici ruoli: Componenti strutturali (collagene, tessuto connettivo, citoscheletro, pelle) Trasportatori (emoglobina, albumina) Trasmettitori di messaggi
Macromolecole Biologiche. La struttura secondaria (I)
 La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
Costituenti chimici della materia vivente
 Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Schemi delle lezioni 1
 Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Acquisizione e Stabilità della struttura terziaria delle proteine
 Acquisizione e Stabilità della struttura terziaria delle proteine FORZE CHE STABILIZZANO LA STRUTTURA TERZIARIA DELLE PROTEINE 1. Legame covalente S-S (forte): non è presente in tutte le proteine che,
Acquisizione e Stabilità della struttura terziaria delle proteine FORZE CHE STABILIZZANO LA STRUTTURA TERZIARIA DELLE PROTEINE 1. Legame covalente S-S (forte): non è presente in tutte le proteine che,
Nel DNA e nell RNA i nucleotidi sono legati covalentemente da legami fosfodiesterei.
 DNA e RNA Composizione e proprietà Struttura Analisi 1 STRUTTURA DAGLI ACIDI NUCLEICI Nel DNA e nell RNA i nucleotidi sono legati covalentemente da legami fosfodiesterei. I gruppi fosforici hanno pka vicino
DNA e RNA Composizione e proprietà Struttura Analisi 1 STRUTTURA DAGLI ACIDI NUCLEICI Nel DNA e nell RNA i nucleotidi sono legati covalentemente da legami fosfodiesterei. I gruppi fosforici hanno pka vicino
Struttura e funzione delle proteine
 Proteine Struttura e funzione delle proteine Le cellule viventi contengono un corredo estremamente diversificato di molecole proteiche, ciascuna costituita da una catena lineare di aminoacidi uniti da
Proteine Struttura e funzione delle proteine Le cellule viventi contengono un corredo estremamente diversificato di molecole proteiche, ciascuna costituita da una catena lineare di aminoacidi uniti da
Il legame peptidico è un ibrido di risonanza: scaricato da
 Il legame peptidico è un ibrido di risonanza: - O ha una parziale carica negativa - - la coppia di e - del legame C=O è parzialmente spostata verso O - N ha una parziale carica positiva + - la coppia di
Il legame peptidico è un ibrido di risonanza: - O ha una parziale carica negativa - - la coppia di e - del legame C=O è parzialmente spostata verso O - N ha una parziale carica positiva + - la coppia di
STRUTTURAZIONE DELLE PROTEINE
 STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
2) La presenza di gruppi funzionali specifici che partecipano alla catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o quelli
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
Diagramma di Ramachandran
 Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Macromolecole Biologiche. La struttura secondaria (II)
 La struttura secondaria (II) Nello stesso anno (1951) in cui proposero l α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo l α elica,
La struttura secondaria (II) Nello stesso anno (1951) in cui proposero l α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo l α elica,
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE
 STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
CROMATINA ISTONI. Proteine relativamente piccole, con forte carica positiva per la presenza degli aminoacidi lisina e arginina
 CROMATINA Complesso molecolare formato da DNA, istoni e proteine non istoniche ISTONI Proteine relativamente piccole, con forte carica positiva per la presenza degli aminoacidi lisina e arginina Si conoscono
CROMATINA Complesso molecolare formato da DNA, istoni e proteine non istoniche ISTONI Proteine relativamente piccole, con forte carica positiva per la presenza degli aminoacidi lisina e arginina Si conoscono
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
COSTITUENTI DELLE PROTEINE: AMINOACIDI
 2^ lezione Proteine COSTITUENTI DELLE PROTEINE: AMINOACIDI Nell organismo umano ne sono presenti centinaia ma solo 20 nelle proteine. Per la sintesi di una proteina devono essere presenti tutti contemporaneamente.
2^ lezione Proteine COSTITUENTI DELLE PROTEINE: AMINOACIDI Nell organismo umano ne sono presenti centinaia ma solo 20 nelle proteine. Per la sintesi di una proteina devono essere presenti tutti contemporaneamente.
ACIDI GRASSI INSATURI
 LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
Definizione Composti quaternari: C H O N S P Fe Mg I
 PROTIDI Definizione Composti quaternari: C H O N S P Fe Mg I ORIGINE cellulare ogni cellula sintetizza le sue prote CARATTERISTICHE insolubili in acqua sensibili a variazioni di ph coagulano in presenza
PROTIDI Definizione Composti quaternari: C H O N S P Fe Mg I ORIGINE cellulare ogni cellula sintetizza le sue prote CARATTERISTICHE insolubili in acqua sensibili a variazioni di ph coagulano in presenza
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
BIOMOLECOLE LE BASI DELLA BIOCHIMICA. Capitolo 1 Dal Carbonio agli OGM PLUS
 BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
Biochimica. studio della vita a livello molecolare
 Biochimica studio della vita a livello molecolare studio della composizione molecolare dei sistemi viventi studio delle reazioni chimiche cui vanno incontro i sistemi viventi ALCUNI QUESITI DELLA BIOCHIMICA
Biochimica studio della vita a livello molecolare studio della composizione molecolare dei sistemi viventi studio delle reazioni chimiche cui vanno incontro i sistemi viventi ALCUNI QUESITI DELLA BIOCHIMICA
Proteine ed acidi nucleici
 Proteine ed acidi nucleici Prof.ssa Flavia Frabetti aa. 2010-11 PRTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,,,
Proteine ed acidi nucleici Prof.ssa Flavia Frabetti aa. 2010-11 PRTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,,,
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOACIDI
 LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
STRUTTURA TERZIARIA. H 3 N + COO - β-foglietto
 STRUTTURA TERZIARIA α-eliche H 3 N + COO - β-foglietto La catena polipeptidica delle proteine GLOBULARI oltre ad organizzarsi in strutture di tipo secondario va incontro ad un ulteriore ripiegamento sino
STRUTTURA TERZIARIA α-eliche H 3 N + COO - β-foglietto La catena polipeptidica delle proteine GLOBULARI oltre ad organizzarsi in strutture di tipo secondario va incontro ad un ulteriore ripiegamento sino
Modello del collasso idrofobico. Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60
 Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare quattro legami covalenti. Questi
apitolo 3 Le biomolecole I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare quattro legami covalenti. Questi
Principi di biologia TEMI - TRASVERSALI FONDAMENTALI IN BIOLOGIA E GENETICA
 BIOLOGIA è la scienza della vita, che indaga le caratteristiche dei sistemi viventi Principi di biologia biologia animale biologia cellulare biologia molecolare programma interno morte ordine riproduzione
BIOLOGIA è la scienza della vita, che indaga le caratteristiche dei sistemi viventi Principi di biologia biologia animale biologia cellulare biologia molecolare programma interno morte ordine riproduzione
Le molecole biologiche. Le proteine
 Le molecole biologiche Le proteine Le proteine sono macromolecole che costituiscono la maggior parte delle strutture cellulari ed extra-cellulari Così come nel caso di lipidi e carboidrati, anch esse
Le molecole biologiche Le proteine Le proteine sono macromolecole che costituiscono la maggior parte delle strutture cellulari ed extra-cellulari Così come nel caso di lipidi e carboidrati, anch esse
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico
 gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 6
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
Il carbonio è l elemento di base delle biomolecole. Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici.
 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
AMMINOACIDI. Gli amminoacidi si distinguono in base alla diversità della catena laterale R in ciascuno di essi.
 AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche
AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche
SOLUZIONI DEGLI ESERCIZI
 Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Il gruppo peptidico ha una struttura rigida e planare, dovuta al parziale. legame peptidico. O O - N N + H H
 Il legame peptidico Il gruppo peptidico ha una struttura rigida e planare, dovuta al parziale (~40 %) carattere di doppio legame del legame peptidico. O O - C C N N + H H Il legame peptidico pp Il legame
Il legame peptidico Il gruppo peptidico ha una struttura rigida e planare, dovuta al parziale (~40 %) carattere di doppio legame del legame peptidico. O O - C C N N + H H Il legame peptidico pp Il legame
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Le molecole biologiche. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Protidi. Protidi 16/01/2019
 Protidi I protidi sono macromolecole costituite dall unione di amminoacidi tra loro. I protidi, a seconda del numero di amminoacidi che li costituiscono, sono distinti in: oligopeptidi, formati da pochi
Protidi I protidi sono macromolecole costituite dall unione di amminoacidi tra loro. I protidi, a seconda del numero di amminoacidi che li costituiscono, sono distinti in: oligopeptidi, formati da pochi
