Alcheni, Dieni e Alchini
|
|
|
- Nicoletta Simone
- 5 anni fa
- Visualizzazioni
Transcript
1 Alcheni, Dieni e Alchini
2 Alcheni Sono idrocarburi che contengono uno o più doppi legami C C Sono anche chiamati olefine Gli atomi di C impegnati nella formazione dei doppi legami sono ibridati sp 2 ed hanno quindi struttura trigonale planare
3 La formula generale di un alchene non ciclico (con un solo doppio legame) è C n H 2n La formula generale di un alchene ciclico (con un solo doppio legame) è C n H 2n-2 E detto indice di insaturazione di una molecola il difetto di atomi di idrogeno che questa ha rispetto all alcano lineare contenente un uguale numero di atomi di carbonio. L indice di insaturazione corrisponde alla somma del numero di cicli e di legami pi greco presenti nella molecola analizzata. C n H m Ind. Ins. = (2n+2-m)/2
4 Es. 1 C n H m CH 2 Ind. Ins. = (2n+2-m)/2 C 11 H 18 = (2* )/2 = (24-18)/2 = 3 Es. 2 C 12 H 18 Ind. Ins. = (2* )/2 = 4
5 Proprietà fisiche degli alcheni Sono composti non polari e, come negli alcani, le sole forze di attrazione attive tra le loro molecole sono quelle di dispersione (van der Waals). Stato fisico: da 2 a 4 atomi di carbonio: gassosi; da 5 a 17 atomi di carbonio: liquidi; oltre 17 atomi di carbonio: solidi solubilità Insolubili in H 2 O Solubili in idrocarburi Solubili in solventi organici apolari Solubili in etanolo Sono meno densi dell acqua
6 Isomeria geometrica E una forma di isomeria configurazionale che deriva dalla presenza nella molecola di un elemento di rigidità (generalmente un doppio legame Carbonio-Carbonio, o un anello ciclico) che impedisce agli isomeri di interconvertire rapidamente. Le forme isomere differiscono per la posizione spaziale statica (configurazione) di due sostituenti: l isomero è detto cis se i sostituenti risultano disposti dalla stessa parte del doppio legame (o del ciclo) e trans se disposti su lati opposti diastereomeri Isomeri configurazionali diastereomeri Isomeri configurazionali Gli isomeri geometrici hanno proprietà fisiche diverse (punto di fusione, punto di ebollizione, densità, indice di rifrazione ecc.) e sono quindi separabili con metodi fisici.
7 Quale dei due alogeni, il bromo o il cloro, deve essere considerato in posizione trans rispetto al metile e quale in posizione cis? Quando i due atomi di carbonio impegnati nel doppio legame (o appartenenti al ciclo) sono legati a 4 sostituenti a coppie a coppie diversi (almeno 3 diversi dall idrogeno), la notazione cis/trans non è adeguata e va sostituita con la notazione E/Z. Per l attribuzione dei descrittori E/Z è necessario: 1) individuare il gruppo sostituente a maggior priorità tra quelli legati al carbonio sp 2 di destra ed il gruppo a maggior priorità tra quelli legati al carbonio sp 2 di sinistra utilizzando le regole di Cahn-Ingold-Prelog (regole CIP) 2) Il prefisso E (entgegen = opposti) viene assegnato allo stereoisomero in cui i due gruppi a maggior priorità si trovano ai lati opposti rispetto al doppio legame 3) Il prefizzo Z (zusammen = insieme) viene assegnato allo stereoisomero in cui i due gruppi a priorità più elevata si trovano dallo stesso lato del doppio legame.
8 Nomenclatura nomi comuni utilizzati nella nomenclatura di gruppi alchenici CH 2 gruppi: metilidenico H C H C CH 3 CH 2 CH 3 etilidenico propilidenico CH 2 metilidencicloesano
9 Nomenclatura sistematica 1. Individuare come catena principale quella più lunga che contiene il doppio legame, numerandola in modo che al doppio legame risulti assegnato il più basso valore possibile 2. Per l attribuzione del nome occorre ; a) selezionare un prefisso riferito al numero di atomi di carbonio che costituisce la catena principale (vedi tabella); b) far seguire tale prefisso dal numero che identifica la posizione del doppio legame e dal suffisso -ene
10 3. Gli eventuali sostituenti vanno citati in ordine alfabetico, riportando l indice dell atomo su cui risultano attaccatti 4. A parità di indice che individua la posizione del doppio legame, la numerazione della catena và effettuata in modo che agli eventuali sostituenti sia assegnata la più bassa numerazione possibile
11 5. Negli alcheni ciclici non è necessario indicare la posizione del doppio legame, a meno che nella molecola non siano presenti raggruppamenti di maggiore priorità (p.es. C=O, COOH, ecc.)
12 Alcheni stereoisomeri: isomeria cis/trans ed E/Z L esistenza di alcheni stereoisomeri è possibile quando, a coppie, i sostituenti legati agli atomi impegnati nel doppio legame sono diversi tra loro A B A B' stereoisomeri A' B' A' B A A e B B L isomeria nasce dal fatto che la veloce rotazione intorno al doppio legame è inibita dalla perdita di sovrapposizione tra i due orbitali p affacciati (rottura del legame p).
13 La notazione cis/trans è comunemente utilizzata per distinguere alcheni isomeri disostituiti non in posizione geminale (cioè non sullo stesso atomo di carbonio; simbolo: gem) A H A H A B B H H B H H Sostituzione gem (geminale). Non determina isomeria Isomero trans Isomero cis La notazione E/Z è proficuamente utilizzata quando almeno 3 dei 4 sostituenti dei carboni sp 2 non sono atomi di idrogeno. Alta priorita' Alta priorita' Alta priorita' Bassa priorita' Bassa priorita' Bassa priorita' Bassa priorita' Alta priorita' isomero Z isomero E Le regole per l attribuzione delle priorità sono quelle già considerate nella sezione dedicata alla stereochimica
14 (E)-3-metil-es-3-ene (4E)-4-butil-3-cicloesil-epta-1,4-diene (3E,6Z)-6-isopropil-3-metil-nona-3,6-diene
15 Influenza dell isomeria geometrica sulle proprietà degli alcheni Il valore assunto dal momento dipolare della molecola può essere fortemente condizionato dal tipo di sostituzione esistente Il legame Csp 3 -Csp 2 è moderatamente polarizzato a causa del maggiore carattere s dell orbitale ibrido sp 2. Questo, infatti, favorisce il richiamo degli elettroni di legame verso il carbonio Csp 2 Negli alcheni trans disostituiti con gruppi uguali il momento dipolare è nullo perché i momenti di dipolo locali risultano sistematicamente orientati in senso opposto (le rispettive componenti vettoriali si elidono reciprocamente).
16 La stabilità energetica di alcheni isomeri è governata da fattori sterici, quella di alcheni sostituiti è influenzata anche da fattori elettronici. I primi favoriscono la stabilità dell isomero trans, i secondi possono giocare a favore dell uno o dell altro stereoisomero, a seconda del tipo di gruppi implicati nella sostituzione (caso di alcheni funzionalizzati) cis Isomero più stabile trans
17 Isomero più stabile cis trans NH 2 OMe H OMe H H NH 2 In questo caso la formazione di uno stabile legame a idrogeno intramolecolare rende più stabile l isomero cis, annullando lo svantaggio dovuto all ingombro sterico presente in questa stessa struttura H
18 L isomerizzazione cis-trans non ha luogo spontaneamente, ma può essere promossa da un ambiente acido, dalla luce o da un opportuno riscaldamento opp. hn opp. D Sfruttando la reazione di idrogenazione catalitica (che trasforma un alchene nel corrispondente alcano) è possibile stilare un ordine di stabilità relativa delle insaturazioni in funzione della posizione che queste assumono all interno della molecola
19 In generale ~ ~ ~ ~ ~ Quindi, gli alcheni più sostituiti sono i più stabili (alcheni interni). La spiegazione di questo comportamento può essere dato in termini di iperconiugazione Iperconiugazione
20 Il legame Carbonio-Carbonio sp 2 -sp 3 è più forte, e quindi più stabile, del legame Carbonio-Carbonio sp 3 -sp 3 (l ordine del legame sp 3 -sp 3 è 1, mentre quello del legame sp 2 -sp 3 è maggiore di 1 ) Più stabile Pertanto, negli alcheni isomeri al crescere del numero di sostituenti alchilici legati ai carboni sp 2 aumenta il numero di legami sp 2 -sp 3 che sostituiscono i legami sp 3 -sp 3 meno stabili
21 Proprietà chimiche degli alcheni Mentre le proprietà fisiche degli alcheni sono piuttosto simili a quelle dei corrispondenti alcani le proprietà chimiche sono profondamente diverse. Questo deriva dalla presenza dei doppi legami. Gli elettroni p hanno energia più elevata e sono pertanto più disponibili, conferendo alla molecola carattere elettron-ricco = Nu In generale, specie elettron-ricche (atomi o molecole) hanno la tendenza a interagire, in modo covalente o non covalente, con specie elettron-povere. Le specie elettron-ricche sono chiamate Nucleofili (simbolo:nu) Le specie elettron-povere sono chiamate Elettrofili (simbolo:e)
22 Polieni Idrocarburi contenenti più doppi legami ( ) sono chiamati polieni. In particolare: 2 diene 3 triene 4 tetraene Le proprietà generali delle molecole polieniche possono essere dedotte per estrapolazione da quelle possedute dalle più semplici strutture dieniche Possibili disposizioni relative dei doppi legami nei dieni 1 2 3
23 libera rotazione In questo tipo di diene i due doppi legami non si influenzano reciprocamente (non c è sovrapposizione tra orbitali p dei carboni impegnati nei due distinti legami p) e quindi, sotto il profilo della reattività, si comportano come sistemi insaturi indipendenti Sotto il profilo della struttura, non c è limitazione alla disposizione relativa che i due sottosistemi insaturi possono assumere nello spazio
24 In questi dieni le due porzioni insature assumono una disposizione complanare perchè questo garantisce una buona sovrapposizione laterale tra gli orbitali p degli atomi di carbonio dei due distinti doppi legami. s-trans s-cis Perciò sono possibili due distinte disposizioni spaziali, una con i due doppi legami in posizione trans rispetto al legame semplice che li unisce (disposizione s-trans) e l altra con i due doppi legami in posizione cis rispetto al legame semplice che li unisce (disposizione s-cis)
25 La buona sovrapposizione laterale tra gli orbitali p degli atomi di carbonio appartenenti ai due distinti doppi legami consente la delocalizzazione dei 4 elettroni p sui 4 atomi di carbonio ibridati sp 2. Questo determina un contributo di stabilizzazione aggiuntivo della molecola (risonanza) assente negli altri tipi di dieni.
26 Sono anche chiamati alleni In questi dieni l atomo di carbonio comune alle due insaturazioni ha ibridazione sp. Questo comporta l impossibilità di una diretta interazione tra i due doppi legami, poiché le due nuvole di elettroni p saranno rigidamente disposte su piani ortogonali Ibridazione sp
27 Una diretta conseguenza della disposizione a 90 dei piani associati alle due insaturazioni è che i sostituenti degli atomi di carbonio ibridati sp 2 giacciono anch essi, a coppie, su piani ortogonali e possono dare luogo (se diversi) alla esistenza di un asse di chiralità (e quindi a isomeria ottica) enantiomeri
28 Stabilità relativa di dieni isomeri Può essere dedotta confrontando le entalpie di idrogenazione relative ai diversi isomeri, essendo il prodotto di reazione (l alcano corrispondente) lo stesso in tutti i casi
29 In particolare, l energia di due doppi legami isolati può essere calcolata come 2 volte l energia di un singolo doppio legame. Reazioni di idrogenazione di alcheni La stabilizzazione di risonanza dovuta alla coniugazione di 2 doppi legami è invece quantificabile in circa 4 kcal/mole s-cis s-trans Infine, nell ambito dei dieni coniugati, per motivi sterici, le geometrie s-trans risultano notevolmente più stabili di quelle s-cis (poco meno di 3 kcal/mole)
30 Nomenclatura 1.Selezionare come catena principale quella contenente il maggior numero di legami multipli (doppi legami ma, eventualmente, anche tripli legami) 2. Attribuire al legame multiplo più vicino all estremità di catena la più bassa numerazione; a parità di posizione un doppio legame ha però priorità su un triplo legame
31 3. Il numero che indica la posizione di ogni legame multiplo deve essere citato o prima del nome complessivo del poliene o prima del suffisso en, ene. Ricordare di anteporre al suffisso la desinenza che indica il numero di doppi legami (di-, tri-, tetra-, ecc.) 4. Se sono presenti sostituenti, tenere conto che: a) la catena va numerata ricordando che questi potrebbero avere maggiore priorità rispetto al doppio legame; b) i sostituenti vanno citati in ordine alfabetico
32 6-cloro-5-metossi-cicloesa-2,4-dienammina Cl NH 2 OMe 5. In caso di possibile isomeria geometrica, riportare tra parentesi tonde, prima del nome completo della molecola, i descrittori E/Z relativi ad ogni doppio legame. Ognuno di questi dovrà essere preceduto dal numero che identifica la posizione del doppio legame.
33 Alchini Gli alchini sono idrocarburi contenenti uno o più tripli legami.
34 La formula generale degli alchini aciclici contenenti un solo triplo legame è C n H 2n-2 mentre quella degli alchini ciclici (un solo ciclo) è C n H 2n-4 Tenere presente che ogni triplo legame ha un indice di insaturazione pari a 2 CH 3 CH 2 CH 2 C CH C n H m C5 H8 Ind. Ins. = (2n+2-m)/2 = (2*5+2-8)/2 = (12-8)/2 = 2
35 Es.1 C CH Es.2 C 10 H 16 C n H m Ind. Ins. = (2* )/2 = (22-16)/2 = 3 2 = 1 triplo legame 1 = 1 ciclo C 17 H 24 Ind. Ins. = (2* )/2 = (36-24)/2 = 6 2 = 1 triplo legame 1 = 1 ciclo 3 = 3 doppi legami
36 Nomenclatura H C C H L alchino più semplice (2 atomi di carbonio) è chiamato acetilene Nella nomenclatura comune gli alchini sono nominati riferendoli come acetileni sostituiti Il raggruppamento è chiamato propargile
37 La nomenclatura sistematica IUPAC è del tutto simile a quella già descritta per gli alcheni. In tale nomenclatura ciò che diversifica gli alchini dagli alcheni è il diverso suffisso da utilizzare: ene viene modificato in ino (-in quando sono presenti altri gruppi funzionali a più alta priorità). Nei nomi di alchini contenenti più tripli legami andranno utilizzati gli infissi adiin (2) atriin (3) atetrain (4) e così via metil-2,6-ottadiino ciclononino 4-metil otta-2,6-diino
38 Cicloalchini Tra gli alchini ciclici il più piccolo isolato è il cicloottino. Questo, comunque, è instabile e polimerizza velocemente a temperatura ambiente. L instabilità deriva dalla deformazione piuttosto marcata dell angolo tra gli atomi C-C C che invece di essere di 180 è di circa 158 e da fenomeni di eclissamento nella conformazione. Il ciclononino, invece, pur presentando ancora una discreta distorsione dell angolo C-C C (~164 ), è stabile a temperatura ambiente Due situazioni di eclissamento Tre situazioni di eclissamento ciclononino cicloottino
39 Proprietà fisiche degli alchini Sono composti non polari e, come negli alcani e alcheni, le sole forze di attrazione attive tra le loro molecole sono quelle di dispersione (van der Stato fisico: Waals). da 2 a 4 atomi di carbonio: gassosi; liquidi con più di 5 atomi di carbonio solubilità Insolubili in H 2 O e solventi organici polari Solubili in idrocarburi Solubili in solventi organici apolari Sono meno densi dell acqua
40 Proprietà chimiche degli alchini Le proprietà chimiche degli alchini sono per molti versi simili a quelle degli alcheni. Questo deriva dalla presenza della doppia insaturazione a chiaro carattere elettron-ricco. Pertanto molte delle reazioni elettrofilo-nucleofilo tipiche degli alcheni sono possibili anche per gli alchini. E Nu Nu E Tuttavia tra alcheni ed alchini (e ancor più tra alchini ed alcani) esiste una differenza di fondamentale importanza, collegata alla diversa acidità posseduta dagli idrogeni legati agli atomi di carbonio ibridati sp negli alchini terminali e sp 2 negli alcheni (o sp 3 negli alcani).
41 La diversa percentuale di carattere s degli orbitali impegnati dagli atomi di carbonio di alchini, alcheni ed alcani per legare l atomo di idrogeno è alla base della diversa acidità riscontrata. 2) 1) L elettronegatività di un atomo di carbonio cresce al crescere del carattere s del suo orbitale impegnato nel legame covalente. Nel legame con atomi di idrogeno la maggiore elettronegatività di C si traduce in una maggiore polarizzazione del legame C-H e quindi in una più facile reazione di deprotonazione. Inoltre, la carica negativa che si genera sulla base coniugata dell idrocarburo deprotonato (carbanione) sarà stabilizzata tanto più efficacemente quanto più marcato sarà il carattere s dell orbitale che la ospita
42 L acidità di un idrogeno alchinico è sufficientemente elevata da consentire che la base coniugata dell ammoniaca (lo ione amiduro, NH 2- ) possa quantitativamente ionizzarlo. Altri esempi di basi in grado di deprotonare quantitativamente un alchino sono i composti di alchil-litio, i reattivi di Grignard, l idruro di sodio, la litio diisopropilammide. - - H C C H + NH 2 H C C: + NH 3 ione acetiluro L acidità degli idrogeni alchinici è molto importante da un punto di vista sintetico perché un alchino deprotonato (ione acetiluro) è un carbanione che possiede spiccate proprietà nucleofile, utilizzabili per la formazione di nuovi legami C-C
Alcheni: struttura e proprietà
 Chimica Organica Informazione Scientifica sul Farmaco Alcheni: struttura e proprietà Organic Chemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: struttura degli alcheni nomenclatura proprietà fisiche
Chimica Organica Informazione Scientifica sul Farmaco Alcheni: struttura e proprietà Organic Chemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: struttura degli alcheni nomenclatura proprietà fisiche
Contenuti della lezione:
 Alcheni e Alchini Contenuti della lezione: Aspetti generali e nomenclatura di alcheni e alchini Uso delle nomenclature cis/trans e E/Z per gli alcheni di-sostituiti e tri- o tetrasostituiti rispetivamente
Alcheni e Alchini Contenuti della lezione: Aspetti generali e nomenclatura di alcheni e alchini Uso delle nomenclature cis/trans e E/Z per gli alcheni di-sostituiti e tri- o tetrasostituiti rispetivamente
Teoria degli orbitali. Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale.
 Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Gli Alcheni : struttura e nomenclatura
 Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è n H
Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è n H
IBRIDAZIONE DEL CARBONIO NEGLI ALCANI PREMESSA: COSA SONO GLI ORBITALI IBRIDI.
 ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
Alcani e cicloalcani. Nomenclatura e nomi comuni Struttura e proprietà Reazioni
 Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
Alcheni. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcheni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcheni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Isomeria Costituzionale. Isomeria Conformazionale
 Isomeria ostituzionale Isomeri ostituzionali: omposti con uguale formula molecolare ma con un diverso ordine con cui sono legati gli atomi tra loro. Isomeria onformazionale onformazione: ciascuna disposizione
Isomeria ostituzionale Isomeri ostituzionali: omposti con uguale formula molecolare ma con un diverso ordine con cui sono legati gli atomi tra loro. Isomeria onformazionale onformazione: ciascuna disposizione
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 9 Il mondo del carbonio 3 Sommario 1. Esiste un enorme varietà di composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 9 Il mondo del carbonio 3 Sommario 1. Esiste un enorme varietà di composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani
IDROCARBURI: classificazione
 ALCANI 1 IDROCARBURI: classificazione 2 ALCANI Formula bruta: C n H 2n+2 1 C CH 4 2 C C 2 H 6 3 C C 3 H 8 4 C C 4 H 10 3 ALCANI: ibridazione Orbitali s, p e sp 3 z orbitale 2s y x z z z orbitali 2p y x
ALCANI 1 IDROCARBURI: classificazione 2 ALCANI Formula bruta: C n H 2n+2 1 C CH 4 2 C C 2 H 6 3 C C 3 H 8 4 C C 4 H 10 3 ALCANI: ibridazione Orbitali s, p e sp 3 z orbitale 2s y x z z z orbitali 2p y x
Alchini. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alchini Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alchini Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
IDROCARBURI I ALCANI ANALISI CONFORMAZIONALE
 IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
Gruppi funzionali Un gruppo funzionale è un atomo o un gruppo di atomi con proprietà chimiche e fisiche tipiche. E
 Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a
 Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a formare lo scheletro della molecola, mentre gli atomi di
Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a formare lo scheletro della molecola, mentre gli atomi di
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
CHIMICA ORGANICA. Gli alcheni
 1 2-ALENI IMIA ORGANIA ALENI Formula generale n 2n Desinenza -ene Gli alcheni La prima classe di idrocarburi insaturi è quella degli alcheni, detti anche olefine, che presentano lungo la catena uno o più
1 2-ALENI IMIA ORGANIA ALENI Formula generale n 2n Desinenza -ene Gli alcheni La prima classe di idrocarburi insaturi è quella degli alcheni, detti anche olefine, che presentano lungo la catena uno o più
CHIMICA ORGANICA CHIMICA DEL CARBONIO
 CHIMICA ORGANICA CHIMICA DEL CARBONIO Fino al 1828 con il termine organico si indicavano le sostanze prodotte dagli organismi viventi, mentre si classificavano come inorganiche tutte le altre Dopo il 1828
CHIMICA ORGANICA CHIMICA DEL CARBONIO Fino al 1828 con il termine organico si indicavano le sostanze prodotte dagli organismi viventi, mentre si classificavano come inorganiche tutte le altre Dopo il 1828
Alcheni e alchini. idrocarburi. Insaturi C-C doppi/tripli. alcani. Saturi C-C semplici cicloalcani. aromatici
 Alcheni e alchini alcani Saturi C-C semplici cicloalcani idrocarburi Insaturi C-C doppi/tripli aromatici 1 Alcheni e Alchini Alcheni e alchini sono idrocarburi che hanno rispettivamente un doppio legame
Alcheni e alchini alcani Saturi C-C semplici cicloalcani idrocarburi Insaturi C-C doppi/tripli aromatici 1 Alcheni e Alchini Alcheni e alchini sono idrocarburi che hanno rispettivamente un doppio legame
Idrocarburi Saturi. Alcani
 Idrocarburi Saturi Alcani IDROCARBURI I principali componenti del petrolio e del gas naturale, risorse dalle quali proviene la maggior parte dei combustibili per la produzione di energia sono idrocarburi,
Idrocarburi Saturi Alcani IDROCARBURI I principali componenti del petrolio e del gas naturale, risorse dalle quali proviene la maggior parte dei combustibili per la produzione di energia sono idrocarburi,
IDROCARBURI. Alcani Alcheni Alchini C-C C=C C C
 IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
Idrocarburi insaturi. Alcheni
 Idrocarburi insaturi Alcheni Idrocarburi insaturi Un idrocarburo si dice insaturo quando possiede un numero di atomi di idrogeno minore al numero massimo possibile per un dato numero di atomi di carbonio.
Idrocarburi insaturi Alcheni Idrocarburi insaturi Un idrocarburo si dice insaturo quando possiede un numero di atomi di idrogeno minore al numero massimo possibile per un dato numero di atomi di carbonio.
Idrocarburi Alifatici
 Idrocarburi Alifatici Alcano R-C 2 -C 2 -R C n 2n+2 Questo è il massimo rapporto /C per un dato numero di atomi di carbonio. Alchene R-C=C-R C n 2n Ogni doppio legame riduce il numero di atomi di idrogeno
Idrocarburi Alifatici Alcano R-C 2 -C 2 -R C n 2n+2 Questo è il massimo rapporto /C per un dato numero di atomi di carbonio. Alchene R-C=C-R C n 2n Ogni doppio legame riduce il numero di atomi di idrogeno
Gli Alcheni. Ibridazione sp 2. I legami chimici degli alcheni
 Gli Alcheni 2p Energia Ibridazione sp 2 sp 2 1s I tre orbitali ibridi sono disposti su un piano secondo una geometria trigonaleplanare con angoli di 120. L'orbitale 2p che non partecipa all'ibridazione
Gli Alcheni 2p Energia Ibridazione sp 2 sp 2 1s I tre orbitali ibridi sono disposti su un piano secondo una geometria trigonaleplanare con angoli di 120. L'orbitale 2p che non partecipa all'ibridazione
Idrocarburi alifatici
 Idrocarburi alifatici Gli idrocarburi Gli idrocarburi sono composti organici costituiti esclusivamente da atomi di carbonio e idrogeno. In base alla loro struttura si suddividono in due grandi gruppi:
Idrocarburi alifatici Gli idrocarburi Gli idrocarburi sono composti organici costituiti esclusivamente da atomi di carbonio e idrogeno. In base alla loro struttura si suddividono in due grandi gruppi:
MATERIA CHIMICA ORGANICA E BIOCHIMICA
 Anno scolastico 2013/14 INDIRIZZO TECNOLOGICO: CHIMICO, MATERIALI E BIOTECNOLOGIE; ARTICOLAZIONE: BIOTECNOLOGIE SANITARIE. PROGRAMMA CONSUNTIVO MATERIA CHIMICA ORGANICA E BIOCHIMICA DOCENTE Prof. SSA CARLA
Anno scolastico 2013/14 INDIRIZZO TECNOLOGICO: CHIMICO, MATERIALI E BIOTECNOLOGIE; ARTICOLAZIONE: BIOTECNOLOGIE SANITARIE. PROGRAMMA CONSUNTIVO MATERIA CHIMICA ORGANICA E BIOCHIMICA DOCENTE Prof. SSA CARLA
Nome degli alcheni a catena lineare
 Gli alcheni sono idrocarboni insaturi. insaturi (almeno un doppio legame) idrocarboni (solo e ) n 2n 1-Esene 6 12 opyright 1999, Michael J. Wovkulich. All rights reserved. Nome degli alcheni a catena lineare
Gli alcheni sono idrocarboni insaturi. insaturi (almeno un doppio legame) idrocarboni (solo e ) n 2n 1-Esene 6 12 opyright 1999, Michael J. Wovkulich. All rights reserved. Nome degli alcheni a catena lineare
Gruppi funzionali. Gruppi funzionali
 Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
Riassunto delle lezioni precedenti..
 Riassunto delle lezioni precedenti.. Chimica del Carbonio L atomo di Carbonio può formare legami singoli, legami doppi e legami tripli IDROCARBURI formati solo da carbonio e idrogeno Si dividono in 3 classi:
Riassunto delle lezioni precedenti.. Chimica del Carbonio L atomo di Carbonio può formare legami singoli, legami doppi e legami tripli IDROCARBURI formati solo da carbonio e idrogeno Si dividono in 3 classi:
Chimica Organica. In passato, i composti chimici erano suddivisi in due grandi gruppi,
 Chimica Organica In passato, i composti chimici erano suddivisi in due grandi gruppi, inorganici e organici, in base alla loro origine. La chimica organica diveniva così la chimica dei composti del carbonio.
Chimica Organica In passato, i composti chimici erano suddivisi in due grandi gruppi, inorganici e organici, in base alla loro origine. La chimica organica diveniva così la chimica dei composti del carbonio.
8. Idrocarburi contenenti carbonio SP 2 : ALCHENI
 8. Idrocarburi contenenti carbonio SP 2 : ALCENI Detti anche olefine dal latino oleum faciens. π C σ π C Planare E σ = 95 kcal/mol (più corto di un σ sp 3 -sp 3 ) E π = 51 kcal/mol E totale ~ 146 kcal/mol
8. Idrocarburi contenenti carbonio SP 2 : ALCENI Detti anche olefine dal latino oleum faciens. π C σ π C Planare E σ = 95 kcal/mol (più corto di un σ sp 3 -sp 3 ) E π = 51 kcal/mol E totale ~ 146 kcal/mol
I composti organici. Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H)
 I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole.
 4.1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione
4.1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione
Il termine arene viene impiegato per descrivere gli idrocarburi aromatici, in analogia con gli alcheni. prodotto di sostituzione.
 I Il termine aromatico venne riferito inizialmente all odore caratteristico di questa categoria di idrocarburi. Successivamente, tale nome è stato usato per indicare che questi composti sono altamente
I Il termine aromatico venne riferito inizialmente all odore caratteristico di questa categoria di idrocarburi. Successivamente, tale nome è stato usato per indicare che questi composti sono altamente
IDROCARBURI. Alcani Alcheni Alchini Areni. Tipo di legami carboniocarbonio. Solo legami semplici. Uno o più tripli legami. Uno o più doppi legami
 IMICA ORGANICA La chimica del carbonio, per le proprietà del carbonio di formare un numero grandissimo di composti con proprietà diverse, costituisce una branca della chimica, denominata chimica organica.
IMICA ORGANICA La chimica del carbonio, per le proprietà del carbonio di formare un numero grandissimo di composti con proprietà diverse, costituisce una branca della chimica, denominata chimica organica.
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Alcheni: : struttura e reattività. Alcheni. Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n. H 2n. Alcheni in biologia
 Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Gli Alcheni : struttura e nomenclatura
 Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
Gli idrocarburi contengono solo atomi di carbonio e di idrogeno. Gli idrocarburi alifatici hanno molecole lineari (talora ramificate) mentre quelli
 Gli idrocarburi contengono solo atomi di carbonio e di idrogeno. Gli idrocarburi alifatici hanno molecole lineari (talora ramificate) mentre quelli ciclici presentano molecole ad anello. Se hanno tutti
Gli idrocarburi contengono solo atomi di carbonio e di idrogeno. Gli idrocarburi alifatici hanno molecole lineari (talora ramificate) mentre quelli ciclici presentano molecole ad anello. Se hanno tutti
Capitolo 19 Dal carbonio agli idrocarburi
 apitolo 19 Dal carbonio agli idrocarburi Hai capito? pag. 436 7 H 16 No pag. 437 8 H 16 pag. 438 A La struttura ramificata già descritta in (3) e (4). pag. 438 B l 2, l l, l 2, l l ; isomeria di posizione.
apitolo 19 Dal carbonio agli idrocarburi Hai capito? pag. 436 7 H 16 No pag. 437 8 H 16 pag. 438 A La struttura ramificata già descritta in (3) e (4). pag. 438 B l 2, l l, l 2, l l ; isomeria di posizione.
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
Gli elettroni della molecola sono quindi descritti da
 IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
Idrocarburi Saturi. Cicloalcani
 Idrocarburi Saturi Cicloalcani Cicloalcani I cicloalcani sono idrocarburi i cui atomi di carbonio sono uniti per formare un anello In natura sono presenti cicloalcani con dimensioni dell anello che vanno
Idrocarburi Saturi Cicloalcani Cicloalcani I cicloalcani sono idrocarburi i cui atomi di carbonio sono uniti per formare un anello In natura sono presenti cicloalcani con dimensioni dell anello che vanno
Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica.
 Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica. 1. Scrivere la formula condensata per la molecola seguente: Br e la
Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica. 1. Scrivere la formula condensata per la molecola seguente: Br e la
Tipologie di formule chimiche
 CHIMICA ORGANICA Tipologie di formule chimiche FORMULA RAZIONALE Tipo di formula che utilizza una rappresentazione analoga alla formula bruta per quei gruppi di atomi sulla cui disposizione non vi possono
CHIMICA ORGANICA Tipologie di formule chimiche FORMULA RAZIONALE Tipo di formula che utilizza una rappresentazione analoga alla formula bruta per quei gruppi di atomi sulla cui disposizione non vi possono
CHIMICA ORGANICA - CLASSE 3 - RISPOSTE
 CHIMICA ORGANICA - CLASSE 3 - RISPOSTE Prof: Anna Rosa MASTELLARI. Specializzazione di CHIMICA Testo: CHIMICA ORGANICA, BIORGANICA E LABORATORIO ALCANI E CICLOALCANI (Capitolo 2) 1. Assegnare la nomenclatura
CHIMICA ORGANICA - CLASSE 3 - RISPOSTE Prof: Anna Rosa MASTELLARI. Specializzazione di CHIMICA Testo: CHIMICA ORGANICA, BIORGANICA E LABORATORIO ALCANI E CICLOALCANI (Capitolo 2) 1. Assegnare la nomenclatura
Idrocarburi: composti organici che hanno nella loro struttura solo atomo di C o H
 Idrocarburi: composti organici che hanno nella loro struttura solo atomo di C o H Alifatici: deriva dal greco aleifar cioè unguento; questo perché molti grassi contengono lunghe catene carboniose. GLI
Idrocarburi: composti organici che hanno nella loro struttura solo atomo di C o H Alifatici: deriva dal greco aleifar cioè unguento; questo perché molti grassi contengono lunghe catene carboniose. GLI
CHIMICA ORGANICA. Gli alchini
 1 C3-ALCHINI CHIMICA ORGANICA ALCHINI Formula generale C n n 2 Desinenza -ino Gli alchini Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carboniocarbonio e sono anch essi classificati
1 C3-ALCHINI CHIMICA ORGANICA ALCHINI Formula generale C n n 2 Desinenza -ino Gli alchini Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carboniocarbonio e sono anch essi classificati
Chimica del carbonio. 1. Composti contenenti azoto (C,H,N) ammine. Aromatici (derivati del benzene di formula C 6 H 6 )
 himica del carbonio Il carbonio forma con 4 atomi diversi 4 legami covalenti equivalenti posti a 109,5, oppure con 3 atomi diversi 3 legami posti a 120, di cui uno doppio, oppure 2 legami covalenti con
himica del carbonio Il carbonio forma con 4 atomi diversi 4 legami covalenti equivalenti posti a 109,5, oppure con 3 atomi diversi 3 legami posti a 120, di cui uno doppio, oppure 2 legami covalenti con
CHIMICA delle MACROMOLECOLE BIOLOGICHE
 Progetto Tandem 2016-17 GIOVANNI GOTTE Biochimica/BIO-10, Università degli Studi di Verona CIMICA delle MACROMOLECOLE BIOLOGICE CIMICA ORGANICA CE COS E LA CIMICA ORGANICA? La chimica organica descrive
Progetto Tandem 2016-17 GIOVANNI GOTTE Biochimica/BIO-10, Università degli Studi di Verona CIMICA delle MACROMOLECOLE BIOLOGICE CIMICA ORGANICA CE COS E LA CIMICA ORGANICA? La chimica organica descrive
IDROCARBURI INSATURI: GLI ALCHENI HANNO ALMENO UN DOPPIO LEGAME NELLA STRUTTURA NOMENCLATURA: RADICE COME NEGLI IDROCARBURI, DESINENZA -ENE
 IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
ISOMERIA GEOMETRICA NEGLI ALCHENI
 ISOMERIA GEOMETRIA NEGLI ALENI Negli alcheni, la rotazione è ancora possibile attorno ai legami - semplici, ma non attorno ai legami doppi = propene.. Anche se la rotazione intorno al doppio legame non
ISOMERIA GEOMETRIA NEGLI ALENI Negli alcheni, la rotazione è ancora possibile attorno ai legami - semplici, ma non attorno ai legami doppi = propene.. Anche se la rotazione intorno al doppio legame non
ESERCIZI ESERCIZI. il basso d. aumenta lungo un periodo da sinistra verso
 ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA CORSO DI LAUREA IN TECNICHE DI LABORATORIO BIOMEDICO SAPIENZA UNIVERSITA' DI ROMA CHIMICA ORGANICA
 CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA CORSO DI LAUREA IN TECNICHE DI LABORATORIO BIOMEDICO SAPIENZA UNIVERSITA' DI ROMA CHIMICA ORGANICA A causa della sua limitata elettronegativita', il carbonio
CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA CORSO DI LAUREA IN TECNICHE DI LABORATORIO BIOMEDICO SAPIENZA UNIVERSITA' DI ROMA CHIMICA ORGANICA A causa della sua limitata elettronegativita', il carbonio
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Reazioni Stereospecifiche e Stereoselettive
 Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
I Legami intermolecolari
 I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
Classificazione degli idrocarburi
 Classificazione degli idrocarburi ALCANI Alcani: idrocarburi saturi contenenti solo legami semplici carbonio-carbonio (tutti i carboni sono ibridati sp3). Modelli molecolari di etano, propano e butano.
Classificazione degli idrocarburi ALCANI Alcani: idrocarburi saturi contenenti solo legami semplici carbonio-carbonio (tutti i carboni sono ibridati sp3). Modelli molecolari di etano, propano e butano.
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Alcani e Cicloalcani
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcani e Cicloalcani Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcani e Cicloalcani Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e
Introduzione alla Chimica Organica. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
PERCHE STUDIARE LA CHIMICA ORGANICA?
 CIMICA ORGANICA CE COSA E LA CIMICA ORGANICA? La chimica organica è dedicata alla descrizione della struttura, delle proprietà e delle funzioni dei composti del carbonio (C). PERCE STUDIARE LA CIMICA ORGANICA?
CIMICA ORGANICA CE COSA E LA CIMICA ORGANICA? La chimica organica è dedicata alla descrizione della struttura, delle proprietà e delle funzioni dei composti del carbonio (C). PERCE STUDIARE LA CIMICA ORGANICA?
COMPOSTI AROMATICI. Formula C 6 H 6
 COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
La chimica organica è la chimica dei composti contenenti carbonio
 Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Forze intermolecolari
 Forze intermolecolari Sono le forze che si instaurano tra le molecole di un composto e ne determinano lo stato di aggregazione (gas, liquido, solido) interazioni dipolo-dipolo attrazioni di van der Waals
Forze intermolecolari Sono le forze che si instaurano tra le molecole di un composto e ne determinano lo stato di aggregazione (gas, liquido, solido) interazioni dipolo-dipolo attrazioni di van der Waals
Prof.ssa Stacca Prof.ssa Stacca
 La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
Benzene e Composti Aromatici
 Benzene e Composti Aromatici Contenuti della lezione: Il benzene e i requisiti per l aromaticità Nomenclatura di benzeni mono- e di-sostituiti Composti aromatici diversi dal benzene: IPA e eteroaromatici
Benzene e Composti Aromatici Contenuti della lezione: Il benzene e i requisiti per l aromaticità Nomenclatura di benzeni mono- e di-sostituiti Composti aromatici diversi dal benzene: IPA e eteroaromatici
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/
Forze intermolecolari
 Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Composti carbonilici
 Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Capitolo 23 Dal carbonio agli idrocarburi
 Capitolo 23 Dal carbonio agli idrocarburi 1. I composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani 3. L isomeria 4. La nomenclatura degli idrocarburi saturi 5. Proprietà fisiche e chimiche
Capitolo 23 Dal carbonio agli idrocarburi 1. I composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani 3. L isomeria 4. La nomenclatura degli idrocarburi saturi 5. Proprietà fisiche e chimiche
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano
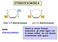 STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano sono stereoisomeri Hanno la stessa formula molecolare, gli atomi legati con lo stesso ordine, ma con diversa orientazione nello spazio
STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano sono stereoisomeri Hanno la stessa formula molecolare, gli atomi legati con lo stesso ordine, ma con diversa orientazione nello spazio
ALCHENI: Reazioni del doppio legame
 ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
2. Gli Idrocarburi IDROCARBURI. solo C e H. alcani e cicloalcani (solo C sp 3 ) alcheni e cicloalcheni (almeno 2 C sp 2 ) Alifatici
 2. Gli Idrocarburi IDROCARBURI solo C e H Si classificano in 2 grandi gruppi, a loro volta suddivisi in sottogruppi. Alifatici alcani e cicloalcani (solo C sp 3 ) alcheni e cicloalcheni (almeno 2 C sp
2. Gli Idrocarburi IDROCARBURI solo C e H Si classificano in 2 grandi gruppi, a loro volta suddivisi in sottogruppi. Alifatici alcani e cicloalcani (solo C sp 3 ) alcheni e cicloalcheni (almeno 2 C sp
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
Modulo di Biochimica 3 CFU (30 ore) Orario delle Lezioni: 1 semestre (settembre-dicembre) Lunedì 14-17
 Corso di laurea in ingegneria Biomedica A.A. 2017/2018 Modulo di Biochimica 3 CFU (30 ore) Orario delle Lezioni: 1 semestre (settembre-dicembre) Lunedì 14-17 Dott.ssa Morena Arba PhD. morena.arba@unica.it
Corso di laurea in ingegneria Biomedica A.A. 2017/2018 Modulo di Biochimica 3 CFU (30 ore) Orario delle Lezioni: 1 semestre (settembre-dicembre) Lunedì 14-17 Dott.ssa Morena Arba PhD. morena.arba@unica.it
PIANO DELLE UDA Terzo Anno
 ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Terzo Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Rappresentare una
ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Terzo Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Rappresentare una
IBRIDAZIONE. MODELLO DELL ORBITALE di LEGAME
 IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
Aldeidi e Chetoni. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
NOMENCLATURA DI MOLECOLE CONTENENTI GRUPPI FUNZIONALI E LEGAMI MULTIPLI
 NOMENCLATURA DI MOLECOLE CONTENENTI GRUPPI FUNZIONALI E LEGAMI MULTIPLI Quando la molecola contiene sia un gruppo funzionale che un legame multiplo la desinenza deve essere doppia, includendo sia il suffisso
NOMENCLATURA DI MOLECOLE CONTENENTI GRUPPI FUNZIONALI E LEGAMI MULTIPLI Quando la molecola contiene sia un gruppo funzionale che un legame multiplo la desinenza deve essere doppia, includendo sia il suffisso
- il DNA, la molecola che contiene l informazione genetica, - le proteine dei nostro organismo ( proteine dei muscoli, della pelle, gli enzimi),
 La chimica organica è la chimica dei composti del carbonio, che sono i mattoni con cui sono costruiti tutti i corpi viventi della terra. Questi composti comprendono ad esempio - il DNA, la molecola che
La chimica organica è la chimica dei composti del carbonio, che sono i mattoni con cui sono costruiti tutti i corpi viventi della terra. Questi composti comprendono ad esempio - il DNA, la molecola che
LA CHIMICA ORGANICA IBRIDAZIONE
 LA CHIMICA ORGANICA Detta anche LA CHIMICA DEL CARBONIO (C) perché Il C gioca un ruolo fondamentale in tutte le molecole organiche (cioè appartenenti o derivanti da esseri viventi). Possiamo spiegarlo
LA CHIMICA ORGANICA Detta anche LA CHIMICA DEL CARBONIO (C) perché Il C gioca un ruolo fondamentale in tutte le molecole organiche (cioè appartenenti o derivanti da esseri viventi). Possiamo spiegarlo
PIANO DI LAVORO ANNUALE
 PIANO DI LAVORO ANNUALE Classe 3B A.S. 2013-14 Disciplina: Chimica Organica Docente: prof. Laura M. Iannone Ore settimanali: 4 Libro di testo: Percorsi di Chimica Organica, di Paolo De Maria ed. Zanichelli.
PIANO DI LAVORO ANNUALE Classe 3B A.S. 2013-14 Disciplina: Chimica Organica Docente: prof. Laura M. Iannone Ore settimanali: 4 Libro di testo: Percorsi di Chimica Organica, di Paolo De Maria ed. Zanichelli.
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Cos è la chimica organica
 Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
