the power of ten Prof.ssa Patrizia Gallucci
|
|
|
- Ada Bucci
- 5 anni fa
- Visualizzazioni
Transcript
1 the power of ten Prof.ssa Patrizia Gallucci
2 ESPERIMENTO DI RUTHEFORD
3 Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni e protoni, in cui è concentrata la massa.tale nucleo è molto più piccolo dell atomo e attorno ad esso gira l elettrone legato dalla forza di attrazione elettrostatica.
4 L atomo è costituito da: ELETTRONI, PROTONI e NEUTRONI
5 Z = numero atomico = numero dei protoni A = numero di massa = numero di protoni + numero dei neutroni ISOTOPI = Atomi di un elemento con diverso numero di neutroni,cioè diverso A n= A -Z
6 Il modello atomico di Rutherford, pur rappresentando un notevole balzo in avanti, ebbe comunque vita breve, in quanto non si accordava con altre osservazioni sperimentali e soprattutto non era in grado di giustificare la stabilità degli atomi. Secondo le leggi dell elettromagnetismo,infatti, una carica elettrica in movimento irradia energia sotto forma di onde elettromagnetiche, e l elettrone, dotato di carica elettrica, nella sua orbita intorno al nucleo avrebbe dovuto perdere continuamente energia e finire col cadere su di esso.
7 Ogni onda viaggia alla velocità c c = λ ν
8 La luce è un tipo di onda elettromagnetica che i nostri occhi riescono a percepire e che quindi ci permette di vedere ciò che ci circonda. Come tutte le onde elettromagnetiche ha una duplice natura: Si comporta come onda quando viaggia da un punto ad un altro dello spazio Si comporta come un fascio di particelle di massa zero (i fotoni) quando colpisce la materia
9 Fotone Pacchetto di energia E= h ν Dove h è la costante di Planck Onda elettromagnetica
10 SPETTRO DELLE ONDE ELETTROMAGNETICHE
11
12
13 E= h ν Dove h è la costante di Planck L ENERGIA E QUANTIZZATA
14 La contraddizione del modello atomico planetario di Rutherford venne risolta nel 1913 dal fisico danese Niels Bohr. L intuizione di Bohr fu che non vi è emissione di energia quando l elettrone si trova in una particolare orbita stazionaria, definita da un determinato raggio. L ipotesi di Bohr si basava sulla teoria del quanto di azione di Max Planck, vale a dire, l irradiazione di energia da un sistema atomico non avviene in maniera continua secondo le leggi dell elettrodinamica classica, ma, al contrario, avviene in distinte emissioni separate, secondo l equazione : E = hʋ In sostanza, l idea di Bohr era che l elettrone nel suo moto intorno al nucleo potesse occupare solo particolari orbite stabili che soddisfacessero la relazione: mvr = nh/2π
15 LIVELLI ENERGETICI Secondo Bohr gli elettroni si possono trovare solo in particolari orbite il cui raggio è quantizzato e definito da n (numero quantico principale). Quando l elettrone si muove in queste orbite, non assorbe ed emette energia e si trova in un dato livello energetico. In genere l elettrone si trova nell orbita con n più basso.
16 SPETTRO DI ASSORBIMENTO SPETTRO DI EMISSIONE
17 SPETTRO DI EMISSIONE modello di bohr 1 storia di bohr modello di bohr 2 storia di bohr
18 PRINCIPIO DI INDETERMINAZIONE HEISEMBERG TEORIA DI DE BROGLIE DUALISMO ONDA- PARTICELLA ORBITALE L ORBITALE è lo spazio attorno al nucleo in cui è massima la probabilità di trovare l ELETTRONE
19 Numero quantico principale n,definisce il livello o strato, può assumere valori interi da 1 a 7 Numero quantico angolare l, definisce il sottolivello e la forma dell orbitale, può assumere i seguenti valori 0,1,..n-1 Numero quantico magnetico m, definisce il numero degli orbitali del sottolivello, può assumere tutti i valori ±l,..±1,0 Numero quantico di spin s s= ± 1/2
20
21
22
23 ENERGIE DEI LIVELLI E SOTTOLIVELLI Dkkz3TQ
24 PRINCIPIO DI ESCLUSIONE DI PAULI: In ogni orbitale ci possono essere al massimo due elettroni con spin opposti. Sottolivello s (un orbitale) Sottolivello p (3 orbitali) Sottolivello d (5 orbitali ) Sottolivello f (7 orbitali) 2e 6e 10e 14e
25 La CONFIGURAZIONE ELETTRONICA di atomo dà indicazioni su come gli elettroni sono distribuiti nei suoi orbitali: ad essa sono collegate le proprietà chimiche. Rispettando alcune semplici regole, la configurazione elettronica può essere costruita a partire dal numero atomico Z, secondo un procedimento relativamente semplice: AUFBAU
26 La configurazione elettronica viene costruita secondo il principio dell Aufbau (= edificare) disponendo gli elettroni negli orbitali secondo energia crescente, a partire da quelli ad energia minore. Si tiene conto degli orbitali degeneri (3 per gli orbitali p, 5 per i d, 7 per gli f) e del fatto che ogni orbitale può contenere al massimo due elettroni con spin opposti (principio di esclusione di Pauli). La somma degli elettroni disposti negli orbitali corrisponderà al numero atomico. L ordine di riempimento degli orbitali, verificato sperimentalmente in passato, può essere ricavato dallo schema seguente procedendo lungo le frecce. Si può notare che non sempre il principio del numero quantico principale crescente è rispettato: ad esempio, gli orbitali 3d hanno energia leggermente superiore rispetto al 4s e quest ultimo viene occupato prima.
27 LIVELLI E SOTTOLIVELLI ORDINE DI RIEMPIMENTO DEGLI ORBITALI La regola di Hund (PRINCIPIO DELLA MASSIMA MOLTEPLICITÀ) afferma che, se più elettroni vanno su orbitali degeneri, essi ne devono occupare il maggior numero possibile con spin parallelo, se sono singoli o spaiati (condizione di minima energia, cioè di stabilità). Successivamente si dispongono gli altri elettroni, che si accoppiano ai precedenti con spin antiparallelo ( doppietti elettronici).
28
29 Per trovare la configurazione elettronica di un atomo, ricorda: Di seguire la seguente scala dell energia crescente degli orbitali: 1s-2s-2p-3s-3p-4s-3d-4p-5s-4f-5p-6s- 4f-5d-6p-7s-5f-6d Di seguire il principio di PAULI ( al max 2 elettroni per orbitale); Di occupare il maggior numero di orbitali degeneri (con la stessa energia) possibili.
30 Fe Z=26 Elemento di transizione 1s 2 / 2s 2 2p 6 /3s 2 3p 6 3d 6 /4s 2 Formula di Lewis Fe :
31 Esempi di configurazione elettronica con formule di Lewis
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia!1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia!1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
ATOMI E PARTICELLE SUBATOMICHE
 ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
E. SCHRODINGER ( )
 E. SCHRODINGER (1887-1961) Elettrone = onda le cui caratteristiche possono essere descritte con un equazione simile a quella delle onde stazionarie le cui soluzioni, dette funzioni d onda ψ, rappresentano
E. SCHRODINGER (1887-1961) Elettrone = onda le cui caratteristiche possono essere descritte con un equazione simile a quella delle onde stazionarie le cui soluzioni, dette funzioni d onda ψ, rappresentano
La teoria atomistica
 La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Quarta unità didattica. Disposizione degli elettroni nell atomo
 Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
Modello atomico ad orbitali e numeri quantici
 Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
ATOMO. Avogadro (1811) Volumi uguali di gas diversi contengono un ugual numero di MOLECOLE (N A =6,022*10 23 )
 ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
1 3 STRUTTURA ATOMICA
 1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
La struttura dell atomo
 La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
Teoria atomica. Dr. Lucia Tonucci Ingegneria delle Costruzioni
 Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
ATOMI MONOELETTRONICI
 ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
Struttura dell atomo atomo particelle sub-atomiche - protoni positiva - neutroni } nucleoni - elettroni negativa elemento
 Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Particelle Subatomiche
 GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
Unbowed, Unbent, Unbroken
 Unbowed, Unbent, Unbroken L ATOMO E LE SUE PROPRIETÀ STRUTTURA DELL ATOMO Carica Massa Protoni = particelle a carica positiva +1,6 x 10-19 C 1,67 x 10-27 Kg Elettroni = particelle a carica negativa -1,6
Unbowed, Unbent, Unbroken L ATOMO E LE SUE PROPRIETÀ STRUTTURA DELL ATOMO Carica Massa Protoni = particelle a carica positiva +1,6 x 10-19 C 1,67 x 10-27 Kg Elettroni = particelle a carica negativa -1,6
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI
 CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
STRUTTURA ATOMICA. Per lo studio della struttura dell atomo ci si avvale della Spettroscopia.
 STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
COMPORTAMENTO DUALISTICO della MATERIA
 COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico. Prof. Stefano Piotto Università di Salerno
 Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico Prof. Stefano Piotto Università di Salerno Seconda parte 1. Teoria atomica 2. Esperimenti di Thompson e Millikan 3. Modello
Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico Prof. Stefano Piotto Università di Salerno Seconda parte 1. Teoria atomica 2. Esperimenti di Thompson e Millikan 3. Modello
Rappresentazione dell atomo. Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano.
 Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
L atomo di Bohr. Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913)
 L atomo di Bohr Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913) L atomo di Bohr L atomo di idrogeno presenta un solo elettrone 1. L elettrone
L atomo di Bohr Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913) L atomo di Bohr L atomo di idrogeno presenta un solo elettrone 1. L elettrone
STRUTTURA ATOMICA. tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica
 STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
mvr = n h e 2 r = m v 2 e m r v = La configurazione elettronica r = e 2 m v 2 (1) Quantizzazione del momento angolare (2) 4 πε.
 La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
- Dati sperimentali: interazione luce / materia spettri caratteristici
 - Thomson: evidenza sperimentale per elettrone misura e/m e - Millikan: misura la carica dell elettrone e ne ricava la massa e = 1,60 x 10-19 C - Rutherford: stima le dimensioni atomiche struttura vuota
- Thomson: evidenza sperimentale per elettrone misura e/m e - Millikan: misura la carica dell elettrone e ne ricava la massa e = 1,60 x 10-19 C - Rutherford: stima le dimensioni atomiche struttura vuota
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole.
 1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
3. Struttura dell atomo
 Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per
 Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per materia?? Uno dei primi interrogativi che gli scienziati
Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per materia?? Uno dei primi interrogativi che gli scienziati
MODELLO PLANETARIO ATTORNO AL NUCLEO ORBITANO GLI ELETTRONI COME PIANETI INTORNO AL SOLE TUTTAVIA
 MODELLO PLANETARIO ATTORNO AL NUCLEO ORBITANO GLI ELETTRONI COME PIANETI INTORNO AL SOLE TUTTAVIA LASCIAVA IRRISOLTI MOLTI PROBLEMI RIGUARDANTI IN PARTICOLARE LA DISPOSIZIONE DEGLI ELETTRONI INTORNO AL
MODELLO PLANETARIO ATTORNO AL NUCLEO ORBITANO GLI ELETTRONI COME PIANETI INTORNO AL SOLE TUTTAVIA LASCIAVA IRRISOLTI MOLTI PROBLEMI RIGUARDANTI IN PARTICOLARE LA DISPOSIZIONE DEGLI ELETTRONI INTORNO AL
A Z. L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone. +1e e.
 L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
I numeri quantici. Numero quantico principale, n: numero intero Caratterizza l energia dell elettrone
 I numeri quantici La regione dello spazio in cui si ha la probabilità massima di trovare un elettrone con una certa energia è detto orbitale Gli orbitali vengono definiti dai numeri quantici Numero quantico
I numeri quantici La regione dello spazio in cui si ha la probabilità massima di trovare un elettrone con una certa energia è detto orbitale Gli orbitali vengono definiti dai numeri quantici Numero quantico
2bis. I modelli atomici
 2bis. I modelli atomici 2.1 Il modello di Thomson 2.2 Il modello di Rutherford; 2.3 Il dualismo particella-onda; 2.4 Il modello di Bohr 2.5 Il modello a orbitali 2.6 Il riempimento degli orbitali e le
2bis. I modelli atomici 2.1 Il modello di Thomson 2.2 Il modello di Rutherford; 2.3 Il dualismo particella-onda; 2.4 Il modello di Bohr 2.5 Il modello a orbitali 2.6 Il riempimento degli orbitali e le
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Il modello di Bohr. Lezioni d'autore di Giorgio Benedetti
 Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole
 Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
La Struttura degli Atomi
 La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
Lezione n. 13. Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo. di idrogeno. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
La struttura degli atomi
 1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno:
 La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
ATOMO POLIELETTRONICO. Numero quantico di spin m s
 ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Struttura della materia
 Struttura della materia 1. L elettrone 2. Effetto Compton 3. Struttura dell atomo XIV - 0 Rapporto carica/massa dell elettrone Esperimento di Thomson: raggi catodici. Fascio non deflesso: Quando B=0: con
Struttura della materia 1. L elettrone 2. Effetto Compton 3. Struttura dell atomo XIV - 0 Rapporto carica/massa dell elettrone Esperimento di Thomson: raggi catodici. Fascio non deflesso: Quando B=0: con
Radiazioni ionizzanti
 Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
Atomi a più elettroni
 Atomi a più elettroni L atomo di elio è il più semplice sistema di atomo a più elettroni. Due sistemi di livelli tra i quali non si osservano transizioni Sistema di singoletto->paraelio Righe singole,
Atomi a più elettroni L atomo di elio è il più semplice sistema di atomo a più elettroni. Due sistemi di livelli tra i quali non si osservano transizioni Sistema di singoletto->paraelio Righe singole,
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
I NUMERI QUANTICI. per l = orbitale: s p d f
 I NUMERI QUANTICI I numeri quantici sono quattro. I primi tre servono a indicare e a distinguere i diversi orbitali. Il quarto numero descrive una proprietà tipica dell elettrone. Esaminiamo in dettaglio
I NUMERI QUANTICI I numeri quantici sono quattro. I primi tre servono a indicare e a distinguere i diversi orbitali. Il quarto numero descrive una proprietà tipica dell elettrone. Esaminiamo in dettaglio
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
ESERCIZI W X Y Z. Numero di massa Neutroni nel nucleo Soluzione
 ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
λν = c, ove c velocità della luce.
 Cap.2 Struttura elettronica degli atomi Le radiazioni luminose (sia visibili che non) sono radiazioni elettromagnetiche che consistono in una forma di energia che si propaga anche nel vuoto: sono la simultanea
Cap.2 Struttura elettronica degli atomi Le radiazioni luminose (sia visibili che non) sono radiazioni elettromagnetiche che consistono in una forma di energia che si propaga anche nel vuoto: sono la simultanea
numeri quantici orbitale spin
 La funzione d onda ψ definisce i diversi stati in cui può trovarsi l elettrone nell atomo. Nella sua espressione matematica, essa contiene tre numeri interi, chiamati numeri quantici, indicati con le lettere
La funzione d onda ψ definisce i diversi stati in cui può trovarsi l elettrone nell atomo. Nella sua espressione matematica, essa contiene tre numeri interi, chiamati numeri quantici, indicati con le lettere
La teoria del corpo nero
 La teoria del corpo nero Max Planck Primo Levi 2014 Roberto Bedogni INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
La teoria del corpo nero Max Planck Primo Levi 2014 Roberto Bedogni INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
6) Modello atomico a ORBITALI
 6) Modello atomico a ORBITALI PREMESSA: LIMITI DEL MODELLO DI BOHR (pag. 94 par.3) Applicando il concetto di quantizzazione dell E all atomo, Bohr ipotizzò che un atomo potesse esistere solo in determinati
6) Modello atomico a ORBITALI PREMESSA: LIMITI DEL MODELLO DI BOHR (pag. 94 par.3) Applicando il concetto di quantizzazione dell E all atomo, Bohr ipotizzò che un atomo potesse esistere solo in determinati
Atomo e particelle atomiche
 Atomo e particelle atomiche La natura elettrica della materia lo strofinio di qualsiasi materiale provoca la comparsa su di esso di una carica elettrica capace di attrarre piccoli oggetti; la carica elettrica
Atomo e particelle atomiche La natura elettrica della materia lo strofinio di qualsiasi materiale provoca la comparsa su di esso di una carica elettrica capace di attrarre piccoli oggetti; la carica elettrica
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una
 Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
LA STRUTTURA DELL ATOMO
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 3 Anno Accademico 2010-2011 Docente: Dimitrios Fessas LA STRUTTURA DELL
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 3 Anno Accademico 2010-2011 Docente: Dimitrios Fessas LA STRUTTURA DELL
J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo
 STRUTTURA dell ATOMO J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo J. Chadwich (193): dimostra l esistenza del neutrone J.J. Thomson (1897):
STRUTTURA dell ATOMO J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo J. Chadwich (193): dimostra l esistenza del neutrone J.J. Thomson (1897):
Configurazione elettronica e collegamento alla tavola periodica
 Configurazione elettronica e collegamento alla tavola periodica Modelli atomici a confronto Un elettrone che si trova in un certo livello possiede l energia associata a quel livello, in particolare al
Configurazione elettronica e collegamento alla tavola periodica Modelli atomici a confronto Un elettrone che si trova in un certo livello possiede l energia associata a quel livello, in particolare al
La struttura della materia
 La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
CHIMICA. Thomas Fraling. Bohr e la configurazione dell elettrone. 1. Il modello atomico di Bohr per l idrogeno
 1. Il modello atomico di Bohr per l idrogeno Il modello atomico di Rutherford presentò vari problemi: secondo lui gli elettroni possono orbitare attorno al nucleo a qualsiasi distanza, infatti questa imprecisione
1. Il modello atomico di Bohr per l idrogeno Il modello atomico di Rutherford presentò vari problemi: secondo lui gli elettroni possono orbitare attorno al nucleo a qualsiasi distanza, infatti questa imprecisione
P. Sapia Università della Calabria. a.a. 2009/10
 FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
I 4 NUMERI QUANTICI. I numeri quantici consentono di definire forma, dimensioni ed energia degli orbitali.
 I 4 NUMERI QUANTICI I numeri quantici consentono di definire forma, dimensioni ed energia degli orbitali. n, numero quantico principale, indica il livello energetico e le dimensioni degli orbitali. Può
I 4 NUMERI QUANTICI I numeri quantici consentono di definire forma, dimensioni ed energia degli orbitali. n, numero quantico principale, indica il livello energetico e le dimensioni degli orbitali. Può
il modello atomico di Bohr
 il modello atomico di Bohr Lo scienziato Niels Bohr, ospite nel laboratorio di Rutherford a Manchester ma anche allievo di Planck, nel 93 pubblicò alcuni saggi in cui, accettando il modello planetario
il modello atomico di Bohr Lo scienziato Niels Bohr, ospite nel laboratorio di Rutherford a Manchester ma anche allievo di Planck, nel 93 pubblicò alcuni saggi in cui, accettando il modello planetario
Il metodo scientifico
 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Interazione luce- atomo
 Interazione luce- atomo Descrizione semiclassica L interazione predominante è quella tra il campo elettrico e le cariche ASSORBIMENTO: Elettrone e protone formano un dipolo che viene messo in oscillazione
Interazione luce- atomo Descrizione semiclassica L interazione predominante è quella tra il campo elettrico e le cariche ASSORBIMENTO: Elettrone e protone formano un dipolo che viene messo in oscillazione
Modelli atomici. Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle.
 Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Il principio di indeterminazione di Heisenberg
 Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA
 pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
Orbitali nei primi tre livelli
 Orbitali nei primi tre livelli La tavola periodica degli elementi Numeri quantici e tavola Configurazioni elettroniche degli atomi Elenco degli orbitali occupati in un atomo nel suo stato fondamentale
Orbitali nei primi tre livelli La tavola periodica degli elementi Numeri quantici e tavola Configurazioni elettroniche degli atomi Elenco degli orbitali occupati in un atomo nel suo stato fondamentale
Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi
 Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi Gli elementi sono ordinati secondo numero atomico Z ( numero dei protoni ) crescente Il numero
Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi Gli elementi sono ordinati secondo numero atomico Z ( numero dei protoni ) crescente Il numero
Comunicazioni Docente - Studenti
 Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
CONFIGURAZIONE ELETTRONICA
 CONFIGURAZIONE ELETTRONICA MODELLO DELL ATOMO DI BHOR La configurazione elettronica è la disposizione degli elettroni intorno al nucleo dell atomo, nei suoi orbitali. Gli orbitali hanno differenti forme
CONFIGURAZIONE ELETTRONICA MODELLO DELL ATOMO DI BHOR La configurazione elettronica è la disposizione degli elettroni intorno al nucleo dell atomo, nei suoi orbitali. Gli orbitali hanno differenti forme
raggio atomico: raggio del nucleo: cm cm
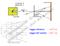 raggio atomico: raggio del nucleo: 10 10 8 1 cm cm Modello di Rutherford: contrasto con la fisica classica perché prima o poi l elettrone avrebbe dovuto cadere sul nucleo irradiando Energia. Le leggi valide
raggio atomico: raggio del nucleo: 10 10 8 1 cm cm Modello di Rutherford: contrasto con la fisica classica perché prima o poi l elettrone avrebbe dovuto cadere sul nucleo irradiando Energia. Le leggi valide
