PARTICELLE SUBATOMICHE
|
|
|
- Olimpia Festa
- 8 anni fa
- Visualizzazioni
Transcript
1 MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti; è stato necessario modificare profondamente l impostazione tradizionale della fisica, creare di fatto una nuova fisica, per poter costruire dei modelli del mondo microscopico che potessero interpretare in modo soddisfacente i fenomeni osservati. Il risultato finale di questo enorme lavoro teorico è quella conoscenza dell atomo che ha fornito le basi a una varietà di applicazioni tecnologiche, compreso lo sfruttamento delle sue enormi riserve di energia, e che ha cambiato la storia stessa: da quando esiste la bomba atomica, l uomo sa che mai più potrà permettersi una guerra mondiale. Lo studio del mondo degli atomi non è ancora esaurito: da una parte continua la ricerca teorica sulle numerose particelle più piccole dell atomo; dall altra continua la ricerca teorica e tecnologica per mettere a punto soluzioni che permettano di sfruttare l energia dell atomo senza i problemi associati alle centrali nucleari attuali. Per comprendere meglio la moderna teoria dell atomo è importante riconsiderare i vari stadi che hanno portato alla sua formulazione, e capire attraverso quali scoperte, esperienze, ipotesi e proposte di modelli si è arrivati alle attuali conoscenze. Alcuni fenomeni, scoperti e studiati alla fine del XIX secolo, hanno reso evidente che esistono particelle più piccole dell atomo e che, quindi, l atomo non è indivisibile e non è la particella più piccola della materia, ma è a sua volta costituito da altre particelle: ha, cioè, una struttura complessa. I fenomeni più importanti furono quelli riguardanti le scariche elettriche attraverso i gas e la radioattività. Le PARTICELLE SUBATOMICHE Alla fine dell Ottocento gli scienziati effettuarono molti esperimenti per studiare la conducibilità elettrica nei gas; in questi esperimenti essi impiegavano un tubo di vetro nel quale si faceva il vuoto, togliendo il più possibile l aria dal suo interno, e che poi veniva riempito con il gas in esame: 1
2 Alle estremità del tubo venivano inoltre posti due elettrodi, fra i quali si applicava una differenza di potenziale di circa V: azionando la pompa aspirante, si abbassava gradualmente la pressione del gas all interno del tubo e, quando la pressione raggiungeva un valore sufficientemente basso, si notava che il gas cominciava a condurre corrente, rendendo luminoso il tubo. Se tuttavia la pressione del gas veniva abbassata ulteriormente, compariva una zona scura intorno al catodo: questa zona scura diveniva sempre più estesa man mano che la pressione del gas nel tubo diminuiva; ad una pressione di circa 10-6 atm, il gas rimasto nel tubo non emetteva più luce: il vetro aveva tuttavia una luminosità diffusa, a causa della fluorescenza provocata da raggi emessi dal catodo. Tali raggi vennero chiamati raggi catodici, e gli scienziati effettuarono una serie di esperimenti per identificarne la natura e studiarne le proprietà; si scoprì così che: - i raggi catodici si propagano in linea retta (mettendo una croce di Malta sulla traiettoria dei raggi, si forma l ombra netta della croce sul vetro); - i raggi catodici sono costituiti da particelle dotate di massa (mettendo sulla traiettoria dei raggi catodici un mulinello a pale, si osserva che questo mulinello si mette a girare quando viene colpito); - i raggi catodici sono costituiti da particelle dotate di carica elettrica negativa (se si pongono, sopra e sotto il fascio, due piastre elettricamente cariche e di segno opposto, il fascio di raggi catodici devia dal suo percorso, perché viene attratto dalla piastra positiva e respinto da quella negativa). 2
3 Le particelle che costituiscono i raggi catodici vennero chiamate elettroni: esse risultarono identiche, qualunque fosse la natura del gas presente nel tubo e qualunque fosse il metallo usato per costruire il catodo. L obiettivo successivo, per gli scienziati, fu quello di mettere a punto esperimenti per determinare il valore della massa e della carica degli elettroni: alla fine del secolo scorso il fisico inglese Thomson riuscì a determinare il rapporto fra la carica e la massa dell elettrone. Nel 1909 Millikan stabilì che la carica dell elettrone è di 1, Coulomb. La conoscenza di questi due valori permise di ricavare quindi quello della massa dell elettrone: me = 9, g La carica dell elettrone è la carica elementare, cioè è la minima quantità di carica elettrica esistente: per questo motivo la si sceglie spesso come unità di misura per la carica elettrica delle particelle che costituiscono la materia; ad esempio, dire che una particella ha carica +2e significa dire che quella particella ha una carica elettrica di segno positivo, il cui valore assoluto è doppio del valore assoluto della carica dell elettrone. In molti casi la lettera e viene omessa, e si indica soltanto il numero che esprime la misura della carica in termini di e: quando si usa questa convenzione, la carica elettrica delle particelle viene espressa soltanto da un numero preceduto da un segno (ad esempio, la carica dell elettrone viene espressa come 1). La SCOPERTA della RADIOATTIVITA Verso la fine del XIX secolo si scoprì che esistono in natura alcuni elementi che emettono spontaneamente radiazioni e si trasformano in altri elementi; nel 1897 il fisico Becquerel scoprì che i minerali di uranio erano capaci di impressionare una lastra fotografica: questo indicava che l uranio emette radiazioni alle quali una lastra è sensibile. Qualche anno dopo i coniugi Curie isolarono da un minerale di uranio un nuovo elemento, che chiamarono radio, e che emetteva radiazioni molto più intense di quelle dell uranio; gli esperimenti mostrarono che le radiazioni emesse dalle sostanze radioattive sono di tre tipi. Nel 1899 Rutherford identificò due di esse, e poco dopo venne identificata anche la terza: per distinguerle è sufficiente far passare un fascio di radiazioni attraverso un forte campo magnetico. Il campo agisce in modo diverso sui diversi tipi di raggi: due di essi vengono deviati dal campo, ma in direzioni opposte, il che indica che sono costituiti da particelle dotate di carica elettrica opposta; il terzo tipo non subisce alcuna deviazione, e ciò indica che non è associato alla presenza di cariche elettriche. Una cosa analoga avviene se si fa passare la radiazione attraverso due piastre cariche elettricamente con segno opposto; i tre tipi di radiazione vennero indicati con le prime tre lettere dell alfabeto greco, e sono: - i raggi, costituiti da nuclei di elio; 3
4 - i raggi, costituiti da elettroni (cioè sono le stesse particelle che costituiscono i raggi catodici; - i raggi, costituiti da onde elettromagnetiche con lunghezza d onda molto piccola e, quindi, frequenza ed energia molto alte. La scoperta della radioattività e i risultati ottenuti negli studi sui raggi catodici cambiarono radicalmente l immagine dell atomo, perché: - il fatto che gli atomi potessero emettere particelle indicava molto chiaramente che l atomo non era indivisibile; - il fatto che le particelle emesse fossero dotate di carica elettrica indicava chiaramente che la carica è una caratteristica della materia, presente nei suoi costituenti più piccoli. Inoltre, siccome la materia è normalmente neutra, diventava evidente che, all interno dell atomo, le cariche positive e quelle negative dovessero bilanciarsi. Una volta stabilito che l atomo è costituito da particelle più piccole, si presentava subito un altro problema: quello di comprendere come queste particelle sono «organizzate» all interno dell atomo; all inizio del XX secolo furono proposti due modelli diversi, uno da Thomson e l altro da Rutherford. Thomson ipotizzò che l atomo avesse una struttura omogenea, con la massa e la carica positiva distribuite omogeneamente in tutto lo spazio dell atomo, e gli elettroni inseriti all interno come particelle individuali distribuite in modo uniforme. Il modello era compatibile con i calcoli teorici; per ritenerlo valido sarebbe stata però necessaria una conferma sperimentale. Secondo il modello di Rutherford, la massa e la carica positiva sono concentrate in una parte molto piccola dell atomo, chiamata nucleo, e gli elettroni si trovano nella zona periferica, a grande distanza del nucleo. Questa ipotesi nasceva da un importante esperienza, effettuata da due allievi di Rutherford: essi avevano bombardato una lamina sottilissima di metallo con particelle veloci; uno schermo rivelatore indicava i punti di arrivo delle particelle, permettendo quindi di stabilirne la traiettoria dopo il passaggio attraverso la lamina. 4
5 Se fosse stato valido il modello di Thomson, cioè se l atomo avesse avuto una struttura omogenea, le particelle avrebbero dovuto comportarsi tutte nello stesso modo, perché in qualunque punto avessero colpito la lamina metallica avrebbero trovato situazioni equivalenti. In realtà, le particelle si comportarono in modo diverso: per la maggior parte passarono senza subire deviazioni, ma alcune vennero deviate secondo vari angoli, e alcune addirittura respinte (veniva deviata circa una particella su 8000); questo comportamento spinse Rutherford a proporre il suo modello, l unico in grado di spiegarlo. Le particelle che non venivano deviate erano quelle che passavano abbastanza distanti dai nuclei: quelle che si avvicinavano ai nuclei venivano deviate per effetto della repulsione elettrica, visto che sia le particelle che i nuclei sono positivi; tanto più si avvicinavano ai nuclei, tanto più fortemente venivano deviate. Quelle che viaggiavano direttamente verso i nuclei venivano respinte: queste ultime erano poche, e ciò mostrava che la probabilità che una particella si dirigesse proprio contro un nucleo era bassa. Ciò porta a concludere che il nucleo occupa una parte molto piccola rispetto allo spazio complessivamente occupato da un atomo. Il modello di Rutherford, nato dall esperienza, si proponeva come quello valido: massa e carica positiva sono concentrate in una parte molto piccola dell atomo con gli elettroni che sono invece distribuiti tutt intorno e occupano tutto il resto dell atomo. Una volta appurato che la carica positiva è concentrata nel nucleo, restava da vedere se esistevano particelle dotate di una carica positiva minima (cosi come l elettrone è dotato di una carica negativa minima). L atomo è neutro, perché contiene cariche positive e cariche negative in numero uguale: però gli elettroni, responsabili delle cariche negative, si trovano alla periferia dell atomo, e possono esserne strappati; quando questo avviene, le cariche positive non sono più bilanciate esattamente da quelle negative: l atomo allora non è più elettricamente neutro, ma ha una carica positiva: si dice che è uno ione positivo. Gli scienziati determinarono sperimentalmente la massa e la carica di vari ioni positivi: trovarono che la carica positiva più piccola è quella che ha lo stesso valore assoluto della carica dell elettrone, ma segno 5
6 opposto; fra gli ioni con carica +1, quello avente massa più piccola era quello ottenuto dall atomo di idrogeno: questo ione è quindi la più piccola particella dotata di carica positiva e venne chiamato protone. A questo punto siamo già in grado di fornire un primo schema della struttura fondamentale dell atomo, e di definire alcune grandezze che lo caratterizzano: l atomo è costituito da un nucleo, nel quale sono concentrate la massa e la carica positiva, e dagli elettroni, che si trovano intorno al nucleo e occupano la quasi totalità del volume dell atomo. Il nucleo è a sua volta costituito da particelle più piccole: i protoni, con carica, ed i neutroni, elettricamente neutri (cioè non dotati di carica); protoni, neutroni ed elettroni sono stati a lungo considerati particelle elementari, cioè particelle indivisibili e semplici (non costituite a loro volta da altre particelle). Più recentemente i fisici hanno scoperto che neutroni e protoni sono a loro volta costituiti da quarks, particelle elementari che non possono mai essere isolate singolarmente: per quanto riguarda le caratteristiche dell atomo che interessano il chimico, non è comunque necessario prendere in considerazione questa loro struttura complessa. Il NUMERO ATOMICO e il NUMERO di MASSA Il numero atomico è il numero di protoni presenti nel nucleo di un atomo: viene generalmente indicato con la lettera Z; in un atomo neutro, il numero di cariche negative presenti è uguale al numero di cariche positive: quindi il numero di elettroni è uguale al numero di protoni. La carica nucleare è la carica elettrica complessiva del nucleo dell atomo: è dovuta ai protoni e poiché ogni protone ha carica +1, la carica del nucleo è +Z; questi valori di carica sono ovviamente riferiti alla carica elementare e: quindi la carica di un nucleo è pari in valore assoluto a +Ze. Il numero di protoni presenti nel nucleo è ciò che rende gli elementi diversi l uno dall altro: il numero atomico, quindi, è caratteristico per ogni elemento. Quando si vuole indicare il numero atomico di un elemento, è convenzione scriverlo in basso a sinistra del simbolo dell elemento: 1H 6C 8O 11Na Il numero di massa è la somma del numero di protoni e del numero di neutroni: come si deduce facilmente dai valori della massa delle particelle, protoni e neutroni sono i principali responsabili della massa di un atomo (al loro confronto, la massa degli elettroni è praticamente trascurabile); per questo motivo, il numero che esprime la loro somma è associato al concetto di massa. Quando si conoscono il numero atomico e il numero di massa di un elemento, è facile calcolare il numero di protoni, neutroni ed elettroni presenti nell atomo di quell elemento; infatti: N protoni = Z N neutroni = A Z N elettroni = Z (se l atomo è neutro) 6
7 Quando si vuole indicare il numero di massa di un elemento è convenzione scriverlo in alto a sinistra rispetto al simbolo dell elemento: così, ad esempio, la scrittura 23 Na ci informa che il numero di massa del sodio è 23. Esistono atomi che hanno lo stesso numero di protoni e diverso numero di neutroni: avendo lo stesso numero di protoni, sono atomi di uno stesso elemento e hanno quindi lo stesso numero atomico; il diverso numero di neutroni determina invece un diverso numero di massa. Atomi di questo tipo vengono chiamati isotopi dell elemento preso in considerazione: gli isotopi di uno stesso elemento hanno le stesse proprietà chimiche. L idrogeno, ad esempio, ha tre isotopi: l idrogeno 1 H, con un protone nel nucleo e nessun neutrone, il deuterio 2 H, con un protone e un neutrone nel nucleo ed il trizio 3 H, con un protone e due neutroni nel nucleo. Quando esistono due o più isotopi naturali di un dato elemento, quell elemento è sempre presente come miscela dei suoi isotopi: la composizione della miscela è costante in natura, cioè le percentuali dei vari isotopi che la costituiscono sono sempre le stesse. Per alcuni elementi, la percentuale di uno degli isotopi è molto alta, e le percentuali degli altri sono molto basse: nel caso dell idrogeno, ad esempio, il primo isotopo è di gran lunga il più diffuso, costituendo il 99,9844% di tutto l idrogeno esistente; il deuterio è presente soltanto per lo 0,0156% ed il trizio non è praticamente presente in natura, ma è stato creato artificialmente in laboratorio, ed è radioattivo (sembra che sulla Terra esista un solo atomo di trizio su ogni 1017 atomi di idrogeno, mentre la percentuale è più alta nelle stelle). Per altri elementi due o più isotopi sono presenti in percentuali considerevoli, come nel caso del cloro, dove l isotopo con numero di massa 35 è presente per il 75,4% e l isotopo con numero di massa 37 per il 24,6%. Quando si determina sperimentalmente la massa atomica di un elemento, non si separano i vari isotopi: il valore che si ottiene nasce quindi dal contributo di tutti gli isotopi di quell elemento presenti in natura; è cioè un valore medio a cui ogni isotopo contribuisce a seconda della percentuale con cui è presente (maggiore è la percentuale, maggiore è il contributo dell isotopo corrispondente). Se si conoscono le masse e le percentuali degli isotopi naturali di un dato elemento, è possibile calcolare la massa atomica media di quell elemento mediante l equazione della media pesata; questo è un tipo di media che tiene conto del fatto che i singoli contributi non hanno tutti la stessa importanza. Per calcolarla, si moltiplica il numero di massa di ciascun isotopo per il corrispondente valore di percentuale, si sommano tutti i termini così ottenuti e si divide la somma per 100: in tal modo, il contributo di un isotopo presente in percentuale maggiore ha più peso del contributo di un isotopo presente in percentuale minore. Per determinare le masse atomiche dei singoli isotopi di un elemento si usa uno strumento chiamato spettrometro di massa. 7
8 L ATOMO di BOHR Fino al momento in cui Rutherford propose il suo modello di atomo, la fisica si era sviluppata senza incontrare grosse crisi: Galileo e Newton avevano posto le basi della meccanica, descrivendo il moto dei corpi e le leggi che lo governano; altri fisici avevano studiato i fenomeni elettrici e magnetici e formulato le leggi dell elettromagnetismo. Nel suo complesso, la fisica si presentava come un insieme di conoscenze che gli esperimenti continuavano a confermare; tali leggi sono tuttora considerate valide per la descrizione dei fenomeni e degli oggetti del mondo macroscopico : a questa parte della fisica si dà oggi il nome di fisica classica. Il comportamento delle particelle del mondo microscopico (l atomo e i suoi costituenti) non risultava però in accordo con le leggi della fisica classica: secondo queste leggi l atomo, così come lo aveva ipotizzato Rutherford, non sarebbe potuto esistere. Infatti, il nucleo e gli elettroni hanno carica di segno opposto, e particelle con carica di segno opposto si attirano: l attrazione dovrebbe portare le particelle a muoversi l una verso l altra fino a incontrarsi. Se una delle due particelle ruota intorno all altra, come fa l elettrone intorno al nucleo, l effetto combinato del moto e dell attrazione elettrica le farebbe descrivere una traiettoria a spirale con cui si avvicinerebbe sempre più all altra particella, fino a cadervi sopra: man mano che la particella si avvicina a quella intorno a cui ruota, la sua energia diminuisce e, quindi, la particella dovrebbe emettere energia in modo continuo per tutta la durata del suo moto verso l altra. In altre parole, secondo le leggi della fisica classica, gli elettroni dovrebbero andare tutti a cadere sul nucleo; questo però non avviene: gli atomi esistono, con i loro elettroni ben distinti e distanti dal nucleo. In particolari condizioni, gli atomi possono emettere energia sotto forma di radiazioni elettromagnetiche: atomi di elementi diversi emettono radiazioni diverse, cioè radiazioni aventi diversi valori di lunghezza d onda, frequenza e quindi energia. L insieme delle radiazioni emesse dagli atomi di un elemento viene chiamato spettro di emissione di quell elemento: per ottenere lo spettro di emissione di un elemento quest ultimo viene portato allo stato gassoso, e poi si fa passare attraverso di esso una scarica elettrica. Per effetto della scarica, alcuni atomi passano a una situazione in cui hanno un energia più alta del solito: subito dopo, questi atomi ritornano alla loro situazione normale, ed emettono l energia in eccesso sotto forma di radiazione elettromagnetica. La radiazione emessa è in genere costituita da due o più radiazioni di frequenza diversa: per separarle, si fa passare la radiazione attraverso una fessura, in modo da isolarne un fascio sottile; il fascio, a sua volta, viene fatto passare attraverso un prisma, che devia radiazioni di diversa frequenza con angoli diversi. Dal prisma, quindi, escono diversi raggi, distinti l uno dall altro e con direzioni di propagazione diverse: sul loro cammino viene messa una lastra sensibile; i diversi raggi colpiscono la lastra in posizioni diverse, dando così origine alle varie righe dello spettro. 8
9 Gli spettri atomici hanno una caratteristica particolare: essi non sono continui, ma discreti, cioè non presentano un passaggio graduale attraverso i vari valori di energia (o di frequenza), ma delle righe nette, corrispondenti a ben definiti valori di energia. Ciò significa che un atomo può emettere soltanto radiazioni con valori di energia specifici e suoi caratteristici. Anche questo era un fenomeno che non poteva essere spiegato in base alle leggi della fisica classica, che prevedono soltanto spettri continui (perché prevedono che l energia venga emessa o assorbita senza preferenze per certi valori piuttosto che altri e senza salti nell ambito dei valori possibili); la natura degli spettri atomici veniva quindi ad essere un altro problema che richiedeva l elaborazione di modelli nuovi. Era evidente che gli spettri contenessero indicazioni sulla situazione energetica degli atomi da cui si originavano, ma risultava difficile interpretare tali indicazioni. Fisici e chimici lavorarono intensamente per determinare tutte le righe dello spettro dei vari elementi; lo spettro dell atomo di idrogeno (che fu lo spettro studiato più a fondo) mostrava tre serie di righe, che vennero indicate con i nomi degli scienziati che le scoprirono: la serie di Lyman nella regione dell ultravioletto, la serie di Balmer nella regione del visibile e la serie di Paschen nella regione dell infrarosso. 9
10 Oltre a individuare la serie di righe degli spettri dei vari elementi, i fisici cercarono di individuare possibili regolarità e trovare relazioni matematiche che le esprimessero: Rydberg trovò una relazione che permetteva di calcolare il numero d onda delle righe dello spettro dell atomo di idrogeno. Il numero d onda è il reciproco della lunghezza d onda ; l equazione di Rydberg può essere espressa per mezzo della seguente relazione: 1 1 n2 1 n 1 R H 2 2 dove n2 e nl sono dei numeri interi e positivi e RH è una costante, chiamata costante di Rydberg e avente il valore di cm -l. Ogni serie corrisponde a un unico valore di n2, mentre n1 può assumere valori a partire da quello immediatamente successivo al valore di n2 (cioè n1 = n2 + 1, n2 + 2, n2 + 3,...). L equazione di Rydberg era un equazione empirica, cioè collegava dati sperimentali, senza che per il momento ne esistesse una spiegazione teorica; la spiegazione teorica sarebbe potuta venire solo da un nuovo modello di atomo. Questo nuovo modello di atomo, che per certi aspetti andava oltre i confini della fisica classica, fu proposto da Niels Bohr nel 1913: alcuni anni prima Max Planck aveva introdotto un concetto che non faceva parte della fisica classica, quello di quantizzazione. La quantizzazione implica restrizioni nei valori possibili per una grandezza: se una grandezza è quantizzata, può assumere soltanto certi valori (valori permessi), ma non può assumere valori intermedi fra quelli permessi. Planck era ricorso alla quantizzazione per spiegare un altro fenomeno che aveva costituito un rompicapo per i fisici: la radiazione del corpo nero; Bohr pensò che una ipotesi analoga potesse permettere di spiegare i fenomeni che riguardano gli atomi. Ipotesi del modello di Bohr Il modello di Bohr comprende alcune ipotesi fondamentali: - nell atomo gli elettroni ruotano intorno al nucleo in orbite circolari; - il momento angolare degli elettroni è quantizzato: esso può assumere soltanto i valori dati dalla relazione: m e v r n dove me è la massa dell elettrone, v è la velocità dell elettrone, r è il raggio dell orbita su cui si muove l elettrone, (m v r) è il momento angolare dell elettrone, h è una costante universale, chiamata costante di Planck, ed n è un numero naturale, cioè un numero intero positivo, chiamato numero quantico. h 2 10
11 L equazione ci mostra la natura matematica della quantizzazione: la quantizzazione nasce dal fatto che a destra compare un numero naturale, che è discreto per sua natura; il fatto che i valori del momento angolare dipendano dal numero naturale n fa sì che soltanto certi valori risultino possibili e, quindi, dà origine alla quantizzazione. - finché un elettrone rimane nella sua orbita, non emette e non assorbe energia. Quantizzazione dei raggi delle orbite Dopo avere introdotto queste ipotesi, Bohr studia la situazione dell elettrone utilizzando le leggi della fisica classica: l elettrone è soggetto alla forza di attrazione elettrostatica del nucleo; questa forza che fa sì che l elettrone resti intorno al nucleo e, pertanto, svolge il ruolo di forza centripeta. È quindi possibile scrivere un uguaglianza fra l espressione della forza di attrazione elettrostatica e quella della forza centripeta. Semplici passaggi matematici, permettono di trovare un espressione per il raggio delle orbite su cui ruotano gli elettroni: a0 n r Z dove r è il raggio dell orbita, n è il numero quantico, che caratterizza l orbita stessa, Z è il numero atomico dell elemento considerato ed a0 è una costante indicata con il termine di chiamata raggio di Bohr. Il fatto che in questa espressione compaia il numero quantico n significa che anche i raggi delle orbite possono assumere soltanto certi valori, e non valori intermedi fra quelli permessi; il valore del raggio aumenta inoltre al crescere di n. L orbita più vicina al nucleo è quella corrispondente al minimo valore di n, cioè a n = 1; più alto è il valore di n, più l orbita corrispondente è distante dal nucleo. L elettrone non può avvicinarsi al nucleo oltre la distanza corrispondente a n = l e, quindi, non può andare a cadere sul nucleo; inoltre, la distanza fra un orbita e quella che la precede non è costante, ma aumenta man mano che ci si allontana dal nucleo. 2 Quantizzazione dei livelli energetici Gli elettroni nell atomo possiedono una certa quantità di energia: essi infatti sono in moto e, quindi, hanno energia cinetica; inoltre hanno energia potenziale dovuta all attrazione elettrostatica fra elettrone e nucleo. Quando è presente più di un elettrone, si aggiunge l energia della repulsione elettrostatica fra un elettrone e l altro: l energia totale di un elettrone è data dalla somma di tutti questi contributi. Anche l energia è quantizzata, cioè può assumere solo certi valori; questi valori permessi dell energia vengono chiamati livelli energetici e dipendono dal numero quantico n: 2,18 10 E 2 n 18 J 11
12 Ad ogni orbita corrisponde un dato valore di energia: il valore più basso è quello dell orbita più vicina al nucleo (n = 1); man mano che il valore di n aumenta, e quindi aumenta il raggio dell orbita (cioè man mano che ci si allontana dal nucleo), aumenta anche il corrispondente valore di energia. Il modello di Bohr forniva una spiegazione soddisfacente del motivo per il quale gli spettri degli atomi sono discreti; per comprenderla, teniamo presente la terza ipotesi del modello: finché l elettrone rimane nella stessa orbita, la sua energia non cambia. Per passare da un orbita con energia minore a un orbita con energia maggiore (cioè da un orbita più interna a un orbita più esterna), l elettrone deve ricevere dall esterno una quantità di energia corrispondente alla differenza di energia fra le due orbite; se invece passa da un orbita con energia maggiore a un orbita con energia minore (cioè da un orbita più esterna a un orbita più interna), l elettrone emette una quantità di energia pari alla differenza di energia fra le due orbite. Indichiamo la differenza di energia come E2 - E1, dove E2 è l'energia dell orbita più esterna ed E1 è l energia dell orbita più interna. L energia viene emessa o assorbita sotto forma di radiazione elettromagnetica. L energia di una radiazione elettromagnetica è uguale al prodotto della costante di Planck per la frequenza della radiazione; l energia della radiazione emessa o assorbita dell elettrone è pertanto uguale alla differenza di energia delle due orbite interessate, cioè: h = E2 - El Questa equazione ci permette di risalire alla differenza di energia fra le due orbite in base alla frequenza della radiazione emessa o assorbita dall atomo; l ipotesi di Bohr sulla struttura dell atomo spiega quindi perché gli spettri di emissione degli atomi sono discreti: ogni riga corrisponde a un valore specifico di energia, che a sua volta corrisponde alla differenza di energia fra due orbite. Se dall esterno arriva all atomo energia sufficiente perché un elettrone possa passare da un orbita più interna a un orbita più esterna, l elettrone assorbe questa energia ed effettua il salto ; poi ritorna all orbita di partenza ed emette l energia che aveva assorbito: tale emissione è responsabile di una riga nello spettro. 12
13 L insieme dei possibili passaggi da un orbita a un altra genera l insieme delle righe dello spettro: lo spettro dell atomo di idrogeno trovava una spiegazione completa. Ciascuna delle serie spettrali corrisponde al passaggio dell elettrone da orbite più esterne alla stessa orbita di arrivo : quest ultima è l orbita con n = 1 per la serie di Lyman, l orbita con n = 2 per la serie di Balmer, l orbita con n = 3 per la serie di Paschen e così via; anche l equazione di Rydberg trovava la sua spiegazione teorica: il numero n1 corrisponde al numero quantico dell orbita da cui parte l elettrone, il numero n2 a quello dell orbita a cui l elettrone arriva. Con l introduzione del concetto di quantizzazione nella descrizione dell atomo, il modello di Bohr era stato un enorme passo avanti: dava una risposta ai problemi che la fisica classica non era riuscita a spiegare, e le sue previsioni erano in accordo con i dati sperimentali, soprattutto per quanto riguarda l atomo di idrogeno; ma il futuro riservava ai fisici nuove sorprese, perché la natura e il comportamento dell elettrone si sarebbero rivelati molto più complessi di quelli delineati dal modello di Bohr. 13
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
Da Newton a Planck. La struttura dell atomo. Da Newton a Planck. Da Newton a Planck. Meccanica classica (Newton): insieme
 Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
MODELLI ATOMICI. Dai primi modelli alla teoria moderna
 MODELLI ATOMICI Dai primi modelli alla teoria moderna Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole,
MODELLI ATOMICI Dai primi modelli alla teoria moderna Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole,
19 Il campo elettrico - 3. Le linee del campo elettrico
 Moto di una carica in un campo elettrico uniforme Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice se il campo elettrico è uniforme,
Moto di una carica in un campo elettrico uniforme Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice se il campo elettrico è uniforme,
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Capitolo 7 Le particelle dell atomo
 Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Struttura Elettronica degli Atomi
 Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
L ATOMO. Risponde (o almeno ci prova)
 L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
IL MODELLO ATOMICO DI BOHR
 IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
Dai primi modelli atomici alla teoria moderna
 Dai primi modelli atomici alla teoria moderna 1 Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole, non
Dai primi modelli atomici alla teoria moderna 1 Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole, non
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
9. Urti e conservazione della quantità di moto.
 9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
IL FOTOVOLTAICO E L ARCHITETTURA
 IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Tesina di scienze. L Elettricità. Le forze elettriche
 Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER:
 ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER: CORSO DI LAUREA TRIENNALE IN SCIENZE E TECNOLOGIE PER LO STUDIO E LA CONSERVAZIONE DEI BENI CULTURALI E DEI SUPPORTI DELLA
ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER: CORSO DI LAUREA TRIENNALE IN SCIENZE E TECNOLOGIE PER LO STUDIO E LA CONSERVAZIONE DEI BENI CULTURALI E DEI SUPPORTI DELLA
I modelli atomici da Dalton a Bohr
 1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
MOTO DI UNA CARICA IN UN CAMPO ELETTRICO UNIFORME
 6. IL CONDNSATOR FNOMNI DI LTTROSTATICA MOTO DI UNA CARICA IN UN CAMPO LTTRICO UNIFORM Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice
6. IL CONDNSATOR FNOMNI DI LTTROSTATICA MOTO DI UNA CARICA IN UN CAMPO LTTRICO UNIFORM Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice
Forza. Forza. Esempi di forze. Caratteristiche della forza. Forze fondamentali CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA
 Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione
 Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione 1. L elettrone ha una massa di 9.1 10-31 kg ed una carica elettrica di -1.6 10-19 C. Ricordando che la forza gravitazionale
Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione 1. L elettrone ha una massa di 9.1 10-31 kg ed una carica elettrica di -1.6 10-19 C. Ricordando che la forza gravitazionale
Il fotone. Emanuele Pugliese, Lorenzo Santi URDF Udine
 Il fotone Emanuele Pugliese, Lorenzo Santi URDF Udine Interpretazione di Einstein dell effetto fotoelettrico Esistono «particelle»* di luce: i fotoni! La luce è composta da quantità indivisibili di energia
Il fotone Emanuele Pugliese, Lorenzo Santi URDF Udine Interpretazione di Einstein dell effetto fotoelettrico Esistono «particelle»* di luce: i fotoni! La luce è composta da quantità indivisibili di energia
I COLORI DEL CIELO: COME SI FORMANO LE IMMAGINI ASTRONOMICHE
 I COLORI DEL CIELO: COME SI FORMANO LE IMMAGINI ASTRONOMICHE Nell ultima notte di osservazione abbiamo visto bellissime immagini della Galassia, delle sue stelle e delle nubi di gas che la compongono.
I COLORI DEL CIELO: COME SI FORMANO LE IMMAGINI ASTRONOMICHE Nell ultima notte di osservazione abbiamo visto bellissime immagini della Galassia, delle sue stelle e delle nubi di gas che la compongono.
CORRENTE E TENSIONE ELETTRICA LA CORRENTE ELETTRICA
 CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone
 Unità n 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Unità n 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Spettrometria di massa
 Tecniche di monitoraggio ambientale di tipo fisico Spettrometria di massa (J. B. Fenn, K. Tanaka, K. Wüthrich, premio nobel per la chimica nel 2002) Analisi chimica dell aerosol Riconoscimento di inquinanti
Tecniche di monitoraggio ambientale di tipo fisico Spettrometria di massa (J. B. Fenn, K. Tanaka, K. Wüthrich, premio nobel per la chimica nel 2002) Analisi chimica dell aerosol Riconoscimento di inquinanti
GIROSCOPIO. Scopo dell esperienza: Teoria fisica. Verificare la relazione: ω p = bmg/iω
 GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
Campione sciolto in un solvente (deuterato) e. posto in un tubo. di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm
 posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
LA LEGGE DI GRAVITAZIONE UNIVERSALE
 GRAVIMETRIA LA LEGGE DI GRAVITAZIONE UNIVERSALE r La legge di gravitazione universale, formulata da Isaac Newton nel 1666 e pubblicata nel 1684, afferma che l'attrazione gravitazionale tra due corpi è
GRAVIMETRIA LA LEGGE DI GRAVITAZIONE UNIVERSALE r La legge di gravitazione universale, formulata da Isaac Newton nel 1666 e pubblicata nel 1684, afferma che l'attrazione gravitazionale tra due corpi è
Siamo così arrivati all aritmetica modulare, ma anche a individuare alcuni aspetti di come funziona l aritmetica del calcolatore come vedremo.
 DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
Fisica II - CdL Chimica. La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche
 La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche La natura della luce Teoria corpuscolare (Newton) Teoria ondulatoria: proposta già al tempo di Newton, ma scartata perchè
La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche La natura della luce Teoria corpuscolare (Newton) Teoria ondulatoria: proposta già al tempo di Newton, ma scartata perchè
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1
 LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1 I CODICI 1 IL CODICE BCD 1 Somma in BCD 2 Sottrazione BCD 5 IL CODICE ECCESSO 3 20 La trasmissione delle informazioni Quarta Parte I codici Il codice BCD
LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1 I CODICI 1 IL CODICE BCD 1 Somma in BCD 2 Sottrazione BCD 5 IL CODICE ECCESSO 3 20 La trasmissione delle informazioni Quarta Parte I codici Il codice BCD
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
Q 1 = +3 10-5 C carica numero 1 Q 2 = +4 10-5 C carica numero 2 forza esercitata tra le cariche distanza tra le cariche, incognita
 Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
LICEO SCIENTIFICO STATALE MARIE CURIE Savignano s. R. (FC) CLASSE 3C ESERCIZI SU MOMENTO ANGOLARE-ROTOLAMENTO. Esercizio.
 LICEO SCIENTIFICO STATALE MARIE CURIE Savignano s. R. (FC) CLASSE 3C ESERCIZI SU MOMENTO ANGOLARE-ROTOLAMENTO Esercizio Esercizio Esercizio Dati esercizio: I 1 =5,0 Kg m 2 I 2 =10 Kg m 2 ω i =10giri/sec
LICEO SCIENTIFICO STATALE MARIE CURIE Savignano s. R. (FC) CLASSE 3C ESERCIZI SU MOMENTO ANGOLARE-ROTOLAMENTO Esercizio Esercizio Esercizio Dati esercizio: I 1 =5,0 Kg m 2 I 2 =10 Kg m 2 ω i =10giri/sec
Moto circolare uniforme
 Moto circolare uniforme 01 - Moto circolare uniforme. Il moto di un corpo che avviene su una traiettoria circolare (una circonferenza) con velocità (in modulo, intensità) costante si dice moto circolare
Moto circolare uniforme 01 - Moto circolare uniforme. Il moto di un corpo che avviene su una traiettoria circolare (una circonferenza) con velocità (in modulo, intensità) costante si dice moto circolare
Amplificatori Audio di Potenza
 Amplificatori Audio di Potenza Un amplificatore, semplificando al massimo, può essere visto come un oggetto in grado di aumentare il livello di un segnale. Ha quindi, generalmente, due porte: un ingresso
Amplificatori Audio di Potenza Un amplificatore, semplificando al massimo, può essere visto come un oggetto in grado di aumentare il livello di un segnale. Ha quindi, generalmente, due porte: un ingresso
Gli orbitali: modello atomico probabilistico
 1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Gli effetti della forza di Coriolis
 LA FORZA DI CORIOLIS di Giulio Mazzolini 2012 1 Gli effetti della forza di Coriolis È un effetto noto che i venti nell emisfero nord deviano sempre verso destra, invece nell emisfero sud deviano sempre
LA FORZA DI CORIOLIS di Giulio Mazzolini 2012 1 Gli effetti della forza di Coriolis È un effetto noto che i venti nell emisfero nord deviano sempre verso destra, invece nell emisfero sud deviano sempre
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
1-LA FISICA DEI CAMPI ELETTRICI E MAGNETICI.
 1-LA FISICA DEI CAMPI ELETTRICI E MAGNETICI. Tutti i fenomeni elettrici e magnetici hanno origine da cariche elettriche. Per comprendere a fondo la definizione di carica elettrica occorre risalire alla
1-LA FISICA DEI CAMPI ELETTRICI E MAGNETICI. Tutti i fenomeni elettrici e magnetici hanno origine da cariche elettriche. Per comprendere a fondo la definizione di carica elettrica occorre risalire alla
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
L osservazione in luce bianca è, per così dire, l osservazione del Sole al naturale ovviamente dopo averne attenuato la fortissima emissione di luce.
 L osservazione in luce bianca è, per così dire, l osservazione del Sole al naturale ovviamente dopo averne attenuato la fortissima emissione di luce. Questa attenuazione si ottiene mediante l uso di un
L osservazione in luce bianca è, per così dire, l osservazione del Sole al naturale ovviamente dopo averne attenuato la fortissima emissione di luce. Questa attenuazione si ottiene mediante l uso di un
May 5, 2013. Fisica Quantistica. Monica Sambo. Sommario
 May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.6 ENERGIE DI IONIZZAZIONE E DISTRIBUZIONE DEGLI ELETTRONI 4.C OBIETTIVI
 LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
Energia potenziale elettrica e potenziale. In queste pagine R indicherà una regione in cui è presente un campo elettrostatico.
 Energia potenziale elettrica e potenziale 0. Premessa In queste pagine R indicherà una regione in cui è presente un campo elettrostatico. 1. La forza elettrostatica è conservativa Una o più cariche ferme
Energia potenziale elettrica e potenziale 0. Premessa In queste pagine R indicherà una regione in cui è presente un campo elettrostatico. 1. La forza elettrostatica è conservativa Una o più cariche ferme
PROGETTO. SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science. Education
 PROGETTO SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science Education 1 Anno scolastico 2013 2014 Classe I A ottici Modulo: Affonda o galleggia? Agata Conti 2 Sintesi Il modulo offre l'opportunità
PROGETTO SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science Education 1 Anno scolastico 2013 2014 Classe I A ottici Modulo: Affonda o galleggia? Agata Conti 2 Sintesi Il modulo offre l'opportunità
Uso di base delle funzioni in Microsoft Excel
 Uso di base delle funzioni in Microsoft Excel Le funzioni Una funzione è un operatore che applicato a uno o più argomenti (valori, siano essi numeri con virgola, numeri interi, stringhe di caratteri) restituisce
Uso di base delle funzioni in Microsoft Excel Le funzioni Una funzione è un operatore che applicato a uno o più argomenti (valori, siano essi numeri con virgola, numeri interi, stringhe di caratteri) restituisce
1. LE GRANDEZZE FISICHE
 1. LE GRANDEZZE FISICHE La fisica (dal greco physis, natura ) è una scienza che ha come scopo guardare, descrivere e tentare di comprendere il mondo che ci circonda. La fisica si propone di descrivere
1. LE GRANDEZZE FISICHE La fisica (dal greco physis, natura ) è una scienza che ha come scopo guardare, descrivere e tentare di comprendere il mondo che ci circonda. La fisica si propone di descrivere
Genova 15 01 14 TIPOLOGIE DI LAMPADE
 Genova 15 01 14 TIPOLOGIE DI LAMPADE Le lampade a vapori di mercurio sono sicuramente le sorgenti di radiazione UV più utilizzate nella disinfezione delle acque destinate al consumo umano in quanto offrono
Genova 15 01 14 TIPOLOGIE DI LAMPADE Le lampade a vapori di mercurio sono sicuramente le sorgenti di radiazione UV più utilizzate nella disinfezione delle acque destinate al consumo umano in quanto offrono
Elettrostatica dei mezzi materiali
 Elettrostatica dei mezzi materiali Nel caso dei conduttori si è visto che: Il campo elettrico farà muovere le cariche all interno del conduttore in modo tale che: Tutte le cariche sono sulla superficie
Elettrostatica dei mezzi materiali Nel caso dei conduttori si è visto che: Il campo elettrico farà muovere le cariche all interno del conduttore in modo tale che: Tutte le cariche sono sulla superficie
La chimica e il metodo scientifico. Lezioni d'autore di Giorgio Benedetti
 La chimica e il metodo scientifico Lezioni d'autore di Giorgio Benedetti INTRODUZIONE (I) VIDEO INTRODUZIONE (II) VIDEO INTRODUZIONE (III) Fino alla fine del settecento, la manipolazione dei metalli, degli
La chimica e il metodo scientifico Lezioni d'autore di Giorgio Benedetti INTRODUZIONE (I) VIDEO INTRODUZIONE (II) VIDEO INTRODUZIONE (III) Fino alla fine del settecento, la manipolazione dei metalli, degli
I CIRCUITI ELETTRICI. Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi.
 I CIRCUITI ELETTRICI Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi. Definiamo ramo un tratto di circuito senza diramazioni (tratto evidenziato in rosso nella
I CIRCUITI ELETTRICI Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi. Definiamo ramo un tratto di circuito senza diramazioni (tratto evidenziato in rosso nella
Prove associate al percorso INVESTIGAZIONI SUL MODELLO PARTICELLARE
 Titolo: Prove associate al percorso INVESTIGAZIONI SUL MODELLO PARTICELLARE Autore: Elisabetta Caroti Percorsi didattici associati: 1. Investigazioni sul modello particellare AVVERTENZA: Le domande che
Titolo: Prove associate al percorso INVESTIGAZIONI SUL MODELLO PARTICELLARE Autore: Elisabetta Caroti Percorsi didattici associati: 1. Investigazioni sul modello particellare AVVERTENZA: Le domande che
Lunedì 20 dicembre 2010. Docente del corso: prof. V. Maiorino
 Lunedì 20 dicembre 2010 Docente del corso: prof. V. Maiorino Se la Terra si spostasse all improvviso su un orbita dieci volte più lontana dal Sole rispetto all attuale, di quanto dovrebbe variare la massa
Lunedì 20 dicembre 2010 Docente del corso: prof. V. Maiorino Se la Terra si spostasse all improvviso su un orbita dieci volte più lontana dal Sole rispetto all attuale, di quanto dovrebbe variare la massa
Grandezze scalari e vettoriali
 Grandezze scalari e vettoriali 01 - Grandezze scalari e grandezze vettoriali. Le grandezze fisiche, gli oggetti di cui si occupa la fisica, sono grandezze misurabili. Altri enti che non sono misurabili
Grandezze scalari e vettoriali 01 - Grandezze scalari e grandezze vettoriali. Le grandezze fisiche, gli oggetti di cui si occupa la fisica, sono grandezze misurabili. Altri enti che non sono misurabili
TEORIA CINETICA DEI GAS
 TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
Università degli studi di Messina facoltà di Scienze mm ff nn. Progetto Lauree Scientifiche (FISICA) Prisma ottico
 Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
4 3 4 = 4 x 10 2 + 3 x 10 1 + 4 x 10 0 aaa 10 2 10 1 10 0
 Rappresentazione dei numeri I numeri che siamo abituati ad utilizzare sono espressi utilizzando il sistema di numerazione decimale, che si chiama così perché utilizza 0 cifre (0,,2,3,4,5,6,7,8,9). Si dice
Rappresentazione dei numeri I numeri che siamo abituati ad utilizzare sono espressi utilizzando il sistema di numerazione decimale, che si chiama così perché utilizza 0 cifre (0,,2,3,4,5,6,7,8,9). Si dice
Lezioni di Matematica 1 - I modulo
 Lezioni di Matematica 1 - I modulo Luciano Battaia 16 ottobre 2008 Luciano Battaia - http://www.batmath.it Matematica 1 - I modulo. Lezione del 16/10/2008 1 / 13 L introduzione dei numeri reali si può
Lezioni di Matematica 1 - I modulo Luciano Battaia 16 ottobre 2008 Luciano Battaia - http://www.batmath.it Matematica 1 - I modulo. Lezione del 16/10/2008 1 / 13 L introduzione dei numeri reali si può
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
Relatività INTRODUZIONE
 Relatività INTRODUZIONE Un po di ordine Einstein, nel 1905, dopo aver inviato alcuni articoli alla rivista scientifica «Annalen der physik» diventa subito famoso, uno dei quali riguardava la relatività
Relatività INTRODUZIONE Un po di ordine Einstein, nel 1905, dopo aver inviato alcuni articoli alla rivista scientifica «Annalen der physik» diventa subito famoso, uno dei quali riguardava la relatività
CALCOLO COMBINATORIO
 CALCOLO COMBINATORIO 1 Modi di formare gruppi di k oggetti presi da n dati 11 disposizioni semplici, permutazioni Dati n oggetti distinti a 1,, a n si chiamano disposizioni semplici di questi oggetti,
CALCOLO COMBINATORIO 1 Modi di formare gruppi di k oggetti presi da n dati 11 disposizioni semplici, permutazioni Dati n oggetti distinti a 1,, a n si chiamano disposizioni semplici di questi oggetti,
UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA
 UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA Tutti gli anni, affrontando l argomento della divisibilità, trovavo utile far lavorare gli alunni sul Crivello di Eratostene. Presentavo ai ragazzi una
UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA Tutti gli anni, affrontando l argomento della divisibilità, trovavo utile far lavorare gli alunni sul Crivello di Eratostene. Presentavo ai ragazzi una
Corso di. Dott.ssa Donatella Cocca
 Corso di Statistica medica e applicata Dott.ssa Donatella Cocca 1 a Lezione Cos'è la statistica? Come in tutta la ricerca scientifica sperimentale, anche nelle scienze mediche e biologiche è indispensabile
Corso di Statistica medica e applicata Dott.ssa Donatella Cocca 1 a Lezione Cos'è la statistica? Come in tutta la ricerca scientifica sperimentale, anche nelle scienze mediche e biologiche è indispensabile
Modulo di Meccanica e Termodinamica
 Modulo di Meccanica e Termodinamica 1) Misure e unita di misura 2) Cinematica: + Moto Rettilineo + Moto Uniformemente Accelerato [+ Vettori e Calcolo Vettoriale] + Moti Relativi 3) Dinamica: + Forza e
Modulo di Meccanica e Termodinamica 1) Misure e unita di misura 2) Cinematica: + Moto Rettilineo + Moto Uniformemente Accelerato [+ Vettori e Calcolo Vettoriale] + Moti Relativi 3) Dinamica: + Forza e
Il concetto di valore medio in generale
 Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Sommario. Definizione di informatica. Definizione di un calcolatore come esecutore. Gli algoritmi.
 Algoritmi 1 Sommario Definizione di informatica. Definizione di un calcolatore come esecutore. Gli algoritmi. 2 Informatica Nome Informatica=informazione+automatica. Definizione Scienza che si occupa dell
Algoritmi 1 Sommario Definizione di informatica. Definizione di un calcolatore come esecutore. Gli algoritmi. 2 Informatica Nome Informatica=informazione+automatica. Definizione Scienza che si occupa dell
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose.
 Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Generatore radiologico
 Generatore radiologico Radiazioni artificiali alimentazione: corrente elettrica www.med.unipg.it/ac/rad/ www.etsrm.it oscar fiorucci. laurea.tecn.radiol@ospedale.perugia.it Impianto radiologico trasformatore
Generatore radiologico Radiazioni artificiali alimentazione: corrente elettrica www.med.unipg.it/ac/rad/ www.etsrm.it oscar fiorucci. laurea.tecn.radiol@ospedale.perugia.it Impianto radiologico trasformatore
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
RIASSUNTO DI FISICA 3 a LICEO
 RIASSUNTO DI FISICA 3 a LICEO ELETTROLOGIA 1) CONCETTI FONDAMENTALI Cariche elettriche: cariche elettriche dello stesso segno si respingono e cariche elettriche di segno opposto si attraggono. Conduttore:
RIASSUNTO DI FISICA 3 a LICEO ELETTROLOGIA 1) CONCETTI FONDAMENTALI Cariche elettriche: cariche elettriche dello stesso segno si respingono e cariche elettriche di segno opposto si attraggono. Conduttore:
Usando il pendolo reversibile di Kater
 Usando il pendolo reversibile di Kater Scopo dell esperienza è la misurazione dell accelerazione di gravità g attraverso il periodo di oscillazione di un pendolo reversibile L accelerazione di gravità
Usando il pendolo reversibile di Kater Scopo dell esperienza è la misurazione dell accelerazione di gravità g attraverso il periodo di oscillazione di un pendolo reversibile L accelerazione di gravità
Energia potenziale elettrica
 Energia potenziale elettrica Simone Alghisi Liceo Scientifico Luzzago Novembre 2013 Simone Alghisi (Liceo Scientifico Luzzago) Energia potenziale elettrica Novembre 2013 1 / 14 Ripasso Quando spingiamo
Energia potenziale elettrica Simone Alghisi Liceo Scientifico Luzzago Novembre 2013 Simone Alghisi (Liceo Scientifico Luzzago) Energia potenziale elettrica Novembre 2013 1 / 14 Ripasso Quando spingiamo
Più processori uguale più velocità?
 Più processori uguale più velocità? e un processore impiega per eseguire un programma un tempo T, un sistema formato da P processori dello stesso tipo esegue lo stesso programma in un tempo TP T / P? In
Più processori uguale più velocità? e un processore impiega per eseguire un programma un tempo T, un sistema formato da P processori dello stesso tipo esegue lo stesso programma in un tempo TP T / P? In
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
Il metodo scientifico
 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
www.andreatorinesi.it
 La lunghezza focale Lunghezza focale Si definisce lunghezza focale la distanza tra il centro ottico dell'obiettivo (a infinito ) e il piano su cui si forma l'immagine (nel caso del digitale, il sensore).
La lunghezza focale Lunghezza focale Si definisce lunghezza focale la distanza tra il centro ottico dell'obiettivo (a infinito ) e il piano su cui si forma l'immagine (nel caso del digitale, il sensore).
Esercitazione 5 Dinamica del punto materiale
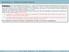 Problema 1 Un corpo puntiforme di massa m = 1.0 kg viene lanciato lungo la superficie di un cuneo avente un inclinazione θ = 40 rispetto all orizzontale e altezza h = 80 cm. Il corpo viene lanciato dal
Problema 1 Un corpo puntiforme di massa m = 1.0 kg viene lanciato lungo la superficie di un cuneo avente un inclinazione θ = 40 rispetto all orizzontale e altezza h = 80 cm. Il corpo viene lanciato dal
Nascita e morte delle stelle
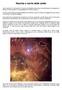 Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
La corrente elettrica
 PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio La corrente elettrica Sommario 1) Corrente elettrica
PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio La corrente elettrica Sommario 1) Corrente elettrica
Verifica sperimentale del principio di conservazione dell'energia meccanica totale
 Scopo: Verifica sperimentale del principio di conservazione dell'energia meccanica totale Materiale: treppiede con morsa asta millimetrata treppiede senza morsa con due masse da 5 kg pallina carta carbone
Scopo: Verifica sperimentale del principio di conservazione dell'energia meccanica totale Materiale: treppiede con morsa asta millimetrata treppiede senza morsa con due masse da 5 kg pallina carta carbone
Lezione 14: L energia
 Lezione 4 - pag. Lezione 4: L energia 4.. L apologo di Feynman In questa lezione cominceremo a descrivere la grandezza energia. Per iniziare questo lungo percorso vogliamo citare, quasi parola per parola,
Lezione 4 - pag. Lezione 4: L energia 4.. L apologo di Feynman In questa lezione cominceremo a descrivere la grandezza energia. Per iniziare questo lungo percorso vogliamo citare, quasi parola per parola,
quale agisce una forza e viceversa. situazioni. applicate a due corpi che interagiscono. Determinare la forza centripeta di un
 CLASSE Seconda DISCIPLINA Fisica ORE SETTIMANALI 3 TIPO DI PROVA PER GIUDIZIO SOSPESO Test a risposta multipla MODULO U.D Conoscenze Abilità Competenze Enunciato del primo principio della Calcolare l accelerazione
CLASSE Seconda DISCIPLINA Fisica ORE SETTIMANALI 3 TIPO DI PROVA PER GIUDIZIO SOSPESO Test a risposta multipla MODULO U.D Conoscenze Abilità Competenze Enunciato del primo principio della Calcolare l accelerazione
Appunti sulla Macchina di Turing. Macchina di Turing
 Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
LA TERMOGRAFIA SPETTRO ONDE ELETTROMAGNETICHE
 SPETTRO ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è un mezzo di trasmissione dell energia sotto forma di onde aventi entrambe le componenti elettriche e magnetiche. La sequenza ordinata delle
SPETTRO ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è un mezzo di trasmissione dell energia sotto forma di onde aventi entrambe le componenti elettriche e magnetiche. La sequenza ordinata delle
Corrispondenze e funzioni
 Corrispondenze e funzioni L attività fondamentale della mente umana consiste nello stabilire corrispondenze e relazioni tra oggetti; è anche per questo motivo che il concetto di corrispondenza è uno dei
Corrispondenze e funzioni L attività fondamentale della mente umana consiste nello stabilire corrispondenze e relazioni tra oggetti; è anche per questo motivo che il concetto di corrispondenza è uno dei
Transitori del primo ordine
 Università di Ferrara Corso di Elettrotecnica Transitori del primo ordine Si consideri il circuito in figura, composto da un generatore ideale di tensione, una resistenza ed una capacità. I tre bipoli
Università di Ferrara Corso di Elettrotecnica Transitori del primo ordine Si consideri il circuito in figura, composto da un generatore ideale di tensione, una resistenza ed una capacità. I tre bipoli
Grandezze fisiche e loro misura
 Grandezze fisiche e loro misura Cos è la fisica? e di che cosa si occupa? - Scienza sperimentale che studia i fenomeni naturali suscettibili di sperimentazione e caratterizzati da entità o grandezze misurabili.
Grandezze fisiche e loro misura Cos è la fisica? e di che cosa si occupa? - Scienza sperimentale che studia i fenomeni naturali suscettibili di sperimentazione e caratterizzati da entità o grandezze misurabili.
SISTEMI DI NUMERAZIONE E CODICI
 SISTEMI DI NUMERAZIONE E CODICI Il Sistema di Numerazione Decimale Il sistema decimale o sistema di numerazione a base dieci usa dieci cifre, dette cifre decimali, da O a 9. Il sistema decimale è un sistema
SISTEMI DI NUMERAZIONE E CODICI Il Sistema di Numerazione Decimale Il sistema decimale o sistema di numerazione a base dieci usa dieci cifre, dette cifre decimali, da O a 9. Il sistema decimale è un sistema
Un gioco con tre dadi
 Un gioco con tre dadi Livello scolare: biennio Abilità interessate Costruire lo spazio degli eventi in casi semplici e determinarne la cardinalità. Valutare la probabilità in diversi contesti problematici.
Un gioco con tre dadi Livello scolare: biennio Abilità interessate Costruire lo spazio degli eventi in casi semplici e determinarne la cardinalità. Valutare la probabilità in diversi contesti problematici.
Laboratorio di Fisica 3 Ottica 2. Studenti: Buoni - Giambastiani - Leidi Gruppo: G09
 Laboratorio di Fisica 3 Ottica 2 Studenti: Buoni - Giambastiani - Leidi Gruppo: G09 24 febbraio 2015 1 Lunghezza d onda di un laser He-Ne 1.1 Scopo dell esperienza Lo scopo dell esperienza è quello di
Laboratorio di Fisica 3 Ottica 2 Studenti: Buoni - Giambastiani - Leidi Gruppo: G09 24 febbraio 2015 1 Lunghezza d onda di un laser He-Ne 1.1 Scopo dell esperienza Lo scopo dell esperienza è quello di
UNIVERSITÀ DEGLI STUDI DI TERAMO
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN ECONOMIA BANCARIA FINANZIARIA ED ASSICURATIVA (Classe 7) Corso di Matematica per l Economia (Prof. F. Eugeni) TEST DI INGRESSO Teramo, ottobre 00 SEZIONE
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN ECONOMIA BANCARIA FINANZIARIA ED ASSICURATIVA (Classe 7) Corso di Matematica per l Economia (Prof. F. Eugeni) TEST DI INGRESSO Teramo, ottobre 00 SEZIONE
