CLASSIFICAZIONE DEI PEPTIDI
|
|
|
- Norberto Fiori
- 5 anni fa
- Visualizzazioni
Transcript
1 terminale). PEPTIDI Gli amminoacidi si legano tra di loro attraverso una reazione che coinvolge COOH di un amminoacido e NH 2 di un altro amminoacido, con la liberazione di una molecola di acqua per ogni legame formato. Il legame covalente che si forma prende il nome di legame peptidico. Il peso molecolare di una proteina è uguale alla somma dei pesi molecolari degli amminoacidi che la compongono, togliendo i pesi molecolari di tutte le molecole d acqua eliminate per formare i legami. La formazione dei legami comporterà la formazione di due estremità del peptide: l estremità ammino-terminale (Nterminale) e l estremità carbossi-terminale (C- CLASSIFICAZIONE DEI PEPTIDI Le proteine possono essere classificate in base al numero di amminoacidi di cui sono composte: - Dipeptide (due amminoacidi) - Tripeptide (tre amminoacidi) - Tetrapeptide (quattro amminoacidi) - Oligopeptide (circa venti amminoacidi) - Polipeptide (oltre venti amminoacidi) LEGAMI
2 I legami che si possono trovare in una proteina sono molteplici e ogni legame è diverso dagli altri per lunghezza ed energia: - Legame peptidico: è un tipo di legame covalente che differisce per caratteristiche dal classico legame ammidico. Il legame peptidico è più forte di un comune legame covalente C-C, poiché ha la tendenza ad assomigliare a un doppio legame a causa di una differenza di cariche parziali tra N e O. - Ponte disolfuro (legame SH): è un tipo di legame covalente che si forma tra le catene laterali di cisteina di diverse subunità proteiche. - Ponte idrogeno (legame H): è un tipo di legame polare molto debole che si forma tra H e un atomo molto elettronegativo (es. O e N). PURIFICAZIONE DI UNA PROTEINA Il processo di purificazione di una proteina segue diverse fasi: 1) Lisi delle cellule 2) Estratto grezzo 3) Frazionamento 4) Dialisi 5) Separazione delle proteine Lisi delle cellule La lisi delle cellule consiste di rompere la membrana plasmatica delle cellule per far uscire il citoplasma con gli organuli. Sono tre le tecniche di lisi cellulare: - Omogeneizzazione - Ultrasuoni - Lisi ipotonica Estratto grezzo L estratto grezzo è il citoplasma con gli organuli così come esce dalla cellula. Frazionamento Il frazionamento è il processo con cui vengono separate le componenti pesanti da quelle leggere con una centrifugazione frazionale, quindi con l utilizzo di una centrifuga.
3 Dialisi La dialisi ha la funzione di allontanare i composti di piccole dimensioni da quelli di grandi dimensioni. Si utilizza un sacchetto con pori con pori con una soluzione concentrata e le proteine in un becher con un solvente. In questo modo le piccole particelle escono dai pori del sacchetto. Separazione delle proteine La separazione delle proteine l una dalle altre è un processo che può essere mediato da diverse tecniche: - Cromatografia su colonna: si utilizza una colonna di vetro in cui è inserita la matrice (materiale solido e poroso). Una soluzione (fase mobile) fluisce attraverso la matrice, che rappresenta invece la fase stazionaria. La soluzione che esce dal fondo della colonna viene rimpiazzata da una soluzione contenuta in un recipienti di riserva in sima alla colonna. La soluzione di proteina che devono essere separate viene stratificata sulla parte alta della colonna e la si lascia penetrare nella matrice. La soluzione proteica forma una banda all interno della fase mobile, il cui spessore iniziale dipende dal volume della soluzione proteica caricata. Man mano che le proteine migrano attraverso la colonna, esse vengono rallentate in modo diverso, a seconda del grado di interazione con la matrice. La banda proteica complessiva tende quindi ad allargarsi, man mano che si muove lungo la colonna. Le varie proteine gradualmente si separano l una dall altra, formando bande discrete all interno della banda più ambia che comprende l intera gamma delle proteine. La separazione migliora se si aumenta la lunghezza della colonna, però anche le singole bande si allargano col tempo per effetto della diffusione di molecole. - Cromatografia a scambio ionico: la miscela viene aggiunta alla colonna contenente scambiatori di ioni. Le proteine di muovo attraverso la colonna a una
4 velocità che dipende dalla loro carica netta al ph della soluzione utilizzata. Con gli scambiatori si ioni, le proteine con carica netta stessa a quella degli scambiatori si muovono più velocemente e fuoriescono prima. - Cromatografia per esclusione molecolare (gel-filtrazione): la miscela di proteine viene aggiunta alla colonna contenente un polimero con legami incrociati. Le molecole proteiche sono separate per dimensione: le molecole più grandi passano liberamente e si ritrovano nelle prime frazioni raccolte. - Cromatografia per affinità: una soluzione di ligando viene aggiunta alla colonna. La miscela di proteine viene caricata su una colonna contenente un polimero che ha legato a sé un ligando specifico per la proteina di interesse.
5
6 STRUTTURE PROTEICHE Ad una sequenza di amminoacidi corrisponde una struttura. Ad una struttura corrisponde una funzione. Le proteine non sono lineari, ma prendono conformazioni diverse in base alla quantità di amminoacidi con cui sono composte, al tipo di amminoacidi e all ordine con cui questi sono legati. Esistono quattro strutture proteiche per descrivere le funzioni delle proteine e tutte queste strutture sono dipendenti dalla struttura primaria. STRUTTURA PRIMARIA La struttura primaria descrive la sequenza con cui sono disposti gli amminoacidi nella proteina. Le caratteristiche chimico-fisiche di una proteina ripiegano in modo diverso ogni proteina, si avranno così strutture tridimensionali diverse. Alcune malattie genetiche sono causate da una struttura primaria alterata, cioè quindi da problemi a livello amminoacidico; per esempio, l anemia falciforme è causata dalla sostituzione della valina con il glutammato. Scomposizione della proteina Una volta separate le proteine nel processo di purificazione, serve sapere la composizione amminoacidica, quindi si deve idrolizzare la proteina con una soluzione HCl/6M/110 C/24-48h, in modo tale che si rompano i legami peptidici per separare gli amminoacidi. Giunti a questo punto, si attua il processo di derivatizzazione, che consiste nel legare agli amminoacidi un composto che assorbe la luce a diverse lunghezze d onda (es. la ninidra assorbe la luce a 570nm). Per capire a quale amminoacido corrisponde ogni picco, si usano amminoacidi standard singoli in cromatografia, successivamente si misura la curva prodotta da ogni amminoacido sul cromatogramma e si nota a quale essa corrisponde con gli amminoacidi standard.
7 Sistema di Frederick Sanger Si fa reagire la proteina con il fluoridinitrobenzene e questo si lega all estremità N-terminale con un legame che conferirà un assorbimento della luce a una certa lunghezza d onda, data la caratteristica di fotoassorbimento del fluoridinitrobenzene. A questo punto l estremità N-terminale viene separata dal resto del peptide. Se la proteina dovesse avere più unità legate, per esempio, da ponti disolfuro, si tratta la proteina con agenti riducenti come di ditiotreitolo, con la conseguenti rigenerazione delle cisteine e la separazione delle unità proteiche. Degradazione di Edman Si utilizza il fenilisotiocianato e, quando reagisce in ambiente alcalino, si lega al gruppo N- terminale. Successivamente si fa reagire la proteina con acidotrifluoroacetico per rompere il legame tra N e C e creare un nuovo gruppo N-terminale.
8 Questo metodo ha la possibilità di legare ogni amminoacido, perché, staccato uno, si ripete il processo con l amminoacido successivo. La degradazione di Edman ha però solo il 90% di possibilità di riuscita, quindi si deve attuare più volte, e funziona solo su peptidi non più lunghi di 40 amminoacidi, quindi deve essere scomposto il peptide in segmenti più corti in due differenti modi: - Metodo enzimatico: si utilizzano degli enzimi chiamati proteasi, come la tripsina, che demolisce i legami tra un qualsiasi amminoacido e la lisina o l arginina, che sono carichi positivamente. - Metodo chimico: si utilizza una sostanza chimica chiamata bromuro di cianogeno, che demolisce i legami tra un qualsiasi amminoacido e la metionina. Famiglie proteiche funzione di questa proteina è poco importante. Comparando la sequenza primaria delle proteine si può parlare di famiglie di proteine che sono omologhe e, che quindi, hanno la stessa funzione pur avendo una composizione amminoacidica differente (simile, ma differente). Le proteine, nel corso dell evoluzione, sono cambiate, perché è cambiato il DNA, e quindi i geni, che danno inizio al processo di sintesi. Alcune proteine modificate causano danni all organismo, mentre altre mantengono la stessa funzione, senza alcuna alterazione. L istone H4 ha sostituito pochi amminoacidi in 1 miliardo di anni, quindi contiene amminoacidi importantissimi per il suo funzionamento; i fibrinopeptidi hanno sostituito centinaia di amminoacidi, quindi la Domini proteici In alcune proteine si possono riscontrare sequenze amminoacidiche identiche chiamate domini o moduli, che si ripetono più volte nel peptide. Ogni dominio si può ripiegare autonomamente dal resto della proteine, conferendo diverse funzioni a questa. STRUTTURA SECONDARIA La struttura secondaria descrive la sequenza degli amminoacidi tenendo conto solo dello scheletro di una proteina, quindi senza tenere conto delle catene laterali. Nello scheletro di una proteina si hanno tre legami: - C α -CO - CO-NH - NH- C α Angoli di rotazione La rotazione dei legami determina la struttura secondaria e gli unici legami che possono ruotare sono NH- C α (forma un angolo φ) e C α -CO (forma un angolo ψ). La disposizione nello spazio di questi due angoli determina la struttura secondaria. Gli angoli φ
9 e ψ possono assumere valori da -180 a +180 e sono valori che possono differire da quelli precedenti o successivi in un peptide. Esistono diverse conformazioni della struttura secondaria: - Random coil - α-elica - Filamento-β - Foglietto- β - Ripiegamento- β Random coil E una struttura irregolare, casuale, disordinata e senza forma. α-elica E una struttura regolare con una forma di un elica che si avvolge su un ipotetico asse centrale. La struttura ad elica è determinata dal passo, cioè dalla lunghezza tra due atomi che si trovano dalla stessa parte dell elica, che ha un valore di circa 0,54nm con la presenza di circa 3,6 residui amminoacidici tra un passo e l altro. Ad ogni passo si forma un ponte H tra CO e NH e ciò consente di stabilizzare ancora di più la struttura. I legami a H che si vengono a formare sono tutti paralleli all asse centrale dell elica. Le estremità N e C terminale non sono coinvolte nei legami a H, quindi si crea un dipolo con cariche opposti alle estremità opposte dell elica. In tante proteine l elica si interrompe per poi riprendere, perché non tutti gli amminoacidi sono compatibili con l elica a causa di diverse cause: La propensione intrinseca di un residuo amminoacidico a formare un elica. L interazione tra gruppi R, specialmente quelli che si trovano lontani 3/4 residui. L ingombro sterico di gruppi R adiacenti. La presenza di prolina (l anello a cinque non consente la formazione dell elica) e glicina (la catena laterale è troppo corta). Le interazioni tra residui amminoacidici che si trovano alla fine del segmento dell elica e il dipolo elettrico dell elica. Filamento-β E una struttura regolare a zig-zag. Foglietto-β E una struttura regolare composta da più filamenti-β legati tra di loro. Le catene laterali sono disposte in alternanza sotto/sopra. Se i
10 foglietti vanno nella stessa direzione saranno paralleli, altrimenti antiparalleli. Ripiegamento-β E una struttura regolare che si crea quando un tratto di polipeptide si ripiega ad ansa. L ansa è composta da 4 amminoacidi e tra il primo e il quarto si forma un ponte H. STRUTTURA TERZIARIA La struttura terziaria descrive la disposizione nello spazio di tutti gli atomi di una proteina. Non descrive solo lo scheletro carbonioso di un polipeptide, ma descrive anche le disposizioni assunte dalle catene laterali. Questa struttura è quella che maggiormente dà idea della forma della proteina. La struttura terziaria ottenuta è sempre quella termodinamicamente più stabile, infatti per stabilizzare la struttura terziaria si formano molte interazioni deboli, quali: - Attrazioni elettrostatiche o ponti ad idrogeno, se gli amminoacidi trovano nella posizione corretta. - Interazioni idrofobiche, da cui dipende il ripiegamento globale di una proteina. Infatti una catena polipeptidica può avere tanti amminoacidi idrofobici, i quali non possono presentare le loro catene laterali disposte verso l esterno, in quanto sarebbero a contatto con l acqua. Per questo motivo le proteine si ripiegano in modo tale da avere gli amminoacidi idrofobici rivolti verso l interno, o confinati in una nicchia. - Ponti disolfuro, i quali intervengono per stabilizzare ulteriormente la struttura. In questo caso la catena polipeptidica è invitata a ripiegarsi in maniera tale da dare la possibilità alle cisteine di interagire mediante ponti disolfuro. Relazione tra struttura terziaria e struttura secondaria La struttura terziaria contiene al suo interno diversi elementi della struttura secondaria. Nella struttura terziaria di una proteina riconosciamo il ripetersi ed il ripresentarsi di diversi tratti con struttura secondaria nota. Ci sono alcune particolari associazioni di strutture secondarie riconoscibili all interno di una proteina, che sono spesso ripetute. Ad esempio la struttura β-α-β. Non è raro trovare in una proteina un foglietto-β, formato dai due filamenti-β, uniti tra loro mediante ponti idrogeno, un α-elica e due strutture random coil.
11 Un altro esempio di strutture terziarie particolari è rappresentato dal barile-β, formato da un gran numero di filamenti-β. La struttura terziaria non è solo un insieme delle strutture secondarie, per via del contributo delle catene laterali. Nel definire la struttura terziaria, in genere, le proteine vengono divise in due grosse famiglie: - Proteine fibrose: proteine la cui struttura terziaria assume una forma filiforme. Le proteine fibrose hanno funzioni strutturali, dando sostegno, forza e rigidità alla cellula. Spesso nelle proteine fibrose, non in tutte, si trova un unico tipo di struttura secondaria che si ripete per tutta la lunghezza della proteina. Un esempio di ciò è possibile notarlo nell α-cheratina, nella fibra della seta, che presenta una struttura secondaria β-foglietto, e nel collagene. - Proteine globulari: proteine che assumono dei ripiegamenti complessi, con forme chiuse su se stesse (sferiche o cilindriche). Le proteine globulari svolgono funzioni specializzate molto precise. Nelle proteine globulari non si troveranno mai solo un tipo di struttura secondaria. α-cheratina L α-cheratina è una proteina molto importante che riesce a donare durezza e resistenza alla tensione molto forte alle parti del corpo che compone. La struttura secondaria dell α-cheratina è rappresentata da un α-elica, che si ripete ininterrottamente per tutta la lunghezza della proteina (particolarità dell α-cheratina). Tendenzialmente la struttura secondaria dell α-cheratina si avvolge attorno ad altro polipeptide che presenta una struttura ad α-elica. Questa struttura prende il nome di struttura coiled-coil. Questo tipo di struttura altro non è che l esempio più semplice di struttura quaternaria, che descrive come catene polipeptidiche diverse si dispongono nello spazio tra di loro. Questo tipo di struttura si viene a formare quando le α-elica di due proteine sono sempre a contatto tra loro. Per formare una struttura coiled-coil queste due facce devono avere degli amminoacidi con strutture compatibili. Tendenzialmente gli amminoacidi che formano le strutture coiled-coil sono amminoacidi idrofobici. Collagene Il collagene è una proteina fondamentale, che costituisce nel nostro organismo la cartilagine, i tendini e le ossa. La sua funzione è quella di donare resistenza alla tensione e ciò è reso possibile dalla particolare struttura assunta. Infatti il collagene è composto da un unica catena polipeptidica, la cui struttura secondaria è regolare, in quanto assume una forma elicoidale. A differenza dell α-elica, l elica collagenica è sinistrorsa, inoltre è organizzata in maniera più lassa e si avvolge più stretta attorno all asse centrale. Inoltre differisce dall α-elica anche per gli angoli di legame φ e ψ, in quanto φ= - 51 e ψ= Così come nel caso dell α-cheratina, anche in questo caso troviamo un superavvolgimento dell elica. In questo caso, però, tre eliche si superavvolgono l un l altra portando alla formazione della tripla elica collagenica, in cui lo spazio interno è molto ristretto. Questa particolare struttura terziaria è dovuta alla peculiarità della sequenza amminoacidica presente nella struttura
12 primaria. Infatti tutti i collagene hanno due caratteristiche peculiari: - Un terzo della struttura primaria è costituita da glicina, disposta con estrema regolarità, in quanto c è un residuo di glicina ogni tre residui amminoacidici. La presenza di tutti questi residui di glicina è fondamentale nella tripla elica collagenica, in quanto lo spazio interno è molto limitato, per cui un amminoacido con una catena laterale ingombrante non troverebbe spazio. La glicina è l unico aminoacido che può posizionarsi nello spazio interno della tripla elica collagenica, in quanto presenta una catena laterale molto piccola. Per questo motivo, tutta la faccia interna del canale centrale della tripla elica è costituito da dei residui di glicina. - La presenza di molti residui di prolina. Molto spesso i residui di prolina sono modificati in 4- idrossiprolina, ossia una prolina che presenta un gruppo OH sul carbonio 4. La presenza di tutti questi residui di prolina induce la singola catena polipeptidica del collagene ad assumere una struttura elicoidale, a causa dell ingombro sterico dovuto alle catene laterali della prolina. La disposizione elicoidale della catena tiene i residui della prolina il più lontano tra loro, evitando così l ingombro sterico. L unità formatasi mediante l assemblaggio di tre eliche, ossia la tripla elica collagenica, prende il nome di tropo-collagene. Nei tendini, nell osso e nella cartilagine, il tropo-collagene tende ad associarsi con alte molecole di tropo-collagene creando delle fibre di collagene. Le fibre di collagene sono unite grazie ai ponti ad idrogeno, che si vengono a creare tra i gruppi OH dei residui di 4-idrossi-prolina, in quanto stabilizzano e legano i monomeri di collagene che formano la tripla elica. La trasformazione del residuo di prolina in 4-idrossi-prolina all interno della molecola di collagene è una reazione che richiede molti reagenti, tra cui la vitamina C, la quale assiste la prolina nell idrossidazione. Carenze di vitamina C causano una ridotta idrossidazione nelle proline, quindi una ridotta capacità di stabilizzare le molecole di collagene all interno della tripla elica, rendendo il collagene meno resistente. STRUTTURA QUATERNARIA Riguarda solo le proteine composte da più di una sub-unità e descrive solo il modo con cui le diverse subunità sono disposte tra loro nello spazio e che tipo di interazione le tiene unite. Ci sono proteine funzionali costituite da polipeptidi diversi associati tra loro. A volte le sub-unità possono essere due o più (anche 24 ad esempio). Le forze che tengono insieme le catene polipeptidiche sono sostanzialmente interazioni deboli (elettrostatiche e ponti idrogeno), molto meno rilevante interazioni idrofobiche, perché già nelle sub-unità sono disposti verso l interno. Talvolta anche ponti disolfuro, dovuto a cisteine su catene polipeptidiche diverse che possono ossidarsi e fare ponti disolfuro. Molto spesso la disposizione con cui diverse sub-unità si associano tra loro rispetta sempre dei piani di simmetria. La struttura quaternaria è tenuta insieme da interazioni deboli tra le sub-unità, la terziaria da interazioni deboli tra catene laterali e la struttura secondaria dipende da primaria. Tutti questi livelli della struttura terziaria dipendono dalla sequenza primaria, è dalla sequenza primaria che derivano tutte le informazioni utili alla proteina per poter disporre gli
13 amminoacidi in modo preciso per formare la struttura terziaria e quaternaria. La struttura terziaria e quaternaria di una proteina sono stabilite dalla struttura primaria.
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 9
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 9 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 9 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
aa 2013-14 Proteine Struttura delle Proteine α Amminoacidi
 Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
PROTEINE. Amminoacidi
 PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
Struttura delle proteine
 Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE
 Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine.
 Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
Peptidi, proteine ed e nzim i i 1
 Peptidi, proteine ed enzimi 1 Gli amminoacidi possono formare catene Due amminoacidi possono unirsi tra loro attraverso il legame ammidico detto legame peptidico, tra il gruppo NH 2 di un amminoacido e
Peptidi, proteine ed enzimi 1 Gli amminoacidi possono formare catene Due amminoacidi possono unirsi tra loro attraverso il legame ammidico detto legame peptidico, tra il gruppo NH 2 di un amminoacido e
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
È stimato che oggi sulla terra sono presenti da 10*10 6 a 100*10 6 specie viventi
 È stimato che oggi sulla terra sono presenti da 10*10 6 a 100*10 6 specie viventi Enorme diversità di forme Costanza di struttura interna La cellula è l unità fondamentale di tutti gli organismi viventi
È stimato che oggi sulla terra sono presenti da 10*10 6 a 100*10 6 specie viventi Enorme diversità di forme Costanza di struttura interna La cellula è l unità fondamentale di tutti gli organismi viventi
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
La biochimica è anche definita la chimica del C :
 Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
Livello di organizzazione degli esseri viventi
 Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
NUCLEOTIDI e ACIDI NUCLEICI
 NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
BIOMOLECOLE STRUTTURA E FUNZIONE
 BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Lezione 2. Sommario. Bioinformatica. Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi e proteine. Mauro Ceccanti e Alberto Paoluzzi
 Lezione 2 Bioinformatica Mauro Ceccanti e Alberto Paoluzzi Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi e proteine Dip. Informatica e Automazione Università Roma Tre Dip. Medicina Clinica Università
Lezione 2 Bioinformatica Mauro Ceccanti e Alberto Paoluzzi Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi e proteine Dip. Informatica e Automazione Università Roma Tre Dip. Medicina Clinica Università
Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa
 Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Amminoacidi e Proteine
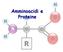 Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Macromolecole Biologiche. I domini (II)
 I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura
Macromolecole Biologiche. I domini (I)
 I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
Capitolo 17. Risposte alle domande interne al capitolo. 17.1 (p. 501) a. glicina. b. prolina. c. treonina. d. aspartato
 apitolo 17 Risposte alle domande interne al capitolo 17.1 (p. 501) a. glicina b. prolina c. treonina d. aspartato e. 17.2 (p. 501) a. La glicina è un aminoacido idrofobico. b. La prolina è un aminoacido
apitolo 17 Risposte alle domande interne al capitolo 17.1 (p. 501) a. glicina b. prolina c. treonina d. aspartato e. 17.2 (p. 501) a. La glicina è un aminoacido idrofobico. b. La prolina è un aminoacido
MEMBRANE. struttura: fosfolipidi e proteine
 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
4x4x4=4 3 =64 codoni. 20 aminoacidi
 4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
I Composti Organici. Le Biomolecole
 I Composti Organici I composti organici sono molecole tutte contenenti carbonio. Essi comprendono. 1. composti di interesse energetico che sono gli Idrocarburi ( i derivati del petrolio), 2. composti a
I Composti Organici I composti organici sono molecole tutte contenenti carbonio. Essi comprendono. 1. composti di interesse energetico che sono gli Idrocarburi ( i derivati del petrolio), 2. composti a
corta catena (meno di 20 ammino acidi) mancanza di una struttura spaziale organizzata lunga catena di ammino acidi struttura spaziale organizzata
 STRUTTURA DELLE PROTEINE Peptide: corta catena (meno di 20 ammino acidi) mancanza di una struttura spaziale organizzata Polipeptide (proteina): lunga catena di ammino acidi struttura spaziale organizzata
STRUTTURA DELLE PROTEINE Peptide: corta catena (meno di 20 ammino acidi) mancanza di una struttura spaziale organizzata Polipeptide (proteina): lunga catena di ammino acidi struttura spaziale organizzata
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 7
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 7 La struttura delle proteine Concetti chiave: La struttura terziaria di una proteina descrive il ripiegamentodei suoi elementi
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 7 La struttura delle proteine Concetti chiave: La struttura terziaria di una proteina descrive il ripiegamentodei suoi elementi
Macromolecole Biologiche. I domini (III)
 I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
DOMINI E MODULI 02/04/2014. Domini modulari delle proteine 2
 Domini modulari delle proteine 1 Proteine della matrice DOMINI E MODULI La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette domini,
Domini modulari delle proteine 1 Proteine della matrice DOMINI E MODULI La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette domini,
Seminario. Domini modulari delle proteine 1
 Seminario Proteine della matrice DOMINI E MODULI Domini modulari delle proteine 1 La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette
Seminario Proteine della matrice DOMINI E MODULI Domini modulari delle proteine 1 La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette
Strutture molecolari della cellula: Bio-macromolecole. Prof. C. Guarino
 Strutture molecolari della cellula: Bio-macromolecole Prof. C. Guarino INTRO Ogni cellula vivente racchiude una pluralità di molecole diverse L acqua è l elemento dominante, nelle cellule vegetali e nei
Strutture molecolari della cellula: Bio-macromolecole Prof. C. Guarino INTRO Ogni cellula vivente racchiude una pluralità di molecole diverse L acqua è l elemento dominante, nelle cellule vegetali e nei
LA CHERATINA. CORSO COSMETOLOGIA- DOTT.SSA B. SCARABELLI (www.cosmesinice.it) PROTEINA: unione di più aminoacidi
 PROTEINA: unione di più aminoacidi LA CHERATINA AMINOACIDO: molecola unità di base; ce ne sono 20 di cui 8 sono essenziali (da introdurre solo con i cibi) La struttura delle proteine vien suddivisa in
PROTEINA: unione di più aminoacidi LA CHERATINA AMINOACIDO: molecola unità di base; ce ne sono 20 di cui 8 sono essenziali (da introdurre solo con i cibi) La struttura delle proteine vien suddivisa in
LE PROTEINE. Le proteine sono i biopolimeri piu' abbondanti negli organismi viventi e svolgono funzioni biologiche di fondamentale importanza:
 LE PRTEINE Le proteine sono i biopolimeri piu' abbondanti negli organismi viventi e svolgono funzioni biologiche di fondamentale importanza: PRTEINE CATALITICHE PRTEINE REGLATRICI PRTEINE DIFESA PRTEINE
LE PRTEINE Le proteine sono i biopolimeri piu' abbondanti negli organismi viventi e svolgono funzioni biologiche di fondamentale importanza: PRTEINE CATALITICHE PRTEINE REGLATRICI PRTEINE DIFESA PRTEINE
Le proteine. Le proteine sono macromolecole che presentano differenze funzionali e strutturali
 Le proteine Le proteine sono macromolecole che presentano differenze funzionali e strutturali LE PROTEINE HANNO FUNZIONI BIOLOGICHE DIVERSE enzimi proteine di trasporto proteine strutturali proteine di
Le proteine Le proteine sono macromolecole che presentano differenze funzionali e strutturali LE PROTEINE HANNO FUNZIONI BIOLOGICHE DIVERSE enzimi proteine di trasporto proteine strutturali proteine di
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini.
 I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 4
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 4 Scoperta degli amminoacidi: gli amminoacidi essenziali Gli amminoacidi essenziali sono quegli amminoacidi che un
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 4 Scoperta degli amminoacidi: gli amminoacidi essenziali Gli amminoacidi essenziali sono quegli amminoacidi che un
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta)
 Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
NH 2 CHCOOH AMINOACIDI PRESENTI NELLE PROTEINE. Abbreviazione internazionale. Nome. acido aspartico acido glutammico. CXasparagina.
 Le proteine sono composti organici quaternari; esse sono costituite infatti da C,H,N e O. Pertanto rappresentano l'unica fonte di azoto del nostro organismo. Le proteine si formano per polimerizzazione
Le proteine sono composti organici quaternari; esse sono costituite infatti da C,H,N e O. Pertanto rappresentano l'unica fonte di azoto del nostro organismo. Le proteine si formano per polimerizzazione
Legame al GMPciclico COOH
 Moduli strutturali delle proteine Nelle proteine è possibile individuare alcune strutture caratterizzate da omologia, che svolgono particolari funzioni, e che si ritrovano in proteine diverse. Si può parlare
Moduli strutturali delle proteine Nelle proteine è possibile individuare alcune strutture caratterizzate da omologia, che svolgono particolari funzioni, e che si ritrovano in proteine diverse. Si può parlare
TRASCRIZIONE DEL DNA, TRADUZIONE DELL RNA
 TRASCRIZIONE DEL DNA, TRADUZIONE DELL RNA TRADUZIONE La traduzione e il processo con cui viene sintetizzata un data proteina, attraverso reazioni chimiche di polimerizzazione di amminoacidi, in una
TRASCRIZIONE DEL DNA, TRADUZIONE DELL RNA TRADUZIONE La traduzione e il processo con cui viene sintetizzata un data proteina, attraverso reazioni chimiche di polimerizzazione di amminoacidi, in una
Costituzione dei viventi
 Costituzione dei viventi La materia e costituita da elementi chimici in forma pura o in combinazioni dette composti 25 dei 92 elementi naturali sono costituenti essenziali dei viventi 4 (C, O,, N) costituiscono
Costituzione dei viventi La materia e costituita da elementi chimici in forma pura o in combinazioni dette composti 25 dei 92 elementi naturali sono costituenti essenziali dei viventi 4 (C, O,, N) costituiscono
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Università di Roma Tor Vergata - Corso di Laurea in Scienze Biologiche - Immunologia Molecolare - dott. Claudio PIOLI - a.a.
 Anticorpi generalità Riconoscimento antigene Anticorpi Molecole MHC Recettore per l Ag dei linfociti T (TCR) Anticorpi riconoscono diversi tipi di strutture antigeniche macromolecole proteine, lipidi,
Anticorpi generalità Riconoscimento antigene Anticorpi Molecole MHC Recettore per l Ag dei linfociti T (TCR) Anticorpi riconoscono diversi tipi di strutture antigeniche macromolecole proteine, lipidi,
Il dogma centrale della biologia. molecolare
 Il dogma centrale della biologia Cell molecolare Transcription Translation Ribosome DNA mrna Polypeptide (protein) L informazione per la sintesi delle proteine è contenuta nel DNA. La trascrizione e la
Il dogma centrale della biologia Cell molecolare Transcription Translation Ribosome DNA mrna Polypeptide (protein) L informazione per la sintesi delle proteine è contenuta nel DNA. La trascrizione e la
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Dall RNA alle proteine. La traduzione nei procarioti e negli eucarioti
 Dall RNA alle proteine La traduzione nei procarioti e negli eucarioti Codice genetico La sequenza dell mrna viene decodificata a gruppi di tre nucleotidi, e tradotta in una sequenza di amminoacidi 4 x
Dall RNA alle proteine La traduzione nei procarioti e negli eucarioti Codice genetico La sequenza dell mrna viene decodificata a gruppi di tre nucleotidi, e tradotta in una sequenza di amminoacidi 4 x
Laurea Magistrale in Biologia
 Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Rappresentazione dei Dati Biologici
 Rappresentazione dei Dati Biologici CORSO DI BIOINFORMATICA C.d.L. Ingegneria Informatica e Biomedica Outline Proteine ed Amminoacidi Rappresentazione di Amminoacidi Rappresentazione delle strutture Proteiche
Rappresentazione dei Dati Biologici CORSO DI BIOINFORMATICA C.d.L. Ingegneria Informatica e Biomedica Outline Proteine ed Amminoacidi Rappresentazione di Amminoacidi Rappresentazione delle strutture Proteiche
L E P R O T E I N E. Le proteine sono macromolecole formate dall'unione di molte unità elementari chiamate amminoacidi (AA).
 L E P R O T E I N E ASPETTI GENERALI I protidi o proteine sono i costituenti principali delle cellule, sia animali che vegetali; sono sempre presenti negli esseri viventi dei quali entrano a far parte
L E P R O T E I N E ASPETTI GENERALI I protidi o proteine sono i costituenti principali delle cellule, sia animali che vegetali; sono sempre presenti negli esseri viventi dei quali entrano a far parte
Metodi di studio delle interazioni proteina-proteina. Metodi biochimici
 Metodi di studio delle interazioni proteina-proteina Metodi biochimici Interazioni proteina-proteina Giocano un ruolo fondamentale nell organizzazione strutturale e funzionale della cellula Interazioni
Metodi di studio delle interazioni proteina-proteina Metodi biochimici Interazioni proteina-proteina Giocano un ruolo fondamentale nell organizzazione strutturale e funzionale della cellula Interazioni
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
la struttura tridimensionale può essere ottenuta solo per Un intero dominio in genere da 50 a 300 residui
 Durante la traduzione l informazione di ripiegamento codificata nella sequenza aminoacidica diventa disponibile in maniera vettoriale la struttura tridimensionale può essere ottenuta solo per Un intero
Durante la traduzione l informazione di ripiegamento codificata nella sequenza aminoacidica diventa disponibile in maniera vettoriale la struttura tridimensionale può essere ottenuta solo per Un intero
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido
 Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
DNA - RNA. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi.
 DNA - RNA Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Esistono 4 basi azotate per il DNA e 4 per RNA Differenze
DNA - RNA Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Esistono 4 basi azotate per il DNA e 4 per RNA Differenze
PROGRAMMA DI BIOLOGIA. CLASSE 2^ F a. s. 2014 2015. Prof.ssa RUBINO ALESSANDRA
 ISTITUTO TECNICO INDUSTRIALE DI STATO "ENRICO FERMI" Via Luosi n. 23-41124 Modena Tel. 059211092 059236398 - (Fax): 059226478 E-mail: info@fermi.mo.it Pagina web: www.fermi.mo.it PROGRAMMA DI BIOLOGIA
ISTITUTO TECNICO INDUSTRIALE DI STATO "ENRICO FERMI" Via Luosi n. 23-41124 Modena Tel. 059211092 059236398 - (Fax): 059226478 E-mail: info@fermi.mo.it Pagina web: www.fermi.mo.it PROGRAMMA DI BIOLOGIA
Acido oleico (C18): (nero: carbonio, bianco: idrogeno, rosso: ossigeno), al centro il doppio legame.
 1 ACIDI GRASSI Gli acidi grassi sono acidi carbossilici con una catena alifatica (idrocarburica) con almeno 8 atomi di carbonio. Sono gli ingredienti costitutivi di quasi tutti i lipidi complessi e dei
1 ACIDI GRASSI Gli acidi grassi sono acidi carbossilici con una catena alifatica (idrocarburica) con almeno 8 atomi di carbonio. Sono gli ingredienti costitutivi di quasi tutti i lipidi complessi e dei
Digestione delle proteine: 6 fasi
 orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
INTRODUZIONE ALLA PROTEINE BCP 1-2
 INTRODUZIONE ALLA BIOCHIMICA DELLE PROTEINE BCP 1-2 Pietre miliari Lehninger 1973 Biochemistry Proteine ricombinanti Protein engineering Cristallografia, NMR, EM, MS, spettroscopie... Computing Bioinformaticai
INTRODUZIONE ALLA BIOCHIMICA DELLE PROTEINE BCP 1-2 Pietre miliari Lehninger 1973 Biochemistry Proteine ricombinanti Protein engineering Cristallografia, NMR, EM, MS, spettroscopie... Computing Bioinformaticai
Modello del collasso idrofobico. Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60
 Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
- lipidi strutturali, costituenti fondamentali delle membrane cellulari ed intracellulari (fosfolipidi, glicolipidi e colesterolo)
 I lipidi, o grassi, costituiscono un gruppo eterogeneo di sostanze accomunate dalla proprietà fisica della insolubilità nei solventi polari (es. acqua) (idrofobicità) e dalla solubilità nei soventi organici
I lipidi, o grassi, costituiscono un gruppo eterogeneo di sostanze accomunate dalla proprietà fisica della insolubilità nei solventi polari (es. acqua) (idrofobicità) e dalla solubilità nei soventi organici
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE
 MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
Gerarchia della struttura delle proteine
 Si indica con CONFORMAZIONE la disposizione tridimensionale degli atomi di una molecola, cioè la loro organizzazione spaziale. Gerarchia della struttura delle proteine struttura primaria: sequenza degli
Si indica con CONFORMAZIONE la disposizione tridimensionale degli atomi di una molecola, cioè la loro organizzazione spaziale. Gerarchia della struttura delle proteine struttura primaria: sequenza degli
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
che è caratteristico degli alcoli (es CH 3 -CH 2 -OH etanolo) gruppo carbonilico che si trova in composti detti chetoni;
 LE BIOMOLECOLE 1. IL CARBONIO E I SUOI COMPOSTI Il carbonio è l'elemento base del mondo vivente. Ciò si deve alla sua particolare capacità di formare 4 legami covalenti, in genere molto forti, o con altri
LE BIOMOLECOLE 1. IL CARBONIO E I SUOI COMPOSTI Il carbonio è l'elemento base del mondo vivente. Ciò si deve alla sua particolare capacità di formare 4 legami covalenti, in genere molto forti, o con altri
CAP. 3 Molecole organiche degli organismi: carboidrati, lipidi, amminoacidi, proteine, acidi nucleici.
 CAP. 3 Molecole organiche degli organismi: carboidrati, lipidi, amminoacidi, proteine, acidi nucleici. 3.1 Molecole organiche degli organismi 3.1.1 I carboidrati CARBOIDRATI: comprendono zuccheri semplici
CAP. 3 Molecole organiche degli organismi: carboidrati, lipidi, amminoacidi, proteine, acidi nucleici. 3.1 Molecole organiche degli organismi 3.1.1 I carboidrati CARBOIDRATI: comprendono zuccheri semplici
Indice. Dalla sequenza alla struttura. 1.0 Visione d insieme: funzione e architettura delle proteine 2. 1.1 Gli amminoacidi 4
 Indice Prefazione XIII Protein Data Bank: una nota degli autori XIV Nota all edizione italiana XV Ringraziamenti XVI CAPITOLO 1 Dalla sequenza alla struttura 1.0 Visione d insieme: funzione e architettura
Indice Prefazione XIII Protein Data Bank: una nota degli autori XIV Nota all edizione italiana XV Ringraziamenti XVI CAPITOLO 1 Dalla sequenza alla struttura 1.0 Visione d insieme: funzione e architettura
Le Ig sono glicoproteine costituite da 4 catene polipeptidiche:
 Struttura delle Ig Le Ig sono glicoproteine costituite da 4 catene polipeptidiche: 2 catene pesanti H (heavy( heavy) di P.M. 50.000 D, formate da c/a 450 amminoacidi 2 catene leggere L (light) Di P.M.
Struttura delle Ig Le Ig sono glicoproteine costituite da 4 catene polipeptidiche: 2 catene pesanti H (heavy( heavy) di P.M. 50.000 D, formate da c/a 450 amminoacidi 2 catene leggere L (light) Di P.M.
proteasi (distrugge le proteine) batteri virulenti del ceppo S e del ceppo R
 unità 1. La funzione del DN negli organismi La funzione del DN L acido desossiribonucleico o DN (dall inglese deoxyribonucleic acid) è la molecola informazionale delle cellule. Essa contiene e trasmette
unità 1. La funzione del DN negli organismi La funzione del DN L acido desossiribonucleico o DN (dall inglese deoxyribonucleic acid) è la molecola informazionale delle cellule. Essa contiene e trasmette
PROCESSI DI ADESIONE ED ACCRESCIMENTO DEI TESSUTI: BIOMOLECOLE DI INTERESSE APPLICATIVO
 Interazione tra Biomateriali e Tessuti Anno Accademico 2004/2005 PROCESSI DI ADESIONE ED ACCRESCIMENTO DEI TESSUTI: BIOMOLECOLE DI INTERESSE APPLICATIVO Premessa Negli ultimi 20 anni, indagini in campo
Interazione tra Biomateriali e Tessuti Anno Accademico 2004/2005 PROCESSI DI ADESIONE ED ACCRESCIMENTO DEI TESSUTI: BIOMOLECOLE DI INTERESSE APPLICATIVO Premessa Negli ultimi 20 anni, indagini in campo
SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA)
 SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA) ORGANIZZAZIONE TERZIARIA DEL DNA Il DNA cellulare contiene porzioni geniche e intergeniche, entrambe necessarie per le funzioni vitali della
SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA) ORGANIZZAZIONE TERZIARIA DEL DNA Il DNA cellulare contiene porzioni geniche e intergeniche, entrambe necessarie per le funzioni vitali della
Traduzione dell informazione genetica (1)
 Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
strutture di Proteine
 Laboratorio di Bioinformatica I Database di strutture di Proteine Dott. Sergio Marin Vargas (2014 / 2015) Dal gene alla proteina La funzione della proteina è nella sua struttura 3D. Struttura delle proteine
Laboratorio di Bioinformatica I Database di strutture di Proteine Dott. Sergio Marin Vargas (2014 / 2015) Dal gene alla proteina La funzione della proteina è nella sua struttura 3D. Struttura delle proteine
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Analisi Molecolare di sequenze di acidi nucleici
 Analisi Molecolare di sequenze di acidi nucleici 1. L Analisi di restrizione di frammenti o RFLP (Restriction Fragment Lenght Polymorphism) di DNA comporta lo studio delle dimensioni dei frammenti di DNA
Analisi Molecolare di sequenze di acidi nucleici 1. L Analisi di restrizione di frammenti o RFLP (Restriction Fragment Lenght Polymorphism) di DNA comporta lo studio delle dimensioni dei frammenti di DNA
MATERIALI CERAMICI Classificazione e caratteristiche generali
 MATERIALI CERAMICI Classificazione e caratteristiche generali I materiali ceramici sono materiali inorganici non metallici, costituiti da elementi metallici e non metalici legati fra loro prevalentemente
MATERIALI CERAMICI Classificazione e caratteristiche generali I materiali ceramici sono materiali inorganici non metallici, costituiti da elementi metallici e non metalici legati fra loro prevalentemente
dominio strutturale dominio modulo
 Riepilogo 2^lezione DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali
Riepilogo 2^lezione DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali
LA TRADUZIONE E IL CODICE GENETICO
 LA TRADUZIONE E IL CODICE GENETICO La traduzione La traduzione è il processo di sintesi di una catena polipeptidica, un polimero costituito da amminoacidi legati insieme da legami peptidici Le molecole
LA TRADUZIONE E IL CODICE GENETICO La traduzione La traduzione è il processo di sintesi di una catena polipeptidica, un polimero costituito da amminoacidi legati insieme da legami peptidici Le molecole
Marinella Bosetto Irene Lozzi. Elementi di biochimica agraria
 A07 25 Marinella Bosetto Irene Lozzi Elementi di biochimica agraria Copyright MMVI ARACNE editrice S.r.l. www.aracneeditrice.it info@aracneeditrice.it via Raffaele Garofalo, 133 A/B 00173 Roma (06) 93781065
A07 25 Marinella Bosetto Irene Lozzi Elementi di biochimica agraria Copyright MMVI ARACNE editrice S.r.l. www.aracneeditrice.it info@aracneeditrice.it via Raffaele Garofalo, 133 A/B 00173 Roma (06) 93781065
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
Never impure protein PURIFICAZIONE DI PROTEINE
 Never waste pure thoughts on an impure protein PURIFICAZIONE DI PROTEINE PURIFICARE Purificare significa ottenere solamente la nostra molecola di interesse. Purificare una proteina per: Determinarne la
Never waste pure thoughts on an impure protein PURIFICAZIONE DI PROTEINE PURIFICARE Purificare significa ottenere solamente la nostra molecola di interesse. Purificare una proteina per: Determinarne la
