Fondamenti di chimica generale e inorganica
|
|
|
- Amando Carnevale
- 5 anni fa
- Visualizzazioni
Transcript
1
2 Luca Longo Fondamenti di chimica generale e inorganica ovvero: tutto quello che avreste voluto sapere sulla chimica e che non avete mai osato chiedere. Pp esercizi Prima edizione: aprile 2001 Ultima revisione: giugno 2008
3 ai giganti sulle cui spalle abbiamo costruito il nostro mondo ed a quelli che verranno La parola è un'ombra dell'azione. [Democrito]
4 Sommario Sommario 1 Teoria atomica e leggi quantitative 1.1 La struttura della materia: atomi ed elementi 1.2 Simbologia chimica 1.3 Coefficienti stechiometrici e bilanciamento 1.4 Le prime leggi della chimica Legge della conservazione della massa di Lavoisier (1789) Legge delle proporzioni definite e costanti (Proust 1799) Legge delle proporzioni multiple (Dalton 1803) Legge dei rapporti volumetrici gassosi definiti e costanti (Gay Lussac 1808) 1.5 Pesi atomici e molecolari relativi: l unità di massa atomica 1.6 Nuclidi: numero atomico Z e numero di massa A 1.7 La mole ed il Peso molare 1.8 Il numero di Avogadro 1.9 Calcolo delle quantità che reagiscono 1.10 Composizione percentuale e formula di un composto 1.11 Esercizi Bilanciamento Pesi (masse) relativi ed assoluti Mole, Peso molare e numero di Avogadro Elementi, Nuclidi (isotopi, isobari, isotoni) e Ioni Rapporti stechiometrici numerici e ponderali Quantità che reagiscono e reagente limitante Conversione composizione percentuale/formula Test di riepilogo 2 Modelli atomici classici 2.1 La struttura interna dell atomo 2.2 I modelli atomici di Thomson e Rutherford 3 La radiazione elettromagnetica 3.1 Modello ondulatorio e corpuscolare a confronto 3.2 Le onde elettromagnetiche 3.3 I parametri di un onda e lo spettro elettromagnetico 3.4 Spettri di emissione e di assorbimento 3.5 I quanti di radiazione: fotoni 4 Modelli atomici quantistici semiclassici 4.1 Il modello atomico di Bohr 4.2 Conferme sperimentali del modello di Bohr 4.3 Il modello di Bohr-Sommerfeld: numero quantico secondario l 4.4 Il numero quantico magnetico m 4.5 Numero quantico di spin e principio di esclusione di Pauli 5 Modelli atomici quanto-meccanici 5.1 La natura ondulatoria della materia: De Broglie 5.2 Natura ondulatoria della materia: interpretazione probabilistica 5.3 La meccanica ondulatoria di Schroedinger 5.4 La meccanica matriciale di Heisenberg Il principio di indeterminazione di Heisenberg Principio di indeterminazione e natura ondulatoria della materia
5 6 Meccanica quantistica: interpretazioni 6.1 Il MICROSCOPIO di Heisenberg 6.2 Principio di complementarietà e interpretazione di Copenaghen 6.3 La probabilità quantistica 6.4 L'effetto tunnel 6.5 Il principio di causalità locale e l'esperimento EPR 6.6 La disuguaglianza di Bell 6.7 L'equazione relativistica di Dirac 6.8 Conclusioni 7 STRUTTURA ATOMICA E CARATTERISTICHE CHIMICHE 7.1 Il riempimento degli orbitali Principio di minima energia Principio di esclusione di Pauli Principio di massima molteplicità di Hund 7.2 Analisi della configurazione elettronica nella tabella periodica 7.3 Metalli e non metalli 7.4 Energia di prima ionizzazione 7.5 Affinità elettronica 7.6 Altre informazioni utili nella tabella periodica 8 I legami chimici 8.1 Configurazione di Lewis 8.2 Il legame covalente puro o omopolare 8.3 Legame covalente polare e elettronegatività 8.4 Elettronegatività 8.5 Legame ionico 8.6 Legame dativo o di coordinazione 8.7 Promozione ed ibridazione 8.8 Risonanza o mesomeria Risonanza e delocalizzazione degli elettroni 8.9 La geometria delle molecole: teoria VSEPR e orbitali ibridi 8.10 Legame metallico 8.11 Legami intermolecolari e forze di Van der Waals Interazione dipolo-dipolo Legame idrogeno (ponte idrogeno) Interazioni tra molecole apolari: la forza di London 9 COSTRUZIONE DEI COMPOSTI E NOMENCLATURA CHIMICA 9.1 Numero di ossidazione (nox) o stato di ossidazione (stox) 9.2 Regole per la costruzione dei composti binari 9.3 Principali composti binari Idruri Perossidi Ossidi Idracidi 9.4 COMPOSTI TERNARI: OSSIACIDI ED IDROSSIDI ACIDI IDROSSIDI 9.5 I SALI PROCESSI DI SALIFICAZIONE Dissociazione dei Sali Sali idratati Sali doppi Sali complessi
6 9.6 Composti complessi e agenti complessati Nomenclatura dei complessi 10 STECHIOMETRIA 10.1 Bilanciamento delle reazioni chimiche 10.2 Strategia di bilanciamento delle reazioni redox 10.3 Rapporti ponderali: calcolo delle quantità che reagiscono 11 STATO GASSOSO 11.1 LE LEGGI DEI GAS Legge di Boyle Legge di Charles o 1 a legge di Gay-Lussac a legge di Gay-Lussac Equazione di stato dei gas perfetti 11.2 CENNI DI TEORIA CINETICA DEI GAS Distribuzione delle velocità - Maxwelliana 11.3 Legge di Graham 11.4 Legge di Dalton o delle pressioni parziali 11.5 Temperatura critica 12 Stato liquido 12.1 Diffusione ed entropia 12.2 Evaporazione e tensione di vapore 12.3 Ebollizione 12.4 Diagramma di stato 13 SOLUZIONI 13.1 Concentrazione di una soluzione 13.2 Solubilità 13.3 Elettroliti, non-elettroliti e grado di dissociazione 13.4 Osmosi e Pressione osmotica 13.5 Legge di Raoult 13.6 Innalzamento ebullioscopico ed abbassamento crioscopico 13.7 Proprietà colligative 14 CINETICA CHIMICA 14.1 Velocità di reazione 14.2 Costante di velocità specifica ed equazione di Arrhenius Altri fattori che influenzano la velocità di una reazione 15 EQUILIBRIO CHIMICO 15.1 Legge di azione di massa (legge di Gulberg-Waage) 15.2 Equilibri chimici omogenei ed eterogenei 15.3 Modificazioni di un equilibrio chimico: il principio di Le Chatelier 16 EQUILIBRI DI DISSOCIAZIONE 16.1 Il prodotto ionico dell acqua 16.2 ph e poh 16.3 CALCOLO DEL ph Calcolo ph per acidi e basi forti ph in soluzioni molto diluite di acidi (e basi) forti ph in soluzioni di Acidi (e basi) deboli: k a e k b Metodo semplificato per il calcolo del ph di acidi (o basi deboli) ph in soluzioni di Acidi (e basi) deboli poliprotici 16.4 Indicatori di ph 16.5 IDROLISI SALINA ed EQUILIBRIO DI IDROLISI Idrolisi basica Idrolisi acida Idrolisi neutra
7 Idrolisi di un sale derivante da un acido debole e da una base debole 16.6 Titolazione Acido-base 16.7 Soluzioni tampone 16.8 Elettroliti anfoteri in soluzione 16.9 Equilibri di solubilità e prodotto di solubilità k ps Effetto dello ione comune 17 ELETTROCHIMICA 17.1 Celle galvaniche o pile Potenziale di elettrodo Equazione di Nernst Relazione tra k c e f.e.m. ( E ) Lavoro eseguito da una pila 17.2 Elettrolisi e celle elettrolitiche Elettrolisi di una soluzione contenente più ioni (precedenza di scarica) Le leggi di Faraday Equivalente elettrochimico Fenomeni elettrochimici di interesse pratico 18 Elementi di termodinamica chimica 18.1 I sistemi termodinamici 18.2 Energia interna (E) Variazioni dell'energia interna E di un sistema chimico 18.3 Entalpia (H) e termochimica Legge di Lavoisier-Laplace (1780) Legge di Hess (1840) 18.4 Entropia (S), Energia libera (G) e criteri di spontaneità 18.5 Previsioni sulla spontaneità di una reazione 18.6 Energia libera e sistemi all'equilibrio 18.7 Relazione tra G e E 18.8 Calcolo approssimato della costante di equilibrio K per temperature diverse da 25 C Note alla consultazione in formato digitale 1) I capitoli sono divisi in sezioni. Per andare all argomento desiderato [Ctrl + click] o semplicemente cliccare (a seconda della versione di Word posseduta) sul titolo dell argomento nel Sommario) 2) Per stampare un intervallo di pagine è necessario specificare anche il numero della sezione, ad esempio per stampare dalla pagina 3 alla pagina 8 della sezione 11 inserire p3s11-p8s11)
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Indice generale. Prefazione
 26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO: CHIMICA, MATERIALI E BIOTECNOLOGIE
 RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA. L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
 COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
PIANO DI LAVORO ANNUALE
 Docenti Materia Classi Alessandra Cattaneo Erminia Palma Scienze Integrate (Chimica) biennio PIANO DI LAVORO ANNUALE 1. Finalità Promuovere negli allievi lo sviluppo e il perfezionamento delle capacità
Docenti Materia Classi Alessandra Cattaneo Erminia Palma Scienze Integrate (Chimica) biennio PIANO DI LAVORO ANNUALE 1. Finalità Promuovere negli allievi lo sviluppo e il perfezionamento delle capacità
Programmazione di CHIMICA ANALITICA E STRUMENTALE. Classe: 4 a A CHIMICI
 R E P U B B L I C A I T A L I A N A I.T.I. MINERARIO G. ASPRONI - IGLESIAS A.S. 2014-2015 Programmazione di CHIMICA ANALITICA E STRUMENTALE Classe: 4 a A CHIMICI INSEGNANTE TEORICO Silvia Chinedda INSEGNANTE
R E P U B B L I C A I T A L I A N A I.T.I. MINERARIO G. ASPRONI - IGLESIAS A.S. 2014-2015 Programmazione di CHIMICA ANALITICA E STRUMENTALE Classe: 4 a A CHIMICI INSEGNANTE TEORICO Silvia Chinedda INSEGNANTE
Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Programmazione di Scienze A.S. 2013-2014
 Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Le trasformazioni fisiche della materia Gli stati fisici della materia I sistemi omogenei ed eterogenei Le sostanze pure ed i miscugli
Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Le trasformazioni fisiche della materia Gli stati fisici della materia I sistemi omogenei ed eterogenei Le sostanze pure ed i miscugli
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016. CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO
 ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE Elaborata conformemente alle linee
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE Elaborata conformemente alle linee
Istituto di Istruzione Superiore L. da Vinci Civitanova Marche. Anno scolastico 2014-2015. Programma svolto. Docente: Silvana Venditti
 Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
indice breve 1 Chimica, la scienza centrale 2 Appendici
 indice breve 1 Chimica, la scienza centrale 2 2 Atomi, Molecole e Ioni 32 3 Stechiometria: Rapporti di combinazione 72 4 Reazioni in soluzioni acquose 110 5 Termochimica 158 6 Teoria quantistica e struttura
indice breve 1 Chimica, la scienza centrale 2 2 Atomi, Molecole e Ioni 32 3 Stechiometria: Rapporti di combinazione 72 4 Reazioni in soluzioni acquose 110 5 Termochimica 158 6 Teoria quantistica e struttura
ISTITUTO TECNICO INDUSTRIALE STATALE. B.Pascal Roma
 Ministero dell Istruzione, dell Università e della Ricerca ISTITUTO TECNICO INDUSTRIALE STATALE B.Pascal Roma Anno Scolastico 2012-201 PIANO DI LAVORO DELLE CLASSI PRIME MATERIA: Scienze Integrate CHIMICA
Ministero dell Istruzione, dell Università e della Ricerca ISTITUTO TECNICO INDUSTRIALE STATALE B.Pascal Roma Anno Scolastico 2012-201 PIANO DI LAVORO DELLE CLASSI PRIME MATERIA: Scienze Integrate CHIMICA
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013
 LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
PROGRAMMA DI SCIENZE NATURALI CLASSE 1 a SEZ. A. Prof.ssa Maria Luisa Smorto
 PROGRAMMA DI SCIENZE NATURALI CLASSE 1 a SEZ. A A.S. 2014/2015 Prof.ssa Maria Luisa Smorto Conoscenze chimiche e fisiche di base per le Scienze della Terra - Le unità di misura nel Sistema Internazionale
PROGRAMMA DI SCIENZE NATURALI CLASSE 1 a SEZ. A A.S. 2014/2015 Prof.ssa Maria Luisa Smorto Conoscenze chimiche e fisiche di base per le Scienze della Terra - Le unità di misura nel Sistema Internazionale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI
 TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
DIPARTIMENTO DI SCIENZE INTEGRATE CHIMICA FISICA SCIENZE DELLA TERRA - BIOLOGIA
 IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
Programma (piano di lavoro) preventivo
 I S T I T U T O T E C N I C O I N D U S T R I A L E S T A T A L E G u g l i e l m o M a r c o n i V e r o n a Programma (piano di lavoro) preventivo Anno Scolastico 2014/2015 Materia SCIENZE INTEGRATE:
I S T I T U T O T E C N I C O I N D U S T R I A L E S T A T A L E G u g l i e l m o M a r c o n i V e r o n a Programma (piano di lavoro) preventivo Anno Scolastico 2014/2015 Materia SCIENZE INTEGRATE:
Programma Didattico Annuale
 LICEO SCIENTIFICO STATALE GALILEO GALILEI PdQ - 7.06 Ediz.: 1 Rev.: 0 Data 02/09/05 Alleg.: D01 PROG. M2 PROCEDURA della QUALITA' Programma Didattico Annuale Anno Scolastico 2011/2012 MATERIA : Scienze
LICEO SCIENTIFICO STATALE GALILEO GALILEI PdQ - 7.06 Ediz.: 1 Rev.: 0 Data 02/09/05 Alleg.: D01 PROG. M2 PROCEDURA della QUALITA' Programma Didattico Annuale Anno Scolastico 2011/2012 MATERIA : Scienze
Università degli Studi di Pavia Facoltà di Medicina e Chirurgia
 Università degli Studi di Pavia Facoltà di Medicina e Chirurgia CORSO DI LAUREA TRIENNALE CLASSE DELLLE LAUREE DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE CLASSE 2 Corso Integrato di Fisica, Statistica,
Università degli Studi di Pavia Facoltà di Medicina e Chirurgia CORSO DI LAUREA TRIENNALE CLASSE DELLLE LAUREE DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE CLASSE 2 Corso Integrato di Fisica, Statistica,
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
Programmi relativi ai quesiti delle prove di ammissione ai corsi di. Odontoiatria e Protesi Dentaria, in Medicina Veterinaria e ai corsi di
 Programmi relativi ai quesiti delle prove di ammissione ai corsi di Odontoiatria e Protesi Dentaria, in Medicina Veterinaria e ai corsi di laurea delle professioni sanitarie Per l ammissione ai corsi è
Programmi relativi ai quesiti delle prove di ammissione ai corsi di Odontoiatria e Protesi Dentaria, in Medicina Veterinaria e ai corsi di laurea delle professioni sanitarie Per l ammissione ai corsi è
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM
 Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM Docente : Macaluso Maria Annunziata Classe : 2^ sez.a B - C Indirizzo AM Materia di insegnamento : Scienze Integrate (CHIMICA) Libro di testo
Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM Docente : Macaluso Maria Annunziata Classe : 2^ sez.a B - C Indirizzo AM Materia di insegnamento : Scienze Integrate (CHIMICA) Libro di testo
Progettazione disciplinare:
 PIANO DI LAVORO ANNUALE-PROGETTAZIONE INDIVIDUALE PER SINGOLA DISCIPLINA E PER CLASSE Classe 1A A.S. 2015/2016 Disciplina: CHIMICA Docente: Rosselli Antonino Ore settimanali: 3 (1 di laboratorio) Libro
PIANO DI LAVORO ANNUALE-PROGETTAZIONE INDIVIDUALE PER SINGOLA DISCIPLINA E PER CLASSE Classe 1A A.S. 2015/2016 Disciplina: CHIMICA Docente: Rosselli Antonino Ore settimanali: 3 (1 di laboratorio) Libro
STATO LIQUIDO. Si definisce tensione superficiale (γ) il lavoro che bisogna fare per aumentare di 1 cm 2 la superficie del liquido.
 STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. Anodo = Polo Positivo Anione = Ione Negativo. Catodo = Polo Negativo Catione = Ione Positivo
 1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
PROGRAMMAZIONE DI MATERIA
 MATERIA PROGRAMMAZIONE DI MATERIA SINTESI CLASSI QUARTE LICEO LINGUISTICO E DELLE UMANE COMPETENZE ATTESE AL TERMINE DEL PERCORSO DI STUDIO DELLA DISCIPLINA 1 sapere effettuare connessioni logiche, riconoscere
MATERIA PROGRAMMAZIONE DI MATERIA SINTESI CLASSI QUARTE LICEO LINGUISTICO E DELLE UMANE COMPETENZE ATTESE AL TERMINE DEL PERCORSO DI STUDIO DELLA DISCIPLINA 1 sapere effettuare connessioni logiche, riconoscere
LICEO SCIENTIFICO G. BRUNO A.S. 2011/2012
 PROGRAMMA DI LABORATORIO DI CHIMICA SVOLTO NELLA CLASSE 1^ C Di seguito vengono elencate le attività teoriche e pratiche effettuate durante l anno scolastico: chimica. Lettura integrale delle norme di
PROGRAMMA DI LABORATORIO DI CHIMICA SVOLTO NELLA CLASSE 1^ C Di seguito vengono elencate le attività teoriche e pratiche effettuate durante l anno scolastico: chimica. Lettura integrale delle norme di
1.11.3 Distribuzione di carica piana ed uniforme... 32
 Indice 1 Campo elettrico nel vuoto 1 1.1 Forza elettromagnetica............ 2 1.2 Carica elettrica................ 3 1.3 Fenomeni elettrostatici............ 6 1.4 Legge di Coulomb.............. 9 1.5 Campo
Indice 1 Campo elettrico nel vuoto 1 1.1 Forza elettromagnetica............ 2 1.2 Carica elettrica................ 3 1.3 Fenomeni elettrostatici............ 6 1.4 Legge di Coulomb.............. 9 1.5 Campo
TEORIA QUANTISTICA E STRUTTURA ATOMICA
 TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
Programmazione individuale per competenze CLASSE 3^B LSA. Materia: CHIMICA
 Programmazione individuale per competenze CLASSE 3^B LSA Materia: CHIMICA Situazione della classe Accordi con la classe Accordi con le altre discipline Correlazione con i progetti proposti alla classe
Programmazione individuale per competenze CLASSE 3^B LSA Materia: CHIMICA Situazione della classe Accordi con la classe Accordi con le altre discipline Correlazione con i progetti proposti alla classe
LA MOLE LA MOLE 2.A PRE-REQUISITI 2.3 FORMULE E COMPOSIZIONE 2.B PRE-TEST
 LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
PROGRAMMAZIONE DIDATTICA ANNUALE
 PROGRAMMAZIONE DIDATTICA ANNUALE Anno Scolastico: 2013 / 2014 Dipartimento (1) : Scienze - Chimica Coordinatore (1) : Classe: Prof. Giovanni MIRAGLIOTTA 2^B.G, Q Indirizzo: Economico aziendale; servizi
PROGRAMMAZIONE DIDATTICA ANNUALE Anno Scolastico: 2013 / 2014 Dipartimento (1) : Scienze - Chimica Coordinatore (1) : Classe: Prof. Giovanni MIRAGLIOTTA 2^B.G, Q Indirizzo: Economico aziendale; servizi
ISTITUTO SALESIANO DON BOSCO Villa Ranchibile. LICEO SCIENTIFICO Anno scolastico 2015/2016 PROGRAMMA DI SCIENZE Svolto nella classe II a sez.
 ISTITUTO SALESIANO DON BOSCO Villa Ranchibile Via Libertà, 199 90143 PALERMO LICEO SCIENTIFICO Anno scolastico 2015/2016 PROGRAMMA DI SCIENZE Svolto nella classe II a sez. A Docente: Prof. Rosario Papa
ISTITUTO SALESIANO DON BOSCO Villa Ranchibile Via Libertà, 199 90143 PALERMO LICEO SCIENTIFICO Anno scolastico 2015/2016 PROGRAMMA DI SCIENZE Svolto nella classe II a sez. A Docente: Prof. Rosario Papa
Programmazione individuale di Laboratorio Materia : Chimica e Laboratorio. Docenti : Giancarlo Cardone Classe : 2 CAT a.s.
 Programmazione individuale di Laboratorio Materia : Chimica e Laboratorio. Docenti : Giancarlo Cardone Classe : 2 CAT a.s. 2015-2016 Mondovi 05/11/2015 Prof. Giancarlo Cardone PROGRAMMAZIONE DELL ATTIVITA
Programmazione individuale di Laboratorio Materia : Chimica e Laboratorio. Docenti : Giancarlo Cardone Classe : 2 CAT a.s. 2015-2016 Mondovi 05/11/2015 Prof. Giancarlo Cardone PROGRAMMAZIONE DELL ATTIVITA
Indice. Nota del autore... III
 Nota del autore... III Capitolo 1 Introduzione al metodo scientifico... 1 1.1 Le scienze naturali e la fisica... 1 1.2 Metodo scientifico... 2 1.3 Il tacchino (induttivista) di Russel... 3 1.4 Sul significato
Nota del autore... III Capitolo 1 Introduzione al metodo scientifico... 1 1.1 Le scienze naturali e la fisica... 1 1.2 Metodo scientifico... 2 1.3 Il tacchino (induttivista) di Russel... 3 1.4 Sul significato
FONDAZIONE MALAVASI. Scuola secondaria di 2 grado A. MANZONI
 FONDAZIONE MALAVASI Scuola secondaria di 2 grado A. MANZONI PIANO DI LAVORO E PROGRAMMAZIONE DIDATTICA DISCIPLINA: Scienze Naturali DOCENTE: Lucia Roncaglia CLASSE I CLASSICO A.S.2015 /2016 1. OBIETTIVI
FONDAZIONE MALAVASI Scuola secondaria di 2 grado A. MANZONI PIANO DI LAVORO E PROGRAMMAZIONE DIDATTICA DISCIPLINA: Scienze Naturali DOCENTE: Lucia Roncaglia CLASSE I CLASSICO A.S.2015 /2016 1. OBIETTIVI
Catalogo d esame per la maturità di stato anno scolastico 2009/2010. Chimica
 Catalogo d esame per la maturità di stato anno scolastico 2009/2010 Chimica Membri della commissione tecnica per la realizzazione del materiale d esame di chimica: dr. sc. Nenad Judaš, Facoltà di Scienze
Catalogo d esame per la maturità di stato anno scolastico 2009/2010 Chimica Membri della commissione tecnica per la realizzazione del materiale d esame di chimica: dr. sc. Nenad Judaš, Facoltà di Scienze
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Il metodo scientifico
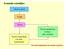 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Nota dell editore Presentazione
 00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
PROGRAMMA DI SCIENZE. Argomenti svolti anno scolastico 2014\1 5. Docente: Gennaro Sollo Classe: I sez.: Au
 Argomenti svolti anno scolastico 2014\1 5 Docente: Gennaro Sollo Classe: I sez.: Au ASTRONOMIA: Nascita dell Universo Galassie Sistema solare Teoria geocentrica ed eliocentrica Leggi di Keplero Legge di
Argomenti svolti anno scolastico 2014\1 5 Docente: Gennaro Sollo Classe: I sez.: Au ASTRONOMIA: Nascita dell Universo Galassie Sistema solare Teoria geocentrica ed eliocentrica Leggi di Keplero Legge di
Giochi della Chimica 2007 Fase nazionale Classi A e B
 Giochi della Chimica 2007 Fase nazionale Classi A e B 1. Una soluzione è sicuramente satura quando é: A) in equilibrio dinamico con il soluto indisciolto B) in equilibrio statico con il soluto indisciolto
Giochi della Chimica 2007 Fase nazionale Classi A e B 1. Una soluzione è sicuramente satura quando é: A) in equilibrio dinamico con il soluto indisciolto B) in equilibrio statico con il soluto indisciolto
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente
 Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà. I liquidi e loro proprietà
 2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
Gruppo 10 Nickel Ni (1751)
 Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Liquidi, Solidi e Forze Intermolecolari
 Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 3 Le proprietà fisiche dell acqua Concetti chiave: Le molecole d'acqua, che sono polari, possono formare legami idrogeno
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 3 Le proprietà fisiche dell acqua Concetti chiave: Le molecole d'acqua, che sono polari, possono formare legami idrogeno
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016
 ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 Classe II^ D COSTRUZIONI AMBIENTE E TERRITORIO Disciplina : SCIENZE INTEGRATE CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 Classe II^ D COSTRUZIONI AMBIENTE E TERRITORIO Disciplina : SCIENZE INTEGRATE CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE
CHIMICA GENERALE E PROPEDEUTICA BIOCHIMICA
 1 CHIMICA GENERALE E PROPEDEUTICA BIOCHIMICA CHIMICA GENERALE Materia La materia può avere: - Proprietà fisiche: se studiate non comportano trasformazione della materia (es.: temperatura di ebollizione,
1 CHIMICA GENERALE E PROPEDEUTICA BIOCHIMICA CHIMICA GENERALE Materia La materia può avere: - Proprietà fisiche: se studiate non comportano trasformazione della materia (es.: temperatura di ebollizione,
FONDAZIONE MALAVASI ISTITUTO TECNICO DEI TRASPORTI E DELLA LOGISTICA
 FONDAZIONE MALAVASI ISTITUTO TECNICO DEI TRASPORTI E DELLA LOGISTICA PIANO DI LAVORO E PROGRAMMAZIONE DIDATTICA DISCIPLINA: SCIENZE INTEGRATE (CHIMICA) DOCENTE: Luca Grillini CLASSE II SEZ.A A.S.2014/2015
FONDAZIONE MALAVASI ISTITUTO TECNICO DEI TRASPORTI E DELLA LOGISTICA PIANO DI LAVORO E PROGRAMMAZIONE DIDATTICA DISCIPLINA: SCIENZE INTEGRATE (CHIMICA) DOCENTE: Luca Grillini CLASSE II SEZ.A A.S.2014/2015
... corso di chimica elettrochimica 1
 ... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
Giochi della Chimica 2007 Fase regionale Classi A e B
 Giochi della Chimica 2007 Fase regionale Classi A e B 1. Indicare, tra i seguenti ioni isoelettronici: K +, Ca 2+, Cl, S 2 quello che ha raggio maggiore: A) K + B) Ca 2+ C) Cl D) S 2 2. Indicare, tra i
Giochi della Chimica 2007 Fase regionale Classi A e B 1. Indicare, tra i seguenti ioni isoelettronici: K +, Ca 2+, Cl, S 2 quello che ha raggio maggiore: A) K + B) Ca 2+ C) Cl D) S 2 2. Indicare, tra i
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Indice PREFAZIONE. Capitolo 5 LE LEGGI DEL MOTO DI NEWTON 58 5.1 La terza legge di Newton 58
 Indice PREFAZIONE XV Capitolo 1 RICHIAMI DI MATEMATICA 1 1.1 Simboli, notazione scientifica e cifre significative 1 1.2 Algebra 3 1.3 Geometria e trigonometria 5 1.4 Vettori 7 1.5 Sviluppi in serie e approssimazioni
Indice PREFAZIONE XV Capitolo 1 RICHIAMI DI MATEMATICA 1 1.1 Simboli, notazione scientifica e cifre significative 1 1.2 Algebra 3 1.3 Geometria e trigonometria 5 1.4 Vettori 7 1.5 Sviluppi in serie e approssimazioni
Stati di aggregazione della materia
 SOLIDO: Forma e volume propri. Stati di aggregazione della materia LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. GASSOSO: Forma e volume del recipiente in cui è contenuto. Parametri
SOLIDO: Forma e volume propri. Stati di aggregazione della materia LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. GASSOSO: Forma e volume del recipiente in cui è contenuto. Parametri
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
Leggi dei gas. PV = n RT SISTEMI DI PARTICELLE NON INTERAGENTI. perché le forze tra le molecole sono differenti. Gas perfetti o gas ideali
 Perché nelle stesse condizioni di temperatura e pressione sostanze differenti possono trovarsi in stati di aggregazione differenti? perché le forze tra le molecole sono differenti Da che cosa hanno origine
Perché nelle stesse condizioni di temperatura e pressione sostanze differenti possono trovarsi in stati di aggregazione differenti? perché le forze tra le molecole sono differenti Da che cosa hanno origine
Istituto di Istruzione Superiore Minerario Giorgio Asproni Enrico Fermi PROGRAMMAZIONE DIDATTICA ANNUALE DEL DOCENTE
 Istituto di Istruzione Superiore Minerario Giorgio Asproni Enrico Fermi PROGRAMMAZIONE DIDATTICA ANNUALE DEL DOCENTE Anno scolastico 2014\/2015 Classe IV Corso Tecnologie Chimiche DOCENTE: Ritano Riccardo
Istituto di Istruzione Superiore Minerario Giorgio Asproni Enrico Fermi PROGRAMMAZIONE DIDATTICA ANNUALE DEL DOCENTE Anno scolastico 2014\/2015 Classe IV Corso Tecnologie Chimiche DOCENTE: Ritano Riccardo
Energia elettrica. L atomo nel suo complesso è neutro perché ha l equilibrio tra protoni ed elettroni presenti nello stesso numero.
 Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
PROGRAMMA DI SCIENZE Cl. II sez. E A.S. 2014/2015. Testo: S. Passannanti C. Sbriziolo Noi e la chimica Dai fenomeni alle leggi Ed.
 PROGRAMMA DI SCIENZE Cl. II sez. E A.S. 2014/2015 CHIMICA Testo: S. Passannanti C. Sbriziolo Noi e la chimica Dai fenomeni alle leggi Ed. Tramontana S. Passannanti C. Sbriziolo Noi e la chimica agli atomi
PROGRAMMA DI SCIENZE Cl. II sez. E A.S. 2014/2015 CHIMICA Testo: S. Passannanti C. Sbriziolo Noi e la chimica Dai fenomeni alle leggi Ed. Tramontana S. Passannanti C. Sbriziolo Noi e la chimica agli atomi
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Državni izpitni center. Prova d esame 1. Giovedì, 29 agosto 2013 / 90 minuti
 odice del candidato: ržavni izpitni center *M13243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 29 agosto 2013 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
odice del candidato: ržavni izpitni center *M13243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 29 agosto 2013 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
Celle a combustibile Fuel cells (FC)
 Celle a combustibile Fuel cells (FC) Celle a combustibile Sono dispositivi di conversione elettrochimica ad alto rendimento energetico. Esse trasformano in potenza elettrica l energia chimica contenuta
Celle a combustibile Fuel cells (FC) Celle a combustibile Sono dispositivi di conversione elettrochimica ad alto rendimento energetico. Esse trasformano in potenza elettrica l energia chimica contenuta
Gruppo Elettroni più esterni Valenza IV 4 (2+2) 2, 4 V 5 (1+2+2) 1, 3, 5 VI 6 (2 +2+2) 2, 4, 6 VII 7 (1+2+2+2) 1, 3, 5, 7
 REAZINI CHIMICHE E BILANCIAMENT - Prof. Enrico Maria Bruti La Valenza La valenza è il numero di legami che un atomo può formare. La valenza è in stretta relazione con il numero di elettroni presenti nel
REAZINI CHIMICHE E BILANCIAMENT - Prof. Enrico Maria Bruti La Valenza La valenza è il numero di legami che un atomo può formare. La valenza è in stretta relazione con il numero di elettroni presenti nel
Le reazioni di ossidoriduzione
 I.S. G. TASSINARI PROGRAMMAZIONE di CHIMICA ANALITICA E STUMENTALE Classe 4L - A.S. 2015-16 Docenti: prof.ssa Stefania Comes- prof.ssa Anna Alfano ANALISI INIZIALE DELLA CLASSE: La classe risulta composta
I.S. G. TASSINARI PROGRAMMAZIONE di CHIMICA ANALITICA E STUMENTALE Classe 4L - A.S. 2015-16 Docenti: prof.ssa Stefania Comes- prof.ssa Anna Alfano ANALISI INIZIALE DELLA CLASSE: La classe risulta composta
Chimica Kotz, Treichel, Townsend
 Chimica Kotz, Treichel, Townsend SITO DEDICATO integra e completa questo testo con: Filmati e Animazioni Simulazioni e Tutorial per i principali argomenti di ogni capitolo Link utili Tavola periodica interattiva
Chimica Kotz, Treichel, Townsend SITO DEDICATO integra e completa questo testo con: Filmati e Animazioni Simulazioni e Tutorial per i principali argomenti di ogni capitolo Link utili Tavola periodica interattiva
FISICA E LABORATORIO
 Programma di FISICA E LABORATORIO Anno Scolastico 2014-2015 Classe V P indirizzo OTTICO Docente Giuseppe CORSINO Programma di FISICA E LABORATORIO Anno Scolastico 2013-2014 Classe V P indirizzo OTTICO
Programma di FISICA E LABORATORIO Anno Scolastico 2014-2015 Classe V P indirizzo OTTICO Docente Giuseppe CORSINO Programma di FISICA E LABORATORIO Anno Scolastico 2013-2014 Classe V P indirizzo OTTICO
Esercizi di Chimica (2 a prova in itinere)
 Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Argomenti di chimica e scienze della natura
 I.S.I.S Le Filandiere SAN VITO AL TAGLIAMENTO ANNO SCOLASTICO 2015/2016 Piano di lavoro della classe II E (liceo scientifico opzione scienze applicate) Materia: scienze Insegnante: Donatella D'Angela Testi
I.S.I.S Le Filandiere SAN VITO AL TAGLIAMENTO ANNO SCOLASTICO 2015/2016 Piano di lavoro della classe II E (liceo scientifico opzione scienze applicate) Materia: scienze Insegnante: Donatella D'Angela Testi
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
2 classificare, formulare ipotesi in base ai dati forniti, trarre conclusioni basate sui risultati ottenuti e sulle ipotesi verificate
 PIANO DI LAVORO DOCENTE MATERIA DESTINATARI ANNO SCOLASTICO 2013-14 Olga Pecorari SCIENZE NATURALI CLASSE QUARTA B LICEO LINGUISTICO COMPETENZE CONCORDATE CON CONSIGLIO DI CLASSE OBIETTIVI/COMPETENZE CONCORDATE
PIANO DI LAVORO DOCENTE MATERIA DESTINATARI ANNO SCOLASTICO 2013-14 Olga Pecorari SCIENZE NATURALI CLASSE QUARTA B LICEO LINGUISTICO COMPETENZE CONCORDATE CON CONSIGLIO DI CLASSE OBIETTIVI/COMPETENZE CONCORDATE
CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011
 MANIFESTO DEGLI STUDI CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011 1. Denominazione - Laurea in SCIENZE FISICHE 2. Classe Il Corso di laurea in Scienze Fisiche appartiene alla classe L-30 - Scienze
MANIFESTO DEGLI STUDI CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011 1. Denominazione - Laurea in SCIENZE FISICHE 2. Classe Il Corso di laurea in Scienze Fisiche appartiene alla classe L-30 - Scienze
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
LICEO SCIENTIFICO F.LUSSANA. PROGRAMMA DI SCIENZE EFFETTIVAMENTE SVOLTO Classe 2 B
 LICEO SCIENTIFICO F.LUSSANA PROGRAMMA DI SCIENZE EFFETTIVAMENTE SVOLTO Classe 2 B anno scolastico 2013 / 14 PROF. tiziana de simone Libro di testo di chimica : ESPLORIAMO LA CHIMICA Autori : G.Valitutti-A.Tifi-A.Gentile
LICEO SCIENTIFICO F.LUSSANA PROGRAMMA DI SCIENZE EFFETTIVAMENTE SVOLTO Classe 2 B anno scolastico 2013 / 14 PROF. tiziana de simone Libro di testo di chimica : ESPLORIAMO LA CHIMICA Autori : G.Valitutti-A.Tifi-A.Gentile
INDICE CARICA ELETTRICA E LEGGE DI COULOMB 591 ENERGIA POTENZIALE E POTENZIALI ELETTRICI 663 CAMPO ELETTRICO 613 PROPRIETÀ ELETTRICHE DELLA MATERIA 93
 INDICE CAPITOLO 25 CARICA ELETTRICA E LEGGE DI COULOMB 591 25.1 Elettromagnetismo: presentazione 591 25.2 Carica elettrica 592 25.3 Conduttori e isolanti 595 25.4 Legge di Coulomb 597 25.5 Distribuzioni
INDICE CAPITOLO 25 CARICA ELETTRICA E LEGGE DI COULOMB 591 25.1 Elettromagnetismo: presentazione 591 25.2 Carica elettrica 592 25.3 Conduttori e isolanti 595 25.4 Legge di Coulomb 597 25.5 Distribuzioni
Il Metodo Scientifico
 Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Capitolo 4 Le spettroscopie. 1. Lo spettro elettromagnetico
 Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Corso integrato: FISICA, STATISTICA E INFORMATICA Disciplina: FISICA MEDICA Docente: Prof. Massimo MONCIARDINI Recapito: maxmonc@inwind.
 Corso integrato: FISICA, STATISTICA E INFORMATICA Disciplina: FISICA MEDICA Docente: Prof. Massimo MONCIARDINI Recapito: maxmonc@inwind.it Programma: Introduzione Meccanica Cinematica Dinamica Statica
Corso integrato: FISICA, STATISTICA E INFORMATICA Disciplina: FISICA MEDICA Docente: Prof. Massimo MONCIARDINI Recapito: maxmonc@inwind.it Programma: Introduzione Meccanica Cinematica Dinamica Statica
Elettrolisi del solfato di rame
 Elettrolisi del solfato di rame Calcolo dell equivalente equivalente elettrochimico del rame Calcolo del valore della carica elementare Un po di storia 1800 - Invenzione della pila di Volta 1807 - Davy,,
Elettrolisi del solfato di rame Calcolo dell equivalente equivalente elettrochimico del rame Calcolo del valore della carica elementare Un po di storia 1800 - Invenzione della pila di Volta 1807 - Davy,,
Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012)
 CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
EQUILIBRI ACIDO-BASE
 EQUILIBRI ACIDO-BASE ACIDI e BASI Definizione di acido e base secondo Arrhenius (1887) Acido è una specie chimica che in soluzione acquosa si dissocia dando uno o più ioni idrogeno H + Base è una specie
EQUILIBRI ACIDO-BASE ACIDI e BASI Definizione di acido e base secondo Arrhenius (1887) Acido è una specie chimica che in soluzione acquosa si dissocia dando uno o più ioni idrogeno H + Base è una specie
Ionizzazione dell acqua
 Acidi e basi L idrogenione Un atomo di idrogeno è costituito da un solo protone e un solo elettrone. Se da un atomo di idrogeno estraiamo l elettrone, abbiamo un protone, che è il catione H + detto idrogenione
Acidi e basi L idrogenione Un atomo di idrogeno è costituito da un solo protone e un solo elettrone. Se da un atomo di idrogeno estraiamo l elettrone, abbiamo un protone, che è il catione H + detto idrogenione
Corso di Chimica Modulare
 GIUSEPPE SICHERI PAL VLPI ELISABETTA BALZAN Corso di Chimica Modulare VLUME 1 - GENERALE E INRGANICA VLUME 2 - CHIMICA DEL CARBNI L Indice generale e di collegamento ai due Volumi è proposto a pagina 5
GIUSEPPE SICHERI PAL VLPI ELISABETTA BALZAN Corso di Chimica Modulare VLUME 1 - GENERALE E INRGANICA VLUME 2 - CHIMICA DEL CARBNI L Indice generale e di collegamento ai due Volumi è proposto a pagina 5
STATI FISICI DELLA MATERIA: SOLIDI, LIQUIDI E GAS
 STATI FISICI DELLA MATERIA: SOLIDI, LIQUIDI E GAS 7.A PRE-REQUISITI 7.B PRE-TEST 7.C OBIETTIVI 7.1 INTRODUZIONE 7.2 LO STATO SOLIDO 7.2.1 IL RETICOLO CRISTALLINO 7.2.2 STRUTTURA E PROPRIETA DEI DIVERSI
STATI FISICI DELLA MATERIA: SOLIDI, LIQUIDI E GAS 7.A PRE-REQUISITI 7.B PRE-TEST 7.C OBIETTIVI 7.1 INTRODUZIONE 7.2 LO STATO SOLIDO 7.2.1 IL RETICOLO CRISTALLINO 7.2.2 STRUTTURA E PROPRIETA DEI DIVERSI
PIANO DI LAVOR A. S. 2013/ 2014. III E sezione tecnica CHIMICI. Testo in adozione. Dispense
 Pagina 1 di 5 Nome docenti BENEDETTO LUIGINA Materia insegnata Analisi Chimica e laboratorio Classe III E sezione tecnica CHIMICI Nome Ins. Tecn. Pratico Romagnollo Lidia Rubino,Venzaghi,Cozzi Le basi
Pagina 1 di 5 Nome docenti BENEDETTO LUIGINA Materia insegnata Analisi Chimica e laboratorio Classe III E sezione tecnica CHIMICI Nome Ins. Tecn. Pratico Romagnollo Lidia Rubino,Venzaghi,Cozzi Le basi
Lezione di Combustione
 Lezione di Combustione Introduzione Da un punto di vista chimico-fisico la combustione è un processo reattivo fortemente esotermico Generalmente le temperature in gioco sono particolarmente elevate e dipendono
Lezione di Combustione Introduzione Da un punto di vista chimico-fisico la combustione è un processo reattivo fortemente esotermico Generalmente le temperature in gioco sono particolarmente elevate e dipendono
Unità di misura. Perché servono le unità di misura nella pratica di laboratorio e in corsia? Le unità di misura sono molto importanti
 Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012
 Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012 Misure e grandezze Grandezze fondamentali Grandezza fisica Simbolo della grandezza Unità di misura Simbolo dell unità di misura lunghezza
Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012 Misure e grandezze Grandezze fondamentali Grandezza fisica Simbolo della grandezza Unità di misura Simbolo dell unità di misura lunghezza
