LA DUPLICE NATURA DELLA LUCE
|
|
|
- Violetta Verde
- 8 anni fa
- Visualizzazioni
Transcript
1 LA DUPLICE NATURA DELLA LUCE Ovvero: Così è, se vi pare La secolare disputa sulla natura della luce è caratterizzata da numerosi rovesciamenti di fronte. Newton sosteneva essere costituita da un flusso di corpuscoli, fino a che Huygens e Fresnel non ne dimostrarono incontrovertibilmente la natura ondulatoria, come solo mezzo per spiegare i fenomeni di diffrazione e interferenza. Maxwell diede poi la veste teorica a questa interpretazione, incorporando la luce nella sua teoria del campo elettromagnetico. Ma decenni dopo l apparente vittoria della ipotesi ondulatoria, la scoperta dell effetto fotoelettrico riapre le ostilità, e Albert Einstein, non ancora noto per i successivi lavori sulla struttura dello Spazio e del Tempo, fornisce una meravigliosa teoria dell assorbimento e dell emissione della luce sulla base della sua natura corpuscolare, ed introduce di fatto il concetto di fotone, o particella di luce o granulo di energia. A questo punto la confusione è massima, perché ognuna delle due teorie fornisce una spiegazione indiscutibile per una classe di fenomeni, ma è incapace di spiegarne un altra classe. La guerra finirà solo con l avvento della nuova fisica e sarà a tutti gli effetti un armistizio senza vinti né vincitori. La Meccanica Quantistica sancisce infatti la duplicità inestricabile della natura, sia per l energia che per la materia: entrambe, aspetti diversi di una sola realtà, manifestano sia la natura di onda che quella di particella, ma mai nello stesso esperimento e sempre in modo mutuamente esclusivo. In tutti gli esperimenti (come la diffrazione) che presuppongono la natura ondulatoria, la luce si manifesta come onda; in tutti gli esperimenti (come l emissione e l assorbimento) che presuppongono la natura corpuscolare, la luce si manifesta come corpuscolo. Insomma, la luce, e più in generale la radiazione elettromagnetica, ci appare come noi ci aspettiamo che appaia: un onda in un certo ordine di fenomeni, un flusso di particelle in un altro ordine di fenomeni: come dire: così è se vi pare Inoltre, sia la materia che l energia sono costituite da granuli, cioè da porzioni minime al di sotto delle quali non si va. La natura corpuscolare era già acquisita per la materia, mentre appariva indigesta per l energia, che l intuito è riluttante a immaginare a palline. Ancor più indigesta è l idea che la materia, nei sui costituenti elementari, sia fatta di onde. Eppure è così: la particelle elementari, con l opportuna disposizione sperimentale, danno luogo a fenomeni di diffrazione esattamente come le onde luminose e le onde luminose convogliano granuli di energia ed hanno una massa, come le particelle. Accingendoci a capire la spettroscopia, avremo a che fare inevitabilmente ora con l uno ora con l altro di questi due aspetti contrastanti ma compresenti (duali) della luce. Per capire come funziona la strumentazione, il solo aspetto rilevante è quello ondulatorio (gli spettroscopi funzionano perché la luce è un onda elettromagnetica). Per capire perché gli spettri hanno la struttura che hanno, sono rilevanti sia l aspetto
2 corpuscolare (emissione e assorbimento) che quello ondulatorio (propagazione). EMISSIONE/ASSORBIMENTO Qualunque corpo emette radiazioni elettromagnetiche; la quantità di energia emessa cresce rapidamente col crescere della temperatura. Consideriamo un corpo solido o un gas molto denso, a temperatura elevata. Se la luce emanata da questo corpo incandescente viene osservata con uno spettroscopio, si vede uno spettro continuo, cioè una distribuzione di frequenze che digrada uniformemente dal rosso scuro al violetto; e si nota che col crescere della temperatura il massimo dell intensità si sposta sempre più verso le minori lunghezze d onda (o maggiori frequenze). Invece, lo spettro di un gas rarefatto e sufficientemente caldo ha un aspetto del tutto diverso da quello di un solido o di un liquido incandescenti: invece di una striscia continua con i colori dell iride, guardando all oculare di uno spettroscopio si vede una successione di righe luminose isolate di diverso colore, cioè uno spettro a righe. Ognuna di queste è un immagine della fenditura, attraverso cui la luce penetra nello strumento, in una particolare lunghezza d onda; il numero, la posizione e l intensità delle righe sono diversi a seconda della natura chimica e della temperatura del gas. L insieme delle righe che compaiono nello spettro è caratteristico ed inconfondibile di ogni elemento chimico. Se la luce di un solido incandescente attraversa un gas freddo, lo spettro continuo della sorgente appare solcato da righe oscure che occupano le stesse posizioni delle righe che apparirebbero luminose se quel medesimo gas fosse riscaldato a sufficiente temperatura. Le righe oscure non sono altro che luce mancante in quelle particolari lunghezze d onda; luce sottratta dal gas alla sorgente: un gas assorbe quelle stesse radiazioni che è capace di emettere (legge di Kirchoff). Spettro di emissione Spettro di assorbimento
3 > La lampada, sorgente di luce continua, emette radiazioni (o fotoni volendo usare la terminologia corpuscolare) di ogni possibile lunghezza d onda: non c è nessun vuoto di lunghezza d onda fra una radiazione e l altra. Se questa luce attraversa un ampolla contenente un gas, gli atomi di questo gas assorbono, eccitandosi, una percentuale dei fotoni aventi energia pari ad uno dei salti di livello possibili ( come vedremo fra poco, gli elettroni in un atomo possono muoversi soltanto su orbite ben determinate, per saltare da un orbita all altra hanno bisogno di energia di definita lunghezza d onda). I fotoni assorbiti vengono riemessi entro un miliardesimo di secondo; però non tutti vengono riemessi nella direzione originaria ma bensì ciascuno in una direzione a caso, per cui solo una parte dei fotoni riprende la direzione dell osservatore che guarda la lampada attraverso il gas. Perciò a questo osservatore arrivano meno fotoni, aventi lunghezza d onda caratteristica di quel gas, di quanti ne ha emessi la lampada nella sua direzione. Conseguentemente, se di questa luce si osserva lo spettro, in corrispondenza alle lunghezze d onda delle radiazioni assorbite appaiono delle righe oscure (luce che manca dal continuo emesso dalla lampada). Se invece si osserva il gas obliquamente, in modo che all osservatore non giunga la luce diretta dalla lampada, si vedranno solo i fotoni riemessi dal gas in seguito alla diseccitazione degli atomi, e nello spettro appariranno le righe luminose caratteristiche di quel gas. LEGGI EMPIRICHE Nel 1855 Johann Balmer aveva riconosciuto che le quattro righe della zona del visibile dello spettro dell atomo di idrogeno hanno frequenze che ubbidiscono alla seguente legge empirica:
4 con n=3;4;5; ecc dove R è una costante che vale 3, successivamente si trovarono altre due serie con n=4;5; ecc e con n=5;6; ecc Queste tre serie, e altre successivamente scoperte nell infrarosso e nell ultravioletto si possono scrivere nell unico modo (formula di Ritz) con m= 1;2;3 ecc; n>m Le varie formule introdotte degli spettroscopisti per tentare di mettere ordine nella massa di dati sperimantali, sono leggi empiriche, cioè regolarità riscontrate sperimentalmente e formalizzate matematicamente, ma di cui non è ancora chiara la ragione fisica. Le leggi empiriche sono una tappa importante della maturazione della Fisica, e preludono di solito alla comprensione vera del fenomeno. Altro esempi illustri sono le leggi di Keplero, spiegate dalla teoria di Newton, le leggi di Laplace, Ampere, Biot-Savart, Neumann-Lentz ecc sui vari fenomeni elettromagnetici, incorporate e spiegate poi dalla Teoria del Campo Elettromagnetico di Maxwell, e ancora la trasformazione di Lorentz, preludio della Relatività Speciale. Il problema da risolvere, nel caso della formula di Ritz, era capire quale meccanismo di emissione e assorbimento potesse determinare scambi di energia solo a determinate lunghezze d onda e perché proprio a quelle. PERCHE I GAS EMETTONO ED ASSORBONO LUCE Lo scambio di energia tra fotoni (luce) e particelle (materia) avviene per successivi processi di assorbimento (fotoni cedono energia alla materia), ed emissione (energia contenuta nella materia viene impiegata per generare fotoni) Tutto ciò che diremo in tema di emissione, assorbimento e propagazione, vale a rigore anche per i solidi ed i liquidi, ma parlando di stelle abbiamo a che fare con temperature che precludono l esistenza dello stato solido o liquido; e parlando di nebulose abbiamo a che fare con materia non condensata. Per capire i meccanismi di emissione e assorbimento, dobbiamo rifarci al modello dell atomo.
5 MODELLO DELL ATOMO Dire modello dell atomo è di per sé un controsenso, poiché a causa del principio di indeterminazione, base dalla Meccanica Quantistica, il sistema atomo non è riconducibile ad un modello univoco ed omnicomprensivo. Esistono peraltro parecchi modelli parziali dell atomo, ognuno capace di aiutarci a rappresentare determinate classi di fenomeni. Il modello che viene proficuamente usato per comprendere i fenomeni che stanno alla base della spettroscopia, è il modello atomico di Bohr (1913). Per comprenderne altri aspetti più fini bisogna ricorrere al modello di Bohr-Sommerfeld (1915..). In questi modelli si rinuncia a considerare gli orbitali elettronici nel loro aspetto indeterministico (gusci nei quali è alta la probabilità di trovare l elettrone di data energia), ma si considerano ancora gli elettroni come cariche puntiformi su orbite circolari o ellittiche). La teoria degli spettri atomici spiega con questo modello la distribuzione delle righe spettrali. Vediamo come. Il modello di Bohr si basa su questi presupposti: a. dai lavori di Rutherford risulta che l atomo è costituito da un concentrazione centrale di massa e carica positiva, e che le cariche negative sono in qualche modo all esterno del nucleo a grandissima distanza da esso. b. da alcune ipotesi che L. De Broglie e Sommerfeld derivano dalla nascente fisica quantistica, si evince che possono esistere orbite elettroniche stabili solo a condizione che il loro raggio abbia valori ben precisi e strettamente selezionati, in modo che le orbite stesse contengano un numero intero di lunghezze d onda di De Broglie Bohr affrontò il problema nella sua forma più elementare: la costruzione del modello dell'atomo dell'idrogeno. Scelse l'idrogeno sia perché si trattava dell'atomo più semplice di tutti (un nucleo centrale con carica positiva con un unico elettrone che gli gira intorno), sia perché lo spettro di quell'elemento si presentava anch'esso in forma molto semplice, con pochissime righe ben distanziate fra loro. Bohr ragionò nel modo seguente: se la materia assorbe ed emette energia in modo discontinuo significa che l'atomo, suo costituente fondamentale, può esistere solo in determinate configurazioni ciascuna con un proprio contenuto energetico. Quando l'atomo passa da una configurazione con un certo contenuto energetico ad un'altra con contenuto energetico diverso, esso assorbe o emette energia sotto forma di fotoni di quella esatta energia, e per tale motivo lo spettro appare con una linea scura o con una linea colorata in corrispondenza di quel determinato valore dell'energia. Lo spettro dell'idrogeno pertanto, non è altro che la rappresentazione visiva del passaggio da atomi con un certo contenuto energetico ad altri con diverso contenuto energetico. Bohr riuscì a dimostrare matematicamente che per ottenere configurazioni dell'atomo di
6 idrogeno a contenuto energetico diverso bisognava ipotizzare che il momento angolare dell'elettrone che gira intorno al nucleo, fosse quantizzato. Più precisamente, egli suppose che il momento angolare dell'elettrone dovesse essere un multiplo intero del quanto di azione (h) di Planck. In parole: quantità di moto (m v) dell'elettrone in rotazione intorno al nucleo, moltiplicata per la lunghezza dell'orbita (2 pr) uguale a un numero intero di quanti h Ossia in formula: Il prodotto mvr (massa dell'elettrone per la sua velocità e per il raggio dell'orbita circolare da esso percorsa) rappresenta il momento angolare dell'elettrone. Esso è quantizzato in quanto non può assumere valori qualsiasi, ma solo valori che sono multipli interi di h/2p; cioè ad esempio il valore h/2 stesso, oppure il valore 2(h/2 ), oppure 3(h/2 ), e così via. Il numero intero n venne chiamato da Bohr numero quantico dell'elettrone. La conseguenza dell'ipotesi avanzata da Bohr era che l'elettrone dell'atomo di idrogeno poteva muoversi solo su orbite preferenziali, dette orbite stazionarie, e che movendosi su tali orbite non emetteva energia. Questa limitazione corrispondeva, in un certo senso, a considerare l'elettrone come qualche cosa di speciale e comunque qualche cosa di diverso da un corpo carico di elettricità che, girando su un'orbita circolare, è tenuto a rispettare le leggi dell'elettromagnetismo. Per Bohr, in contrasto con le leggi dell'elettromagnetismo, l elettrone in moto su un'orbita permessa non irradia L'elettrone emetteva energia solo quando passava spontaneamente da un'orbita più esterna verso una più interna. Viceversa l'elettrone poteva passare da un'orbita più interna (a minore contenuto energetico) ad una più esterna solo se assorbiva dall'ambiente l'energia necessaria. La quantizzazione del momento angolare permise di determinare, in funzione di n, i raggi delle orbite permesse, nonché i valori dell'energia posseduta dall'elettrone in movimento su dette orbite. L'elettrone può quindi venirsi a trovare solo a determinate distanze dal nucleo (mai al di sotto di una distanza minima rappresentata da quella che viene chiamata orbita fondamentale ), e può inoltre assumere solo determinati valori dell'energia, il cui minimo era, per l'appunto, quello relativo all'orbita fondamentale. Senza entrare nei dettagli della teoria, possiamo farci un'idea del modello atomico di Bohr.
7 Il raggio della prima orbita percorsa dall'elettrone dell'atomo d'idrogeno, quella corrispondente al valore n=1, calcolata utilizzando i postulati imposti da Bohr, è pari a: r = 0, m = 0,53 Å mentre la corrispondente energia risulta: E= - 1, Joule L'elettrone con n=1 percorre quindi l'orbita che si trova più vicina al nucleo (orbita fondamentale) e possiede il valore minimo di energia (il valore più negativo). Sostituendo ad n i successivi valori interi (2, 3, 4, ecc.), si ottengono i raggi e le energie dei livelli più esterni. Il valore riportato sopra (ma con segno cambiato) rappresenta l'energia necessaria per allontanare l'elettrone dalla prima orbita e portarlo a distanza infinita (praticamente fuori dall'influenza del nucleo). L'atomo, privato di uno o più elettroni, come già sappiamo, è un sistema con carica positiva che prende il nome di ione; l'energia spesa per l'allontanamento degli elettroni viene detta energia di ionizzazione. Se moltiplichiamo per il numero di Avogadro (6, ) il valore dell'energia necessaria per allontanare l'elettrone dalla prima orbita dell'atomo di idrogeno e portarlo all'infinito, otteniamo il valore dell'energia necessaria per allontanare tutti gli elettroni di una mole di idrogeno, dalla prima orbita all'infinito. Tale valore risulta di 313,6 Kcal. Pertanto possiamo dire che l'energia corrispondente alla prima orbita dell'atomo di idrogeno è -313,6 Kcal/mol. I valori dell'energia relativi alle orbite più esterne percorse dall'elettrone, possono essere calcolati con la seguente formula: Quindi c è una dipendenza dell energia dall inverso quadrato del numero quantico n L'energia della seconda orbita (n=2) vale quindi 1/4 di quella della prima, quella della terza (n=3), vale 1/9 della prima, e così via. I valori dell'energia relativa ad alcuni livelli dell'atomo di idrogeno (v. fig. 16) crescono all'aumentare del numero quantico n, cioè a mano a mano che gli elettroni occupano orbite più lontane dal nucleo. Il valore massimo (cioè il valore zero) si ha quando la distanza dal nucleo è infinita. Il modello atomico di Bohr permette di dare un'interpretazione chiara e convincente dello spettro a righe dell'idrogeno. Possiamo infatti immaginare che quando all'idrogeno viene fornita energia, ad esempio all'interno di un tubo a scarica, gli elettroni, dal livello fondamentale, passino ai livelli energetici più esterni; dalle orbite più elevate gli elettroni ritornano quindi immediatamente (e spontaneamente) a quelle più basse. Nella caduta spontanea degli elettroni vengono emessi fotoni. L'energia posseduta da questi fotoni corrisponde alla differenza energetica degli stati stazionari tra i quali è avvenuta la transizione. Quando gli elettroni, dalle orbite più elevate, ritornano a quella fondamentale (la più bassa di tutte), si ha emissione di fotoni molto energetici, corrispondenti alle righe dell'ultravioletto (serie di Lyman). Quando gli elettroni ricadono, dalle orbite periferiche, sulla seconda orbita stazionaria, si ha emissione di fotoni la cui energia corrisponde alle righe dello spettro visibile (serie di Balmer). Un
8 discorso analogo vale per gli spostamenti sulla terza, sulla quarta orbita, e così via. Gli spettri che si ottengono in questi casi sono spettri di emissione. Gli spettri di assorbimento si ottengono invece quando gli atomi di idrogeno vengono illuminati con luce di tutte le lunghezze d'onda. Tutti i fotoni in questo caso passano indisturbati, tranne alcuni. Non passano quei fotoni che, possedendo una quantità di energia esattamente uguale a quella necessaria per far saltare l'elettrone su un'orbita più esterna, vengono utilizzati per questa operazione. Questi fotoni scompaiono quindi dalla scena e pertanto avremo uno spettro continuo di luce di tutti i colori, solcato da alcune linee scure. RIASSUMENDO Secondo Bohr, il modello dell atomo si basa su tre postulati: 1.esistono orbite particolari, sulle quali l elettrone può stazionare in rotazione senza perdere energia. 2.le orbite stazionarie sono caratterizzate da valori discreti (quantizzati) del momento angolare 3.un elettrone può cade spontaneamente da un orbita stazionaria a un altra, emettendo un fotone di energia hn=ei-ef (Ei Energia Iniziale, Ef Energia finale) Con questo modello vengono calcolati livelli energetici permessi per l atomo di idrogeno, per He + e per Li ++, che hanno una conformazione formalmente identica a quella dell idrogeno, a parte il numero di componenti, e degli atomi alcalini. L accordo con i valori di energia che conseguono alle transizioni tra i vari livelli è soddisfacente. IL MODELLO DI SOMMERFELD E LA RELATIVITÀ E interessante riflettere sul momento storico in cui il modello di Bohr (1913) viene proposto. La Meccanica Quantistica vera e propria (1926) era ancora ben lontana da una soddisfacente formalizzazione, ma era già noto che l energia è quantizzata sia nella propagazione che nell emissione/assorbimento (Planck e Einstein, 1900,1905). Si incomincia a capire che il concetto classico di traiettoria e di precisa localizzabilità entra in crisi per le particelle che costituiscono l atomo; tuttavia, non essendo ancora stato formulato il principio di indeterminazione, non c è una chiara consapevolezza della non modellizzabilità dei sistemi atomici. Questo in un certo senso è stato un bene perché ha dato fiducia in modelli che, visti con la scienza del poi, sono fallaci, ma che hanno dato, nel campo specifico della spettroscopia degli atomi e ioni più semplici, dei risultati soddisfacenti. Era invece ormai accettata dalla comunità scientifica la Relatività Speciale di Einstein, ma il modello di Bohr non ne teneva conto. Il fondamentale contributo di Sommerfeld consiste appunto nell introdurre nel modello
9 di Bohr la fondamentale conquista della Relatività, la dipendenza della massa dell elettrone dalla velocità lungo l orbita. Il primo passo di Sommerfeld è di ampliare il modello di Bohr ad orbite ellittiche: Bohr le aveva supposte circolari per semplicità di trattazione matematica, ma si trattava evidentemente di casi particolari. La conseguenza delle orbite ellittiche è che la velocità dell elettrone varia lungo l orbita, e di conseguenza ne varia la massa. Da ciò segue che la disposizione dell orbita nello spazio varia nel tempo, venendo ad occupare un volume intorno al nucleo con una configurazione tridimensionale a rosetta. (figura più in basso) Con questo modello si spiega il fatto che le righe ritenute semplici dai primi sperimentatori sono in realtà dei gruppetti (doppietti, tripletti o multipletti) di frequenze molto vicine fra loro. Mentre per descrivere un orbita circolare basta un solo numero quantico n (quello che quantizza il momento angolare), per descrivere orbite ellittiche a rosetta tridimensionale ne occorre un secondo, il numero quantico azimutale indicato con l1, che deve essere positivo e non maggiore di n. L aumento in numero dei possibili livelli energetici porta alla proliferazione dei possibili salti quantici. Si trova però che i salti osservati (transizioni permesse) sono molto meno di quelli possibili, e corrispondono a transizioni tra livelli il cui l, differisce di una unità. Viene quindi sancita la regola di selezione D l =±1 Ma non basta: secondo la teoria del Campo EM, un elettrone su un orbita ellittica equivale ad una spira percorsa da corrente variabile, quindi interagisce con campi magnetici esterni a seconda dell orientamento nello spazio dell orbita. L intensità di interazione è legata dal suo momento magnetico, un energia potenziale di origine magnetica la cui entità dipende appunto dalla giacitura nello spazio dell orbita, oltre che dall intensità della corrente e dalla superficie racchiusa dall ellisse. Questo momento magnetico è già di per sé quantizzato, perché a causa della prima quantizzazione di Bohr la superficie racchiusa dall ellisse non può avere tutti i valori possibili. Sommerfeld intuisce che anche gli orientamenti nello spazio devono essere quantizzati, e introduce questa ulteriore condizione imponendola alla componente del momento angolare orbitale lungo la direzione del campo magnetico: a questa componente quantizzata, corrisponde il nuovo numero quantico magnetico, chiamato m.
10 Vi è quindi una catena di 3 numeri quantici: n, l, m ognuno con le sue regole. Il numero quantico magnetico spiega l Effetto Zeeman, cioè la formazione di multipletti al posto di ogni riga singola, in presenza di forti campi magnetici. Val la pena di sottolineare (dato che il nostro punto di partenza è la spettroscopia astronomica), quanto sia importante l effetto Zeeman ai fini delle ricerche sui campi magnetici nelle stelle e in altri oggetti. Anche il numero quantico magnetico m è soggetto ad una regola di selezione uguale a quella sul numero quantico azimutale: m =±1
11 Ma la storia non è finita. Senza entrare nei particolari, si ritenne di dover introdurre un quarto numero quantico, i cui valori dovevano essere 1/2. Al momento fu una forzatura al modello per spiegare ulteriori particolari sperimentali, poi nel 1925 si scopri che l elettrone non andava concepito come rigorosamente puntiforme e quindi privo di orientamento nello spazio, ma piuttosto come una piccolissima trottola carica (spin), con un momento magnetico derivante dalla rotazione della carica. Questo nuovo momento magnetico ms ci obbliga a distinguere gli elettroni orientati nel verso del campo magnetico o in verso opposto. L evidenza sperimentale di questo fatto si deve a Unlebeck e Goudsmith (1925). Per la comprensione teorica bisognerà attendere due anni (Teoria quantistica relativistica di Dirac, 1927) In definitiva, ogni possibile livello di energia di un elettrone atomico è caratterizzato da quattro diversi valori dei numeri quantici, così individuati: fissato un valore per il numero quantico principale n, ci sono n diversi valori del numero quantico azimutale l; per ogni valore di l, ci sono 2(2l+1) livelli di energia che si manifestano in presenza di un campo magnetico, dei quali 2l+1 sono associati ai possibili valori del numero quantico magnetico m e allo spin +½, e altrettanti associati agli stessi valori del numero quantico magnetico m ma allo spin -½,
12 Anche se esula dal tema della spettroscopia, non posso non accennare a questo punto a un principio fondamentale: in un sistema legato (atomo), può essere presente uno ed un solo elettrone in un certo stato quantico, cioè con una certa quaterna di numeri quantici. Questo è il Principio di Pauli, ed è la chiave di interpretazione della tavola periodica degli elementi chimici, perché ci fornisce la regola con cui si popolano i vari strati e sottostrati successivi della corteccia elettronica. Si tratta del il maggior successo del modello atomico di Bohr Sommerfeld. In fisica, anche con strumenti imperfetti si possono talvolta realizzare sintesi teoriche mirabili.
Da Newton a Planck. La struttura dell atomo. Da Newton a Planck. Da Newton a Planck. Meccanica classica (Newton): insieme
 Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
Struttura Elettronica degli Atomi
 Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
IL MODELLO ATOMICO DI BOHR
 IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Il fotone. Emanuele Pugliese, Lorenzo Santi URDF Udine
 Il fotone Emanuele Pugliese, Lorenzo Santi URDF Udine Interpretazione di Einstein dell effetto fotoelettrico Esistono «particelle»* di luce: i fotoni! La luce è composta da quantità indivisibili di energia
Il fotone Emanuele Pugliese, Lorenzo Santi URDF Udine Interpretazione di Einstein dell effetto fotoelettrico Esistono «particelle»* di luce: i fotoni! La luce è composta da quantità indivisibili di energia
May 5, 2013. Fisica Quantistica. Monica Sambo. Sommario
 May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
Fisica II - CdL Chimica. La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche
 La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche La natura della luce Teoria corpuscolare (Newton) Teoria ondulatoria: proposta già al tempo di Newton, ma scartata perchè
La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche La natura della luce Teoria corpuscolare (Newton) Teoria ondulatoria: proposta già al tempo di Newton, ma scartata perchè
LE PARTICELLE ELEMENTARI: loro scoperta
 LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
Moto circolare uniforme
 Moto circolare uniforme 01 - Moto circolare uniforme. Il moto di un corpo che avviene su una traiettoria circolare (una circonferenza) con velocità (in modulo, intensità) costante si dice moto circolare
Moto circolare uniforme 01 - Moto circolare uniforme. Il moto di un corpo che avviene su una traiettoria circolare (una circonferenza) con velocità (in modulo, intensità) costante si dice moto circolare
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose.
 Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
L osservazione in luce bianca è, per così dire, l osservazione del Sole al naturale ovviamente dopo averne attenuato la fortissima emissione di luce.
 L osservazione in luce bianca è, per così dire, l osservazione del Sole al naturale ovviamente dopo averne attenuato la fortissima emissione di luce. Questa attenuazione si ottiene mediante l uso di un
L osservazione in luce bianca è, per così dire, l osservazione del Sole al naturale ovviamente dopo averne attenuato la fortissima emissione di luce. Questa attenuazione si ottiene mediante l uso di un
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
FISICA E LABORATORIO
 Programma di FISICA E LABORATORIO Anno Scolastico 2014-2015 Classe V P indirizzo OTTICO Docente Giuseppe CORSINO Programma di FISICA E LABORATORIO Anno Scolastico 2013-2014 Classe V P indirizzo OTTICO
Programma di FISICA E LABORATORIO Anno Scolastico 2014-2015 Classe V P indirizzo OTTICO Docente Giuseppe CORSINO Programma di FISICA E LABORATORIO Anno Scolastico 2013-2014 Classe V P indirizzo OTTICO
Gli orbitali: modello atomico probabilistico
 1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
Onde elettromagnetiche
 Onde elettromagnetiche Alla metà del XIX secolo Maxwell prevede teoricamente le onde e.m. Sono scoperte sperimentalmente da Hertz Danno la possibilità di comunicare a distanza (radio, televisione, telecomandi
Onde elettromagnetiche Alla metà del XIX secolo Maxwell prevede teoricamente le onde e.m. Sono scoperte sperimentalmente da Hertz Danno la possibilità di comunicare a distanza (radio, televisione, telecomandi
APPUNTI DI MATEMATICA LE FRAZIONI ALGEBRICHE ALESSANDRO BOCCONI
 APPUNTI DI MATEMATICA LE FRAZIONI ALGEBRICHE ALESSANDRO BOCCONI Indice 1 Le frazioni algebriche 1.1 Il minimo comune multiplo e il Massimo Comun Divisore fra polinomi........ 1. Le frazioni algebriche....................................
APPUNTI DI MATEMATICA LE FRAZIONI ALGEBRICHE ALESSANDRO BOCCONI Indice 1 Le frazioni algebriche 1.1 Il minimo comune multiplo e il Massimo Comun Divisore fra polinomi........ 1. Le frazioni algebriche....................................
9. Urti e conservazione della quantità di moto.
 9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
Capitolo 4 Le spettroscopie. 1. Lo spettro elettromagnetico
 Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Corrispondenze e funzioni
 Corrispondenze e funzioni L attività fondamentale della mente umana consiste nello stabilire corrispondenze e relazioni tra oggetti; è anche per questo motivo che il concetto di corrispondenza è uno dei
Corrispondenze e funzioni L attività fondamentale della mente umana consiste nello stabilire corrispondenze e relazioni tra oggetti; è anche per questo motivo che il concetto di corrispondenza è uno dei
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
La spettroscopia stellare
 La spettroscopia stellare Noi studiamo i corpi celesti, e quindi anche le galassie, misurando le radiazioni che ci mandano e che riusciamo a rilevare con i nostri strumenti. La luce che i nostri occhi
La spettroscopia stellare Noi studiamo i corpi celesti, e quindi anche le galassie, misurando le radiazioni che ci mandano e che riusciamo a rilevare con i nostri strumenti. La luce che i nostri occhi
PARTICELLE SUBATOMICHE
 MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti;
MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti;
Capitolo 2. Operazione di limite
 Capitolo 2 Operazione di ite In questo capitolo vogliamo occuparci dell operazione di ite, strumento indispensabile per scoprire molte proprietà delle funzioni. D ora in avanti riguarderemo i domini A
Capitolo 2 Operazione di ite In questo capitolo vogliamo occuparci dell operazione di ite, strumento indispensabile per scoprire molte proprietà delle funzioni. D ora in avanti riguarderemo i domini A
1. LE GRANDEZZE FISICHE
 1. LE GRANDEZZE FISICHE La fisica (dal greco physis, natura ) è una scienza che ha come scopo guardare, descrivere e tentare di comprendere il mondo che ci circonda. La fisica si propone di descrivere
1. LE GRANDEZZE FISICHE La fisica (dal greco physis, natura ) è una scienza che ha come scopo guardare, descrivere e tentare di comprendere il mondo che ci circonda. La fisica si propone di descrivere
Alessandro Farini: Dispense di Illuminotecnica per le scienze della visione
 Capitolo 1 Radiazione elettromagnetica e occhio In questo capitolo prendiamo in considerazione alcune grandezze fondamentali riguardanti l illuminazione e alcuni concetti legati alla visione umana che
Capitolo 1 Radiazione elettromagnetica e occhio In questo capitolo prendiamo in considerazione alcune grandezze fondamentali riguardanti l illuminazione e alcuni concetti legati alla visione umana che
Corso di. Dott.ssa Donatella Cocca
 Corso di Statistica medica e applicata Dott.ssa Donatella Cocca 1 a Lezione Cos'è la statistica? Come in tutta la ricerca scientifica sperimentale, anche nelle scienze mediche e biologiche è indispensabile
Corso di Statistica medica e applicata Dott.ssa Donatella Cocca 1 a Lezione Cos'è la statistica? Come in tutta la ricerca scientifica sperimentale, anche nelle scienze mediche e biologiche è indispensabile
La corrente elettrica
 PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio La corrente elettrica Sommario 1) Corrente elettrica
PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio La corrente elettrica Sommario 1) Corrente elettrica
Termodinamica: legge zero e temperatura
 Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Insegnare relatività. nel XXI secolo
 Insegnare relatività nel XXI secolo L ' i n e r z i a d e l l ' e n e r g i a L'inerzia dell'energia Questa è la denominazione più corretta, al posto della consueta equivalenza massa energia. Einstein
Insegnare relatività nel XXI secolo L ' i n e r z i a d e l l ' e n e r g i a L'inerzia dell'energia Questa è la denominazione più corretta, al posto della consueta equivalenza massa energia. Einstein
CALORE. Compie lavoro. Il calore è energia. Temperatura e calore. L energia è la capacità di un corpo di compiere un lavoro
 Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Elettricità e magnetismo
 E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
Siamo così arrivati all aritmetica modulare, ma anche a individuare alcuni aspetti di come funziona l aritmetica del calcolatore come vedremo.
 DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
Q 1 = +3 10-5 C carica numero 1 Q 2 = +4 10-5 C carica numero 2 forza esercitata tra le cariche distanza tra le cariche, incognita
 Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
Liceo Scientifico Statale A. Volta, Torino Anno scolastico 2015 / 2016
 Liceo Scientifico Statale A. Volta, Torino Anno scolastico 2015 / 2016 FISICA ELETTROMAGNETISMO FISICA MODERNA classe 5 B MAG. 2016 Esercitazione di Fisica in preparazione all Esame di Stato A.S. 2015-2016
Liceo Scientifico Statale A. Volta, Torino Anno scolastico 2015 / 2016 FISICA ELETTROMAGNETISMO FISICA MODERNA classe 5 B MAG. 2016 Esercitazione di Fisica in preparazione all Esame di Stato A.S. 2015-2016
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Termologia. Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti
 Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
I modelli atomici da Dalton a Bohr
 1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
LE SUCCESSIONI 1. COS E UNA SUCCESSIONE
 LE SUCCESSIONI 1. COS E UNA SUCCESSIONE La sequenza costituisce un esempio di SUCCESSIONE. Ecco un altro esempio di successione: Una successione è dunque una sequenza infinita di numeri reali (ma potrebbe
LE SUCCESSIONI 1. COS E UNA SUCCESSIONE La sequenza costituisce un esempio di SUCCESSIONE. Ecco un altro esempio di successione: Una successione è dunque una sequenza infinita di numeri reali (ma potrebbe
IL FOTOVOLTAICO E L ARCHITETTURA
 IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI
 RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI Autore: Andrea Peluso INTRODUZIONE: La riduzione delle cloroammine in piscina tramite l utilizzo di raggi ultravioletti è una pratica
RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI Autore: Andrea Peluso INTRODUZIONE: La riduzione delle cloroammine in piscina tramite l utilizzo di raggi ultravioletti è una pratica
CORRENTE ELETTRICA Intensità e densità di corrente sistema formato da due conduttori carichi a potenziali V 1 e V 2 isolati tra loro V 2 > V 1 V 2
 COENTE ELETTICA Intensità e densità di corrente sistema formato da due conduttori carichi a potenziali V 1 e V isolati tra loro V > V 1 V V 1 Li colleghiamo mediante un conduttore Fase transitoria: sotto
COENTE ELETTICA Intensità e densità di corrente sistema formato da due conduttori carichi a potenziali V 1 e V isolati tra loro V > V 1 V V 1 Li colleghiamo mediante un conduttore Fase transitoria: sotto
Il magnetismo nella materia
 Le orbite degli elettroni in atomo di idrogeno Forma spaziale degli Orbitali elettronici di atomo di idrogeno Un solido Il magnetismo nella materia ferrimagnetismo Dr. Daniele Di Gioacchino Istituto Nazionale
Le orbite degli elettroni in atomo di idrogeno Forma spaziale degli Orbitali elettronici di atomo di idrogeno Un solido Il magnetismo nella materia ferrimagnetismo Dr. Daniele Di Gioacchino Istituto Nazionale
Slide Cerbara parte1 5. Le distribuzioni teoriche
 Slide Cerbara parte1 5 Le distribuzioni teoriche I fenomeni biologici, demografici, sociali ed economici, che sono il principale oggetto della statistica, non sono retti da leggi matematiche. Però dalle
Slide Cerbara parte1 5 Le distribuzioni teoriche I fenomeni biologici, demografici, sociali ed economici, che sono il principale oggetto della statistica, non sono retti da leggi matematiche. Però dalle
13. Campi vettoriali
 13. Campi vettoriali 1 Il campo di velocità di un fluido Il concetto di campo in fisica non è limitato ai fenomeni elettrici. In generale il valore di una grandezza fisica assegnato per ogni punto dello
13. Campi vettoriali 1 Il campo di velocità di un fluido Il concetto di campo in fisica non è limitato ai fenomeni elettrici. In generale il valore di una grandezza fisica assegnato per ogni punto dello
www.andreatorinesi.it
 La lunghezza focale Lunghezza focale Si definisce lunghezza focale la distanza tra il centro ottico dell'obiettivo (a infinito ) e il piano su cui si forma l'immagine (nel caso del digitale, il sensore).
La lunghezza focale Lunghezza focale Si definisce lunghezza focale la distanza tra il centro ottico dell'obiettivo (a infinito ) e il piano su cui si forma l'immagine (nel caso del digitale, il sensore).
I COLORI DEL CIELO: COME SI FORMANO LE IMMAGINI ASTRONOMICHE
 I COLORI DEL CIELO: COME SI FORMANO LE IMMAGINI ASTRONOMICHE Nell ultima notte di osservazione abbiamo visto bellissime immagini della Galassia, delle sue stelle e delle nubi di gas che la compongono.
I COLORI DEL CIELO: COME SI FORMANO LE IMMAGINI ASTRONOMICHE Nell ultima notte di osservazione abbiamo visto bellissime immagini della Galassia, delle sue stelle e delle nubi di gas che la compongono.
LA TERMOGRAFIA SPETTRO ONDE ELETTROMAGNETICHE
 SPETTRO ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è un mezzo di trasmissione dell energia sotto forma di onde aventi entrambe le componenti elettriche e magnetiche. La sequenza ordinata delle
SPETTRO ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è un mezzo di trasmissione dell energia sotto forma di onde aventi entrambe le componenti elettriche e magnetiche. La sequenza ordinata delle
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
Genova 15 01 14 TIPOLOGIE DI LAMPADE
 Genova 15 01 14 TIPOLOGIE DI LAMPADE Le lampade a vapori di mercurio sono sicuramente le sorgenti di radiazione UV più utilizzate nella disinfezione delle acque destinate al consumo umano in quanto offrono
Genova 15 01 14 TIPOLOGIE DI LAMPADE Le lampade a vapori di mercurio sono sicuramente le sorgenti di radiazione UV più utilizzate nella disinfezione delle acque destinate al consumo umano in quanto offrono
risulta (x) = 1 se x < 0.
 Questo file si pone come obiettivo quello di mostrarvi come lo studio di una funzione reale di una variabile reale, nella cui espressione compare un qualche valore assoluto, possa essere svolto senza necessariamente
Questo file si pone come obiettivo quello di mostrarvi come lo studio di una funzione reale di una variabile reale, nella cui espressione compare un qualche valore assoluto, possa essere svolto senza necessariamente
Perché osservare le binarie ad eclisse
 Perché osservare le binarie ad eclisse Marco Vincenzi Amelia 15-16 maggio 2010 VI Meeting sulle Stelle Variabili SSV UAI GRAV Le binarie ad eclisse, e, più in generale, i sistemi binari si studiano perché
Perché osservare le binarie ad eclisse Marco Vincenzi Amelia 15-16 maggio 2010 VI Meeting sulle Stelle Variabili SSV UAI GRAV Le binarie ad eclisse, e, più in generale, i sistemi binari si studiano perché
APPUNTI DEL CORSO DI SISTEMI IMPIANTISTICI E SICUREZZA INTRODUZIONE AGLI IMPIANTI ELETTRICI: FONDAMENTI DI ELETTROTECNICA
 APPUNTI DEL CORSO DI SISTEMI IMPIANTISTICI E SICUREZZA INTRODUZIONE AGLI IMPIANTI ELETTRICI: FONDAMENTI DI ELETTROTECNICA Concetti e grandezze fondamentali CAMPO ELETTRICO: è un campo vettoriale di forze,
APPUNTI DEL CORSO DI SISTEMI IMPIANTISTICI E SICUREZZA INTRODUZIONE AGLI IMPIANTI ELETTRICI: FONDAMENTI DI ELETTROTECNICA Concetti e grandezze fondamentali CAMPO ELETTRICO: è un campo vettoriale di forze,
Appunti sulla Macchina di Turing. Macchina di Turing
 Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione
 Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione 1. L elettrone ha una massa di 9.1 10-31 kg ed una carica elettrica di -1.6 10-19 C. Ricordando che la forza gravitazionale
Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione 1. L elettrone ha una massa di 9.1 10-31 kg ed una carica elettrica di -1.6 10-19 C. Ricordando che la forza gravitazionale
I CIRCUITI ELETTRICI. Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi.
 I CIRCUITI ELETTRICI Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi. Definiamo ramo un tratto di circuito senza diramazioni (tratto evidenziato in rosso nella
I CIRCUITI ELETTRICI Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi. Definiamo ramo un tratto di circuito senza diramazioni (tratto evidenziato in rosso nella
TX Figura 1: collegamento tra due antenne nello spazio libero.
 Collegamenti Supponiamo di avere due antenne, una trasmittente X e una ricevente X e consideriamo il collegamento tra queste due antenne distanti X X Figura : collegamento tra due antenne nello spazio
Collegamenti Supponiamo di avere due antenne, una trasmittente X e una ricevente X e consideriamo il collegamento tra queste due antenne distanti X X Figura : collegamento tra due antenne nello spazio
Percorso multidisciplinare
 La luce Faremo degli esperimenti atti ad indagare la natura e le caratteristiche della luce ed esporremo le principali teorie che sono state elaborate su questo argomento dagli scienziati nel corso dei
La luce Faremo degli esperimenti atti ad indagare la natura e le caratteristiche della luce ed esporremo le principali teorie che sono state elaborate su questo argomento dagli scienziati nel corso dei
( x) ( x) 0. Equazioni irrazionali
 Equazioni irrazionali Definizione: si definisce equazione irrazionale un equazione in cui compaiono uno o più radicali contenenti l incognita. Esempio 7 Ricordiamo quanto visto sulle condizioni di esistenza
Equazioni irrazionali Definizione: si definisce equazione irrazionale un equazione in cui compaiono uno o più radicali contenenti l incognita. Esempio 7 Ricordiamo quanto visto sulle condizioni di esistenza
UNIVERSITA DEGLI STUDI DI PALERMO MASTER: MISSB. UDA di Fisica
 UNIVERSITA DEGLI STUDI DI PALERMO MASTER: MISSB UDA di Fisica CLASSE V Scheda di Fisica di: Rosalia Rinaldi Prof.ssa Sperandeo 1 PREMESSA: Calore e temperatura sono concetti che ricorrono frequentemente
UNIVERSITA DEGLI STUDI DI PALERMO MASTER: MISSB UDA di Fisica CLASSE V Scheda di Fisica di: Rosalia Rinaldi Prof.ssa Sperandeo 1 PREMESSA: Calore e temperatura sono concetti che ricorrono frequentemente
All interno dei colori primari e secondari, abbiamo tre coppie di colori detti COMPLEMENTARI.
 Teoria del colore La teoria dei colori Gli oggetti e gli ambienti che ci circondano sono in gran parte colorati. Ciò dipende dal fatto che la luce si diffonde attraverso onde di diversa lunghezza: ad ogni
Teoria del colore La teoria dei colori Gli oggetti e gli ambienti che ci circondano sono in gran parte colorati. Ciò dipende dal fatto che la luce si diffonde attraverso onde di diversa lunghezza: ad ogni
19 Il campo elettrico - 3. Le linee del campo elettrico
 Moto di una carica in un campo elettrico uniforme Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice se il campo elettrico è uniforme,
Moto di una carica in un campo elettrico uniforme Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice se il campo elettrico è uniforme,
Logica Numerica Approfondimento 1. Minimo Comune Multiplo e Massimo Comun Divisore. Il concetto di multiplo e di divisore. Il Minimo Comune Multiplo
 Logica Numerica Approfondimento E. Barbuto Minimo Comune Multiplo e Massimo Comun Divisore Il concetto di multiplo e di divisore Considerato un numero intero n, se esso viene moltiplicato per un numero
Logica Numerica Approfondimento E. Barbuto Minimo Comune Multiplo e Massimo Comun Divisore Il concetto di multiplo e di divisore Considerato un numero intero n, se esso viene moltiplicato per un numero
Termodinamica. Sistema termodinamico. Piano di Clapeyron. Sistema termodinamico. Esempio. Cosa è la termodinamica? TERMODINAMICA
 Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
CORRENTE E TENSIONE ELETTRICA LA CORRENTE ELETTRICA
 CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
Temperatura e Calore
 Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
La distribuzione Normale. La distribuzione Normale
 La Distribuzione Normale o Gaussiana è la distribuzione più importante ed utilizzata in tutta la statistica La curva delle frequenze della distribuzione Normale ha una forma caratteristica, simile ad una
La Distribuzione Normale o Gaussiana è la distribuzione più importante ed utilizzata in tutta la statistica La curva delle frequenze della distribuzione Normale ha una forma caratteristica, simile ad una
Einstein ci dice che la luce è costituita da unità elementari chiamate fotoni. Cosa sono questi fotoni?
 La natura della luce Einstein ci dice che la luce è costituita da unità elementari chiamate fotoni. Cosa sono questi fotoni? Se si potesse fotografare un fotone in un certo istante vedremmo una deformazione
La natura della luce Einstein ci dice che la luce è costituita da unità elementari chiamate fotoni. Cosa sono questi fotoni? Se si potesse fotografare un fotone in un certo istante vedremmo una deformazione
Corrente elettrica. Esempio LA CORRENTE ELETTRICA CONTINUA. Cos è la corrente elettrica? Definizione di intensità di corrente elettrica
 Corrente elettrica LA CORRENTE ELETTRICA CONTINUA Cos è la corrente elettrica? La corrente elettrica è un flusso di elettroni che si spostano dentro un conduttore dal polo negativo verso il polo positivo
Corrente elettrica LA CORRENTE ELETTRICA CONTINUA Cos è la corrente elettrica? La corrente elettrica è un flusso di elettroni che si spostano dentro un conduttore dal polo negativo verso il polo positivo
Un altro importante parametro di questo processo è la risoluzione che rappresenta la distanza minima che la litografia può apprezzare.
 TECNICHE LITOGRAFICHE La litografia è un processo basilare nella realizzazione di circuiti integrati,esso consiste nel depositare un materiale detto resist sul wafer da processare che una volta esposto
TECNICHE LITOGRAFICHE La litografia è un processo basilare nella realizzazione di circuiti integrati,esso consiste nel depositare un materiale detto resist sul wafer da processare che una volta esposto
Capitolo 7 Le particelle dell atomo
 Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
f(x) = 1 x. Il dominio di questa funzione è il sottoinsieme proprio di R dato da
 Data una funzione reale f di variabile reale x, definita su un sottoinsieme proprio D f di R (con questo voglio dire che il dominio di f è un sottoinsieme di R che non coincide con tutto R), ci si chiede
Data una funzione reale f di variabile reale x, definita su un sottoinsieme proprio D f di R (con questo voglio dire che il dominio di f è un sottoinsieme di R che non coincide con tutto R), ci si chiede
UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA
 UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA Tutti gli anni, affrontando l argomento della divisibilità, trovavo utile far lavorare gli alunni sul Crivello di Eratostene. Presentavo ai ragazzi una
UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA Tutti gli anni, affrontando l argomento della divisibilità, trovavo utile far lavorare gli alunni sul Crivello di Eratostene. Presentavo ai ragazzi una
Come visto precedentemente l equazione integro differenziale rappresentativa dell equilibrio elettrico di un circuito RLC è la seguente: 1 = (1)
 Transitori Analisi nel dominio del tempo Ricordiamo che si definisce transitorio il periodo di tempo che intercorre nel passaggio, di un sistema, da uno stato energetico ad un altro, non è comunque sempre
Transitori Analisi nel dominio del tempo Ricordiamo che si definisce transitorio il periodo di tempo che intercorre nel passaggio, di un sistema, da uno stato energetico ad un altro, non è comunque sempre
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
LE FUNZIONI A DUE VARIABILI
 Capitolo I LE FUNZIONI A DUE VARIABILI In questo primo capitolo introduciamo alcune definizioni di base delle funzioni reali a due variabili reali. Nel seguito R denoterà l insieme dei numeri reali mentre
Capitolo I LE FUNZIONI A DUE VARIABILI In questo primo capitolo introduciamo alcune definizioni di base delle funzioni reali a due variabili reali. Nel seguito R denoterà l insieme dei numeri reali mentre
LE COSTANTI E LE LEGGI FISICHE DIPENDONO DAL TEMPO
 Pagina 1 di 8 LE COSTANTI E LE LEGGI FISICHE DIPENDONO DAL TEMPO Ing. Pier Franz Roggero, Dott. Michele Nardelli, P.A. Francesco Di Noto Abstract: This paper explains that all physical constants and consequently
Pagina 1 di 8 LE COSTANTI E LE LEGGI FISICHE DIPENDONO DAL TEMPO Ing. Pier Franz Roggero, Dott. Michele Nardelli, P.A. Francesco Di Noto Abstract: This paper explains that all physical constants and consequently
IL SOLE. Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%)
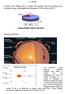 IL SOLE Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%) Struttura del Sole 0 - nel NUCLEO viene prodotta l energia emessa
IL SOLE Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%) Struttura del Sole 0 - nel NUCLEO viene prodotta l energia emessa
1 Caratteristiche dei materiali utilizzati in ottica oftalmica di Alessandro Farini 1.1 Caratteristiche ottiche dei materiali oftalmici
 1 Caratteristiche dei materiali utilizzati in ottica oftalmica di Alessandro Farini Esaminiamo in questo capitolo le principali caratteristiche dei vari materiali utilizzati nel campo dell'ottica oftalmica,
1 Caratteristiche dei materiali utilizzati in ottica oftalmica di Alessandro Farini Esaminiamo in questo capitolo le principali caratteristiche dei vari materiali utilizzati nel campo dell'ottica oftalmica,
LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1
 LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1 I CODICI 1 IL CODICE BCD 1 Somma in BCD 2 Sottrazione BCD 5 IL CODICE ECCESSO 3 20 La trasmissione delle informazioni Quarta Parte I codici Il codice BCD
LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1 I CODICI 1 IL CODICE BCD 1 Somma in BCD 2 Sottrazione BCD 5 IL CODICE ECCESSO 3 20 La trasmissione delle informazioni Quarta Parte I codici Il codice BCD
1-LA FISICA DEI CAMPI ELETTRICI E MAGNETICI.
 1-LA FISICA DEI CAMPI ELETTRICI E MAGNETICI. Tutti i fenomeni elettrici e magnetici hanno origine da cariche elettriche. Per comprendere a fondo la definizione di carica elettrica occorre risalire alla
1-LA FISICA DEI CAMPI ELETTRICI E MAGNETICI. Tutti i fenomeni elettrici e magnetici hanno origine da cariche elettriche. Per comprendere a fondo la definizione di carica elettrica occorre risalire alla
4 3 4 = 4 x 10 2 + 3 x 10 1 + 4 x 10 0 aaa 10 2 10 1 10 0
 Rappresentazione dei numeri I numeri che siamo abituati ad utilizzare sono espressi utilizzando il sistema di numerazione decimale, che si chiama così perché utilizza 0 cifre (0,,2,3,4,5,6,7,8,9). Si dice
Rappresentazione dei numeri I numeri che siamo abituati ad utilizzare sono espressi utilizzando il sistema di numerazione decimale, che si chiama così perché utilizza 0 cifre (0,,2,3,4,5,6,7,8,9). Si dice
Induzione magnetica. Corrente indotta. Corrente indotta. Esempio. Definizione di flusso magnetico INDUZIONE MAGNETICA E ONDE ELETTROMAGNETICHE
 Induzione magnetica INDUZIONE MAGNETICA E ONDE ELETTROMAGNETICHE Che cos è l induzione magnetica? Si parla di induzione magnetica quando si misura una intensità di corrente diversa da zero che attraversa
Induzione magnetica INDUZIONE MAGNETICA E ONDE ELETTROMAGNETICHE Che cos è l induzione magnetica? Si parla di induzione magnetica quando si misura una intensità di corrente diversa da zero che attraversa
Istituzioni di fisica della materia I Lezione 3. S. Solimeno lezione 3 1
 Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
GIROSCOPIO. Scopo dell esperienza: Teoria fisica. Verificare la relazione: ω p = bmg/iω
 GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
II.f. Altre attività sull euro
 Altre attività sull euro II.f È consigliabile costruire modelli in carta o cartoncino di monete e banconote, e farli usare ai bambini in varie attività di classe fin dal primo o al più dal secondo anno.
Altre attività sull euro II.f È consigliabile costruire modelli in carta o cartoncino di monete e banconote, e farli usare ai bambini in varie attività di classe fin dal primo o al più dal secondo anno.
Funzioni funzione dominio codominio legge argomento variabile indipendente variabile dipendente
 Funzioni In matematica, una funzione f da X in Y consiste in: 1. un insieme X detto dominio di f 2. un insieme Y detto codominio di f 3. una legge che ad ogni elemento x in X associa uno ed un solo elemento
Funzioni In matematica, una funzione f da X in Y consiste in: 1. un insieme X detto dominio di f 2. un insieme Y detto codominio di f 3. una legge che ad ogni elemento x in X associa uno ed un solo elemento
Natura della luce. Qualsiasi tipo di onda è caratterizzato da:
 Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR
 LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR LIMITI DEL MODELLO ATOMICO DI RUTHERFORD Il modello atomico planetario di Ernest Rutherford, seppure rappresentava un grande passo avanti rispetto al modello
LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR LIMITI DEL MODELLO ATOMICO DI RUTHERFORD Il modello atomico planetario di Ernest Rutherford, seppure rappresentava un grande passo avanti rispetto al modello
Università degli studi di Messina facoltà di Scienze mm ff nn. Progetto Lauree Scientifiche (FISICA) Prisma ottico
 Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Misureremo e analizzeremo la distribuzione di intensità luminosa di diverse figure di diffrazione in funzione della posizione acquisite on- line.
 4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
INTEGRATORE E DERIVATORE REALI
 INTEGRATORE E DERIVATORE REALI -Schemi elettrici: Integratore reale : C1 R2 vi (t) R1 vu (t) Derivatore reale : R2 vi (t) R1 C1 vu (t) Elenco componenti utilizzati : - 1 resistenza da 3,3kΩ - 1 resistenza
INTEGRATORE E DERIVATORE REALI -Schemi elettrici: Integratore reale : C1 R2 vi (t) R1 vu (t) Derivatore reale : R2 vi (t) R1 C1 vu (t) Elenco componenti utilizzati : - 1 resistenza da 3,3kΩ - 1 resistenza
Lezione 18. Magnetismo WWW.SLIDETUBE.IT
 Lezione 18 Magnetismo Cenni di magnetismo Già a Talete (600 a.c.) era noto che la magnetitite ed alcune altre pietre naturali (minerali di ferro, trovati a Magnesia in Asia Minore) avevano la proprietà
Lezione 18 Magnetismo Cenni di magnetismo Già a Talete (600 a.c.) era noto che la magnetitite ed alcune altre pietre naturali (minerali di ferro, trovati a Magnesia in Asia Minore) avevano la proprietà
QUANTIZZAZIONE diverse fasi del processo di conversione da analogico a digitale quantizzazione
 QUANTIZZAZIONE Di seguito lo schema che illustra le diverse fasi del processo di conversione da analogico a digitale. Dopo aver trattato la fase di campionamento, occupiamoci ora della quantizzazione.
QUANTIZZAZIONE Di seguito lo schema che illustra le diverse fasi del processo di conversione da analogico a digitale. Dopo aver trattato la fase di campionamento, occupiamoci ora della quantizzazione.
