STRUTTURA TERZIARIA. H 3 N + COO - β-foglietto
|
|
|
- Beatrice Bonetti
- 5 anni fa
- Visualizzazioni
Transcript
1 STRUTTURA TERZIARIA α-eliche H 3 N + COO - β-foglietto La catena polipeptidica delle proteine GLOBULARI oltre ad organizzarsi in strutture di tipo secondario va incontro ad un ulteriore ripiegamento sino ad assumere una struttura fortemente impaccata. Il ripiegamento (FOLDING) è tale che residui lontani nella struttura primaria sono avvicinati dal ripiegamento in modo da stabilire interazioni tra le loro catene R (interazioni a lungo raggio)
2 Il ripiegamento di una proteina non è mai un processo casuale Ma sempre dettato dalla sequenza amminoacidica della proteina. La catena polipeptidica assume strutture secondarie che sono avvicinate e impaccate mediante anse e curve della catena. La proteina collassa assumendo una struttura sempre più ordinata e impaccata. Assume il ripiegamento tridimensionale che garantisce la maggiore stabilità Nelson Cox, I principi di Biochimica di Lehninger, Zanichelli editore spa
3 Il ripiegamento inizia sotto la spinata dell EFFETTO IDROFOBICO: la catena polipeptidica si ripiega in modo da costringere le catene non polari ad associarsi tra loro in un CORE idrofobico da cui sono escluse le molecole d H 2 O (diminuisce l entropia del polipeptide e aumenta quella del solvente). H 2 O Durante l avvolgimento le catene laterali polari tendono ad essere spinte sulla superficie esterna della proteina, a contatto con le molecole d H 2 O della sfera di solvatazione. II processo risulta energeticamente favorito dalla formazione di numerosissime interazioni tra le catene laterali degli amminoacidi che vengono avvicinati.
4 Il modo in cui una catena proteica si avvolge dipende dal tipo di interazioni che si stabiliscono fra le catene laterali dei suoi residui amminoacidici. Una proteina, fra tutti i possibili ripiegamenti, addotta quello in cui le interazioni fra le catene R dei suoi residui sono OTTIMALI e consentono di raggiungere la maggiore stabilità (e quindi uno stato di minima energia) La proteina addotta la sua CONFORMAZIONE NATIVA. Non covalenti Interazioni idrofobiche Interazioni di van der Waals Legami idrogeno Interazioni ioniche Covalenti Ponti disolfuro Lys Tyr Asp Ser Leu 2 Cys Phe
5 Folding proteine
6 Esempi: Durante il processo di avvolgimento della catena polipeptidica più strutture secondarie riconoscibili si combinano formando i MOTIVI o STRUTTURE SUPERSECONDARIE ansa β-α-β Elica-ansa-elica es: proteine leganti calcio Barilotto β (proteine di membrana) Motivo complesso caratteristico dell α-emolisina di Staphylococcus aureus (tossina che uccide le cellule formando pori nella membrana)
7 STRUTTURA QUATERNARIA Presente in proteine costituite da 2 o più subunità, quindi da 2 o + catene polipetidiche. Le subunità (o monomeri) possono essere identiche o diverse I monomeri si associano nelle superfici di contatto per mezzo di Interazioni idrofobiche, Forze elettrostatiche, legami idrogeno, ponti disolfuro Chaperonina Emoglobina
8 Modificazioni delle proteine POST-TRADUZIONALI = avvengono dopo la sintesi proteica CO-TRADUZIONALI = avvengono durante la sintesi proteica Sono modificazioni chimiche della catena polipeptidica ad opera, generalmente (ma non sempre!) di enzimi specifici. Servono a modificare la funzione di una proteina (attivarla, inibirla, regolarla) Sono modificazioni che riguardano le ESTREMITA AMMINO- e CARBOSSI-TERMINALI o/e la CATENA LATERALE di DERMINATI RESIDUI AMMINOACIDICI che si trovano all interno di specifiche sequenze consenso o in particolari motivi strutturali. Tali modificazioni possono essere di natura covalente (ponti disolfuro, Acetilazione, Ossidazioni, Fosforilazioni, Tagli proteolitici, Glicosilazioni..) o non covalente (coniugazioni con metalli o gruppi prostetici attraverso interazioni polari o idrofobiche)
9 Modificazioni post/co-traduzionali possono coesistere nella stessa proteina generando diverse proteoforme con attività differenti. Prenilazione Glicosilazione Ponti disolfuro 2x PDI S Fosforilazione CHINASI O - P=O O - Modificata da James Hougland, Syracuse University, Department of Chemistry
10 PROTEINE FIBROSE: RUOLO STRUTTURALE Non assumono una struttura terziaria ma presentano una struttura fondamentalmente secondaria e filamentosa che si associano in strutture polimeriche. Esempi: cheratine (α-eliche appaiate con un doppio avvolgimento) >>> capelli, unghie fibroina (foglietti β) >>> fibre della seta collagene (tripla elica) >>> tendini, tessuto connettivo, matrice ossea
11 α-cheratine: ne esistono vari tipi a seconda del tipo di tessuto che costituiscono (epidermide, unghie, capelli, mucosa, tessuti di sostegno ) Alterazione permanente delle α- cheratine di tipo I dei capelli α-elica Doppia elica di 2 α-eliche α-cheratine Protofilamento: 2 doppie elica accoppiate Filamento: superavvolgimento destrogiro di 4 protofibrille
12 COLLAGENE 25%-35% delle proteine totali dei mammiferi Catene polipeptidiche elicoidali sinistrorse (NON sono α-eliche) con ~3.0 residui per giro e un passo di 0,94 nm (sono più estese di un alfaelica). Ogni elica possiede ~ 1000 residui. 3 eliche sinistrorse si avvolgono l una all altra in senso destrorso a formare una tripla elica = TROPOCOLLAGENE
13 La sequenza amminoacidica di ogni elica è costituita da ripetizioni di 3 residui: - Gly-X-Y- X = spesso Prolina Y = spesso 4-idrossi-prolina Frequentemente presenti Lisina e 5-idrossi-lisina e 3-idrossi-prolina Limitata flessibilità conformazionale, Rigidità Impossibilità a formare α-eliche Nel superavvolgimento i residui di glicina delle 3 eliche sono localizzati lungo l asse centrale della tripla elica (in rosso), dove lo stretto impaccamento non consente la presenza di altri amminoacidi
14 IDROSSILAZIONE ad opera di prolil-idrossilasi e lisil-idrossilasi che utilizzano come cofattore l ac.ascorbico, vengono introdotti gruppi OH sulle catene laterali, che servono a formare legami idrogeno nei punti di contatto delle 3 eliche del tropocollegeno. Carenza di vitamina C = Cattivo assemblaggio della tripla elica (lesioni della pelle, indebolimento vasi sanguigni) >> Scorbuto
15 Il collagene è una proteina altamente modificata: -Idrossilazioni sui residui di prolina e lisina -Ossidazione su residui di lisina -Glicosilazione sui residui di idrossi-lys -Rimozione domini N- teminali e C-terminali (Taglio di legami peptidici) -Legami crociati Focus on collagen: In vitro systems to study fibrogenesis and antifibrosis _ state of the art. Clarice ZC Chen1,2 and Michael Raghunath. 2009, Fibrogenesis & Tissue Repair 2(1):7
16 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina e emoglobina. Sostegno e mantenimento della forma cellulare = collagene, actina Lavoro meccanico = contrazione muscolare, separazione cromosomi nella mitosi, movimento flagelli. Decodificazione dell informazione genetica della cellula, traduzione, regolazione dell espressione genica. Regolazione attività biologiche in cellule e tessuti bersaglio = ormoni, recettori Funzioni di difesa dell organismo = anticorpi, tossine
STRUTTURA TERZIARIA. H 3 N + COO - β-foglietto. La catena polipeptidica delle proteine globulari oltre ad organizzarsi in
 STRUTTURA TERZIARIA α-eliche H 3 N + COO - β-foglietto La catena polipeptidica delle proteine globulari oltre ad organizzarsi in strutture di tipo secondario va incontro ad un ulteriore RIPIEGAMENTO sino
STRUTTURA TERZIARIA α-eliche H 3 N + COO - β-foglietto La catena polipeptidica delle proteine globulari oltre ad organizzarsi in strutture di tipo secondario va incontro ad un ulteriore RIPIEGAMENTO sino
Modificazioni delle proteine
 Modificazioni delle proteine POST-TRADUZIONALI = avvengono dopo la sintesi proteica CO-TRADUZIONALI = avvengono durante la sintesi proteica Sono modificazioni chimiche della catena polipeptidica ad opera,
Modificazioni delle proteine POST-TRADUZIONALI = avvengono dopo la sintesi proteica CO-TRADUZIONALI = avvengono durante la sintesi proteica Sono modificazioni chimiche della catena polipeptidica ad opera,
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
RUOLI BIOLOGICI DELLE PROTEINE. Biochimica
 RUOLI BIOLOGICI DELLE PROTEINE Biochimica Il collagene una proteina strutturale Il collagene è un componente principale di tessuti quali la pelle, i capelli, i tendini, le ossa, il cartilagine, i vasi
RUOLI BIOLOGICI DELLE PROTEINE Biochimica Il collagene una proteina strutturale Il collagene è un componente principale di tessuti quali la pelle, i capelli, i tendini, le ossa, il cartilagine, i vasi
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
COMPOSTI AZOTATI. derivanti dall ammoniaca AMMINE. desinenza -INA AMMIDE
 COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
30/10/2015 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE
 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
α-cheratine (α-elica) collageni e cheratine β-cheratine (conformazione β) M.N. Gadaleta
 Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi
 POTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,, O, N) macromolecole organiche, molecole informazionali, polimeri
POTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,, O, N) macromolecole organiche, molecole informazionali, polimeri
Proteine. Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana)
 Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Il legame peptidico è un ibrido di risonanza: scaricato da
 Il legame peptidico è un ibrido di risonanza: - O ha una parziale carica negativa - - la coppia di e - del legame C=O è parzialmente spostata verso O - N ha una parziale carica positiva + - la coppia di
Il legame peptidico è un ibrido di risonanza: - O ha una parziale carica negativa - - la coppia di e - del legame C=O è parzialmente spostata verso O - N ha una parziale carica positiva + - la coppia di
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine:
 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
Chaperonina. Emoglobina
 STRUTTURA QUATERNARIA Presente in proteine costituite da 2 o più subunità, quindi da 2 o + catene poipetidiche. Le subunità (o monomeri) possono essere identiche o diverse I monomeri si associano nee superfici
STRUTTURA QUATERNARIA Presente in proteine costituite da 2 o più subunità, quindi da 2 o + catene poipetidiche. Le subunità (o monomeri) possono essere identiche o diverse I monomeri si associano nee superfici
AMMINOACIDI. Gli amminoacidi si distinguono in base alla diversità della catena laterale R in ciascuno di essi.
 AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche
AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a:
 I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
Le Biomolecole II parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole II parte Lezioni d'autore di Giorgio Benedetti LA STRUTTURA TERZIARIA DI UNA PROTEINA La struttura tridimensionale adottata da una proteina è detta struttura terziaria. Essa prende in considerazione
Le Biomolecole II parte Lezioni d'autore di Giorgio Benedetti LA STRUTTURA TERZIARIA DI UNA PROTEINA La struttura tridimensionale adottata da una proteina è detta struttura terziaria. Essa prende in considerazione
lati esterni altamente Idrofilici
 I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
Parametri dell α-elica. residui/giro 3.6. passo dell elica
 GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
moli OH - /mole amminoacido
 ) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
Polimorfismo genetico del collageno
 COLLAGENO È la proteina più abbondante del nostro corpo costituendo il 25% delle proteine totali. È la proteina principale dei tessuti connettivi, la cui matrice extracellulare contiene anche: -proteoglicani
COLLAGENO È la proteina più abbondante del nostro corpo costituendo il 25% delle proteine totali. È la proteina principale dei tessuti connettivi, la cui matrice extracellulare contiene anche: -proteoglicani
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA
 PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
La struttura terziaria delle proteine
 La struttura terziaria delle proteine 1 La struttura terziaria L arrangiamento spaziale degli aminoacidi di una singola catena polipeptidica a formare la sua struttura tridimensionale a domini viene chiamata
La struttura terziaria delle proteine 1 La struttura terziaria L arrangiamento spaziale degli aminoacidi di una singola catena polipeptidica a formare la sua struttura tridimensionale a domini viene chiamata
LE PROTEINE DEL CONNETTIVO: IL COLLAGENO, L ELASTINA.
 UNITÀ BIOTEC. DIDATTICA DI BIOCHIMICA GENERALE LE PROTEINE DEL CONNETTIVO: IL COLLAGENO, L ELASTINA. Roberto Giacominelli Stuffler IL COLLAGENO 2 IL COLLAGENO E una famiglia di proteine fibrose con ruolo
UNITÀ BIOTEC. DIDATTICA DI BIOCHIMICA GENERALE LE PROTEINE DEL CONNETTIVO: IL COLLAGENO, L ELASTINA. Roberto Giacominelli Stuffler IL COLLAGENO 2 IL COLLAGENO E una famiglia di proteine fibrose con ruolo
Catene laterali all esterno del cilindro dell elica
 Catene aterai a esterno de ciindro de eica L INTERA ELICA È UN DIPOLO: Tutti i gruppi peptidici che si susseguono ungo eica mantengono a stessa poarità (SONO DIPOLI) δδ - Tutti i gruppi C=O sono rivoti
Catene aterai a esterno de ciindro de eica L INTERA ELICA È UN DIPOLO: Tutti i gruppi peptidici che si susseguono ungo eica mantengono a stessa poarità (SONO DIPOLI) δδ - Tutti i gruppi C=O sono rivoti
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ
Macromolecole Biologiche. La struttura secondaria (I)
 La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
FUNZIONI DELLE PROTEINE
 FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Struttura degli Amminoacidi
 Amminoacidi Struttura degli Amminoacidi Amminoacido (o α-amminoacido): molecola che possiede un gruppo amminico primario (-NH 2 ) come sostituente dell atomo di carbonio α, e un gruppo carbossilico acido
Amminoacidi Struttura degli Amminoacidi Amminoacido (o α-amminoacido): molecola che possiede un gruppo amminico primario (-NH 2 ) come sostituente dell atomo di carbonio α, e un gruppo carbossilico acido
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
LIVELLI DI STRUTTURA DELLE PROTEINE
 FUNZIONI E STRUTTURA DELLE PROTEINE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 LIVELLI
FUNZIONI E STRUTTURA DELLE PROTEINE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 LIVELLI
Diagramma di Ramachandran
 Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE
 STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
30/10/2015. Molte proteine sono. intrinsecamente disordinate. o destrutturate (IDP/IUP), cioè non hanno una struttura
 Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
IL COLLAGENO. E la specie proteica più abbondante nella maggior parte dei vertebrati, in tutti gli organi è presente la molecola di collageno.
 IL COLLAGENO E la specie proteica più abbondante nella maggior parte dei vertebrati, in tutti gli organi è presente la molecola di collageno. Fibre di collageno formano la matrice dell osso su cui precipitano
IL COLLAGENO E la specie proteica più abbondante nella maggior parte dei vertebrati, in tutti gli organi è presente la molecola di collageno. Fibre di collageno formano la matrice dell osso su cui precipitano
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
CLASSIFICAZIONE DEI PEPTIDI
 terminale). PEPTIDI Gli amminoacidi si legano tra di loro attraverso una reazione che coinvolge COOH di un amminoacido e NH 2 di un altro amminoacido, con la liberazione di una molecola di acqua per ogni
terminale). PEPTIDI Gli amminoacidi si legano tra di loro attraverso una reazione che coinvolge COOH di un amminoacido e NH 2 di un altro amminoacido, con la liberazione di una molecola di acqua per ogni
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
La struttura delle proteine viene suddivisa in quattro livelli di organizzazione:
 Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
Schemi delle lezioni 1
 Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Il legame peptidico è polare
 Scaricato da Il legame peptidico è polare SONO FAVORITE QUELLE CONFIGURAZIONI CHE CONSENTONO IL MAGGIOR NUMERO DI INTERAZIONI TRA LE PARTI DELLA CATENA POLIPEPTIDICA. A CAUSA DELLA POLARITA' DEL LEGAME
Scaricato da Il legame peptidico è polare SONO FAVORITE QUELLE CONFIGURAZIONI CHE CONSENTONO IL MAGGIOR NUMERO DI INTERAZIONI TRA LE PARTI DELLA CATENA POLIPEPTIDICA. A CAUSA DELLA POLARITA' DEL LEGAME
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH
 Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
La chimica della pelle
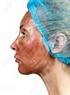 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ
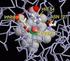 Scaricato da Le proteine con peso molecolare superiore a 50.000 sono OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ SunHope.it 1 Scaricato da Le proteine oligomeriche
Scaricato da Le proteine con peso molecolare superiore a 50.000 sono OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ SunHope.it 1 Scaricato da Le proteine oligomeriche
Protidi. Protidi 16/01/2019
 Protidi I protidi sono macromolecole costituite dall unione di amminoacidi tra loro. I protidi, a seconda del numero di amminoacidi che li costituiscono, sono distinti in: oligopeptidi, formati da pochi
Protidi I protidi sono macromolecole costituite dall unione di amminoacidi tra loro. I protidi, a seconda del numero di amminoacidi che li costituiscono, sono distinti in: oligopeptidi, formati da pochi
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Modulo 2. Struttura e funzione delle proteine
 Modulo 2 Struttura e funzione delle proteine Le proteine e i suoi costituenti Macromolecole più abbondanti e varie delle cellule - sbalorditiva diversità Ruolo primario nelle cellule e nell organismo (da
Modulo 2 Struttura e funzione delle proteine Le proteine e i suoi costituenti Macromolecole più abbondanti e varie delle cellule - sbalorditiva diversità Ruolo primario nelle cellule e nell organismo (da
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOACIDI
 LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Il gruppo peptidico ha una struttura rigida e planare, dovuta al parziale. legame peptidico. O O - N N + H H
 Il legame peptidico Il gruppo peptidico ha una struttura rigida e planare, dovuta al parziale (~40 %) carattere di doppio legame del legame peptidico. O O - C C N N + H H Il legame peptidico pp Il legame
Il legame peptidico Il gruppo peptidico ha una struttura rigida e planare, dovuta al parziale (~40 %) carattere di doppio legame del legame peptidico. O O - C C N N + H H Il legame peptidico pp Il legame
STRUTTURA E FUNZIONE DELLE
 STRUTTURA E FUNZIONE DELLE PROTEINE Compongono la STRUTTURA della cellula ma hanno anche altre FUNZIONI intelaiatura citoscheletrica strutture cellulari (organelli) impalcatura di sostegno extracellulare
STRUTTURA E FUNZIONE DELLE PROTEINE Compongono la STRUTTURA della cellula ma hanno anche altre FUNZIONI intelaiatura citoscheletrica strutture cellulari (organelli) impalcatura di sostegno extracellulare
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 9
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 9 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 9 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Proteine ed acidi nucleici
 Proteine ed acidi nucleici Prof.ssa Flavia Frabetti aa. 2010-11 PRTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,,,
Proteine ed acidi nucleici Prof.ssa Flavia Frabetti aa. 2010-11 PRTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,,,
 COMPOSIZIONE: - Semplici - Coniugate: Apolipoproteine Glicoproteine Nucleoproteine Metalloproteine Cromoproteine STRUTTURA: - Fibrose forma molecolare allungata struttura II - Globulari: forma molecolare
COMPOSIZIONE: - Semplici - Coniugate: Apolipoproteine Glicoproteine Nucleoproteine Metalloproteine Cromoproteine STRUTTURA: - Fibrose forma molecolare allungata struttura II - Globulari: forma molecolare
Il carbonio è l elemento di base delle biomolecole. Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici.
 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 6
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 11
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 11 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 11 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Macromolecole Biologiche. La struttura secondaria (II)
 La struttura secondaria (II) Nello stesso anno (1951) in cui proposero l α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo l α elica,
La struttura secondaria (II) Nello stesso anno (1951) in cui proposero l α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo l α elica,
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
LE MEMBRANE CELLULARI
 LE MEMBRANE CELLULARI Sono strutture sovramolecolari che racchiudono e delimitano l ambiente intracellulare e negli eucarioti anche gli organuli citoplasmatici. Hanno funzione di Protezione. Sostegno.
LE MEMBRANE CELLULARI Sono strutture sovramolecolari che racchiudono e delimitano l ambiente intracellulare e negli eucarioti anche gli organuli citoplasmatici. Hanno funzione di Protezione. Sostegno.
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
