Quesiti e problemi (sul libro da pag. 189)
|
|
|
- Margherita Carrara
- 8 anni fa
- Visualizzazioni
Transcript
1 Quesiti e problemi (sul libro da pag. 189) 1 La doppia natura della luce 1 Qual è la prova più evidente della natura ondulatoria della luce? la diffrazione 2 Come sono chiamate le particelle che costituiscono la luce secondo la teoria corpuscolare? fotoni 3 Qual è il rapporto che lega la frequenza e la lunghezza d onda della luce? ν = c/λ 4 Un bagnante seduto sulla spiaggia per divertimento si mette a contare le onde che si infrangono sul- la battigia. Se ne conta 12 in un minuto, quale proprietà delle onde marine sta valutando? la frequenza Dopo qualche ora ripete la stessa osservazione e ne arriva a contare 20 in un minuto. Che cosa è cambiato nel moto ondoso? è aumentata la frequenza 5 Una radiazione monocromatica (cioè di un solo colore) è costituita da fotoni che hanno una lunghezza d onda λ 450 nm. Riferendoti allo spettro elettromagnetico (figura 8.1), individua il colore e calcola l energia associata a ogni fotone di questa radiazione. azzurro; E = 4, J 6 In una stanza buia, basta che ci sia un sottilissimo spiraglio di luce perché essa venga illuminata interamente. Quale fenomeno tipico della luce può giustificare ciò? la diffrazione 7 Tutti i fenomeni ondulatori sono caratterizzati dal trasporto di energia. Prova a trovare esempi al riguardo nel caso di onde marine, onde sismiche, onde sonore, onde elettromagnetiche. 8 Il processo di fotosintesi è possibile grazie all energia solare. I pigmenti fotosintetici captano i fotoni luminosi e convertono la loro energia in energia chimica. I fotoni assorbiti sono soprattutto quelli rossi (λ 680 nm) e quelli blu (λ 440 nm), mentre i fotoni verdi non vengono quasi per niente assorbiti. Calcola l energia trasportata da ogni fotone rosso e blu. E rossi = 2, J; E blu = 4, J Sai giustificare il colore verde delle foglie? 2 La «luce» degli atomi 9 Qual è la differenza fra uno spettro continuo e uno spettro a righe? 10 Come vengono ottenuti gli spettri di emissione e di assorbimento dei gas rarefatti? 11 In che cosa differiscono le righe di assorbimento e quelle di emissione di uno stesso gas? coincidono 3 L atomo di Bohr 12 Che cosa si intende con il termine «quantizzazione»? Prova a descrivere questo termine con paro- le tue, utilizzando dei sinonimi. 13 Tra gli esempi riportati, stabilisci quali siano quantizzati e quali no, discutendo le tue risposte in classe: a) scambio di denaro b) acqua che scorre dal rubinetto c) latte in tetrabrick d) marmellata prelevata con un cucchiaino dal barattolo e) tempo che scorre f) costituenti della materia sono quantizzati: a); c); d); f) 14 Il raggio delle orbite dell atomo di Bohr può essere calcolato con la formula generalizzata r n 53 n 2 r n è il raggio calcolato in picometri (1 pm m), n è un numero (numero quantico principale) che può assumere i valori da 1 a 7. Calcola i raggi delle sette orbite permesse dell atomo di Bohr. r 1 = 53 pm; r 2 = 212 pm; r 3 = 477 pm; r 4 = 848 pm; r 5 = 1325 pm; r 6 = 1908 pm; r 7 = 2597 pm 15 L energia associata a ogni orbita dell atomo di Bohr può essere calcolata con la seguente formula generale: E n K/n 2 E n rappresenta l energia (in joule) del livello considerato, K è una costante che vale K 2, e n è un numero (numero quantico principale) che può assumere i valori dei numeri naturali, da 1 a 7. Calcola i valori delle energie di tutte le orbite dell atomo di idrogeno. E 1 = 2, J; E 2 = 5, J; E 3 = 2, J; E 4 = 1, J; E 5 = 8, J; E 6 = 6, J; E 7 = 4, J 16 Considera le dimensioni e le energie delle orbite che hai calcolato nei due esercizi precedenti. Che cosa noti al crescere di n per quanto riguarda le dimensioni delle orbite? il raggio atomico aumenta 1
2 Che cosa noti per quanto riguarda l energia a esse associata? l energia aumenta Sapresti spiegare il segno algebrico negativo davanti alla formula usata per trovare l energia? 4 La doppia natura dell elettrone 17 Che cosa sono le onde di de Broglie? 18 In che modo è stata verificata sperimentalmente l ipotesi di de Broglie? 19 Il microscopio elettronico permette di osservare oggetti con un ingrandimento molto superiore al normale microscopio ottico. Il microscopio elettronico utilizza un fascio di elettroni che subisce fenomeni di diffrazione e di interferenza. Quale proprietà dell elettrone permette di spiegare questo tipo di comportamento? L elettrone si comporta come un onda di de Broglie 20 Il vento solare è un flusso di particelle proveniente dalle regioni più esterne del Sole e che investe tutto lo spazio interplanetario, compresa la Terra. È costituito da elettroni, protoni e altre particelle elettricamente cariche che si muovono ad una velocità molto elevata, oltre 500 km/s. Usando la formula di de Broglie sull onda di materia, calcola la lunghezza d onda associata a ogni elettrone del vento solare. λ = 1, m 21 L aereo più veloce fino a ora costruito è un jet ipersonico che riesce a volare a Mach 10, quindi 10 vol- te più velocemente rispetto al suono (nell aria circa 330 m/s) e con una massa di circa kg. Quale lunghezza d onda è associata all aereo quando è in volo? λ = 4, m Quali considerazioni puoi fare sulle lunghezze d onda associate a oggetti macroscopici? 22 Quale dovrebbe essere la velocità di un corpo di massa pari a 50 kg affinché la lunghezza d onda dell onda di materia (onda di de Broglie) a esso associata fosse quella di una radiazione luminosa di colore rosso (λ 700 nm)? Esegui il calcolo e commenta il risultato. ν = 1, m/s 6 L equazione d onda 26 Che cosa si intende per onda stazionaria? 27 Che cosa è la funzione d onda? 28 Che significato assume ψ2? 29 In che senso le onde di de Broglie possono essere definite «onde di probabilità»? 7 Numeri quantici e orbitali 30 Scrivi la definizione di orbitale. 31 Descrivi il significato di ciascuno dei quattro numeri quantici. 32 Scrivi tutti i valori che possono assumere l e m quando n 3. l = 0, 1, 2; m = 0, 1, + 1, 2, Abbina alle seguenti terne di numeri quantici il rispettivo orbitale a) n 2 l 0 m 0 2s b) n 6 l 2 m 1 6d c) n 4 l 3 m 3 4f d) n 3 l 2 m +2 3d 34 Individua gli eventuali errori presenti nei seguenti gruppi di numeri quantici. a) n 2 l 2 m 0 m s +1/2 b) n 1 l 0 m 2 m s ±1/2 c) n 3 l 2 m 0 m s 1/2 d) n 0 l 0 m 0 m s +1 8 Dall orbitale alla forma dell atomo 35 Che cosa si intende per superficie di contorno? 36 Da quali numeri quantici sono determinati la forma e il volume delle superfici di contorno? l (la forma); n (il volume) 37 Quali sono le forme delle superfici di contorno degli orbitali s, p e d? 2 5 L elettrone e la meccanica quantistica 23 Che cosa si intende con il termine «meccanica quantistica»? 24 Che cosa afferma il principio di indeterminazione di Heisenberg? 25 Perché, alla luce di quanto enunciato dal principio di indeterminazione, non ha senso parlare di orbita di un elettrone? 9 L atomo di idrogeno secondo la meccanica quantistica 38 In che modo si ottiene l insieme degli orbitali che corrispondono agli stati quantici dell atomo di idrogeno? dalla risoluzione dell equazione d onda 39 Da che cosa dipende lo stato energetico nell atomo di idrogeno? dal numero quantico n
3 10 La configurazione degli atomi polielettronici 40 Spiega la regola di Hund e il principio di esclusione di Pauli. 41 Quali sono le regole per il corretto riempimento degli orbitali? 42 Spiega le irregolarità di riempimento degli orbitali che si verificano a partire dagli elementi con Z Quali delle seguenti non possono essere parti di configurazioni elettroniche? Individua gli errori e spiegali. a) 2s 2 b ) 2d 5 ) c 3f 10 d ) 5s 3 e) 8s 1 f) 6d 5 44 Individua gli eventuali errori nelle seguenti configurazioni, spiegando perché non sono corrette. a) 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6s 2 4f 10 5d 10 6p 2 corretta/errata perché il livello 4f non è completo b) 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 c) 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6s 2 4f 14 5d 10 6p 4 d) 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 4p 6 4d 10 5s 2 corretta/errata perché il livello 3d non è completo e) 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2 6p 6 7s 2 45 Date le seguenti configurazioni elettroniche, determina il numero atomico Z e il nome dell ele- mento di cui sono caratteristiche. a) 2 2s 2 2p 3 Z = 7; azoto b) 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 Z = 25; manganese c) 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4 Z = 34; selenio d) 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 2 Z = 50; stagno e) 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6s 1 Z = 55; cesio 46 Nelle seguenti configurazioni totali individua gli elettroni di valenza, sottolineandoli, e attribuisci all elemento il gruppo e il periodo di appartenenza. Individua gli elementi sulla tavola periodica. a) 2 2s 2 2p 2 gruppo 14; periodo 2; carbonio b) 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 gruppo 3; periodo 4; scandio c) 2 2s 2 2p 6 3s 2 3p 5 gruppo 17; periodo 3; cloro d) 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 2 gruppo 14; periodo 5; stagno e) 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2 6p 2 gruppo 14; periodo 6; piombo 47 Completa la tabella, inserendo i dati mancanti. atomico neutroni massa Simbolo isotopo Z = 31 N 38 A Ga 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1 Configurazione elettronica Z 53 N 74 A = I 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 Z 13 N = 14 A Al 2 2s 2 2p 6 3s 2 3p 1 Z = 21 N 24 A Sc 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 Z = 15 N 16 A P 2 2s 2 2p 6 3s 2 3p 3 Z = 11 N = 12 A = Na 2 2s 2 2p 6 3s 1 Z = 19 N = 21 A K 2 2s 2 2p 6 3s 2 3p 6 4s 1 Z = 23 N 28 A = V 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 48 Individua i seguenti elementi, di cui viene fornito il numero atomico Z. Scrivi poi la configurazione elettronica completa e rappresenta l ordine di riempimento degli orbitali. a) Z 13 b) Z 31 c) Z 52 d) Z 29 e) Z 41 f) Z 58 a) Al: 2 2s 2 2p 6 3s 2 3p 1 b) Ga: 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1 c) Te: 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 4 d) Cu: 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 e) Nb: 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 4 5s 1 f) Ce: 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 1 5s 2 5p 6 5d 1 6s 2 49 Individua tra le seguenti configurazioni esterne quelle di stato fondamentale e quelle di stato eccitato. a) 4s 2 3d 9 4p 1 stato eccitato b) 4s 2 3d 10 4p 5 5s 1 stato eccitato 3
4 c) 4s 2 3d 10 4p 6 5s 0 4d 2 stato eccitato d) 4s 2 3d 10 4p 1 stato fondamentale e) 4s 2 3d 10 4p 5 stato fondamentale f) 4s 1 3d 9 4p 1 stato eccitato 50 Quale elemento presenta la seguente configurazione elettronica? 2s 2p neon (Ne) 51 Quale elemento presenta la seguente configurazione elettronica? 2s 2p azoto (N) 52 Scrivi la configurazione elettronica e rappresenta l ordine di riempimento degli orbitali di ossigeno, zolfo e selenio. Che cosa hanno in comune le configurazioni elettroniche di questi elementi? O: 2 2s 2 2p 4 2s 2p S: 2 2s 2 2p 6 3s 2 3p 4 2s 2p 3s 3p Se: 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4 3s 4s 2s 3p 4p 2p 3d nello strato esterno sono tutte ns 2 np 4 53 Scrivi la configurazione elettronica e rappresenta l ordine di riempimento degli orbitali di quattro elementi aventi numero atomico tra 10 e Scrivi la configurazione elettronica dell ittrio Y (Z 39) tenendo conto delle irregolarità nell ordine di riempimento degli orbitali. 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 1 55 Scrivi le configurazioni elettroniche dei seguenti ioni. a) Be 2 2 b) S 2 2 2s 2 2p 6 3s 2 3p 6 c) Na 2 2s 2 2p 6 d) Al 3 2 2s 2 2p 6 Review (sul libro da pag. 192) 1 Lo ione sodio colora la fiamma di una caratteristica e intensa luce giallo-arancione con lunghezza d onda λ 589 nm. Calcola la frequenza della radiazione. ν = 5, Hz Qual è l energia associata a una mole di fotoni con la frequenza della luce del sodio? E = 204 Kj/mol 2 Per rompere i legami di una mole di Cl 2 sono necessari 243,4 kj di energia. Puoi rompere i legami irraggiando il gas con una luce di lunghezza d onda opportuna. Qual è la lunghezza d onda della radiazione? λ = 492 nm In quale zona dello spettro si trova? verde 3 Scrivi la configurazione elettronica degli ioni K, O 2 e Hf 4. K + : 2 2s 2 2p 6 3s 2 3p 6 O 2 : 2 2s 2 2p 6 Hf 4+ : 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 4 Due elementi allo stato ionico presentano la stessa configurazione elettronica 2 2s 2 2p 6. Un ele- mento allo stato ionico assume carica 2 mentre l altro carica 3. Indica il nome dei due elementi. ossigeno (O) e alluminio (Al) 5 Qual è il numero di elettroni contenuti in 30 g di ioni Cu 2? 7, Nella corona solare vi sono atomi di ferro ionizzati 13 volte. Che cosa puoi dire circa l energia di questa regione del Sole? Prova a risalire, studiando la configurazione elettronica totale di questo elemento, al livello che viene intaccato con questa ionizzazione. il terzo livello 7 Uno degli strumenti più potenti per lo studio della natura fisica e chimica degli oggetti più lontani del cosmo (stelle, galassie e nebulose) è la loro analisi 4
5 spettrale. Per lo studio del Sole è molto importante la cosiddetta riga H-alfa dello spettro dell idrogeno, con lunghezza d onda pari a λ 656,28 nm. Calcola l energia del fotone emesso dall atomo di idrogeno che porta alla produzione di questa riga e stabilisci la banda dello spettro a cui appartiene. E = 3, J; visibile - riga rossa A quale salto elettronico è dovuta la riga? dal livello 2 al livello 3 8 Le righe spettrali non sempre sono dovute a salti elettronici tra orbitali; per esempio, la cosiddetta «riga a 21 cm» emessa dalle nebulose, oggetti gassosi costituiti soprattutto da idrogeno atomico, è dovuta all inversione di spin del suo elettrone rispetto al protone. Essa viene captata con uno strumento molto particolare: il radiotelescopio. Calcola l energia associata a questa riga. E = 9, J In quale banda dello spettro si trova? microonde Write the electron configuration for an atom that has 17 electrons. 2 2s 2 2p 6 3s 2 3p 5 Write the electron configuration for nickel, whose atomic number is 28. Remember that the 4s orbital has lower energy than the 3d orbital does and that the d sublevel can hold a maximum of 10 electrons. 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 2 How many orbitals are completely filled in an atom of an element whose atomic number is 18? 9 Use the Pauli exclusion principle, the Ausbau principle or the Hund rule to explain why the following electron configurations are incorrect. a) 2 2s 3 2p 6 3s 1 b) 2 2s 2 2p 5 3s 1 Write the correct configurations. a) 2 2s 2 2p 6 3s 2 b) 2 2s 2 2p Calculate the maximum number of electrons that can occupy the third energy level orbitals. 18 «An empty orbital is not like an empty box. An empty box can be seen. So can the contents of the box when the box is filled. An orbital cannot be seen, whether it is empty or not. However, when an orbital is occupied, the electron density as given by the square of the wave function describing the orbital can be seen.» (M. I. Winter, Chemical Bonding, Oxford Science Publications.) Traduci il brano e commentalo. Prova a pensare a uno sciame di moscerini, oppure a un elica di aeroplano in rapidissima rotazione: puoi trovare analogie e differenze con la situazione di un orbitale occupato oppure vuoto? INVESTIGARE INSIEME L insegnante ti consegna un paio di occhiali di sicurezza, un bunsen, una bacchetta di vetro con filo metallico al nichel-cromo e tre polveri (cloruro di sodio, NaCl; cloruro di bario, BaCl 2 ; cloruro di calcio, CaCl 2 ). Descrivi la procedura per identificare le tre polveri. Quale colore assume la fiamma per ciascuna polvere analizzata? Il colore della fiamma è dovuto all atomo del metallo oppure del cloro? Puoi spiegare cosa accade, a livello atomico, quando la fiamma assume un determinato colore? 5
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Da Newton a Planck. La struttura dell atomo. Da Newton a Planck. Da Newton a Planck. Meccanica classica (Newton): insieme
 Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Struttura Elettronica degli Atomi
 Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
IL MODELLO ATOMICO DI BOHR
 IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
INDIRIZZO TECNOLOGICO CLASSE A033 n. 2
 INDIRIZZO TECNOLOGICO CLASSE A033 n. 2 1) La tensione di rete domestica è in Italia di 230 V. In una stanza è accesa una lampada di 100W, in un altra stanza una lampada di 200W. L intensità di corrente
INDIRIZZO TECNOLOGICO CLASSE A033 n. 2 1) La tensione di rete domestica è in Italia di 230 V. In una stanza è accesa una lampada di 100W, in un altra stanza una lampada di 200W. L intensità di corrente
Un altro importante parametro di questo processo è la risoluzione che rappresenta la distanza minima che la litografia può apprezzare.
 TECNICHE LITOGRAFICHE La litografia è un processo basilare nella realizzazione di circuiti integrati,esso consiste nel depositare un materiale detto resist sul wafer da processare che una volta esposto
TECNICHE LITOGRAFICHE La litografia è un processo basilare nella realizzazione di circuiti integrati,esso consiste nel depositare un materiale detto resist sul wafer da processare che una volta esposto
Gli orbitali: modello atomico probabilistico
 1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
L osservazione in luce bianca è, per così dire, l osservazione del Sole al naturale ovviamente dopo averne attenuato la fortissima emissione di luce.
 L osservazione in luce bianca è, per così dire, l osservazione del Sole al naturale ovviamente dopo averne attenuato la fortissima emissione di luce. Questa attenuazione si ottiene mediante l uso di un
L osservazione in luce bianca è, per così dire, l osservazione del Sole al naturale ovviamente dopo averne attenuato la fortissima emissione di luce. Questa attenuazione si ottiene mediante l uso di un
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.6 ENERGIE DI IONIZZAZIONE E DISTRIBUZIONE DEGLI ELETTRONI 4.C OBIETTIVI
 LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
I COLORI DEL CIELO: COME SI FORMANO LE IMMAGINI ASTRONOMICHE
 I COLORI DEL CIELO: COME SI FORMANO LE IMMAGINI ASTRONOMICHE Nell ultima notte di osservazione abbiamo visto bellissime immagini della Galassia, delle sue stelle e delle nubi di gas che la compongono.
I COLORI DEL CIELO: COME SI FORMANO LE IMMAGINI ASTRONOMICHE Nell ultima notte di osservazione abbiamo visto bellissime immagini della Galassia, delle sue stelle e delle nubi di gas che la compongono.
Na (T 1/2 =15 h), che a sua volta decade β - in 24 12
 Esercizio 1 Il 24 10 Ne (T 1/2 =3.38 min) decade β - in 24 11 Na (T 1/2 =15 h), che a sua volta decade β - in 24 12 Mg. Dire quali livelli sono raggiungibili dal decadimento beta e indicare lo schema di
Esercizio 1 Il 24 10 Ne (T 1/2 =3.38 min) decade β - in 24 11 Na (T 1/2 =15 h), che a sua volta decade β - in 24 12 Mg. Dire quali livelli sono raggiungibili dal decadimento beta e indicare lo schema di
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
May 5, 2013. Fisica Quantistica. Monica Sambo. Sommario
 May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
Elettricità e magnetismo
 E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
Capitolo 4 Le spettroscopie. 1. Lo spettro elettromagnetico
 Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione
 Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione 1. L elettrone ha una massa di 9.1 10-31 kg ed una carica elettrica di -1.6 10-19 C. Ricordando che la forza gravitazionale
Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione 1. L elettrone ha una massa di 9.1 10-31 kg ed una carica elettrica di -1.6 10-19 C. Ricordando che la forza gravitazionale
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
LA TERMOGRAFIA SPETTRO ONDE ELETTROMAGNETICHE
 SPETTRO ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è un mezzo di trasmissione dell energia sotto forma di onde aventi entrambe le componenti elettriche e magnetiche. La sequenza ordinata delle
SPETTRO ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è un mezzo di trasmissione dell energia sotto forma di onde aventi entrambe le componenti elettriche e magnetiche. La sequenza ordinata delle
Fisica II - CdL Chimica. La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche
 La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche La natura della luce Teoria corpuscolare (Newton) Teoria ondulatoria: proposta già al tempo di Newton, ma scartata perchè
La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche La natura della luce Teoria corpuscolare (Newton) Teoria ondulatoria: proposta già al tempo di Newton, ma scartata perchè
Classificazione della materia: Sostanze pure e miscugli
 Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Università degli studi di Messina facoltà di Scienze mm ff nn. Progetto Lauree Scientifiche (FISICA) Prisma ottico
 Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Il fotone. Emanuele Pugliese, Lorenzo Santi URDF Udine
 Il fotone Emanuele Pugliese, Lorenzo Santi URDF Udine Interpretazione di Einstein dell effetto fotoelettrico Esistono «particelle»* di luce: i fotoni! La luce è composta da quantità indivisibili di energia
Il fotone Emanuele Pugliese, Lorenzo Santi URDF Udine Interpretazione di Einstein dell effetto fotoelettrico Esistono «particelle»* di luce: i fotoni! La luce è composta da quantità indivisibili di energia
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
IL FOTOVOLTAICO E L ARCHITETTURA
 IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
Natura della luce. Qualsiasi tipo di onda è caratterizzato da:
 Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Gruppo di Lavoro Scienze
 Gruppo di Lavoro Scienze Brainstorming a) acido ascorbico titolazioni b) acidità nei vari distretti dell apparato digerente c) zuccheri nelle bibite d) comportamento delle rocce e) meteorologia: guarda
Gruppo di Lavoro Scienze Brainstorming a) acido ascorbico titolazioni b) acidità nei vari distretti dell apparato digerente c) zuccheri nelle bibite d) comportamento delle rocce e) meteorologia: guarda
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose.
 Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Misureremo e analizzeremo la distribuzione di intensità luminosa di diverse figure di diffrazione in funzione della posizione acquisite on- line.
 4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
LE PARTICELLE ELEMENTARI: loro scoperta
 LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
Tesina di scienze. L Elettricità. Le forze elettriche
 Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Dai colori alle stelle: un excursus tra Fisica e Ottica
 Dai colori alle stelle: un excursus tra Fisica e Ottica Martina Giordani Facoltà di Scienze matematiche, fisiche e naturali Corso di Laurea in Ottica e Optometria Federica Ricci Facoltà di Scienze matematiche,
Dai colori alle stelle: un excursus tra Fisica e Ottica Martina Giordani Facoltà di Scienze matematiche, fisiche e naturali Corso di Laurea in Ottica e Optometria Federica Ricci Facoltà di Scienze matematiche,
Applicazioni tecnologiche del campo magnetico
 A.S. 2014/2015 Definizione Motore elettrico Definizione Definizione Un motore elettrico è uno strumento che ha l obiettivo di trasformare il lavoro di tipo elettrico in lavoro di tipo meccanico. Definizione
A.S. 2014/2015 Definizione Motore elettrico Definizione Definizione Un motore elettrico è uno strumento che ha l obiettivo di trasformare il lavoro di tipo elettrico in lavoro di tipo meccanico. Definizione
10) Se ad una soluzione aumentiamo la temperatura cosa succede? Dire quale delle seguenti affermazioni è corretta.
 Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: mail@antoniotucci.net - www.agora.lesina.org
Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: mail@antoniotucci.net - www.agora.lesina.org
RADIAZIONI RADIAZIONI IONIZZANTI RADIAZIONI IONIZZANTI
 RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
Queste note non vogliono essere esaustive, ma solo servire come linee guida per le lezioni
 Alessandro Farini: note per le lezioni di ottica del sistema visivo Queste note non vogliono essere esaustive, ma solo servire come linee guida per le lezioni 1 Lo spettro elettromagnetico La radiazione
Alessandro Farini: note per le lezioni di ottica del sistema visivo Queste note non vogliono essere esaustive, ma solo servire come linee guida per le lezioni 1 Lo spettro elettromagnetico La radiazione
Laboratorio di Fisica 3 Ottica 2. Studenti: Buoni - Giambastiani - Leidi Gruppo: G09
 Laboratorio di Fisica 3 Ottica 2 Studenti: Buoni - Giambastiani - Leidi Gruppo: G09 24 febbraio 2015 1 Lunghezza d onda di un laser He-Ne 1.1 Scopo dell esperienza Lo scopo dell esperienza è quello di
Laboratorio di Fisica 3 Ottica 2 Studenti: Buoni - Giambastiani - Leidi Gruppo: G09 24 febbraio 2015 1 Lunghezza d onda di un laser He-Ne 1.1 Scopo dell esperienza Lo scopo dell esperienza è quello di
Quali conoscenze di base per comprendere l'innovazione?
 Quali conoscenze di base per comprendere l'innovazione? 2006-2015: dieci anni di SPAIS 2015 Anno internazionale della luce e delle tecnologie basate sulla luce IX Edizione Il Sole. La nostra stella e/è
Quali conoscenze di base per comprendere l'innovazione? 2006-2015: dieci anni di SPAIS 2015 Anno internazionale della luce e delle tecnologie basate sulla luce IX Edizione Il Sole. La nostra stella e/è
Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM
 Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM Docente : Macaluso Maria Annunziata Classe : 2^ sez.a B - C Indirizzo AM Materia di insegnamento : Scienze Integrate (CHIMICA) Libro di testo
Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM Docente : Macaluso Maria Annunziata Classe : 2^ sez.a B - C Indirizzo AM Materia di insegnamento : Scienze Integrate (CHIMICA) Libro di testo
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
quale agisce una forza e viceversa. situazioni. applicate a due corpi che interagiscono. Determinare la forza centripeta di un
 CLASSE Seconda DISCIPLINA Fisica ORE SETTIMANALI 3 TIPO DI PROVA PER GIUDIZIO SOSPESO Test a risposta multipla MODULO U.D Conoscenze Abilità Competenze Enunciato del primo principio della Calcolare l accelerazione
CLASSE Seconda DISCIPLINA Fisica ORE SETTIMANALI 3 TIPO DI PROVA PER GIUDIZIO SOSPESO Test a risposta multipla MODULO U.D Conoscenze Abilità Competenze Enunciato del primo principio della Calcolare l accelerazione
I.P.S.I.A. Di BOCCHIGLIERO. ---- Fotoemettitori e Fotorivelatori ---- Materia: Telecomunicazioni. prof. Ing. Zumpano Luigi. Filippelli Maria Fortunata
 I..S.I.A. Di BOCCHIGLIERO a.s. 2010/2011 -classe III- Materia: Telecomunicazioni ---- Fotoemettitori e Fotorivelatori ---- alunna Filippelli Maria Fortunata prof. Ing. Zumpano Luigi Fotoemettitori e fotorivelatori
I..S.I.A. Di BOCCHIGLIERO a.s. 2010/2011 -classe III- Materia: Telecomunicazioni ---- Fotoemettitori e Fotorivelatori ---- alunna Filippelli Maria Fortunata prof. Ing. Zumpano Luigi Fotoemettitori e fotorivelatori
Radiazione elettromagnetica
 Radiazione elettromagnetica Un onda e.m. e un onda trasversa cioe si propaga in direzione ortogonale alle perturbazioni ( campo elettrico e magnetico) che l hanno generata. Nel vuoto la velocita di propagazione
Radiazione elettromagnetica Un onda e.m. e un onda trasversa cioe si propaga in direzione ortogonale alle perturbazioni ( campo elettrico e magnetico) che l hanno generata. Nel vuoto la velocita di propagazione
INDICAZIONI ED ESERCIZI PER LA PREPARAZIONE ALLA PROVA DI VERIFICA DI SETTEMBRE SCIENZE INTEGRATE (CHIMICA)
 ISTITUTO DI ISTRUZIONE SUPERIORE CHINO CHINI Via Pietro Caiani 68-50032 Borgo San Lorenzo (Fi) Tel. 055.8459.268 - Fax 055.8495.131 Sito Web: www.chinochini.it - E-mail: chinochini@tin.it - PEC FIIS02300N@PEC.ISTRUZIONE.IT
ISTITUTO DI ISTRUZIONE SUPERIORE CHINO CHINI Via Pietro Caiani 68-50032 Borgo San Lorenzo (Fi) Tel. 055.8459.268 - Fax 055.8495.131 Sito Web: www.chinochini.it - E-mail: chinochini@tin.it - PEC FIIS02300N@PEC.ISTRUZIONE.IT
Polimeri semiconduttori negli OLED
 Polimeri semiconduttori negli OLED Nella figura viene mostrato uno schema di funzionamento di un Organic Light Emitting Diode (OLED). Il catodo e formato da un elettrodo di Alluminio (Magnesio o Calcio)
Polimeri semiconduttori negli OLED Nella figura viene mostrato uno schema di funzionamento di un Organic Light Emitting Diode (OLED). Il catodo e formato da un elettrodo di Alluminio (Magnesio o Calcio)
ENERGIA NELLE REAZIONI CHIMICHE
 ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
S- magari si potrebbe dire la prima riga, la seconda riga UNITÀ DIDATTICA: TESTO POETICO. Obiettivi
 UNITÀ DIDATTICA: TESTO POETICO Obiettivi - Confrontare due testi poetici - Trovare le differenze e le somiglianze - Osservare le differenze e coglierne le caratteristiche. ATTIVITÀ L argomento presentato
UNITÀ DIDATTICA: TESTO POETICO Obiettivi - Confrontare due testi poetici - Trovare le differenze e le somiglianze - Osservare le differenze e coglierne le caratteristiche. ATTIVITÀ L argomento presentato
Gas perfetti e sue variabili
 Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI
 Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail danidvd@hotmail.it daniela.devita@uniroma1.it
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail danidvd@hotmail.it daniela.devita@uniroma1.it
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
Vero Falso. Questo documento è stato creato con QuestBase. Crea, stampa e svolgi questionari gratuitamente a http://www.questbase.
 1 Una fenditura, di larghezza è illuminata con luce monocromatica di lunghezza d'onda. Si osserva la figura di diffrazione su uno schermo posto a 1 m della fenditura. Qual è la larghezza del massimo centrale?
1 Una fenditura, di larghezza è illuminata con luce monocromatica di lunghezza d'onda. Si osserva la figura di diffrazione su uno schermo posto a 1 m della fenditura. Qual è la larghezza del massimo centrale?
XRF SEM Micro-Raman. Fluorescenza a raggi X (XRF) S4 Pioneer - Bruker. Analisi elementale qualitativa e quantitativa
 XRF SEM Micro-Raman Fluorescenza a raggi X (XRF) S4 Pioneer - Bruker Analisi elementale qualitativa e quantitativa Non distruttiva Campioni solidi, liquidi o in polvere Multielementale Veloce Limite di
XRF SEM Micro-Raman Fluorescenza a raggi X (XRF) S4 Pioneer - Bruker Analisi elementale qualitativa e quantitativa Non distruttiva Campioni solidi, liquidi o in polvere Multielementale Veloce Limite di
Genova 15 01 14 TIPOLOGIE DI LAMPADE
 Genova 15 01 14 TIPOLOGIE DI LAMPADE Le lampade a vapori di mercurio sono sicuramente le sorgenti di radiazione UV più utilizzate nella disinfezione delle acque destinate al consumo umano in quanto offrono
Genova 15 01 14 TIPOLOGIE DI LAMPADE Le lampade a vapori di mercurio sono sicuramente le sorgenti di radiazione UV più utilizzate nella disinfezione delle acque destinate al consumo umano in quanto offrono
Ciao!! Un cielo stellato così come lo puoi vedere con i tuoi occhi. Il cielo visto da un potente telescopio molto lontano dalle città
 1 Ciao!! Quando guardi il cielo ogni volta che si fa buio, se è sereno, vedi tanti piccoli punti luminosi distribuiti nel cielo notturno: le stelle. Oggi si apre l immaginario Osservatorio per guardare...
1 Ciao!! Quando guardi il cielo ogni volta che si fa buio, se è sereno, vedi tanti piccoli punti luminosi distribuiti nel cielo notturno: le stelle. Oggi si apre l immaginario Osservatorio per guardare...
La pista del mio studio Riflettiamo sulla pista. Guida per l insegnante
 Riflettiamo sulla pista Guida per l insegnante Obiettivi educativi generali Compito di specificazione - possiede capacità progettuale - è in grado di organizzare il proprio tempo e di costruire piani per
Riflettiamo sulla pista Guida per l insegnante Obiettivi educativi generali Compito di specificazione - possiede capacità progettuale - è in grado di organizzare il proprio tempo e di costruire piani per
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
RICHIAMI DI TERMOCHIMICA
 CAPITOLO 5 RICHIAMI DI TERMOCHIMICA ARIA TEORICA DI COMBUSTIONE Una reazione di combustione risulta completa se il combustibile ha ossigeno sufficiente per ossidarsi completamente. Si ha combustione completa
CAPITOLO 5 RICHIAMI DI TERMOCHIMICA ARIA TEORICA DI COMBUSTIONE Una reazione di combustione risulta completa se il combustibile ha ossigeno sufficiente per ossidarsi completamente. Si ha combustione completa
IL SOLE. Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%)
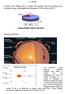 IL SOLE Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%) Struttura del Sole 0 - nel NUCLEO viene prodotta l energia emessa
IL SOLE Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%) Struttura del Sole 0 - nel NUCLEO viene prodotta l energia emessa
GIROSCOPIO. Scopo dell esperienza: Teoria fisica. Verificare la relazione: ω p = bmg/iω
 GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
Il campionamento. La digitalizzazione. Teoria e pratica. La rappresentazione digitale delle immagini. La rappresentazione digitale delle immagini
 ACQUISIZIONE ED ELABORAZIONE DELLE IMMAGINI Teoria e pratica La digitalizzazione La digitalizzazione di oggetti legati a fenomeni di tipo analogico, avviene attraverso due parametri fondamentali: Il numero
ACQUISIZIONE ED ELABORAZIONE DELLE IMMAGINI Teoria e pratica La digitalizzazione La digitalizzazione di oggetti legati a fenomeni di tipo analogico, avviene attraverso due parametri fondamentali: Il numero
ENERGIA SOLARE: Centrali fotovoltaiche e termosolari. Istituto Paritario Scuole Pie Napoletane - Anno Scolastico 2012-13 -
 ENERGIA SOLARE: Centrali fotovoltaiche e termosolari L A V E R A N A T U R A D E L L A L U C E La luce, sia naturale sia artificiale, è una forma di energia fondamentale per la nostra esistenza e per quella
ENERGIA SOLARE: Centrali fotovoltaiche e termosolari L A V E R A N A T U R A D E L L A L U C E La luce, sia naturale sia artificiale, è una forma di energia fondamentale per la nostra esistenza e per quella
La candela accesa. Descrizione generale. Obiettivi. Sequenza didattica e metodo di lavoro. Esperimenti sulla crescita delle piante
 Esperimenti sulla crescita delle piante unità didattica 1 La candela accesa Durata 60 minuti Materiali per ciascun gruppo - 1 candela - 1 vaso di vetro - 1 cronometro - 1 cannuccia - fiammiferi - 1 pezzo
Esperimenti sulla crescita delle piante unità didattica 1 La candela accesa Durata 60 minuti Materiali per ciascun gruppo - 1 candela - 1 vaso di vetro - 1 cronometro - 1 cannuccia - fiammiferi - 1 pezzo
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
Radiazione atmosferica
 Radiazione atmosferica Fondamenti di meteorologia e climatologia Trento, 28 Aprile 2015 Radiazione elettromagnetica La radiazione elettromagnetica puó essere vista come un insieme di onde che si propagano
Radiazione atmosferica Fondamenti di meteorologia e climatologia Trento, 28 Aprile 2015 Radiazione elettromagnetica La radiazione elettromagnetica puó essere vista come un insieme di onde che si propagano
La combustione ed i combustibili
 La combustione ed i combustibili Concetti di base Potere calorifico Aria teorica di combustione Fumi: volume e composizione Temperatura teorica di combustione Perdita al camino Combustibili Gassosi Solidi
La combustione ed i combustibili Concetti di base Potere calorifico Aria teorica di combustione Fumi: volume e composizione Temperatura teorica di combustione Perdita al camino Combustibili Gassosi Solidi
OTTICA TORNA ALL'INDICE
 OTTICA TORNA ALL'INDICE La luce è energia che si propaga in linea retta da un corpo, sorgente, in tutto lo spazio ad esso circostante. Le direzioni di propagazione sono dei raggi che partono dal corpo
OTTICA TORNA ALL'INDICE La luce è energia che si propaga in linea retta da un corpo, sorgente, in tutto lo spazio ad esso circostante. Le direzioni di propagazione sono dei raggi che partono dal corpo
Misura delle proprietà di trasmissione e assorbimento della luce da parte dei materiali mediante spettrofotometro
 Misura delle proprietà di trasmissione e assorbimento della luce da parte dei materiali mediante spettrofotometro Apparato sperimentale: Spettrofotometro digitale SPID HR (U21830) con software di acquisizione,
Misura delle proprietà di trasmissione e assorbimento della luce da parte dei materiali mediante spettrofotometro Apparato sperimentale: Spettrofotometro digitale SPID HR (U21830) con software di acquisizione,
Prova scritta intercorso 2 31/5/2002
 Prova scritta intercorso 3/5/ Diploma in Scienza e Ingegneria dei Materiali anno accademico - Istituzioni di Fisica della Materia - Prof. Lorenzo Marrucci Tempo a disposizione ora e 45 minuti ) Un elettrone
Prova scritta intercorso 3/5/ Diploma in Scienza e Ingegneria dei Materiali anno accademico - Istituzioni di Fisica della Materia - Prof. Lorenzo Marrucci Tempo a disposizione ora e 45 minuti ) Un elettrone
Convertitori numerici in Excel
 ISTITUTO DI ISTRUZIONE SUPERIORE G. M. ANGIOY CARBONIA Convertitori numerici in Excel Prof. G. Ciaschetti Come attività di laboratorio, vogliamo realizzare dei convertitori numerici con Microsoft Excel
ISTITUTO DI ISTRUZIONE SUPERIORE G. M. ANGIOY CARBONIA Convertitori numerici in Excel Prof. G. Ciaschetti Come attività di laboratorio, vogliamo realizzare dei convertitori numerici con Microsoft Excel
I sistemi di numerazione
 I sistemi di numerazione 01-INFORMAZIONE E SUA RAPPRESENTAZIONE Sia dato un insieme finito di caratteri distinti, che chiameremo alfabeto. Utilizzando anche ripetutamente caratteri di un alfabeto, si possono
I sistemi di numerazione 01-INFORMAZIONE E SUA RAPPRESENTAZIONE Sia dato un insieme finito di caratteri distinti, che chiameremo alfabeto. Utilizzando anche ripetutamente caratteri di un alfabeto, si possono
La radioattività e la datazione al radio-carbonio
 1 Espansione 2.2 La radioattività e la datazione al radio-carbonio Henry Becquerel. I coniugi Pierre e Marie Curie. La radioattività La radioattività è un fenomeno naturale provocato dai nuclei atomici
1 Espansione 2.2 La radioattività e la datazione al radio-carbonio Henry Becquerel. I coniugi Pierre e Marie Curie. La radioattività La radioattività è un fenomeno naturale provocato dai nuclei atomici
Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno
 Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
I.S.I.S. Zenale e Butinone di Treviglio Dipartimento di Scienze integrate anno scolastico 2013/14
 I.S.I.S. Zenale e Butinone di Treviglio Dipartimento di Scienze integrate anno scolastico 2013/14 KIT RECUPERO SCIENZE INTEGRATE FISICA CLASSI SECONDE TECNICO GRAFICO SUPPORTO DIDATTICO PER ALUNNI CON
I.S.I.S. Zenale e Butinone di Treviglio Dipartimento di Scienze integrate anno scolastico 2013/14 KIT RECUPERO SCIENZE INTEGRATE FISICA CLASSI SECONDE TECNICO GRAFICO SUPPORTO DIDATTICO PER ALUNNI CON
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
Prove associate al percorso INVESTIGAZIONI SUL MODELLO PARTICELLARE
 Titolo: Prove associate al percorso INVESTIGAZIONI SUL MODELLO PARTICELLARE Autore: Elisabetta Caroti Percorsi didattici associati: 1. Investigazioni sul modello particellare AVVERTENZA: Le domande che
Titolo: Prove associate al percorso INVESTIGAZIONI SUL MODELLO PARTICELLARE Autore: Elisabetta Caroti Percorsi didattici associati: 1. Investigazioni sul modello particellare AVVERTENZA: Le domande che
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
I modelli atomici da Dalton a Bohr
 1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
Istituzioni di fisica della materia I Lezione 3. S. Solimeno lezione 3 1
 Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Diffrazione da reticolo: un CD come Spettroscopio
 Diffrazione da reticolo: un CD come Spettroscopio 1 -Argomento Esperimenti con uno spettroscopio realizzato con materiali a costo nullo o basso o di riciclo. Cosa serve - un vecchio CD, - una scatola di
Diffrazione da reticolo: un CD come Spettroscopio 1 -Argomento Esperimenti con uno spettroscopio realizzato con materiali a costo nullo o basso o di riciclo. Cosa serve - un vecchio CD, - una scatola di
Eliosismologia. Marco Potenza. Planetario di Milano 30 maggio 2006
 Eliosismologia Marco Potenza Planetario di Milano 30 maggio 2006 Elio-sismologia = studio dei terremoti sul Sole o meglio: Studio del Sole mediante l analisi delle sue oscillazioni Guardiamo da vicino
Eliosismologia Marco Potenza Planetario di Milano 30 maggio 2006 Elio-sismologia = studio dei terremoti sul Sole o meglio: Studio del Sole mediante l analisi delle sue oscillazioni Guardiamo da vicino
Simulazione test di ingresso Ingegneria Industriale Viterbo. Quesiti di Logica, Chimica e Fisica. Logica
 Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come continua questa serie di numeri? 1-4 - 10-22 - 46-94 -... A) 188 B) 190 C) 200 D) 47 L2
Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come continua questa serie di numeri? 1-4 - 10-22 - 46-94 -... A) 188 B) 190 C) 200 D) 47 L2
Interesse, sconto, ratei e risconti
 TXT HTM PDF pdf P1 P2 P3 P4 293 Interesse, sconto, ratei e risconti Capitolo 129 129.1 Interesse semplice....................................................... 293 129.1.1 Esercizio per il calcolo dell
TXT HTM PDF pdf P1 P2 P3 P4 293 Interesse, sconto, ratei e risconti Capitolo 129 129.1 Interesse semplice....................................................... 293 129.1.1 Esercizio per il calcolo dell
RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI
 RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI Autore: Andrea Peluso INTRODUZIONE: La riduzione delle cloroammine in piscina tramite l utilizzo di raggi ultravioletti è una pratica
RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI Autore: Andrea Peluso INTRODUZIONE: La riduzione delle cloroammine in piscina tramite l utilizzo di raggi ultravioletti è una pratica
Temperatura e Calore
 Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ
 Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Che cos è la corrente elettrica? Nei conduttori metallici la corrente è un flusso di elettroni. L intensità della corrente è il rapporto tra la quantità
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Che cos è la corrente elettrica? Nei conduttori metallici la corrente è un flusso di elettroni. L intensità della corrente è il rapporto tra la quantità
