GAZYVARO. Farmaco di nuova registrazione
|
|
|
- Florindo Costantino
- 8 anni fa
- Visualizzazioni
Transcript
1 AllegatoallaDeterminaAIFANumero1012/2014del24/09/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda partedell aziendainteressatadiun eventualedomandadidiversaclassificazione. Farmacodinuovaregistrazione GAZYVARO CodiceATCPrincipioAttivo:L01 Citostatici Obinutuzumab Titolare: ROCHEREGISTRATIONLIMITED GUUE 29/08/2014 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuoveinformazionisullasicurezza.aglioperatorisanitarièrichiestodisegnalarequalsiasireazione avversasospetta. Vedere paragrafo 4.8 del Riassunto delle Caratteristiche del Prodotto per informazioni sulle modalitàdisegnalazionedellereazioniavverse. Indicazioniterapeutiche Gazyvaro in associazione a clorambucile è indicato nel trattamento di pazienti adulti affetti da leucemia linfatica cronica (LLC) non pretrattata e con comorbilità che li rendono non idonei a una terapia a base di fludarabinaadosepiena(vedereparagrafo5.1delriassuntodellecaratteristichedelprodotto). Mododisomministrazione Gazyvarodeveesseresomministratosottol'attentasupervisionediunmedicoespertoeinunambientecon immediatadisponibilitàdiapparecchiatureperlarianimazione. Gazyvaro è per uso endovenoso e deve essere somministrato dopo la diluizione mediante infusione endovenosa attraverso una linea dedicata (vedere paragrafo 6.6 del Riassunto delle Caratteristiche del Prodotto).Gazyvaronondeveesseresomministratocomepushoboloendovenoso. PerleistruzionisulladiluizionediGazyvaroprimadellasomministrazionevedereilparagrafo6.6delRiassunto dellecaratteristichedelprodotto. Le istruzioni sulla velocità di infusione sono illustrate nella Tabella 3 del Riassunto delle Caratteristiche del Prodotto. La gestione delle IRR può richiedere l interruzione temporanea della somministrazione, la riduzione della velocità di infusione o l interruzione del trattamento con Gazyvaro come indicato di seguito (vedere anche paragrafo4.4delriassuntodellecaratteristichedelprodotto). Grado4(potenzialmenteletale):l infusionedeveesseresospesaelaterapiadefinitivamenteinterrotta. Grado 3 (severo): l infusione deve essere temporaneamente sospesa e i sintomi devono essere trattati. L infusionepuòessereripresaallarisoluzionedeisintomi,aunavelocitàridottanonpiùdellametàrispettoa quellaprecedentementeadottata(ovverolavelocitàutilizzatanelmomentoincuisièverificatalairr)e,seil pazientenonmanifestaalcunsintomoindicativodiunairr,èpossibileripristinarel aumentogradualedella velocitàdiinfusioneinbaseagliincrementieintervalliappropriatiperladoseterapeutica(vederetabella3). Lavelocitàdell infusionedelgiorno1(ciclo1)puòessereriportatafinoa25mg/hdopoun ora,senzaperò essereulteriormenteincrementata.seilpazientemanifestaperlasecondavoltaunairrdigrado3,l infusione deveesseresospesaelaterapiadefinitivamenteinterrotta. Grado 12 (da lieve a moderato): la velocità di infusione deve essere ridotta e i sintomi devono essere trattati.l infusionepuòessereripresaallarisoluzionedeisintomie,seilpazientenonmanifestaalcunsintomo indicativo di una IRR, è possibile ripristinare l aumento graduale della velocità di infusione in base agli incrementi e intervalli appropriati per la dose terapeutica (vedere Tabella 3). La velocità dell infusione del 118
2 Giorno 1 (Ciclo 1) può essere riportata fino a 25 mg/h dopo un ora, senza però essere ulteriormente incrementata. Confezioniautorizzate: EU/1/14/937/001 AIC: /E 1000 MG CONCENTRATO PER SOLUZIONE PER INFUSIONE USO ENDOVENOSO FLACONCINO 1000MG/40ML1FLACONCINO Altrecondizionierequisitidell'autorizzazioneall'immissioneincommercio Rapportiperiodicidiaggiornamentosullasicurezza(PSUR) Il titolare dell autorizzazione all immissione in commercio deve presentare il primo PSUR per questo medicinaleentro6mesisuccessiviall'autorizzazione.inseguito,iltitolaredell autorizzazioneall immissionein commercio presenterà gli PSUR per questo medicinale conformemente ai requisiti definiti nell elenco delle date di riferimento per l Unione europea (elenco ERUD) di cui all articolo 107 quater, par 7. della direttiva 2001/83/CEepubblicatosulsitowebdeimedicinalieuropei. Condizioniolimitazioniperquantoriguardal'usosicuroedefficacedelmedicinale Pianodigestionedelrischio(RMP) Il titolare dell autorizzazione all'immissione in commercio deve effettuare le attività e gli interventi di farmacovigilanzarichiestiedettagliatinelrmpconcordatoepresentatonelmodulo1.8.2dell autorizzazione all'immissioneincommercioequalsiasisuccessivoaggiornamentoconcordatodelrmp. IlRMPaggiornatodeveesserepresentato: surichiestadell Agenziaeuropeaperimedicinali; ognivoltacheilsistemadigestionedelrischioèmodificato,inparticolareaseguitodelricevimentodinuove informazionichepossonoportareauncambiamentosignificativodelprofilobeneficio/rischiooalrisultatodel raggiungimentodiunimportanteobiettivo(difarmacovigilanzaodiminimizzazionedelrischio). Quando le date per la presentazione di un rapporto periodico di aggiornamento sulla sicurezza (PSUR) e l aggiornamentodelrmpcoincidono,essipossonoesserepresentatiallostessotempo. Obbligodicondurremisurepostautorizzative Il titolare dell autorizzazione all immissione in commercio deve completare entro la tempistica stabilita, le seguentiattività: Descrizione Termine IltitolaredevesottomettereidatimaturidiOSdelloStage2dellostudioBO21004/CLL11a confermadelbeneficiodigclbperl endpointos.devonoessereresenoteleanalisidios neisottogruppideipazientifraileunfit IltitolaredevesottomettereidatimaturidiOSdelloStage1AdellostudioBO21004/CLL11 nellapopolazioneitt(intenttotreat),neisottogruppidipazientizap70positiviezap70 negativi 31Gennaio Gennaio 2016 Regimediprescrizione Medicinaleutilizzabileesclusivamenteinambienteospedalierooinstruttureadessoassimilabili(OSP). MEKINIST CodiceATCPrincipioAttivo:L01XE25Trametinib Titolare: GLAXOGROUPLIMITED GUUE 25/07/
3 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuoveinformazionisullasicurezza.aglioperatorisanitarièrichiestodisegnalarequalsiasireazione avversasospetta. Vedere paragrafo 4.8 del Riassunto delle Caratteristiche del Prodotto per informazioni sulle modalitàdisegnalazionedellereazioniavverse. Indicazioniterapeutiche Trametinibèindicatoperiltrattamentodipazientiadulticonmelanomainoperabileometastaticopositivo allamutazionebrafv600. Trametinib non ha dimostrato attività clinica in pazienti che sono andati incontro a progressione su una precedente terapia con un inibitore BRAF (vedere paragrafo 5.1 del Riassunto delle Caratteristiche del Prodotto). Mododisomministrazione Il trattamento con trametinib deve essere iniziato e supervisionato solo da un medico esperto nella somministrazionedimedicinaliantitumorali. Primadiiniziarelaterapiacontrametinib,sideveaccertarelapresenzadellamutazioneBRAFV600neltessuto tumoraledeipazientimedianteuntestvalidato. Siraccomandadiassumereladoseditrametiniballastessaoraognigiorno. Trametinibdeveesserepresoperviaoraleconunbicchierepienodiacqua.Lecompresseditrametinibnon devonoesseremasticateoschiacciate.trametinibdeveesserepresosenzacibo,almeno1oraprimao2ore dopoilpasto. Se un paziente vomita dopo l assunzione di trametinib, il paziente non deve riprendere la dose ma deve prenderelaprossimadoseprevista. Confezioniautorizzate: EU/1/14/931/01 AIC: /E 0,5MGCOMPRESSARIVESTITACONFILMUSOORALEFLACONE(HDPE)7COMPRESSE EU/1/14/931/02 AIC: /E 0,5MGCOMPRESSARIVESTITACONFILMUSOORALEFLACONE(HDPE)30COMPRESSE EU/1/14/931/03 AIC: /E 1MGCOMPRESSARIVESTITACONFILMUSOORALEFLACONE(HDPE)7COMPRESSE EU/1/14/931/04 AIC: /E 1MGCOMPRESSARIVESTITACONFILMUSOORALEFLACONE(HDPE)30COMPRESSE EU/1/14/931/05 AIC: /E 2MGCOMPRESSARIVESTITACONFILMUSOORALEFLACONE(HDPE)7COMPRESSE EU/1/14/931/06 AIC: /E 2MGCOMPRESSARIVESTITACONFILMUSOORALEFLACONE(HDPE)30COMPRESSE Altrecondizionierequisitidell'autorizzazioneall'immissioneincommercio Rapportiperiodicidiaggiornamentosullasicurezza(PSUR) Il titolare dell autorizzazione all immissione in commercio deve presentare il primo PSUR per questo medicinaleentro6mesisuccessiviall'autorizzazione.inseguito,iltitolaredell autorizzazioneall immissionein commercio presenterà gli PSUR per questo medicinale conformemente ai requisiti definiti nell elenco delle date di riferimento per l Unione europea (elenco ERUD) di cui all articolo 107 quater, par 7. della direttiva 2001/83/CEepubblicatosulsitowebdeimedicinalieuropei. Condizioniolimitazioniperquantoriguardal'usosicuroedefficacedelmedicinale Pianodigestionedelrischio(RMP) Il titolare dell autorizzazione all'immissione in commercio deve effettuare le attività e gli interventi di farmacovigilanzarichiestiedettagliatinelrmpconcordatoepresentatonelmodulo1.8.2dell autorizzazione all'immissioneincommercioequalsiasisuccessivoaggiornamentoconcordatodelrmp. 120
4 IlRMPaggiornatodeveesserepresentato: surichiestadell Agenziaeuropeaperimedicinali; ognivoltacheilsistemadigestionedelrischioèmodificato,inparticolareaseguitodelricevimentodinuove informazionichepossonoportareauncambiamentosignificativodelprofilobeneficio/rischiooalrisultatodel raggiungimentodiunimportanteobiettivo(difarmacovigilanzaodiminimizzazionedelrischio). Quando le date per la presentazione di un rapporto periodico di aggiornamento sulla sicurezza (PSUR) e l aggiornamentodelrmpcoincidono,essipossonoesserepresentatiallostessotempo. Regimediprescrizione Medicinale soggetto a prescrizione medica limitativa, da rinnovare volta per volta, vendibile al pubblico su prescrizionedicentriospedalieriodispecialisti oncologo internista(rnrl). Farmacidinuovaregistrazione NUWIQ CodiceATCPrincipioAttivo:B02BD02 FattoreVIIIdellacoagulazione Titolare: OCTAPHARMAAB GUUE 29/08/2014 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuoveinformazionisullasicurezza.aglioperatorisanitarièrichiestodisegnalarequalsiasireazione avversasospetta. Vedere paragrafo 4.8 del Riassunto delle Caratteristiche del Prodotto per informazioni sulle modalitàdisegnalazionedellereazioniavverse. Indicazioniterapeutiche TrattamentoeprofilassideglieventiemorragiciinpazienticonemofiliaA(deficitcongenitodelfattoreVIII). Nuwiqpuòessereusatointuttelefasced età. Mododisomministrazione Iltrattamentodeveavveniresottolasupervisionediunmedicoespertoneltrattamentodell emofilia. Lasicurezzael efficaciadinuwiqneipazientinontrattatiinprecedenzanonsonostateancorastabilite. Usoendovenoso. Siraccomandadinonsomministrarepiùdi4mlalminuto. Per le istruzioni sulla ricostituzione del medicinale prima della somministrazione, vedere paragrafo 6.6 del RiassuntodelleCaratteristichedelProdotto. Confezioniautorizzate: EU/A/14/936/001 AIC: /E 250UNITÀINTERNAZIONALIDISIMOCTOGALFA(100UL/MLDOPORICOSTITUZIONE)POLVEREESOLVENTE PER SOLUZIONE INIETTABILE USO ENDOVENOSO DOPO RICOSTITUZIONE FLACONCINO 250 UNITÀ INTERNAZIONALI1FLACONCINO EU/A/14/936/002 AIC: /E 500UNITÀINTERNAZIONALIDISIMOCTOGALFA(100UL/MLDOPORICOSTITUZIONE)POLVEREESOLVENTE PER SOLUZIONE INIETTABILE USO ENDOVENOSO DOPO RICOSTITUZIONE FLACONCINO 500 UNITÀ INTERNAZIONALI1FLACONCINO EU/A/14/936/003 AIC: /E 1000UNITÀINTERNAZIONALIDISIMOCTOGALFA(400UL/MLDOPORICOSTITUZIONE)POLVEREESOLVENTE 121
5 PER SOLUZIONE INIETTABILEUSO ENDOVENOSO DOPO RICOSTITUZIONEFLACONCINO 1000UNITÀ INTERNAZIONALI1FLACONCINO EU/A/14/936/004 AIC: /E 2000UNITÀINTERNAZIONALIDISIMOCTOGALFA(800UL/MLDOPORICOSTITUZIONE)POLVEREESOLVENTE PER SOLUZIONE INIETTABILEUSO ENDOVENOSO DOPO RICOSTITUZIONEFLACONCINO 2000UNITÀ INTERNAZIONALI1FLACONCINO Altrecondizionierequisitidell'autorizzazioneall'immissioneincommercio Rapportiperiodicidiaggiornamentosullasicurezza(PSUR) Il titolare dell autorizzazione all immissione in commercio deve presentare il primo PSUR per questo medicinaleentro6mesisuccessiviall'autorizzazione.inseguito,iltitolaredell autorizzazioneall immissionein commercio presenterà gli PSUR per questo medicinale conformemente ai requisiti definiti nell elenco delle date di riferimento per l Unione europea (elenco ERUD) di cui all articolo 107 quater, par 7. della direttiva 2001/83/CEepubblicatosulsitowebdeimedicinalieuropei. Condizioniolimitazioniperquantoriguardal'usosicuroedefficacedelmedicinale Pianodigestionedelrischio(RMP) Il titolare dell autorizzazione all'immissione in commercio deve effettuare le attività e gli interventi di farmacovigilanzarichiestiedettagliatinelrmpconcordatoepresentatonelmodulo1.8.2dell autorizzazione all'immissioneincommercioequalsiasisuccessivoaggiornamentoconcordatodelrmp. IlRMPaggiornatodeveesserepresentato: surichiestadell Agenziaeuropeaperimedicinali; ognivoltacheilsistemadigestionedelrischioèmodificato,inparticolareaseguitodelricevimentodinuove informazionichepossonoportareauncambiamentosignificativodelprofilobeneficio/rischiooalrisultatodel raggiungimentodiunimportanteobiettivo(difarmacovigilanzaodiminimizzazionedelrischio). Quando le date per la presentazione di un rapporto periodico di aggiornamento sulla sicurezza (PSUR) e l aggiornamentodelrmpcoincidono,essipossonoesserepresentatiallostessotempo. Regimediprescrizione Medicinalesoggettoaprescrizionemedica(RR). Il trattamento deve essere avviato sotto la supervisione di un medico specializzato nel trattamento dell emofiliaoperanteneicentriidentificatidalleregioni. PianoTerapeuticocomedamodelloallegato. 122
6 NUWIQMODELLOPERLADEFINIZIONEDELPIANOTERAPEUTICO NUWIQB02BD02FattoreVIIIdellacoagulazione Indicazioniterapeutiche TrattamentoeprofilassidiepisodiemorragiciinpazientiaffettidaemofiliaA(deficitcongenitodi fattoreviii).nuwiqpuòessereusatointuttelefasced età. Paziente Cognome /Nome / Datadinascita(gg/mm/aaaa) / / /SessoMF Diagnosi Farmacoprescritto EU/A/14/936/001 AIC: /E 250UNITÀINTERNAZIONALIDISIMOCTOGALFA(100UL/MLDOPORICOSTITUZIONE)POLVEREESOLVENTE PER SOLUZIONE INIETTABILE USO ENDOVENOSO DOPO RICOSTITUZIONE FLACONCINO 250 UNITÀ INTERNAZIONALI1FLACONCINO EU/A/14/936/002 AIC: /E 500UNITÀINTERNAZIONALIDISIMOCTOGALFA(100UL/MLDOPORICOSTITUZIONE)POLVEREESOLVENTE PER SOLUZIONE INIETTABILE USO ENDOVENOSO DOPO RICOSTITUZIONE FLACONCINO 500 UNITÀ INTERNAZIONALI1FLACONCINO EU/A/14/936/003 AIC: /E 1000UNITÀINTERNAZIONALIDISIMOCTOGALFA(400UL/MLDOPORICOSTITUZIONE)POLVEREESOLVENTE PER SOLUZIONE INIETTABILEUSO ENDOVENOSO DOPO RICOSTITUZIONEFLACONCINO 1000UNITÀ INTERNAZIONALI1FLACONCINO EU/A/14/936/004 AIC: /E 2000UNITÀINTERNAZIONALIDISIMOCTOGALFA(800UL/MLDOPORICOSTITUZIONE)POLVEREESOLVENTE PER SOLUZIONE INIETTABILEUSO ENDOVENOSO DOPO RICOSTITUZIONEFLACONCINO 2000UNITÀ INTERNAZIONALI1FLACONCINO Primaprescrizione Prosecuzionedeltrattamento Posologia Iltrattamentodeveavveniresottolasupervisionediunmedicoespertoneltrattamentodell emofilia. Lasicurezzael efficaciadinuwiqneipazientinontrattatiinprecedenzanonsonostateancorastabilite. Usoendovenoso. 123
7 Siraccomandadinonsomministrarepiùdi4mlalminuto. Per le istruzioni sulla ricostituzione del medicinale prima della somministrazione, vedere paragrafo 6.6 del RiassuntodelleCaratteristichedelProdotto. Timbroefirmadelmedicoprescrittore TimbrodelCentro Prof.XxxxxXXXXXXX TelefonoXXXXXXXXXXXX Dettaglidelcentro Numerodiriferimentoregionale Telefoni Data(gg/mm/aaaa) / / / 124
8 Farmacidinuovaregistrazione PLEGRIDY CodiceATCPrincipioAttivo:L03AB13Peginterferonbeta1a Titolare: BIOGENIDECLIMITED GUUE 29/08/2014 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuoveinformazionisullasicurezza.aglioperatorisanitarièrichiestodisegnalarequalsiasireazione avversasospetta. Vedere paragrafo 4.8 del Riassunto delle Caratteristiche del Prodotto per informazioni sulle modalitàdisegnalazionedellereazioniavverse. Indicazioniterapeutiche Plegridyèindicatoneipazientiadultiperiltrattamentodellasclerosimultiplarecidivanteremittente(vedere paragrafo5.1delriassuntodellecaratteristichedelprodotto). Mododisomministrazione Iltrattamentodeveessereiniziatosottolasupervisionediunmedicoespertoneltrattamentodellasclerosi multipla. L efficaciadiplegridyèstatadimostratarispettoalplacebo.nonsonodisponibilidatidiconfrontodirettodi Plegridyversointerferonebetanonpegilatoodatisull'efficaciadiPlegridydopoilpassaggiodauninterferone betanonpegilato.questodeveesserepresoinconsiderazioneincasodicambiamentodeltrattamentodei pazienti tra interferone pegilato e non pegilato. Si prega di fare riferimento anche al paragrafo 5.1 del RiassuntodelleCaratteristichedelProdotto. Plegridyèperusosottocutaneo. Siraccomandal addestramentodeipazientidapartediunoperatoresanitarioriguardoallacorrettatecnicadi autosomministrazionedelleiniezionisottocutaneeutilizzandolasiringa/pennapreriempita.ipazientidevono essere avvertiti di ruotare i siti delle iniezioni sottocutanee. I siti abituali per somministrare le iniezioni sottocutaneeincludonol addome,ilbraccioelacoscia. Ciascuna siringa/penna preriempita di Plegridy è dotata di ago premontato. Le siringhe/penne preriempite sonoesclusivamentemonousoedevonoesseregettatedopol uso. Precauzionidaadottareprimadimanipolareosomministrareilmedicinale Unavoltatoltodalfrigorifero,lasciarechePlegridysiriscaldiatemperaturaambiente(circa30minuti)prima di eseguire l iniezione. Non devono essere usate fonti esterne di calore, come acqua calda, per scaldare Plegridy. Plegridyinsiringapreriempitanondeveessereutilizzatoseilliquidoècolorato,torbidoocontieneparticelle insospensione.illiquidonellasiringadeveesserelimpidoeincolore. Plegridyinpennapreriempitanondeveessereutilizzatoamenochelestrisceverdisianovisibilinellafinestra divisualizzazionedellostatodell iniezionedellapennapreriempita.plegridyinpennapreriempitanondeve essereutilizzatoseilliquidoècolorato,torbidoocontieneparticelleinsospensione.illiquidonellafinestradi medicazionedeveesserelimpidoeincolore. Confezioniautorizzate: EU/1/14/934/001 AIC: /E 63MCG;94MCGSOLUZIONEINIETTABILEUSOSOTTOCUTANEOSIRINGAPRERIEMPITA(VETRO)0,5ML 1SIRINGAPRERIEMPITA(63MCG)+1SIRINGAPRERIEMPITA(94MCG) EU/1/14/934/002 AIC: /E 63MCG;94MCGSOLUZIONEINIETTABILEUSOSOTTOCUTANEOPENNAPRERIEMPITA0,5ML1PENNA PRERIEMPITA(63MCG)+1PENNAPRERIEMPITA(94MCG) 125
9 EU/1/14/934/003 AIC: /E 125 MCGSOLUZIONE INIETTABILEUSO SOTTOCUTANEOSIRINGA PRERIEMPITA (VETRO)0,5 ML2 SIRINGHEPRERIEMPITE EU/1/14/934/004 AIC: /E 125 MCGSOLUZIONE INIETTABILEUSO SOTTOCUTANEOSIRINGA PRERIEMPITA (VETRO)0,5 ML6 SIRINGEPRERIEMPITE EU/1/14/934/005 AIC: /E 125 MCG SOLUZIONE INIETTABILE USO SOTTOCUTANEO PENNA PRERIEMPITA 0,5 ML 2 PENNE PRERIEMPITE EU/1/14/934/006 AIC: /E 125 MCG SOLUZIONE INIETTABILE USO SOTTOCUTANEO PENNA PRERIEMPITA 0,5 ML 6 PENNE PRERIEMPITE Altrecondizionierequisitidell'autorizzazioneall'immissioneincommercio Rapportiperiodicidiaggiornamentosullasicurezza(PSUR) Il titolare dell autorizzazione all immissione in commercio deve presentare il primo PSUR per questo medicinaleentro6mesisuccessiviall'autorizzazione.inseguito,iltitolaredell autorizzazioneall immissionein commercio presenterà gli PSUR per questo medicinale conformemente ai requisiti definiti nell elenco delle date di riferimento per l Unione europea (elenco ERUD) di cui all articolo 107 quater, par 7. della direttiva 2001/83/CEepubblicatosulsitowebdeimedicinalieuropei. Condizioniolimitazioniperquantoriguardal'usosicuroedefficacedelmedicinale Pianodigestionedelrischio(RMP) Il titolare dell autorizzazione all'immissione in commercio deve effettuare le attività e gli interventi di farmacovigilanzarichiestiedettagliatinelrmpconcordatoepresentatonelmodulo1.8.2dell autorizzazione all'immissioneincommercioequalsiasisuccessivoaggiornamentoconcordatodelrmp. IlRMPaggiornatodeveesserepresentato: surichiestadell Agenziaeuropeaperimedicinali; ognivoltacheilsistemadigestionedelrischioèmodificato,inparticolareaseguitodelricevimentodinuove informazionichepossonoportareauncambiamentosignificativodelprofilobeneficio/rischiooalrisultatodel raggiungimentodiunimportanteobiettivo(difarmacovigilanzaodiminimizzazionedelrischio). Quando le date per la presentazione di un rapporto periodico di aggiornamento sulla sicurezza (PSUR) e l aggiornamentodelrmpcoincidono,essipossonoesserepresentatiallostessotempo. Regimediprescrizione Medicinale soggetto a prescrizione medica, vendibile al pubblico su prescrizione di specialisti operanti nei CentridesignatidalleRegioniperprescrizionedeifarmacidiNota65(RR). Farmacidinuovaregistrazione SIMBRINZA CodiceATCPrincipioAttivo:S01BrinzolamideeBrimonidina Titolare: ALCONLABORATORIES(UK)LTD GUUE 29/08/2014 Indicazioniterapeutiche Riduzione della pressione intraoculare (PIO) elevata in pazienti adulti con glaucoma ad angolo aperto o ipertensioneoculareperiqualilamonoterapiaproduceunariduzionedellapioinsufficiente(vedereparagrafo 5.1delRiassuntodelleCaratteristichedelProdotto). 126
10 Mododisomministrazione Perusooftalmico. Ipazientidevonoessereinformatidiagitarebeneilflaconeprimadell uso. Quando si effettua l occlusione nasolacrimale e la chiusura delle palpebre per 2 minuti, l assorbimento sistemicosiriduce.questopuòcomportareunariduzionedeglieffettiindesideratisistemiciedunaumento dell azionealivellolocale(vedereparagrafo4.4delriassuntodellecaratteristichedelprodotto). Perimpedirelacontaminazionedellapuntadelflaconecontagocceedellasoluzione,sideveporreattenzione anontoccarelepalpebre,leareecircostantioaltresuperficiconlapuntacontagoccedelflaconeipazienti devonoessereinformatidiconservareilflaconebenchiusoquandononlosiutilizza. SIMBRINZApuòessereutilizzatoinconcomitanzaconaltrimedicinalitopicioftalmiciperridurrelapressione intraoculare.sevieneusatopiùdiunmedicinaletopicooftalmico,imedicinalidevonoesseresomministrati singolarmenteadistanzadialmeno5minuti. Sesisaltaunadose,proseguireiltrattamentoconladosesuccessivacomeprogrammato.Ladosenondovrà esseresuperioread1goccia2voltealgiornoperocchioaffetto. Confezioniautorizzate: EU/1/14/933/001 AIC: /E 10MG/ML/2MG/MLCOLLIRIO,SOSPENSIONEUSOOFTALMICOFLACONE(LDPE)5ML1FLACONE EU/1/14/933/002 AIC: /E 10MG/ML/2MG/MLCOLLIRIO,SOSPENSIONEUSOOFTALMICOFLACONE(LDPE)5ML3FLACONI Altrecondizionierequisitidell'autorizzazioneall'immissioneincommercio Rapportiperiodicidiaggiornamentosullasicurezza(PSUR) Il titolare dell autorizzazione all immissione in commercio deve presentare il primo PSUR per questo medicinaleentro6mesisuccessiviall'autorizzazione.inseguito,iltitolaredell autorizzazioneall immissionein commercio presenterà gli PSUR per questo medicinale conformemente ai requisiti definiti nell elenco delle date di riferimento per l Unione europea (elenco ERUD) di cui all articolo 107 quater, par 7. della direttiva 2001/83/CEepubblicatosulsitowebdeimedicinalieuropei. Condizioniolimitazioniperquantoriguardal'usosicuroedefficacedelmedicinale Pianodigestionedelrischio(RMP) Il titolare dell autorizzazione all'immissione in commercio deve effettuare le attività e gli interventi di farmacovigilanzarichiestiedettagliatinelrmpconcordatoepresentatonelmodulo1.8.2dell autorizzazione all'immissioneincommercioequalsiasisuccessivoaggiornamentoconcordatodelrmp. IlRMPaggiornatodeveesserepresentato: surichiestadell Agenziaeuropeaperimedicinali; ognivoltacheilsistemadigestionedelrischioèmodificato,inparticolareaseguitodelricevimentodinuove informazionichepossonoportareauncambiamentosignificativodelprofilobeneficio/rischiooalrisultatodel raggiungimentodiunimportanteobiettivo(difarmacovigilanzaodiminimizzazionedelrischio). Quando le date per la presentazione di un rapporto periodico di aggiornamento sulla sicurezza (PSUR) e l aggiornamentodelrmpcoincidono,essipossonoesserepresentatiallostessotempo. Regimediprescrizione Medicinalesoggettoaprescrizionemedica(RR) 14A
Farmaci di nuova registrazione
 Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominataclassec(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànelle more della presentazione
Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominataclassec(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànelle more della presentazione
Modo di somministrazione La terapia deve essere iniziata e monitorata sotto la supervisione di medici esperti nel trattamento del mieloma multiplo.
 AllegatoallaDeterminaAIFANumero42/2014del15/01/2014. Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
AllegatoallaDeterminaAIFANumero42/2014del15/01/2014. Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
Allegato I. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Allegato III. Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Queste modifiche agli specifici paragrafi del Riassunto delle Caratteristiche
Allegato III Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Queste modifiche agli specifici paragrafi del Riassunto delle Caratteristiche
PRESCRIZIONE FARMACI BIOLOGICI REGIONE del VENETO Psoriasi a Placche. Cognome:..Nome:.. Codice Fiscale Sesso: M F
 Servizio Sanitario Nazionale - Regione Veneto AZIENDA ULSS N. 6 VICENZA Viale F. Rodolfi n. 37 36100 VICENZA COD. REGIONE 050 COD. U.L.SS. 006 COD.FISC. E P.IVA 02441500242 PRESCRIZIONE FARMACI BIOLOGICI
Servizio Sanitario Nazionale - Regione Veneto AZIENDA ULSS N. 6 VICENZA Viale F. Rodolfi n. 37 36100 VICENZA COD. REGIONE 050 COD. U.L.SS. 006 COD.FISC. E P.IVA 02441500242 PRESCRIZIONE FARMACI BIOLOGICI
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio
 Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
CARTA INTESTATA DEL CENTRO CLINICO
 CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
Nome di fantasia. Asprimax 850 mg/g. 100%, soluzione in polvere per amministrazione orale 80% WSP
 ALLEGATO I NOME, FORMA FARMACEUTICA, CONCENTRAZIONE DEL MEDICINALE, SPECIE ANIMALI, VIE DI SOMMINISTRAZIONE E TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO / RICHIEDENTE 1/9 Stato membro / Numero
ALLEGATO I NOME, FORMA FARMACEUTICA, CONCENTRAZIONE DEL MEDICINALE, SPECIE ANIMALI, VIE DI SOMMINISTRAZIONE E TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO / RICHIEDENTE 1/9 Stato membro / Numero
Nuove confezioni di farmaci approvati mediante procedura centralizzata.
 Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione, denominataclassec(nn),dedicataaifarmacinonancoravalutatiaifinidellarimborsabilità nellemoredellapresentazionedapartedell
Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione, denominataclassec(nn),dedicataaifarmacinonancoravalutatiaifinidellarimborsabilità nellemoredellapresentazionedapartedell
Medicinale: MIRANOVA Variazione AIC: Modifica della posologia e del modo di somministrazione (B13)
 ModiÞ cazione dell autorizzazione all immissione in commercio del medicinale «Miranova» Estratto determinazione AIC/N/V n. 1595 del 26 giugno 2009 Medicinale: MIRANOVA Variazione AIC: Modifica della posologia
ModiÞ cazione dell autorizzazione all immissione in commercio del medicinale «Miranova» Estratto determinazione AIC/N/V n. 1595 del 26 giugno 2009 Medicinale: MIRANOVA Variazione AIC: Modifica della posologia
STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI
 STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI Questo strumento è stato creato per facilitare gli operatori sanitari nella valutazione e nell educazione dei pazienti trattati
STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI Questo strumento è stato creato per facilitare gli operatori sanitari nella valutazione e nell educazione dei pazienti trattati
Foglio illustrativo: Informazioni per l utilizzatore. Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente
 Foglio illustrativo: Informazioni per l utilizzatore Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché
Foglio illustrativo: Informazioni per l utilizzatore Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché
DOCUMENTO DI SPECIFICA DEI REQUISITI SOFTWARE
 DOCUMENTO DI SPECIFICA DEI REQUISITI SOFTWARE Tabella dei contenuti 1. Introduzione 1.1 Propositi 1.2 Obiettivi 1.3 Definizioni, acronimi ed abbreviazioni 1.4 Riferimenti 1.5 Panoramica 2. Descrizione
DOCUMENTO DI SPECIFICA DEI REQUISITI SOFTWARE Tabella dei contenuti 1. Introduzione 1.1 Propositi 1.2 Obiettivi 1.3 Definizioni, acronimi ed abbreviazioni 1.4 Riferimenti 1.5 Panoramica 2. Descrizione
AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune)
 AIFA - Sirolimus (Rapamune) 08/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune) Nota Informativa Importante (08 Febbraio 2010) file:///c /documenti/sir653.htm [08/02/2010 10.47.36]
AIFA - Sirolimus (Rapamune) 08/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune) Nota Informativa Importante (08 Febbraio 2010) file:///c /documenti/sir653.htm [08/02/2010 10.47.36]
BEMFOLA. Codice ATC Principio Attivo: G03GA05 Follitropin alfa Titolare: FINOX BIOTECH AG GUUE 28/08/2015
 Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominataclassec(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànelle more della presentazione
Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominataclassec(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànelle more della presentazione
TRASFERIMENTI INTEROSPEDALIERI
 TRASFERIMENTI INTEROSPEDALIERI L attuale organizzazione del Sistema 1-1-8 della Regione Toscana ha evidenziato, fra l altro, una rilevante criticità in merito alla problematica riguardante i Trasporti
TRASFERIMENTI INTEROSPEDALIERI L attuale organizzazione del Sistema 1-1-8 della Regione Toscana ha evidenziato, fra l altro, una rilevante criticità in merito alla problematica riguardante i Trasporti
TRATTAMENTO DEL DOLORE POSTOPERATORIO
 TRATTAMENTO DEL DOLORE POSTOPERATORIO SITUAZIONE ALGICA MAGGIORE PERIDURALE CONTINUA Analgesia OPPURE PERINERVOSO CONTINUO + AD ORARI FISSI OPPURE ENDOVENOSO CONTINUO * + AD ORARI FISSI * in mancanza di
TRATTAMENTO DEL DOLORE POSTOPERATORIO SITUAZIONE ALGICA MAGGIORE PERIDURALE CONTINUA Analgesia OPPURE PERINERVOSO CONTINUO + AD ORARI FISSI OPPURE ENDOVENOSO CONTINUO * + AD ORARI FISSI * in mancanza di
PROCEDURA STE STE 00. DATA REDAZIONE FIRMA Nome e Cognome. DATA VERIFICA FIRMA Nome e Cognome. DATA APPROVAZIONE FIRMA Nome e Cognome
 Pagina 1 di 15 Documento Codice documento STE 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 15 1. Generalità... 3 1.1 Scopo
Pagina 1 di 15 Documento Codice documento STE 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 15 1. Generalità... 3 1.1 Scopo
SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO
 SOCIETA ITALIANA DI FARMACIA OSPEDALIERA E DEI SERVIZI FARMACEUTICI DELLE AZIENDE SANITARIE Area Scientifico-Culturale SIFO Rischio Clinico SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO MODALITÀ DI COMPILAZIONE
SOCIETA ITALIANA DI FARMACIA OSPEDALIERA E DEI SERVIZI FARMACEUTICI DELLE AZIENDE SANITARIE Area Scientifico-Culturale SIFO Rischio Clinico SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO MODALITÀ DI COMPILAZIONE
Conclusioni scientifiche
 Allegato II Conclusioni scientifiche e motivi della revoca o variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione
Allegato II Conclusioni scientifiche e motivi della revoca o variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione
Il Sistema di qualità. delle Unità di raccolta Avis
 delle Unità di raccolta Avis La Legge 21 ottobre 2005, n. 219 ha confermato che le Associazioni dei donatori volontari del sangue possono gestire strutture incaricate della raccolta del sangue (Unità di
delle Unità di raccolta Avis La Legge 21 ottobre 2005, n. 219 ha confermato che le Associazioni dei donatori volontari del sangue possono gestire strutture incaricate della raccolta del sangue (Unità di
Segnaliamo le sospette reazioni avverse! Come fare?
 La Farmacovigilanza. Perché, quando e come segnalare le Reazioni Avverse da Farmaci Segnaliamo le sospette reazioni avverse! Come fare? Dr. Michele Conti Regione Lazio Farmacista collaboratore di Farmacovigilanza
La Farmacovigilanza. Perché, quando e come segnalare le Reazioni Avverse da Farmaci Segnaliamo le sospette reazioni avverse! Come fare? Dr. Michele Conti Regione Lazio Farmacista collaboratore di Farmacovigilanza
SOMMINISTRAZIONE DEI FARMACI A SCUOLA
 ISTITUTO TECNICO INDUSTRIALE STATALE Galileo Galilei Via D. Menci, 1-52100 Arezzo - Tel. 05753131 - Fax 0575313206 E-mail: galilei@itis.arezzo.it; Sito Internet: http://www.itis.arezzo.it C.F.: 80002160515
ISTITUTO TECNICO INDUSTRIALE STATALE Galileo Galilei Via D. Menci, 1-52100 Arezzo - Tel. 05753131 - Fax 0575313206 E-mail: galilei@itis.arezzo.it; Sito Internet: http://www.itis.arezzo.it C.F.: 80002160515
Istituto Scientifico di Pavia Sede di Via Salvatore Maugeri 10
 Sede legale e amministrativa: Via Salvatore Maugeri 4, 27100 Pavia Italy Tel. 0382 592504 Fax 0382 592576 www.fsm.it C.F. e P. IVA 00305700189 Registro Persone Giuridiche Private della Regione Lombardia
Sede legale e amministrativa: Via Salvatore Maugeri 4, 27100 Pavia Italy Tel. 0382 592504 Fax 0382 592576 www.fsm.it C.F. e P. IVA 00305700189 Registro Persone Giuridiche Private della Regione Lombardia
SOFTWARE A SUPPORTO DELLA GESTIONE AMMINISTRATIVA DELLO SPORTELLO UNICO SPECIFICA DEI REQUISITI UTENTE
 Pag. 1 di 16 SOFTWARE A SUPPORTO DELLA (VERS. 3.1) Specifica dei Requisiti Utente Funzionalità di associazione di più Richiedenti ad un procedimento Codice Identificativo VERIFICHE ED APPROVAZIONI CONTROLLO
Pag. 1 di 16 SOFTWARE A SUPPORTO DELLA (VERS. 3.1) Specifica dei Requisiti Utente Funzionalità di associazione di più Richiedenti ad un procedimento Codice Identificativo VERIFICHE ED APPROVAZIONI CONTROLLO
INFORMAZIONE PROFESSIONALE N 13 del 15/04/2008 CONSEGNA MEDICINALI SENZA RICETTA- DM 31.3.2008
 ORDINE DEI FARMACISTI DELLA PROVINCIA DI TREVISO Via Cortese 8-31100 TREVISO - Telefono 0422544873 - Fax 0422545097 E-Mail : ordine@farmacietv.it Orari di apertura al pubblico: dal lun al gio dalle 10.30
ORDINE DEI FARMACISTI DELLA PROVINCIA DI TREVISO Via Cortese 8-31100 TREVISO - Telefono 0422544873 - Fax 0422545097 E-Mail : ordine@farmacietv.it Orari di apertura al pubblico: dal lun al gio dalle 10.30
Alla seguente lettera è allegata la dichiarazione CE di conformità per i lavabi da bagno prodotti da GlassTek.
 A tutti i clienti Vinci, 19 maggio 2011 OGGETTO: Marcatura CE La presente per ricordare a tutti i clienti che, a seguito dell entrata in vigore dall anno 2009 della marcatura CE obbligatoria per i lavabi
A tutti i clienti Vinci, 19 maggio 2011 OGGETTO: Marcatura CE La presente per ricordare a tutti i clienti che, a seguito dell entrata in vigore dall anno 2009 della marcatura CE obbligatoria per i lavabi
Esperienza del network JCI
 Esperienza del network JCI Dr. Massimiliano Raponi 19 novembre 2011 2 IL SECOLO XIX 1! 3 L Attività dell OPBG 4 Sedi 11 Dipartimenti 607 posti letto 30.344 Ricoveri Ordinari/anno 101.980 Accessi DH/anno
Esperienza del network JCI Dr. Massimiliano Raponi 19 novembre 2011 2 IL SECOLO XIX 1! 3 L Attività dell OPBG 4 Sedi 11 Dipartimenti 607 posti letto 30.344 Ricoveri Ordinari/anno 101.980 Accessi DH/anno
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE. Carenza di ferro molto diffusa e spesso sottovalutata
 FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Beta-interferoni: rischio di microangiopatia trombotica e sindrome nefrosica 20 Agosto
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Beta-interferoni: rischio di microangiopatia trombotica e sindrome nefrosica 20 Agosto
CAPITOLO 20 AGGIORNAMENTO DEL CODICE DI STOCCAGGIO
 CAPITOLO 20 AGGIORNAMENTO DEL CODICE DI STOCCAGGIO 20.1 PREMESSA... 255 20.2 COMITATO DI CONSULTAZIONE... 255 20.3 SOGGETTI TITOLATI A PRESENTARE RICHIESTE DI MODIFICA... 255 20.4 REQUISITI DI RICEVIBILITA
CAPITOLO 20 AGGIORNAMENTO DEL CODICE DI STOCCAGGIO 20.1 PREMESSA... 255 20.2 COMITATO DI CONSULTAZIONE... 255 20.3 SOGGETTI TITOLATI A PRESENTARE RICHIESTE DI MODIFICA... 255 20.4 REQUISITI DI RICEVIBILITA
Focus su epatite C e terapie di nuova generazione Place in Therapy: documento ARS
 Focus su epatite C e terapie di nuova generazione Place in Therapy: documento ARS Genova, 9 aprile 2014 Dott.ssa M.S. Rivetti Normativa Determinazioni AIFA 26.11.2012 (G.U. n. 287 del 10.12.2012) Regime
Focus su epatite C e terapie di nuova generazione Place in Therapy: documento ARS Genova, 9 aprile 2014 Dott.ssa M.S. Rivetti Normativa Determinazioni AIFA 26.11.2012 (G.U. n. 287 del 10.12.2012) Regime
OSPEDALI RIUNITI DI BERGAMO AZIENDA OSPEDALIERA di rilievo nazionale e di alta specializzazione. FarmaSafe@
 OSPEDALI RIUNITI DI BERGAMO AZIENDA OSPEDALIERA di rilievo nazionale e di alta specializzazione FarmaSafe@ Esperienza degli Ospedali Riuniti di Bergamo sulla farmacoterapia informatizzata Forum PA Roma,
OSPEDALI RIUNITI DI BERGAMO AZIENDA OSPEDALIERA di rilievo nazionale e di alta specializzazione FarmaSafe@ Esperienza degli Ospedali Riuniti di Bergamo sulla farmacoterapia informatizzata Forum PA Roma,
INFORMATIVA PROFESSIONALE n. 25 del 29.05.2009. Informazioni di sicurezza relative all uso di thalidomide celgene (principio attivo: talidomide)
 Brescia, 3 giugno 2009 Circ. n. 169 INFORMATIVA PROFESSIONALE n. 25 del 29.05.2009 Informazioni di sicurezza relative all uso di thalidomide celgene (principio attivo: talidomide) La Regione Lombardia,
Brescia, 3 giugno 2009 Circ. n. 169 INFORMATIVA PROFESSIONALE n. 25 del 29.05.2009 Informazioni di sicurezza relative all uso di thalidomide celgene (principio attivo: talidomide) La Regione Lombardia,
RUOLO DEL TRAPIANTO NEL PAZIENTE CON MIELOMA MULTIPLO
 RUOLO DEL TRAPIANTO NEL PAZIENTE CON MIELOMA MULTIPLO Nicola Giuliani U. O. Ematologia e CTMO, Azienda Ospedaliero-Universitaria di Parma MM-EPIDEMIOLOGIA 10% di tutti i tumori del sangue Malattia dell
RUOLO DEL TRAPIANTO NEL PAZIENTE CON MIELOMA MULTIPLO Nicola Giuliani U. O. Ematologia e CTMO, Azienda Ospedaliero-Universitaria di Parma MM-EPIDEMIOLOGIA 10% di tutti i tumori del sangue Malattia dell
Pradaxa è un medicinale contenente il principio attivo dabigatran etexilato. È disponibile in capsule (75, 110 e 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Riassunto destinato al pubblico dabigatran etexilato Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato
EMA/47517/2015 EMEA/H/C/000829 Riassunto destinato al pubblico dabigatran etexilato Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Marzo 2009 Nuove modalità di prescrizione per i medicinali contenenti isotretinoina ad
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Marzo 2009 Nuove modalità di prescrizione per i medicinali contenenti isotretinoina ad
Servizi per il cittadino: le richieste di prestazioni via Internet.
 Prestazioni a sostegno del reddito Servizi per il cittadino: le richieste di prestazioni via Internet. - Mobilità ordinaria Descrizione del servizio Premessa Questo documento descrive le funzionalità messa
Prestazioni a sostegno del reddito Servizi per il cittadino: le richieste di prestazioni via Internet. - Mobilità ordinaria Descrizione del servizio Premessa Questo documento descrive le funzionalità messa
Guida Compilazione Piani di Studio on-line
 Guida Compilazione Piani di Studio on-line SIA (Sistemi Informativi d Ateneo) Visualizzazione e presentazione piani di studio ordinamento 509 e 270 Università della Calabria (Unità organizzativa complessa-
Guida Compilazione Piani di Studio on-line SIA (Sistemi Informativi d Ateneo) Visualizzazione e presentazione piani di studio ordinamento 509 e 270 Università della Calabria (Unità organizzativa complessa-
Manuale Utente per la registrazione al Sistema di Tracciabilità del Farmaco
 per la registrazione al Sistema di Tracciabilità del Farmaco Manuale per la registrazione al sistema Versione 1.0 20 11 2009 SISN_SSW.MSW_FARUM_TRA_MTR_REG.doc Pagina 1 di 22 Versione 1.0 Scheda informativa
per la registrazione al Sistema di Tracciabilità del Farmaco Manuale per la registrazione al sistema Versione 1.0 20 11 2009 SISN_SSW.MSW_FARUM_TRA_MTR_REG.doc Pagina 1 di 22 Versione 1.0 Scheda informativa
Guida di addestramento Introduzione alle Comunicazioni Obbligatorie [COB] SINTESI
![Guida di addestramento Introduzione alle Comunicazioni Obbligatorie [COB] SINTESI Guida di addestramento Introduzione alle Comunicazioni Obbligatorie [COB] SINTESI](/thumbs/33/15778229.jpg) SINTESI Introduzione alle Comunicazioni Obbligatorie [COB] Questo documento è una guida al sito dedicato alle aziende: archivio delle comunicazioni obbligatorie che i datori di lavoro sono tenuti ad effettuare
SINTESI Introduzione alle Comunicazioni Obbligatorie [COB] Questo documento è una guida al sito dedicato alle aziende: archivio delle comunicazioni obbligatorie che i datori di lavoro sono tenuti ad effettuare
Il progetto CCM Piano operativo nazionale per la prevenzione degli effetti del caldo sulla salute
 Il progetto CCM Piano operativo nazionale per la prevenzione degli effetti del caldo sulla salute Francesca de Donato Dipartimento di Epidemiologia SSR Lazio\ASLRME Centro di Competenza DPC Roma, 17 dicembre
Il progetto CCM Piano operativo nazionale per la prevenzione degli effetti del caldo sulla salute Francesca de Donato Dipartimento di Epidemiologia SSR Lazio\ASLRME Centro di Competenza DPC Roma, 17 dicembre
Regolamento per la formazione continua professionale
 Regolamento per la formazione continua professionale Approvato dal comitato dell Associazione Cranio Suisse il 18 agosto 2011 Regolamento per la formazione continua professionale 1. Norme Generali I terapeuti
Regolamento per la formazione continua professionale Approvato dal comitato dell Associazione Cranio Suisse il 18 agosto 2011 Regolamento per la formazione continua professionale 1. Norme Generali I terapeuti
ULSS2 FELTRE UOC GASTROENTEROLOGIA ED ENDOSCOPIA DIGESTIVA PREPARAZIONI PER LA COLONSCOPIA
 ULSS2 FELTRE UOC GASTROENTEROLOGIA ED ENDOSCOPIA DIGESTIVA PREPARAZIONI PER LA COLONSCOPIA Pag. 2 : Pag. 4 : Pag. 6 : preparazione con LOVOL-ESSE preparazione con MOVIPREP preparazione con ISOCOLAN NB:
ULSS2 FELTRE UOC GASTROENTEROLOGIA ED ENDOSCOPIA DIGESTIVA PREPARAZIONI PER LA COLONSCOPIA Pag. 2 : Pag. 4 : Pag. 6 : preparazione con LOVOL-ESSE preparazione con MOVIPREP preparazione con ISOCOLAN NB:
REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO-SANITARIA N. 6 VICENZA DELIBERAZIONE. n. 749 del 26-10-2015 O G G E T T O
 REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO-SANITARIA N. 6 VICENZA DELIBERAZIONE n. 749 del 26-10-2015 O G G E T T O Istituzione Commissione per la valutazione della richiesta di farmaci non erogabili
REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO-SANITARIA N. 6 VICENZA DELIBERAZIONE n. 749 del 26-10-2015 O G G E T T O Istituzione Commissione per la valutazione della richiesta di farmaci non erogabili
Generici / Equivalenti / Biosimilari di nuova registrazione mediante procedura centralizzata.
 AllegatoallaDeterminaAIFANumero1445/2014del09/12/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
AllegatoallaDeterminaAIFANumero1445/2014del09/12/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
Questa la racconto Elidel e Protopic. Osservatorio Arno Bologna 2 luglio 2007
 Questa la racconto Elidel e Protopic Osservatorio Arno Bologna 2 luglio 2007 Questa la racconto Questionario online da giugno 2006 sul sito Internet www. altroconsumo.it Per utilizzatori di creme Elidel
Questa la racconto Elidel e Protopic Osservatorio Arno Bologna 2 luglio 2007 Questa la racconto Questionario online da giugno 2006 sul sito Internet www. altroconsumo.it Per utilizzatori di creme Elidel
Trattamento del diabete mellito in adulti, adolescenti e bambini a partire dai 2 anni di età.
 AllegatoallaDeterminaAIFANumero1445/2014del09/12/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
AllegatoallaDeterminaAIFANumero1445/2014del09/12/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
Gestione della terapia orale, diario delle terapie e coinvolgimento del paziente. (Racc. RER n.3: sez.4.7 4.9)
 Giunta Regionale Direzione Generale Sanità e Politiche Sociali Servizio Politica del Farmaco Agenzia sanitaria e sociale regionale Raccomandazione Regionale per la sicurezza nella terapia farmacologica
Giunta Regionale Direzione Generale Sanità e Politiche Sociali Servizio Politica del Farmaco Agenzia sanitaria e sociale regionale Raccomandazione Regionale per la sicurezza nella terapia farmacologica
I processi di finanziamento (segue)
 I processi di finanziamento (segue) Finanziamenti a titolo di capitale + capitale proprio Finanziamenti a titolo di credito + debiti a breve e a lungo termine Realizzi derivanti dalle vendite di prodotti/servizi
I processi di finanziamento (segue) Finanziamenti a titolo di capitale + capitale proprio Finanziamenti a titolo di credito + debiti a breve e a lungo termine Realizzi derivanti dalle vendite di prodotti/servizi
LA COMMISSIONE UNICA DEL FARMACO. Viste le proprie deliberazioni assunte nelle sedute del 25 gennaio 2000 e 7 giugno 2000; Dispone: Art. l.
 PROVVEDIMENTO 20 luglio 2000. Istituzione dell'elenco delle specialità medicinali erogabili a totale carico del Servizio sanitario nazionale ai sensi della legge 648/96. LA COMMISSIONE UNICA DEL FARMACO
PROVVEDIMENTO 20 luglio 2000. Istituzione dell'elenco delle specialità medicinali erogabili a totale carico del Servizio sanitario nazionale ai sensi della legge 648/96. LA COMMISSIONE UNICA DEL FARMACO
UNIVERSITA' CATTOLICA DEL SACRO CUORE FACOLTA' DI MEDICINA E CHIRURGIA "A. GEMELLI" - ROMA CORSO DI LAUREA IN INFERMIERISTICA. Protocollo n...
 UNIVERSITA' CATTOLICA DEL SACRO CUORE FACOLTA' DI MEDICINA E CHIRURGIA "A. GEMELLI" - ROMA CORSO DI LAUREA IN INFERMIERISTICA Protocollo n... Preparazione della Terapia Endovenosa OBIETTIVI Garantire un
UNIVERSITA' CATTOLICA DEL SACRO CUORE FACOLTA' DI MEDICINA E CHIRURGIA "A. GEMELLI" - ROMA CORSO DI LAUREA IN INFERMIERISTICA Protocollo n... Preparazione della Terapia Endovenosa OBIETTIVI Garantire un
FPf per Windows 3.1. Guida all uso
 FPf per Windows 3.1 Guida all uso 3 Configurazione di una rete locale Versione 1.0 del 18/05/2004 Guida 03 ver 02.doc Pagina 1 Scenario di riferimento In figura è mostrata una possibile soluzione di rete
FPf per Windows 3.1 Guida all uso 3 Configurazione di una rete locale Versione 1.0 del 18/05/2004 Guida 03 ver 02.doc Pagina 1 Scenario di riferimento In figura è mostrata una possibile soluzione di rete
ALLEGATO I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 ALLEGATO I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche - Sindrome da astinenza: Con Effentora/Actiq si
ALLEGATO I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche - Sindrome da astinenza: Con Effentora/Actiq si
LA GESTIONE DELLE FORNITURE DEL FARMACO OSSIGENO IN AMBITO DOMICILIARE E DEI SERVIZI CONNESSI ALL OSSIGENOTERAPIA DOMICILIARE
 LA GESTIONE DELLE FORNITURE DEL FARMACO OSSIGENO IN AMBITO DOMICILIARE E DEI SERVIZI CONNESSI ALL OSSIGENOTERAPIA DOMICILIARE La proposta di Assogastecnici Gruppo Gas Medicinali OTTOBRE 2010 PREMESSA Con
LA GESTIONE DELLE FORNITURE DEL FARMACO OSSIGENO IN AMBITO DOMICILIARE E DEI SERVIZI CONNESSI ALL OSSIGENOTERAPIA DOMICILIARE La proposta di Assogastecnici Gruppo Gas Medicinali OTTOBRE 2010 PREMESSA Con
Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale
 Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
SCHEDA DI SEGNALAZIONE DI SOSPETTA REAZIONE AVVERSA A SEGUITO DI UTILIZZO DI SIGARETTA ELETTRONICA
 SCHEDA DI SEGNALAZIONE DI SOSPETTA REAZIONE AVVERSA A SEGUITO DI UTILIZZO DI SIGARETTA ELETTRONICA Codice segnalazione Codice centro Dati del segnalatore Data compilazione Nome e Cognome del segnalatore
SCHEDA DI SEGNALAZIONE DI SOSPETTA REAZIONE AVVERSA A SEGUITO DI UTILIZZO DI SIGARETTA ELETTRONICA Codice segnalazione Codice centro Dati del segnalatore Data compilazione Nome e Cognome del segnalatore
Le novità tecnologiche introdotte dalla Norma CEI 0-21
 Le novità tecnologiche introdotte dalla Norma CEI 0-21 Ing. Francesco Iannello Responsabile Tecnico ANIE/GIFI Reggio Emilia, 25 luglio 2012 SOMMARIO Obiettivi della Norma CEI 0-21 Entrata in vigore della
Le novità tecnologiche introdotte dalla Norma CEI 0-21 Ing. Francesco Iannello Responsabile Tecnico ANIE/GIFI Reggio Emilia, 25 luglio 2012 SOMMARIO Obiettivi della Norma CEI 0-21 Entrata in vigore della
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO ProteqFlu sospensione iniettabile per cavalli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una dose da
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO ProteqFlu sospensione iniettabile per cavalli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una dose da
Linee guida per l'instillazione della vescica - Scheda di avvenuto corso di formazione
 Linee guida per l'instillazione della vescica - Scheda di avvenuto corso di formazione La finalità di questo documento è di integrare le Linee guida EB (basate sulle evidenze) riguardanti le migliori procedure
Linee guida per l'instillazione della vescica - Scheda di avvenuto corso di formazione La finalità di questo documento è di integrare le Linee guida EB (basate sulle evidenze) riguardanti le migliori procedure
DATI PRELIMINARI SU DUE CASI DI SCLEROSI MULTIPLA TRATTATI CON OZONOTERAPIA (dott.luciano C. Giancola - specialista malattie nervose e mentali) La
 DATI PRELIMINARI SU DUE CASI DI SCLEROSI MULTIPLA TRATTATI CON OZONOTERAPIA (dott.luciano C. Giancola - specialista malattie nervose e mentali) La sclerosi multipla è una malattia caratterizzata dalla
DATI PRELIMINARI SU DUE CASI DI SCLEROSI MULTIPLA TRATTATI CON OZONOTERAPIA (dott.luciano C. Giancola - specialista malattie nervose e mentali) La sclerosi multipla è una malattia caratterizzata dalla
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ACICLOVIR ABC 800 mg COMPRESSE ACICLOVIR ABC 400 mg/5 ml SOSPENSIONE ORALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Aciclovir
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ACICLOVIR ABC 800 mg COMPRESSE ACICLOVIR ABC 400 mg/5 ml SOSPENSIONE ORALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Aciclovir
PASQUALE FREGA Assobiotec
 ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
SCHEDA DI VALIDAZIONE DEGLI INTERVENTI. dosi novembre dosi dicembre n. Operatore comunita
 SCHEDA DI VALIDAZIONE DEGLI INTERVENTI cod. identificativo.. regione centro cod.utente 1 2 3 4 5 6 7 8 9 n. cod. int. 10 11 12 13 14 15 16 17 18 19 20 data inizio dose iniziale dosi novembre dosi dicembre
SCHEDA DI VALIDAZIONE DEGLI INTERVENTI cod. identificativo.. regione centro cod.utente 1 2 3 4 5 6 7 8 9 n. cod. int. 10 11 12 13 14 15 16 17 18 19 20 data inizio dose iniziale dosi novembre dosi dicembre
TRIATEC. Caso clinico
 Caso clinico A inizio 2012: una nuova paziente di 34 anni (A.V.) mi chiede al telefono un appuntamento riferendo di essere all inizio della sua prima gravidanza (6 settimane di amenorrea). Chiedo se ha
Caso clinico A inizio 2012: una nuova paziente di 34 anni (A.V.) mi chiede al telefono un appuntamento riferendo di essere all inizio della sua prima gravidanza (6 settimane di amenorrea). Chiedo se ha
Priming Avvio Mantenimento - Stop
 TERAPIA SOSTITUTIVA RENALE CONTINUA Priming Avvio Mantenimento - Stop N. Lanfranconi Terapia Intensiva OEI Genova Premessa Le tecniche di CRRT prevedono l utilizzo di circuiti ematici extracorporei e sotto
TERAPIA SOSTITUTIVA RENALE CONTINUA Priming Avvio Mantenimento - Stop N. Lanfranconi Terapia Intensiva OEI Genova Premessa Le tecniche di CRRT prevedono l utilizzo di circuiti ematici extracorporei e sotto
Codice ATC - Principio Attivo: R03AL04 - indacaterol / glycopyrronium bromide Titolare: NOVARTIS EUROPHARM LTD GUUE 26/02/2016
 A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
Modulo 4 LA GESTIONE CONDIVISA TRA SPECIALISTA E MMG DELLE SINDROMI RINO-BRONCHIALI
 Modulo 4 LA GESTIONE CONDIVISA TRA SPECIALISTA E MMG DELLE SINDROMI RINO-BRONCHIALI 1 Obiettivi del modulo 4 Definire i principali ostacoli che incontra il MMG nella sua attività quotidiana Spiegare le
Modulo 4 LA GESTIONE CONDIVISA TRA SPECIALISTA E MMG DELLE SINDROMI RINO-BRONCHIALI 1 Obiettivi del modulo 4 Definire i principali ostacoli che incontra il MMG nella sua attività quotidiana Spiegare le
Asma difficile on-line
 Asma difficile on-line è il nome di un Archivio web-based promosso dalla SIMRI e gestito in collaborazione con il CINECA che raccoglie casi di pazienti con asma problematico grave, affetti cioè da asma
Asma difficile on-line è il nome di un Archivio web-based promosso dalla SIMRI e gestito in collaborazione con il CINECA che raccoglie casi di pazienti con asma problematico grave, affetti cioè da asma
D.M. 3 agosto 2001. Approvazione del registro di carico e scarico delle sostanze stupefacenti e psicotrope per le unità operative
 D.M. 3 agosto 2001 Approvazione del registro di carico e scarico delle sostanze stupefacenti e psicotrope per le unità operative (Pubblicato nella Gazzetta Ufficiale 3 settembre 2001, n. 204) IL MINISTRO
D.M. 3 agosto 2001 Approvazione del registro di carico e scarico delle sostanze stupefacenti e psicotrope per le unità operative (Pubblicato nella Gazzetta Ufficiale 3 settembre 2001, n. 204) IL MINISTRO
STUDIO PROFESSIONALE DI FISIOTERAPIA
 Studio professionale di fisioterapia: Gli Studi Professionali di Fisioterapia sono strutture dove possono essere erogate prestazioni terapeutiche riconducibili al profilo professionale del fisioterapista
Studio professionale di fisioterapia: Gli Studi Professionali di Fisioterapia sono strutture dove possono essere erogate prestazioni terapeutiche riconducibili al profilo professionale del fisioterapista
VERIFICA DELLA CONGRUITA dalla parte delle imprese
 EdilConnect Scheda operativa VERIFICA DELLA CONGRUITA dalla parte delle imprese GUIDA RAPIDA IMPRESE NON ASSISTITE DA UN CONSULENTE Guida per le imprese iscritte a una o più Casse Edili lombarde, che gestiscono
EdilConnect Scheda operativa VERIFICA DELLA CONGRUITA dalla parte delle imprese GUIDA RAPIDA IMPRESE NON ASSISTITE DA UN CONSULENTE Guida per le imprese iscritte a una o più Casse Edili lombarde, che gestiscono
VISUALFLEET Software Overview
 soft-in VISUALFLEET Software Overview SOFTWARE PER SISTEMI INDUSTRIALI - Strada Antica di None 2/4A - 10092 BEINASCO (TO) - ITALY Tel.: +39-011-39.87.711 - Fax: +39-011-39.87.727 1 Introduzione Il software
soft-in VISUALFLEET Software Overview SOFTWARE PER SISTEMI INDUSTRIALI - Strada Antica di None 2/4A - 10092 BEINASCO (TO) - ITALY Tel.: +39-011-39.87.711 - Fax: +39-011-39.87.727 1 Introduzione Il software
Manuale d uso per la raccolta: Sicurezza degli impianti di utenza a gas - Postcontatore
 Manuale d uso per la raccolta: Sicurezza degli impianti di utenza a gas - Postcontatore 1. Obbligo di comunicazione dei dati... 2 2. Accesso alla raccolta... 2 3. Compilazione... 6 2.1 Dati generali Sicurezza
Manuale d uso per la raccolta: Sicurezza degli impianti di utenza a gas - Postcontatore 1. Obbligo di comunicazione dei dati... 2 2. Accesso alla raccolta... 2 3. Compilazione... 6 2.1 Dati generali Sicurezza
FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
IL DIRETTORE GENERALE. VISTI gli articoli 8 e 9 del decreto legislativo 30 luglio 1999, n. 300;
 DETERMINAZIONE 6 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Renvela» (sevelamer carbonato) - autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determinazione/C
DETERMINAZIONE 6 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Renvela» (sevelamer carbonato) - autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determinazione/C
ISTRUZIONI PER LA DICHIARAZIONE PREZZI ONLINE (Guide naturalistiche)
 ISTRUZIONI PER LA DICHIARAZIONE PREZZI ONLINE (Guide naturalistiche) Come raggiungere il servizio Il servizio di dichiarazione on line è accessibile direttamente dal sito dell assessorato al turismo www.turismo.provincia.venezia.it.
ISTRUZIONI PER LA DICHIARAZIONE PREZZI ONLINE (Guide naturalistiche) Come raggiungere il servizio Il servizio di dichiarazione on line è accessibile direttamente dal sito dell assessorato al turismo www.turismo.provincia.venezia.it.
Stefano Miglior. Il glaucoma ad angolo aperto - G. Cronico SMI
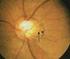 Stefano Miglior Il glaucoma ad angolo aperto - G. Cronico Concetti fondamentali E una malattia estremamente particolare caratterizzata da una progressione lenta ma continua verso la perdita della funzione
Stefano Miglior Il glaucoma ad angolo aperto - G. Cronico Concetti fondamentali E una malattia estremamente particolare caratterizzata da una progressione lenta ma continua verso la perdita della funzione
134 8.1.2014 - BOLLETTINO UFFICIALE DELLA REGIONE TOSCANA - N. 1 DELIBERAZIONE 23 dicembre 2013, n. 1162
 134 8.1.2014 - BOLLETTINO UFFICIALE DELLA REGIONE TOSCANA - N. 1 DELIBERAZIONE 23 dicembre 2013, n. 1162 Indirizzi procedurali ed organizzativi per l attuazione della Legge Regionale 8 maggio 2012 n 18,
134 8.1.2014 - BOLLETTINO UFFICIALE DELLA REGIONE TOSCANA - N. 1 DELIBERAZIONE 23 dicembre 2013, n. 1162 Indirizzi procedurali ed organizzativi per l attuazione della Legge Regionale 8 maggio 2012 n 18,
IL RISPARMIO ENERGETICO E GLI AZIONAMENTI A VELOCITA VARIABILE L utilizzo dell inverter negli impianti frigoriferi.
 IL RISPARMIO ENERGETICO E GLI AZIONAMENTI A VELOCITA VARIABILE L utilizzo dell inverter negli impianti frigoriferi. Negli ultimi anni, il concetto di risparmio energetico sta diventando di fondamentale
IL RISPARMIO ENERGETICO E GLI AZIONAMENTI A VELOCITA VARIABILE L utilizzo dell inverter negli impianti frigoriferi. Negli ultimi anni, il concetto di risparmio energetico sta diventando di fondamentale
Prof. Tarcisio Niglio CURE PALLIATIVE
 Prof. Tarcisio Niglio Anno Accademico 2012-2013 Corso Triennale in Scienze Infermieristiche III anno 2 semestre CURE PALLIATIVE Troverete copia di queste diapositive nel sito internet: www.tarcisio.net
Prof. Tarcisio Niglio Anno Accademico 2012-2013 Corso Triennale in Scienze Infermieristiche III anno 2 semestre CURE PALLIATIVE Troverete copia di queste diapositive nel sito internet: www.tarcisio.net
Misurarsi la pressione non è sempre facile. Guida alla corretta automisurazione domiciliare.
 Misurarsi la pressione non è sempre facile. Guida alla corretta automisurazione domiciliare. L ipertensione (alti valori della pressione arteriosa) è il più importante fattore di rischio per malattie cardiache,
Misurarsi la pressione non è sempre facile. Guida alla corretta automisurazione domiciliare. L ipertensione (alti valori della pressione arteriosa) è il più importante fattore di rischio per malattie cardiache,
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO NAXCEL 200 mg/ml sospensione iniettabile per bovini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO NAXCEL 200 mg/ml sospensione iniettabile per bovini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml
LEGGE 15 Marzo 2010 n. 38: DISPOSIZIONI PER GARANTIRE L ACCESSO ALLE CURE PALLIATIVE E ALLA TERAPIA DEL DOLORE
 LEGGE 15 Marzo 2010 n. 38: DISPOSIZIONI PER GARANTIRE L ACCESSO ALLE CURE PALLIATIVE E ALLA TERAPIA DEL DOLORE SOMMARIO pag.4 Sintesi della normativa pag.6 LEGGE 15 Marzo 2010 n. 38: disposizioni per
LEGGE 15 Marzo 2010 n. 38: DISPOSIZIONI PER GARANTIRE L ACCESSO ALLE CURE PALLIATIVE E ALLA TERAPIA DEL DOLORE SOMMARIO pag.4 Sintesi della normativa pag.6 LEGGE 15 Marzo 2010 n. 38: disposizioni per
INTESA TRA COMUNE DI MILANO E AZIENDA SANITARIA LOCALE CITTA DI MILANO PER LA SOMMINISTRAZIONE DI FARMACI NEI SERVIZI ALL INFANZIA (0-6 ANNI)
 INTESA TRA COMUNE DI MILANO E AZIENDA SANITARIA LOCALE CITTA DI MILANO PER LA SOMMINISTRAZIONE DI FARMACI NEI SERVIZI ALL INFANZIA (0-6 ANNI) Al fine di garantire un approccio coordinato alla gestione
INTESA TRA COMUNE DI MILANO E AZIENDA SANITARIA LOCALE CITTA DI MILANO PER LA SOMMINISTRAZIONE DI FARMACI NEI SERVIZI ALL INFANZIA (0-6 ANNI) Al fine di garantire un approccio coordinato alla gestione
Periotest è un misuratore per uso in odontoiatria con il seguente spettro di applicazioni:
 PERIOTEST Lo strumento di misurazione dentale per l implantologia e l odontoiatria esigente CHI È MEDIZINTECHNIK GULDEN Nel 1997 la ditta Medizintechnik Gulden ha acquisito da Siemens AG i diritti esclusivi
PERIOTEST Lo strumento di misurazione dentale per l implantologia e l odontoiatria esigente CHI È MEDIZINTECHNIK GULDEN Nel 1997 la ditta Medizintechnik Gulden ha acquisito da Siemens AG i diritti esclusivi
A2A SpA - Regolamentazione di Mercato. 24 gennaio 2008
 A2A SpA - Regolamentazione di Mercato 24 gennaio 2008 Indice del documento Delibera n. 139/07 - Direttiva in tema di qualità dei servizi telefonici dei venditori di energia elettrica e di gas Delibera
A2A SpA - Regolamentazione di Mercato 24 gennaio 2008 Indice del documento Delibera n. 139/07 - Direttiva in tema di qualità dei servizi telefonici dei venditori di energia elettrica e di gas Delibera
Raccomandazione per per la la prevenzione dell osteonecrosi della della mascella/mandibola da da bifosfonati in in ambito ambito oncologico
 Raccomandazione 0, 0, Marzo Marzo 008. 008. Raccomandazione per per la la prevenzione dell osteonecrosi della della. Committenza della Direzione Aziendale/Zonale per la prevenzione della osteonecrosi da
Raccomandazione 0, 0, Marzo Marzo 008. 008. Raccomandazione per per la la prevenzione dell osteonecrosi della della. Committenza della Direzione Aziendale/Zonale per la prevenzione della osteonecrosi da
U.O. FARMACIA LFA.P 13
 . Pag. 1 / 5 Viene definito File F il tracciato record per la gestione, attivazione e rendicontazione dei farmaci somministrati e forniti dalle strutture ospedaliere, per l utilizzo ambulatoriale e domiciliare,
. Pag. 1 / 5 Viene definito File F il tracciato record per la gestione, attivazione e rendicontazione dei farmaci somministrati e forniti dalle strutture ospedaliere, per l utilizzo ambulatoriale e domiciliare,
MANUALE REGISTRAZIONE UTENTE
 MANUALE REGISTRAZIONE UTENTE Aggiornato al 16 Gennaio 2015 Registrazione utente Manuale utente Pagina 1 di 41 Sommario 1 Introduzione... 3 2 Abilitazione ai sistemi informativi AIFA... 4 3 Registrazione...
MANUALE REGISTRAZIONE UTENTE Aggiornato al 16 Gennaio 2015 Registrazione utente Manuale utente Pagina 1 di 41 Sommario 1 Introduzione... 3 2 Abilitazione ai sistemi informativi AIFA... 4 3 Registrazione...
Educazione terapeutica a malati sottoposti a chemioterapia che presentano nausea e vomito.
 Progetto ET Formazione in educazione per infermieri in oncologia I livello Educazione terapeutica a malati sottoposti a chemioterapia che presentano nausea e vomito. Progetto educativo presentato da Graziella
Progetto ET Formazione in educazione per infermieri in oncologia I livello Educazione terapeutica a malati sottoposti a chemioterapia che presentano nausea e vomito. Progetto educativo presentato da Graziella
farmaceutica Clavulanic acid 10 mg Dosaggio standard di 10 mg di amoxicillina/2,5 mg di acido clavulanico/kg di peso corporeo Repubblica Ceca
 Allegato I Elenco dei nomi, della forma farmaceutica, del dosaggio del medicinale veterinario, della specie animale, della via di somministrazione, del richiedente/titolare dell autorizzazione all immissione
Allegato I Elenco dei nomi, della forma farmaceutica, del dosaggio del medicinale veterinario, della specie animale, della via di somministrazione, del richiedente/titolare dell autorizzazione all immissione
Manuale della qualità. Procedure. Istruzioni operative
 Unione Industriale 19 di 94 4.2 SISTEMA QUALITÀ 4.2.1 Generalità Un Sistema qualità è costituito dalla struttura organizzata, dalle responsabilità definite, dalle procedure, dai procedimenti di lavoro
Unione Industriale 19 di 94 4.2 SISTEMA QUALITÀ 4.2.1 Generalità Un Sistema qualità è costituito dalla struttura organizzata, dalle responsabilità definite, dalle procedure, dai procedimenti di lavoro
DELIBERAZIONE N. 5/31 DEL 11.2.2014. Istituzione della rete per la terapia del dolore della Regione Sardegna.
 Oggetto: Istituzione della rete per la terapia del dolore della Regione Sardegna. L Assessore dell'igiene e Sanità e dell'assistenza Sociale ricorda che la legge 15 marzo 2010, n. 38, tutela il diritto
Oggetto: Istituzione della rete per la terapia del dolore della Regione Sardegna. L Assessore dell'igiene e Sanità e dell'assistenza Sociale ricorda che la legge 15 marzo 2010, n. 38, tutela il diritto
La tutela dei pazienti affetti da malattie rare
 La tutela dei pazienti affetti da malattie rare Isabella Quinti Responsabile Centro di Riferimento Immunodeficienze Primitive Sapienza Università di Roma La tutela Sociale: Non sentirsi solo Legislativa
La tutela dei pazienti affetti da malattie rare Isabella Quinti Responsabile Centro di Riferimento Immunodeficienze Primitive Sapienza Università di Roma La tutela Sociale: Non sentirsi solo Legislativa
Farmacovigilanza Veterinaria
 Farmacovigilanza Centro Regionale della Campania Dr.ssa Silvia Cappiello(Phd,DVM) 1. La Farmacovigilanza Che cosa è la farmacovigilanza La parola farmacovigilanza deriva dal greco Pharmakon (veleno-medicina)
Farmacovigilanza Centro Regionale della Campania Dr.ssa Silvia Cappiello(Phd,DVM) 1. La Farmacovigilanza Che cosa è la farmacovigilanza La parola farmacovigilanza deriva dal greco Pharmakon (veleno-medicina)
PIANO ASSISTENZIALE INDIVIDUALE DIALISI DOMICILIARE (P.A.I.D.D.) PROPOSTA di supporto al trattamento dialitico domiciliare
 Allegato C) Al Direttore del Distretto di dell Azienda Sanitaria Locale PIANO ASSISTENZIALE INDIVIDUALE DIALISI DOMICILIARE (P.A.I.D.D.) PROPOSTA di supporto al trattamento dialitico domiciliare Cognome
Allegato C) Al Direttore del Distretto di dell Azienda Sanitaria Locale PIANO ASSISTENZIALE INDIVIDUALE DIALISI DOMICILIARE (P.A.I.D.D.) PROPOSTA di supporto al trattamento dialitico domiciliare Cognome
Corretto utilizzo delle soluzioni concentrate di Potassio cloruro. ed altre soluzioni contenenti Potassio
 cloruro cloruro Data Revisione Redazione Approvazione Autorizzazione N archiviazione 00/00/2010 e Risk management Produzione Qualità e Risk management Direttore Sanitario 1 cloruro INDICE: 1. Premessa
cloruro cloruro Data Revisione Redazione Approvazione Autorizzazione N archiviazione 00/00/2010 e Risk management Produzione Qualità e Risk management Direttore Sanitario 1 cloruro INDICE: 1. Premessa
Limitazioni d uso dei medicinali contenenti domperidone
 1 settembre 2014 EMA/465179/2014 Il 23 aprile 2014 il gruppo di coordinamento per le procedure di mutuo riconoscimento e decentrate - medicinali per uso umano (CMDh) ha approvato le raccomandazioni relative
1 settembre 2014 EMA/465179/2014 Il 23 aprile 2014 il gruppo di coordinamento per le procedure di mutuo riconoscimento e decentrate - medicinali per uso umano (CMDh) ha approvato le raccomandazioni relative
Automedicarsi vuol dire curare da sé lievi disturbi o sintomi passeggeri,
 1. RESPONSABILE 1. CHE COSA È L AUTOMEDICAZIONE RESPONSABILE Automedicarsi vuol dire curare da sé lievi disturbi o sintomi passeggeri, come tosse, raffreddore, stitichezza: disturbi che conosciamo bene,
1. RESPONSABILE 1. CHE COSA È L AUTOMEDICAZIONE RESPONSABILE Automedicarsi vuol dire curare da sé lievi disturbi o sintomi passeggeri, come tosse, raffreddore, stitichezza: disturbi che conosciamo bene,
