Esame (0) classei - Codice Prova:
|
|
|
- Timoteo Leone
- 5 anni fa
- Visualizzazioni
Transcript
1 1) Il diossido di zolfo reagirà con l acqua secondo la reazione: SO 2 (g) + H 2 O (l) H 2 SO 3 (l) Quanto diossido di zolfo è necessario per preparare g di H 2 SO 3 (l)? A g B g C g D g E g 2) Se dalla completa combustione di un campione di etilene si ottengono 16.0 g di CO 2, qual era la massa iniziale di etilene? C 2 H 4 (g) + 3 O 2 2 CO 2 (g) + 2 H 2 O (g) A g B g C g D g E g 3) Il rame puro può essere prodotto per reazione del solfuro di rame (I) con ossigeno: Cu 2 S (s) + O 2 (g) 2 Cu (s) + SO 2 (g) Se la reazione di kg di solfuro di rame(i) con eccesso di ossigeno ha portato alla formazione di 0.19 kg di rame metallico, qual è la resa percentuale? A. 67.9% B. 27.1% C. 39.9% D. 135% E. 33.9% 4) Quanti grammi di ossigeno si formano quando si formano di 6.21 moli di KOH? 4 KO 2 (s) + 2 H 2 O (l) 4 KOH (s) + 3 O 2 (g) A g di O 2 B g di O 2 C. 199 g di O 2 D g di O 2 E g di O 2 5) Litio ed azoto si combinano tra loro per produrre nitruro di litio: 6 Li (s) + N 2 (g) 2 Li 3 N (s) Quante moli di litio sono necessarie per produrre 0.60 moli di Li 3 N quando la reazione avviene in presenza di un eccesso di azoto? A mol B mol C. 1.8 mol D. 3.6 mol E mol 6) Quanto ferro può essere prodotto dalla reazione di 175 kg di Fe 2 O 3 con 385 kg di CO? Fe 2 O 3 (s) + CO (g) 2 Fe (s) + 3 CO 2 (g) A. 512 kg B kg C kg D kg E. 122 kg 7) PCl 3 può essere prodotto dalla reazione tra P 4 e Cl 2 :
2 P 4 (s) + 6 Cl 2 (g) 4 PCl 3 (g) Se 1.00 g di P 4 reagiscono con 1.00 g di Cl 2, qual è il reagente limitante? Quanto prodotto può essere formato? A. il fosforo; 4.40 g B. il cloro; 2.00 g C. il cloro; 1.28 g D. il fosforo; 1.28 g E. non c è un reagente limitante; 2.00 g 8) Se 27.9 g di LiCl sono sciolti in 175 g di H 2 O, qual è il peso percentuale di LiCl in soluzione? A. 13.8% B. 19.0% C % D. 15.9% E. 6.78% 9) Qual è la percentuale in massa di soluzione acquosa di idrossido di sodio nella quale la frazione molare di NaOH è ? A. 23% B. 10.0% C. 69% D. 5% E. 2% 10) Quante moli di ione solfato sono presenti in L di una soluzione M di Al 2 (SO 4 ) 3? A mol B mol C mol D mol E mol 11) Calcolare il volume finale che dovrebbe avere una soluzione di NaCl preparata diluendo 10,0 ml di una soluzione 6,9 M per ottenere una concentrazione finale di 0,0500 M. A. 1380,0 ml B. 346,09 ml C ,0 ml D. 138,0 ml E. 100,03 ml 12) Lo zinco reagisce con acido cloridrico: Zn (s) + 2 HCl (aq) ZnCl 2 (aq) + H 2 (g) Quale volume di HCl 3.05 M è necessario per far reagire 25.0 g di Zn (s)? A L B L C L D L E L 13) Quanti millilitri di una soluzione M di Na 2 S sono necessari per reagire con ml di una soluzione M di AgNO 3? Na 2 S (aq) + 2 AgNO 3 (aq) 2 NaNO 3 (aq) + Ag 2 S (s) A ml B ml C ml D ml
3 E ml 14) Sulla base della reazione chimica sotto riportata, determinare la molarità di una soluzione contenente Fe 2+ (aq), quando ml di tale soluzione sono necessari per reagire completamente con ml di una soluzione M di bromato di potassio, KBrO 3 (aq). 6 Fe 2+ (aq) + BrO 3 - (aq) + 6 H + (aq) 6 Fe 3+ (aq) + Br - (aq) + 3 H 2 O (l). A M B M C M D M E M 15) Se ml di una soluzione M di acido cloridrico vengono aggiunti a 135 ml di una soluzione M di Mg(OH) 2, la soluzione risultante sarà: A. fredda B. Non è possibile prevedere quale sarà la natura della soluzione dalle informazioni date C. neutra D. acida E. basica 16) Un gas tenuto alla temperatura di 25.0 C occupa un volume di 10.0 L alla pressione di 629 torr. Utilizzando la legge di Charles, calcolare il volume (in L) che il gas occuperebbe se la temperatura venisse innalzata a 121 C mantenendo la pressione costante a 629 torr. A L B L C L D L E L 17) Quale volume (in ml) occuperà un campione di F 2 gassoso in un recipiente alla pressione di 5.5 atm, se lo stesso campione di F 2 alla pressione di 1.2 atm occupa un volume di 25.0 ml? A. 7.6 ml B. 5.5 ml C. 17 ml D. 11 ml E. 3.8 ml 18) Un campione di gas è mantenuto a pressione costante ed occupa 3.62 L ad una temperatura di 21.6 C. Quale sarà la temperatura del gas se il volume diventa 3.40 L? A. 314 K B K C. 277 K D. 550 K E. 295 K 19) Quale pressione eserciterebbe una miscela di gas composta da 48.5 g di He e da 94.6 g di CO 2 in una bombola da 10.0 L alla temperatura di 398 K? Pesi atomici: He = g/mol, C = g/mol, O = g/mol A atm B atm C atm D atm E atm 20) Un pallone contiene 0.76 moli di N 2, 0.18 moli di O 2, moli di He e moli di H 2 alla pressione di
4 749 mmhg. Qual è la pressione parziale di O 2? A. 570 mmhg B. 20 mmhg C. Nessuna delle pressioni riportate D. 23 mmhg E. 140 mmhg
5 Powered by TCPDF ( RISPOSTE CORRETTE 1) D 2) D 3) E 4) A 5) C 6) E 7) C 8) A 9) B 10) C 11) A 12) B 13) C 14) C 15) E 16) B 17) B 18) C 19) D 20) E
Problema 1 Mg + 2HCl H 2 + MgCl 2. di Mg 1 Mg 1 H 2 quindi 0,823 moli di H 2 di H 2
 REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
I Gas e Loro Proprietà (II)
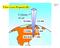 I Gas e Loro Proprietà (II) 2017 10 miles 0.2 atm 4 miles 0.5 atm Sea level 1 atm Dario Bressanini Gas e reazioni chimiche Determinare il volume di CO 2 prodotto a 37 0 C e 1.0 atm quando 5.6 g di glucosio
I Gas e Loro Proprietà (II) 2017 10 miles 0.2 atm 4 miles 0.5 atm Sea level 1 atm Dario Bressanini Gas e reazioni chimiche Determinare il volume di CO 2 prodotto a 37 0 C e 1.0 atm quando 5.6 g di glucosio
Esercizi di. Stechiometria dei composti. mercoledì 9 dicembre 2015
 Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
ossidazione/riduzione, ossidante/riducente
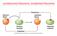 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
Appello del 6 luglio 2017 ESERCIZI NUMERICI. Fila A
 Appello del 6 luglio 2017 ESERCIZI NUMERICI Fila A 1C) L acido solforico ossida a caldo il rame con formazione di solfato di rame(ii), biossido di zolfo e acqua, secondo la seguente reazione (da bilanciare):
Appello del 6 luglio 2017 ESERCIZI NUMERICI Fila A 1C) L acido solforico ossida a caldo il rame con formazione di solfato di rame(ii), biossido di zolfo e acqua, secondo la seguente reazione (da bilanciare):
Lezione 5. Equazioni Chimiche e Stechiometria
 2018 Lezione 5. Equazioni Chimiche e Stechiometria n. moli = g sostanza M (g/mol) g sostanza = n. moli x M (g/mol) 1 Stechiometria Affronta gli aspeb quanctacvi delle reazioni chimiche, si basa sul principio
2018 Lezione 5. Equazioni Chimiche e Stechiometria n. moli = g sostanza M (g/mol) g sostanza = n. moli x M (g/mol) 1 Stechiometria Affronta gli aspeb quanctacvi delle reazioni chimiche, si basa sul principio
ESERCIZI SU. le soluzioni e la loro composizione
 ESERCIZI SU le soluzioni e la loro composizione martedì 15 dicembre 2015 Composizione delle soluzioni definita da grandezze di primario interesse fisico Composizione percentuale in massa % di A = (m A
ESERCIZI SU le soluzioni e la loro composizione martedì 15 dicembre 2015 Composizione delle soluzioni definita da grandezze di primario interesse fisico Composizione percentuale in massa % di A = (m A
LICEO SCIENTIFICO STATALE Nicola Sensale NOCERA INFERIORE (SA)
 1. 14,0 g di azoto puro (N 2) sono costituiti da un numero di molecole uguale a: A) 6,02 10 23 B) 3,01 10 23 C) 1,20 10 24 D) lo stesso numero di particelle contenute in 12,0 g di 12 C 2 Un recipiente
1. 14,0 g di azoto puro (N 2) sono costituiti da un numero di molecole uguale a: A) 6,02 10 23 B) 3,01 10 23 C) 1,20 10 24 D) lo stesso numero di particelle contenute in 12,0 g di 12 C 2 Un recipiente
Prova in itinere di Chimica Generale 14 Gennaio 2010
 Prova in itinere di Chimica Generale 14 Gennaio 2010 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 14 Gennaio 2010 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
ossidazione/riduzione, ossidante/riducente
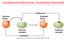 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
Calcolo del numero di moli dei reagenti: P.M. HCl= 36 uma. 36 g/mol. n HCl = 1,9 g = 0,0528 moli
 ESERCIZI DI STECHIOMETRIA IN CUI COMPAIONO SPECIE ALLO STATO GASSOSO Es. ESERCIZIO 1 Nella reazione tra alluminio ed acido cloridrico si sviluppa idrogeno gassoso. Determinare il volume di H 2, misurato
ESERCIZI DI STECHIOMETRIA IN CUI COMPAIONO SPECIE ALLO STATO GASSOSO Es. ESERCIZIO 1 Nella reazione tra alluminio ed acido cloridrico si sviluppa idrogeno gassoso. Determinare il volume di H 2, misurato
Leggi ricavate da osservazioni sperimentali : mantenendo costante due dei 4 parametri, come variano gli altri due?
 Le leggi dei gas Lo stato gassoso è caratterizzato da mancanza di forma e volume propri, e dalla tendenza a occupare tutto il volume disponibile. Lo stato di un gas dipende da 4 parametri: Volume (V) Pressione
Le leggi dei gas Lo stato gassoso è caratterizzato da mancanza di forma e volume propri, e dalla tendenza a occupare tutto il volume disponibile. Lo stato di un gas dipende da 4 parametri: Volume (V) Pressione
Scritto chimica generale
 Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Esame di Chimica Generale 21 Febbraio 2012
 Esame di Chimica Generale 21 Febbraio 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 21 Febbraio 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esercizi bilanciamento redox
 Esercizi bilanciamento redox Bilanciare la reazione e calcolare la massima quantità (in grammi) di zinco nitrato che si ottiene facendo reagire 2.10 10 3 g di acido nitrico puro al 85.0 % p/p con un eccesso
Esercizi bilanciamento redox Bilanciare la reazione e calcolare la massima quantità (in grammi) di zinco nitrato che si ottiene facendo reagire 2.10 10 3 g di acido nitrico puro al 85.0 % p/p con un eccesso
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI DI RIEPILOGO GENERALE
 ESERCIZI DI RIEPILOGO GENERALE 1) Scrivere le formule brute e le formule di Lewis per: ammoniaca; ione ammonio; ione solfato; ione bicarbonato; acido acetico; anidride solforosa. Dove necessario, indicare
ESERCIZI DI RIEPILOGO GENERALE 1) Scrivere le formule brute e le formule di Lewis per: ammoniaca; ione ammonio; ione solfato; ione bicarbonato; acido acetico; anidride solforosa. Dove necessario, indicare
PROVA SCRITTA DI CHIMICA GENERALE ED INORGANICA Scienze e Tecnologie per l Ambiente
 10 Dicembre 2008 eventuale presenza di momento dipolare per I - 3 e per gli anioni dei sali: nitrato di sodio, perclorato di potassio. 2) a) Calcolare il ph di una soluzione di carbonato di sodio 0.10
10 Dicembre 2008 eventuale presenza di momento dipolare per I - 3 e per gli anioni dei sali: nitrato di sodio, perclorato di potassio. 2) a) Calcolare il ph di una soluzione di carbonato di sodio 0.10
TUTORAGGIO CHIMICA A.A. 2018/2019 Tutoraggio Chimica (Prof. L. Pilia) Nicola Melis
 TUTORAGGIO CHIMICA 20.11.2018 1 Che volume, in ml, di acido cloridrico 2,50 M è necessario per far reagire completamente 11,8 g di Zn? Quale sarà la molarità di ZnCl 2 a seguito della reazione? Zn + HCl
TUTORAGGIO CHIMICA 20.11.2018 1 Che volume, in ml, di acido cloridrico 2,50 M è necessario per far reagire completamente 11,8 g di Zn? Quale sarà la molarità di ZnCl 2 a seguito della reazione? Zn + HCl
SOLUZIONI COMPITO A DI CHIMICA DEL
 SOLUZIONI COMPITO A DI CHIMICA DEL 26-11-10 1A) Il permanganato di potassio reagisce con il perossido di idrogeno in presenza di acido solforico dando luogo alla formazione di ossigeno, diossido di manganese
SOLUZIONI COMPITO A DI CHIMICA DEL 26-11-10 1A) Il permanganato di potassio reagisce con il perossido di idrogeno in presenza di acido solforico dando luogo alla formazione di ossigeno, diossido di manganese
Prima parte dell esame di CHIMICA GENERALE ED INORGANICA CORSO DI LAUREA IN SCIENZE BIOLOGICHE (L-Z) (ELABORATO SIMBOLICO-NUMERICO)
 (Es.1) 1) 4.4 grammi di propano, C 3 H 8, vengono bruciati in aria. Determinare la massa dell ossigeno consumato nella combustione. R = 16 g 2) La costante di equilibrio della seguente reazione di dissociazione
(Es.1) 1) 4.4 grammi di propano, C 3 H 8, vengono bruciati in aria. Determinare la massa dell ossigeno consumato nella combustione. R = 16 g 2) La costante di equilibrio della seguente reazione di dissociazione
Reagente limitante / in eccesso
 220,0 g di nitrato di argento vengono aggiunti ad una soluzione contenente 98.0 g di cloruro di calcio. Si forma cloruro di argento e nitrato di calcio. 2 AgNO3 + CaCl2 2 AgCl + Ca(NO3)2 Individuare il
220,0 g di nitrato di argento vengono aggiunti ad una soluzione contenente 98.0 g di cloruro di calcio. Si forma cloruro di argento e nitrato di calcio. 2 AgNO3 + CaCl2 2 AgCl + Ca(NO3)2 Individuare il
prendono parte alla reazione.
 REAZIONI CHIMICHE A + B = C + D A, B = reagenti C, D = prodotti Es. C 3 H 8 (g) + O 2 (g) = CO 2 (g) + H 2 O (g) propano BILANCIAMENTO DELL EQUAZIONE DI REAZIONE (principio di conservazione della massa)
REAZIONI CHIMICHE A + B = C + D A, B = reagenti C, D = prodotti Es. C 3 H 8 (g) + O 2 (g) = CO 2 (g) + H 2 O (g) propano BILANCIAMENTO DELL EQUAZIONE DI REAZIONE (principio di conservazione della massa)
N.B. Indicare i passaggi dei calcoli
 Corso Corso di di Laurea Laurea in in Fisica ca COMPITO N 3 DA CONSEGNARE ENTRO IL 11/12/09 Cognome Nome(*)....N di Matricola (*) scrivere in stampatello N.B. Indicare i passaggi dei calcoli 1. Il cloro
Corso Corso di di Laurea Laurea in in Fisica ca COMPITO N 3 DA CONSEGNARE ENTRO IL 11/12/09 Cognome Nome(*)....N di Matricola (*) scrivere in stampatello N.B. Indicare i passaggi dei calcoli 1. Il cloro
See more about
 See more about www.scienzaescuola.it ESERCIZI DI STECHIOMETRIA CON ESEMPI DI SOLUZIONI TIPO. Prof. Gabrielli Luciano (Lic. Scientifico L. da Vinci -Sora FR) P.M : Calcola il P.M. di: Al 2 (SO 4 ) 3 Fe(NO
See more about www.scienzaescuola.it ESERCIZI DI STECHIOMETRIA CON ESEMPI DI SOLUZIONI TIPO. Prof. Gabrielli Luciano (Lic. Scientifico L. da Vinci -Sora FR) P.M : Calcola il P.M. di: Al 2 (SO 4 ) 3 Fe(NO
Correzione Parziale del 24/01/2014
 Correzione Parziale del 24/01/2014 Compito A Esercizio 1 L analisi elementare di una sostanza ha dato il seguente risultato: C 52,2%, H 13%, O 34,8%. 3,83 g di questa sostanza vengono introdotti in un
Correzione Parziale del 24/01/2014 Compito A Esercizio 1 L analisi elementare di una sostanza ha dato il seguente risultato: C 52,2%, H 13%, O 34,8%. 3,83 g di questa sostanza vengono introdotti in un
SOLUZIONE DEL COMPITO A DI CHIMICA DEL
 SOLUZIONE DEL COMPITO A DI CHIMICA DEL 05-07-13 1A) 33.5 g di ioduro di sodio e 33.0 g di iodio vengono sciolti in acqua trattati con 17.9 L (a c.n.) di cloro; si formano iodato di sodio, acido iodico
SOLUZIONE DEL COMPITO A DI CHIMICA DEL 05-07-13 1A) 33.5 g di ioduro di sodio e 33.0 g di iodio vengono sciolti in acqua trattati con 17.9 L (a c.n.) di cloro; si formano iodato di sodio, acido iodico
Le reazioni chimiche
 Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Una reazione chimica è un processo in cui una serie di sostanza (dette reagenti) viene convertita in altre sostanza (dette
Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Una reazione chimica è un processo in cui una serie di sostanza (dette reagenti) viene convertita in altre sostanza (dette
ATTIVITA' ESTIVA 3ASA
 ATTIVITA' ESTIVA 3ASA PROBLEMI STECHIOMETRIA 1) Nella reazione chimica AsF 3 + C 2 Cl 6 AsCl 3 + C 2 Cl 2 F 4 la resa teorica di C 2 Cl 2 F 4 è stata calcolata in 1,86 mol. Se la resa in percentuale della
ATTIVITA' ESTIVA 3ASA PROBLEMI STECHIOMETRIA 1) Nella reazione chimica AsF 3 + C 2 Cl 6 AsCl 3 + C 2 Cl 2 F 4 la resa teorica di C 2 Cl 2 F 4 è stata calcolata in 1,86 mol. Se la resa in percentuale della
Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 1: mole, bilanciamento di equazioni chimiche non redox, formule minime e
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 1: mole, bilanciamento di equazioni chimiche non redox, formule minime e
Prova scritta d esame
 Prova scritta d esame Sono riportati i testi e, successivamente, le soluzioni di prove scritte d esame. Il documento intende dare una informazione sul livello della prova con cui si confronteranno gli
Prova scritta d esame Sono riportati i testi e, successivamente, le soluzioni di prove scritte d esame. Il documento intende dare una informazione sul livello della prova con cui si confronteranno gli
Reazioni chimiche e stechiometria
 Reazioni chimiche e stechiometria REAZIONI CHIMICHE Trasformazione di una o più sostanze (reagenti) in una o più sostanze (prodotti) EQUAZIONE CHIMICA Una equazione chimica è la rappresentazione simbolica
Reazioni chimiche e stechiometria REAZIONI CHIMICHE Trasformazione di una o più sostanze (reagenti) in una o più sostanze (prodotti) EQUAZIONE CHIMICA Una equazione chimica è la rappresentazione simbolica
Chimica A.A. 2017/2018
 Chimica A.A. 2017/2018 INGEGNERIA BIOMEDICA Tutorato Lezione 8 Calcolare il ph di una soluzione ottenuta mescolando 6.30 g di HNO 3 in acqua e avente un volume di 1500 ml Calcoliamo il peso molecolare
Chimica A.A. 2017/2018 INGEGNERIA BIOMEDICA Tutorato Lezione 8 Calcolare il ph di una soluzione ottenuta mescolando 6.30 g di HNO 3 in acqua e avente un volume di 1500 ml Calcoliamo il peso molecolare
Classe ISB. 1. (1pt.) Calcola la massa molecolare e la massa molare delle seguenti molecole:
 Cl 2 CO 2 Ca(OH) 2 H 2 CO 3 2. (0,5 pt.) Calcola il volume occupato da 3 moli di O 2 (g) in STP 3. (0,5 pt.) Calcola il peso in grammi di una molecola di H 2 O 4. (1 pt.) Trova la composizione percentuale
Cl 2 CO 2 Ca(OH) 2 H 2 CO 3 2. (0,5 pt.) Calcola il volume occupato da 3 moli di O 2 (g) in STP 3. (0,5 pt.) Calcola il peso in grammi di una molecola di H 2 O 4. (1 pt.) Trova la composizione percentuale
Cosa è una reazione chimica?
 Cosa è una reazione chimica? Una reazione chimica è un processo o trasformazione della materia che porta alla formazione di nuove sostanze, i prodotti, trasformando profondamente le sostanze di partenza,
Cosa è una reazione chimica? Una reazione chimica è un processo o trasformazione della materia che porta alla formazione di nuove sostanze, i prodotti, trasformando profondamente le sostanze di partenza,
Calcolare la resa teorica di AgCl: 0.640g x 100/98.3 = 0.651g. Calcolare le moli di AgCl: massa molare AgCl: g/mol
 Esercizio 1 Quanti millilitri di una soluzione 2.73x10-1 M di AgNO3 bisogna far reagire con una soluzione di HCl per ottenere 640 mg di AgCl sapendo che la resa della reazione è del 98.3%. Scrivere la
Esercizio 1 Quanti millilitri di una soluzione 2.73x10-1 M di AgNO3 bisogna far reagire con una soluzione di HCl per ottenere 640 mg di AgCl sapendo che la resa della reazione è del 98.3%. Scrivere la
Chimica A.A. 2017/2018
 Chimica A.A. 2017/2018 INGEGNERIA BIOMEDICA Tutorato Lezione 6 Un gas contenuto in una bombola da 5,0 dm 3 esercita una pressione di 2,6 am. Il gas viene quindi compresso in condizioni isoterme fino ad
Chimica A.A. 2017/2018 INGEGNERIA BIOMEDICA Tutorato Lezione 6 Un gas contenuto in una bombola da 5,0 dm 3 esercita una pressione di 2,6 am. Il gas viene quindi compresso in condizioni isoterme fino ad
SOLUZIONI DEL COMPITO DI CHIMICA DEL
 SOLUZIONI DEL COMPITO DI CHIMICA DEL 19-11-12 1) Determinare la formula minima di un composto organico contenente C, H, O e N sapendo che: a) dalla combustione di 1.278 g di tale composto si ottengono
SOLUZIONI DEL COMPITO DI CHIMICA DEL 19-11-12 1) Determinare la formula minima di un composto organico contenente C, H, O e N sapendo che: a) dalla combustione di 1.278 g di tale composto si ottengono
Esame di Chimica Generale 10 Settembre 2013
 Esame di Chimica Generale 10 Settembre 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 10 Settembre 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Calcolare il peso atomico assoluto del Carbonio 12. Pa = 12 u.m.a. x x g/u.m.a. = x g 2.0 x g
 Calcolare il peso atomico assoluto del Carbonio 12 Pa = 12 u.m.a. x 1.6605 x 10-24 g/u.m.a. = 1.9926 x 10-23 g 2.0 x 10-23 g Calcolare quanto pesa 1 mole di CH 4 Il peso relativo di CH 4 è: Pa = 16 u.m.a.
Calcolare il peso atomico assoluto del Carbonio 12 Pa = 12 u.m.a. x 1.6605 x 10-24 g/u.m.a. = 1.9926 x 10-23 g 2.0 x 10-23 g Calcolare quanto pesa 1 mole di CH 4 Il peso relativo di CH 4 è: Pa = 16 u.m.a.
ESERCIZIO 1 Per combustione completa in eccesso di ossigeno di un composto costituito da calcio, carbonio e azoto, si formano CaO, CO 2 e NO 2 in
 ESERCIZIO 1 Per combustione completa in eccesso di ossigeno di un composto costituito da calcio, carbonio e azoto, si formano CaO, CO 2 e NO 2 in quantità rispettivamente pari a 3,500, 2,747 e 5,743 g.
ESERCIZIO 1 Per combustione completa in eccesso di ossigeno di un composto costituito da calcio, carbonio e azoto, si formano CaO, CO 2 e NO 2 in quantità rispettivamente pari a 3,500, 2,747 e 5,743 g.
H 2 SO 4 : mol : 3 = mol REAGENTE LIMITANTE Ca 3 (PO 4 ) 2 : mol : 1 = mol
 1) Partendo da 100.0 g di H 2 SO 4 e 300.0 g di Ca 3 (PO 4 ) 2, calcolare quanti grammi di prodotti si formano e quanti grammi di reagente in eccesso rimangono non reagiti. 3H 2 SO 4 + Ca 3 (PO 4 ) 2 3CaSO
1) Partendo da 100.0 g di H 2 SO 4 e 300.0 g di Ca 3 (PO 4 ) 2, calcolare quanti grammi di prodotti si formano e quanti grammi di reagente in eccesso rimangono non reagiti. 3H 2 SO 4 + Ca 3 (PO 4 ) 2 3CaSO
Gas. Caratteristiche tipiche dei gas rispetto a solidi e liquidi. Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro
 Gas Caratteristiche tipiche dei gas rispetto a solidi e liquidi Definizione di pressione Unità di misura della pressione Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro Equazione di
Gas Caratteristiche tipiche dei gas rispetto a solidi e liquidi Definizione di pressione Unità di misura della pressione Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro Equazione di
Generica equazione chimica:
 REAZIONI CHIMICHE Trasformazione di una o più sostanze (reagenti) in una o più sostanze (prodotti) EQUAZIONE CHIMICA Una equazione chimica è la rappresentazione simbolica di una reazione chimica in termini
REAZIONI CHIMICHE Trasformazione di una o più sostanze (reagenti) in una o più sostanze (prodotti) EQUAZIONE CHIMICA Una equazione chimica è la rappresentazione simbolica di una reazione chimica in termini
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Studenti L-P(2017/18) L-O(2018/19) (Prof.Giuliano Moretti) Risultati della prova scritta del 15 febbraio 2019
 Studenti LP(2017/18) LO(2018/19) (Prof.Giuliano Moretti) Risultati della prova scritta del 15 febbraio 2019 La prova orale si svolgerà secondo il calendario riportato di seguito Presentarsi presso la stanza
Studenti LP(2017/18) LO(2018/19) (Prof.Giuliano Moretti) Risultati della prova scritta del 15 febbraio 2019 La prova orale si svolgerà secondo il calendario riportato di seguito Presentarsi presso la stanza
Relazioni di massa nelle reazioni chimiche. Capitolo 3
 Relazioni di massa nelle reazioni chimiche Capitolo 3 Micro mondo atomi & molecole Macro mondo grammi Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo
Relazioni di massa nelle reazioni chimiche Capitolo 3 Micro mondo atomi & molecole Macro mondo grammi Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo
PROVA 1. Dati i composti con formula HI e NaNO 2 :
 PROVA 1 Dati i composti con formula HI e NaNO 2 : 1) Denominare i composti 2) Determinare le valenze o i numeri di ossidazione di tutti gli elementi nei due composti 3) Indicare quale legame esiste per
PROVA 1 Dati i composti con formula HI e NaNO 2 : 1) Denominare i composti 2) Determinare le valenze o i numeri di ossidazione di tutti gli elementi nei due composti 3) Indicare quale legame esiste per
Composti chimici. Formula minima: CH 3 molecolare: C 2 H 6 di struttura: H H H C C H H H
 Stechiometria Composti chimici Formula minima: CH 3 molecolare: C H 6 di struttura: H H H C C H H H Formula di struttura Formula minima molecolare: C H 6 O Formula di struttura H O H H H H Reazioni
Stechiometria Composti chimici Formula minima: CH 3 molecolare: C H 6 di struttura: H H H C C H H H Formula di struttura Formula minima molecolare: C H 6 O Formula di struttura H O H H H H Reazioni
UNIVERSITÀ DEGLI STUDI DI ROMA TOR VERGATA
 I prova in itinere - Compito A - 21.01.2008 1. Calcolare la quantità in grammi di Cl 2 che occupa un volume di 682mL alla temperatura di 38,2C e alla pressione di 435 torr. Quale sarebbe la pressione del
I prova in itinere - Compito A - 21.01.2008 1. Calcolare la quantità in grammi di Cl 2 che occupa un volume di 682mL alla temperatura di 38,2C e alla pressione di 435 torr. Quale sarebbe la pressione del
Esame di Chimica Generale 16 Gennaio 2015
 Esame di Chimica Generale 16 Gennaio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Gennaio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero Le soluzioni La diluizione è il procedimento per preparare una soluzione meno concentrata da una soluzione più concentrata. Diluizione Aggiungi Solvente Moli
Scienziati in Erba Chimica Acqua Oro Zucchero Le soluzioni La diluizione è il procedimento per preparare una soluzione meno concentrata da una soluzione più concentrata. Diluizione Aggiungi Solvente Moli
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I
 Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
LEGGI PONDERALI DELLA CHIMICA
 LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
Esame di Chimica Generale 19 Giugno 2013
 Esame di Chimica Generale 19 Giugno 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 19 Giugno 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame (0) - solubilità dei composti e reaz - Codice Prova:
 1) Ci si aspetta la formazione di un precipitato quando una soluzione acquosa di ioduro di potassio è aggiunta ad una soluzione acquosa di: A. idrossido di bario B. perclorato di piombo C. cloruro di ferro(ii)
1) Ci si aspetta la formazione di un precipitato quando una soluzione acquosa di ioduro di potassio è aggiunta ad una soluzione acquosa di: A. idrossido di bario B. perclorato di piombo C. cloruro di ferro(ii)
Prova scritta CTF del 20- Gen NO 2
 Prova scritta CTF del 20Gen2011 1) Il Legame Covalente 2) Bilanciare in ambiente acido la seguente reazione di ossido riduzione: MnO 4 + NO 2 = Mn 2+ + NO 3 3) Applicando la teoria della repulsione delle
Prova scritta CTF del 20Gen2011 1) Il Legame Covalente 2) Bilanciare in ambiente acido la seguente reazione di ossido riduzione: MnO 4 + NO 2 = Mn 2+ + NO 3 3) Applicando la teoria della repulsione delle
Prova in itinere di Chimica Generale 9 Gennaio 2013
 Prova in itinere di Chimica Generale 9 Gennaio 2013 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 9 Gennaio 2013 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Le reazioni chimiche
 Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Una reazione chimica è un processo in cui una serie di sostanza (dette reagenti) viene convertita in altre sostanza (dette
Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Una reazione chimica è un processo in cui una serie di sostanza (dette reagenti) viene convertita in altre sostanza (dette
A-PDF Merger DEMO : Purchase from to remove the watermark
 A-PDF Merger DEMO : Purchase from www.a-pdf.com to remove the watermark Corso di Laurea in Farmacia/ISF Esame di Chimica Generale ed Inorganica Prova scritta di Stechiometria 3-0-004 Cognome e Nome Corso
A-PDF Merger DEMO : Purchase from www.a-pdf.com to remove the watermark Corso di Laurea in Farmacia/ISF Esame di Chimica Generale ed Inorganica Prova scritta di Stechiometria 3-0-004 Cognome e Nome Corso
1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2.
 1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2. H 2 SO 3 Pm = 2 1 + 32 + 16 3 = 82 H 3 PO 4 Pm = 3 1 +
1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2. H 2 SO 3 Pm = 2 1 + 32 + 16 3 = 82 H 3 PO 4 Pm = 3 1 +
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Facoltà di Ingegneria Corso di Chimica (9 CFU) Venerdì, 7 Febbraio 2014
 Facoltà di Ingegneria Corso di Chimica (9 CFU) Venerdì, 7 Febbraio 2014 Compito 1 1. Data la reazione (da bilanciare con metodo ionico-elettronico) "# 3 + " + "# " + "#$ 2" + 2 quale volume di NO si ottiene
Facoltà di Ingegneria Corso di Chimica (9 CFU) Venerdì, 7 Febbraio 2014 Compito 1 1. Data la reazione (da bilanciare con metodo ionico-elettronico) "# 3 + " + "# " + "#$ 2" + 2 quale volume di NO si ottiene
Numero di ossidazione
 Numero di ossidazione Si definisce numero di ossidazione la carica elettrica che l elemento assume in un composto se si pensa di associare gli elettroni di ciascun legame all atomo considerato più elettronegativo
Numero di ossidazione Si definisce numero di ossidazione la carica elettrica che l elemento assume in un composto se si pensa di associare gli elettroni di ciascun legame all atomo considerato più elettronegativo
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Esame di Chimica Generale 20 Aprile 2011
 Esame di Chimica Generale 20 Aprile 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 20 Aprile 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
COMPITO A DI CHIMICA DEL 15-09-09
 COMPITO A DI CHIMICA DEL 15-09-09 1A) 3,447 g di anidride arsenica (As 2 O 5 ) solida e 6,278 g di zinco metallico vengono fatti reagire con un eccesso di acido solforico. Si calcoli il volume di arsina
COMPITO A DI CHIMICA DEL 15-09-09 1A) 3,447 g di anidride arsenica (As 2 O 5 ) solida e 6,278 g di zinco metallico vengono fatti reagire con un eccesso di acido solforico. Si calcoli il volume di arsina
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
SOLUZIONI COMPITO A CHIMICA
 SOLUZIONI COMPITO A CHIMICA 07-07-211 1A) Per combustione di una miscela (0,596 moli totali) di due idrocarburi di formula (C 7 H 16 e C 9 H 20 ) si ottengono 102.420 g di acqua ed anidride carbonica.
SOLUZIONI COMPITO A CHIMICA 07-07-211 1A) Per combustione di una miscela (0,596 moli totali) di due idrocarburi di formula (C 7 H 16 e C 9 H 20 ) si ottengono 102.420 g di acqua ed anidride carbonica.
Prova in itinere di Chimica Generale 28 Gennaio 2011
 Prova in itinere di Chimica Generale 28 Gennaio 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 28 Gennaio 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
DIPARTIMENTO DI FARMACIA C.d.S. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 24 Giugno 2015
 A DIPARTIMENTO DI FARMACIA C.d.S. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 24 Giugno 2015 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta.
A DIPARTIMENTO DI FARMACIA C.d.S. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 24 Giugno 2015 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta.
Esami di Chimica Generale ed Inorganica per S.F.A del 10/02/2014
 Esami di Chimica Generale ed Inorganica per S.F.A del 10/02/2014 1) Si consideri la reazione da bilanciare in ambiente acido: MnO4 - + H2O2 à Mn +2 + O2 Partendo da una mole di permanganato di potassio
Esami di Chimica Generale ed Inorganica per S.F.A del 10/02/2014 1) Si consideri la reazione da bilanciare in ambiente acido: MnO4 - + H2O2 à Mn +2 + O2 Partendo da una mole di permanganato di potassio
La reazione tra Mg metallico e CO 2 è 2Mg + CO 2(g) 2 MgO(s) + C (grafite)
 3 kg di butano (C 4 H 10 ) vengono bruciati in una caldaia con un eccesso di aria del 40% in moli. Determinare il calore sviluppato dalla combustione e quanti m 3 (STP) di CO2 vengono prodotti. Determinare
3 kg di butano (C 4 H 10 ) vengono bruciati in una caldaia con un eccesso di aria del 40% in moli. Determinare il calore sviluppato dalla combustione e quanti m 3 (STP) di CO2 vengono prodotti. Determinare
3) La reazione tra Mg metallico e CO 2 è 2Mg + CO 2(g) 2 MgO(s) + C (grafite)
 1) Determinare la variazione di entalpia associata alla seguente reazione e indicare se è esotermica o endotermica: a) Na(s) + ½Cl 2 (g) NaCl(s) Sono note le variazioni di entalpia delle seguenti reazioni:
1) Determinare la variazione di entalpia associata alla seguente reazione e indicare se è esotermica o endotermica: a) Na(s) + ½Cl 2 (g) NaCl(s) Sono note le variazioni di entalpia delle seguenti reazioni:
11. Un composto contiene il 43,64% di fosforo ed il 56,36% di ossigeno. Qual è la sua formula empirica? (P 2 O 5 )
 ESERCIZI DI CHIMICA 1. Scrivere le formule brute e le formule di struttura corrispondenti ai seguenti composti: ortofosfato di calcio, ossido di sodio, silicato di alluminio, nitrito di magnesio, pirofosfato
ESERCIZI DI CHIMICA 1. Scrivere le formule brute e le formule di struttura corrispondenti ai seguenti composti: ortofosfato di calcio, ossido di sodio, silicato di alluminio, nitrito di magnesio, pirofosfato
Esame (396065) - Esame scritto I appello AA gennaio 2016 definitivo - Codice Prova:
 1) Secondo la definizione di Brønsted-Lowry, un acido: A. è un donatore di protoni B. è un elettrolita forte C. aumenta la concentrazione di H 3 O - in soluzione acquosa D. è un accettore di protoni E.
1) Secondo la definizione di Brønsted-Lowry, un acido: A. è un donatore di protoni B. è un elettrolita forte C. aumenta la concentrazione di H 3 O - in soluzione acquosa D. è un accettore di protoni E.
ESERCIZI I PARTE. 1 Bilanciamento
 ESERCIZI I PARTE 1 1 Bilanciamento 1. H 3 PO 3 + CuO Cu 3 (PO 3 ) 2 +3H 2 O ) 2. Cs 2 O + H 2 O CsOH 3. P 2 O 5 + H 2 O HPO 3 4. NaCl + H 2 SO 4 Na 2 SO 4 + HCl 5. NaF + Mg(OH) 2 MgF 2 + NaOH 6. Al(OH)
ESERCIZI I PARTE 1 1 Bilanciamento 1. H 3 PO 3 + CuO Cu 3 (PO 3 ) 2 +3H 2 O ) 2. Cs 2 O + H 2 O CsOH 3. P 2 O 5 + H 2 O HPO 3 4. NaCl + H 2 SO 4 Na 2 SO 4 + HCl 5. NaF + Mg(OH) 2 MgF 2 + NaOH 6. Al(OH)
Fondamenti di Chimica T-A T A (A-K) Calcolo n moli e rendimento reazione
 Università degli Studi di Bologna Anno Accademico 009/010 Facoltà di Ingegneria Corso di Laurea in Ingegneria Gestionale Fondamenti di Chimica T-A T A (A-K) Calcolo n moli e rendimento reazione Dott. Enzo
Università degli Studi di Bologna Anno Accademico 009/010 Facoltà di Ingegneria Corso di Laurea in Ingegneria Gestionale Fondamenti di Chimica T-A T A (A-K) Calcolo n moli e rendimento reazione Dott. Enzo
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
MASSE ATOMICHE. Oggi è possibile misurare accuratamente le masse atomiche tramite uno strumento chiamato spettrometro di massa
 Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
PROVA SCRITTA DI CHIMICA GENERALE ED INORGANICA Scienze e Tecnologie per l Ambiente 1 Febbraio 2013
 1 Febbraio 2013 1) a) Scrivere le formule di Lewis, l ibridizzazione dell'atomo centrale, la geometria molecolare ed eventuale presenza di momento dipolare per SF 6 e per gli anioni dei sali: fosfato di
1 Febbraio 2013 1) a) Scrivere le formule di Lewis, l ibridizzazione dell'atomo centrale, la geometria molecolare ed eventuale presenza di momento dipolare per SF 6 e per gli anioni dei sali: fosfato di
Per definizione di valore medio : Per questo caso abbiamo :
 D1-1 L'argo che si trova in natura è formato da tre isotopi i cui atomi sono presenti nelle seguenti proporzioni: 0.337% 36 Ar, 0.063% 38 Ar, 99.600% 40 Ar. Le masse nuclidiche di questi isotopi sono rispettivamente
D1-1 L'argo che si trova in natura è formato da tre isotopi i cui atomi sono presenti nelle seguenti proporzioni: 0.337% 36 Ar, 0.063% 38 Ar, 99.600% 40 Ar. Le masse nuclidiche di questi isotopi sono rispettivamente
Stechiometria. Relazione quantitativa tra specie chimiche che reagiscono tra loro
 Stechiometria Relazione quantitativa tra specie chimiche che reagiscono tra loro Massa molecolare (o peso molecolare) e massa formula Massa molecolare (o peso molecolare) di un composto è pari alla somma
Stechiometria Relazione quantitativa tra specie chimiche che reagiscono tra loro Massa molecolare (o peso molecolare) e massa formula Massa molecolare (o peso molecolare) di un composto è pari alla somma
SOLUZIONI COMPITO A CHIMICA
 SOLUZIONI COMPITO A CHIMICA 16-01-2012 1A) Il permanganato di ammonio si può ottenere dalla reazione tra permanganato di bario e solfato di ammonio, filtrando il precipitato di solfato di bario che si
SOLUZIONI COMPITO A CHIMICA 16-01-2012 1A) Il permanganato di ammonio si può ottenere dalla reazione tra permanganato di bario e solfato di ammonio, filtrando il precipitato di solfato di bario che si
La stechiometria studia i rapporti quantitativi fra le masse delle sostanze coinvolte in una reazione chimica.
 La Stechiometria La stechiometria studia i rapporti quantitativi fra le masse delle sostanze coinvolte in una reazione chimica. La stechiometria di reazione indica in che rapporti due o più sostanze reagiscono
La Stechiometria La stechiometria studia i rapporti quantitativi fra le masse delle sostanze coinvolte in una reazione chimica. La stechiometria di reazione indica in che rapporti due o più sostanze reagiscono
Reazioni ed Equazioni Chimiche
 ESERCITAZIONE 2 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche
ESERCITAZIONE 2 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Le soluzioni La diluizione è il procedimento per preparare una soluzione meno concentrata da una soluzione più concentrata. Diluizione Aggiungi Solvente
La Vita è una Reazione Chimica Acqua Oro Zucchero Le soluzioni La diluizione è il procedimento per preparare una soluzione meno concentrata da una soluzione più concentrata. Diluizione Aggiungi Solvente
Carica e massa di particelle atomiche
 Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA. Prof. Antonino Mamo
 Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA Prof. Antonino Mamo 1) Scrivere le formule di struttura dei seguenti sali: a) permanganato di
Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA Prof. Antonino Mamo 1) Scrivere le formule di struttura dei seguenti sali: a) permanganato di
Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ).
 Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ). moli Zn = massa Zn / m.m. Zn = 5,50 / 65,409 g mol -1 = 8,41 10-2 mol Calcolare a quante moli
Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ). moli Zn = massa Zn / m.m. Zn = 5,50 / 65,409 g mol -1 = 8,41 10-2 mol Calcolare a quante moli
COMPITO A DI CHIMICA DEL
 COMPITO A DI CHIMICA DEL 17-09-13 1A) Una miscela di solfato di rame pentaidrato e solfato di calcio diidrato viene scaldata fino alla perdita completa di acqua. La diminuzione in peso della miscela risulta
COMPITO A DI CHIMICA DEL 17-09-13 1A) Una miscela di solfato di rame pentaidrato e solfato di calcio diidrato viene scaldata fino alla perdita completa di acqua. La diminuzione in peso della miscela risulta
Esame di Chimica Generale 19 Febbraio 2013
 Esame di Chimica Generale 19 Febbraio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 19 Febbraio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono.
 ESERCITAZIONE 6 RAPPORTI PONDERALI E VOLUMETRICI NELLE REAZIONI In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono. 1) Quanto acido solforico reagisce con 100g
ESERCITAZIONE 6 RAPPORTI PONDERALI E VOLUMETRICI NELLE REAZIONI In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono. 1) Quanto acido solforico reagisce con 100g
SOLUZIONI COMPITO A DI CHIMICA DEL
 SOLUZIONI COMPITO A DI CHIMICA DEL 03-07-12 1) Il cloruro di manganese (II) reagisce con l'azoto gassoso in acqua per dare acido manganoso, idrazina gassosa (N 2 H 4 ) ed acido cloridrico. Bilanciare,
SOLUZIONI COMPITO A DI CHIMICA DEL 03-07-12 1) Il cloruro di manganese (II) reagisce con l'azoto gassoso in acqua per dare acido manganoso, idrazina gassosa (N 2 H 4 ) ed acido cloridrico. Bilanciare,
COMPITO B DI CHIMICA DEL
 COMPITO B DI CHIMICA DEL 220713 1B) Un campione di aria (mm = 29.0 g/mol) del volume di 6.12 L, misurati a c.s., è inquinato da ossido di azoto. Il campione viene fatto passare attraverso 340 ml di una
COMPITO B DI CHIMICA DEL 220713 1B) Un campione di aria (mm = 29.0 g/mol) del volume di 6.12 L, misurati a c.s., è inquinato da ossido di azoto. Il campione viene fatto passare attraverso 340 ml di una
UNIVERSITÀ DEGLI STUDI DI TORINO
 UNIVERSITÀ DEGLI STUDI DI TORINO Laurea Triennale in Scienze Biologiche TUTORAGGIO DEL CORSO DI CHIMICA GENERALE ED INORGANICA (CORSO A) AA 2017-2018 GIUSEPPE RICCIO giuseppe.riccio@edu.unito.it REAGENTI
UNIVERSITÀ DEGLI STUDI DI TORINO Laurea Triennale in Scienze Biologiche TUTORAGGIO DEL CORSO DI CHIMICA GENERALE ED INORGANICA (CORSO A) AA 2017-2018 GIUSEPPE RICCIO giuseppe.riccio@edu.unito.it REAGENTI
soluzione acquosa di HCl al 37% in peso è una soluzione contenente 37g di HCl ogni 100g di soluzione. ESERCIZIO 1 soluzione.
 SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti SOLVENTE componente presente in maggiore quantità SOLUTO componente presente in minore quantità DENSITA di una soluzione:
SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti SOLVENTE componente presente in maggiore quantità SOLUTO componente presente in minore quantità DENSITA di una soluzione:
Corso di Laurea in ISF Esame di Chimica Generale ed Inorganica Appello del Cognome e Nome
 Corso di Laurea in ISF Esame di Chimica Generale ed Inorganica Appello del 30-01-2006 Cognome e Nome Anno Immatricolazione n matricola Esercizio 1 Calcolare il ph di una soluzione ottenuta aggiungendo
Corso di Laurea in ISF Esame di Chimica Generale ed Inorganica Appello del 30-01-2006 Cognome e Nome Anno Immatricolazione n matricola Esercizio 1 Calcolare il ph di una soluzione ottenuta aggiungendo
Brady Senese Pignocchino Chimica.blu Zanichelli 2013 Soluzione degli esercizi Capitolo 6
 Brady Senese Pignocchino Chimica.blu Zanichelli 2013 Soluzione degli esercizi Capitolo 6 Esercizio Risposta PAG 124 ES 1 12 C. 12u PAG 124 ES 2 Perché non esistono bilance con una sensibilità abbastanza
Brady Senese Pignocchino Chimica.blu Zanichelli 2013 Soluzione degli esercizi Capitolo 6 Esercizio Risposta PAG 124 ES 1 12 C. 12u PAG 124 ES 2 Perché non esistono bilance con una sensibilità abbastanza
