Elementi di Stereochimica
|
|
|
- Lamberto Mura
- 4 anni fa
- Visualizzazioni
Transcript
1 Stereochimica
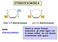
2 Elementi di Stereochimica Catena Costituzionale Posizione Funzione Isomeria CONFORMAZIONALE Stereoisomeria Diastereoisomeria Enantiomeria CONFIGURAZIONALE CONFORMAZIONALE CONFIGURAZIONALE Isomeria Costituzionale Isomeri di catena Isomeri di posizione Isomeri di gruppo funzionale Diversa concatenazione degli atomi di carbonio Diversa posizione del medesimo gruppo funzionale Diverso gruppo funzionale C 3 C 3 C 3 C C 3 C 3 C 3 C 3 3 C ; C 3 C C 3 C 3 O C 3
3 Stereoisomeria Gli stereoisomeri sono molecole caratterizzate da uguale formula molecolare e identica connettività ma diversa orientazione degli atomi nello spazio. Possono essere distinti in due grandi sottocategorie: quella degli enantiomeri e quella dei diastereoisomeri (anche detti diastereomeri). enantiomeri Stereoisomeri caratterizzati dall essere l uno l immagine speculare non sovrapponibile dell altro. diastereoisomeri Stereoisomeri caratterizzati dal non essere immagini speculari l uno dell altro.
4 A loro volta, diastereomeri ed enantiomeri possono essere ulteriormente classificati distinguendoli in base alle modalità richieste per l interconversione tra le forme isomere: stereoisomeri conformazionali Sono quelli che possono interconvertire per rotazioni intorno a legami semplici (generalmente non sono isolabili a temperatura ambiente) Es.1 Es.2 Diastereomeri (conformeri o rotameri) stereoisomeri configurazionali Sono quelli che per interconvertire richiedono prima la rottura e poi la formazione di nuovi legami (generalmente sono isolabili a temperatura ambiente). Es.1 Es.2 enantiomeri diastereomeri diastereomeri
5 la possibilità che, a parità di formula molecolare e costituzione, una specie molecolare possa esistere in più forme stereoisomere è legata alla presenza al suo interno di elementi stereogenici: Centri stereogenici Atomi della molecola che, per interscambio di due loro ligandi, generano stereoisomeri Assi stereogenici Generalmente sono colineari con legami; la rotazione intorno ad essi di una opportuna porzione di molecola (operazione caratterizzata da alta energia di attivazione) genera una forma isomera stabile Piani stereogenici Sono piani su cui giacciono gruppi di atomi a loro volta connessi a strutture rigide che si estendono sopra o sotto i piani stessi
6 Stereoisomeria Enantiomeria Isomeria ottica Diastereoisomeria Isomeria geometrica altre
7 Regole di priorità di Cahn-Ingold-Prelog 1. La priorità viene attribuita sulla base del numero atomico. Più elevato è il numero atomico più alta è la priorità del sostituente. Per esempio: 17 Cl > 8 O > 7 N > 6 C > 1 2. A parità di numero atomico (isotopi), la priorità spetta all isotopo con massa atomica maggiore.
8 3. Se i due atomi confrontati sono uguali è necessario esaminare e confrontare progressivamente gli altri atomi a cui questi ultimi sono legati. Si procede pertanto, sempre applicando le regole precedenti, al confronto degli atomi successivi in entrambe le catene fino al punto in cui si individua una differenza di priorità. Per facilitare il confronto si può associare a ciascun atomo della catena il rispettivo numero atomico seguito, in parentesi, dai numeri atomici ordinati in senso decrescente degli altri atomi che ad esso sono legati. Tra questi due gruppi chi ha la priorità?
9 4. i) i legami multipli devono essere trasformati in legami semplici; ii) ad ogni atomo che ha subito la riduzione dell ordine di legame deve essere unito un equivalente numero di atomi fantasma appartenenti allo stesso elemento di quelli precedentemente scollegati (solitamente questi vengono racchiusi tra parentesi quadre). 5. Se in un ligando è presente una struttura ciclica prima di iniziare il confronto è necessario riscrivere il ciclo aprendolo con due successive disconnessioni O O O C C C 3 O C 3 O O Priorità maggiore Priorità minore Br = C 3 O C 3 O O O C C Br
10 6. Se due sostituenti hanno la stessa costituzione e si differenziano solo per la configurazione (diversa disposizione spaziale degli atomi, non annullabile per rotazione intorno a legami semplici) allora si applicano regole di priorità che verranno descritte più avanti, nella sezione riguardante la notazione R/S 1 Esempio Sostituente I - -CCl-C 3 Sostituente II Br 2 Esempio
11 3 Esempio 4 Esempio
12 Isomeria ottica In certi casi gli elementi stereogenici, con la loro presenza, inducono asimmetria. Quando questo accade essi si comportano come focolai di chiralità e per questo assumono più propriamente la denominazione di Centri di chiralità Assi di chiralità Piani di chiralità Centri di chiralità Un centro chirale è un atomo ibridato sp 3 al quale sono legati 4 sostituenti diversi tra loro, collocati in posizioni corrispondenti ai vertici di un tetraedro. Nel caso più frequente questo è rappresentato da un atomo di carbonio. sinonimi di centro chirale sono: 1. Atomo chirale 2. Centro asimmetrico 3. Atomo asimmetrico Un atomo chirale è un oggetto privo di elementi di simmetria ed è per tale motivo che può essere correttamente definito asimmetrico.
13 Il termine chirale, associato come appellativo ad un generico oggetto, sottintende che l immagine speculare di quell oggetto non è sovrapponibile all originale. 2 stereoisomeri che siano l immagine speculare l uno dell altro (cioè 2 enantiomeri) sono anche chiamati isomeri ottici Importante! Una molecola che contiene un solo centro asimmetrico è certamente nel suo insieme asimmetrica, cioè completamente priva di elementi di simmetria, e pertanto anche chirale.ma attenzione! una molecola che contiene più di un centro asimmetrico può essere chirale ma può anche non esserlo!! Esempio 2 centri di chiralità Br Br Br Br Geometrie achirali identiche chirali
14 Esempio Cl 2 centri di chiralità * * Br chirale asimmetrica (Nessun elemento di simmetria) Cl Cl * * chirale dissimmetrica C 2 (asse di simmetria C 2 ) Cl Cl * * achirale mesoforma (piano di simmetria)
15 Nomenclatura dei centri chirali: notazione R/S Per caratterizzare la particolare disposizione spaziale assunta da gruppi sostituenti legati a centri chirali (configurazione assoluta del centro asimmetrico) è utilizzata la notazione R/S. La procedura da seguire per l assegnazione dei descrittori R e S è articolata in 3 fasi: 1. Assegnazione della priorità tra i sostituenti del centro chirale analizzato utilizzando le regole CIP; 2 Cl 4 C enantiomeri Br C Br 1 C 3 C Orientazione della molecola in modo che il gruppo a più bassa priorità si allontani dall osservatore; in tal modo gli altri 3 sostituenti saranno diretti verso l osservatore, mentre i loro legami con l atomo asimmetrico, proiettati sul piano, formeranno angoli di Cl 3. Se la lettura di questi ultimi 3 gruppi, eseguita a partire da quello di più alta priorità e muovendo progressivamente verso quello di più bassa priorità, procede in senso orario il descrittore assegnato al centro chirale sarà R (configurazione assoluta R), altrimenti S (configurazione assoluta S).
16 2 Cl Br 1 C 3 4 C 3 R (R)-1-bromo-1cloro-etano I descrittori di configurazione del o dei centri chirali presenti nella molecola analizzata vanno riportati, separati da virgole e con il numero identificativo dell atomo chirale collocato sulla sinistra, tra parentesi tonde davanti al nome IUPAC di quest ultima
17 Uso della proiezione di Fischer per rappresentare molecole con centri stereogenici ed assegnare i descrittori R/S Nel proiettare una molecola contenente un solo stereocentro la catena più lunga di atomi di carbonio deve essere riportata verticalmente, collocando in alto il carbonio al quale spetta il più basso numero di posizione derivante dalla nomenclatura IUPAC. I 4 sostituenti devono infine essere disposti in modo tale che i legami verticali si allontanino dall osservatore uscendo dietro il piano del foglio, mentre i legami orizzontali si avvicinino all osservatore uscendo davanti al piano del foglio.
18 Assegnare la priorità secondo le regole CIP ai gruppi legati al centro chirale 2 2 Caso d) Caso b) 1 R S Leggere in sequenza i gruppi a priorità 1, 2 e 3. A questo punto: a) Se la lettura procede in senso orario e il gruppo a priorità 4 è impegnato in legame verticale il descrittore sarà R; b) Se la lettura procede in senso orario e il gruppo a priorità 4 è impegnato in legame orizzontale il descrittore sarà S; c) Se la lettura procede in senso antiorario e il gruppo a priorità 4 è impegnato in legame verticale il descrittore sarà S; d) Se la lettura procede in senso antiorario e il gruppo a priorità 4 è impegnato in legame orizzontale il descrittore sarà R; Si procede in modo analogo se la molecola contiene più centri stereogenici, ripetendo la procedura per ognuno di essi
19 Manipolazioni consentite sulle proiezioni di Fischer Rotazione della molecola è possibile ruotare la molecola di 180, ma non di 90, perché questo implicherebbe l inversione di configurazione di tutti i centri chirali CO rotazione 90 rotazione 90 rotazione 90 2 C CO O C CO D(+)-Gliceraldeide L(-)-Gliceraldeide D(+)-Gliceraldeide L(-)-Gliceraldeide Rotazione di sostituenti Tenendo fermo un sostituente qualsiasi e ruotando gli altri tre si lascia inalterata la configurazione dello stereocentro CO O CO C C Scambio di sostituenti è possibile scambiare in successione due coppie di sostituenti. Non è invece possibile effettuare un singolo scambio tra una coppia di sostituenti perché questo implicherebbe l inversione di configurazione del centro chirale coinvolto CO D(+)-Gliceraldeide 1 scambio D(+)-Gliceraldeide 2 scambio 3 scambio 4 scambio D(+)-Gliceraldeide D(+)-Gliceraldeide CO CO CO O CO O (+)-Gliceraldeide L(-)-Gliceraldeide D(+)-Gliceraldeide L(-)-Gliceraldeide D(+)-Gliceraldeide
20 La stereogenia di un atomo ibridato sp 3 può derivare anche da una diversità di configurazione dei gruppi ad esso legati (cioè quando almeno 2 di questi gruppi siano enantiomorfi o diastereomorfi). Configurazione? cis C C C 3 C C C trans C 3 In questi casi, alle 5 regole già riportate per l attribuzione della priorità di gruppi secondo Cahn-Ingold-Prelog è necessario aggiungerne una sesta, quella sotto riportata 6. Se due sostituenti hanno la stessa costituzione e si differenziano solo per la configurazione si applicano le seguenti regole di priorità: un sostituente con configurazione assoluta R è prioritario su di un sostituente con configurazione assoluta S un sostituente con configurazione assoluta R,R è prioritario su di un sostituente con configurazione assoluta S,S i sostituenti con configurazione assoluta (R, R) ed (S, S) sono prioritari sui sostituenti con configurazione (R, S) e (S, R) un sostituente con configurazione Z è prioritario su di un sostituente con configurazione E. un sostituente con configurazione cis è prioritario su di un sostituente con configurazione trans. O CO CO Configurazione?
21 cis 1 2 C C 3 C trans Configurazione S C C 3 4 C C 3 CO minore priorità O S R Configurazione S maggiore priorità S S CO Configurazione S Cl C 3 C C 3 C C C Cl Z C Cl C 3 E Cl
22 Relazione tra numero di stereocentri e numero di stereoisomeri possibili Di una molecola, lineare o ciclica, di definita costituzione e massa molecolare contenente n centri stereogenici e certamente priva di potenziali piani e centri di simmetria possono esistere 2 n stereoisomeri, tutti chirali. Questi saranno rappresentati da 2 n-1 coppie di enantiomeri CO O * * n = 2 Stereoisomeri = 4 diastereomeri
23 Importante! Occorre tenere presente che nella proiezione di Fischer i sostituenti di ogni coppia di atomi stereogenici adiacenti sono disposti in conformazione eclissata, cioè in una geometria caratterizzata da un massimo di energia. Quindi la proiezione di Fischer è utile per stabilire con facilità la particolare configurazione posseduta da una molecola contenente molti centri stereogenici, ma non rappresenterà mai una geometria stabile, e quindi significativamente popolata, di quella molecola. Questo può portare alla individuazione di falsi elementi di simmetria, come nel caso dell esempio sotto rappresentato Piano di simmetria: falso elemento centro di simmetria: elemento corretto
24 riflessione Infatti lo scambio di sostituenti di questo atomo di carbonio porta ad una struttura identica all originale: Diastereoisomeri Epimeri Si definiscono epimeri due diastereoisomeri che, avendo due o più stereocentri, differiscono per la configurazione di uno solo di essi.
25 Enantiomeri configurazionali (non epimeri) chirale chirale Diastereoisomeri configurazionali epimeri achirale Diastereoisomeri configurazionali epimeri
26 Assi di chiralità La chiralità assiale è presente quando due coppie di sostituenti, ciascuno diverso dall altro nell ambito della stessa coppia, risultano legate in disposizione sfalsata alle estremità di una porzione di molecola rigida allungata (asse stereogenico chirale). Virtualmente una disposizione del tipo appena descritto può essere immaginata come il risultato dello stiramento di un centro tetraedrico asimmetrico Zona rigida, variabile nella struttura Mentre un atomo tetraedrico per essere centro di chiralità deve possedere 4 sostituenti diversi (a b c d), l esistenza di un asse di chiralità associato al frammento rigido di molecola sopra descritto richiede che i sostituenti siano diversi tra loro solo nell ambito di ogni coppia. Pertanto risultano chirali anche molecole del tipo:
27 Piani di chiralità La chiralità planare si genera quando un gruppo di atomi disposti su di un piano (piano chirale) sono connessi ad una struttura rigida (spesso a ponte) che si estende sopra o sotto il piano.
28 Proprietà delle molecole chirali In linea di principio le proprietà fisiche e chimiche degli isomeri costituzionali e dei distereoisomeri sono diverse, così che, se questi sono sufficientemente stabili, è possibile isolarli senza incontrare particolari difficoltà Nel caso degli enantiomeri, invece è necessario fare alcune precisazioni. La maggior parte delle proprietà della materia, infatti, sono invarianti alla riflessione (cioè sono identiche negli enantiomeri) e sono dette proprietà scalari A titolo di esempio tra queste possono essere citate: p. ebollizione, p. fusione, solubilità, spettri IR, UV, Raman, NMR, indice di rifrazione, densità. Alcune proprietà, invece, in seguito ad operazioni di riflessione (cioè valutate in enantiomeri) risultano diverse, non nel valore assoluto ma nel segno della grandezza associata. Queste sono dette proprietà pseudoscalari Le più rilevanti sono: l attività ottica, la dispersione ottica rotatoria, il dicroismo circolare
29 Tutte le molecole chirali presentano proprietà pseudoscalari non nulle Attività ottica Si definisce attività ottica la capacità di una molecola di ruotare il piano della luce polarizzata. In particolare quando un raggio di luce polarizzata (radiazione in cui il campo elettrico E e quello magnetico variano solo lungo un piano) attraversa una soluzione contenente una specie chirale il piano di vibrazione di E e di viene ruotato di un certo angolo a che dipende dalla concentrazione (c), dalla lunghezza d onda (l) della radiazione monocromatica, dalla temperatura (t), dal solvente usato e dalla lunghezza del percorso ottico (l). Polarimetro (rotazione specifica) rotazione osservata lunghezza tubo di saggio (dm) x concentrazione (g/ml)
30 A parità di condizioni due enantiomeri hanno la medesima rotazione specifica (ruotano il piano della luce polarizzata del medesimo angolo), ma con segno opposto. Per questo due enantiomeri vengono anche definiti antipodi ottici rotazione in senso orario: antipodo destrogiro indicato con (+) rotazione in senso antiorario: antipodo levogiro indicato con (-) I simboli (+) e (-), quando noti da misure sperimentali, vanno riportati dopo i descrittori di configurazione e prima del nome IUPAC
31 Un sistema contenente un ugual numero (uguale concentrazione) di molecole dei due enantiomeri si definisce miscela racemica. non presenta attività ottica e viene contraddistinto dal simbolo (±) posto davanti al nome del composto Un sistema contenente un diverso numero (diversa concentrazione) di molecole dei due enantiomeri presenta attività ottica proporzionale alla percentuale della specie in eccesso. Tale sistema si definisce miscela scalemica. La percentuale dell enantiomero in eccesso nelle miscele scalemiche viene detta eccesso enantiomerico (e.e.) ed è calcolata con la seguente formula: e.e. = enantiomero maggioritario enantiomero maggioritario - + enantiomero minoritario enantiomero minoritario 100
32 Un altra grandezza usata per esprimere la percentuale dell enantiomero in eccesso nelle miscele scalemiche è la Purezza Ottica che è calcolata con la seguente formula: [a] campione Purezza ottica 100 percentuale = [a] enantiomero puro Dal collegamento delle due equazioni si ottiene la seguente relazione, utile per il calcolo della frazione di enantiomero in eccesso da misure polarimetriche enantiomero maggioritario = 1 2 [a] campione + [a] enantiomero puro [a] enantiomero puro 100
33 Configurazione relativa La configurazione di un centro di chiralità può essere analizzata per confronto con: 1. quella di centri chirali contenuti in altre molecole di struttura affine usate come riferimento. 2. quella di altri centri chirali contenuti nella stessa molecola; Queste configurazioni sono definite relative Caso 1 Notazione D/L D ed L sono i descrittori che vennero usati per la prima volta per distinguere la configurazione dell atomo chirale presente negli enantiomeri della molecola di gliceraldeide: D ed L definiscono la posizione assunta dall ossidrile legato al carbonio asimmetrico nella proiezione di Fischer. Non hanno alcuna relazione con il senso di rotazione del piano della luce polarizzata
34 Il carbonio chirale nella molecola di D o L gliceraldeide è utilizzato come riferimento per caratterizzare la configurazione di atomi chirali in altre molecole correlate strutturalmente, come quelle dei monosaccaridi, degli acidi saccarici, degli a-amminoacidi R S
35 Notazione eritro/treo I descrittori eritro e treo Sono utilizzati per caratterizzare la configurazione relativa di due atomi asimmetrici collocati in posizione adiacente nella proiezione di Fischer analizzata. La disposizione dei due gruppi sostituenti a maggiore priorità (regole CIP) viene confrontata con quella assunta dai gruppi ossidrilici nella molecola di eritrosio e di treosio: Gruppi dalla stessa parte nella proiezione di Fischer R' Isomero eritro R'' X Y Gruppi da parti opposte nella proiezione di Fischer R' Y R'' X Isomero treo esempio
36 Caso 2 Notazione sin/anti E utilizzata per caratterizzare a prima vista la configurazione relativa di diastereomeri in cui sia facilmente individuabile una catena principale. La catena principale và disegnata a zig-zag e giacente sul piano della rappresentazione, mentre gli altri legami vanno tracciati come cunei pieni (verso l osservatore) o tratteggiati (dalla parte opposta È sufficiente assegnare la priorità a solo 2 dei 4 sostituenti di ogni atomo chirale e riportare come sin o anti la posizione del gruppo prioritario rispetto a quella del gruppo posizionato sul carbonio a più bassa numerazione dell osservatore). 1 2 O Cl 3 C (2,4-anti, 2,5-sin) 4-cloro-5metil-eptan-2,5-diolo esempio
37 Centri asimmetrici diversi dal carbonio Atomo di azoto nelle ammine terziarie non simmetriche Però generalmente la configurazione viene persa con facilità per inversione del centro (barriere di circa 7 kcal mol -1 ) Il doppietto elettronico viene considerato come quarto sostituente. Ad esso viene assegnata la priorità CIP più bassa. sp 3 sp 2 sp 3 Esempi nei quali la configurazione dell azoto è ritenuta
38 Atomo di fosforo Configurazione stabile fosfine Atomo di zolfo Atomo di arsenico Atomo di antimonio Atomo di silicio arsine stibine Atomo di ossigeno Ioni ossonio silani Configurazione instabile
39 Separazione di enantiomeri: risoluzione La separazione di una miscela racemica nei suoi due enantiomeri è detta risoluzione miscela Enantiomero R Enantiomero S Schema generale: + Specie chirale S miscela Enantiomero R Specie chirale S + Enantiomero S Specie chirale S Stesse proprietà scalari 2 diastereomeri diverse proprietà scalari
40 Metodo di separazione: a. Cristallizzazione frazionata b. Distillazione frazionata c. Cromatografia Enantiomero R Specie chirale S + Enantiomero S Specie chirale S d. Approccio enzimatico Enantiomero R Specie chirale S + diastereomeri separati Enantiomero S Specie chirale S diastereomeri In miscela Ripristino delle specie di partenza Enantiomero R Specie chirale S Enantiomero R Specie + chirale S Enantiomero S Specie chirale S Enantiomero S Specie + chirale S
41 Esempio 1 Risoluzione degli enantiomeri dell acido mandelico
42 Esempio 2 MeO Estere etilico dell (S)-naprossene Solo l enantiomero S è idrolizzato dall enzima e, in tal modo, solubilizzato in 2 O O C O C 3 C 3 C 3 O 3 C C O OMe Estere etilico dell (R)-naprossene 1) Esterasi in 2 O e Na 2) Cl, 2 O O C C 3 MeO (S)-naprossene
STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano
 STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano sono stereoisomeri Hanno la stessa formula molecolare, gli atomi legati con lo stesso ordine, ma con diversa orientazione nello spazio
STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano sono stereoisomeri Hanno la stessa formula molecolare, gli atomi legati con lo stesso ordine, ma con diversa orientazione nello spazio
Isomeria nelle molecole organiche
 Isomeria nelle molecole organiche 3 Cis/Trans o Z/E 1 4 Regole di priorità negli alcheni: 1. Numero atomico maggiore=maggiore priorità; 2. Maggiore priorità all isotopo più pesante; 3. Se il primo atomo
Isomeria nelle molecole organiche 3 Cis/Trans o Z/E 1 4 Regole di priorità negli alcheni: 1. Numero atomico maggiore=maggiore priorità; 2. Maggiore priorità all isotopo più pesante; 3. Se il primo atomo
C 4 H 10 C 4 H 10. Hanno la stessa formula molecolare C 4 H 10.
 Isomeria costituzionale negli alcani Isomeri costituzionali (strutturali): composti con uguale formula molecolare ma diversa formula di struttura (con un diverso ordine con cui sono legati i loro atomi).
Isomeria costituzionale negli alcani Isomeri costituzionali (strutturali): composti con uguale formula molecolare ma diversa formula di struttura (con un diverso ordine con cui sono legati i loro atomi).
CHIRALITA' E' una proprietà relativa ad oggetti PRIVI DI UN PIANO DI SIMMETRIA.
 CIRALITA' E' una proprietà relativa ad oggetti PRIVI DI UN PIANO DI SIMMETRIA. non simmetrica rispetto al piano piano di simmetria La mano destra non è sovrapponibile alla mano sinistra: ne è invece l'immagine
CIRALITA' E' una proprietà relativa ad oggetti PRIVI DI UN PIANO DI SIMMETRIA. non simmetrica rispetto al piano piano di simmetria La mano destra non è sovrapponibile alla mano sinistra: ne è invece l'immagine
Isomeri. Unità didattica 5. Isomeri cis-trans. La stereochimica. I composti achirali hanno immagini speculari sovrapponibili
 Isomeri Composti non identici ma che hanno la stessa formula molecolare Unità didattica 5 La stereochimica La disposizione degli atomi nello spazio; La stereochimica delle reazioni di addizione Isomeri
Isomeri Composti non identici ma che hanno la stessa formula molecolare Unità didattica 5 La stereochimica La disposizione degli atomi nello spazio; La stereochimica delle reazioni di addizione Isomeri
La isomeria in Chimica Organica
 La isomeria in himica Organica isomeri composti differenti con la stessa formula molecolare (bruta) costituzionali isomeri i cui atomi sono connessi in modi diversi stereoisomeri P.es.: butano, 2-metil-propano
La isomeria in himica Organica isomeri composti differenti con la stessa formula molecolare (bruta) costituzionali isomeri i cui atomi sono connessi in modi diversi stereoisomeri P.es.: butano, 2-metil-propano
ISOMERIA. Isomeri di struttura O OH C 4 H 10 O C 4 H 10
 ISOMERIA O O C 4 10 O C 4 10 Isomeri di struttura Isomeri conformazionali conformazioni rotameri STEREOISOMERIA stereoisomeri o isomeri spaziali o isomeri costituzionali ( in greco vuol dire spazio) si
ISOMERIA O O C 4 10 O C 4 10 Isomeri di struttura Isomeri conformazionali conformazioni rotameri STEREOISOMERIA stereoisomeri o isomeri spaziali o isomeri costituzionali ( in greco vuol dire spazio) si
CONTENUTI DELLA LEZIONE:
 Stereochimica CONTENUTI DELLA LEZIONE: 1. La Chiralità: Molecole chirali e achirali 2. Identificare uno stereocentro 3. Enantiomeri 4. Regole per assegnare la configurazione R,S 5. Diastereoisomeri 6.
Stereochimica CONTENUTI DELLA LEZIONE: 1. La Chiralità: Molecole chirali e achirali 2. Identificare uno stereocentro 3. Enantiomeri 4. Regole per assegnare la configurazione R,S 5. Diastereoisomeri 6.
OPERAZIONI ed ELEMENTI di SIMMETRIA
 OPERAZIONI ed ELEMENTI di SIMMETRIA Una operazione di simmetria è un'azione che lascia immutato l oggetto a cui si applica. A una operazione di simmetria è associato uno o più elementi di simmetria. Le
OPERAZIONI ed ELEMENTI di SIMMETRIA Una operazione di simmetria è un'azione che lascia immutato l oggetto a cui si applica. A una operazione di simmetria è associato uno o più elementi di simmetria. Le
Idrocarburi. Stereoisomeria
 Idrocarburi Stereoisomeria Stereisomeri configurazionali Il fatto che gli atomi di carbonio degli alcani siano tutti ibridati sp 3 rende possibile la formazione anche di altri stereoisomeri (isomeri con
Idrocarburi Stereoisomeria Stereisomeri configurazionali Il fatto che gli atomi di carbonio degli alcani siano tutti ibridati sp 3 rende possibile la formazione anche di altri stereoisomeri (isomeri con
Figura. Stereochimica
 Figura Stereochimica Stereochimica: enantiomeri Differenze apparentemente insignificanti nella struttura 3-D possono causare proprietà molto differenti. Si può osservare questo considerando amido e cellulosa,
Figura Stereochimica Stereochimica: enantiomeri Differenze apparentemente insignificanti nella struttura 3-D possono causare proprietà molto differenti. Si può osservare questo considerando amido e cellulosa,
ISOMERI. composti differenti con la stessa formula molecolare DIASTEREOISOMERI
 ISOMERI composti differenti con la stessa formula molecolare ISOMERI COSTITUZIONALI isomeri i cui atomi hanno una differente connettività STEREOISOMERI isomeri che hanno la stessa connettività ma differiscono
ISOMERI composti differenti con la stessa formula molecolare ISOMERI COSTITUZIONALI isomeri i cui atomi hanno una differente connettività STEREOISOMERI isomeri che hanno la stessa connettività ma differiscono
21/03/2011 STEREOCHIMICA. Gli stereoisomeri differiscono unicamente per la disposizione degli atomi nello spazio. Diastereoisomeri.
 L esistenza degli enantiomeri è legata ad una precisa proprietà strutturale delle molecole:le molecole devono essere chirali Una molecola chirale è una molecola che non è sovrapponibile alla sua immagine
L esistenza degli enantiomeri è legata ad una precisa proprietà strutturale delle molecole:le molecole devono essere chirali Una molecola chirale è una molecola che non è sovrapponibile alla sua immagine
CH3CHCH H2C CHCHCH2CH3. 31 L ordine di priorità CIP è riferito ai quattro sostituenti legati allo stereocentro e viene assegnato
 Chimica organica: stereoisomeria ottica Capitolo C4 VERIFICA LE TUE CONOSCENZE 1A 4A 7C 10 D 13 D 2B 5C 8A 11 C 14 B 3D 6C 9B 12 B VERIFICA LE TUE ABILITÀ 15 Un carbonio asimmetrico è un atomo di carbonio
Chimica organica: stereoisomeria ottica Capitolo C4 VERIFICA LE TUE CONOSCENZE 1A 4A 7C 10 D 13 D 2B 5C 8A 11 C 14 B 3D 6C 9B 12 B VERIFICA LE TUE ABILITÀ 15 Un carbonio asimmetrico è un atomo di carbonio
Capitolo 6 stereoisomeria
 himica Organica Informazione Scientifica sul Farmaco apitolo 6 stereoisomeria Organic hemistry, 5 th Edition L. G. Wade, Jr. Louis Pasteur, 1822-1895 In questa lezione: hiralità ed enantiomeri onfigurazione
himica Organica Informazione Scientifica sul Farmaco apitolo 6 stereoisomeria Organic hemistry, 5 th Edition L. G. Wade, Jr. Louis Pasteur, 1822-1895 In questa lezione: hiralità ed enantiomeri onfigurazione
28/03/2013. Stereochimica: enantiomeri
 Figura Stereochimica Stereochimica: enantiomeri Atomi di carbonio tetraedrici e loro immagini speculari. Le molecole del tipo CH 3 X e CH 2 XY sono identiche alle loro immagini speculari, ma una molecola
Figura Stereochimica Stereochimica: enantiomeri Atomi di carbonio tetraedrici e loro immagini speculari. Le molecole del tipo CH 3 X e CH 2 XY sono identiche alle loro immagini speculari, ma una molecola
02/10/2018. di catena. di posizione. strutturali. di gruppo funzionale. isomeri. geometrici. stereoisomeri. ottici
 Quando due composti organici sono costituiti dagli stessi atomi ma possiedono una struttura differente si definiscono ISOMERI. Esistono diversi tipi di isomeria: di catena strutturali di posizione isomeri
Quando due composti organici sono costituiti dagli stessi atomi ma possiedono una struttura differente si definiscono ISOMERI. Esistono diversi tipi di isomeria: di catena strutturali di posizione isomeri
Diagramma che riassume i diversi tipi di isomeri. N.B. Gli isomeri costituzionali (o isomeri di struttura: es. n-propile /isopropile non sono
 STEREOCHIMICA La stereochimica studia la struttura molecolare nelle tre dimensioni, cioè nello spazio. Un aspetto della stereochimica è la STEREOISOMERIA. Diagramma che riassume i diversi tipi di isomeri.
STEREOCHIMICA La stereochimica studia la struttura molecolare nelle tre dimensioni, cioè nello spazio. Un aspetto della stereochimica è la STEREOISOMERIA. Diagramma che riassume i diversi tipi di isomeri.
Gli isomeri sono composti caratterizzati dalla stessa formula molecolare o bruta. Fino ad ora abbiamo conosciuto tre tipi di isomeria :
 Gli isomeri sono composti caratterizzati dalla stessa formula molecolare o bruta. Fino ad ora abbiamo conosciuto tre tipi di isomeria : ONFORMAZIONALE (eclissata, sfalsata) STRUTTURALE (pentano, 2 metil
Gli isomeri sono composti caratterizzati dalla stessa formula molecolare o bruta. Fino ad ora abbiamo conosciuto tre tipi di isomeria : ONFORMAZIONALE (eclissata, sfalsata) STRUTTURALE (pentano, 2 metil
Configurazione. Conformazione
 Configurazione (Mislow,, 1965) Posizione relativa degli atomi nello spazio cha caratterizza un particolare stereoisomero Enantiomeri: : configurazione opposta Diastereoisomeri: : configurazione diversa
Configurazione (Mislow,, 1965) Posizione relativa degli atomi nello spazio cha caratterizza un particolare stereoisomero Enantiomeri: : configurazione opposta Diastereoisomeri: : configurazione diversa
Chimica Organica. Stereochimica ISOMERI ISOMERI DI STRUTTURA STEREOISOMERI DIASTEREOMERI ENANTIOMERI ISOMERI CIS-TRANS CONFORMERI ROTAMERI
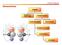 Chimica rganica Stereochimica ISMERI ISMERI DI STRUTTURA STEREISMERI DIASTEREMERI ENANTIMERI ISMERI CIS-TRANS CNFRMERI RTAMERI Stereoisomeri Composti con la stessa connessione tra gli atomi, ma con una
Chimica rganica Stereochimica ISMERI ISMERI DI STRUTTURA STEREISMERI DIASTEREMERI ENANTIMERI ISMERI CIS-TRANS CNFRMERI RTAMERI Stereoisomeri Composti con la stessa connessione tra gli atomi, ma con una
CONTENUTI DELLA LEZIONE DI OGGI:
 CONTENUTI DELLA LEZIONE DI OGGI: 1. Isomeria (chiralità, enantiomeri, configurazione assoluta, nomenclatura R, S) 2. Analisi miscela di enantiomeri - polarimetria - cromatografia chirale - NMR 3. Risoluzione
CONTENUTI DELLA LEZIONE DI OGGI: 1. Isomeria (chiralità, enantiomeri, configurazione assoluta, nomenclatura R, S) 2. Analisi miscela di enantiomeri - polarimetria - cromatografia chirale - NMR 3. Risoluzione
L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer
 L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer Un atomo di carbonio con almeno due sostituenti identici e la sua immagine speculare sono sovrapponibili e quindi eguali atomo1.c3d Un atomo
L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer Un atomo di carbonio con almeno due sostituenti identici e la sua immagine speculare sono sovrapponibili e quindi eguali atomo1.c3d Un atomo
Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica.
 Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica. 1. Scrivere la formula condensata per la molecola seguente: Br e la
Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica. 1. Scrivere la formula condensata per la molecola seguente: Br e la
Stereochimica. Atomi di carbonio tetraedrici e loro immagini speculari. Le molecole del tipo CH 3
 Figura Stereochimica Stereochimica: enantiomeri Atomi di carbonio tetraedrici e loro immagini speculari. Le molecole del tipo CH 3 X e CH 2 XY sono identiche alle loro immagini speculari, ma una molecola
Figura Stereochimica Stereochimica: enantiomeri Atomi di carbonio tetraedrici e loro immagini speculari. Le molecole del tipo CH 3 X e CH 2 XY sono identiche alle loro immagini speculari, ma una molecola
4. Stereoisomeria ottica o enantiomeria
 . Stereoisomeria ottica o enantiomeria Fenomeno per cui due (o più) stereoisomeri sono distinguibili solo per via ottica o enzimatica. Nel 1850 Biot scopre l esistenza, in alcuni composti organici, dell
. Stereoisomeria ottica o enantiomeria Fenomeno per cui due (o più) stereoisomeri sono distinguibili solo per via ottica o enzimatica. Nel 1850 Biot scopre l esistenza, in alcuni composti organici, dell
Come scrivere correttamente le rappresentazioni tridimensionali (formalismo dei cunei pieni e cunei tratteggiati) e le proiezioni di Fischer
 ome scrivere correttamente le rappresentazioni tridimensionali (formalismo dei cunei pieni e cunei tratteggiati) e le proiezioni di Fischer Supponiamo di dover disegnare, usando la rappresentazione tridimensionale
ome scrivere correttamente le rappresentazioni tridimensionali (formalismo dei cunei pieni e cunei tratteggiati) e le proiezioni di Fischer Supponiamo di dover disegnare, usando la rappresentazione tridimensionale
ISOMERI. Stereoisomeri. Isomeri Cos/tuzionali. Conformeri. Geometrici. configurazionali. Enan/omeri. Diastereoisomeri
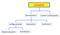 ISOMEI Stereoisomeri Isomeri Cos/tuzionali configurazionali Geometrici Conformeri Diastereoisomeri Enan/omeri Chiralità Dato un Piano di iflessione ( specchio ) è possibile o=enere per qualunque ogge=o
ISOMEI Stereoisomeri Isomeri Cos/tuzionali configurazionali Geometrici Conformeri Diastereoisomeri Enan/omeri Chiralità Dato un Piano di iflessione ( specchio ) è possibile o=enere per qualunque ogge=o
Teoria degli orbitali. Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale.
 Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Idrocarburi Saturi. Cicloalcani
 Idrocarburi Saturi Cicloalcani Cicloalcani I cicloalcani sono idrocarburi i cui atomi di carbonio sono uniti per formare un anello In natura sono presenti cicloalcani con dimensioni dell anello che vanno
Idrocarburi Saturi Cicloalcani Cicloalcani I cicloalcani sono idrocarburi i cui atomi di carbonio sono uniti per formare un anello In natura sono presenti cicloalcani con dimensioni dell anello che vanno
Isomeria Costituzionale. Isomeria Conformazionale
 Isomeria ostituzionale Isomeri ostituzionali: omposti con uguale formula molecolare ma con un diverso ordine con cui sono legati gli atomi tra loro. Isomeria onformazionale onformazione: ciascuna disposizione
Isomeria ostituzionale Isomeri ostituzionali: omposti con uguale formula molecolare ma con un diverso ordine con cui sono legati gli atomi tra loro. Isomeria onformazionale onformazione: ciascuna disposizione
Il materiale didattico presentato è di uso esclusivamente personale: NON deve essere trasferito a terzi né diffuso pubblicamente
 Il materiale didattico presentato è di uso esclusivamente personale: NON deve essere trasferito a terzi né diffuso pubblicamente Il materiale didattico non riporta esaurientemente quanto discusso durante
Il materiale didattico presentato è di uso esclusivamente personale: NON deve essere trasferito a terzi né diffuso pubblicamente Il materiale didattico non riporta esaurientemente quanto discusso durante
Gli elettroni della molecola sono quindi descritti da
 IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
Stereochimica. Molecole nello spazio
 Stereochimica Molecole nello spazio Stereoisomeri: definizioni Stereoisomeri: isomeri che hanno la medesima connettività tra gli atomi ma differente orientazione 3D degli atomi nello spazio. Stereoisomeri
Stereochimica Molecole nello spazio Stereoisomeri: definizioni Stereoisomeri: isomeri che hanno la medesima connettività tra gli atomi ma differente orientazione 3D degli atomi nello spazio. Stereoisomeri
ISOMERIA. Isomeri costituzionali. Stereoisomeri. Nomenclatura. Importanza biologica della chiralità
 ISOMERIA Isomeri costituzionali Stereoisomeri Nomenclatura Importanza biologica della chiralità ISOMERI Si definiscono isomeri composti con identica formula molecolare, ma diversa struttura (concatenazione
ISOMERIA Isomeri costituzionali Stereoisomeri Nomenclatura Importanza biologica della chiralità ISOMERI Si definiscono isomeri composti con identica formula molecolare, ma diversa struttura (concatenazione
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 9 Il mondo del carbonio 3 Sommario 1. Esiste un enorme varietà di composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 9 Il mondo del carbonio 3 Sommario 1. Esiste un enorme varietà di composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani
CHIMICA ORGANICA CHIMICA DEL CARBONIO
 CHIMICA ORGANICA CHIMICA DEL CARBONIO Fino al 1828 con il termine organico si indicavano le sostanze prodotte dagli organismi viventi, mentre si classificavano come inorganiche tutte le altre Dopo il 1828
CHIMICA ORGANICA CHIMICA DEL CARBONIO Fino al 1828 con il termine organico si indicavano le sostanze prodotte dagli organismi viventi, mentre si classificavano come inorganiche tutte le altre Dopo il 1828
Tipologie di formule chimiche
 CHIMICA ORGANICA Tipologie di formule chimiche FORMULA RAZIONALE Tipo di formula che utilizza una rappresentazione analoga alla formula bruta per quei gruppi di atomi sulla cui disposizione non vi possono
CHIMICA ORGANICA Tipologie di formule chimiche FORMULA RAZIONALE Tipo di formula che utilizza una rappresentazione analoga alla formula bruta per quei gruppi di atomi sulla cui disposizione non vi possono
Un oggetto si definisce chirale se non è sovrapponibile alla. propria immagine speculare (mano destra e mano sinistra). Non
 Illustrate la chiralità delle molecole: Chiralità Un oggetto si definisce chirale se non è sovrapponibile alla propria immagine speculare (mano destra e mano sinistra). Non c è un piano di simmetria La
Illustrate la chiralità delle molecole: Chiralità Un oggetto si definisce chirale se non è sovrapponibile alla propria immagine speculare (mano destra e mano sinistra). Non c è un piano di simmetria La
Sostanze otticamente attive POLARIMETRIA
 Sostanze otticamente attive POLARIMETRIA COMPOSTI OTTICAMENTE ATTIVI I composti vengono definiti otticamente attivi se sono in grado di fare ruotare il piano della luce polarizzata (stato gassoso, liquido,
Sostanze otticamente attive POLARIMETRIA COMPOSTI OTTICAMENTE ATTIVI I composti vengono definiti otticamente attivi se sono in grado di fare ruotare il piano della luce polarizzata (stato gassoso, liquido,
Sostanze otticamente attive POLARIMETRIA
 Sostanze otticamente attive POLARIMETRIA COMPOSTI OTTICAMENTE ATTIVI I composti vengono definiti otticamente attivi se sono in grado di fare ruotare il piano della luce polarizzata (stato gassoso, liquido,
Sostanze otticamente attive POLARIMETRIA COMPOSTI OTTICAMENTE ATTIVI I composti vengono definiti otticamente attivi se sono in grado di fare ruotare il piano della luce polarizzata (stato gassoso, liquido,
Configurazione. Conformazione
 Configurazione Posizione relativa degli atomi nello spazio che caratterizza un particolare stereoisomero Sono in numero limitato (in genere 2) Conformazione Particolare geometria di una molecola che dipende
Configurazione Posizione relativa degli atomi nello spazio che caratterizza un particolare stereoisomero Sono in numero limitato (in genere 2) Conformazione Particolare geometria di una molecola che dipende
- il DNA, la molecola che contiene l informazione genetica, - le proteine dei nostro organismo ( proteine dei muscoli, della pelle, gli enzimi),
 La chimica organica è la chimica dei composti del carbonio, che sono i mattoni con cui sono costruiti tutti i corpi viventi della terra. Questi composti comprendono ad esempio - il DNA, la molecola che
La chimica organica è la chimica dei composti del carbonio, che sono i mattoni con cui sono costruiti tutti i corpi viventi della terra. Questi composti comprendono ad esempio - il DNA, la molecola che
ROTAZIONI OTTICHE DICOMPOSTI CHIRALI
 Corso di Chimica Organica: 6 a esperienza di laboratorio : ROTAZIONI OTTICHE DICOMPOSTI CHIRALI Anno accademico 2012/2013 PRINCIPI GENERALI Un atomo di carbonio legato a 4 gruppi diversi è un centro stereogeno
Corso di Chimica Organica: 6 a esperienza di laboratorio : ROTAZIONI OTTICHE DICOMPOSTI CHIRALI Anno accademico 2012/2013 PRINCIPI GENERALI Un atomo di carbonio legato a 4 gruppi diversi è un centro stereogeno
ROTAZIONI OTTICHE DICOMPOSTI CHIRALI
 Corso di Chimica Organica: 6 a esperienza di laboratorio : ROTAZIONI OTTICHE DICOMPOSTI CHIRALI Anno accademico 2011/2012 PRINCIPI GENERALI Un atomo di carbonio legato a 4 gruppi diversi è un centro stereogeno
Corso di Chimica Organica: 6 a esperienza di laboratorio : ROTAZIONI OTTICHE DICOMPOSTI CHIRALI Anno accademico 2011/2012 PRINCIPI GENERALI Un atomo di carbonio legato a 4 gruppi diversi è un centro stereogeno
M i n i s t e r o d e l l I s t r u z i o n e, d e l l U n i v e r s i t à e d e l l a R i c e r c a
 PROGRAMMA SVOLTO DOCENTE: Campani Maria Varini Simone A.S: 2018/2019 DISCIPLINA: Chimica organica e biochimica CLASSE: 3^A CHI MAT Per ogni Tema svolto vengono indicati i relativi contenuti. LEGAME CHIMICO
PROGRAMMA SVOLTO DOCENTE: Campani Maria Varini Simone A.S: 2018/2019 DISCIPLINA: Chimica organica e biochimica CLASSE: 3^A CHI MAT Per ogni Tema svolto vengono indicati i relativi contenuti. LEGAME CHIMICO
Alcani e cicloalcani. Nomenclatura e nomi comuni Struttura e proprietà Reazioni
 Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata CHO
 Configurazione (Mislow, 1965) Posizione relativa degli atomi nello spazio cha caratterizza un particolare stereoisomero Enantiomeri: configurazione opposta Diastereoisomeri: configurazione diversa Conformazione
Configurazione (Mislow, 1965) Posizione relativa degli atomi nello spazio cha caratterizza un particolare stereoisomero Enantiomeri: configurazione opposta Diastereoisomeri: configurazione diversa Conformazione
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Composti formati esclusivamente dagli elementi Carbonio ed Idrogeno
 Alcani Composti formati esclusivamente dagli elementi Carbonio ed Idrogeno Alcani Sono il tipo di idrocarburi che contiene il maggior numero di atomi di per numero di atomi di C Sono anche detti idrocarburi
Alcani Composti formati esclusivamente dagli elementi Carbonio ed Idrogeno Alcani Sono il tipo di idrocarburi che contiene il maggior numero di atomi di per numero di atomi di C Sono anche detti idrocarburi
Non non STEREOISOMERI
 Stereoisomeria Isomeri i cui atomi sono legati nello stesso ordine ma sono orientati in modo diverso nello spazio Non sono in equilibrio tra loro, non sono diversi conformeri ma sono STEREOISOMERI Oltre
Stereoisomeria Isomeri i cui atomi sono legati nello stesso ordine ma sono orientati in modo diverso nello spazio Non sono in equilibrio tra loro, non sono diversi conformeri ma sono STEREOISOMERI Oltre
Gli Alcheni : struttura e nomenclatura
 Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è n H
Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è n H
Alcani e Cicloalcani
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcani e Cicloalcani Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcani e Cicloalcani Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e
Tutor: Dr. Cristina Contini e Dott. Simone Serrao
 Testi adottati: - I PRINCIPI DI BIOCHIMICA DI LEHNINGER di D.L. Nelson, M.M. Cox. Ed. ZANICHELLI. Settima Edizione, 2018. - PRINCIPI DI BIOCHIMICA. Horton, Moran, Scrimgeour, Perry, Rawn. Ed. Pearson.
Testi adottati: - I PRINCIPI DI BIOCHIMICA DI LEHNINGER di D.L. Nelson, M.M. Cox. Ed. ZANICHELLI. Settima Edizione, 2018. - PRINCIPI DI BIOCHIMICA. Horton, Moran, Scrimgeour, Perry, Rawn. Ed. Pearson.
Classificazione degli idrocarburi
 Classificazione degli idrocarburi ALCANI Alcani: idrocarburi saturi contenenti solo legami semplici carbonio-carbonio (tutti i carboni sono ibridati sp3). Modelli molecolari di etano, propano e butano.
Classificazione degli idrocarburi ALCANI Alcani: idrocarburi saturi contenenti solo legami semplici carbonio-carbonio (tutti i carboni sono ibridati sp3). Modelli molecolari di etano, propano e butano.
ISOMERIA GEOMETRICA NEGLI ALCHENI
 ISOMERIA GEOMETRIA NEGLI ALENI Negli alcheni, la rotazione è ancora possibile attorno ai legami - semplici, ma non attorno ai legami doppi = propene.. Anche se la rotazione intorno al doppio legame non
ISOMERIA GEOMETRIA NEGLI ALENI Negli alcheni, la rotazione è ancora possibile attorno ai legami - semplici, ma non attorno ai legami doppi = propene.. Anche se la rotazione intorno al doppio legame non
Parametri da cui dipendono le costanti di accoppiamento
 Parametri da cui dipendono le costanti di accoppiamento 2 J: può essere negativa o positiva 2 J 12-15 z se Csp 3 ; 2-4 z se Csp 2 Metodi Fisici in Chimica Organica - NMR 3 J: è di solito positiva a) angolo
Parametri da cui dipendono le costanti di accoppiamento 2 J: può essere negativa o positiva 2 J 12-15 z se Csp 3 ; 2-4 z se Csp 2 Metodi Fisici in Chimica Organica - NMR 3 J: è di solito positiva a) angolo
IBRIDAZIONE DEL CARBONIO NEGLI ALCANI PREMESSA: COSA SONO GLI ORBITALI IBRIDI.
 ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
Reazioni Stereospecifiche e Stereoselettive
 Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
7.9 Reazioni che introducono un centro Stereogenico
 7.9 eazioni che introducono un centro tereogenico Molte reazioni convertono reagenti achirali a prodotti chirali. E importante ricordare, comunque che se tutti i i componenti iniziali (reagenti, catalizzatori,
7.9 eazioni che introducono un centro tereogenico Molte reazioni convertono reagenti achirali a prodotti chirali. E importante ricordare, comunque che se tutti i i componenti iniziali (reagenti, catalizzatori,
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
Isomeria ottica. Un atomo di carbonio presente in un composto organico viene definito asimmetrico quando lega quattro sostituenti diversi.
 Isomeria ottica Un atomo di carbonio presente in un composto organico viene definito asimmetrico quando lega quattro sostituenti diversi. Un atomo di carbonio asimmetrico è un centro chirale, e forma così
Isomeria ottica Un atomo di carbonio presente in un composto organico viene definito asimmetrico quando lega quattro sostituenti diversi. Un atomo di carbonio asimmetrico è un centro chirale, e forma così
PIANO DELLE UDA Terzo Anno
 ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Terzo Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Rappresentare una
ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Terzo Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Rappresentare una
Esercitazione n. 6 Selezione risposte sulla stereoisomeria ottica. 2. Sistemate un piano di simmetria in ciascuna delle seguenti strutture:
 .. Esercitazione n. 6 Selezione risposte sulla stereoisomeria ottica.. Sistemate un piano di simmetria in ciascuna delle seguenti strutture: a) -------------- b) c) d) 5. Indicare con un asterisco gli
.. Esercitazione n. 6 Selezione risposte sulla stereoisomeria ottica.. Sistemate un piano di simmetria in ciascuna delle seguenti strutture: a) -------------- b) c) d) 5. Indicare con un asterisco gli
isomeria di struttura isomeria di posizione isomeria di catena stereoisomeria isomeria di conformazione isomeria di configurazione 'isomeria ottica
 ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
Gli idrocarburi contengono solo atomi di carbonio e di idrogeno. Gli idrocarburi alifatici hanno molecole lineari (talora ramificate) mentre quelli
 Gli idrocarburi contengono solo atomi di carbonio e di idrogeno. Gli idrocarburi alifatici hanno molecole lineari (talora ramificate) mentre quelli ciclici presentano molecole ad anello. Se hanno tutti
Gli idrocarburi contengono solo atomi di carbonio e di idrogeno. Gli idrocarburi alifatici hanno molecole lineari (talora ramificate) mentre quelli ciclici presentano molecole ad anello. Se hanno tutti
Gruppi funzionali Un gruppo funzionale è un atomo o un gruppo di atomi con proprietà chimiche e fisiche tipiche. E
 Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
Idrocarburi Saturi. Alcani
 Idrocarburi Saturi Alcani IDROCARBURI I principali componenti del petrolio e del gas naturale, risorse dalle quali proviene la maggior parte dei combustibili per la produzione di energia sono idrocarburi,
Idrocarburi Saturi Alcani IDROCARBURI I principali componenti del petrolio e del gas naturale, risorse dalle quali proviene la maggior parte dei combustibili per la produzione di energia sono idrocarburi,
Stereochimica di alcani e cicloalcani
 di alcani e cicloalcani Conformazioni, conformeri Due conformazioni dell etano. Le conformazioni sono arrangiamenti diversi di atomi che interconvertono per rotazione attorno al legame C-C. Rappresentazione
di alcani e cicloalcani Conformazioni, conformeri Due conformazioni dell etano. Le conformazioni sono arrangiamenti diversi di atomi che interconvertono per rotazione attorno al legame C-C. Rappresentazione
3. Cicloalcani. Formula generale: C n H 2n in serie omologa C 9 C 10 C 11 C 12 >C 12. Es.: 1,1-dimetilciclopropano. Anelli. piccoli. Anelli.
 . Cicloalcani Formula generale: C n 2n in serie omologa ciclopropano ciclobutano ciclopentano Anelli piccoli C 9 C 10 C 11 C 12 cicloottano ciclononano ciclodecano cicloundecano ciclododecano Anelli medi
. Cicloalcani Formula generale: C n 2n in serie omologa ciclopropano ciclobutano ciclopentano Anelli piccoli C 9 C 10 C 11 C 12 cicloottano ciclononano ciclodecano cicloundecano ciclododecano Anelli medi
PIANO DI LAVORO ANNUALE
 PIANO DI LAVORO ANNUALE Classe 3B A.S. 2013-14 Disciplina: Chimica Organica Docente: prof. Laura M. Iannone Ore settimanali: 4 Libro di testo: Percorsi di Chimica Organica, di Paolo De Maria ed. Zanichelli.
PIANO DI LAVORO ANNUALE Classe 3B A.S. 2013-14 Disciplina: Chimica Organica Docente: prof. Laura M. Iannone Ore settimanali: 4 Libro di testo: Percorsi di Chimica Organica, di Paolo De Maria ed. Zanichelli.
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 CIALITA Una molecola è chirale quando non è sovrapponibile alla sua immagine speculare Immagine speculare = entità distinta Chiralità: proprietà PSEUSCALAE esta invariata con un operazione di simmetria
CIALITA Una molecola è chirale quando non è sovrapponibile alla sua immagine speculare Immagine speculare = entità distinta Chiralità: proprietà PSEUSCALAE esta invariata con un operazione di simmetria
Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a
 Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a formare lo scheletro della molecola, mentre gli atomi di
Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a formare lo scheletro della molecola, mentre gli atomi di
Gruppi funzionali. Gruppi funzionali
 Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
ALCANI. C n H 2n+2 CH 3 CH 2 CH 2 CH 2 CH 2 CH 3. alcani lineari. alcani ramificati. Cap. 2
 ALANI n 2n+2 2 2 2 2 alcani lineari alcani ramificati ap. 2 1-4 5-10 10-16 15-20 ONFORMAZIONI DEGLI ALANI Ruotando attorno al legame - si individuano alcune posizioni relative dei tetraedri ALTERNATA (SFALSATA)
ALANI n 2n+2 2 2 2 2 alcani lineari alcani ramificati ap. 2 1-4 5-10 10-16 15-20 ONFORMAZIONI DEGLI ALANI Ruotando attorno al legame - si individuano alcune posizioni relative dei tetraedri ALTERNATA (SFALSATA)
Conformazione degli alcani
 onformazione degli alcani La conformazione di un alcano si riferisce alla disposizione tridimensionale degli atomi che risulta dalla rotazione attorno al legame -. Nonostante in una molecola possano esservi
onformazione degli alcani La conformazione di un alcano si riferisce alla disposizione tridimensionale degli atomi che risulta dalla rotazione attorno al legame -. Nonostante in una molecola possano esservi
Stereochimica di alcani e cicloalcani. Stereochimica. Conformazioni, conformeri
 di alcani e cicloalcani Conformazioni, conformeri Due conformazioni dell etano. I differenti conformeri si interconvertono per rotazione attorno al legame C-C. 1 Rappresentazione a cavalletto e proiezione
di alcani e cicloalcani Conformazioni, conformeri Due conformazioni dell etano. I differenti conformeri si interconvertono per rotazione attorno al legame C-C. 1 Rappresentazione a cavalletto e proiezione
esempio: glucosio C 6 H 12 O 6
 CARBIDRATI CARBIDRATI Il nome, carboidrati, di questa categoria di composti deriva dal fatto che molti membri hanno formula generale C n ( 2 ) m da cui il nome alternativo di idrati del carbonio. esempio:
CARBIDRATI CARBIDRATI Il nome, carboidrati, di questa categoria di composti deriva dal fatto che molti membri hanno formula generale C n ( 2 ) m da cui il nome alternativo di idrati del carbonio. esempio:
Alcani. Es. CH 3 CH 2 CH 2 CH 3
 Alcani Gli alcani sono i composti organici più semplici costituiti solo da atomi di e di (Idrocarburi); Sono composti saturi poiché ogni atomo di carbonio è legato al numero massimo possibile (4) di altri
Alcani Gli alcani sono i composti organici più semplici costituiti solo da atomi di e di (Idrocarburi); Sono composti saturi poiché ogni atomo di carbonio è legato al numero massimo possibile (4) di altri
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
CHIMICA ORGANICA. L isomeria
 1 B-ISOMERIA IMIA ORGANIA L isomeria Gli isomeri sono composti diversi (ciascuno con proprietà fisiche e chimiche proprie) che hanno tuttavia la stessa composizione chimica e quindi la stessa formula chimica
1 B-ISOMERIA IMIA ORGANIA L isomeria Gli isomeri sono composti diversi (ciascuno con proprietà fisiche e chimiche proprie) che hanno tuttavia la stessa composizione chimica e quindi la stessa formula chimica
Chimica Organica. Definizione. La chimica organica è la chimica dei composti contenenti carbonio
 Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Riassunto delle lezioni precedenti..
 Riassunto delle lezioni precedenti.. Chimica del Carbonio L atomo di Carbonio può formare legami singoli, legami doppi e legami tripli IDROCARBURI formati solo da carbonio e idrogeno Si dividono in 3 classi:
Riassunto delle lezioni precedenti.. Chimica del Carbonio L atomo di Carbonio può formare legami singoli, legami doppi e legami tripli IDROCARBURI formati solo da carbonio e idrogeno Si dividono in 3 classi:
Introduzione alla Simmetria Molecolare
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Introduzione alla Simmetria Molecolare Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/general-chemistry-lessons/
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Introduzione alla Simmetria Molecolare Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/general-chemistry-lessons/
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
IDROCARBURI: classificazione
 ALCANI 1 IDROCARBURI: classificazione 2 ALCANI Formula bruta: C n H 2n+2 1 C CH 4 2 C C 2 H 6 3 C C 3 H 8 4 C C 4 H 10 3 ALCANI: ibridazione Orbitali s, p e sp 3 z orbitale 2s y x z z z orbitali 2p y x
ALCANI 1 IDROCARBURI: classificazione 2 ALCANI Formula bruta: C n H 2n+2 1 C CH 4 2 C C 2 H 6 3 C C 3 H 8 4 C C 4 H 10 3 ALCANI: ibridazione Orbitali s, p e sp 3 z orbitale 2s y x z z z orbitali 2p y x
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A Prova scritta del corso di Fondamenti di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
Struttura e legami dei composti organici. VIDEOLEZIONE L ibridazione dell atomo di carbonio. Alcani e cicloalcani
 III 1 Struttura e legami dei composti organici 1.1 La nascita della chimica organica 2 1.2 Struttura elettronica degli atomi 3 1.3 Regola dell ottetto e simbolismo di Lewis 5 1.4 Elettronegatività e legami
III 1 Struttura e legami dei composti organici 1.1 La nascita della chimica organica 2 1.2 Struttura elettronica degli atomi 3 1.3 Regola dell ottetto e simbolismo di Lewis 5 1.4 Elettronegatività e legami
Chimica Organica. Studio dei composti del CARBONIO
 Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
ALCHENI CICLOALCHENI. C n H 2n. C n H 2n-2 C C. Gruppo funzionale degli alcheni (idrocarburi insaturi): doppio legame carbonio-carbonio
 ALCENI C n 2n CICLOALCENI C n 2n-2 C C Gruppo funzionale degli alcheni (idrocarburi insaturi): doppio legame carbonio-carbonio I carboni coinvolti nel doppio legame sono ibridati sp 2 : per cui sono legati
ALCENI C n 2n CICLOALCENI C n 2n-2 C C Gruppo funzionale degli alcheni (idrocarburi insaturi): doppio legame carbonio-carbonio I carboni coinvolti nel doppio legame sono ibridati sp 2 : per cui sono legati
Idrocarburi: composti organici che hanno nella loro struttura solo atomo di C o H
 Idrocarburi: composti organici che hanno nella loro struttura solo atomo di C o H Alifatici: deriva dal greco aleifar cioè unguento; questo perché molti grassi contengono lunghe catene carboniose. GLI
Idrocarburi: composti organici che hanno nella loro struttura solo atomo di C o H Alifatici: deriva dal greco aleifar cioè unguento; questo perché molti grassi contengono lunghe catene carboniose. GLI
nella forma CIS i due gruppi funzionali si trovano dalla stessa parte, mentre nella forma trans si trovano dalla parte opposta.
 http://www. STEREOCHIMICA Considera i due composti 1 forma CIS 2 forma TRANS nella forma CIS i due gruppi funzionali si trovano dalla stessa parte, mentre nella forma trans si trovano dalla parte opposta.
http://www. STEREOCHIMICA Considera i due composti 1 forma CIS 2 forma TRANS nella forma CIS i due gruppi funzionali si trovano dalla stessa parte, mentre nella forma trans si trovano dalla parte opposta.
Carboidrati semplici
 arboidrati semplici ontenuti della lezione: Monosaccaridi aldosi e chetosi Proiezioni di Fischer La reattività dei monosaccaridi: formazione di emiacetaliciclici, ossidazione ad acidi aldonici, riduzione
arboidrati semplici ontenuti della lezione: Monosaccaridi aldosi e chetosi Proiezioni di Fischer La reattività dei monosaccaridi: formazione di emiacetaliciclici, ossidazione ad acidi aldonici, riduzione
Isomeria configurazionale o stereoisomeria
 Isomeria configurazionale o stereoisomeria Tale isomeria si ha in complessi che hanno la stessa formula empirica e la stessa sequenza delle connessioni atomiche, ma diversa distribuzione spaziale degli
Isomeria configurazionale o stereoisomeria Tale isomeria si ha in complessi che hanno la stessa formula empirica e la stessa sequenza delle connessioni atomiche, ma diversa distribuzione spaziale degli
