LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
|
|
|
- Valerio Pisano
- 4 anni fa
- Visualizzazioni
Transcript
1 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
2 LA RADIAZIONE ELETTROMAGNETICA
3 LA RADIAZIONE ELETTROMAGNETICA
4 LA RADIAZIONE ELETTROMAGNETICA
5 LO SPETTRO ELETTROMAGNETICO
6 LA QUANTIZZAZIONE DELL ENERGIA
7 GLI SPETTRI ATOMICI DI EMISSIONE L equazione di Rydberg 1 l = R ( 1 1 ) n 2 1 n 2 2 R = m -1
8 IL MODELLO ATOMICO DI BOHR: I LIVELLI ENERGETICI DELL ATOMO DI IDROGENO Energia totale dell elettrone nel livello n E n = R h c n 2 Bohr stabilì come energia zero il punto in cui elettrone e protone sono completamente separati, per cui l elettrone in ogni suo stato energetico all interno dell atomo ha un energia negativa; n definisce l energia degli orbitali permessi; Un atomo che ha i suoi elettroni nei livelli energetici più bassi si trova nello stato fondamentale; l atomo di idrogeno è nel suo stato di minima energia: stato fondamentale con n = 1; Per l atomo di idrogeno, gli stati con energia maggiore n > 1 sono detti stati eccitati. Per valori di n maggiori, l elettrone è più lontano dal nucleo; I livelli energetici sono sempre più vicini tra di loro al crescere di n.
9 IL MODELLO ATOMICO DI BOHR
10 IL MODELLO ATOMICO DI BOHR Quando un elettrone eccitato passa ad uno stato energetico inferiore emette energia sottoforma di un fotone di luce: DE = hn = E fin E in
11 IL MODELLO QUANTO-MECCANICO L equazione di De Broglie e il dualismo onda-particella L equazione di Schrödinger HY = EY l = h mv Il principio di Indeterminazione di Heisenberg E impossibile conoscere contemporaneamente con precisione la posizione e l energia di un elettrone.
12 IL MODELLO QUANTO-MECCANICO L equazione di Schrödinger HY = EY Solo certe funzioni d onda sono possibili e a ciascuna di esse è associato un valore di energia: l energia dell elettrone è quantizzata; Le soluzioni dell equazione di Schrödinger per un elettrone nello spazio dipendono da 3 numeri interi, detti numeri quantici; solo certe combinazioni dei loro valori sono possibili; Il valore della funzione d onda in un dato punto nello spazio è l ampiezza dell onda associata all elettrone; questo valore possiede un segno che può essere negativo o positivo; Il quadrato della funzione d onda è legato alla probabilità di trovare l elettrone in una data zona di spazio, si chiama densità di probabilità o densità elettronica.
13 I NUMERI QUANTICI
14 I NUMERI QUANTICI
15 GLI ORBITALI ATOMICI
16 L ORBITALE s Diagrammi della distribuzione della densità elettronica associata agli orbitali s
17 GLI ORBITALI p
18 GLI ORBITALI d
19 GLI ORBITALI f
20 IL MODELLO QUANTO-MECCANICO L equazione di Schrödinger HY = EY Ogni soluzione dell equazione di Schrödinger descrive un possibile stato energetico dell elettrone dentro l atomo; Ogni soluzione dell equazione di Schrödinger è definita da un insieme di numeri quantici; Le soluzioni dell equazione di Schrödinger danno informazioni anche sulla forma e l orientazione delle probabilità di densità elettronica che sono espresse in termini dei cosiddetti orbitali atomici; Gli orbitali atomici sono definiti dai numeri quantici; Un orbitale atomico è una regione di spazio in cui si ha un elevata probabilità di trovare un elettrone.
21 GLI ORBITALI
22 I NUMERI QUANTICI
23 L ENERGIA DEGLI ORBITALI
24 L ENERGIA DEGLI ORBITALI
25 CONFIGURAZIONE ELETTRONICA
26 CONFIGURAZIONE ELETTRONICA AufBau Notazione spettroscopica
27 CONFIGURAZIONE ELETTRONICA
28
29
30
31 PROPRIETA PERIODICHE DEGLI ELEMENTI
32 RAGGIO ATOMICO Misurato in pm
33 RAGGIO ATOMICO e RAGGIO IONICO Misurato in Å
34 1.52 Å 0.72 Å 0.90 Å 1.19 Å
35 IONI ISOELETTRONICI
36 ENERGIA DI IONIZZAZIONE
37 ENERGIA DI IONIZZAZIONE
38 ENERGIA DI IONIZZAZIONE
39 AFFINITA ELETTRONICA
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
1 3 STRUTTURA ATOMICA
 1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
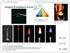 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
ATOMI E PARTICELLE SUBATOMICHE
 ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
La struttura degli atomi
 1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La struttura dell atomo
 La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
- Dati sperimentali: interazione luce / materia spettri caratteristici
 - Thomson: evidenza sperimentale per elettrone misura e/m e - Millikan: misura la carica dell elettrone e ne ricava la massa e = 1,60 x 10-19 C - Rutherford: stima le dimensioni atomiche struttura vuota
- Thomson: evidenza sperimentale per elettrone misura e/m e - Millikan: misura la carica dell elettrone e ne ricava la massa e = 1,60 x 10-19 C - Rutherford: stima le dimensioni atomiche struttura vuota
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
ATOMO. Avogadro (1811) Volumi uguali di gas diversi contengono un ugual numero di MOLECOLE (N A =6,022*10 23 )
 ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
STRUTTURA ATOMICA. Per lo studio della struttura dell atomo ci si avvale della Spettroscopia.
 STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno:
 La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole
 Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Quarta unità didattica. Disposizione degli elettroni nell atomo
 Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
COMPORTAMENTO DUALISTICO della MATERIA
 COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
the power of ten Prof.ssa Patrizia Gallucci
 https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
Struttura atomica, configurazione elettronica e periodicità chimica
 Struttura atomica, configurazione elettronica e periodicità chimica Dualismo onda-particella (V. de Broglie) Principio di indeterminazione (W. Heisenberg) Equazione di Shrodinger(1925) Modello quantomeccanico
Struttura atomica, configurazione elettronica e periodicità chimica Dualismo onda-particella (V. de Broglie) Principio di indeterminazione (W. Heisenberg) Equazione di Shrodinger(1925) Modello quantomeccanico
mvr = n h e 2 r = m v 2 e m r v = La configurazione elettronica r = e 2 m v 2 (1) Quantizzazione del momento angolare (2) 4 πε.
 La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
Il principio di indeterminazione di Heisenberg
 Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Modello atomico ad orbitali e numeri quantici
 Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Unbowed, Unbent, Unbroken
 Unbowed, Unbent, Unbroken L ATOMO E LE SUE PROPRIETÀ STRUTTURA DELL ATOMO Carica Massa Protoni = particelle a carica positiva +1,6 x 10-19 C 1,67 x 10-27 Kg Elettroni = particelle a carica negativa -1,6
Unbowed, Unbent, Unbroken L ATOMO E LE SUE PROPRIETÀ STRUTTURA DELL ATOMO Carica Massa Protoni = particelle a carica positiva +1,6 x 10-19 C 1,67 x 10-27 Kg Elettroni = particelle a carica negativa -1,6
La Struttura degli Atomi
 La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
L evoluzione del modello di atomo
 L evoluzione del modello di atomo Dalton (1803) Thomson (1898) Rutherford (1911) Bohr (1913) L atomo di Bohr e la quantizzazione dell energia I pianeti più interni sentono maggiormente l attrazione gravitazionale
L evoluzione del modello di atomo Dalton (1803) Thomson (1898) Rutherford (1911) Bohr (1913) L atomo di Bohr e la quantizzazione dell energia I pianeti più interni sentono maggiormente l attrazione gravitazionale
Rappresentazione dell atomo. Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano.
 Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Il modello di Bohr. Lezioni d'autore di Giorgio Benedetti
 Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo
 STRUTTURA dell ATOMO J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo J. Chadwich (193): dimostra l esistenza del neutrone J.J. Thomson (1897):
STRUTTURA dell ATOMO J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo J. Chadwich (193): dimostra l esistenza del neutrone J.J. Thomson (1897):
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Radiazioni ionizzanti
 Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
Interazione luce- atomo
 Interazione luce- atomo Descrizione semiclassica L interazione predominante è quella tra il campo elettrico e le cariche ASSORBIMENTO: Elettrone e protone formano un dipolo che viene messo in oscillazione
Interazione luce- atomo Descrizione semiclassica L interazione predominante è quella tra il campo elettrico e le cariche ASSORBIMENTO: Elettrone e protone formano un dipolo che viene messo in oscillazione
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Lezioni di Meccanica Quantistica
 Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Come sono disposti gli elettroni intorno al nucleo in un atomo?
 Come sono disposti gli elettroni intorno al nucleo in un atomo? La natura ondulatoria della radiazione elettromagnetica e della luce La luce è una radiazione elettromagnetica che si muove nello spazio
Come sono disposti gli elettroni intorno al nucleo in un atomo? La natura ondulatoria della radiazione elettromagnetica e della luce La luce è una radiazione elettromagnetica che si muove nello spazio
Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico. Prof. Stefano Piotto Università di Salerno
 Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico Prof. Stefano Piotto Università di Salerno Seconda parte 1. Teoria atomica 2. Esperimenti di Thompson e Millikan 3. Modello
Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico Prof. Stefano Piotto Università di Salerno Seconda parte 1. Teoria atomica 2. Esperimenti di Thompson e Millikan 3. Modello
Comunicazioni Docente - Studenti
 Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
A Z. L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone. +1e e.
 L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
Teoria atomica. Dr. Lucia Tonucci Ingegneria delle Costruzioni
 Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
CHIMICA E BIOCHIMICA
 CHIMICA E BIOCHIMICA CHIMICA: studia la materia Materia= ogni cosa che ha massa Proprietà Struttura Trasformazioni (Reazioni) BIOCHIMICA: studia la chimica degli organismi viventi Di cosa è composta la
CHIMICA E BIOCHIMICA CHIMICA: studia la materia Materia= ogni cosa che ha massa Proprietà Struttura Trasformazioni (Reazioni) BIOCHIMICA: studia la chimica degli organismi viventi Di cosa è composta la
ESERCIZI W X Y Z. Numero di massa Neutroni nel nucleo Soluzione
 ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
E. SCHRODINGER ( )
 E. SCHRODINGER (1887-1961) Elettrone = onda le cui caratteristiche possono essere descritte con un equazione simile a quella delle onde stazionarie le cui soluzioni, dette funzioni d onda ψ, rappresentano
E. SCHRODINGER (1887-1961) Elettrone = onda le cui caratteristiche possono essere descritte con un equazione simile a quella delle onde stazionarie le cui soluzioni, dette funzioni d onda ψ, rappresentano
Crisi della Fisica Classica & Fisica Quantistica
 Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 11, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 11, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
ATOMI MONOELETTRONICI
 ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
Gli argomenti trattati
 LEZIONE 1 Struttura della materia e Gli argomenti trattati Composizione della materia materia, sostanze e miscele, elementi e composti Fondamenti di struttura atomica Molecole: formula empirica, formula
LEZIONE 1 Struttura della materia e Gli argomenti trattati Composizione della materia materia, sostanze e miscele, elementi e composti Fondamenti di struttura atomica Molecole: formula empirica, formula
6) Modello atomico a ORBITALI
 6) Modello atomico a ORBITALI PREMESSA: LIMITI DEL MODELLO DI BOHR (pag. 94 par.3) Applicando il concetto di quantizzazione dell E all atomo, Bohr ipotizzò che un atomo potesse esistere solo in determinati
6) Modello atomico a ORBITALI PREMESSA: LIMITI DEL MODELLO DI BOHR (pag. 94 par.3) Applicando il concetto di quantizzazione dell E all atomo, Bohr ipotizzò che un atomo potesse esistere solo in determinati
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
L atomo di Bohr. Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913)
 L atomo di Bohr Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913) L atomo di Bohr L atomo di idrogeno presenta un solo elettrone 1. L elettrone
L atomo di Bohr Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913) L atomo di Bohr L atomo di idrogeno presenta un solo elettrone 1. L elettrone
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tavola Periodica degli Elementi: Gruppi e Periodi
 La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti).
 4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
ATOMO POLIELETTRONICO. Numero quantico di spin m s
 ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
La struttura dell atomo
 La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
Libri di testo consigliati. In Italiano: D.F. Shriver & P.W. Atkins Chimica Inorganica (II edizione, dalla V edizione Inglese) Zanichelli
 Libri di testo consigliati In Italiano: D.F. Shriver & P.W. Atkins Chimica Inorganica (II edizione, dalla V edizione Inglese) Zanichelli G. L. Miessler, D. A. Tarr Chimica Inorganica Piccin Editore In
Libri di testo consigliati In Italiano: D.F. Shriver & P.W. Atkins Chimica Inorganica (II edizione, dalla V edizione Inglese) Zanichelli G. L. Miessler, D. A. Tarr Chimica Inorganica Piccin Editore In
STRUTTURA ATOMICA. tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica
 STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
LA STRUTTURA DELLE MOLECOLE. Meccanica Quantistica e Orbitali Atomici
 LA STRUTTURA DELLE MOLECOLE Meccanica Quantistica e Orbitali Atomici LE MOLECOLE Le molecole sono i costituenti di tutta la materia e possono essere considerate degli oggetti costruiti con componenti chiamati
LA STRUTTURA DELLE MOLECOLE Meccanica Quantistica e Orbitali Atomici LE MOLECOLE Le molecole sono i costituenti di tutta la materia e possono essere considerate degli oggetti costruiti con componenti chiamati
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia!1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia!1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Struttura della materia
 Struttura della materia 1. L elettrone 2. Effetto Compton 3. Struttura dell atomo XIV - 0 Rapporto carica/massa dell elettrone Esperimento di Thomson: raggi catodici. Fascio non deflesso: Quando B=0: con
Struttura della materia 1. L elettrone 2. Effetto Compton 3. Struttura dell atomo XIV - 0 Rapporto carica/massa dell elettrone Esperimento di Thomson: raggi catodici. Fascio non deflesso: Quando B=0: con
Modelli atomici. Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle.
 Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
2bis. I modelli atomici
 2bis. I modelli atomici 2.1 Il modello di Thomson 2.2 Il modello di Rutherford; 2.3 Il dualismo particella-onda; 2.4 Il modello di Bohr 2.5 Il modello a orbitali 2.6 Il riempimento degli orbitali e le
2bis. I modelli atomici 2.1 Il modello di Thomson 2.2 Il modello di Rutherford; 2.3 Il dualismo particella-onda; 2.4 Il modello di Bohr 2.5 Il modello a orbitali 2.6 Il riempimento degli orbitali e le
LEZIONE N 28. Corso di Fisica II Prof. Giuseppe Ciancio
 LEZIONE N 28 1 Cenni storici atomo dal greco "atomòs" "indivisibile" Democrito In verità esistono solo atomi e il vuoto«. L uomo pensava che ogni cosa nel mondo fosse un composto dei quattro elementi:
LEZIONE N 28 1 Cenni storici atomo dal greco "atomòs" "indivisibile" Democrito In verità esistono solo atomi e il vuoto«. L uomo pensava che ogni cosa nel mondo fosse un composto dei quattro elementi:
Testi Consigliati. I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli. Qualsiasi altro testo che tratti gli argomenti elencati nel programma
 Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
1. Scrivere l equazione di Schrödinger unidimensionale per una particella di massa m con energia potenziale V (x) = mω2
 1 Teoria Una particella di massa m = 1 g e carica elettrica q = 1 c viene accelerata per un tratto pari a l = m da una differenza di potenziale pari av = 0 volt Determinare la lunghezza d onda di De Broglie
1 Teoria Una particella di massa m = 1 g e carica elettrica q = 1 c viene accelerata per un tratto pari a l = m da una differenza di potenziale pari av = 0 volt Determinare la lunghezza d onda di De Broglie
Sommario delle lezione 3. Struttura dell atomo. Configurazione elettronica
 Sommario delle lezione 3 Struttura dell atomo Configurazione elettronica Spettri di emissione e assorbimento degli atomi Ogni elemento ha uno spettro caratteristico che può essere usato per identificarlo
Sommario delle lezione 3 Struttura dell atomo Configurazione elettronica Spettri di emissione e assorbimento degli atomi Ogni elemento ha uno spettro caratteristico che può essere usato per identificarlo
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica Teoria atomica della materia Teoria atomica di Dalton 1.Ciascun elemento è composto da particelle estremamente piccole chiamate atomi. 2.Tutti gli atomi di un dato
Struttura elettronica e tavola periodica Teoria atomica della materia Teoria atomica di Dalton 1.Ciascun elemento è composto da particelle estremamente piccole chiamate atomi. 2.Tutti gli atomi di un dato
Non c è alcuna possibilità che gli uomini un giorno accedano all energia. Robert Millikan Premio Nobel per la Fisica 1923
 Capitolo 3 Atomi Non c è alcuna possibilità che gli uomini un giorno accedano all energia atomica. Robert Millikan Premio Nobel per la Fisica 1923 3.1 Potenziali a simmetria sferica In problemi a simmetria
Capitolo 3 Atomi Non c è alcuna possibilità che gli uomini un giorno accedano all energia atomica. Robert Millikan Premio Nobel per la Fisica 1923 3.1 Potenziali a simmetria sferica In problemi a simmetria
Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L.
 Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L. Lozzi Testi degli esercizi svolti in aula Corpo Nero 1. Il corpo
Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L. Lozzi Testi degli esercizi svolti in aula Corpo Nero 1. Il corpo
λν = c, ove c velocità della luce.
 Cap.2 Struttura elettronica degli atomi Le radiazioni luminose (sia visibili che non) sono radiazioni elettromagnetiche che consistono in una forma di energia che si propaga anche nel vuoto: sono la simultanea
Cap.2 Struttura elettronica degli atomi Le radiazioni luminose (sia visibili che non) sono radiazioni elettromagnetiche che consistono in una forma di energia che si propaga anche nel vuoto: sono la simultanea
Chimica generale. Corsi di laurea in - Tecnologie alimentari - Viticoltura ed enologia PARTE 1
 Chimica generale Corsi di laurea in - Tecnologie alimentari - Viticoltura ed enologia PARTE 1 1 Michèle Nègre DI.VA.P.R.A. Settore di chimica agraria Tel: 011 6708508 michele.negre@unito.it 2 Chimica generale
Chimica generale Corsi di laurea in - Tecnologie alimentari - Viticoltura ed enologia PARTE 1 1 Michèle Nègre DI.VA.P.R.A. Settore di chimica agraria Tel: 011 6708508 michele.negre@unito.it 2 Chimica generale
Struttura dell atomo atomo particelle sub-atomiche - protoni positiva - neutroni } nucleoni - elettroni negativa elemento
 Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica. Mod. 1 CHIMICA. Mod. 2 CHIMICA FISICA. Lezione 1 RECAPITI
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 1 Anno Accademico 2010-2011 Docente: Dimitrios Fessas RECAPITI Prof. Dimitrios
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 1 Anno Accademico 2010-2011 Docente: Dimitrios Fessas RECAPITI Prof. Dimitrios
Configurazione elettronica e collegamento alla tavola periodica
 Configurazione elettronica e collegamento alla tavola periodica Modelli atomici a confronto Un elettrone che si trova in un certo livello possiede l energia associata a quel livello, in particolare al
Configurazione elettronica e collegamento alla tavola periodica Modelli atomici a confronto Un elettrone che si trova in un certo livello possiede l energia associata a quel livello, in particolare al
Particelle Subatomiche
 GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
Chimica e laboratorio
 Chimica e laboratorio L atomo: configurazione elettronica Classi Terze Lic. Sc. Tecnologico Anno Scolastico 2007/2008 Prerequisiti Conoscere l evoluzione delle conoscenze sulla costituzione dell atomo,
Chimica e laboratorio L atomo: configurazione elettronica Classi Terze Lic. Sc. Tecnologico Anno Scolastico 2007/2008 Prerequisiti Conoscere l evoluzione delle conoscenze sulla costituzione dell atomo,
Forma e proprietà dell orbitale 1s
 Riassumendo Forma e proprietà dell orbitale 1s Proprietà degli orbitali 2s Forma e proprietà degli orbitali 2p Forma e proprieta degli orbitali d Orbitali di tipo f Comportamento degli elettroni in un
Riassumendo Forma e proprietà dell orbitale 1s Proprietà degli orbitali 2s Forma e proprietà degli orbitali 2p Forma e proprieta degli orbitali d Orbitali di tipo f Comportamento degli elettroni in un
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
Programma svolto nell a.s
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
