ph = log 1/[H+] = - log [H+]
|
|
|
- Regina Falco
- 8 anni fa
- Visualizzazioni
Transcript
1 ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare = ph urina 4.5 8
2 Valori normali di concentrazione degli ioni H+ nel sangue e nelle cellule della mucosa dello stomaco Sangue 0,00004 meq/l = 40 neq/l ph= log 1/40 neq ph = log 0, Eq/L = 7,4 Stomaco ph = log 0,16 Eq/L= 0,8
3 Produzione H+ nell organismo mmol/dì 1) CO2 CO 2 + H 2 O H 2 CO 3 H+ + HCO 3 Non costituisce guadagno di H + perché CO 2 è volatile 2) Acidi fissi (0.2%): Acido solforico (metabolismo proteico: metionina, cisteina, cistina) Acido fosforico (metabolismo fosfolipidi) Acido cloridrico (conversione Cloruro di ammonio in Urea) Acido lattico Corpi chetonici (Acido acetoacetico, βidrossibutirrico, acetone) Consumo H + Reazioni metaboliche Ossidazione anioni (citrato, lattato, acetato) Bilancio adulto in dieta mista + 1 meq/kg/dì di H +
4 Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione: CO 2 Eliminazione H + Rene: H +
5 Sistemi di regolazione del ph 1. Sistemi tampone nei liquidi corporei (si combinano istantaneamente con acidi e basi per impedire variazioni consistenti del ph) risposta immediata 2. Centro respiratorio (regola in pochi minuti la ventilazione e quindi l eliminazione di CO 2 ) risposta rapida 3. Rene (elimina dal corpo gli acidi o le basi in eccesso) risposta lenta
6 Azione dei tamponi sul ph 12 acqua Con tampone ph 7 2 Aggiunta di acido forte Aggiunta di base forte
7 ph = pk+ log [A ] [HA]
8 Potere tampone: Quantità (moli) di acido o base che occorre aggiungere ad 1l di soluzione tampone per variare il ph di 1 unità Equazione di HendersonHasselbalck permette di calcolare il ph di una soluzione tampone ed è descritta dalla cinetica della reazione: Per la Legge dell azione delle masse: K 1 [HA] = K 2 [H + ] [A ] K 1 K 2 = K = HA [H + ] [A ] K 1 [HA] [H + ] [A ] [HA] K1 K2 log [H + ] = log K log H + + A All equilibrio K 1 = K 2 K 2 [H + ] = K [A ] [HA] [A ] = K costante di equilibrio [HA] ph = pk+ log [A ] [HA]
9 Rappresentazione grafica dell equazione di HendersonHasselbalck Curva di titolazione di un acido debole Aggiunta di H + HA pk = 6,5 Rimozione di H + A ph Quando il valore del ph è uguale al valore del pk, le concentrazioni di HA ed A sono uguali. Il sistema tampone è più efficiente nella parte centrale della curva (entro oscillazioni di 1 unità di ph in più o in meno del valore di pk) Il tampone è efficace se: il suo pk è vicino al ph desiderato è presente in elevate concentrazioni
10 Sistema tampone del Bicarbonato E formato dalla coppia tampone HCO 3 /H 2 CO 3 Quando viene aggiunto un acido forte come HCl, l H + liberato viene tamponato da HCO 3 con formazione di H 2 CO 3 secondo la reazione: H + + HCO 3 K1 H 2 CO 3 H 2 O + CO 2 Quando viene aggiunta una base forte come NaOH, l OH liberato si combina con H 2 CO 3 formando HCO 3. La concentrazione di H 2 CO 3 diminuisce e la reazione è spostata verso sinistra. Secondo l equazione di HendersonHasselbalck: ph = pk + log [HCO 3 ] /[H 2 CO 3 ] dove H 2 CO 3 può essere sostituito da CO 2 (40 mmhg*0,03) L aumento della concentrazione di HCO 3 determina aumento del ph, spostando l equilibrio acidobase verso l alcalosi, mentre un aumento di CO 2 abbassa il ph spostando l equilibrio acidobase verso l acidosi K2 ph = pk + log [HCO 3 ] /1.2mmol/l pk = 6.1 ph = log 24mmol/l /1.2mmol/l ph = log 20 (1.3) = 7.4
11 Punto al quale normalmente opera nell organismo questo sistema tampone Aggiunta di H + % tampone sotto forma di H 2 CO 3 eco pk = 6, % tampone sotto forma di HCO 3 Aggiunta di OH ph Curva di titolazione del sistema bicarbonato Il sistema tampone non sembra essere particolarmente efficiente perché pk è 6.1 e il ph è 7.4.
12 Il sistema tampone Bicarbonato è il sistema tampone extracellulare più potente dell organismo, perché rappresenta un sistema aperto nel quale CO 2 è controllata dalla respirazione e HCO 3 dal rene. ph = log 24mmol/l /1.2mmol/l = 7.4 L aggiunta di 5 mmol HCl in un sistema chiuso: ph = log (24 5)/(1.2 +5) ph = log 19/6.5 = 6.6 L aggiunta di 5 mmol HCl in un sistema aperto, in cui CO 2 è costantemente controllata: ph = log 19/1.2 = 7.3
13 Sistema tampone del Fosfato HPO 4 2 /H 2 PO 4 pk = 6.8 E meno efficace perché: meno concentrato (12 meq/l) la forma acida non può essere eliminata come la CO 2 E comunque essenziale per la regolazione del ph del liquido extracellulare e del liquido tubulare renale perché: il fosfato è enormemente concentrato nei tubuli renali il liquido tubulare ha un ph più vicino al pk del tampone Sistema tampone delle Proteine Le proteine sono i sistemi tampone più abbondanti dell organismo. La loro capacità tampone è legata all esistenza di gruppi imidazolici dell istidina (pk = ) e αaminici (pk = ). Nell emoglobina ridotta i gruppi imidazolici hanno un pk più elevato: maggiore potere tampone. Nei globuli rossi l Emoglobina ha una importante funzione tampone.
14 Tamponi intracellulari (principio isoidrico) Il ph intracellulare è leggermente inferiore a quello del LEC, ma segue, anche se lentamente, le sue variazioni, perché CO 2 diffonde nelle cellule e H + entra con anioni organici e in scambio con il K +. I sistemi tampone intracellulari contribuiscono ad impedire variazioni del ph del LEC, anche se agiscono lentamente e sono rappresentati dalle proteine e dai fosfati inorganici (ATP, ADP, AMP Glucosio1 monofosfato e 2,3DPG).
15 Basi tampone totali: Somma di tutti gli anioni (essenzialmente proteinati e bicarbonati) con effetto tampone La concentrazione totale delle basi tampone nel sangue ammonta a circa 48 mmol/l e non si modifica al variare della pco 2 (se pco 2 aumenta, al corrispondente aumento di HCO 3, segue una diminuzione dei proteinati che tamponano l H + ) La concentrazione totale delle basi tampone è un buon indice per il riconoscimento delle alterazioni dell equilibrio acidobase dovute ad aumento o diminuzione degli acidi fissi nel sangue Un aumento della concentrazione delle basi tampone, rispetto al normale, viene definito come eccesso di basi (BE). In caso di riduzione si parla di BE negativo
16 Basi tampone totali P BIC 50 proteine C Cl 25 bicarbonato 0 Plasma GR Sangue pco 2
17 La regolazione respiratoria dell equilibrio acidobase La seconda linea di difesa dalle alterazioni dell equilibrio acidobase è costituita dal controllo polmonare della concentrazione di CO 2 Aumento di pco 2 significa diminuzione del ph, diminuzione di pco 2 aumento del ph. Regolando la pco 2 attraverso variazioni della ventilazione, i polmoni possono regolare il ph: Se il ph diminuisce la ventilazione è stimolata e la conseguente riduzione di pco 2 riporta il ph vicino ai valori normali Se il ph aumenta il centro respiratorio viene depresso, la ventilazione si riduce e il conseguente aumento di pco 2 riporta il ph vicino ai valori normali
18 I reni mantengono l equilibrio acidobase in condizioni normali attraverso: Riassorbimento di quasi tutto l HCO 3 filtrato (4320 meq/dì) Secrezione di una quantità di ioni H + (4400 meq/dì) equivalente a quella prodotta
19 I reni ripristinano l equilibrio acidobase in condizioni di alterazione attraverso: Riassorbimento di tutto l HCO 3 filtrato (acidosi) o di quantità minori di HCO 3 filtrato (alcalosi) Secrezione di quantità maggiori (acidosi) o minori (alcalosi) di H + Produzione di nuovi HCO 3 (acidosi)
20 In condizioni normali la velocità di secrezione tubulare degli ioni H + è di circa 4400 meq/dì (4320 meq/dì di HCO 3 sono presenti nel tubulo) Gli H + in eccesso (80 meq/dì) vengono escreti con l urina in combinazione con altri tamponi urinari. Infatti poiché il ph dell urina non può scendere sotto 4.5 (0.03 meq/l), solo una piccola parte degli H + eccedenti può essere escreta in forma ionizzata. Se gli 80 meq/dì di H + in eccesso fossero eliminati in forma ionizzata, sarebbe necessaria l escrezione di 2667 litri/dì di urina L escrezione nell urina di abbondanti quantitativi di ioni H + si ottiene grazie alla presenza di tamponi urinari (sistema del fosfato e sistema dell ammoniaca)
21 Il riassorbimento degli HCO 3 filtrati avviene grazie alla secrezione di ioni H +
22 Riassorbimento degli HCO meq/dì 10% 432 meq/dì > 4.9% 215 meq/dì 1 meq/dì
23 Modalità di screzione di H + e riassorbimento di HCO 3 nel tubulo prossimale Cellule tubulari Filtrazione HCO 3 Sangue Na + ATP K + HCO 3 + H + H + + Anidrasi carbonica H 2 CO 3 H 2 O + CO 2 Na + H 2 CO 3 CO 2 + H 2 O Liquido interstiziale Per ogni ione H + secreto nel lume, uno ione HCO 3 viene riassorbito e passa nel sangue Lume tubulare
24 Quando si ha un eccesso di HCO 3 rispetto ad H + nell urina (alcalosi metabolica) gli HCO 3 in eccesso non possono essere riassorbiti e vengono escreti (compensazione dell alcalosi) Quando si ha un eccesso di H + rispetto ad HCO 3 (acidosi), HCO 3 viene completamente riassorbito e gli H + in eccesso passano nell urina, dove sono tamponati da fosfato ed ammoniaca ed escreti in forma di sali (compensazione dell acidosi)
25 Escrezione acida renale ph urinario max 4,5 per cui l H+ libero non supera i 30 micromol/l L H+ per essere escreto deve essere tamponato : Sistema NH 3 /NH 4 (60%), non titolabile, perchè oltre ph 7 resta legato come NH 4. A livello renale la glutaminasi è attivata dall acidosi ed inibita dall alcalosi. Se la secrezione di NH 4 continuasse in alcalosi poco NH 3 verrebbe escreto (tossicità per il SNC) Ruolo del Fegato:Acidosi: inibizione glutaminasi epatica e si forma glutamina al posto dell urea: la glutamina viene utilizzata dalla glutaminasi renale per eliminare H+ Alcalosi: attivazione glutaminasi epatica, si forma urea e il rene elimina urea e non H+ Sistema HPO 4 2 /HPO 4 (30%). In condizioni normali la maggior parte del fosfato filtrato è riassorbita, solo 3040 meq/dì sono utilizzabili come tampone urinario
26 Il sistema tampone del fosfato: pk = 6.8 Cellule tubulari Filtrazione Na + ATP K + Na + HPO 4 2 HCO 3 + H + H + + Sangue Liquido interstiziale Anidrasi carbonica H 2 CO 3 CO 2 H 2 PO 4 H 2 O + CO 2 NaH 2 PO 4 Per ogni ione H + secreto nel lume che si combina con un tampone diverso dall HCO 3, un nuovo ione HCO 3 viene immesso nel sangue Lume tubulare
27 Escrezione NH 3 nel tubulo prossimale Liquido interstiziale Glutamina Cellule tubulo prossimale 2HCO 3 Glutamina + NH 3 2NH 4 + Lume tubulare Glutamina Cl Sangue Na + ATP K + NH 4 + NH 4 + Na + + Cl NH 4 + Per ogni molecola di glutamina metabolizzata nei tubuli prossimali 2NH 4+ vengono secreti nell urina e 2HCO 3 di nuova formazione vengono immessi nel sangue
28 Escrezione NH 3 nei tubuli collettori NH 3 Na + NH 3 NH 3 ATP K + ATP + HCO 3 + H + H + H + H + Cl Sangue CO 2 Liquido interstiziale Anidrasi carbonica H 2 CO 3 H 2 O + CO 2 Per ogni NH + 4 escreto nell urina viene generato un nuovo HCO 3 viene immesso nel sangue K + + NH 4 Cl Lume tubulare
29 Acido netto escreto L escrezione di HCO 3 (U HCO3 x V) indica la rapidità con cui i reni rimuovono HCO 3 dal sangue. La quantità di HCO 3 di nuova formazione è uguale alla quantità di H + secreti nel tubulo ed associati a tamponi diversi da HCO + 3 (quantità di NH 4 escreto + acidità titolabile, valutata con NaOH fino a ph 7.4) Acido netto escreto = NH 4+ escreto + Acido titolabile urinario HCO 3 escreto
30 Ruolo delle cellule intercalate del nefrone distale nell acidosi e nell alcalosi
31 Secrezione di H + (5%) a livello delle cellule intercalate di tipo A in caso di acidosi Liquido interstiziale Cellule intercalate Lume tubulare Sangue CO 2 Cl K + HCO 3 Anidrasi carbonica + H 2 CO 3 H 2 O + CO 2 H + H + ATP ATP Per ogni ione H + secreto nel lume, uno ione HCO 3 viene riassorbito e passa nel sangue Cl H + H + K + H + Escrezione nell urina
32 Riassorbimento di H + a livello delle cellule intercalate di tipo B in caso di alcalosi Liquido interstiziale Cellule intercalate Lume tubulare Cl Cl H + ATP H + + HCO 3 HCO 3 Sangue CO 2 ATP H + K + Anidrasi carbonica H 2 CO 3 H 2 O + CO 2 Per ogni ione H + riassorbito uno ione HCO 3 viene secreto ed escreto nell urina K + Escrezione nell urina
33 Ruolo delle cellule intercalate del nefrone distale nell acidosi e nell alcalosi In caso di acidosi le cellule intercalate di tipo A secernono H + e riassorbono HCO 3 (pompa ATPasi H + e pompa ATPasi H + /K + membrana apicale) In caso di alcalosi le cellule intercalate di tipo B riassorbono H + ed eliminano HCO 3 (pompa ATPasi H + e pompa ATPasi H + /K + membrana basolaterale) La pompa ATPasi H + /K + rappresenta il punto di contatto tra H + e K + che può creare alterazioni nella kaliemia parallele a quelle dell equilibrio acidobase. Acidosi associata ad iperkaliemia Alcalosi associata ad ipokaliemia
34 Gastrointestinale secrezione gastrica e marea alcalina, e secrezione pancreatica alcalina Fegato (effetto sulla glutaminasi) Osso ( acidosi solubilizza i sali di carbonato e fosfato alcalino, mentre l alcalosi mineralizza; la mineralizzazione ossea cede H+ al sangue e la demineralizzazione consuma H+. Somministrazioni di CaCl2 possono indurre acidosi) Sali. Eccessi di Sali non consentono il recupero di HCO3 per cui acidosi (in mancanza di Sali si verifica l opposto) Kaliemia: Iperkaliemia depolarizza la cellula: ciò riduce l efflusso di HCO3 fuori della cellula con conseguente alcalosi cellulare e acidosi extarcellulare indotta dal blocco del Na/H e ridotta escrezione renale di H+ LEC
35 Emesi Perdita di HCl gastrico Perdita di H + fissi Riduzione volume del LEC Angiotensina II Aldosterone Scambio Na + H + Riassorbimento HCO 3 Alcalosi metabolica Secrezione H + Secrezione K + Ipopotassiemia
36 In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce causando una diminuzione del ph. Se il rapporto diminuisce per perdita di HCO 3 l acidosi è definita metabolica (nonrespiratoria), se per aumento di CO 2 l acidosi è definita respiratoria Si ha alcalosi quando il rapporto HCO 3 /CO 2 aumenta causando un aumento del ph. Se il rapporto aumenta per aumento di HCO 3 l alcalosi è definita metabolica (nonrespiratoria), se per diminuzioni di CO 2 l alcalosi è definita respiratoria
37 Acidosi Distacco (istidina) aa da enzimi: Acidosi inibisce la glicolisi e favorisce al gluconeogenesi (iperglicemia) ed inibisce la sintesi di DNA. Fattori di crescita stimolano le pompena/h, aumentano il ph cellulare e favoriscono la proliferazione cellulare. Rilascia potassio da parte delle cellule a causa della perdita cellulare di HCO3 e conseguente depolarizzazione cellulare (iperkaliemia) Canali I canali K si chiudono in acidosi In acidosi i mitocondri rilasciano Ca scambiandolo con H, si ha distacco Ca dalle proteine (siti legame) con proteine (ipercalcemia) ed inibizione del Ca muscolare cardiaco Cuore Diminuzione forza contrazione, dilata i vasi,(caduta della pressione) e riduce la permeabilità delle gap junction (rallenta la velocità di conduzione) Aumenta la pressione intracranica (vasodilatazione)
38 Alcalosi Alcalosi stimola glicolisi ed inibisce la gluconeogenesi (ipoglicemia) Ipokaliemia (aritmie) K si apre in alcalosi La corrente entrante di Ca aumenta in alcalosi si ha legame del Ca alle proteine (siti legame) (ipocalcemia) aumento eccitabilità neuromuscolare Vasocostrizione cerebrale e convulsioni
39 Acidosi metabolica: H + HCO 3 pco 2 (H si lega con HCO3 e forma CO2) Compenso respiratorio: pco 2 HCO 3 H + Iperventilazione (pco 2 si riduce di 1.2 mmhg per 1 meq/l di riduzione della [HCO 3 ], risposta limitata dalla conseguente diminuzione di pco 2 che inibisce la ventilazione) Compenso renale: Maggiore secrezione di H + Riassorbimento totale di HCO 3 Maggiore escrezione di NH 4+ (formazione nuovo HCO 3 )
40 Alcalosi metabolica: H + HCO 3 pco 2 Compenso respiratorio: pco 2 H + HCO 3 Ipoventilazione (pco 2 aumenta di 0.7 mmhg per 1 meq/l di aumento della [HCO 3 ]) Minore secrezione di H + Compenso renale: Minor riassorbimento e maggiore escrezione di HCO 3
41 pco 2 HCO 3 Acidosi respiratoria: H + Fase acuta: Tamponamento intracellulare [HCO 3 ] aumenta di 1 meq/l per ogni 10 mmhg di incremento della pco 2 Fase cronica Compenso renale: HCO 3 H + Maggiore secrezione H + Riassorbimento totale HCO 3 Maggiore escrezione di NH 4+ (formazione nuovo HCO 3 ) [HCO 3 ] aumenta di 3.5 meq/l per ogni 10 mmhg di incremento della pco 2
42 Alcalosi respiratoria: pco 2 HCO 3 H + Fase acuta: Tamponamento intracellulare [HCO 3 ] si riduce di 2 meq/l per ogni 10 mmhg di riduzione della pco 2 Fase cronica Compenso renale: HCO 3 H + Minore secrezione H + Minore riassorbimento e maggiore escrezione di HCO 3 Minore escrezione di NH 4 + [HCO 3 ] si riduce di 5 meq/l per ogni 10 mmhg di riduzione della pco 2
43 Analisi dei disturbi acidobase semplici Parametri misurati nel sangue arterioso Acidosi ph Alcalosi HCO 3 24 meq/l CO mmhg HCO meq/l CO 2 40 mmhg Metabolica Respiratoria Metabolica Respiratoria Compenso respiratorio Compenso renale Compenso respiratorio Compenso renale pco 2 40 mmhg HCO meq/l pco mmhg HCO 3 24 meq/l
44 Nomogramma acidobase Vi sono riportati i valori di ph del sangue arterioso, di HCO 3 e della pco 2 che si intersecano secondo l equazione di HendersonHasselbalch.
45 Nomogramma AlM AcRc AcRa Norm AlRa AcM AlRc
46 1a: acidosi primaria non respiratoria 1b: compenso respiratorio (iperventilazione, <pco2). Si parla di acidosi non respiratoria completamente o parzialmente compensata se il ph torna o no al valore normale 2a: alcalosi primaria non respiratoria 2b: compenso respiratorio (ipoventilazione > pco2) sempre incompleta Il diagramma riporta come parametro le curve di pco 2 costante. I punti a sinistra e a destra della banda bianca indicano uno stato di acidosi e di alcalosi 3a: Acidosi respiratoria primaria 3b: compenso renale 4a: alcalosi respiratoria primaria 4b: compenso renale
47 HCO Normale Acidosi METABOLICA, in parte compensata Il metodo di Astrup permette di determinare la pco 2 e lo stato acidobase del sangue. Valutazione in campioni di sangue in esame dei valori d ph ottenuti con miscele gassose a pco 2 note. Il valore di ph e della pco 2 nota (A e B) vengono riportate sul diagramma e congiunti con una retta Sulla retta AB si indica il valore di pco 2 (C), corrispondente al ph reale del sangue in esame. L inserzione della retta con le opportune scale del diagramma permette di conoscere la concentrazione totale delle basi tampone, il BE, e HCO3
48 Nomogramma per la determinazione del BE dai valori di pco 2 e di ph misurati. La retta che unisce i valori di pco 2 e di ph misurati, taglia la scala a destra in corrispondenza del valore di BE cercato. Linee rosse indicano i valori corrispondenti ad un normale stato acidobase Linea blu: acidosi metabolica parzialmente compensata dalla respirazione Linea verde acidosi respiratoria scompensata
49 Sangue arterioso: ph = 7.35, [HCO 3 ] = 16 meq/l, pco 2 = 30 mmhg Acidosi metabolica perché ph 7.4, [HCO 3 ] 24mEq/l, pco 2 40 mmhg Analisi risposta compensatoria: Acidosi metabolica compensata perché pco 2 40 mmhg Diagnosi: Acidosi metabolica semplice, con appropriata risposta compensatoria respiratoria in atto Sangue arterioso: ph = 6.96, [HCO 3 ] = 12 meq/l, pco 2 = 55 mmhg Acidosi metabolica e respiratoria perché ph 7.4, [HCO 3 ] 24mEq/l, pco mmhg Diagnosi: Alterazione mista, potrebbe essere presente in paziente con patologia respiratoria cronica (enfisema) e con una forma gastrointestinale acuta (diarrea)
50
51 Sangue arterioso: ph = 7.35, [HCO 3 ] = 16 meq/l, pco 2 = 30 mmhg Acidosi metabolica perché ph 7.4, [HCO 3 ] 24mEq/l, pco 2 40 mmhg Analisi risposta compensatoria: Acidosi metabolica compensata perché pco 2 40 mmhg Diagnosi: Acidosi metabolica semplice, con appropriata risposta compensatoria respiratoria in atto Sangue arterioso: ph = 6.96, [HCO 3 ] = 12 meq/l, pco 2 = 55 mmhg Acidosi metabolica e respiratoria perché ph 7.4, [HCO 3 ] 24mEq/l, pco mmhg Diagnosi: Alterazione mista, potrebbe essere presente in paziente con patologia respiratoria cronica (enfisema) e con una forma gastrointestinale acuta (diarrea)
Alterazioni equilibrio acidobase
 Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Fisiologia Renale 5. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Bilancio Sodio e Potassio
 Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica
 Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Volume liquidi corporei. Rene
 A breve termine Riflesso barocettivo A lungo termine Controllo volume ematico Quota introduzione liquidi RPT GC Pa Volume liquidi corporei Rene Diuresi Un modo per regolare la Pa è quello di aggiungere
A breve termine Riflesso barocettivo A lungo termine Controllo volume ematico Quota introduzione liquidi RPT GC Pa Volume liquidi corporei Rene Diuresi Un modo per regolare la Pa è quello di aggiungere
FISIOLOGIA CdL in Medicina e Chirurgia. Regolazione del ph. Dott.ssa Michela Anna Pia Ciliberti
 FISIOLOGIA CdL in Medicina e Chirurgia Regolazione del ph Dott.ssa Michela Anna Pia Ciliberti FUNZIONI OMEOSTATICHE INTEGRATE regolazione della temperatura corporea; controllo del ph dell organismo; regolazione
FISIOLOGIA CdL in Medicina e Chirurgia Regolazione del ph Dott.ssa Michela Anna Pia Ciliberti FUNZIONI OMEOSTATICHE INTEGRATE regolazione della temperatura corporea; controllo del ph dell organismo; regolazione
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido
 Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
EMOGASANALISI ARTERIOSA
 EMOGASANALISI ARTERIOSA Prelievo arterioso Il prelievo arterioso può essere eseguito nelle arterie RADIALE, BRACHIALE o FEMORALE. Attualmente viene eseguito più frequentemente il prelievo dall arteria
EMOGASANALISI ARTERIOSA Prelievo arterioso Il prelievo arterioso può essere eseguito nelle arterie RADIALE, BRACHIALE o FEMORALE. Attualmente viene eseguito più frequentemente il prelievo dall arteria
Quota introduzione liquidi. Volume liquidi corporei. Rene
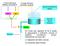 A breve termine Riflesso barocettivo A lungo termine Controllo volemia Quota introduzione liquidi RPT GC Pa Volume liquidi corporei Rene Diuresi Un modo per regolare la Pa è quello di aggiungere o sottrarre
A breve termine Riflesso barocettivo A lungo termine Controllo volemia Quota introduzione liquidi RPT GC Pa Volume liquidi corporei Rene Diuresi Un modo per regolare la Pa è quello di aggiungere o sottrarre
OMEOSTASI DELLA TEMPERATURA CORPOREA
 OMEOSTASI DELLA TEMPERATURA CORPOREA Ruolo fisiologico del calcio Omeostasi del calcio ASSORBIMENTO INTESTINALE DEL CALCIO OMEOSTASI GLICEMICA Il livello normale di glicemia? 90 mg/100 ml Pancreas
OMEOSTASI DELLA TEMPERATURA CORPOREA Ruolo fisiologico del calcio Omeostasi del calcio ASSORBIMENTO INTESTINALE DEL CALCIO OMEOSTASI GLICEMICA Il livello normale di glicemia? 90 mg/100 ml Pancreas
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
LEZIONE 12. Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA. Scaricato da Sunhope.it
 LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano
 EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
GLUCONEOGENESI. Sintesi (GENESI) di nuove (NEO) molecole di glucosio
 GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE
 ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE Struttura La porzione più esterna della corticale, la zona glomerulare, è costituita da piccole cellule mentre la porzione centrale,
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE Struttura La porzione più esterna della corticale, la zona glomerulare, è costituita da piccole cellule mentre la porzione centrale,
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO
 IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 4/1995 Gli insegnanti di chimica, durante l esposizione dei concetti fondamentali di acidità
IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 4/1995 Gli insegnanti di chimica, durante l esposizione dei concetti fondamentali di acidità
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
SDD - Seconde Equilibrio e ph. Equilibrio e ph. Obiettivo
 1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]
![Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ] Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]](/thumbs/34/16945364.jpg) La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE
 STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
Integrali (transmembrana), si estendono attraverso l intera membrana. Classificate in famiglie a seconda del numero di segmenti transmembrana.
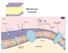 Membrana cellulare Proteine inserite nella membrana cellulare: Integrali (transmembrana), si estendono attraverso l intera membrana. Classificate in famiglie a seconda del numero di segmenti transmembrana.
Membrana cellulare Proteine inserite nella membrana cellulare: Integrali (transmembrana), si estendono attraverso l intera membrana. Classificate in famiglie a seconda del numero di segmenti transmembrana.
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda
 6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda Autoionizzazione (o autoprotolisi) dell acqua. Prodotto ionico dell acqua M = mol/l AA1011 IN L6d p1! AA1011 IN L6d p2! NB: se si
6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda Autoionizzazione (o autoprotolisi) dell acqua. Prodotto ionico dell acqua M = mol/l AA1011 IN L6d p1! AA1011 IN L6d p2! NB: se si
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Funzioni dello stomaco
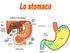 corpo antro Funzioni dello stomaco 1. Storage accumulo di cibo in seguito ad apertura del SEI 2. Mescolamento del cibo con le secrezioni gastriche fino a formare una poltiglia acida detta chimo 3. Digestione
corpo antro Funzioni dello stomaco 1. Storage accumulo di cibo in seguito ad apertura del SEI 2. Mescolamento del cibo con le secrezioni gastriche fino a formare una poltiglia acida detta chimo 3. Digestione
Metabolismo degli amminoacidi. Ciclo dell urea
 Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
GLI EFFETTI DELL ESERCIZIO IN ACQUA. Le risposte fisiologiche dell immersione
 GLI EFFETTI DELL ESERCIZIO IN ACQUA Le risposte fisiologiche dell immersione L acqua È importante che chi si occupa dell attività in acqua sappia che cosa essa provoca nell organismo EFFETTI DELL IMMERSIONE
GLI EFFETTI DELL ESERCIZIO IN ACQUA Le risposte fisiologiche dell immersione L acqua È importante che chi si occupa dell attività in acqua sappia che cosa essa provoca nell organismo EFFETTI DELL IMMERSIONE
In base all equazione di Henderson-Hasselbalch
 Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
ANATOMIA E FISIO-PATOLOGIA L APPARATO URINARIO
 ANATOMIA E FISIO-PATOLOGIA L APPARATO URINARIO CORSO CORSO OSS DISCIPLINA: OSS DISCIPLINA: ANATOMIA PRIMO E FISIO-PATOLOGIA SOCCORSO MASSIMO MASSIMO FRANZIN FRANZIN COSTITUITO DA: DUE RENI DUE URETERI
ANATOMIA E FISIO-PATOLOGIA L APPARATO URINARIO CORSO CORSO OSS DISCIPLINA: OSS DISCIPLINA: ANATOMIA PRIMO E FISIO-PATOLOGIA SOCCORSO MASSIMO MASSIMO FRANZIN FRANZIN COSTITUITO DA: DUE RENI DUE URETERI
a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:30-18:30
 a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4
a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati
 Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
equilibrio acido base
 Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Esercitazione 8. Gli equilibri acido-base: Ka, Kb. L autoprotolisi dell acqua. Misura del ph Soluzioni tampone 1,0 10-14
 Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16
 COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 OMEOSTASI Fisiologia Umana La fisiologia è la scienza che studia i meccanismi di funzionamento degli organismi viventi. E una scienza integrata che
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 OMEOSTASI Fisiologia Umana La fisiologia è la scienza che studia i meccanismi di funzionamento degli organismi viventi. E una scienza integrata che
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
RIASSORBIMENTO PROF. ALESSANDRO MALFATTI. Corso di Fisiologia Speciale Veterinaria
 RIASSORBIMENTO RIASSORBIMENTO TUBULO CONTORTO PROSSIMALE RIASSORBIMENTO OBBLIGATO (indipendente dai sistemi di regolazione) Quantitativamente la gran parte della funzione di riassorbimento avviene a questo
RIASSORBIMENTO RIASSORBIMENTO TUBULO CONTORTO PROSSIMALE RIASSORBIMENTO OBBLIGATO (indipendente dai sistemi di regolazione) Quantitativamente la gran parte della funzione di riassorbimento avviene a questo
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
PERCHE DIABETE MELLITO?
 PERCHE DIABETE MELLITO? La definizione di Diabete Mellito la si deve al medico inglese Willis, che nella seconda metà del XVIII secolo, scoprì, assaggiando l urina dei diabetici, che essa era dolce come
PERCHE DIABETE MELLITO? La definizione di Diabete Mellito la si deve al medico inglese Willis, che nella seconda metà del XVIII secolo, scoprì, assaggiando l urina dei diabetici, che essa era dolce come
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI
 DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
La pressione osmotica del plasma è 28mmHg
 PRESSIONE OSMOTICA capacità di una soluzione più concentrata di richiamare acqua attraverso una membrana semipermeabile (cioè permeabile solo all H 2 O). La pressione osmotica del plasma è 28mmHg 1 SPAZI
PRESSIONE OSMOTICA capacità di una soluzione più concentrata di richiamare acqua attraverso una membrana semipermeabile (cioè permeabile solo all H 2 O). La pressione osmotica del plasma è 28mmHg 1 SPAZI
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
logo.jpg 18F-FDG Vari lavori hanno dimostrato che l accumulo di FDG correla con il Ki-67 MARKER DI PROLIFERAZIONE
 logo.jpg 18F-FDG 18F-FDG Entrata glucosio nelle cellule Segue due vie: diffusione facilitata (in presenza di eccesso) trasporto attivo Na-dipendente (richiede energia) logo.jpg FDG si accumula in base
logo.jpg 18F-FDG 18F-FDG Entrata glucosio nelle cellule Segue due vie: diffusione facilitata (in presenza di eccesso) trasporto attivo Na-dipendente (richiede energia) logo.jpg FDG si accumula in base
2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi
 2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Diffusione semplice e mediata da
2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Diffusione semplice e mediata da
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
MACROSTRUTTURA DEL MUSCOLO STRIATO SCHELETRICO
 FUNZIONE DEL MUSCOLO SCHELETRICO Ultrastruttura della cellula muscolare. Miofilamenti. Meccanismo della contrazione. Trasmissione neuromuscolare. Scossa semplice e tetano muscolare. Unità motoria. PROPRIETA
FUNZIONE DEL MUSCOLO SCHELETRICO Ultrastruttura della cellula muscolare. Miofilamenti. Meccanismo della contrazione. Trasmissione neuromuscolare. Scossa semplice e tetano muscolare. Unità motoria. PROPRIETA
Concetti fondamentali su acidità e basicità delle soluzioni acquose
 Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Corso di elettrocardiografia essenziale
 Corso di elettrocardiografia essenziale Napoli Novembre 2004 ANMCO SIC GISE SIMEU SIS 118 ECG 12 derivazioni preospedaliero Il personale, chiamato ad intervenire nei casi di pazienti con sospetta SCA,
Corso di elettrocardiografia essenziale Napoli Novembre 2004 ANMCO SIC GISE SIMEU SIS 118 ECG 12 derivazioni preospedaliero Il personale, chiamato ad intervenire nei casi di pazienti con sospetta SCA,
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Perché il logaritmo è così importante?
 Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
CLEARANCE. Il concetto di clearance esprime la efficacia della globalità dei nefroni nella eliminazione dei metaboliti filtrati dai glomeruli.
 CLEARANCE Il concetto di clearance esprime la efficacia della globalità dei nefroni nella eliminazione dei metaboliti filtrati dai glomeruli. Clearance of a bridge CLEARANCE La funzione glomerulare
CLEARANCE Il concetto di clearance esprime la efficacia della globalità dei nefroni nella eliminazione dei metaboliti filtrati dai glomeruli. Clearance of a bridge CLEARANCE La funzione glomerulare
VIE DI INTRODUZIONE ED ASSORBIMENTO DEI FARMACI
 VIE DI INTRODUZIONE ED ASSORBIMENTO DEI FARMACI I farmaci possono essere introdotti nell organismo per via enterale e per via parenterale.. Con la somministrazione enterale (enteron = intestino), il farmaco
VIE DI INTRODUZIONE ED ASSORBIMENTO DEI FARMACI I farmaci possono essere introdotti nell organismo per via enterale e per via parenterale.. Con la somministrazione enterale (enteron = intestino), il farmaco
a 25 C da cui si ricava che:
 Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
ossigeno e ne facilita la diffusione dai capillari all ambiente intracellulare.
 Ricostituzione e attività pseudoenzimatica della mioglobina modificata Giulia Bertelegni e Carolina Ferrari I.I.S. A.Maserati Facoltà di Scienze MM.FF.NN. Dipartimento di Chimica generale Università degli
Ricostituzione e attività pseudoenzimatica della mioglobina modificata Giulia Bertelegni e Carolina Ferrari I.I.S. A.Maserati Facoltà di Scienze MM.FF.NN. Dipartimento di Chimica generale Università degli
Attivitá e cinetica enzimatica
 Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
Insufficienza Renale Cronica
 Insufficienza Renale Cronica Le nefropatie croniche si classificano in: - Nefropatia con filtrazione glomerulare (FG) normale [ > 90 ml/min/1,73 m²]; - Nefropatia con diminuzione lieve del FG [89-60 ML
Insufficienza Renale Cronica Le nefropatie croniche si classificano in: - Nefropatia con filtrazione glomerulare (FG) normale [ > 90 ml/min/1,73 m²]; - Nefropatia con diminuzione lieve del FG [89-60 ML
OSS Acidi e Basi. Acidi e basi. Il concetto di equilibrio:
 1 Acidi e basi Il concetto di equilibrio: Le reazioni chimiche sono generalmente irreversibili (non si può tornare alla situazione di partenza). Un esempio semplificato potrebbe essere il seguente: quando
1 Acidi e basi Il concetto di equilibrio: Le reazioni chimiche sono generalmente irreversibili (non si può tornare alla situazione di partenza). Un esempio semplificato potrebbe essere il seguente: quando
EQUILIBRIO ACIDO-BASICO. Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad essere leggermente alcalina.
 EQUILIBRIO ACIDO-BASICO A cura del Dr. Rocco Palmisano (Laureato in Scienza della Salute, U.S.A. - Naturopata) Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad
EQUILIBRIO ACIDO-BASICO A cura del Dr. Rocco Palmisano (Laureato in Scienza della Salute, U.S.A. - Naturopata) Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad
DIABETE MELLITO. Organi danneggiati in corso di diabete mellito INSULINA
 DIABETE MELLITO Il diabete mellito è la più comune malattia endocrina: 1-2% della popolazione E caratterizzato da : -alterazione del metabolismo del glucosio -danni a diversi organi Complicanze acute:
DIABETE MELLITO Il diabete mellito è la più comune malattia endocrina: 1-2% della popolazione E caratterizzato da : -alterazione del metabolismo del glucosio -danni a diversi organi Complicanze acute:
Ritorno venoso. Ingresso nel letto arterioso CUORE. P ad
 Ritorno venoso GC Ingresso nel letto arterioso Eiezione Riempimento CUORE P ad Ra RV Ingresso cuore Rv Mediamente, il volume di sangue che torna al cuore (RV), è uguale a quello che viene immesso nel letto
Ritorno venoso GC Ingresso nel letto arterioso Eiezione Riempimento CUORE P ad Ra RV Ingresso cuore Rv Mediamente, il volume di sangue che torna al cuore (RV), è uguale a quello che viene immesso nel letto
SISTEMA BINARIO DI DUE LIQUIDI VOLATILI TOTALMENTE MISCIBILI che seguono Raoult
 SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
Dipendenza della Solubilità dalla temperatura
 SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
P aria (livello del mare) = 760 mmhg. Composizione: O 2 : 20.84% N 2 : 78.62% CO 2 : 0.04% po 2 = 159 mmhg. pn 2 = 597mmHg. pco 2 = 0.
 Scambi alveolari Aria atmosferica = miscela di gas (principalmente O 2, N 2, CO 2 ) La velocità di diffusione di un gas (quantità di gas che diffonde nell unità di tempo) è direttamente proporzionale alla
Scambi alveolari Aria atmosferica = miscela di gas (principalmente O 2, N 2, CO 2 ) La velocità di diffusione di un gas (quantità di gas che diffonde nell unità di tempo) è direttamente proporzionale alla
OBESITA. 11 Aprile 2013
 OBESITA 11 Aprile 2013 L obesità è una patologia cronica caratterizzata dall eccessivo accumulo di tessuto adiposo nell organismo ed è causata da fattori ereditari e non ereditari che determinano un introito
OBESITA 11 Aprile 2013 L obesità è una patologia cronica caratterizzata dall eccessivo accumulo di tessuto adiposo nell organismo ed è causata da fattori ereditari e non ereditari che determinano un introito
Le due porzioni del pancreas, esocrino ed endocrino, sono anatomicamente e funzionalmente diverse.
 ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 7 PANCREAS Le due porzioni del pancreas, esocrino ed endocrino, sono anatomicamente e funzionalmente diverse. Isole del Langherans Contengono da poche centinaia
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 7 PANCREAS Le due porzioni del pancreas, esocrino ed endocrino, sono anatomicamente e funzionalmente diverse. Isole del Langherans Contengono da poche centinaia
Massimizzazione del Profitto e offerta concorrenziale. G. Pignataro Microeconomia SPOSI
 Massimizzazione del Profitto e offerta concorrenziale 1 Mercati perfettamente concorrenziali 1. Price taking Poiché ogni impresa vende una porzione relativamente piccola della produzione complessiva del
Massimizzazione del Profitto e offerta concorrenziale 1 Mercati perfettamente concorrenziali 1. Price taking Poiché ogni impresa vende una porzione relativamente piccola della produzione complessiva del
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 26 La gluconeogenesi Concetti chiave: Il fegato e il rene possono sintetizzare glucosio da lattato, piruvato e amminoacidi.
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 26 La gluconeogenesi Concetti chiave: Il fegato e il rene possono sintetizzare glucosio da lattato, piruvato e amminoacidi.
CENNI DI ELETTROCHIMICA
 CENNI DI ELETTROCHIMICA Gli elettrodi a membrana sono elettrodi che permettono la determinazione rapida e selettiva, per potenziometria diretta, di numerosi cationi ed anioni. Il meccanismo di formazione
CENNI DI ELETTROCHIMICA Gli elettrodi a membrana sono elettrodi che permettono la determinazione rapida e selettiva, per potenziometria diretta, di numerosi cationi ed anioni. Il meccanismo di formazione
L ACQUA : STRUTTURA E PROPRIETA
 L ACQUA : STRUTTURA E PROPRIETA 1. Sostanza più abbondante in tutti gli esseri viventi 2. Più del 70% del peso di tutti gli esseri viventi 3. Influenza la struttura e la proprietà di tutte le molecole
L ACQUA : STRUTTURA E PROPRIETA 1. Sostanza più abbondante in tutti gli esseri viventi 2. Più del 70% del peso di tutti gli esseri viventi 3. Influenza la struttura e la proprietà di tutte le molecole
La digestione degli alimenti
 La digestione degli alimenti Le sostanze alimentari complesse (lipidi, glucidi, protidi) che vengono introdotte nell organismo, devono subire delle profonde modificazioni che le trasformano in sostanze
La digestione degli alimenti Le sostanze alimentari complesse (lipidi, glucidi, protidi) che vengono introdotte nell organismo, devono subire delle profonde modificazioni che le trasformano in sostanze
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Economia Applicata ai sistemi produttivi. 06.05.05 Lezione II Maria Luisa Venuta 1
 Economia Applicata ai sistemi produttivi 06.05.05 Lezione II Maria Luisa Venuta 1 Schema della lezione di oggi Argomento della lezione: il comportamento del consumatore. Gli economisti assumono che il
Economia Applicata ai sistemi produttivi 06.05.05 Lezione II Maria Luisa Venuta 1 Schema della lezione di oggi Argomento della lezione: il comportamento del consumatore. Gli economisti assumono che il
TRASPORTO: qualunque tipo di passaggio di sostanze attraverso la membrana cellulare.
 Membrana citoplasmatica èsedediscambiodi materia, energia e informazione con l ambiente esterno TRASPORTO: qualunque tipo di passaggio di sostanze attraverso la membrana cellulare. Scaricato da www.sunhope.it
Membrana citoplasmatica èsedediscambiodi materia, energia e informazione con l ambiente esterno TRASPORTO: qualunque tipo di passaggio di sostanze attraverso la membrana cellulare. Scaricato da www.sunhope.it
Domande a scelta multipla 1
 Domande a scelta multipla Domande a scelta multipla 1 Rispondete alle domande seguenti, scegliendo tra le alternative proposte. Cercate di consultare i suggerimenti solo in caso di difficoltà. Dopo l elenco
Domande a scelta multipla Domande a scelta multipla 1 Rispondete alle domande seguenti, scegliendo tra le alternative proposte. Cercate di consultare i suggerimenti solo in caso di difficoltà. Dopo l elenco
Il Sistema Respiratorio. Fisica Medica
 Il Sistema Respiratorio La respirazione Trachea Bronchi Muscoli del diaframma I muscoli che controllano la respirazione fanno variare volume e pressione interna ai polmoni Fase Inspirazione Espirazione
Il Sistema Respiratorio La respirazione Trachea Bronchi Muscoli del diaframma I muscoli che controllano la respirazione fanno variare volume e pressione interna ai polmoni Fase Inspirazione Espirazione
Paratiroidi e regolazione del calcio e fosforo Regolazione calcio fosforo
 Paratiroidi e regolazione del calcio e fosforo Regolazione calcio fosforo La regolazione dei livelli plasmatici di calcio è un evento critico per una normale funzione cellulare, per la trasmissione nervosa,
Paratiroidi e regolazione del calcio e fosforo Regolazione calcio fosforo La regolazione dei livelli plasmatici di calcio è un evento critico per una normale funzione cellulare, per la trasmissione nervosa,
Cause di malattia Genetiche:
 omeostasi Cause di malattia Genetiche: relativamente poche e derivano da alterazioni a carico di uno o più geni. Esempio: sindrome di Down (dovuta a trisomia del cromosoma 21); sindrome di Turner (dovuta
omeostasi Cause di malattia Genetiche: relativamente poche e derivano da alterazioni a carico di uno o più geni. Esempio: sindrome di Down (dovuta a trisomia del cromosoma 21); sindrome di Turner (dovuta
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE
 LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
Appunti di istologia EPITELI GHIANDLARI. STUDENTI X L'UNIVERSITA' Testi e immagini raccolte da Roberta F. www.studxwebmedicina.altervista.
 Appunti di istologia EPITELI GHIANDLARI STUDENTI X L'UNIVERSITA' Testi e immagini raccolte da Roberta F. www.studxwebmedicina.altervista.org Ghiandole Cellule singole o organi specializzati nella produzione
Appunti di istologia EPITELI GHIANDLARI STUDENTI X L'UNIVERSITA' Testi e immagini raccolte da Roberta F. www.studxwebmedicina.altervista.org Ghiandole Cellule singole o organi specializzati nella produzione
www.fondazionedamico.org
 www.fondazionedamico.org COSA SONO Sono due organi situati nell addome, a forma di fagiolo, grandi poco più di un pugno, collegati alla vescica da un condotto chiamato uretere. L urina prodotta dai due
www.fondazionedamico.org COSA SONO Sono due organi situati nell addome, a forma di fagiolo, grandi poco più di un pugno, collegati alla vescica da un condotto chiamato uretere. L urina prodotta dai due
Farmaci del sistema nervoso autonomo
 Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
Si possono suddividere in:
 Si possono suddividere in: LIPIDI DI DEPOSITO: si accumulano nelle cellule del tessuto adiposo, sono una riserva energetica, mantengono costante la temperatura del corpo (termogenesi) LIPIDI STRUTTURALI:
Si possono suddividere in: LIPIDI DI DEPOSITO: si accumulano nelle cellule del tessuto adiposo, sono una riserva energetica, mantengono costante la temperatura del corpo (termogenesi) LIPIDI STRUTTURALI:
http://sds.coniliguria.it 1
 Aspetti metabolici dell esercizio fisico Genova 22 gennaio 2011 A cura di Attilio TRAVERSO http://sds.coniliguria.it 1 L allenamento produce modificazioni fisiologiche (adattamenti) in quasi tutti i sistemi
Aspetti metabolici dell esercizio fisico Genova 22 gennaio 2011 A cura di Attilio TRAVERSO http://sds.coniliguria.it 1 L allenamento produce modificazioni fisiologiche (adattamenti) in quasi tutti i sistemi
Le proteine. Le proteine sono i mattoncini che costituiscono gli organismi viventi.
 Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
Capitolo 26. Stabilizzare l economia: il ruolo della banca centrale. Principi di economia (seconda edizione) Robert H. Frank, Ben S.
 Capitolo 26 Stabilizzare l economia: il ruolo della banca centrale In questa lezione Banca centrale Europea (BCE) e tassi di interesse: M D e sue determinanti; M S ed equilibrio del mercato monetario;
Capitolo 26 Stabilizzare l economia: il ruolo della banca centrale In questa lezione Banca centrale Europea (BCE) e tassi di interesse: M D e sue determinanti; M S ed equilibrio del mercato monetario;
