Specialità: Avastin (Roche spa)
|
|
|
- Severina Castellani
- 8 anni fa
- Visualizzazioni
Transcript
1 BEVACIZUMAB per l'indicazione: trattamento di pazienti con carcinoma metastatico del colon e del retto in combinazione con chemioterapia a base di fluoropirimidine. ( ) Specialità: Avastin (Roche spa) Forma farmaceutica: 1 flaconcino, soluzione per infusione 400mg in 16ml - Prezzo: euro flaconcino, soluzione per infusione 100mg in 4ml - Prezzo: euro 504 ATC: L01XC07 Categoria terapeutica: Citostatici: anticorpi monoclonali Fascia di rimborsabilità: H OSP-1 Indicazioni ministeriali: Avastin (Bevacizumab) in combinazione con chemioterapia a base di fluoropirimidine è indicato per il trattamento di pazienti con carcinoma metastatico del colon e del retto. Avastin in combinazione con paclitaxel è indicato per il trattamento in prima linea di pazienti con carcinoma mammario metastatico. Avastin, in aggiunta a chemioterapia a base di platino, è indicato per il trattamento in prima linea di pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in ricaduta, con istologia a predominanza non squamocellulare. Avastin in combinazione con interferone alfa-2a è indicato per il trattamento in prima linea di pazienti con carcinoma renale avanzato e/o metastatico. Decisioni PTORV Data riunione: Decisione: Allargamento indicazioni Commenti: La Commissione decide di autorizzare il trattamento in II linea perché i dati dimostrano un aumento della sopravvivenza sia complessiva che libera da progressione, mentre nella I linea i dati sono meno solidi in quanto l unica differenza significativa si è osservata sulla sopravvivenza libera da progressione, risultata poco più di un mese. Ritiene, pertanto, di non autorizzare tale allargamento. Caratteristiche del prodotto Bevacizumab è un anticorpo monoclonale ricombinante umanizzato, registrato con procedura centralizzata a livello europeo. E' inibitore dell angioneogenesi e agisce legando il fattore di crescita vascolare endoteliale (VEGF), impedendo così l interazione di questo ai recettori VEGF- 1 e VEGF-2 presenti sulle cellule endoteliali. L espressione del recettore VERG è molto bassa nei tessuti normali, mentre risulta importante in molti tumori incluso quello del colon-retto, mammella, polmone, rene. L azione di bevacizumab di neutralizzazione del VEGF si traduce in una relativamente specifica inibizione dell angiogenesi a livello tumorale e quindi della crescita e sviluppo tumorali[1]. Inquadramento della patologia Il carcinoma del colon retto rappresenta uno dei tumori solidi più frequenti nel mondo: nei paesi sviluppati circa una persona su venti è affetta da tale patologia, con circa nuovi casi/l anno e decessi/anno. L intervento chirurgico rappresenta la prima linea di trattamento nel 75% dei casi ed offre le maggiori possibilità di cura. Tuttavia, anche quando la resezione chirurgica viene considerata curativa, il tasso di sopravvivenza a 5 anni è solo del 50%. Purtroppo, circa il 30% dei pazienti si presenta, alla prima diagnosi, già con malattia in fase metastatica. La prognosi è limitata: il tasso di sopravvivenza a 5 anni, per i pazienti con malattia in stadio avanzato, è del 5% circa (78 % nei pazienti allo stadio II e 54% nei pazienti alla stadio III) [1,2].
2 Trattamenti alternativi Cetuximab, farmaco registrato, in combinazione con irinotecan, per il trattamento di pazienti con carcinoma metastatico del colon-retto esprimente il recettore per l epidermal growth factor (EGFR) dopo fallimento di terapia citotossica contenente irinotecan (seconda linea). Si segnala, tuttavia, che anche cetuximab è stato recentemente approvato dall EMEA (maggio 2008) in monoterapia per il trattamento del carcinoma colorettale metastatico dopo fallimento di regimi chemioterapici contenenti oxaliplatino e irinotecan o nei pazienti con intolleranza ad irinotecan, nel caso in cui i tumori presentino il gene KRAS wild-type. Gli schemi chemioterapici sono numerosi. Tra le alternative disponibili troviamo ad esempio gli schemi: FOLFOX, FOLFIRI, XELOX o altri schemi con oxaliplatino, capecitabina, irinotecan. Linee guida di trattamento esistenti Le recenti linee guida del National Comprehensive Cancer Network (2008) per il trattamento del carcinoma al colon metastatico e per il trattamento del carcinoma al retto metastatico raccomandano come trattamento di prima linea bevacizumab in associazione a diversi regimi chemioterapici [3]. In particolare, per i pazienti in grado di tollerare una terapia chemioterapica intensiva i trattamenti raccomandati come prima linea sono rappresentati da: - bevacizumab + capecitabina-oxaliplatino o bevacizumab + FOLFOX (entrambi grado di raccomandazione 2A). I pazienti che vanno incontro a progressione dopo questa terapia possono passare al trattamento con irinotecan oppure con un regime a base di FOLFIRI (entrambi grado di raccomandazione 2A) o con cetuximab + FOLFIRI (grado di raccomandazione 2B). I pazienti che vanno incontro ad una seconda progressione dopo trattamento con irinotecan o FOLFIRI possono passare al trattamento con cetuximab + irinotecan. Panitumumab è consentito come terza linea solo nei pazienti che non tollerano l associazione cetuximab+irinotecan. - bevacizumab + FOLFIRI (grado di raccomandazione 2A). I pazienti che vanno incontro a progressione dopo questa terapia possono passare al trattamento con capecitabina-oxaliplatino oppure con FOLFOX o con cetuximab + irinotecan (grado di raccomandazione 2A). I pazienti che vanno incontro ad una seconda progressione dopo trattamento con capecitabina-oxaliplatino o FOLFOX possono passare al trattamento con cetuximab + irinotecan. Panitumumab è consentito come seconda o terza linea solo nei pazienti che non tollerano l associazione cetuximab+irinotecan. - bevacizumab + 5 FU/leucovorin (grado di raccomandazione 2A). I pazienti che vanno incontro a progressione dopo questa terapia possono passare al trattamento con irinotecan oppure FOLFIRI oppure capecitabina-oxaliplatino oppure FOLFOX (grado di raccomandazione 2A). I pazienti che vanno incontro ad una seconda progressione dopo trattamento con irinotecan o FOLFIRI possono passare al trattamento con cetuximab + irinotecan; i pazienti che vanno incontro ad una seconda progressione dopo trattamento con capecitabina-oxaliplatino o FOLFOX possono passare al trattamento con irinotecan e quindi all associazione cetuximab + irinotecan. Anche in questo caso, panitumumab è consentito solo nei pazienti che non tollerano l associazione cetuximab+irinotecan. Dati di efficacia Il farmaco era già autorizzato all'uso in combinazione con 5-fluorouracile/acido folinico endovena o 5- fluorouracile/acido folinico/irinotecan endovena è indicato per il trattamento di prima linea dei pazienti con carcinoma del colon e del retto metastatico e a supporto di tale indicazione erano già stati pubblicati due studi di fase II e uno studio pivotal di fase III [4-6]. Tale indicazione viene oggi estesa anche a linee successive alla prima e a regimi di associazione che comprendano fluoropirimidine sulla base della pubblicazione di due grossi studi di fase III. Lo studio nei pazienti naive con malattia metastatica, era inizialmente stato sviluppato con disegno RCT a due bracci che doveva confrontare la non inferiorità tra regime standard FOLFOX-4 con il regime di combinazione capecitabina e oxaliplatino (XELOX). Dopo la pubblicazione dello studio pivotal con bevacizumab [6], però, tale protocollo è stato emendato trasformandolo in uno studio randomizzato, con disegno fattoriale 2x2 e con due obiettivi coprimari. Il primo obiettivo coprimario era quello di mostrare la non inferiorità nella progression free survival (PFS) del regime XELOX, con o senza bevacizumab vs FOLFOX-4 con o senza bevacizumab. Il secondo obiettivo coprimario era invece quello di valutare gli effetti sulla PFS del bevacizumab rispetto al placebo quando utilizzato in regime di associazione con chemioterapia a base oxaliplatino (XELOS o FOLFOX-4).La pubblicazione dei risultati è avvenuta in due pubblicazioni separate [7,8]. Per quanto riguarda la valutazione del primo obiettivo coprimario, è stata valutata la popolazione intention to treat costituita da 2034 pazienti: 634 provenienti dall'arruolamento nel protocollo originale sommati ai 1400 arruolati nello studio emendato con disegno fattoriale 2x2. Il PFS mediano è stato di 8 mesi nel braccio XELOX e 8,5 mesi nel braccio FOLFOX. Anche la sopravvivenza mediana non è risultata differente (19.8 vs 19.6 rispettivamente) [7].
3 Per quanto riguarda, invece, l'efficacia dell'aggiunta di bevacizumab ai due regimi contenenti oxaliplatino, la PFS mediana è risultata significativamente maggiore nel gruppo bevacizumab (p=0.0023) con una differenza però soltanto di 1,4 mesi, la sopravvivenza mediana non è risultata, invece, significativamente diversa tra i gruppi (p= 0.077). Anche le percentuali di risposta sono risultate simili tra i due gruppi. Lo studio relativo ai pazienti precedentemente trattati per carcinoma colon-retto metastatico con fluoropirimidine e irinotecan, ha invece valutato l'efficacia di bevacizumab associato a FOLFOX-4 vs FOLFOX-4 o bevacizumab in monoterapia. End-point primario era la sopravvivenza complessiva mediana che è risultata significativamente maggiore nel gruppo sperimentale rispetto a FOLFOX-4 (12.9 vs 10.8 mesi p=0.0011) e anche vs il solo bevacizumab (10.2 mesi). Anche la PFS mediana e la percentuale di risposta complessiva è risultata significativamente superiore per il regime bevacizumab + FOLFOX-4 vs FOLFOX-4 e vs bevacizumab da solo.
4 Referenza Pazienti e trattamento Disegno Fase Misure di esito Risultati principali Parte A: J Cassidy J Clin Oncol 2008 [7] Parte B: L.B. Saltz J Clin Oncol 2008 [8] B.J. Gianantonio J Clin Oncol 2007 [9] Numero pazienti totale: 2035 con carcinoma colon-rettale inoperabile metastatico, naive al trattamento per malattia metastatica così suddivisi: Prima emendamento: 634 pazienti. Trattamento: XELOX (oxaliplatino IV 130mg/m 2 nel giorno 1 + capecitabina orale 1,000mg/m 2 due volte al gg per 2 settimane in cicli di 3 settimane) [N=317]; FOLFOX-4( oxaliplatino IV 85 mg/m 2 nel giorno 1; leucovorin 200 mg/m 2 nei giorni 1 and 2 in infusione per 2 ore, fluorouracile 400mg/m 2 come iniezione nel bolo nei giorni 1 e 2, seguito da fluorouracile in infusione 600 mg/m 2 per due giorni consecutivi ogni 2 settimane) [N=317]. Dopo emendamento: 1401 pazienti. Trattamento: XELOX + placebo [N=350]; XELOX+ Bevacizumab IV 7.5mg/kg ogni 3 settimane IV [N=350]; FOLFOX-4 + placebo [N=351]; FOLFOX-4 + Bevacizumab IV 5m/kg ogni 2 settimane [N=350]. Durata trattamento: fino a progressione o per 48 settimane Numero pazienti: 829 con carcinoma colon-retto metastatico precedentemente trattati con fluoropirimidine e irinotecan Trattamenti: bevacizumab (10 mg/kg giorno 1 infusione in min )+ FOLFOX-4 ( oxaliplatino IV 85 mg/m 2 nel giorno 1; leucovorin 200 mg/m 2 nei giorni 1 and 2 in infusione per 2 ore, fluorouracile 400mg/m 2 come iniezione nel bolo nei giorni 1 e 2, seguito da fluorouracile in infusione 600 mg/m 2 per due giorni consecutivi ogni 2 settimane) vs FOLFOX-4 vs Bevacizumab (10 mg/kg giorno 1 infusione in min) Randomizzato, multicentrico, 2X2 fattoriale, doppio cieco, di confronto regimi: XELOX+bevacizumab, XELOX+placebo, FOLFOX-4+bevacizumab, FOLFOX-4+placebo Randomizzato, controllato, multicentrico, in aperto III III Parte A End-point coprimario: dimostrare la non inferiorità del trattamento XELOX rispetto al trattamento FOLFOX-4 relativamente PFS. Parte B End-point coprimario:dimostrare la superiorità di bevacizumab (associato ad un regime contenente oxaliplatino) rispetto a placebo relativamente al PFS. End-point primario:sopravvivenza globale mediana Secondari: PFS mediana e % risposta complessiva Parte A: n= 2034 PFS mediana: 8 mesi XELOX vs 8.5 mesi FOLFOX-4; sopravvivenza complessiva mediana: 19.8 XELOX vs 19.6 FOFOX-4 FOLFOX-4 maggiore neutropenia, granulocitopenia e neutropenia febbrile grado 3/4; XELOX maggiore diarrea e eritrodisestesia palmo-plantare di grado 3 Parte B: n= 1401 PFS mediana: 9.4 mesi Bevacizumab vs 8 mesi placebo p=0.0023; sopravvivenza complessiva mediana 21.3 mesi bevacizumab vs 19.9 mesi placebo p=0.077; percentuali di risposta simili nei due gruppi. Soltanto il 29% pz bevacizumab e 47% pz placebo sono stati trattati fino a progressione Sopravvivenza mediana globale: 12.9 mesi bevacizumab+folfox-4 vs 10.8 mesi FOLFOX-4 (p=0.0011) vs 10.2 mesi bevacizumab; PFS mediana: 7.3 mesi bevacizumab+folfox-4 vs 4.7 mesi FOLFOX-4 (p<0.0001) vs 2.7 mesi bevacizumab; RC complessiva: 22.7%bevacizumab+FOLFOX-4 vs 8.6% FOLFOX-4 (p<0.0001) vs 3.3%bevacizumab. L'uso di bevacizumab è stato associato a ipertensione, vomito, sanguinamento. Jadad score * Parte A:3 Parte B: 5 *Jadad Scale: strumento per la verifica della qualità della pubblicazione; tra si basa sulla considerazione che i tre elementi principali che devono essere riportati per avere maggiori garanzie sulla buona qualità di uno studio clinico siano la randomizzazione, la condizione di doppia cecità, e la gestione dei drop-out. Si considerano buone le pubblicazioni che ottengono almeno 3 punti, mentre si considerano di scarsa qualità quelle che raggiungono un punteggio uguale o inferiore a due.
5 Valutazione della qualità degli studi La differenza che si osserva nella valutazione della qualità dello studio nei pazienti naive tra parte A e parte B è correlata al fatto che la parte A di confronto tra regime XELOX e regime FOLFOX è in aperto mentre il confronto della parte B tra bevacizumab e placebo è in doppio cieco. Dati di sicurezza Il profilo di tossicità osservato per bevacizumab in combinazione con terapie contenenti oxaliplatino / fluoropirimidine è confrontabile a quello osservato in precedenti studi di fase II e III in combinazione con regimi a base di 5 FU (5 FU/LV e IFL). La maggior parte degli eventi avversi sono descritti nei pazienti che ricevono chemioterapia ad es. costipazione, diarrea, artralgia, alopecia, rash, stanchezza/astenia, nausea e vomito. Si sono verificati più frequentemente nel gruppo bevacizumab eventi avversi che sono strettamente correlati al farmaco (similmente ad altri studi con bevacizumab): maggiore incidenza di sanguinamento, ipertensione, epistassi, mal di testa e proteinuria. Gli eventi avversi più gravi (grado 3/4) che si sono verificati negli studi principali con maggiore incidenza nei gruppi trattati con bevacizumab sono stati: problemi gastrointestinali, problemi vascolari, vomito, sindrome "mano-piede", problemi cardiaci ed embolia polmonare, ipertensione, sanguinamenti (grado 3-5) e perforazioni gastrointestinali (grado 3-5), eventi tromboembolici venosi (grado 3-5) [1, 7, 8, 9]. Indicazione studi in corso Numerosi sono gli studi in corso già in fase III che stanno valutando l'efficacia di bevacizumab aggiunto a diversi schemi di trattamento per il carcinoma metastatico [15,16]. Sono anche in corso alcuni studi nella fase più precoce della malattia, i cui risultati, se favorevoli potrebbero portare ad allargare ulteriormente le indicazioni. Gli studi sono descritti in tabella.
6 Registro / Nazione clinicaltrials.gov clinicaltrials.gov clinicaltrials.gov Pazienti e trattamento Disegno Fase Pz sottoposti a intervento chirurgico per cancro del colonretto di stadio II o III [N=3450] I pz sono stati randomizzati a ricevere: - bevacizumab + Xelox (capecitabina + oxaliplatino) o Folfox-4 (Oxaliplatino + Leucovorin + Fluorouracile) nella terapia adiuvante -Folfox-4(Oxaliplatino + Leucovorin + Fluorouracile) nella terapia adiuvante Pz sottoposti a intervento chirurgico per cancro del colonretto di stadio II o III [N=238] I pz sono stati randomizzati a ricevere: -terapia adiuvante convenzionale: leucovorin + fluorouracile + oxaliplatino - bevacizumab + leucovorin + fluorouracile + oxaliplatino Pz sottoposti a intervento chirurgico per cancro del colonretto di stadio II o III [N=2100] I pz sono stati randomizzati a ricevere: - oxaliplatino + leucovorin + fluorouracile - bevacizumab + leucovorin + oxaliplatino + fluorouracile RCT RCT con controllo attivo RCT III III III Misure di esito primarie sopravvivenza libera da malattia DFS (sopravvivenza libera da malattia) OS (sopravvivenza globale) Note Attivato, non in reclutamento Attivato, non in reclutamento In reclutamento
7 Altri report HTA E' disponibile per l'indicazione oggetto di valutazione il report dello Scottish Medicines Consortium (SMC) che non ne raccomanda l'uso a carico del SS Scozzese. Infatti, sebbene da un degli studi condotti sia stato evidenziato un piccolo vantaggio di bevacizumab + chemioterapia standard vs chemioterapia standard in termini di efficacia, lo SMC non ha considerato sufficientemente solida l'analisi economica presentata dalla ditta produttrice. Relativamente all'analisi costo utilità presentata dalla ditta che ha confrontato Bevacizumab + CAPOX (capecitabina + oxaliplatino) vs FOLFOX4, con un orizzonte temporale di tutta la vita. Il costo per QALY guadagnato stimato è stato di Pur avendo lo studio principale analizzato anche BFOLFOX4 vs FOLFOX4 la ditta non ha effettuato l'analisi costo utilità in confronto a queste alternative, perché un'analisi economica preliminare ha mostrato che non risultava costo-efficace. Le problematiche sollevate dallo Scottish Medicines Consortium sono legate al fatto che il trattamento standard è principalmente rappresentato da CAPOX e non da FOLFOX4 e pertanto un confronto Bevacizumab + CAPOX vs CAPOX sarebbe stato maggiormente adeguato (10). Per quanto riguarda la popolazione target il report riporta che tutti i pazienti inclusi nello studio pivotal erano relativamente giovani e presentavano un performance status ECOG inferiore o uguale a 1. Il registro tumori scozzese riportava il 73% della popolazione con carcinoma del colon-retto di almeno 65 anni e il 59% oltre i 70. Pertanto i benefici osservati nello studio potrebbero essere differenti a quelli osservati nella popolazione scozzese elegibile per il trattamento. Il NICE ha pubblicato all'inizio del 2007 una valutazione relativa a bevacizumab e cetuximab nel trattamento del colon-retto metastatico. Il NICE non raccomanda l'uso di bevacizumab in combinazione a 5FU/LV con o senza irinotecan (indicazione già precedentemente autorizzata) nel trattamento di prima linea del carcinoma colonrettale metastatico (11). E' inoltre disponibile il report di HTA prodotto dall'hta Programme del National Institute for Health Research inglese che riporta una revisione sistematica e una analisi economica dell'uso di bevacizumab e cetuximab per il trattamento del carcinoma del colon-retto metastatico. L'analisi relativa a bevacizumab è stata anche pubblicata dallo stesso autore e viene dettagliatamente descritta nella sezione relativa agli studi di farmacoeconomia (12). Analisi economiche Sono ad oggi pubblicate tre analisi costo efficacia, una che ha valutato l'impatto del farmaco in Inghilterra e in Galles, una riportata nel report dello Scottish Medicines Consortium (già riportata nella sezione altri report HTA) e una relativa all'ambito extraeuropeo, il Giappone. Lo studio inglese è andato a valutare il costo per QALY guadagnato relativo all'aggiunta di bevacizumab alla chemioterapia in pazienti con carcinoma del colonretto metastatici mai trattati. I trattamenti di confronto erano rappresentati dalla sola chemioterapia (irinotecan + FU/LV oppure il solo 5 FU/LV). Il modello utilizzato assumeva che i costi e la qualità della vita fossero dipendenti soprattutto dalla presenza o assenza di progressione della malattia. Il modello prevedeva tre stati di salute: vivo senza progressione della malattia; vivo con progressione della malattia, morto. I pazienti entravano nel modello al punto in cui erano eleggibili per il trattamento con bevacizumab (vivi senza progressione della malattia) e venivano trattati con uno dei regimi terapeutici fino a che successivamente presentavano progressione della malattia. Il modello assumeva che dopo progressione documentata i pazienti entrassero nella fase di post-progressione, in cui una percentuale di pazienti si assumeva ricevessero oxaliplatino + 5 FU/LV come trattamento di II linea e una piccola percentuale di pazienti successivamente si assumeva ricevessero mitomicina C associato a 5FU/LV in trattamento prolungato come III linea. Successivamente si assumeva che il paziente ricevesse la miglior terapia di supporto fino alla morte (13). Come evidenziato in tabella, i rapporti costo-efficacia e costo-utilità incrementali sono molto elevati, e non sono favorevoli al rimborso di bevacizumab da parte del servizio sanitario inglese. Questo risultato e' dovuto principalmente all'alto costo di acquisizione di bevacizumab in relazione al piccolo beneficio clinico. Lo studio riporta il costo a mg di bevacizumab usato nello studio che è molto simile al costo per mg in Italia (2,84 Inghilterra, al cambio con la sterlina, vs 3,06 in Italia). Lo studio giapponese, (14), che aveva anch'esso come punto di vista quello del Servizio Sanitario, ha effettuato l'analisi di efficacia per anno di vita guadagnato e non per QALY: tale scelta viene giustificata dagli autori in quanto la misura del QALY sarebbe stata effettuata utilizzando valori di utilità non misurati in Giappone. I valori di LYG sono risultati sovrapponibili a quelli dello studio di Tappenden (13). Il costo incrementale dell'aggiunta di bevacizumab ai diversi regimi di chemioterapia vs i rispettivi regimi è risultato elevatissimo, circa $ o superiore ad eccezione dell'associazione con capecitabina/oxaliplatino che comunque è risultata costare $ per LYG; l'analisi di sensitività ha mostrato che il costo incrementale non era sensibile ai costi della terapia palliativa. A conferma del risultato dello studio inglese, anche nello studio Giapponese il trattamento con bevacizumab non e' risultato costo efficace. Oltre alla considerazione sull'elevato costo del farmaco in relazione al piccolo beneficio clinico, i due studi di farmacoeconomica descritti offrono lo spunto per le seguenti considerazioni: - gli studi di efficacia, da cui sono estrapolati i dati per il calcolo degli anni di vita guadagnati, non sono condotti in popolazioni rappresentative delle popolazioni colpite da carcinoma del colon retto metastatico (pazienti più giovani e con un più favorevole performance status). Sono necessari ulteriori dati su
8 popolazioni con diverse caratteristiche per poter condurre una analisi farmacoeconomica trasferibile alla pratica clinica - non sono disponibili stime di qualità della vita correlate all'uso di bevacizumab: le stime utilizzate nello studio inglese sono stime indirette di utilità di pazienti colpiti da carcinoma metastatico del colon retto nei diversi stati di malattia - per condurre una analisi farmacoeconomica affidabile nel contesto descritto, sono necessari dati reali sul reale consumo di risorse legato all'uso di bevacizumab.
9 Referenza Tappenden, Eur J Cancer 2007 (13) Shiroiwa, Clin Ter 2007 (14) Metodologia/tipo di analisi Analisi costo efficacia e costo utilità Analisi costo efficacia (modello di regressione Weibull) Confronti aggiunta di bevacizumab ai seguenti due regimi chemioterapici: irinotecan + FU/LV (IFL) oppure 5-FU/LV da solo aggiunta di bevacizumab a diversi regimi di chemioterapia vs regimi chemioterapia regimi I linea: IFL, FU/LV, FOLFOX6, bfol (bolo FU/LV/Oxaliplatino), CAPOX (capecitabina/oxaliplatino); regime di II linea: FOLFOX4 Nazione/Punto di vista Inghilterra e Galles/ SSN Giappone/SSN Pazienti/time horizon pazienti non precedentement e trattati per carcinoma rettale metastatico Lifetime carcinoma colonretto metastatico Misura di costo costi diretti sanitari: acquisizione dei farmaci, somministrazione, trattamento degli effetti collaterali, test diagnostici ed imaging, visite specialistiche, ospedalizzazione, costi della miglior terapia di supporto; costi medici diretti costo del farmaco, terapie di supporto, visite di controllo, diagnostica per immagini e analisi di laboratorio, pompa di infusione, costo farmacia Risultati aggiunta di bevacizumab a IFL per QALY guadagnato ( LYG); aggiunta di bevacizumab a 5FU/LV per QALY guadagnato ( LYG). I linea: aggiunta bevacizumab comporta un ICER per LYG: $ IFL; $ FU/LV; $ FOLFOX6; $ b FOL; $ CAPOX II linea: aggiunta bevacizumab comporta un ICER per LYG:$ FOLFOX4
10 Analisi dei costi (costi delle alternative, potenziale impatto di budget etc.) Principio attivo Dosaggio Costo all'ospedale per ciclo di terapia (senza risk sharing) Spreco di farmaco per ciclo di terapia Costo all'ospedale per anno di terapia Note BEVACIZUMAB 15mg/kg ogni 3 settimane (2 fl da 400mg e 3 fl da 100mg) 3.366,38 (CICLO DI 3 SETTIMANE) 50mg= 152, il costo all'anno è stato valutato secondo la seguente modalità di rimborso fornita dalla ditta: primi 2 cicli di terapia: risk sharing al 50% cicli dal 3 al 10 a carico dell'ssn i cicli successivi a carico della ditta produttrice il costo all'anno è stato valutato secondo la seguente modalità di rimborso fornita dalla ditta: BEVACIZUMAB 10mg/kg ogni 2 settimane (1fl da 400mg e 3 fl da 100mg) 2.141,83 (CICLO DI 2 SETTIMANE) primi 3 cicli di terapia: risk sharing al 50% cicli dal 4 al 14 a carico dell'ssn i cicli successivi a carico della ditta produttrice BEVACIZUMAB 7,5mg/kg ogni 3 settimane (1 fl da 400mg e 2 fl da 100mg) 1.836,07 (CICLO DI 3 SETTIMANE) 75 mg 229, il costo all'anno tiene conto che i primi due cicli di terapia (prime 6 settimane di terapia) prevedono il risk sharing al 50% BEVACIZUMAB 5mg/kg ogni 2 settimane (1 fl da 400mg) 1.224,55 (CICLO DI 2 SETTIMANE) 50mg il costo all'anno tiene conto che i primi tre cicli di terapia (prime 6 settimane di terapia) prevedono il risk sharing al 50% 152,88 prezzi forniti da ditta produttrice Bevacizumab a basso dosaggio non va impiegato in monoterapia e può essere associato ad uno dei seguenti schemi: Xelox, Folofox-4, Folfiri-b Bevacizumab ad alto dosaggio va impiegato nella terapia di mantenimento dopo il trattamento in associazione e nel caso di associazione con 5FU e Leucovorin (costo per ciclo: 120,00) o con Capecitabina (costo per ciclo: 285,00) Prezzi di alcuni degli schemi chemioterapici usati come alternative terapeutiche
11 Principio attivo Dosaggio Costo all'ospedale per ciclo di terapia Spreco di farmaco per ciclo di terapia Costo all'ospedale per anno di terapia Note XELOX: ciclo di 3 settimane. CAPECITABINA* 1000mg/m 2 2 volte al giorno per 2 settimane (3 cpr da 500 mg e 2 cpr da 150mg per ogni somministrazione) OXALIPLATINO : 130mg/m 2 IV nel giorno 1(2 fl da 100mg e 1 fl da 50 mg) 1.166,81 oxaliplatino:16mg 59, LEUCOVORIN 200mg/m 2 nei giorni 1 e 2 (2 fl da 175mg al giorno) FOLFOX-4: ciclo di 2 settimane 5-FLUOROURACILE 400mg/m 2 come iniezione nel bolo (1 fl da 1000mg al giorno) e 600mg/m 2 in infusione (1 fl da 1000mg e 1 fl da 500mg al giorno) nei giorni 1 e 2 OXALIPLATINO 85mg/m 2 IV nel giorno 1 (1fl da 100mg e 1 fl da 50mg) fluorouracile:1400 mg 3, ,78 IRINOTECAN + CETUXIMAB cicli di 2 settimane IRINOTECAN : 180mg/m 2 in cicli da 2 settimane CETUXIMAB*: prima dose 400mg/m 2, dosi successive 250 mg/m 2 in cicli di una settimana 2.394,52( PER 1 CICLO) 2.035,32(PER CICLI SUCCESSIVI) IRINOTECAN:16mg CETUXIMAB:nei cicli successivi al 1 vengono sprecati 50mg di farmaco ,18 IRINOTECAN : 180mg/m 2 in cicli da 2 settimane FOLFIRI-B ciclo da 2 settimane LEUCOVORIN 200mg/m 2 nei giorni 1 e 2 (2 fl da 175mg al giorno) 5-FLUOROURACILE 400mg/m 2 come iniezione nel bolo (1 fl da 1000mg al giorno) e 600mg/m 2 in infusione nei giorni 1 e 2 (1 fl da 1000mg e 1 fl da 500mg al giorno) * prezzi ex factory forniti da ditta produttrice prezzi al 50% iva esclusa da banca dati Farmadati ,98 5-fluorouracile:1400 mg 3, ,48
12 Bibliografia 1) Scientific Discussion EMEA Avastin n. EMEA/H/C/000582/II/0014 2) Bonadonna et al " MEDICINA ONCOLOGICA" VII Edizione - Masson Editore 3) Linee Guida NCCN v (accesso 13/08/2008) 4) Kabbinavar F. et al, J Clin Oncol 2003; 21(1): ) Kabbinavar F. et al, J Clin Oncol 2005; 23(16): ) Hurwitz H. et al, N Engl J Med 2004; 350(23): ) Cassidy J. et al, J Clin Oncol 2008; 26: ) Salz L.B. et al, J Clin Oncol 2008; 26: ) Gianantonio B.J. et al, J Clin Oncol 2007: ) accesso il 13/08/ ) accesso 26/08/ ) accesso il 13/08/ ) Tappeneden P. et al, Eur J Cancer 2007; 43: ) Shiroiwa T. et al, Clin Ther 2007; 29 (10) ) (accesso 31/08/2008) 16) (accesso 31/08/2008) SINTESI Caratteristiche del prodotto Bevacizumab è un anticorpo monoclonale ricombinante umanizzato, registrato con procedura centralizzata a livello europeo. E' inibitore dell angioneogenesi e agisce legando il fattore di crescita vascolare endoteliale (VEGF), impedendo così l interazione di questo ai recettori VEGF- 1 e VEGF-2 presenti sulle cellule endoteliali. Inquadramento della patologia Il carcinoma del colon retto rappresenta uno dei tumori solidi più frequenti nel mondo: nei paesi sviluppati circa una persona su venti è affetta da tale patologia, con circa nuovi casi/l anno e decessi/anno. Purtroppo, circa il 30% dei pazienti si presenta, alla prima diagnosi, già con malattia in fase metastatica. La prognosi è limitata: il tasso di sopravvivenza a 5 anni, per i pazienti con malattia in stadio avanzato, è del 5% circa (78 % nei pazienti allo stadio II e 54% nei pazienti alla stadio III). Trattamenti alternativi Gli schemi chemioterapici per il trattamento del carcinoma colonretto metastatico sono numerosi. Tra le alternative disponibili troviamo ad esempio gli schemi: FOLFOX, FOLFIRI, XELOX o altri schemi con oxaliplatino, capecitabina, irinotecan. Cetuximab è registrato, in combinazione con irinotecan, per il trattamento di pazienti con carcinoma metastatico del colon-retto esprimente il recettore per l epidermal growth factor (EGFR) dopo fallimento di terapia citotossica contenente irinotecan (seconda linea). Linee guida di trattamento esistenti Le recenti linee guida del National Comprehensive Cancer Network (2008) per il trattamento del carcinoma al colon metastatico e per il trattamento del carcinoma al retto metastatico raccomandano come trattamento di prima linea bevacizumab in associazione a diversi regimi chemioterapici: bevacizumab + capecitabina-oxaliplatino o bevacizumab + FOLFOX (entrambi grado di raccomandazione 2A); bevacizumab + FOLFIRI (grado di raccomandazione 2A); bevacizumab + 5 FU/leucovorin (grado di raccomandazione 2A). Dati di efficacia L'indicazione nel carcinoma colon-retto già autorizzata viene estesa anche a linee successive alla prima e a regimi di associazione che comprendano fluoropirimidine sulla base della pubblicazione di due grossi studi di fase III. Lo studio nei pazienti naive con malattia metastatica, era inizialmente stato sviluppato con disegno RCT a due bracci che doveva confrontare la non inferiorità tra regime standard FOLFOX-4 con il regime di combinazione capecitabina e oxaliplatino (XELOX). Dopo la pubblicazione dello studio e la registrazione del farmaco, però, tale protocollo è stato emendato trasformandolo in uno studio randomizzato, con disegno fattoriale 2x2 e con due obiettivi coprimari. Il primo obiettivo coprimario era quello di mostrare la non inferiorità nella progression free survival (PFS) del regime XELOX, con o senza bevacizumab vs FOLFOX-4 con o senza bevacizumab. Il secondo obiettivo coprimario era invece quello di valutare gli effetti sulla PFS del bevacizumab rispetto al placebo quando utilizzato in regime di associazione con chemioterapia a base oxaliplatino (XELOS o FOLFOX-4).La pubblicazione dei risultati è avvenuta in due pubblicazioni separate.
13 Per quanto riguarda la valutazione del primo obiettivo coprimario, è stata valutata la popolazione intention to treat costituita da 2034 pazienti: 634 provenienti dall'arruolamento nel protocollo originale sommati ai 1400 arruolati nello studio emendato con disegno fattoriale 2x2. Il PFS mediano e la sopravvivenza mediana non sono risultati differenti. Per quanto riguarda, invece, l'efficacia dell'aggiunta di bevacizumab ai due regimi contenenti oxaliplatino, la PFS mediana è risultata significativamente maggiore nel gruppo bevacizumab (p=0.0023) con una differenza però soltanto di 1,4 mesi, la sopravvivenza mediana non è risultata, invece, significativamente diversa tra i gruppi (p= 0.077). Anche le percentuali di risposta sono risultate simili tra i due gruppi. Lo studio relativo ai pazienti precedentemente trattati per carcinoma colon-retto metastatico con fluoropirimidine e irinotecan, ha invece valutato l'efficacia di bevacizumab associato a FOLFOX-4 vs FOLFOX-4 o bevacizumab in monoterapia. End-point primario era la sopravvivenza complessiva mediana che è risultata significativamente maggiore nel gruppo sperimentale rispetto a FOLFOX-4 (12.9 vs 10.8 mesi p=0.0011) e anche vs il solo bevacizumab (10.2 mesi). Anche la PFS mediana e la percentuale di risposta complessiva è risultata significativamente superiore per il regime bevacizumab + FOLFOX-4 vs FOLFOX-4 e vs bevacizumab da solo. Dati di sicurezza Il profilo di tossicità osservato per bevacizumab in combinazione con terapie contenenti oxaliplatino / fluoropirimidine è confrontabile a quello osservato in precedenti studi di fase II e III in combinazione con regimi a base di 5 FU (5 FU/LV e IFL). Nei gruppi trattati con bevacizumab si sono verificati eventi avversi, che sono correlati al farmaco, con frequenza maggiore rispetto ai controlli: incidenza di sanguinamento, ipertensione, epistassi, mal di testa e proteinuria. Gli eventi avversi più gravi (grado 3/4) che si sono verificati negli studi principali con maggiore incidenza nei gruppi trattati con bevacizumab sono stati: problemi gastrointestinali, problemi vascolari, vomito, sindrome "mano-piede", problemi cardiaci ed embolia polmonare, ipertensione, sanguinamenti (grado 3-5) e perforazioni gastrointestinali (grado 3-5), eventi tromboembolici venosi (grado 3-5). Altri report HTA E' disponibile per l'indicazione oggetto di valutazione il report dello Scottish Medicines Consortium (SMC) che non ne raccomanda l'uso a carico del SS Scozzese. Infatti, sebbene da uno degli studi condotti sia stato evidenziato un piccolo vantaggio di bevacizumab + chemioterapia standard vs chemioterapia standard in termini di efficacia, lo SMC non ha considerato sufficientemente solida l'analisi economica presentata dalla ditta produttrice (Bevacizumab+CAPOX vs FOLFOX4). Le problematiche sollevate dallo Scottish Medicines Consortium sono legate al fatto che il trattamento standard è principalmente rappresentato da CAPOX e non da FOLFOX4 e pertanto un confronto Bevacizumab+CAPOX vs CAPOX sarebbe stato maggiormente adeguato. Il NICE ha pubblicato all'inizio del 2007 una valutazione relativa a bevacizumab e cetuximab nel trattamento del colon-retto metastatico. Il report è però relativo all'indicazione del colon-retto già precedentemente registrata e non per il nuovo allargamento. Il NICE non raccomanda l'uso di bevacizumab in combinazione a 5FU/LV con o senza irinotecan nel trattamento di prima linea del carcinoma colonrettale metastatico. Analisi economiche Sono ad oggi pubblicate tre analisi costo efficacia, una che ha valutato l'impatto del farmaco in Inghilterra e in Galles, una riportata nel report dello Scottish Medicines Consortium (già riportata nella sezione altri report HTA) e una relativa all'ambito extraeuropeo, il Giappone. Lo studio inglese è andato a valutare il costo per QALY guadagnato relativo all'aggiunta di bevacizumab alla chemioterapia in pazienti con carcinoma del colonretto metastatici mai trattati. I trattamenti di confronto erano rappresentati dalla sola chemioterapia (irinotecan + FU/LV oppure il solo 5 FU/LV). I rapporti costo-efficacia e costo-utilita' incrementali sono molto elevati, e non sono favorevoli al rimborso di bevacizumab da parte del servizio sanitario inglese. Questo risultato e' dovuto principalmente all'alto costo di acquisizione di bevacizumab in relazione al piccolo beneficio clinico. Lo studio giapponese ha invece effettuato l'analisi di efficacia per anno di vita guadagnato e non per QALY. Il costo incrementale dell'aggiunta di bevacizumab ai diversi regimi di chemioterapia vs i rispettivi regimi è risultato elevatissimo e pertanto non costo-efficace. Analisi dei costi (costi delle alternative, potenziale impatto di budget etc.) Il costo del trattamento per un anno è di circa cui va sommato il costo del trattamento standard. Per il farmaco l'aifa ha contrattato la seguente modalità di rimborso: cicli di 3 settimane: primi 2 cicli di terapia: risk sharing al 50% (solo per il primo anno), cicli dal 3 al 10 a carico dell'ssn,i cicli successivi a carico della ditta produttrice fino ad 1 anno di terapia (solo per il dosaggio più elevato); cicli di 2 settimane: primi 3 cicli di terapia: risk sharing al 50% (solo per il primo anno), cicli dal 4 al 14 a carico dell'ssn, i cicli successivi a carico della ditta produttrice fino ad 1 anno di terapia (solo per il dosaggio più elevato).
Specialità: Avastin(Roche spa)
 BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in ricaduta in aggiunta a chemioterapia a base
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in ricaduta in aggiunta a chemioterapia a base
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel.
 BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel. (09-09-2008) Specialità: Avastin(Roche spa) Forma farmaceutica:
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel. (09-09-2008) Specialità: Avastin(Roche spa) Forma farmaceutica:
SCHEDA FARMACO. Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto. Carmelo Lupo
 Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto Carmelo Lupo RAS-RAF signaling Activation of the RAS-RAF signaling cascade occurs via the following sequential steps 1 : Activation
Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto Carmelo Lupo RAS-RAF signaling Activation of the RAS-RAF signaling cascade occurs via the following sequential steps 1 : Activation
Specialità: Avastin(Roche spa)
 BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma renale avanzato e/o metastatico in combinazione con interferone alfa-2a. (09-09-2008) Specialità: Avastin(Roche spa)
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma renale avanzato e/o metastatico in combinazione con interferone alfa-2a. (09-09-2008) Specialità: Avastin(Roche spa)
LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO
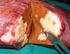 LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO Cetuximab può ridurre la massa tumorale per permettere la resezione delle metastasi, anche, in pazienti inizialmente non resecabili,
LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO Cetuximab può ridurre la massa tumorale per permettere la resezione delle metastasi, anche, in pazienti inizialmente non resecabili,
Forma farmaceutica: 1 flaconcino da 50 ml, soluzione per infusione 2 mg/ml - Prezzo: euro 312.01
 CETUXIMAB per l'indicazione: trattamento di pazienti affetti da carcinoma metastatico del colon-retto con espressione del recettore per EGF e con gene KRAS non mutato (27-10-2009) Specialità: ERBITUX (Merck
CETUXIMAB per l'indicazione: trattamento di pazienti affetti da carcinoma metastatico del colon-retto con espressione del recettore per EGF e con gene KRAS non mutato (27-10-2009) Specialità: ERBITUX (Merck
Terapia in fase Avanzata
 IL CARCINOMA DEL COLON-RETTO 14 OTTOBRE 2011, ROMA Terapia in fase Avanzata Maria Sofia Rosati Oncologia A Policlinico Umberto I Roma Numeri.. e persone!! ***Solo il 56% *50% dei pz con CRC è over 70 degli
IL CARCINOMA DEL COLON-RETTO 14 OTTOBRE 2011, ROMA Terapia in fase Avanzata Maria Sofia Rosati Oncologia A Policlinico Umberto I Roma Numeri.. e persone!! ***Solo il 56% *50% dei pz con CRC è over 70 degli
16th World Conference on Lung Cancer (WCLC): highlights
 16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
Tumore del colon-retto metastatico
 Raccomandazioni d'uso Tumore del colon-retto metastatico Parte A: Bevacizumab A cura del Gruppo Regionale Farmaci Oncologici (GReFO) per l'elaborazione di raccomandazioni evidence based Direzione Generale
Raccomandazioni d'uso Tumore del colon-retto metastatico Parte A: Bevacizumab A cura del Gruppo Regionale Farmaci Oncologici (GReFO) per l'elaborazione di raccomandazioni evidence based Direzione Generale
NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE CONSIDERATO ETICO
 COME E QUANDO GLI ASPETTI TECNICI DEI PROTOCOLLI POSSONO-DEVONO ESSERE OGGETTO-ARGOMENTO DI DECISIONI ETICHE? Fausto Roila Oncologia Medica, Terni NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE
COME E QUANDO GLI ASPETTI TECNICI DEI PROTOCOLLI POSSONO-DEVONO ESSERE OGGETTO-ARGOMENTO DI DECISIONI ETICHE? Fausto Roila Oncologia Medica, Terni NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE
Documento PTR n.212 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Informazioni per potenziali partecipanti. Possiamo sciogliere l'amiloidosi AL?
 Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Espressione di geni specifici per un determinato tumore
 Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO
 1/7 MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO Nome Commerciale Avastin Principio Attivo Bevacizumab Ditta Produttrice Roche ATC L01XC07 Formulazione Concentrato per soluzione
1/7 MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO Nome Commerciale Avastin Principio Attivo Bevacizumab Ditta Produttrice Roche ATC L01XC07 Formulazione Concentrato per soluzione
LINEE GUIDA ROL - COLON. Stadio I
 Adenoma con displasia alto grado o severa Escissione locale LINEE GUIDA ROL - COLON segmentaria per lesioni non suscettibili di escissione locale Sostituisce carcinoma in situ o adenoma intramucoso. Stadio
Adenoma con displasia alto grado o severa Escissione locale LINEE GUIDA ROL - COLON segmentaria per lesioni non suscettibili di escissione locale Sostituisce carcinoma in situ o adenoma intramucoso. Stadio
Specialità: Herceptin (Roche spa) Forma farmaceutica:
 TRASTUZUMAB per l'indicazione: in associazione ad un inibitore dell aromatasi nel trattamento di pazienti in postmenopausa affetti da carcinoma mammario metastatico positivo per i recettori ormonali, non
TRASTUZUMAB per l'indicazione: in associazione ad un inibitore dell aromatasi nel trattamento di pazienti in postmenopausa affetti da carcinoma mammario metastatico positivo per i recettori ormonali, non
SEBASTIANO FILETTI. Dipartimento di Medicina Interna e Specialità Mediche. Università di Roma Sapienza, Roma
 SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
Anticorpi monoclonali Anti-EGFR. -Ruolo Biologico -Evidenze terapeutiche -Problemi -Sviluppi futuri. Valentina Anrò
 Anticorpi monoclonali Anti-EGFR -Ruolo Biologico -Evidenze terapeutiche -Problemi -Sviluppi futuri Valentina Anrò Ruolo Biologico Epidermal Growth Factor Receptor Extracellular Domain Transmembrane Domain
Anticorpi monoclonali Anti-EGFR -Ruolo Biologico -Evidenze terapeutiche -Problemi -Sviluppi futuri Valentina Anrò Ruolo Biologico Epidermal Growth Factor Receptor Extracellular Domain Transmembrane Domain
Avastin è utilizzato con altri medicinali antitumorali per il trattamento dei seguenti tipi di tumore negli adulti:
 EMA/175824/2015 EMEA/H/C/000582 Riassunto destinato al pubblico bevacizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/175824/2015 EMEA/H/C/000582 Riassunto destinato al pubblico bevacizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
Cetuximab e mutazione K-Ras nel tumore del colon-retto
 Università di Pisa Dipartimento di Farmacia Corso di laurea in CTF Corso: Basi biochimiche dell azione dei farmaci Cetuximab e mutazione K-Ras nel tumore del colon-retto Pisa, 27/03/2014 Samuela Fabiani
Università di Pisa Dipartimento di Farmacia Corso di laurea in CTF Corso: Basi biochimiche dell azione dei farmaci Cetuximab e mutazione K-Ras nel tumore del colon-retto Pisa, 27/03/2014 Samuela Fabiani
FARMACEUTICA A.S.S. N.1 TRIESTINA COMPLESSA ASSISTENZA RIESTINA RESPONSABILE FF DOTT.. ABAA BA PETTINELLIETTINELLI
 A CURA DELLA STRUTTURA COMPLESSA ASSISTENZA FARMACEUTICA A.S.S. N.1 TRIESTINA RIESTINA RESPONSABILE FF DOTT.. ABAA BA PETTINELLIETTINELLI NUMEROUMERO 25 OTTOBRE 2012 All interno: pag.2-5 Bevacizumab 1
A CURA DELLA STRUTTURA COMPLESSA ASSISTENZA FARMACEUTICA A.S.S. N.1 TRIESTINA RIESTINA RESPONSABILE FF DOTT.. ABAA BA PETTINELLIETTINELLI NUMEROUMERO 25 OTTOBRE 2012 All interno: pag.2-5 Bevacizumab 1
Sinossi di studio clinico Codice: GECP06/01 Pag. 1 di 5
 Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Principi attivi e indicazioni terapeutiche autorizzate sottoposte a payment by results, cost sharing e risk sharing. Data di inizio 24/07/2006
 ALLEGATO A Principi attivi e indicazioni terapeutiche autorizzate sottoposte a payment by results, cost sharing e risk sharing Principio attivo ERLOTINIB (Tarceva ) SUNITINIB (Sutent ) SORAFENIB (Nexavar
ALLEGATO A Principi attivi e indicazioni terapeutiche autorizzate sottoposte a payment by results, cost sharing e risk sharing Principio attivo ERLOTINIB (Tarceva ) SUNITINIB (Sutent ) SORAFENIB (Nexavar
LINEE GUIDA TERAPEUTICHE TUMORI DEL COLON
 LINEE GUIDA TERAPEUTICHE TUMORI DEL COLON DATA DI AGGIORNAMENTO: MARZO 2012 Adenoma con displasia alto grado o severa (1) Escissione locale completa endoscopica in unica escissione (non piecemeal) Resezione
LINEE GUIDA TERAPEUTICHE TUMORI DEL COLON DATA DI AGGIORNAMENTO: MARZO 2012 Adenoma con displasia alto grado o severa (1) Escissione locale completa endoscopica in unica escissione (non piecemeal) Resezione
Nella provincia di Latina sono diagnosticati in media ogni anno 98 casi ogni 100.000 uomini e 27 ogni 100.000 donne.
 TUMORE DEL POLMONE Nel periodo 27-211 sono stati registrati complessivamente in provincia di Latina 172 nuovi casi di tumore del polmone. E risultato al 1 posto in termini di frequenza fra le neoplasie
TUMORE DEL POLMONE Nel periodo 27-211 sono stati registrati complessivamente in provincia di Latina 172 nuovi casi di tumore del polmone. E risultato al 1 posto in termini di frequenza fra le neoplasie
Trials clinici. Disegni di studio
 Trials Clinici Dott.ssa Pamela Di Giovanni Studi descrittivi Disegni di studio Popolazioni Individui Studi analitici Osservazionali Sperimentali Studi di correlazione o ecologici Case report - Case series
Trials Clinici Dott.ssa Pamela Di Giovanni Studi descrittivi Disegni di studio Popolazioni Individui Studi analitici Osservazionali Sperimentali Studi di correlazione o ecologici Case report - Case series
Sorafenib indicazione epatocarcinoma (09-09-2008)
 Sorafenib indicazione epatocarcinoma (09-09-2008) Specialità: Nexavar (Bayer spa) Forma farmaceutica: 112 compresse 200 mg - Prezzo: euro 5.305 ATC: L01XE05 Categoria terapeutica: Citostatici: inibitori
Sorafenib indicazione epatocarcinoma (09-09-2008) Specialità: Nexavar (Bayer spa) Forma farmaceutica: 112 compresse 200 mg - Prezzo: euro 5.305 ATC: L01XE05 Categoria terapeutica: Citostatici: inibitori
Quando il dolore è ancora un problema. XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013
 Quando il dolore è ancora un problema XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013 Marta Gentili vivere senza dolore onlus In Italia, nel 2012, si stimano circa 364 mila nuove diagnosi per tumore
Quando il dolore è ancora un problema XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013 Marta Gentili vivere senza dolore onlus In Italia, nel 2012, si stimano circa 364 mila nuove diagnosi per tumore
Incidenza, mortalità e sopravvivenza per tumore in Italia nel 2015
 I numeri del cancro in Italia 2015 Ministero della Salute - Roma 24 Settembre 2015 Incidenza, mortalità e sopravvivenza per tumore in Italia nel 2015 Carmine Pinto Presidente Nazionale AIOM I quesiti per
I numeri del cancro in Italia 2015 Ministero della Salute - Roma 24 Settembre 2015 Incidenza, mortalità e sopravvivenza per tumore in Italia nel 2015 Carmine Pinto Presidente Nazionale AIOM I quesiti per
Panitumumab. Raccomandazioni evidence-based. Carcinoma colon-rettale metastatico (I linea di terapia)
 Raccomandazioni evidence-based Panitumumab Carcinoma colon-rettale metastatico (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 36 Ottobre 2014 Direzione
Raccomandazioni evidence-based Panitumumab Carcinoma colon-rettale metastatico (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 36 Ottobre 2014 Direzione
Premessa. Tratto da American Heart Journal 2004; 147: 705-712
 Effetti del cambiamento di terapia con statine sul raggiungimento delle concentrazioni lipidiche ottimali: lo studio Measuring Effective Reductions in Cholesterol Using Rosuvastatin Therapy (MERCURY I)
Effetti del cambiamento di terapia con statine sul raggiungimento delle concentrazioni lipidiche ottimali: lo studio Measuring Effective Reductions in Cholesterol Using Rosuvastatin Therapy (MERCURY I)
REPORT HTA REGIONALE. Decisioni CTR Data riunione: 20/02/2012 fd. Decisione: Inserito
 REPORT HTA REGIONALE Decisioni CTR Data riunione: 20/02/2012 fd Decisione: Inserito CARATTERISTICHE DEL PRODOTTO PRINCIPIO ATTIVO: Pazopanib NOME COMMERCIALE: Votrient DITTA PRODUTTRICE: Glaxosmithkline
REPORT HTA REGIONALE Decisioni CTR Data riunione: 20/02/2012 fd Decisione: Inserito CARATTERISTICHE DEL PRODOTTO PRINCIPIO ATTIVO: Pazopanib NOME COMMERCIALE: Votrient DITTA PRODUTTRICE: Glaxosmithkline
Dott. Alessandro Fabbri U.O. Pneumologia ASL 3 PT Direttore ff Dott. Franco Vannucci
 Dott. Alessandro Fabbri U.O. Pneumologia ASL 3 PT Direttore ff Dott. Franco Vannucci Negli ultimi anni c è stato un notevole cambiamento nella gestione diagnosticoterapeutica dei soggetti affetti da neoplasia
Dott. Alessandro Fabbri U.O. Pneumologia ASL 3 PT Direttore ff Dott. Franco Vannucci Negli ultimi anni c è stato un notevole cambiamento nella gestione diagnosticoterapeutica dei soggetti affetti da neoplasia
Dialogo sui Farmaci n. 4/2009 PRESCRIVERE NEWS < 186 (Pagina 2 di 5)
 Dialogo sui Farmaci n. 4/2009 PRESCRIVERE NEWS < 186 (Pagina 1 di 5) PANITUMUMAB Indicazioni del nuovo principio attivo Come monoterapia per il trattamento di pazienti con carcinoma colorettale metastatico
Dialogo sui Farmaci n. 4/2009 PRESCRIVERE NEWS < 186 (Pagina 1 di 5) PANITUMUMAB Indicazioni del nuovo principio attivo Come monoterapia per il trattamento di pazienti con carcinoma colorettale metastatico
Carcinoma della prostata: INCIDENZA
 Outcomes in Localized Prostate Cancer: National Prostate Cancer Registry of Sweden Follow-up Study JNCI - J Natl Cancer Inst. 2010 Jul 7;102(13):919-20 Trento, 13/11/2010 Di cosa si tratta? E' uno studio
Outcomes in Localized Prostate Cancer: National Prostate Cancer Registry of Sweden Follow-up Study JNCI - J Natl Cancer Inst. 2010 Jul 7;102(13):919-20 Trento, 13/11/2010 Di cosa si tratta? E' uno studio
CAPECITABINA (29-10-2008)
 CAPECITABINA (29-10-2008) Specialità: Xeloda(Roche spa) Forma farmaceutica: 60 CPR 150 mg - Prezzo: euro 84.57 120 CPR 500mg - Prezzo: euro 561 ATC: L01BC06 Categoria terapeutica: Antineoplastici, antimetaboliti-analoghi
CAPECITABINA (29-10-2008) Specialità: Xeloda(Roche spa) Forma farmaceutica: 60 CPR 150 mg - Prezzo: euro 84.57 120 CPR 500mg - Prezzo: euro 561 ATC: L01BC06 Categoria terapeutica: Antineoplastici, antimetaboliti-analoghi
SINOSSI DELLO STUDIO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO
 SINOSSI DELLO STUDIO TITOLO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO SPONSOR Sequenza ottimale di ormonoterapia in pazienti con carcinoma mammario metastatico ricadute dopo terapia
SINOSSI DELLO STUDIO TITOLO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO SPONSOR Sequenza ottimale di ormonoterapia in pazienti con carcinoma mammario metastatico ricadute dopo terapia
Bevacizumab e Cetuximab nel cancro colorettale metastastico in donne e uomini: Studio Multicentrico Retrospettivo in Toscana
 Bevacizumab e Cetuximab nel cancro colorettale metastastico in donne e uomini: Studio Multicentrico Retrospettivo in Toscana L. Bazzani, E. Terzuoli, S. Giorgi, G. Francini, L. Antonuzzo, F. Di Costanzo,
Bevacizumab e Cetuximab nel cancro colorettale metastastico in donne e uomini: Studio Multicentrico Retrospettivo in Toscana L. Bazzani, E. Terzuoli, S. Giorgi, G. Francini, L. Antonuzzo, F. Di Costanzo,
la storia di HER2 Citogenetica e biologia molecolare dei tumori mammari: implicazioni cliniche HER2: Human Epidermal Receptor
 Citogenetica e biologia molecolare dei tumori mammari: implicazioni cliniche la storia di HER2 V. Martin 28 giugno 2011 HER2: Human Epidermal Receptor HER2 e carcinoma mammario alias c-erb, ERBB2, HER-
Citogenetica e biologia molecolare dei tumori mammari: implicazioni cliniche la storia di HER2 V. Martin 28 giugno 2011 HER2: Human Epidermal Receptor HER2 e carcinoma mammario alias c-erb, ERBB2, HER-
Studio di ricerca clinica sul dolore da endometriosi. Il dolore che Lei sente è reale... anche se gli altri non possono vederlo.
 Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
MINI SCHEDA HTA AXITINIB (INLYTA )
 1/6 MINI SCHEDA HTA AXITINIB (INLYTA ) FARMACO IN ESAME Nome commerciale Inlyta Principio Attivo Axitinib Ditta Produttrice Pfizer Italia srl ATC L01XE17 Formulazione Compresse rivestite Dosaggio 1 mg
1/6 MINI SCHEDA HTA AXITINIB (INLYTA ) FARMACO IN ESAME Nome commerciale Inlyta Principio Attivo Axitinib Ditta Produttrice Pfizer Italia srl ATC L01XE17 Formulazione Compresse rivestite Dosaggio 1 mg
MINI SCHEDA HTA CRIZOTINIB (XALKORI )
 1/7 MINI SCHEDA HTA CRIZOTINIB (XALKORI ) Nome Commerciale XALKORI Principio Attivo Crizotinib Ditta Produttrice Pfizer Italia Srl ATC L01XE16 Formulazione Capsule rigide Dosaggio 200 mg 250 mg Altri antineoplastici
1/7 MINI SCHEDA HTA CRIZOTINIB (XALKORI ) Nome Commerciale XALKORI Principio Attivo Crizotinib Ditta Produttrice Pfizer Italia Srl ATC L01XE16 Formulazione Capsule rigide Dosaggio 200 mg 250 mg Altri antineoplastici
Confronto di percorsi di diagnosi e trattamento tra Italia e USA
 Confronto di percorsi di diagnosi e trattamento tra Italia e USA Anna Gigli Istituto di Ricerche sulla Popolazione e le Politiche Sociali (IRPPS-CNR) Seminario L impatto dei tumori sui sistemi sanitari:
Confronto di percorsi di diagnosi e trattamento tra Italia e USA Anna Gigli Istituto di Ricerche sulla Popolazione e le Politiche Sociali (IRPPS-CNR) Seminario L impatto dei tumori sui sistemi sanitari:
NSCLC - stadio iiib/iv
 I TUMORI POLMONARI linee guida per la pratica clinica NSCLC - stadio iiib/iv quale trattamento per i pazienti anziani con malattia avanzata? Il carcinoma polmonare è un tumore frequente nell età avanzata.
I TUMORI POLMONARI linee guida per la pratica clinica NSCLC - stadio iiib/iv quale trattamento per i pazienti anziani con malattia avanzata? Il carcinoma polmonare è un tumore frequente nell età avanzata.
Neoplasie della mammella - 2
 Neoplasie della mammella - 2 Fattori prognostici Numero di N+ : >3 Età e stato menopausale Diametro di T Invasione linfatica e vascolare Tipo istologico Grading Recettore per Estrogeni/Progesterone Amplificazione
Neoplasie della mammella - 2 Fattori prognostici Numero di N+ : >3 Età e stato menopausale Diametro di T Invasione linfatica e vascolare Tipo istologico Grading Recettore per Estrogeni/Progesterone Amplificazione
Diagnosi precoce delle neoplasie del collo dell utero
 Diagnosi precoce delle neoplasie del collo dell utero La neoplasia del collo dell utero a livello mondiale rappresenta ancora il secondo tumore maligno della donna, con circa 500.000 nuovi casi stimati
Diagnosi precoce delle neoplasie del collo dell utero La neoplasia del collo dell utero a livello mondiale rappresenta ancora il secondo tumore maligno della donna, con circa 500.000 nuovi casi stimati
Domande relative alla specializzazione in: Oncologia medica
 Domande relative alla specializzazione in: Oncologia medica Domanda #1 (codice domanda: n.541) : Cosa caratterizza il grado T2 del colangiocarcinoma? A: Interessamento del connettivo periduttale B: Coinvolgimento
Domande relative alla specializzazione in: Oncologia medica Domanda #1 (codice domanda: n.541) : Cosa caratterizza il grado T2 del colangiocarcinoma? A: Interessamento del connettivo periduttale B: Coinvolgimento
Tumore del colon-retto metastatico
 Raccomandazioni d'uso Tumore del colon-retto metastatico Parte B: Cetuximab A cura del Gruppo Regionale Farmaci Oncologici (GReFO) per l'elaborazione di raccomandazioni evidence based Direzione Generale
Raccomandazioni d'uso Tumore del colon-retto metastatico Parte B: Cetuximab A cura del Gruppo Regionale Farmaci Oncologici (GReFO) per l'elaborazione di raccomandazioni evidence based Direzione Generale
PEMETREXED per il trattamento carcinoma polmonare non a piccole cellule. (Nuovo allargamento indicazione) (27-05-2009)
 PEMETREXED per il trattamento carcinoma polmonare non a piccole cellule. (Nuovo allargamento indicazione) (27-05-2009) Specialità: Alimta (Eli lilly italia spa) Forma farmaceutica: 1 fl di polvere per
PEMETREXED per il trattamento carcinoma polmonare non a piccole cellule. (Nuovo allargamento indicazione) (27-05-2009) Specialità: Alimta (Eli lilly italia spa) Forma farmaceutica: 1 fl di polvere per
Terapia medica oncologica e radioterapia adiuvante
 RETTO TRATTAMENTO MEDICO 01 Terapia medica oncologica e radioterapia adiuvante DESCRIZIONE: Stima la proporzione di pazienti che effettuano una terapia medica oncologica e radioterapia post-intervento
RETTO TRATTAMENTO MEDICO 01 Terapia medica oncologica e radioterapia adiuvante DESCRIZIONE: Stima la proporzione di pazienti che effettuano una terapia medica oncologica e radioterapia post-intervento
PREVENZIONE POLMONITE
 fiammaz o l m o n a r e struzione br avità pleuri Streptococcus p n e u m o n i a Infezione Mal Respiratorio PREVENZIONE POLMONITE Vaccino Pneumococcico Polisaccaridico Coniugato, (13Valente Adsorbito)
fiammaz o l m o n a r e struzione br avità pleuri Streptococcus p n e u m o n i a Infezione Mal Respiratorio PREVENZIONE POLMONITE Vaccino Pneumococcico Polisaccaridico Coniugato, (13Valente Adsorbito)
APPROPRIATEZZA IN ECOCARDIOGRAFIA. MARIA CUONZO Cardiologia UTIC AUSL BA Terlizzi
 APPROPRIATEZZA IN ECOCARDIOGRAFIA MARIA CUONZO Cardiologia UTIC AUSL BA Terlizzi SOGGETTO CON CMD NOTA IN COMPENSO PREGRESSO DOLORE TORACICO Quale esame stato richiesto con appropriatezza? SOGGETTO CON
APPROPRIATEZZA IN ECOCARDIOGRAFIA MARIA CUONZO Cardiologia UTIC AUSL BA Terlizzi SOGGETTO CON CMD NOTA IN COMPENSO PREGRESSO DOLORE TORACICO Quale esame stato richiesto con appropriatezza? SOGGETTO CON
L ESEMPIO DELLA VALVOLA CARDIACA TRANSCATETERE
 L ESEMPIO DELLA VALVOLA CARDIACA TRANSCATETERE VALVOLA CARDIACA TRANSCATETERE L ASSESSMENT Caratteristiche del dispositivo medico: le protesi valvolari aortiche trascatetere in commercio presentano alcune
L ESEMPIO DELLA VALVOLA CARDIACA TRANSCATETERE VALVOLA CARDIACA TRANSCATETERE L ASSESSMENT Caratteristiche del dispositivo medico: le protesi valvolari aortiche trascatetere in commercio presentano alcune
Dr. Vittorio Ferrari U.O. Oncologia Medica A. Spedali Civili, Brescia
 Dr. Vittorio Ferrari U.O. Oncologia Medica A. Spedali Civili, Brescia La crescita tumorale Classification Evoluzione dei trattamenti RR OS Sites of therapy STAGE II In colon cancer patients
Dr. Vittorio Ferrari U.O. Oncologia Medica A. Spedali Civili, Brescia La crescita tumorale Classification Evoluzione dei trattamenti RR OS Sites of therapy STAGE II In colon cancer patients
Scritto da RyderItalia Mercoledì 12 Maggio 2010 11:19 - Ultimo aggiornamento Mercoledì 03 Novembre 2010 15:57
 LA TERAPIA METRONOMICA Per oltre mezzo secolo, la terapia sistemica per i tumori è stata caratterizzata dalla somministrazione dei farmaci chemioterapici. La maggior parte di questi farmaci ha lo scopo
LA TERAPIA METRONOMICA Per oltre mezzo secolo, la terapia sistemica per i tumori è stata caratterizzata dalla somministrazione dei farmaci chemioterapici. La maggior parte di questi farmaci ha lo scopo
SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO
 STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO FAX: 0916552413 SITO WEB: www.gstu.it E-MAIL: gstu@gstu.it CRITERI
STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO FAX: 0916552413 SITO WEB: www.gstu.it E-MAIL: gstu@gstu.it CRITERI
IL RAZIONAMENTO DELLE RISORSE: COME AFFRONTARLO. Fausto Roila Oncologia Medica, Terni
 IL RAZIONAMENTO DELLE RISORSE: COME AFFRONTARLO Fausto Roila Oncologia Medica, Terni IL PROBLEMA - CRISI ECONOMICA DEI PAESI INDUSTRIALIZZATI - COSTI SEMPRE PIU ELEVATI DELLA INNOVAZIONE (nuove tecnologie,
IL RAZIONAMENTO DELLE RISORSE: COME AFFRONTARLO Fausto Roila Oncologia Medica, Terni IL PROBLEMA - CRISI ECONOMICA DEI PAESI INDUSTRIALIZZATI - COSTI SEMPRE PIU ELEVATI DELLA INNOVAZIONE (nuove tecnologie,
Rassegna Stampa. Comunicato stampa. Intermedia s.r.l. per la comunicazione integrata
 Rassegna Stampa Comunicato stampa TUMORE DEL SENO: FUNZIONA LA TERAPIA "ACCELERATA" "IL 94% DEI PAZIENTI GUARISCE CON I TEMPI DI CURA PIU' BREVI" Intermedia s.r.l. per la comunicazione integrata Via Malta,
Rassegna Stampa Comunicato stampa TUMORE DEL SENO: FUNZIONA LA TERAPIA "ACCELERATA" "IL 94% DEI PAZIENTI GUARISCE CON I TEMPI DI CURA PIU' BREVI" Intermedia s.r.l. per la comunicazione integrata Via Malta,
Sofosbuvir: Up to date in regione Veneto
 Sofosbuvir: Up to date in regione Veneto Il caso Sofosbuvir è considerato il paradigma attuale e futuro di riferimento su cui basare la politica nazionale del farmaco per i farmaci ad alto costo. AIFA
Sofosbuvir: Up to date in regione Veneto Il caso Sofosbuvir è considerato il paradigma attuale e futuro di riferimento su cui basare la politica nazionale del farmaco per i farmaci ad alto costo. AIFA
REPORT HTA REGIONALE MECCANISMO D AZIONE E POSOLOGIA
 REPORT HTA REGIONALE Decisioni CTR Data riunione:17/04/2012 Decisione: Non Inserito Motivazioni: il farmaco, pur avendo dimostrato di prolungare la sopravvivenza di 2,4 mesi rispetto al fd mitoxantrone,
REPORT HTA REGIONALE Decisioni CTR Data riunione:17/04/2012 Decisione: Non Inserito Motivazioni: il farmaco, pur avendo dimostrato di prolungare la sopravvivenza di 2,4 mesi rispetto al fd mitoxantrone,
Lo screening mammografico una revisione sui dati di letteratura
 Lo screening mammografico una revisione sui dati di letteratura Cos è uno screening Strategia di indagini diagnostiche generalizzate, utilizzate per identificare una malattia in una popolazione standard
Lo screening mammografico una revisione sui dati di letteratura Cos è uno screening Strategia di indagini diagnostiche generalizzate, utilizzate per identificare una malattia in una popolazione standard
Neoplasie dell apparato gastroenterico. Terapia medica
 Neoplasie dell apparato gastroenterico Terapia medica Tumori del colon-retto COLON - Anatomia e vascolarizzazione FLESSURA EPATICA FLESSURA SPLENICA COLON TRASVERSO Mid colic a. Inf. mes. v. Sup. mes
Neoplasie dell apparato gastroenterico Terapia medica Tumori del colon-retto COLON - Anatomia e vascolarizzazione FLESSURA EPATICA FLESSURA SPLENICA COLON TRASVERSO Mid colic a. Inf. mes. v. Sup. mes
Allegato I. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
10 VALUTAZIONE DELLE ANALISI
 10 VALUTAZIONE DELLE ANALISI ECONOMICHE Questa valutazione economica può aiutarvi? 1 Esistono prove valide che gli interventi sono efficaci? 2 Di quale tipo di analisi economica si tratta? Studio costo-conseguenze
10 VALUTAZIONE DELLE ANALISI ECONOMICHE Questa valutazione economica può aiutarvi? 1 Esistono prove valide che gli interventi sono efficaci? 2 Di quale tipo di analisi economica si tratta? Studio costo-conseguenze
ESERCITAZIONE 2. TRATTO E MODIFICATO DA: Esercizi di epidemiologia - MORO, DAVOLI, PIRASTU Il pensiero scientifico editore
 ESERCITAZIONE 2 TRATTO E MODIFICATO DA: Esercizi di epidemiologia - MORO, DAVOLI, PIRASTU Il pensiero scientifico editore Modalità di lettura della tabella di contingenza 2x2 sull associazione tra l esposizione
ESERCITAZIONE 2 TRATTO E MODIFICATO DA: Esercizi di epidemiologia - MORO, DAVOLI, PIRASTU Il pensiero scientifico editore Modalità di lettura della tabella di contingenza 2x2 sull associazione tra l esposizione
Comparabilità fra le somministrazioni successive effetto di trascinamento ( carry-over ) effetto di periodo
 Metodo epidemiologici per la clinica _efficacia / 2 Gli studi crossover Periodo 1 Periodo 2 R A N D O M A B A B Valutazione Tempo 1 0 1 1 2 0 2 1 Gli studi crossover Metodo epidemiologici per la clinica
Metodo epidemiologici per la clinica _efficacia / 2 Gli studi crossover Periodo 1 Periodo 2 R A N D O M A B A B Valutazione Tempo 1 0 1 1 2 0 2 1 Gli studi crossover Metodo epidemiologici per la clinica
TRASTUZUMAB: trattamento adenocarcinoma metastatico dello stomaco e della giunzione gastro esofagea HER2+ (05/04/2011)
 TRASTUZUMAB: trattamento adenocarcinoma metastatico dello stomaco e della giunzione gastro esofagea HER2+ (05/04/2011) Specialità: HERCEPTIN(ROCHE) Forma farmaceutica: polvere per concentrato per soluzione
TRASTUZUMAB: trattamento adenocarcinoma metastatico dello stomaco e della giunzione gastro esofagea HER2+ (05/04/2011) Specialità: HERCEPTIN(ROCHE) Forma farmaceutica: polvere per concentrato per soluzione
Titolo, oggetto e obiettivo del Progetto: Obiettivo Primario
 Titolo, oggetto e obiettivo del Progetto: Studio clinico randomizzato, con gruppo di controllo, sull Agopuntura Tradizionale Cinese come Terapia di Supporto in pazienti sottoposti a trattamento Chemioterapico
Titolo, oggetto e obiettivo del Progetto: Studio clinico randomizzato, con gruppo di controllo, sull Agopuntura Tradizionale Cinese come Terapia di Supporto in pazienti sottoposti a trattamento Chemioterapico
La terapia medica primaria e adiuvante e il follow-up: le principali novità. a cura di Claudio Zamagni (Bologna) e Antonio Frassoldati (Ferrara)
 Protocollo diagnostico-terapeutico per le Pazienti con carcinoma mammario La terapia medica primaria e adiuvante e il follow-up: le principali novità a cura di Claudio Zamagni (Bologna) e Antonio Frassoldati
Protocollo diagnostico-terapeutico per le Pazienti con carcinoma mammario La terapia medica primaria e adiuvante e il follow-up: le principali novità a cura di Claudio Zamagni (Bologna) e Antonio Frassoldati
IL RUOLO DELL INFERMIERE
 A06 152 Maria Grazia Belvedere Paolo Ruggeri IL RUOLO DELL INFERMIERE NELL ASSISTENZA AL PAZIENTE AFFETTO DA IPERTENSIONE ARTERIOSA POLMONARE ANALISI DI UN CASO CLINICO E REVISIONE DELLA LETTERATURA Copyright
A06 152 Maria Grazia Belvedere Paolo Ruggeri IL RUOLO DELL INFERMIERE NELL ASSISTENZA AL PAZIENTE AFFETTO DA IPERTENSIONE ARTERIOSA POLMONARE ANALISI DI UN CASO CLINICO E REVISIONE DELLA LETTERATURA Copyright
CARTA INTESTATA DEL CENTRO CLINICO
 CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
AIFA Agenzia Italiana del Farmaco Valproato
 AIFA - Valproato 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Valproato Rivalutazione CHMP file:///c /documenti/val9510.htm [18/12/2009 12.44.38] Domande e risposte sulla rivalutazione dei
AIFA - Valproato 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Valproato Rivalutazione CHMP file:///c /documenti/val9510.htm [18/12/2009 12.44.38] Domande e risposte sulla rivalutazione dei
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 Presentata da Dott. S. Ortu ASL 2 RICHIESTA DI INSERIMENTO IN PTR DI PANITUMAB ATC L01XC08 (VECTIBIX ) In data febbraio 2010 Per le seguenti motivazioni (sintesi): Monoterapia per il trattamento di pazienti
Presentata da Dott. S. Ortu ASL 2 RICHIESTA DI INSERIMENTO IN PTR DI PANITUMAB ATC L01XC08 (VECTIBIX ) In data febbraio 2010 Per le seguenti motivazioni (sintesi): Monoterapia per il trattamento di pazienti
Università del Piemonte Orientale. Corso di Laurea in Medicina e Chirurgia. Corso di Statistica Medica. I modelli di studio
 Università del Piemonte Orientale Corso di Laurea in Medicina e Chirurgia Corso di Statistica Medica I modelli di studio Corso di laurea in medicina e chirurgia - Statistica Medica Disegno dello studio
Università del Piemonte Orientale Corso di Laurea in Medicina e Chirurgia Corso di Statistica Medica I modelli di studio Corso di laurea in medicina e chirurgia - Statistica Medica Disegno dello studio
 Indicatori di qualità nei carcinomi genitali femminili: ovaio e utero Serata di presentazione progetto Zonta Club Locarno 13.04.2010 Registro Tumori Canton Ticino Istituto Cantonale di Patologia Via in
Indicatori di qualità nei carcinomi genitali femminili: ovaio e utero Serata di presentazione progetto Zonta Club Locarno 13.04.2010 Registro Tumori Canton Ticino Istituto Cantonale di Patologia Via in
Specialità: Hycamtin (Glaxosmithkline Spa)
 TOPOTECAN per l'indicazione: pazienti affetti da carcinoma polmonare a piccole cellule recidivante per i quali non à considerato appropriato un ulteriore trattamento con il regime terapeutico di prima
TOPOTECAN per l'indicazione: pazienti affetti da carcinoma polmonare a piccole cellule recidivante per i quali non à considerato appropriato un ulteriore trattamento con il regime terapeutico di prima
ONCOVIEW 2012. Istruzioni per la compilazione delle schede pazienti
 ONCOVIEW 2012 Istruzioni per la compilazione delle schede pazienti ONCOVIEW - COME SI COLLABORA Lo studio ONCOVIEW ha l obiettivo di fornire un quadro esaustivo ed approfondito delle terapie farmacologiche
ONCOVIEW 2012 Istruzioni per la compilazione delle schede pazienti ONCOVIEW - COME SI COLLABORA Lo studio ONCOVIEW ha l obiettivo di fornire un quadro esaustivo ed approfondito delle terapie farmacologiche
Classificazione degli studi epidemiologici
 Classificazione degli studi epidemiologici STUDI DESCRITTIVI - DI CORRELAZIONE O ECOLOGICI - CASE REPORT/SERIES - DI PREVALENZA O TRASVERSALI STUDI ANALITICI O OSSERVAZIONALI - A COORTE - CASO-CONTROLLO
Classificazione degli studi epidemiologici STUDI DESCRITTIVI - DI CORRELAZIONE O ECOLOGICI - CASE REPORT/SERIES - DI PREVALENZA O TRASVERSALI STUDI ANALITICI O OSSERVAZIONALI - A COORTE - CASO-CONTROLLO
Ricerca farmacologica priclinica e clinica
 Ricerca farmacologica priclinica e clinica SPERIMENTAZIONE PRECLINICA DURATA MEDIA?? ANNI Consente di isolare, dalle migliaia di sostanze sottoposte al primo screening di base farmacologico e biochimico,
Ricerca farmacologica priclinica e clinica SPERIMENTAZIONE PRECLINICA DURATA MEDIA?? ANNI Consente di isolare, dalle migliaia di sostanze sottoposte al primo screening di base farmacologico e biochimico,
Scritto da Giovanni Creton Domenica 27 Febbraio 2011 17:32 - Ultimo aggiornamento Domenica 27 Marzo 2011 19:43
 E evidente che lo screening per un tumore può diagnosticare la malattia molto precocemente, ma nel caso del tumore alla prostata il ricorso al test del PSA può creare dati incerti e rischi sanitari in
E evidente che lo screening per un tumore può diagnosticare la malattia molto precocemente, ma nel caso del tumore alla prostata il ricorso al test del PSA può creare dati incerti e rischi sanitari in
Effetti sull opinione di pazienti riguardo all utilizzo di un computer in uno studio medico nell assistenza ordinaria
 Effetti sull opinione di pazienti riguardo all utilizzo di un computer in uno studio medico nell assistenza ordinaria Christopher N. Sciamanna, Scott P. Novak, Bess H. Marcus. International Journal of
Effetti sull opinione di pazienti riguardo all utilizzo di un computer in uno studio medico nell assistenza ordinaria Christopher N. Sciamanna, Scott P. Novak, Bess H. Marcus. International Journal of
Area per la Promozione della Salute, delle Persone e delle Pari Opportunità
 Area per la Promozione della Salute, delle Persone e delle Pari Opportunità Assessorato alle Politiche della Salute Servizio Programmazione Assistenza Territoriale e Prevenzione Il presente allegato, parte
Area per la Promozione della Salute, delle Persone e delle Pari Opportunità Assessorato alle Politiche della Salute Servizio Programmazione Assistenza Territoriale e Prevenzione Il presente allegato, parte
coin lesion polmonare
 coin lesion polmonare accurata anamnesi ed esame obiettivo impossibile confronto con precedenti radiogrammi lesione non preesistente o modificatasi TC Follow-up caratteri di benignità lesione sospetta
coin lesion polmonare accurata anamnesi ed esame obiettivo impossibile confronto con precedenti radiogrammi lesione non preesistente o modificatasi TC Follow-up caratteri di benignità lesione sospetta
Stato dell arte e prospettive della Target Therapy nei Tumori gastroenterici
 Percorsi e processi organizzativi nei trattamenti integrati dei tumori gastrointestinali Associazione Dossetti Roma, 25-26 ottobre 2011 Stato dell arte e prospettive della Target Therapy nei Tumori gastroenterici
Percorsi e processi organizzativi nei trattamenti integrati dei tumori gastrointestinali Associazione Dossetti Roma, 25-26 ottobre 2011 Stato dell arte e prospettive della Target Therapy nei Tumori gastroenterici
Il programma si compone di due ricerche internazionali sulle valutazioni legate all assistenza degli individui affetti da tali patologie.
 Keeping Care Complete Sintesi dei risultati internazionali Keeping Care Complete ha l obiettivo di esaminare e creare consapevolezza circa le questioni emotive e sociali associate al trattamento e all
Keeping Care Complete Sintesi dei risultati internazionali Keeping Care Complete ha l obiettivo di esaminare e creare consapevolezza circa le questioni emotive e sociali associate al trattamento e all
I nuovi anticoagulanti orali nella fibrillazione atriale non valvolare: le linee guida per la prescrizione
 I nuovi anticoagulanti orali nella fibrillazione atriale non valvolare: le linee guida per la prescrizione Anna Maria Marata Area Valutazione del Farmaco ASSR Regione Emilia Romagna 9 Dicembre 2013 October
I nuovi anticoagulanti orali nella fibrillazione atriale non valvolare: le linee guida per la prescrizione Anna Maria Marata Area Valutazione del Farmaco ASSR Regione Emilia Romagna 9 Dicembre 2013 October
Capitolo 25: Lo scambio nel mercato delle assicurazioni
 Capitolo 25: Lo scambio nel mercato delle assicurazioni 25.1: Introduzione In questo capitolo la teoria economica discussa nei capitoli 23 e 24 viene applicata all analisi dello scambio del rischio nel
Capitolo 25: Lo scambio nel mercato delle assicurazioni 25.1: Introduzione In questo capitolo la teoria economica discussa nei capitoli 23 e 24 viene applicata all analisi dello scambio del rischio nel
T.E.V. E CHEMIOTERAPIA. Dott. Pietro Masullo
 T.E.V. E CHEMIOTERAPIA Dott. Pietro Masullo I MECCANISMI SONO MOLTEPLICI, SPESSO PRESENTI CONTEMPORANEAMENTE E NON ANCORA DEL TUTTO CHIARI LA CHEMIOTERAPIA PU0 AUMENTARE IL RISCHIO TEV ATTRAVERSO
T.E.V. E CHEMIOTERAPIA Dott. Pietro Masullo I MECCANISMI SONO MOLTEPLICI, SPESSO PRESENTI CONTEMPORANEAMENTE E NON ANCORA DEL TUTTO CHIARI LA CHEMIOTERAPIA PU0 AUMENTARE IL RISCHIO TEV ATTRAVERSO
LA CHEMIOTERAPIA ORALE IN ASSOCIAZIONE ALLA RADIOTERAPIA
 LA CHEMIOTERAPIA ORALE IN ASSOCIAZIONE ALLA RADIOTERAPIA G.Lazzari, G. Silvano S. C. Radioterapia Oncologica ASL TA/ 1 - Taranto Taranto, 21 gennaio 2005 BACKGROUND Le formulazioni orali di chemioterapia
LA CHEMIOTERAPIA ORALE IN ASSOCIAZIONE ALLA RADIOTERAPIA G.Lazzari, G. Silvano S. C. Radioterapia Oncologica ASL TA/ 1 - Taranto Taranto, 21 gennaio 2005 BACKGROUND Le formulazioni orali di chemioterapia
per una buona salute Claudio Andreoli
 Alimentazione e stili di vita per una buona salute Claudio Andreoli «Uno stile di vita non corretto può aumentare il rischio di tumori o di malattie cardiache?» UNIVERSITA DEGLI STUDI DI MILANO Facolta
Alimentazione e stili di vita per una buona salute Claudio Andreoli «Uno stile di vita non corretto può aumentare il rischio di tumori o di malattie cardiache?» UNIVERSITA DEGLI STUDI DI MILANO Facolta
Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008
 Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008 1 Quali aspetti della menopausa possono essere divulgati come problemi di salute?
Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008 1 Quali aspetti della menopausa possono essere divulgati come problemi di salute?
ANALISI DELLA SOPRAVVIVENZA
 ANALISI DELLA SOPRAVVIVENZA Prof. Giuseppe Verlato Sezione di Epidemiologia e Statistica Medica Università degli Studi di Verona OBIETTIVI DELL ANALISI DELLA SOPRAVVIVENZA 1) STIMARE la funzione di sopravvivenza
ANALISI DELLA SOPRAVVIVENZA Prof. Giuseppe Verlato Sezione di Epidemiologia e Statistica Medica Università degli Studi di Verona OBIETTIVI DELL ANALISI DELLA SOPRAVVIVENZA 1) STIMARE la funzione di sopravvivenza
LA VALIDITÀ DEGLI STUDI E IL CONTROLLO DEL CONFONDIMENTO
 LA VALIDITÀ DEGLI STUDI E IL CONTROLLO DEL CONFONDIMENTO Accuratezza degli studi Miettinen, nel 1985, afferma che : la accuratezza di uno studio epidemiologico consiste nel grado di - assenza di errori
LA VALIDITÀ DEGLI STUDI E IL CONTROLLO DEL CONFONDIMENTO Accuratezza degli studi Miettinen, nel 1985, afferma che : la accuratezza di uno studio epidemiologico consiste nel grado di - assenza di errori
La valutazione economica dei farmaci biologici in reuma, gastro e derma
 La valutazione economica dei farmaci biologici in reuma, gastro e derma Sergio Iannazzo ISBEM - Istituto Scientifico Biomedico Euro Mediterraneo SIHS Health Economics Consulting SCELTA COLLETTIVITA SCELTA
La valutazione economica dei farmaci biologici in reuma, gastro e derma Sergio Iannazzo ISBEM - Istituto Scientifico Biomedico Euro Mediterraneo SIHS Health Economics Consulting SCELTA COLLETTIVITA SCELTA
Accesso ai farmaci innovativi e controllo della spesa a livello regionale
 FARMACI INNOVATIVI Qualità efficacia appropriatezza 9 ottobre 2009 Camera dei Deputati Palazzo Marini (Roma) Accesso ai farmaci innovativi e controllo della spesa a livello regionale Stefania Melena Direzione
FARMACI INNOVATIVI Qualità efficacia appropriatezza 9 ottobre 2009 Camera dei Deputati Palazzo Marini (Roma) Accesso ai farmaci innovativi e controllo della spesa a livello regionale Stefania Melena Direzione
IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici genovesi
 Università degli Studi di Genova Facoltà di Medicina e Chirurgia IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici
Università degli Studi di Genova Facoltà di Medicina e Chirurgia IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici
Breast Units / Centri di Senologia: verso gli standard europei
 Breast Units / Centri di Senologia: verso gli standard europei Approccio multidisciplinare e medicina personalizzata Roberto Labianca Direttore Cancer Center AO Papa Giovanni XXIII Direttore DIPO Bergamo
Breast Units / Centri di Senologia: verso gli standard europei Approccio multidisciplinare e medicina personalizzata Roberto Labianca Direttore Cancer Center AO Papa Giovanni XXIII Direttore DIPO Bergamo
sembra una Anche qui sembra questione di sesso: Aspirina e donne
 sembra una Anche qui sembra questione di sesso: Aspirina e donne The Women s Health Study Razionale per l uso di bassi dosaggi di aspirina nella prevenzione primaria Nella prevenzione secondaria delle
sembra una Anche qui sembra questione di sesso: Aspirina e donne The Women s Health Study Razionale per l uso di bassi dosaggi di aspirina nella prevenzione primaria Nella prevenzione secondaria delle
