Università degli Studi di Udine PROVA DI ACCESSO
|
|
|
- Salvatore Pisano
- 7 anni fa
- Visualizzazioni
Transcript
1 Università degli Studi di Udine PROVA DI ACCESSO Corso di Laurea in Scienze Agrarie Corso di Laurea in Viticoltura ed Enologia Corso di Laurea in Scienze e Tecnologie Alimentari Corso di Laurea in Scienze per l Ambiente e la Natura A.A. 2014/15 PROVA DEL GIORNO 08/09/2014 TEST A TEMPO A DISPOSIZIONE: 1 ora RISPOSTA ESATTA: RISPOSTA NON DATA: RISPOSTA ERRATA: 1 punto 0 punti -0,25 punti
2
3 MATEMATICA 1) Si considerino i numeri interi 45 e 35; il loro massimo comun divisore positivo è: A) 3 B) 0 C) indeterminato D) 5 2) A Giovanni aumentano lo stipendio del 5%, poi glielo abbassano del 5%. Alla fine il suo stipendio è: A) pari a quello iniziale B) maggiore di quello iniziale C) minore di quello iniziale D) per rispondere occorre sapere l ammontare dello stipendio 3) Sia a = -1; b = 1/(1+ ). Si ha allora: A) a > b B) b > a C) a = b D) Non è possibile confrontare a e b perché è irrazionale 4) La disequazione x x A) ha per soluzione tutti e soli i numeri negativi B) non ha soluzioni C) ha per soluzione ogni x reale D) nessuna delle precedenti risposte è corretta 5) Il polinomio x è uguale a: A) (x + 5) 3 B) (x 5) (x 2 + 5x + 25) C) (x + 5) (x 2 5x + 25) D) (x + 5) (x 2 + 5x + 25) 6) Se x rappresenta il numero di quintali di fertilizzante applicati a una coltivazione di patate e y = -x 2 +10x il numero di quintali di patate raccolti, possiamo dire che: A) per ottenere più raccolto possibile si deve applicare più fertilizzante possibile. B) per ottenere più raccolto possibile si deve applicare fertilizzante per una quantità più vicino possibile a 5 quintali. C) applicare più fertilizzante in realtà diminuisce il raccolto. D) per ottenere il massimo raccolto possibile si devono applicare almeno 10 quintali di fertilizzante. 7) Il centro della circonferenza circoscritta a un triangolo è il punto di incontro: A) delle mediane B) delle altezze C) delle bisettrici D) degli assi 8) Nel piano cartesiano si considerino le rette r1 e r2, di equazioni rispettivamente x+y 3=0 e x+2y 3=0 e si stabilisca quale delle seguenti affermazioni è esatta. A) le rette r1 e r2 sono coincidenti B) le rette r1 e r2 hanno tre punti in comune C) le rette r1 e r2 hanno due punti in comune D) le rette r 1 e r 2 hanno un unico punto in comune 9) Considerando la funzione Y=cos(X) se X = 0 allora: A) Y=1 B) Y = 0 C) Y tende a 0 D) Y = -1 10) Quanto vale log10 [(100) 3 ]? A) 2 B) 3 C) 6 D) 100
4 FISICA 11) Quale delle seguenti grandezze non è vettoriale? A) accelerazione B) quantità di moto C) potenza D) forza 12) Il kilowatt può essere usato come unità di misura di quale grandezza: A) energia elettrica B) tensione elettrica C) corrente elettrica D) potenza 13) Una pallina sospesa ad un filo oscilla in un piano verticale. Quale delle seguenti grandezze resta costante durante il moto? A) l energia cinetica B) la velocità C) la massa D) l energia potenziale 14) Un fotone è: A) un raggio laser B) una particella di luce C) una molecola che emette luce D) un punto luminoso 15) Un oggetto posto a distanza maggiore della lunghezza focale di una lente convergente forma un immagine: A) reale e capovolta B) virtuale e capovolta C) reale e diritta D) virtuale e diritta 16) Un oggetto cubico omogeneo di plastica di 10 cm di lato e 0,7 Kg di massa è immerso in acqua. All'equilibrio il volume della parte dell'oggetto emergente dall'acqua vale: A) 0,3 litri B) 0,7 decimetri cubi C) 3 centilitri D) nessuna delle precedenti affermazioni è corretta 17) Il secondo principio della termodinamica stabilisce che: A) i cambiamenti di stato non dipendono dal tipo di trasformazione B) è possibile trasformare integralmente calore in lavoro C) non è possibile trasformare integralmente calore in lavoro in una trasformazione ciclica D) l'energia si conserva 18) Il pianeta Mercurio compie un'orbita ellittica intorno al Sole. Nel moto del pianeta rimane costante: A) la sua energia meccanica totale B) la sua energia cinetica C) l'energia cinetica e la quantità di moto D) la sua quantità di moto 19) Pensando ai raggi X e ai raggi Gamma, trovate la CORRETTA proposizione. A) essi sono entrambi onde elettromagnetiche B) i raggi X sono più lenti dei raggi Gamma C) non si possono usare in Medicina D) gli X sono visibili dall'occhio i Gamma no 20) Un raggio di luce bianca viene decomposto nelle sue componenti cromatiche quando passa attraverso un prisma di vetro. Ciò avviene perché: A) l'indice di rifrazione dipende dalla lunghezza d'onda B) il vetro ha una diversa trasparenza per i diversi colori C) la velocità della luce è inferiore nel vetro rispetto alla velocità nell'aria D) nessuna delle precedenti possibilità è corretta
5 CHIMICA 21) Gli atomi di tutti gli elementi appartenenti allo stesso gruppo di elementi nella Tavola Periodica hanno lo stesso numero di: A) elettroni B) neutroni C) elettroni del guscio esterno D) protoni 22) Gli ioni sono: A) particelle costituenti il nucleo atomico B) atomi con numero elevato di neutroni C) atomi in cui elettroni e protoni sono presenti in numero diverso D) sostanze radioattive 23) Una soluzione acquosa di cloruro di sodio contiene 5x10-3 moli in 50 cm 3. La molarità è: A) B) 5x10-2 C) 5.0 D) ) La formula dell anidride carbonica è A) CO B) CH4 C) H2CO3 D) CO 2 25) La concentrazione molale corrisponde a: A) numero di moli di soluto in 100 moli di solvente B) numero di grammi di soluto in 1 kg di soluzione C) numero di moli di soluto in 1 kg di solvente D) numero di moli di soluto in un litro di soluzione 26) Nella reazione Zn + FeCl2 ZnCl2 + Fe la specie chimica che si riduce è: A) Zn B) Cl C) non si tratta di una reazione di ossidoriduzione D) Fe 27) Un acido organico è caratterizzato dal gruppo A) -C=O B) -COOH C) -C=OH D) -CHO 28) A quale volume bisogna diluire 10 ml di HNO3 4 M per ottenere HNO3 0.1 M? A) 200 ml B) 40 ml C) 400 ml D) 80 ml 29) Un valore positivo della variazione di energia libera indica che la reazione è: A) spontanea B) non spontanea C) endotermica D) esotermica 30) Un acido è una sostanza che: A) si dissocia in acqua liberando ioni idrogeno B) reagisce con l'acqua liberando idrogeno C) reagisce con l'ossigeno per formare acqua D) si dissocia in acqua liberando ioni ossidrile
6 BIOLOGIA 31) Gli organi femminili del fiore si chiamano: A) antere B) stami C) pistilli D) petali 32) Gli elementi chimici più abbondanti della materia vivente sono: A) carbonio - azoto - calcio - ossigeno B) carbonio - idrogeno - ossigeno - azoto C) carbonio - ossigeno - idrogeno - potassio D) carbonio - fosforo - potassio - calcio 33) Considerando un elefante e una formica, quale di queste affermazioni è VERA? A) le cellule dell'elefante sono più grandi di quelle della formica B) le cellule dell'elefante sono più complesse di quelle della formica C) l'elefante contiene un maggior numero di cellule D) la formica ha cellule più piccole 34) Identificare l'affermazione sbagliata. La selezione naturale: A) preserva le caratteristiche favorevoli ed elimina quelle sfavorevoli B) può determinare un cambiamento di frequenze alleliche C) agisce sul processo evolutivo con un meccanismo diverso dalla deriva genetica D) preserva le caratteristiche indotte dall'ambiente durante la vita di un individuo 35) Le sostanze più rappresentate nella membrana cellulare sono: A) lipidi e proteine B) enzimi e lipidi C) polisaccaridi e proteine D) zuccheri e lipidi 36) La fermentazione è un processo che A) richiede ossigeno B) porta alla sintesi di glucosio C) non richiede ossigeno D) fa parte delle reazioni anaboliche 37) Un enzima serve a: A) mantenere il ph costante B) catalizzare una reazione C) controllare il metabolismo cellulare D) modificare una proteina 38) Il parassita Plasmodium falciparum, agente della malaria, è: A) un insetto del genere Anopheles B) un batterio C) un virus D) un protozoo 39) I globuli rossi hanno vita assai breve. Vengono distrutti: A) nel fegato e nella milza B) nel miocardio C) nel midollo spinale D) nei reni 40) In seguito a divisione meiotica una cellula con 20 cromosomi darà luogo a cellule con: A) 5 cromosomi B) 10 cromosomi C) 20 cromosomi D) 40 cromosomi
Università degli Studi di Udine PROVA DI ACCESSO. Corso di Laurea in Allevamento e Salute Animale A.A. 2014/15
 Università degli Studi di Udine PROVA DI ACCESSO Corso di Laurea in Allevamento e Salute Animale A.A. 2014/15 PROVA DEL GIORNO 08/09/2014 TEST A TEMPO A DISPOSIZIONE: 1 ora RISPOSTA ESATTA: RISPOSTA NON
Università degli Studi di Udine PROVA DI ACCESSO Corso di Laurea in Allevamento e Salute Animale A.A. 2014/15 PROVA DEL GIORNO 08/09/2014 TEST A TEMPO A DISPOSIZIONE: 1 ora RISPOSTA ESATTA: RISPOSTA NON
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Simulazione test di ingresso Ingegneria Industriale Viterbo. Quesiti di Logica, Chimica e Fisica. Logica
 Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come continua questa serie di numeri? 1-4 - 10-22 - 46-94 -... A) 188 B) 190 C) 200 D) 47 L2
Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come continua questa serie di numeri? 1-4 - 10-22 - 46-94 -... A) 188 B) 190 C) 200 D) 47 L2
CORSO DI LAUREA IN FISICA ANNO ACCADEMICO 2013-14 PROVA DI INGRESSO
 CORSO DI LAUREA IN FISICA ANNO ACCADEMICO 2013-14 PROVA DI INGRESSO 20 Settembre 2013 Fisica 1. La figura è una vista dall alto di quattro scatole identiche, S 1, S 2, S 3, S 4, appoggiate su un piano
CORSO DI LAUREA IN FISICA ANNO ACCADEMICO 2013-14 PROVA DI INGRESSO 20 Settembre 2013 Fisica 1. La figura è una vista dall alto di quattro scatole identiche, S 1, S 2, S 3, S 4, appoggiate su un piano
BIOLOGIA. 10) Quale dei seguenti organismi è sprovvisto di vertebre? a) vipera b) squalo c) aragosta d) salamandra
 BIOLOGIA 1) I carboidrati sono costituiti da: a) carbonio, idrogeno ed ossigeno b) carbonio ed idrogeno c) carbonio, idrogeno ed azoto d) carbonio, ossigeno ed azoto 2) In che cosa il DNA si differenzia
BIOLOGIA 1) I carboidrati sono costituiti da: a) carbonio, idrogeno ed ossigeno b) carbonio ed idrogeno c) carbonio, idrogeno ed azoto d) carbonio, ossigeno ed azoto 2) In che cosa il DNA si differenzia
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI
 Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail danidvd@hotmail.it daniela.devita@uniroma1.it
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail danidvd@hotmail.it daniela.devita@uniroma1.it
Unità di misura. Perché servono le unità di misura nella pratica di laboratorio e in corsia? Le unità di misura sono molto importanti
 Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
10) Se ad una soluzione aumentiamo la temperatura cosa succede? Dire quale delle seguenti affermazioni è corretta.
 Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: mail@antoniotucci.net - www.agora.lesina.org
Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: mail@antoniotucci.net - www.agora.lesina.org
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
ENERGIA NELLE REAZIONI CHIMICHE
 ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
IL SISTEMA INTERNAZIONALE DI MISURA
 IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
Simulazione test di ingresso Ingegneria Industriale Viterbo. Quesiti di Logica, Chimica e Fisica. Logica
 Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di numeri? 9, 16, 25, 36,... A) 47 B) 49 C) 48 D) 45 L2 - Quale
Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di numeri? 9, 16, 25, 36,... A) 47 B) 49 C) 48 D) 45 L2 - Quale
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
INDIRIZZO TECNOLOGICO CLASSE A033 n. 2
 INDIRIZZO TECNOLOGICO CLASSE A033 n. 2 1) La tensione di rete domestica è in Italia di 230 V. In una stanza è accesa una lampada di 100W, in un altra stanza una lampada di 200W. L intensità di corrente
INDIRIZZO TECNOLOGICO CLASSE A033 n. 2 1) La tensione di rete domestica è in Italia di 230 V. In una stanza è accesa una lampada di 100W, in un altra stanza una lampada di 200W. L intensità di corrente
Termodinamica. Sistema termodinamico. Piano di Clapeyron. Sistema termodinamico. Esempio. Cosa è la termodinamica? TERMODINAMICA
 Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Elettricità e magnetismo
 E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
Esercizi di Chimica (2 a prova in itinere)
 Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
Corso di Laurea in Matematica Prova di orientamento. Questionario 3
 Università Roma Tre Facoltà di Scienze M.F.N. Corsi di Studio in Matematica Corso di Laurea in Matematica Prova di orientamento Questionario 3 Questionario preparato per consentire la autovalutazione in
Università Roma Tre Facoltà di Scienze M.F.N. Corsi di Studio in Matematica Corso di Laurea in Matematica Prova di orientamento Questionario 3 Questionario preparato per consentire la autovalutazione in
ESAME DI AMMISSIONE AL COLLEGIO INTERNAZIONALE CA FOSCARI PER L ANNO ACCADEMICO 2015/2016 VENEZIA, MERCOLEDÍ 06 MAGGIO 2015 TEST DI ECONOMIA
 ESAME DI AMMISSIONE AL COLLEGIO INTERNAZIONALE CA FOSCARI PER L ANNO ACCADEMICO 2015/2016 VENEZIA, MERCOLEDÍ 06 MAGGIO 2015 TEST DI ECONOMIA Domanda 1. Se il valore della valuta nazionale in termini di
ESAME DI AMMISSIONE AL COLLEGIO INTERNAZIONALE CA FOSCARI PER L ANNO ACCADEMICO 2015/2016 VENEZIA, MERCOLEDÍ 06 MAGGIO 2015 TEST DI ECONOMIA Domanda 1. Se il valore della valuta nazionale in termini di
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
ESEMPI DI TEST DI INGRESSO FISICA 2010 G. Selvaggi, R. Stella Dipartimento Interateneo di fisica di Fisica 3 marzo 2010
 ESEMPI DI TEST DI INGRESSO FISICA 2010 G. Selvaggi, R. Stella Dipartimento Interateneo di fisica di Fisica 3 marzo 2010 1 Fisica 1. Un ciclista percorre 14.4km in mezz ora. La sua velocità media è a. 3.6
ESEMPI DI TEST DI INGRESSO FISICA 2010 G. Selvaggi, R. Stella Dipartimento Interateneo di fisica di Fisica 3 marzo 2010 1 Fisica 1. Un ciclista percorre 14.4km in mezz ora. La sua velocità media è a. 3.6
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
I SISTEMI DI UNITA DI MISURA
 Provincia di Reggio Calabria Assessorato all Ambiente Corso di Energy Manager Maggio - Luglio 2008 I SISTEMI DI UNITA DI MISURA Ilario De Marco Il sistema internazionale di unità di misura Lo studio di
Provincia di Reggio Calabria Assessorato all Ambiente Corso di Energy Manager Maggio - Luglio 2008 I SISTEMI DI UNITA DI MISURA Ilario De Marco Il sistema internazionale di unità di misura Lo studio di
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
Note a cura di M. Martellini e M. Zeni
 Università dell Insubria Corso di laurea Scienze Ambientali FISICA GENERALE Lezione 6 Energia e Lavoro Note a cura di M. Martellini e M. Zeni Queste note sono state in parte preparate con immagini tratte
Università dell Insubria Corso di laurea Scienze Ambientali FISICA GENERALE Lezione 6 Energia e Lavoro Note a cura di M. Martellini e M. Zeni Queste note sono state in parte preparate con immagini tratte
TEST BIOLOGIA 1 ANNO ABEI Da inviare a connesso@alice.it entro e non oltre il 6 novembre 2015
 1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
BIOLOGIA GENERALE 22-24 ottobre 2007
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Il potenziale a distanza r da una carica puntiforme è dato da V = kq/r, quindi è sufficiente calcolare V sx dovuto alla carica a sinistra:
 1. Esercizio Calcolare il potenziale elettrico nel punto A sull asse di simmetria della distribuzione di cariche in figura. Quanto lavoro bisogna spendere per portare una carica da 2 µc dall infinito al
1. Esercizio Calcolare il potenziale elettrico nel punto A sull asse di simmetria della distribuzione di cariche in figura. Quanto lavoro bisogna spendere per portare una carica da 2 µc dall infinito al
Progetto Pilota Valutazione della scuola italiana. Anno Scolastico 2002 2003 PROVA DI MATEMATICA. Scuola Secondaria Superiore.
 Gruppo di lavoro per la predisposizione degli indirizzi per l attuazione delle disposizioni concernenti la valutazione del servizio scolastico Progetto Pilota Valutazione della scuola italiana Anno Scolastico
Gruppo di lavoro per la predisposizione degli indirizzi per l attuazione delle disposizioni concernenti la valutazione del servizio scolastico Progetto Pilota Valutazione della scuola italiana Anno Scolastico
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Prova di recupero del debito formativo di matematica 02/11/09 A
 Prova di recupero del debito formativo di matematica 02/11/09 A Barrare la risposta esatta. Per ogni quesito, la risposta esatta è unica. Ogni risposta esatta vale un punto, ogni risposta errata comporta
Prova di recupero del debito formativo di matematica 02/11/09 A Barrare la risposta esatta. Per ogni quesito, la risposta esatta è unica. Ogni risposta esatta vale un punto, ogni risposta errata comporta
1. Distribuzioni campionarie
 Università degli Studi di Basilicata Facoltà di Economia Corso di Laurea in Economia Aziendale - a.a. 2012/2013 lezioni di statistica del 3 e 6 giugno 2013 - di Massimo Cristallo - 1. Distribuzioni campionarie
Università degli Studi di Basilicata Facoltà di Economia Corso di Laurea in Economia Aziendale - a.a. 2012/2013 lezioni di statistica del 3 e 6 giugno 2013 - di Massimo Cristallo - 1. Distribuzioni campionarie
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
Tesina di scienze. L Elettricità. Le forze elettriche
 Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Definiamo Entalpia la funzione: DH = DU + PDV. Variando lo stato del sistema possiamo misurare la variazione di entalpia: DU = Q - PDV.
 Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI
 RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI Autore: Andrea Peluso INTRODUZIONE: La riduzione delle cloroammine in piscina tramite l utilizzo di raggi ultravioletti è una pratica
RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI Autore: Andrea Peluso INTRODUZIONE: La riduzione delle cloroammine in piscina tramite l utilizzo di raggi ultravioletti è una pratica
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
Due applicazioni dei logaritmi
 Due applicazioni dei logaritmi 22 febbraio 203 I logaritmi vengono usati per trattare grandezze che presentano ampie variazioni su un intervallo di diversi ordini di grandezze; il ph ne è un esempio. Il
Due applicazioni dei logaritmi 22 febbraio 203 I logaritmi vengono usati per trattare grandezze che presentano ampie variazioni su un intervallo di diversi ordini di grandezze; il ph ne è un esempio. Il
DETERMINAZIONI SPERIMENTALI ED ERRORI. confrontare quella grandezza con un'altra di riferimento, ad essa omogenea, detta unità di misura.
 DETERMINAZIONI SPERIMENTALI ED ERRORI MISURARE UNA GRANDEZZA = confrontare quella grandezza con un'altra di riferimento, ad essa omogenea, detta unità di misura. LUNGHEZZA metro (m) distanza percorsa dalla
DETERMINAZIONI SPERIMENTALI ED ERRORI MISURARE UNA GRANDEZZA = confrontare quella grandezza con un'altra di riferimento, ad essa omogenea, detta unità di misura. LUNGHEZZA metro (m) distanza percorsa dalla
Tecniche di microscopia
 Tecniche di microscopia I microscopi permettono di vedere l estremamente piccolo I microscopi ottici utilizzano lenti di vetro in grado di deflettere e focalizzare i raggi luminosi per riprodurre le immagini
Tecniche di microscopia I microscopi permettono di vedere l estremamente piccolo I microscopi ottici utilizzano lenti di vetro in grado di deflettere e focalizzare i raggi luminosi per riprodurre le immagini
Unità di misura e formule utili
 Unità di misura e formule utili Lezione 7 Unità di misura Il Sistema Internazionale di unità di misura (SI) nasce dall'esigenza di utilizzare comuni unità di misura per la quantificazione e la misura delle
Unità di misura e formule utili Lezione 7 Unità di misura Il Sistema Internazionale di unità di misura (SI) nasce dall'esigenza di utilizzare comuni unità di misura per la quantificazione e la misura delle
Sommario Ottica geometrica... 2 Principio di Huygens-Fresnel... 4 Oggetto e immagine... 6 Immagine reale... 7 Immagine virtuale...
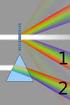 IMMAGINI Sommario Ottica geometrica... 2 Principio di Huygens-Fresnel... 4 Oggetto e immagine... 6 Immagine reale... 7 Immagine virtuale... 9 Immagini - 1/11 Ottica geometrica È la branca dell ottica che
IMMAGINI Sommario Ottica geometrica... 2 Principio di Huygens-Fresnel... 4 Oggetto e immagine... 6 Immagine reale... 7 Immagine virtuale... 9 Immagini - 1/11 Ottica geometrica È la branca dell ottica che
SCIENZE INTEGRATE FISICA
 CLASSE DISCIPLINA ORE SETTIMANALI TIPO DI PROVA PER GIUDIZIO SOSPESO MODULO 1: Il moto e l energia I concetti di sistema di riferimento e le grandezze cinematiche. I diversi tipi di rappresentazione del
CLASSE DISCIPLINA ORE SETTIMANALI TIPO DI PROVA PER GIUDIZIO SOSPESO MODULO 1: Il moto e l energia I concetti di sistema di riferimento e le grandezze cinematiche. I diversi tipi di rappresentazione del
FAM. 1. Sistema composto da quattro PM come nella tabella seguente
 Serie 11: Meccanica IV FAM C. Ferrari Esercizio 1 Centro di massa: sistemi discreti Determina il centro di massa dei seguenti sistemi discreti. 1. Sistema composto da quattro PM come nella tabella seguente
Serie 11: Meccanica IV FAM C. Ferrari Esercizio 1 Centro di massa: sistemi discreti Determina il centro di massa dei seguenti sistemi discreti. 1. Sistema composto da quattro PM come nella tabella seguente
= 9,3 10-5 M = 1,05 10-5 M
 - Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
- Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
RADIAZIONI RADIAZIONI IONIZZANTI RADIAZIONI IONIZZANTI
 RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
SSIS Sezione di Cagliari INDIRIZZO FISICO-MATEMATICO-INFORMATICO. Selezione a.a. 2002/2003
 SSIS Sezione di Cagliari INDIRIZZO FISICO-MATEMATICO-INFORMATICO Selezione a.a. 2002/2003 DOMANDE COMUNI PER INDIRIZZO 1. Quanto vale (in radianti) la somma degli angoli interni del poligono a forma di
SSIS Sezione di Cagliari INDIRIZZO FISICO-MATEMATICO-INFORMATICO Selezione a.a. 2002/2003 DOMANDE COMUNI PER INDIRIZZO 1. Quanto vale (in radianti) la somma degli angoli interni del poligono a forma di
Prova Scritta Completa-Fisica 9 CFU Corso di Laurea in Tossicologia dell ambiente e degli alimenti Novembre 2013
 Prova Scritta Completa-Fisica 9 CFU Corso di Laurea in Tossicologia dell ambiente e degli alimenti Novembre 2013 Quesito 1 Due cubi A e B costruiti con lo stesso legno vengono trascinati sullo stesso pavimento.
Prova Scritta Completa-Fisica 9 CFU Corso di Laurea in Tossicologia dell ambiente e degli alimenti Novembre 2013 Quesito 1 Due cubi A e B costruiti con lo stesso legno vengono trascinati sullo stesso pavimento.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012)
 CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
Q 1 = +3 10-5 C carica numero 1 Q 2 = +4 10-5 C carica numero 2 forza esercitata tra le cariche distanza tra le cariche, incognita
 Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
IDROGENO IN PRATICA. del gruppo degli allievi del Volta. Laboratorio di chimica I.T. I. Volta
 IDROGENO IN PRATICA Pratiche di laboratorio su iniziative del gruppo degli allievi del Volta Laboratorio di chimica I.T. I. Volta da: L Isola Misteriosa Giulio Verne 1874 Senza il carbone non ci sarebbero
IDROGENO IN PRATICA Pratiche di laboratorio su iniziative del gruppo degli allievi del Volta Laboratorio di chimica I.T. I. Volta da: L Isola Misteriosa Giulio Verne 1874 Senza il carbone non ci sarebbero
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
Coordinate Cartesiane nel Piano
 Coordinate Cartesiane nel Piano O = (0,0) origine degli assi ascissa, y ordinata sistemi monometrici: stessa unità di misura sui due assi, y sistemi dimetrici: unità di misura diverse sui due assi (spesso
Coordinate Cartesiane nel Piano O = (0,0) origine degli assi ascissa, y ordinata sistemi monometrici: stessa unità di misura sui due assi, y sistemi dimetrici: unità di misura diverse sui due assi (spesso
Università degli Studi di Verona Corsi di Laurea in Matematica Applicata, Informatica e Informatica Multimediale. Test di autovalutazione (matematica)
 Università degli Studi di Verona Corsi di Laurea in Matematica Applicata, Informatica e Informatica Multimediale Test di autovalutazione (matematica) 1. Eseguendo la divisione con resto di 3437 per 225
Università degli Studi di Verona Corsi di Laurea in Matematica Applicata, Informatica e Informatica Multimediale Test di autovalutazione (matematica) 1. Eseguendo la divisione con resto di 3437 per 225
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
Volume. Unità accettata dal SI è il L (litro) Lunghezza = 1 dimensione Superficie = 2 dimensioni Volume = 3 dimensioni
 Il volume è lo spazio occupato da un corpo oppure la capacità di un contenitore. E una grandezza derivata estensiva, simbolo V, equazione dimensionale [V] = [l 3 ]. L unità di misura SI è il m 3 (metro
Il volume è lo spazio occupato da un corpo oppure la capacità di un contenitore. E una grandezza derivata estensiva, simbolo V, equazione dimensionale [V] = [l 3 ]. L unità di misura SI è il m 3 (metro
Elenco Ordinato per Materia Chimica
 ( [B,25404] Perché le ossa degli uccelli sono pneumatiche, cioè ripiene di aria? C (A) per consentire i movimenti angolari (B) per immagazzinare come riserva di ossigeno X(C) per essere più leggere onde
( [B,25404] Perché le ossa degli uccelli sono pneumatiche, cioè ripiene di aria? C (A) per consentire i movimenti angolari (B) per immagazzinare come riserva di ossigeno X(C) per essere più leggere onde
April 11, 2011. Fisica Nucleare. Monica Sambo. Sommario. Introduzione. Radioattivitá. Fisica del nucleo. Bibliografia. Esempio. Raggi emessi Esempio
 April 11, 2011 1 2 3 4 Indicando con Z il numero dei protoni (numero atomico dell atomo) e con N il numero dei neutroni si definisce A il numero di massa del : A = Z + N (1) Nei nuclei leggeri si ha la
April 11, 2011 1 2 3 4 Indicando con Z il numero dei protoni (numero atomico dell atomo) e con N il numero dei neutroni si definisce A il numero di massa del : A = Z + N (1) Nei nuclei leggeri si ha la
IL CAMPO MAGNETICO. V Scientifico Prof.ssa Delfino M. G.
 IL CAMPO MAGNETICO V Scientifico Prof.ssa Delfino M. G. UNITÀ - IL CAMPO MAGNETICO 1. Fenomeni magnetici 2. Calcolo del campo magnetico 3. Forze su conduttori percorsi da corrente 4. La forza di Lorentz
IL CAMPO MAGNETICO V Scientifico Prof.ssa Delfino M. G. UNITÀ - IL CAMPO MAGNETICO 1. Fenomeni magnetici 2. Calcolo del campo magnetico 3. Forze su conduttori percorsi da corrente 4. La forza di Lorentz
PROGRAMMA DI SCIENZE Cl. II sez. E A.S. 2014/2015. Testo: S. Passannanti C. Sbriziolo Noi e la chimica Dai fenomeni alle leggi Ed.
 PROGRAMMA DI SCIENZE Cl. II sez. E A.S. 2014/2015 CHIMICA Testo: S. Passannanti C. Sbriziolo Noi e la chimica Dai fenomeni alle leggi Ed. Tramontana S. Passannanti C. Sbriziolo Noi e la chimica agli atomi
PROGRAMMA DI SCIENZE Cl. II sez. E A.S. 2014/2015 CHIMICA Testo: S. Passannanti C. Sbriziolo Noi e la chimica Dai fenomeni alle leggi Ed. Tramontana S. Passannanti C. Sbriziolo Noi e la chimica agli atomi
Giochi della Chimica 1988 Fase regionale Classi A e B
 Giochi della Chimica 1988 Fase regionale Classi A e B 1. Il diagramma indica la variazione dell'energia potenziale di un sistema durante il decorso di una reazione: A + B C + D Quale, fra le seguenti affermazioni,
Giochi della Chimica 1988 Fase regionale Classi A e B 1. Il diagramma indica la variazione dell'energia potenziale di un sistema durante il decorso di una reazione: A + B C + D Quale, fra le seguenti affermazioni,
Gas perfetti e sue variabili
 Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER:
 ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER: CORSO DI LAUREA TRIENNALE IN SCIENZE E TECNOLOGIE PER LO STUDIO E LA CONSERVAZIONE DEI BENI CULTURALI E DEI SUPPORTI DELLA
ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER: CORSO DI LAUREA TRIENNALE IN SCIENZE E TECNOLOGIE PER LO STUDIO E LA CONSERVAZIONE DEI BENI CULTURALI E DEI SUPPORTI DELLA
ossigeno e ne facilita la diffusione dai capillari all ambiente intracellulare.
 Ricostituzione e attività pseudoenzimatica della mioglobina modificata Giulia Bertelegni e Carolina Ferrari I.I.S. A.Maserati Facoltà di Scienze MM.FF.NN. Dipartimento di Chimica generale Università degli
Ricostituzione e attività pseudoenzimatica della mioglobina modificata Giulia Bertelegni e Carolina Ferrari I.I.S. A.Maserati Facoltà di Scienze MM.FF.NN. Dipartimento di Chimica generale Università degli
a. 10 4 b. 10-15 c. 10 25 d. 10-4 a. 4,375 10-7 b. 3,625 10-6 c. 4,375 10 2 d. nessuno dei precedenti valori a. 10-5 b. 10 +5 c. 10 +15 d.
 1) Il valore di 5 10 20 è: a. 10 4 b. 10-15 c. 10 25 d. 10-4 2) Il valore del rapporto (2,8 10-4 ) / (6,4 10 2 ) è: a. 4,375 10-7 b. 3,625 10-6 c. 4,375 10 2 d. nessuno dei precedenti valori 3) La quantità
1) Il valore di 5 10 20 è: a. 10 4 b. 10-15 c. 10 25 d. 10-4 2) Il valore del rapporto (2,8 10-4 ) / (6,4 10 2 ) è: a. 4,375 10-7 b. 3,625 10-6 c. 4,375 10 2 d. nessuno dei precedenti valori 3) La quantità
7.4 Proprietà delle Molecole Chirali: Attvità Ottica
 7.4 Proprietà delle Molecole Chirali: Attvità Ottica Una sostanza è attiva otticamente se ruota la luce polarizzata Attività Ottica Affinchè una sostanza esibisca attività ottica, essa deve essere chirale
7.4 Proprietà delle Molecole Chirali: Attvità Ottica Una sostanza è attiva otticamente se ruota la luce polarizzata Attività Ottica Affinchè una sostanza esibisca attività ottica, essa deve essere chirale
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
... corso di chimica elettrochimica 1
 ... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
Forze come grandezze vettoriali
 Forze come grandezze vettoriali L. Paolucci 23 novembre 2010 Sommario Esercizi e problemi risolti. Per la classe prima. Anno Scolastico 2010/11 Parte 1 / versione 2 Si ricordi che la risultante di due
Forze come grandezze vettoriali L. Paolucci 23 novembre 2010 Sommario Esercizi e problemi risolti. Per la classe prima. Anno Scolastico 2010/11 Parte 1 / versione 2 Si ricordi che la risultante di due
Scuola Media Piancavallo 2
 LA CELLULA Una caratteristica di quasi tutti gli esseri viventi è quella di possedere una struttura più o meno complessa in cui parti diverse, gli organi, sono adatte a svolgere funzioni specifiche. Il
LA CELLULA Una caratteristica di quasi tutti gli esseri viventi è quella di possedere una struttura più o meno complessa in cui parti diverse, gli organi, sono adatte a svolgere funzioni specifiche. Il
Classificazione della materia: Sostanze pure e miscugli
 Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Teoria in sintesi 10. Attività di sportello 1, 24 - Attività di sportello 2, 24 - Verifica conclusiva, 25. Teoria in sintesi 26
 Indice L attività di recupero 6 Funzioni Teoria in sintesi 0 Obiettivo Ricerca del dominio e del codominio di funzioni note Obiettivo Ricerca del dominio di funzioni algebriche; scrittura del dominio Obiettivo
Indice L attività di recupero 6 Funzioni Teoria in sintesi 0 Obiettivo Ricerca del dominio e del codominio di funzioni note Obiettivo Ricerca del dominio di funzioni algebriche; scrittura del dominio Obiettivo
A livello della loro struttura chimica, come i grassi, anche i carboidrati sono composti ternari, formati cioè da tre molecole:
 I carboidrati costituiscono la fonte di energia principale per lo svolgimento di tutte le funzioni organiche (mantenimento della temperatura corporea, battito cardiaco, funzioni cerebrali, digestione,
I carboidrati costituiscono la fonte di energia principale per lo svolgimento di tutte le funzioni organiche (mantenimento della temperatura corporea, battito cardiaco, funzioni cerebrali, digestione,
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari.
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
