STEREOCHIMICA C OH CH 2 CH in questo caso nessuna rotazione è in grado di far sovrapporre perfettamente le due strutture
|
|
|
- Giuliano Genovese
- 8 anni fa
- Visualizzazioni
Transcript
1 TEEIMIA TEEIMEI Due stereoisomeri sono sostanze diverse che hanno in comune sia la formula bruta che la formula di costituzione. osa li rende diversi allora? Una differente orientazione tridimensionale dei loro atomi nello spazio DIVEITA' DI DUE TANZE Per capire bene questo concetto dobbiamo per prima cosa capire cosa sono due sostanze diverse: sono due sostanze non sovrapponibili e non facilmente interconvertibili. 180 anche se scritte così sembrano due sostanze diverse, in realtà sono sovrapponibili. Basta ruotare la molecola di destra di 180 lungo l'asse indicato per vederlo in questo caso nessuna rotazione è in grado di far sovrapporre perfettamente le due strutture Queste due strutture non sono sovrapponibili, ma si interconvertono velocemente l'una nell'altra. ono pertanto due conformeri e non due composti differenti ENANTIMEI E DIATEEIMEI e due stereoisomeri sono l'uno l'immagine speculare dell'altro sono detti enantiomeri. Altrimenti sono detti diastereoisomeri. 2 i due enantiomeri del butanolo Brown, pag. 92
2 IEPILG DEI VAI TIPI DI IMEI IMEI composti differenti con la stessa formula bruta diversa formula di costituzione uguale formula di costituzione IMEI DI TITUZINE isomeri con un ordine diverso con cui sono legati gli atomi nelle molecole TEEIMEI isomeri con uguale formula di costituzione, ma con una differenze disposizione spaziale degli atomi o gruppi che li compongono ENANTIMEI stereoisomeri che sono l'uno l'immagine speculare dell'altro DIATEEIMEI stereoisomeri che non sono l'uno l'immagine speculare dell'altro IALITA' Qualunque oggetto (e quindi qualunque molecola) ha un'immagine speculare (con l'eccezione dei vampiri). Alcuni oggetti sono però identici (sovrapponibili) alla propria immagine speculare. Altri oggetti non sono identici (sovrapponibili) alla propria immagine speculare. I primi vengono detti achirali I secondi vengono detti chirali olo le molecole chirali possono avere un enantiomero. La presenza di un piano di simmetria è condizione sufficiente affinché un oggetto (o una molecola) sia achirale. Tuttavia (anche se non molto frequentemente) vi sono oggetti o molecole achirali prive di un piano di simmetria Brown, pag. 92-9
3 Esempi di oggetti achirali ha infiniti piani di simmetria ha un piano di simmetria Esempi di oggetti chirali Ma quando una molecola è chirale? La più comune causa di chiralità è la presenza di un centro stereogenico (o stereocentro). Uno stereocentro è di solito un atomo di carbonio tetraderico portante 4 sostituenti diversi. il carbonio in 2 del 2-butanolo è un carbonio stereogenico. Infatti porta 4 sostituenti diversi: - 1 idrogeno gruppo - 1 gruppo - 1 gruppo 2 i noti che basta che 2 dei 4 sostituenti ad un carbonio tetraedrico siano uguali per avere un piano di simmetria Ad es. nel clorobromometano vi è un piano di simmetria che passa per i due carboni, per l'ossigeno e che biseca i due idrogeni. Il clorobromometano ha un piano di simmetria ed è perciò achirale Brown, pag. 92-9
4 NTAZINI DI NFIGUAZINE ALUTA: IL ITEMA, Due stereoisomeri, avendo la stessa formula di costituzione, avranno lo stesso nome IUPA. Per distinguerli e designarli in modo univoco è necessario utilizzare una nomenclatura specifica. Il sistema più razionale ed universalmente accettato è quello di ahn, Ingold e Prelog. A) Dare un ordine di priorità ai 4 gruppi legati allo stereocentro. i opera secondo queste regole 1) 2) ) 4) i guarda il primo atomo legato allo stereocentro. a maggiore priorità il gruppo con l'atomo con il più alto numero atomico (<<N<<F<P<<l<Br<I) In caso di parità, si guardano i set di atomi legati al primo atomo. gni set sarà dato da tre atomi. I set vengono messi in ordine inverso di numero atomico e confrontati fino al primo punto di differenza. In caso di ulteriore parità si procede ad esaminare i set di atomi legati al primo membro dei set equivalenti e così via. Un caso speciale è rappresentato dai carboni coinvolti in un doppio o triplo legame. In questo caso il set di atomi legati non ha membri. Per convenzione si "raddoppia" l'atomo legato con doppio legame e si "triplica" quello legato con triplo legame. B) ) i dispone la molecola in modo che il gruppo con priorità più bassa sia diretto lontano dall'osservatore. I rimanenti tre verranno tutti verso l'osservatore i esegue una rotazione per passare dal gruppo 1 al 2 e poi al. e la rotazione è oraria, la notazione sarà (rectus, destra). e antioraria la notazione sarà (sinister, sinistra) NFIGUAZINE on il termine configurazione si intende la disposizione spaziali dei sostituenti intorno allo stereocentro. Per ogni stereocentro esistono solo 2 configurazioni IMPTANTE e si scambiano di posto due sostituenti, la configurazione si inverte. e si eseguono due scambi la configurazione rimane la stessa Brown, pag
5 Esempi L'ordine di priorità è Infatti gli atomi legati allo stereocentro sono: > = > Per decidere la priorità tra i gruppi 2 e dobbiamo osservare i set di atomi legati al carbonio: arbonio di destra: arbonio di sinistra: tabilita la priorità bisogna ruotare la molecola in modo che l'idrogeno (priorità più bassa) vada dietro: 2 2 la configurazione è N 1 2 I due set per i carboni legati al centro stereogenico sono arbonio in alto: arbonio in basso: "vince" questo set la configurazione è configurazione??? 2 N configurazione I due set per i carboni legati al centro stereogenico sono arbonio di destra: arbonio di sinistra: "vince" questo set Brown, pag
6 MLELE N DUE PIU' ENTI AIMMETII * * 2 emplicemente osservando la formula di costituzione possiamo individuare i centri stereogenici, indicati con asterischi. 2,,4-Triidrossibutanale gni centro stereogenico può avere 2 configurazioni. Le combinazioni possibili saranno perciò 4: 2, 2, 2, 2, In generale, il numero degli stereoisomeri è pari a 2 n dove n è il numero di stereocentri. enantiomeri EITI diastereoisomeri diastereoisomeri diastereoisomeri diastereoisomeri Brown, pag. 99,100, 105 TEI Il nome IUPA è lo stesso per tutti e 4 (2,,4-Triidrossibutanale). Vengono identificati con le notazioni configurazionali. Queste sostanze hanno però anche un nome usuale, anzi due. enantiomeri importante: 2 enantiomeri devono avere tutte le configurazioni opposte! Quando una sostanza è biologicamente importante, tanto da meritare un nome usuale, è consuetudine dare lo stesso nome a due enantiomeri. Questo fatto ha una spiegazione logica. Due enantiomeri hanno infatti in comune quasi tutte le proprietà fisiche: energia, solubilità, punto di fusione, punto di ebollizione, pk a, etc. Danno identici spettri con le comune tecniche di analisi strumentale. anno identico comportamento cromatografico. Invece, due diastereoisomeri hanno diverse proprietà fisiche
7 ATTIVITA' TTIA Esiste però una proprietà fisica che consente di distinguere due enantiomeri: la rotazione del piano della luce polarizzata. iascun enantiomero, preso separatamente dall'altro, ha questa proprietà ed è perciò detto otticamente attivo. Due enantiomeri ruotano il piano della luce polarizzata di un angolo identico, ma in direzioni opposte. La cella contiene la sostanza come liquido puro o soluzione La luce della lampada è polarizzata lungo tutti i piani possibili L'analizzatore è un altro polarizzatore ruotabile Il polarizzatore fisso lascia passare solo la luce polarizzata su un piano specifico nessuna sostanza otticamente attiva l'analizzatore e il polarizzatore sono paralleli si osserva il massimo di luminosità nessuna sostanza otticamente attiva l'analizzatore e il polarizzatore sono perpendicolari si osserva il buio sostanza otticamente attiva l'analizzatore viene ruotato in modo da ripristinare la situazione di massima luminosità (polarimetri automatici) o di buio (polarimetri manuali) In questo esempio la rotazione necessaria per ripristinare la situazione iniziale è antioraria. Il segno del potere ottico sarà negativo Brown, pag. 105,106
8 PLAIMET MANUALE A DPPI ANALIZZATE I polarimetri manuali a singolo raggio utilizzano il metodo del minimo passaggio di luce (buio). Per avere maggiore sensibilità sono stati realizzati polarimetri a doppio analizzatore. In essi, grazie ad un opportuno sistema di lenti, il fascio di luce polarizzata, dopo aver attraversato la cella, viene sdoppiato, passando così per due analizzatori, posti a 90 tra di loro. I due analizzatori vengono ruotati insieme, mantenendo fisso l'angolo di 90 tra di loro. piano di polarizzazione della luce meno luminoso più luminoso analizzatore 1analizzatore 2 I due analizzatori hanno lo stesso angolo (45 ) con il piano di polarizzazione: l'intensità della luce che fuoriesce da essi è identica La sostanza otticamente attiva ha ruotato il piano di polarizzazione di 15 in senso orario. ra la luminosità che fuoriesce dai due analizzatori non è più identica L'angolo di rotazione del piano della luce polarizzata a di una sostanza chirale enantiomericamente pura dipende da: uotando gli analizzatori di 15, la luminosità che fuoriesce da essi torna ad essere uguale 1. La lunghezza d'onda della radiazione luminosa impiegata. 2. Il solvente utilizzato.. La temperatura. 4. La concentrazione del campione (vi è una relazione di proporzionalità diretta). 5. La lunghezza della cella che contiene il campione (vi è una relazione di proporzionalità diretta). immagine a due semicampi visibile nel polarimetro regolazione sbagliata regolazione esatta regolazione sbagliata per maggiore chiarezza, nel polarimetro Zeiss, la luce che fuoriesce dai due analizzatori viene visualizzata in un campo interno ed in un campo esterno Brown, pag. 106,107
9 La rotazione che viene determinata sperimentalmente al polarimetro è detta rotazione osservata (espressa in gradi). Per una maggiore uniformità è utile: Indicare le variabili non proporzionali (λ, Temp., solvente) Trasformare la rotazione osservata in una grandezza indipendente dalla concentrazione e dalla lunghezza della cella TAZINE PEIFIA [α] t λ dipende dalla lunghezza d'onda, dal solvente, dalla temperatura non dipende dalla concentrazione e dalla lunghezza della cella aso di un liquido puro: Ad una data λ ed a una data T, è [α] = α d l dove l = lunghezza della cella in dm d = densità del liquido Ad esempio per l'()-2-butanolo si ha Temperatura di misura [α] 20 D = + 1,9 (liquido puro) Lunghezza d'onda D = riga D del sodio = 589 nm aso di una soluzione: In questo caso, ad una data T e a una data λ, è [α] = α c l 100 dove c = concentr. in g / 100 ml l = lunghezza cella in dm Ad es.: ()-1-Feniletanolo α misurato = - 1,07 l cella = 1 dm c = 2.5 (= 2.5 g / 100 ml) [α] 20 D = - 42,8 (c 2.5, etanolo) Quando si misura un potere ottico rotatorio in soluzione, è essenziale determinare con precisione la concentrazione, facendo uso di bilancia di precisione (analitica) e matracci volumetrici tarati (pipette graduate, siringhe, etc. non sono sufficientemente precise) Brown, pag. 106,107
10 Due enantiomeri hanno rotazioni specifiche identiche come valore assoluto, ma di segno opposto. ltre che con le notazioni () ed (), due enantiomeri possono essere identificati tramite il segno del potere ottico rotatorio. ()-2-Butanolo oppure (+)-2-Butanolo oppure 2 ()-(+)-2-Butanolo (+) Destrogiro (-) Levogiro Importante differenza La notazione / necessita di conoscere la struttura, ma può essere stabilita semplicemente guardando la rappresentazione spaziale della molecola (senza condurre esperimenti) La notazione (+)/( ) non necessita di conoscere la struttura e viene stabilita sperimentalmente Non esiste alcuna relazione tra i due tipi di notazione: non è possibile dedurre la configurazione / dal segno del potere ottico rotatorio MIELE DI ENANTIMEI osa succede se ho una miscela di due enantiomeri? i possono presentare due casi: A) I due enantiomeri sono presenti in uguale quantità In tal caso si dice che si ha una miscela racemica. La rotazione specifica sarà = 0, come per una sostanza achirale: Una miscela racemica ha in generale le stesse proprietà fisiche dei singoli enantiomeri. ltre al potere ottico rotatorio, un'altra eccezione è costituita dal punto di fusione. Una miscela racemica può avere p.f. più alto o più basso rispetto ai singoli enantiomeri. B) I due enantiomeri sono presenti in diverse quantità In tal caso la miscela è ancora otticamente attiva, ma il potere ottico rotatorio specifico sarà più basso, in valore assoluto, rispetto a quello di un enantiomero puro. Dal potere ottico rotatorio specifico è possibile ricavare la proporzione dei due enantiomeri. dove A è [α] [A] [B] l'enantiomero più osservato P.. = = e.e. = abbondante e B è [α] quello meno enant. puro [A] + [B] abbondante % A = 1 + ee 100 = 1 + P P.. = purezza ottica e.e. = eccesso enantiomerico Brown, pag
11 esempio % 0% ()-2-Butanolo ()-2-Butanolo α 20 (mix) = 5,56 D [ -1,9(0,7) + 1,9(0,)] α 20 = D e.e. = P.. = α 20 = D [α] osservato [α] enant. puro 5.56 = 1.9 = 0,40 (40%) % = 1 + ee = 70% PIEZINI DI FIE E' una convenzione per rappresentare molecole chirali, utile soprattutto per sostanze acicliche con vari centri stereogenici (come i carboidrati) Bisogna orientare lo stereocentro in modo che due legami siano verticali e diretti lontano dall'osservatore e due legami siano orizzontali e diretti verso l'osservatore La determinazione della configurazione / partendo dalle Fischer è più difficile. i viene però 2 2 in aiuto una regoletta ()-2-butanolo ()-2-butanolo nella rappresentazione di Fischer a) tabilire l ordine di priorità dei sostituenti. b)passare da 1 a 2 a e determinare, dal verso di rotazione, una notazione o c)e il sostituente a priorità minore (4) è sulla linea verticale, la configurazione coincide con quella ottenuta in b). Altrimenti è opposta. ATTENZINE: le proiezioni di Fischer non possono essere ruotate arbitrariamente. L'unica rotazione permessa è la seguente rotazione di 180 lungo un asse perpendicolare al foglio 2 Invece, rotazioni di 90, o di 180 lungo gli altri due assi, porterebbero i legami orizzontali dietro e quelli verticali davanti Brown, pag
12 ENTI TEEGENII EQUIVALENTI Esiste un caso in cui l'equazione: n stereoisomeri = 2 n (n = numero di stereocentri) non è rispettata. iò si verifica quando due stereocentri sono equivalenti, ovvero quando i 4 sostituenti diversi legati a ciascuno di essi sono gli stessi 2 2 formula di costituzione dell' acido tartarico (ac. 2,-diidrossibutandioico) disegnamo nelle proiezioni di Fischer i 4 stereoisomeri teorici Le ultime due strutture sono speculari, ma sono anche sovrapponibili! (rotazione permessa) c'è in effetti un piano di simmetria p.f. = [α] D = Questo stereoisomero, achirale, è detto composto meso. L'acido tartarico ha quindi solo stereoisomeri (anziché 4): una coppia di enantiomeri ed il composto meso, che è diastereoisomero degli altri due 2 2 Acido (+)-tartarico p.f. = [α] D = Acido ( )-tartarico p.f. = [α] D = Acido meso-tartarico p.f. = [α] D = 0 Dei tre, il composto naturale è l'acido (+) tartarico, che si forma nelle botti o nelle bottiglie di vino ed è presente nel tartaro dei denti Brown, pag. 101
13 MLELE ILIE N PIU' TEEENTI aso dell'1,2-cicloesandiolo anche qui abbiamo due centri stereogenici equivalenti. Avremo quindi una coppia di enantiomeri ed una forma meso. piano di simmetria forma meso e però osserviamo le conformazioni a sedia, la situazione appare a prima vista meno chiara Entrambe le due conformazioni della forma meso non hanno piani di simmetria e sono perciò chirali,...ma... se ruotiamo di 60 questo conformero o se lo ruotiamo di 120 nel verso opposto notiamo che è l'immagine speculare dell'altro Quindi: i due conformeri sono immagini speculari non sovrapponibili (enantiomeri), ma si interconvertono molto velocemente ed hanno la stessa energia (cioé sono equimolari all'equilibrio). Pertanto la forma meso è otticamente inattiva. In conclusione: basta che l'equilibrio conformazionale comprenda almeno un conformero in cui è presente un piano di simmetria, affinché la molecola sia achirale Quando si ha a che fare con composti ciclici, è meglio, dal punto di vista stereochimico, lavorare sulle proiezioni planari Brown, pag. 104
14 PPIETA' IMIE DI ENANTIMEI Due diastereoisomeri hanno energie diverse e strutture non speculari. Pertanto interagiscono in modo differente con altre sostanze e presentano perciò differente reattività. Per gli enantiomeri è necessario fare una distinzione: due enantiomeri interagiscono esattamente nello stesso modo con le sostanze achirali due enantiomeri interagiscono in modo differente con le sostanze chirali enantiomero A enantiomero B non entra non entra substrato chirale (ad es. enzima o recettore) Quindi due enantiomeri presenteranno la stessa reattività con i comuni reagenti di laboratorio (che sono in genere achirali), ma reagiranno in modo differente (anche molto differente) con catalizzatori biologici come gli enzimi. Allo stesso modo due enantiomeri non verranno distinti dalle comuni tecniche analitiche di laboratorio, ma verranno distinti molto bene dai recettori biologici (ad es. quelli dell'olfatto e del gusto, le antenne degli insetti, etc.) In natura le sostanze chirali sono quasi sempre presenti in forma enantiomericamente pura. Talvolta si trovano in natura entrambi gli enantiomeri, ma in organismi diversi: ()-(+) arvone (lio di semi di arvi, o umino tedesco) ()-(-) arvone [Menta dolce (Menta spicata, o pearmint)] Brown, pag
15 2 (+)-Glucosio (destrosio) Dolce (è una sostanza nutriente) N 2 (-)-Glucosio Amaro (non è una sostanza nutriente) FAMAI IALI Quando un farmaco è chirale, i suoi due enantiomeri possono avere attività molto differente. Pertanto, non solo devono essere messi in commercio in forma enantiomericamente pura, ma si deve evitare la presenza anche di solo tracce dell'enantiomero indesiderato. N N N ()-(+) Talidomide (ha proprietà sedative e anti-nausea con pochi effetti collaterali) ()-(-) Talidomide (è un potente teratogeno se preso nei primi tre mesi di gravidanza) Alcuni farmaci sono prodotti naturali e vengono quindi ricavati già in forma enantiomericamente pura per estrazione o per produzione microbiologica. In molti altri casi, però, i farmaci chirali non sono naturali e non sono ottenibili per via microbiologica. La sintesi di farmaci (o loro intermedi) enantiomericamente puri costituisce pertanto un campo di ricerca molto importante, in cui le biotecnologie industriali rivestono un ruolo sempre più rilevante. Gli enantiomeri puri possono essere ottenuti per sintesi asimmetrica o mediante risoluzione Brown, pag
16 ILUZINE MEDIANTE ALI DIATEEIMEII Due enantiomeri hanno uguali proprietà fisiche e non possono essere separati per cristallizzazione, distillazione o cromatografia. Al contrario due diastereoisomeri possono essere separati per cristallizzazione, distillazione o cromatografia. La risoluzione classica consiste nel trasformare una coppia di enantiomeri in una coppia di diastereoisomeri, per reazione con un agente risolvente, cioé una sostanza enantiomericamente pura (in genere una sostanza naturale di basso costo). La reazione chimica più semplice da realizzare è una reazione acido-base acido 2-fenil-2-idrossiacetico (acido mandelico) * 2 ha un centro stereogenico ha proprietà acide come tutti gli acidi carbossilici (pk a = circa 5) e posto a reagire con un'ammina (pk a dell'acido coniug. = circa 10) darà una reazione acido-base completamente spostata a destra. on un'ammina chirale otterremo due sali diastereoisomerici. N N (+)-inconina una sostanza naturale a 4 centri asimmetrici E' stereoisomericamente pura E' un'ammina terziaria se abbreviamo la cinconina con cin 2 + in racemo cristallizzazione da acqua in p.f.= 177 (meno solubile) p.f.= 165 (più solubile) in in acido ()-( )- mandelico puro acidificazione con l (p < ) estrazione sono diastereoisomeri: infatti solo 1 dei 5 stereocentri è invertito 2 solubile in Et 2 + in + l solubile in 2 Brown, pag
17 ILUZINE DELL'α-METILBENZILAMMINA * N 2 In questo caso faremo uso di un acido carbossilico chirale enantiomericamente puro, l'acido (+)-tartarico N N più solubile metanolo A) B) Note Bisogna usare una stechiometria 1:1. Usando 2 equivalenti di ammina la situazione si complica: si possono formare ben tre sali doppi Per recuperare l'ammina risolta, bisogna impiegare almeno 2 equivalenti di Na. Il primo equivalente reagisce infatti con il secondo gruppo carbossilico dell'acido tartarico N meno solubile 2 2 filtrazione N Na N 2 insolubile in acqua. olubile in etere etilico 2 estrazione N 2 2 liquido altobollente (olio)
18 IMEIA E/Z (cis/trans) NEGLI ALENI butano queste due strutture non sono stereoisomeri, ma conformeri. Infatti la rotazione intorno ad un legame singolo ha una bassa barriera energetica ed avviene quindi molto rapidamente anche a basse temperature 2-butene in questo caso si tratta invece di stereoisomeri. Infatti la barriera energetica per la rotazione di un doppio legame è molto alta (si deve rompere il legame π). Pertanto la rotazione è impedita anche ad alte temperature I due stereoisomeri del 2-butene non sono chiaramente speculari. i tratta pertanto di due diastereoisomeri. ono entrambi achirali. Infatti non vi sono centri stereogenici ed è presente in essi un piano di simmetria. EQUIITI PE l'eitenza DI IMEIA E/Z Esistono 2 possibili configurazioni quando ciascuno dei due atomi di che formano il doppio legame porta due sostituenti diversi. NTAZINI DI NFIGUAZINE a) i mette in ordine di priorità ciascuna coppia di sostituenti legati ai due carboni del doppio legame. Le regole di priorità sono le stesse delle notazioni /. b) e i due sostituenti a maggiore priorità sono dalla stessa parte, la notazione è Z (dal tedesco zusammen). e sono da parti opposte è E (dal tedesco entgegen). Z-2-butene E-2-butene Z-,4-dimetil-2-pentene In casi particolari, i diastereoisomeri Z sono anche detti cis. I diastereoisomeri E sono detti trans. In generale gli stereoisomeri E sono più stabili degli Z. Infatti negli Z sono presenti maggiori interazioni steriche. Le interazioni steriche sono interazioni di non legame destabilizzanti dovute ad un'eccessiva vicinanza delle nuvole elettroniche degli atomi Brown, pag. 12,126,127
STEREOISOMERIA carbonio ibridizzato sp3 è legato a quattro atomi o gruppi tutti diversi fra loro
 STEREOISOMERIA i sono oggetti che sono sovrapponibili alla loro immagine speculare: tutti gli oggetti di forma piana, ad esempio. osì, se prendo un alchene e lo confronto con la sua immagine allo specchio:
STEREOISOMERIA i sono oggetti che sono sovrapponibili alla loro immagine speculare: tutti gli oggetti di forma piana, ad esempio. osì, se prendo un alchene e lo confronto con la sua immagine allo specchio:
Stereochimica. Molecole nello spazio
 Stereochimica Molecole nello spazio Stereoisomeri: definizioni Stereoisomeri: isomeri che hanno la medesima connettività tra gli atomi ma differente orientazione 3D degli atomi nello spazio. Stereoisomeri
Stereochimica Molecole nello spazio Stereoisomeri: definizioni Stereoisomeri: isomeri che hanno la medesima connettività tra gli atomi ma differente orientazione 3D degli atomi nello spazio. Stereoisomeri
isomeria di struttura isomeria di posizione isomeria di catena stereoisomeria isomeria di conformazione isomeria di configurazione 'isomeria ottica
 ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
7.4 Proprietà delle Molecole Chirali: Attvità Ottica
 7.4 Proprietà delle Molecole Chirali: Attvità Ottica Una sostanza è attiva otticamente se ruota la luce polarizzata Attività Ottica Affinchè una sostanza esibisca attività ottica, essa deve essere chirale
7.4 Proprietà delle Molecole Chirali: Attvità Ottica Una sostanza è attiva otticamente se ruota la luce polarizzata Attività Ottica Affinchè una sostanza esibisca attività ottica, essa deve essere chirale
7.9 Reazioni che introducono un centro Stereogenico
 7.9 eazioni che introducono un centro tereogenico Molte reazioni convertono reagenti achirali a prodotti chirali. E importante ricordare, comunque che se tutti i i componenti iniziali (reagenti, catalizzatori,
7.9 eazioni che introducono un centro tereogenico Molte reazioni convertono reagenti achirali a prodotti chirali. E importante ricordare, comunque che se tutti i i componenti iniziali (reagenti, catalizzatori,
L'ATTIVITA' OTTICA DEI COMPOSTI CHIRALI
 L'ATTIVITA' OTTICA DEI COMPOSTI CHIRALI Nei composti inorganici a ogni formula grezza, che esprime la composizione della molecola, corrisponde una sola formula di struttura. Nei composti organici, invece,
L'ATTIVITA' OTTICA DEI COMPOSTI CHIRALI Nei composti inorganici a ogni formula grezza, che esprime la composizione della molecola, corrisponde una sola formula di struttura. Nei composti organici, invece,
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Grandezze scalari e vettoriali
 Grandezze scalari e vettoriali Esempio vettore spostamento: Esistono due tipi di grandezze fisiche. a) Grandezze scalari specificate da un valore numerico (positivo negativo o nullo) e (nel caso di grandezze
Grandezze scalari e vettoriali Esempio vettore spostamento: Esistono due tipi di grandezze fisiche. a) Grandezze scalari specificate da un valore numerico (positivo negativo o nullo) e (nel caso di grandezze
LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1
 LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1 I CODICI 1 IL CODICE BCD 1 Somma in BCD 2 Sottrazione BCD 5 IL CODICE ECCESSO 3 20 La trasmissione delle informazioni Quarta Parte I codici Il codice BCD
LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1 I CODICI 1 IL CODICE BCD 1 Somma in BCD 2 Sottrazione BCD 5 IL CODICE ECCESSO 3 20 La trasmissione delle informazioni Quarta Parte I codici Il codice BCD
GIROSCOPIO. Scopo dell esperienza: Teoria fisica. Verificare la relazione: ω p = bmg/iω
 GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
Siamo così arrivati all aritmetica modulare, ma anche a individuare alcuni aspetti di come funziona l aritmetica del calcolatore come vedremo.
 DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
CHIRALITA' E' una proprietà relativa ad oggetti PRIVI DI UN PIANO DI SIMMETRIA.
 CIRALITA' E' una proprietà relativa ad oggetti PRIVI DI UN PIANO DI SIMMETRIA. non simmetrica rispetto al piano piano di simmetria La mano destra non è sovrapponibile alla mano sinistra: ne è invece l'immagine
CIRALITA' E' una proprietà relativa ad oggetti PRIVI DI UN PIANO DI SIMMETRIA. non simmetrica rispetto al piano piano di simmetria La mano destra non è sovrapponibile alla mano sinistra: ne è invece l'immagine
LE FUNZIONI A DUE VARIABILI
 Capitolo I LE FUNZIONI A DUE VARIABILI In questo primo capitolo introduciamo alcune definizioni di base delle funzioni reali a due variabili reali. Nel seguito R denoterà l insieme dei numeri reali mentre
Capitolo I LE FUNZIONI A DUE VARIABILI In questo primo capitolo introduciamo alcune definizioni di base delle funzioni reali a due variabili reali. Nel seguito R denoterà l insieme dei numeri reali mentre
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
TRASFORMAZIONI GEOMETRICHE NEL PIANO. Parte 1
 TRASFORMAZIONI GEOMETRICHE NEL PIANO Parte 1 La geometria è la scienza che studia la forma e l estensione dei corpi e le trasformazioni che questi possono subire. In generale per trasformazione geometrica
TRASFORMAZIONI GEOMETRICHE NEL PIANO Parte 1 La geometria è la scienza che studia la forma e l estensione dei corpi e le trasformazioni che questi possono subire. In generale per trasformazione geometrica
Polarimetria. Polarimetria
 Polarimetria Polarimetria La radiazione elettromagnetica viene considerata come una forma di energia radiante dotata di una doppia natura, ondulatoria e corpuscolare. In ogni momento il vettore campo elettrico
Polarimetria Polarimetria La radiazione elettromagnetica viene considerata come una forma di energia radiante dotata di una doppia natura, ondulatoria e corpuscolare. In ogni momento il vettore campo elettrico
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
13. Campi vettoriali
 13. Campi vettoriali 1 Il campo di velocità di un fluido Il concetto di campo in fisica non è limitato ai fenomeni elettrici. In generale il valore di una grandezza fisica assegnato per ogni punto dello
13. Campi vettoriali 1 Il campo di velocità di un fluido Il concetto di campo in fisica non è limitato ai fenomeni elettrici. In generale il valore di una grandezza fisica assegnato per ogni punto dello
Università degli studi di Messina facoltà di Scienze mm ff nn. Progetto Lauree Scientifiche (FISICA) Prisma ottico
 Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Esempi di funzione. Scheda Tre
 Scheda Tre Funzioni Consideriamo una legge f che associa ad un elemento di un insieme X al più un elemento di un insieme Y; diciamo che f è una funzione, X è l insieme di partenza e X l insieme di arrivo.
Scheda Tre Funzioni Consideriamo una legge f che associa ad un elemento di un insieme X al più un elemento di un insieme Y; diciamo che f è una funzione, X è l insieme di partenza e X l insieme di arrivo.
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI
 TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
www.andreatorinesi.it
 La lunghezza focale Lunghezza focale Si definisce lunghezza focale la distanza tra il centro ottico dell'obiettivo (a infinito ) e il piano su cui si forma l'immagine (nel caso del digitale, il sensore).
La lunghezza focale Lunghezza focale Si definisce lunghezza focale la distanza tra il centro ottico dell'obiettivo (a infinito ) e il piano su cui si forma l'immagine (nel caso del digitale, il sensore).
La distribuzione Normale. La distribuzione Normale
 La Distribuzione Normale o Gaussiana è la distribuzione più importante ed utilizzata in tutta la statistica La curva delle frequenze della distribuzione Normale ha una forma caratteristica, simile ad una
La Distribuzione Normale o Gaussiana è la distribuzione più importante ed utilizzata in tutta la statistica La curva delle frequenze della distribuzione Normale ha una forma caratteristica, simile ad una
VERIFICA DELLA LEGGE DI MALUS E MISURA DELLA CONCENTRAZIONE DI UNA SOLUZIONE CON DUE POLAROIDI
 VERIFICA DELLA LEGGE DI MALUS E MISURA DELLA CONCENTRAZIONE DI UNA SOLUZIONE CON DUE POLAROIDI A) VERIFICA DELLA LEGGE DI MALUS L intensità luminosa trasmessa da un sistema costituito da due polaroidi
VERIFICA DELLA LEGGE DI MALUS E MISURA DELLA CONCENTRAZIONE DI UNA SOLUZIONE CON DUE POLAROIDI A) VERIFICA DELLA LEGGE DI MALUS L intensità luminosa trasmessa da un sistema costituito da due polaroidi
Appunti sulla Macchina di Turing. Macchina di Turing
 Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Vademecum studio funzione
 Vademecum studio funzione Campo di Esistenza di una funzione o dominio: Studiare una funzione significa determinare gli elementi caratteristici che ci permettono di disegnarne il grafico, a partire dalla
Vademecum studio funzione Campo di Esistenza di una funzione o dominio: Studiare una funzione significa determinare gli elementi caratteristici che ci permettono di disegnarne il grafico, a partire dalla
Capitolo 13: L offerta dell impresa e il surplus del produttore
 Capitolo 13: L offerta dell impresa e il surplus del produttore 13.1: Introduzione L analisi dei due capitoli precedenti ha fornito tutti i concetti necessari per affrontare l argomento di questo capitolo:
Capitolo 13: L offerta dell impresa e il surplus del produttore 13.1: Introduzione L analisi dei due capitoli precedenti ha fornito tutti i concetti necessari per affrontare l argomento di questo capitolo:
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
CHIMICA ORGANICA. Gli alcoli
 1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
Capitolo II. La forma del valore. 7. La duplice forma in cui si presenta la merce: naturale e di valore.
 Capitolo II La forma del valore 7. La duplice forma in cui si presenta la merce: naturale e di valore. I beni nascono come valori d uso: nel loro divenire merci acquisiscono anche un valore (di scambio).
Capitolo II La forma del valore 7. La duplice forma in cui si presenta la merce: naturale e di valore. I beni nascono come valori d uso: nel loro divenire merci acquisiscono anche un valore (di scambio).
APPUNTI SU PROBLEMI CON CALCOLO PERCENTUALE
 APPUNTI SU PROBLEMI CON CALCOLO PERCENTUALE 1. Proporzionalità diretta e proporzionalità inversa Analizziamo le seguenti formule Peso Lordo = Peso Netto + Tara Ricavo = Utile + Costo Rata = Importo + Interesse
APPUNTI SU PROBLEMI CON CALCOLO PERCENTUALE 1. Proporzionalità diretta e proporzionalità inversa Analizziamo le seguenti formule Peso Lordo = Peso Netto + Tara Ricavo = Utile + Costo Rata = Importo + Interesse
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
f(x) = 1 x. Il dominio di questa funzione è il sottoinsieme proprio di R dato da
 Data una funzione reale f di variabile reale x, definita su un sottoinsieme proprio D f di R (con questo voglio dire che il dominio di f è un sottoinsieme di R che non coincide con tutto R), ci si chiede
Data una funzione reale f di variabile reale x, definita su un sottoinsieme proprio D f di R (con questo voglio dire che il dominio di f è un sottoinsieme di R che non coincide con tutto R), ci si chiede
Forze come grandezze vettoriali
 Forze come grandezze vettoriali L. Paolucci 23 novembre 2010 Sommario Esercizi e problemi risolti. Per la classe prima. Anno Scolastico 2010/11 Parte 1 / versione 2 Si ricordi che la risultante di due
Forze come grandezze vettoriali L. Paolucci 23 novembre 2010 Sommario Esercizi e problemi risolti. Per la classe prima. Anno Scolastico 2010/11 Parte 1 / versione 2 Si ricordi che la risultante di due
Corso di Informatica Generale (C. L. Economia e Commercio) Ing. Valerio Lacagnina Rappresentazione in virgola mobile
 Problemi connessi all utilizzo di un numero di bit limitato Abbiamo visto quali sono i vantaggi dell utilizzo della rappresentazione in complemento alla base: corrispondenza biunivoca fra rappresentazione
Problemi connessi all utilizzo di un numero di bit limitato Abbiamo visto quali sono i vantaggi dell utilizzo della rappresentazione in complemento alla base: corrispondenza biunivoca fra rappresentazione
( x) ( x) 0. Equazioni irrazionali
 Equazioni irrazionali Definizione: si definisce equazione irrazionale un equazione in cui compaiono uno o più radicali contenenti l incognita. Esempio 7 Ricordiamo quanto visto sulle condizioni di esistenza
Equazioni irrazionali Definizione: si definisce equazione irrazionale un equazione in cui compaiono uno o più radicali contenenti l incognita. Esempio 7 Ricordiamo quanto visto sulle condizioni di esistenza
FUNZIONE. Si scrive: A B f: A B x y=f(x) (si legge: f funzione da A in B) x f y= f(x)
 1 FUNZIONE Dati gli insiemi A e B, si definisce funzione da A in B una relazione o legge o corrispondenza che ad ogni elemento di A associa uno ed un solo elemento di B. Si scrive: A B f: A B f() (si legge:
1 FUNZIONE Dati gli insiemi A e B, si definisce funzione da A in B una relazione o legge o corrispondenza che ad ogni elemento di A associa uno ed un solo elemento di B. Si scrive: A B f: A B f() (si legge:
Idrocarburi. Stereoisomeria
 Idrocarburi Stereoisomeria Stereisomeri configurazionali Il fatto che gli atomi di carbonio degli alcani siano tutti ibridati sp 3 rende possibile la formazione anche di altri stereoisomeri (isomeri con
Idrocarburi Stereoisomeria Stereisomeri configurazionali Il fatto che gli atomi di carbonio degli alcani siano tutti ibridati sp 3 rende possibile la formazione anche di altri stereoisomeri (isomeri con
Sensori a effetto Hall bipolari con ritenuta stabilizzati e non stabilizzati con circuito chopper
 Sensori a effetto Hall bipolari con ritenuta stabilizzati e non stabilizzati con circuito chopper I risultati dei test mostrano che è possibile ottenere prestazioni significativamente maggiori impiegando
Sensori a effetto Hall bipolari con ritenuta stabilizzati e non stabilizzati con circuito chopper I risultati dei test mostrano che è possibile ottenere prestazioni significativamente maggiori impiegando
STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano
 STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano sono stereoisomeri Hanno la stessa formula molecolare, gli atomi legati con lo stesso ordine, ma con diversa orientazione nello spazio
STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano sono stereoisomeri Hanno la stessa formula molecolare, gli atomi legati con lo stesso ordine, ma con diversa orientazione nello spazio
Per studio di funzione intendiamo un insieme di procedure che hanno lo scopo di analizzare le proprietà di una funzione f ( x) R R
 Studio di funzione Per studio di funzione intendiamo un insieme di procedure che hanno lo scopo di analizzare le proprietà di una funzione f ( x) R R : allo scopo di determinarne le caratteristiche principali.
Studio di funzione Per studio di funzione intendiamo un insieme di procedure che hanno lo scopo di analizzare le proprietà di una funzione f ( x) R R : allo scopo di determinarne le caratteristiche principali.
1.6 Che cosa vede l astronomo
 1.6 Che cosa vede l astronomo Stelle in rotazione Nel corso della notte, la Sfera celeste sembra ruotare attorno a noi. Soltanto un punto detto Polo nord celeste resta fermo; esso si trova vicino a una
1.6 Che cosa vede l astronomo Stelle in rotazione Nel corso della notte, la Sfera celeste sembra ruotare attorno a noi. Soltanto un punto detto Polo nord celeste resta fermo; esso si trova vicino a una
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
Laboratorio di Fisica 3 Ottica 2. Studenti: Buoni - Giambastiani - Leidi Gruppo: G09
 Laboratorio di Fisica 3 Ottica 2 Studenti: Buoni - Giambastiani - Leidi Gruppo: G09 24 febbraio 2015 1 Lunghezza d onda di un laser He-Ne 1.1 Scopo dell esperienza Lo scopo dell esperienza è quello di
Laboratorio di Fisica 3 Ottica 2 Studenti: Buoni - Giambastiani - Leidi Gruppo: G09 24 febbraio 2015 1 Lunghezza d onda di un laser He-Ne 1.1 Scopo dell esperienza Lo scopo dell esperienza è quello di
METODO PER LA DESCRIZIONE DEL CAMPO MAGNETICO ROTANTE
 Ing. ENRICO BIAGI Docente di Tecnologie elettrice, Disegno, Progettazione ITIS A. Volta - Perugia ETODO PER LA DESCRIZIONE DEL CAPO AGNETICO ROTANTE Viene illustrato un metodo analitico-grafico per descrivere
Ing. ENRICO BIAGI Docente di Tecnologie elettrice, Disegno, Progettazione ITIS A. Volta - Perugia ETODO PER LA DESCRIZIONE DEL CAPO AGNETICO ROTANTE Viene illustrato un metodo analitico-grafico per descrivere
GUIDA ALLA RILEVANZA
 GUIDA ALLA RILEVANZA Posizionamento per Rilevanza Suggerimenti per una migliore visibilità su ebay www.egolden.it Vers. 1.1 Questa guida puo essere ridistribuita con l obbligo di non modificarne contenuto
GUIDA ALLA RILEVANZA Posizionamento per Rilevanza Suggerimenti per una migliore visibilità su ebay www.egolden.it Vers. 1.1 Questa guida puo essere ridistribuita con l obbligo di non modificarne contenuto
risulta (x) = 1 se x < 0.
 Questo file si pone come obiettivo quello di mostrarvi come lo studio di una funzione reale di una variabile reale, nella cui espressione compare un qualche valore assoluto, possa essere svolto senza necessariamente
Questo file si pone come obiettivo quello di mostrarvi come lo studio di una funzione reale di una variabile reale, nella cui espressione compare un qualche valore assoluto, possa essere svolto senza necessariamente
Corrispondenze e funzioni
 Corrispondenze e funzioni L attività fondamentale della mente umana consiste nello stabilire corrispondenze e relazioni tra oggetti; è anche per questo motivo che il concetto di corrispondenza è uno dei
Corrispondenze e funzioni L attività fondamentale della mente umana consiste nello stabilire corrispondenze e relazioni tra oggetti; è anche per questo motivo che il concetto di corrispondenza è uno dei
bensì una tendenza a ruotare quando vengono applicate in punti diversi di un corpo
 Momento di una forza Nella figura 1 è illustrato come forze uguali e contrarie possono non produrre equilibrio, bensì una tendenza a ruotare quando vengono applicate in punti diversi di un corpo esteso.
Momento di una forza Nella figura 1 è illustrato come forze uguali e contrarie possono non produrre equilibrio, bensì una tendenza a ruotare quando vengono applicate in punti diversi di un corpo esteso.
Trigliceride (e 3 molecole d'acqua)
 Universit egli Studi di Parma - Scienze e Tecnologie himiche 1 DETEMINAZINE DEI GASSI IN LI ALIMENTAI I trigliceridi I grassi (o meglio i lipidi) sono costituenti essenziali di moltissimi alimenti. In
Universit egli Studi di Parma - Scienze e Tecnologie himiche 1 DETEMINAZINE DEI GASSI IN LI ALIMENTAI I trigliceridi I grassi (o meglio i lipidi) sono costituenti essenziali di moltissimi alimenti. In
Aprire WEKA Explorer Caricare il file circletrain.arff Selezionare random split al 66% come modalità di test Selezionare J48 come classificatore e
 Alberi di decisione Aprire WEKA Explorer Caricare il file circletrain.arff Selezionare random split al 66% come modalità di test Selezionare J48 come classificatore e lanciarlo con i parametri di default.
Alberi di decisione Aprire WEKA Explorer Caricare il file circletrain.arff Selezionare random split al 66% come modalità di test Selezionare J48 come classificatore e lanciarlo con i parametri di default.
Funzioni funzione dominio codominio legge argomento variabile indipendente variabile dipendente
 Funzioni In matematica, una funzione f da X in Y consiste in: 1. un insieme X detto dominio di f 2. un insieme Y detto codominio di f 3. una legge che ad ogni elemento x in X associa uno ed un solo elemento
Funzioni In matematica, una funzione f da X in Y consiste in: 1. un insieme X detto dominio di f 2. un insieme Y detto codominio di f 3. una legge che ad ogni elemento x in X associa uno ed un solo elemento
UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria sede di Vicenza A.A. 2007/08
 UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria sede di Vicenza Corso di Disegno Tecnico Industriale per il Corso di Laurea triennale in Ingegneria Meccanica e in Ingegneria Meccatronica Tolleranze
UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria sede di Vicenza Corso di Disegno Tecnico Industriale per il Corso di Laurea triennale in Ingegneria Meccanica e in Ingegneria Meccatronica Tolleranze
Usando il pendolo reversibile di Kater
 Usando il pendolo reversibile di Kater Scopo dell esperienza è la misurazione dell accelerazione di gravità g attraverso il periodo di oscillazione di un pendolo reversibile L accelerazione di gravità
Usando il pendolo reversibile di Kater Scopo dell esperienza è la misurazione dell accelerazione di gravità g attraverso il periodo di oscillazione di un pendolo reversibile L accelerazione di gravità
SCHEDA M MOSAICI CLASSIFICARE CON LA SIMMETRIA
 SCHEDA M MOSAICI CLASSIFICARE CON LA SIMMETRIA Qui sotto avete una griglia, che rappresenta una normale quadrettatura, come quella dei quaderni a quadretti; nelle attività che seguono dovrete immaginare
SCHEDA M MOSAICI CLASSIFICARE CON LA SIMMETRIA Qui sotto avete una griglia, che rappresenta una normale quadrettatura, come quella dei quaderni a quadretti; nelle attività che seguono dovrete immaginare
La isomeria in Chimica Organica
 La isomeria in himica Organica isomeri composti differenti con la stessa formula molecolare (bruta) costituzionali isomeri i cui atomi sono connessi in modi diversi stereoisomeri P.es.: butano, 2-metil-propano
La isomeria in himica Organica isomeri composti differenti con la stessa formula molecolare (bruta) costituzionali isomeri i cui atomi sono connessi in modi diversi stereoisomeri P.es.: butano, 2-metil-propano
CALCOLO COMBINATORIO
 CALCOLO COMBINATORIO 1 Modi di formare gruppi di k oggetti presi da n dati 11 disposizioni semplici, permutazioni Dati n oggetti distinti a 1,, a n si chiamano disposizioni semplici di questi oggetti,
CALCOLO COMBINATORIO 1 Modi di formare gruppi di k oggetti presi da n dati 11 disposizioni semplici, permutazioni Dati n oggetti distinti a 1,, a n si chiamano disposizioni semplici di questi oggetti,
~ Copyright Ripetizionando - All rights reserved ~ http://ripetizionando.wordpress.com STUDIO DI FUNZIONE
 STUDIO DI FUNZIONE Passaggi fondamentali Per effettuare uno studio di funzione completo, che non lascia quindi margine a una quasi sicuramente errata inventiva, sono necessari i seguenti 7 passaggi: 1.
STUDIO DI FUNZIONE Passaggi fondamentali Per effettuare uno studio di funzione completo, che non lascia quindi margine a una quasi sicuramente errata inventiva, sono necessari i seguenti 7 passaggi: 1.
Complementi di Analisi per Informatica *** Capitolo 2. Numeri Complessi. e Circuiti Elettrici. a Corrente Alternata. Sergio Benenti 7 settembre 2013
 Complementi di Analisi per nformatica *** Capitolo 2 Numeri Complessi e Circuiti Elettrici a Corrente Alternata Sergio Benenti 7 settembre 2013? ndice 2 Circuiti elettrici a corrente alternata 1 21 Circuito
Complementi di Analisi per nformatica *** Capitolo 2 Numeri Complessi e Circuiti Elettrici a Corrente Alternata Sergio Benenti 7 settembre 2013? ndice 2 Circuiti elettrici a corrente alternata 1 21 Circuito
Il concetto di valore medio in generale
 Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Isomeri. Unità didattica 5. Isomeri cis-trans. La stereochimica. I composti achirali hanno immagini speculari sovrapponibili
 Isomeri Composti non identici ma che hanno la stessa formula molecolare Unità didattica 5 La stereochimica La disposizione degli atomi nello spazio; La stereochimica delle reazioni di addizione Isomeri
Isomeri Composti non identici ma che hanno la stessa formula molecolare Unità didattica 5 La stereochimica La disposizione degli atomi nello spazio; La stereochimica delle reazioni di addizione Isomeri
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LA RETTA. Retta per l'origine, rette orizzontali e verticali
 Retta per l'origine, rette orizzontali e verticali LA RETTA Abbiamo visto che l'equazione generica di una retta è del tipo Y = mx + q, dove m ne rappresenta la pendenza e q il punto in cui la retta incrocia
Retta per l'origine, rette orizzontali e verticali LA RETTA Abbiamo visto che l'equazione generica di una retta è del tipo Y = mx + q, dove m ne rappresenta la pendenza e q il punto in cui la retta incrocia
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
Consideriamo due polinomi
 Capitolo 3 Il luogo delle radici Consideriamo due polinomi N(z) = (z z 1 )(z z 2 )... (z z m ) D(z) = (z p 1 )(z p 2 )... (z p n ) della variabile complessa z con m < n. Nelle problematiche connesse al
Capitolo 3 Il luogo delle radici Consideriamo due polinomi N(z) = (z z 1 )(z z 2 )... (z z m ) D(z) = (z p 1 )(z p 2 )... (z p n ) della variabile complessa z con m < n. Nelle problematiche connesse al
GEOMETRIA DELLE MASSE
 1 DISPENSA N 2 GEOMETRIA DELLE MASSE Si prende in considerazione un sistema piano, ossia giacente nel pian x-y. Un insieme di masse posizionato nel piano X-Y, rappresentato da punti individuati dalle loro
1 DISPENSA N 2 GEOMETRIA DELLE MASSE Si prende in considerazione un sistema piano, ossia giacente nel pian x-y. Un insieme di masse posizionato nel piano X-Y, rappresentato da punti individuati dalle loro
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
C 4 H 10 C 4 H 10. Hanno la stessa formula molecolare C 4 H 10.
 Isomeria costituzionale negli alcani Isomeri costituzionali (strutturali): composti con uguale formula molecolare ma diversa formula di struttura (con un diverso ordine con cui sono legati i loro atomi).
Isomeria costituzionale negli alcani Isomeri costituzionali (strutturali): composti con uguale formula molecolare ma diversa formula di struttura (con un diverso ordine con cui sono legati i loro atomi).
Isomeria nelle molecole organiche
 Isomeria nelle molecole organiche 3 Cis/Trans o Z/E 1 4 Regole di priorità negli alcheni: 1. Numero atomico maggiore=maggiore priorità; 2. Maggiore priorità all isotopo più pesante; 3. Se il primo atomo
Isomeria nelle molecole organiche 3 Cis/Trans o Z/E 1 4 Regole di priorità negli alcheni: 1. Numero atomico maggiore=maggiore priorità; 2. Maggiore priorità all isotopo più pesante; 3. Se il primo atomo
Teoria in sintesi 10. Attività di sportello 1, 24 - Attività di sportello 2, 24 - Verifica conclusiva, 25. Teoria in sintesi 26
 Indice L attività di recupero 6 Funzioni Teoria in sintesi 0 Obiettivo Ricerca del dominio e del codominio di funzioni note Obiettivo Ricerca del dominio di funzioni algebriche; scrittura del dominio Obiettivo
Indice L attività di recupero 6 Funzioni Teoria in sintesi 0 Obiettivo Ricerca del dominio e del codominio di funzioni note Obiettivo Ricerca del dominio di funzioni algebriche; scrittura del dominio Obiettivo
Capitolo 3. L applicazione Java Diagrammi ER. 3.1 La finestra iniziale, il menu e la barra pulsanti
 Capitolo 3 L applicazione Java Diagrammi ER Dopo le fasi di analisi, progettazione ed implementazione il software è stato compilato ed ora è pronto all uso; in questo capitolo mostreremo passo passo tutta
Capitolo 3 L applicazione Java Diagrammi ER Dopo le fasi di analisi, progettazione ed implementazione il software è stato compilato ed ora è pronto all uso; in questo capitolo mostreremo passo passo tutta
Il controllo della visualizzazione
 Capitolo 3 Il controllo della visualizzazione Per disegnare in modo preciso è necessario regolare continuamente l inquadratura in modo da vedere la parte di disegno che interessa. Saper utilizzare gli
Capitolo 3 Il controllo della visualizzazione Per disegnare in modo preciso è necessario regolare continuamente l inquadratura in modo da vedere la parte di disegno che interessa. Saper utilizzare gli
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
PROGETTO. SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science. Education
 PROGETTO SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science Education 1 Anno scolastico 2013 2014 Classe I A ottici Modulo: Affonda o galleggia? Agata Conti 2 Sintesi Il modulo offre l'opportunità
PROGETTO SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science Education 1 Anno scolastico 2013 2014 Classe I A ottici Modulo: Affonda o galleggia? Agata Conti 2 Sintesi Il modulo offre l'opportunità
GUIDA RAPIDA PER LA COMPILAZIONE DELLA SCHEDA CCNL GUIDA RAPIDA PER LA COMPILAZIONE DELLA SCHEDA CCNL
 GUIDA RAPIDA BOZZA 23/07/2008 INDICE 1. PERCHÉ UNA NUOVA VERSIONE DEI MODULI DI RACCOLTA DATI... 3 2. INDICAZIONI GENERALI... 4 2.1. Non modificare la struttura dei fogli di lavoro... 4 2.2. Cosa significano
GUIDA RAPIDA BOZZA 23/07/2008 INDICE 1. PERCHÉ UNA NUOVA VERSIONE DEI MODULI DI RACCOLTA DATI... 3 2. INDICAZIONI GENERALI... 4 2.1. Non modificare la struttura dei fogli di lavoro... 4 2.2. Cosa significano
Alcuni consigli per un uso di base delle serie di dati automatiche in Microsoft Excel
 Alcuni consigli per un uso di base delle serie di dati automatiche in Microsoft Excel Le serie Una serie di dati automatica è una sequenza di informazioni legate tra loro da una relazione e contenute in
Alcuni consigli per un uso di base delle serie di dati automatiche in Microsoft Excel Le serie Una serie di dati automatica è una sequenza di informazioni legate tra loro da una relazione e contenute in
LIVELLO STUDENT S1. S2. S3. S4. S5. S6.
 LIVELLO STUDENT S1. (5 punti ) La figura mostra due quadrati uguali che hanno in comune esattamente un vertice. È possibile precisare la misura dell'angolo ABC? S2. (7 punti ) Negli usuali fogli (rettangolari)
LIVELLO STUDENT S1. (5 punti ) La figura mostra due quadrati uguali che hanno in comune esattamente un vertice. È possibile precisare la misura dell'angolo ABC? S2. (7 punti ) Negli usuali fogli (rettangolari)
1. LE GRANDEZZE FISICHE
 1. LE GRANDEZZE FISICHE La fisica (dal greco physis, natura ) è una scienza che ha come scopo guardare, descrivere e tentare di comprendere il mondo che ci circonda. La fisica si propone di descrivere
1. LE GRANDEZZE FISICHE La fisica (dal greco physis, natura ) è una scienza che ha come scopo guardare, descrivere e tentare di comprendere il mondo che ci circonda. La fisica si propone di descrivere
Similitudine e omotetia nella didattica della geometria nella scuola secondaria di primo grado di Luciano Porta
 Similitudine e omotetia nella didattica della geometria nella scuola secondaria di primo grado di Luciano Porta Il concetto di similitudine è innato: riconosciamo lo stesso oggetto se è più o meno distante
Similitudine e omotetia nella didattica della geometria nella scuola secondaria di primo grado di Luciano Porta Il concetto di similitudine è innato: riconosciamo lo stesso oggetto se è più o meno distante
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Analisi e diagramma di Pareto
 Analisi e diagramma di Pareto L'analisi di Pareto è una metodologia statistica utilizzata per individuare i problemi più rilevanti nella situazione in esame e quindi le priorità di intervento. L'obiettivo
Analisi e diagramma di Pareto L'analisi di Pareto è una metodologia statistica utilizzata per individuare i problemi più rilevanti nella situazione in esame e quindi le priorità di intervento. L'obiettivo
Forza. Forza. Esempi di forze. Caratteristiche della forza. Forze fondamentali CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA
 Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
4. Proiezioni del piano e dello spazio
 4. Proiezioni del piano e dello spazio La visualizzazione di oggetti tridimensionali richiede di ottenere una vista piana dell'oggetto. Questo avviene mediante una sequenza di operazioni. Innanzitutto,
4. Proiezioni del piano e dello spazio La visualizzazione di oggetti tridimensionali richiede di ottenere una vista piana dell'oggetto. Questo avviene mediante una sequenza di operazioni. Innanzitutto,
Uso di base delle funzioni in Microsoft Excel
 Uso di base delle funzioni in Microsoft Excel Le funzioni Una funzione è un operatore che applicato a uno o più argomenti (valori, siano essi numeri con virgola, numeri interi, stringhe di caratteri) restituisce
Uso di base delle funzioni in Microsoft Excel Le funzioni Una funzione è un operatore che applicato a uno o più argomenti (valori, siano essi numeri con virgola, numeri interi, stringhe di caratteri) restituisce
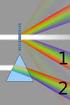
Interferenza e diffrazione
 Interferenza e diffrazione La radiazione elettromagnetica proveniente da diverse sorgenti si sovrappongono in ogni punto combinando l intensita INTERFERENZA Quando la radiazione elettromagnetica passa
Interferenza e diffrazione La radiazione elettromagnetica proveniente da diverse sorgenti si sovrappongono in ogni punto combinando l intensita INTERFERENZA Quando la radiazione elettromagnetica passa
RAPPRESENTAZIONE GRAFICA E ANALISI DEI DATI SPERIMENTALI CON EXCEL
 RAPPRESENTAZIONE GRAFICA E ANALISI DEI DATI SPERIMENTALI CON EXCEL 1 RAPPRESENTAZIONE GRAFICA Per l analisi dati con Excel si fa riferimento alla versione 2007 di Office, le versioni successive non differiscono
RAPPRESENTAZIONE GRAFICA E ANALISI DEI DATI SPERIMENTALI CON EXCEL 1 RAPPRESENTAZIONE GRAFICA Per l analisi dati con Excel si fa riferimento alla versione 2007 di Office, le versioni successive non differiscono
Sommario Ottica geometrica... 2 Principio di Huygens-Fresnel... 4 Oggetto e immagine... 6 Immagine reale... 7 Immagine virtuale...
 IMMAGINI Sommario Ottica geometrica... 2 Principio di Huygens-Fresnel... 4 Oggetto e immagine... 6 Immagine reale... 7 Immagine virtuale... 9 Immagini - 1/11 Ottica geometrica È la branca dell ottica che
IMMAGINI Sommario Ottica geometrica... 2 Principio di Huygens-Fresnel... 4 Oggetto e immagine... 6 Immagine reale... 7 Immagine virtuale... 9 Immagini - 1/11 Ottica geometrica È la branca dell ottica che
UNIVERSITÀ DEGLI STUDI DI TERAMO
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN ECONOMIA BANCARIA FINANZIARIA ED ASSICURATIVA (Classe 7) Corso di Matematica per l Economia (Prof. F. Eugeni) TEST DI INGRESSO Teramo, ottobre 00 SEZIONE
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN ECONOMIA BANCARIA FINANZIARIA ED ASSICURATIVA (Classe 7) Corso di Matematica per l Economia (Prof. F. Eugeni) TEST DI INGRESSO Teramo, ottobre 00 SEZIONE
ISOMERIA. Isomeri di struttura O OH C 4 H 10 O C 4 H 10
 ISOMERIA O O C 4 10 O C 4 10 Isomeri di struttura Isomeri conformazionali conformazioni rotameri STEREOISOMERIA stereoisomeri o isomeri spaziali o isomeri costituzionali ( in greco vuol dire spazio) si
ISOMERIA O O C 4 10 O C 4 10 Isomeri di struttura Isomeri conformazionali conformazioni rotameri STEREOISOMERIA stereoisomeri o isomeri spaziali o isomeri costituzionali ( in greco vuol dire spazio) si
Statistica e biometria. D. Bertacchi. Variabili aleatorie. V.a. discrete e continue. La densità di una v.a. discreta. Esempi.
 Iniziamo con definizione (capiremo fra poco la sua utilità): DEFINIZIONE DI VARIABILE ALEATORIA Una variabile aleatoria (in breve v.a.) X è funzione che ha come dominio Ω e come codominio R. In formule:
Iniziamo con definizione (capiremo fra poco la sua utilità): DEFINIZIONE DI VARIABILE ALEATORIA Una variabile aleatoria (in breve v.a.) X è funzione che ha come dominio Ω e come codominio R. In formule:
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
I SISTEMI TRIFASI B B A N B B
 I SISTEMI TRIFSI ITRODUZIOE Un sistema polifase consiste in due o più tensioni identiche, fra le quali esiste uno sfasamento fisso, che alimentano, attraverso delle linee di collegamento, dei carichi.
I SISTEMI TRIFSI ITRODUZIOE Un sistema polifase consiste in due o più tensioni identiche, fra le quali esiste uno sfasamento fisso, che alimentano, attraverso delle linee di collegamento, dei carichi.
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Il programma CONFELMOD CAD creazione e modifica
 CREAZIONE DEI PEZZI DEL MODELLO Dopo aver fatto la lista di tutti i componenti nella scheda modello si passa alla creazione dei pezzi. Si seleziona il modello e si clicca su Apri Modello 1 Con questa operazione
CREAZIONE DEI PEZZI DEL MODELLO Dopo aver fatto la lista di tutti i componenti nella scheda modello si passa alla creazione dei pezzi. Si seleziona il modello e si clicca su Apri Modello 1 Con questa operazione
Scuola/Classe Cognome Nome Data
 Università di Udine Unità di Ricerca in Didattica della Fisica Scuola/Classe Cognome Nome Data Scheda PotRot Mezzi otticamente attivi Attività A. Riconoscere i mezzi otticamente attivi. Si dispone un puntatore
Università di Udine Unità di Ricerca in Didattica della Fisica Scuola/Classe Cognome Nome Data Scheda PotRot Mezzi otticamente attivi Attività A. Riconoscere i mezzi otticamente attivi. Si dispone un puntatore
Dimensione di uno Spazio vettoriale
 Capitolo 4 Dimensione di uno Spazio vettoriale 4.1 Introduzione Dedichiamo questo capitolo ad un concetto fondamentale in algebra lineare: la dimensione di uno spazio vettoriale. Daremo una definizione
Capitolo 4 Dimensione di uno Spazio vettoriale 4.1 Introduzione Dedichiamo questo capitolo ad un concetto fondamentale in algebra lineare: la dimensione di uno spazio vettoriale. Daremo una definizione
