dominio strutturale dominio modulo
|
|
|
- Edoardo Mora
- 8 anni fa
- Visualizzazioni
Transcript
1 Riepilogo 2^lezione
2 DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali costituiscono divisioni della struttura terziaria. Sono zone distinguibili della proteina ma unite da segmenti flessibili di catene polipeptiche. I domini sono strutture supersecondarie complesse delle proteine. Si distinguono in: Dominio tutto α (paralleli o antiparalleli): formati da alfa elica. Dominio tutto β: formati da foglietti beta. Dominio misti (o domini α+β): formati da entrambe le strutture secondarie Spesso domini diversi hanno diverse funzioni. Per piccole proteine a volte il dominio corrisponde all'intera proteina.
3 Struttura terziaria (i domini) Le catene polipeptidiche formate da più di 200 amminoacidi in genere comprendono 2 o più piccole unità compatte: i domini. I domini sono le unità strutturali e funzionali di una proteina. Ciascun dominio è una regione compatta, che si forma per la combinazione di più elementi strutturali secondari (α-eliche, foglietti β, sequenze non ripetitive). Strutturalmente, ciascun dominio è indipendente da altri domini della stessa catena polipeptidica. La struttura terziaria riguarda sia il ripiegamento di ciascun dominio sia la disposizione reciproca finale dei domini di un polipeptide.
4 Le proteine oligomeriche presentano un ulteriore livello di organizzazione srutturale la struttura quaternaria LA STRUTTURA QUATERNARIA descrive il modo in cui le singole catene polipeptidiche sono disposte l'una rispetto all'altra.
5
6 La struttura quaternaria delle proteine La struttura quaternaria riguarda proteine costituite da 2 o più catene polipeptidiche o da più domini strutturali (es. proteine regolatrici). E possibile classificare le proteine in due gruppi: Proteine fibrose con catene disposte in lunghi fasci o foglietti e Proteine globulari con catene polipeptidiche ripiegate a formare forme globulari o sferiche Esempio: la emoglobina Le interazioni tra le subunità consentono grandi variazioni nell attività catalitica Biofisica
7 Per la sintesi di una catena polipeptidica di 4000 residui aminoacidici è necessario un gene che contenga almeno 4OOO x 3 = basi azotate. Per la sintesi di 2O copie di una stessa catena polipeptidica di 200 residui è sufficiente un gene che contenga solo 200 x 3 = 600 basi Biofisica
8 Le proteine con peso molecolare superiore a sono OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ
9 Vantaggi della struttura quaternaria Risparmio di DNA Minimizzazione degli errori casuali durante la biosintesi proteica Presenza di interazioni allosteriche
10 La Ferritina ha un peso molecolare di circa daltons. Non è costituita da una sola catena polipeptidica di 400 a.a. ma di 20 catene identiche di circa 200 residui ciascuna.
11 LA GLICERALDEIDE-3-FOSFATO DEIDROGENASI È COSTITUITA DA 4 SUBUNITÀ IDENTICHE DI 330 RESIDUI (330 X 3 = 990 NUCLEOTIDI) SE LA PROTEINA CONSISTESSE IN 1 CATENA DI (330 X 4) 1320 RESIDUI OCCORREREBBE UN GENOMA DI 3 X 1320=3960 NUCLEOTIDI.
12
13
14 Generalmente nella formazione delle proteine oligomeriche le subunità difettose sono scartate.
15 Nelle cellule le proteine si sintetizzano ad una velocità molto elevata. Le cellule di E.Coli producono una molecola proteica biologicamente attiva contenente 100 residui aminoacidici in 5 sec a 37.
16 COME FANNO LE PROTEINE AD AVVOLGERSI NEL TEMPO DI POCHI SECONDI?
17 Supponiamo che ciascuno dei 2 angoli di torsione, φ ψ, di una proteina con n residui possa assumere 3 conformazioni stabili, le conformazioni possibili per questa proteina saranno 3 2n circa 100 n Se la proteina può esplorare una conformazione ogni secondi Il tempo in sec necessario per esplorare tutte le conformazioni possibili sarà t = 10 n / Per n= 100 t = ( 20 miliardi di anni!)
18 Le proteine non ricercano casualmente la conformazione nativa fra le molte possibili si ripiegano seguendo vie dirette
19 PICCOLI TRATTI DI STRUTTURA SECONDARIA SERVONO DA MEDIATORI DEL PROCESSO DI AVVOLGIMENTO.
20 LA FORMAZIONE DI CORTI SEGMENTI DI STRUTTURA SECONDARIA È MOLTO VELOCE.
21 Questi piccoli tratti (circa 15 residui) si stabilizzano formando dei complessi (es 2α, 2β, αβ) che si chiamano unità di avvolgimento. Intorno a questi centri si stabilizzano poi altri tratti di struttura secondaria
22 L'avvolgimento spontaneo delle catene polipeptidiche nella loro corretta struttura terziaria è un processo altamente cooperativo, in cui la formazione di piccoli elementi accelera la produzione di altri più grandi
23 Il processo di ripiegamento di una proteina procede da uno stato ad alta energia ed alta entropia ad uno a bassa energia e bassa entropia
24 IL processo di avvolgimento delle proteine può essere accelerato dall enzima proteina disolfuro isomerasi
25
26
27 Per alcune proteine a tale processo partecipano gli chaperoni molecolari che : contribuiscono al corretto avvolgimento di una proteina nascente consentono alle proteine ripiegate in modo non corretto di raggiungere la conformazione nativa
28 Esistono due classi di chaperoni molecolari : la famiglia Hsp70 e le chaperonine (Hps60 o GroEL ed o Hsp10 GroES )
29 Le chaperonine sono costituite da due tipi di proteine HP60 (GroEL) e HP10 (GroES) GroEL 14 subunità identiche (549 aa) disposte in due anelli sovrapposti (7+7) GroES 7 subunità identiche (97aa) formano un anello eptamerico
30 Le chaperonine assistono le proteine nella fase di folding, prevenendo il legame con ligandi inappropriati.
31 L informazione per il folding della proteina è contenuta nella sequenza
32 Proteine denaturare al calore, con acidi, o chimici perdono la struttura terziaria e secondaria e la funzione biologica. Il processo è reversibile
33
34 Conformazione, modificazione e degradazione delle proteine Una catena polipeptidica appena sintetizzata deve conformarsi e spesso subire modificazioni chimiche per generare la proteina finale Tutti i polipeptidi con la stessa sequenza amminoacidica assumono, in condizioni standard, la stessa conformazione (lo stato nativo), che è la più stabile conformazione che la molecola può assumere.
35
36 Molte malattie sono dovute al difettoso ripiegamento di una proteina Alcune patologie derivano da proteine che non sono in grado di raggiungere la loro struttura funzionale e che tendono a formare grossi aggregati (fibrille o forme amiloidi): Alzheimer, Parkinson, encefalopatia spongiforme, diabete di tipo II. In altri casi mutazioni puntiformi generano proteine che non raggiungono la loro locazione finale o che non sono più in grado di svolgere la loro funzione perché incapaci di legare i loro substrati. La fibrosi cistica è un difetto nella proteina transmembrana che agisce come un canale degli ioni cloro nelle cellule epiteliali (CFTR: 1480 amminoacidi). La mutazione più comune è la delezione di un amminoacido (Phe 508) e la proteina mutata non si avvolge correttamente.
37 Proteine conformate in modo aberrante sono implicate nello sviluppo di patologie Una placca amiloide nella malattia di Alzheimer è un agglomerato di filamenti proteici
38 Comparazione sequenze Hum αglobina: Bovis: Pig: mvlspadktn vkaawgkvga hageygaeal mvlsaadkgn vkaawgkvgg haaeygaeal vlsaadkan vkaawgkvgg qagahgaeal ermflsfptt ktyfphfdls hgsaqvkghg kkvadaltna vahvddmpna ermflsfptt ktyfphfdls hgsaqvkghg akvaaaltka vehlddlpga ermflgfptt ktyfphfnls hgsdqvkahg kvadaltka vghlddlpga lsalsdlhah klrvdpvnfk llshcllvtl aahlpaeftp avhasldkfl lselsdlhah klrvdpvnfk llshsllvtl ashlpsdftp avhasldkfl lsalsdlhah klrvdpvnfk llshcllvtl aahhpddfnp svhasldkfl asvstvltsk yr anvstvltsk yr anvstvltsk yr
39 L omologia delle sequenze suggerisce relazioni funzionali ed evolutive tra le proteine
40 Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina e mioglobina ci sono stringenti relazioni di parentela: entrambe sono proteine coniugate ed il loro gruppo prostetico (parte non proteica) è il gruppo eme. La mioglobina è una proteina globulare costituita da una singola catena di circa centocinquanta amminoacidi (dipende dall organismo) ed il suo peso molecolare è di circa 18 Kd. E dotata di un gruppo eme che è inserito in una porzione idrofobica (o lipofila) della proteina, costituita da ripiegamenti riconducibili alle strutture α- elica delle proteine fibrose. La mioglobina è composta principalmente da segmenti di α-eliche, presenti in numero di otto e consiste, quasi esclusivamente, di residui non polari (leucina, valina, metionina e fenilalanina) mentre sono praticamente assenti i residui polari (acido aspartico, acido glutammico, lisina e arginina); gli unici residui polari sono due istidine, che svolgono un ruolo fondamentale per l attacco dell ossigeno al gruppo eme. Il gruppo eme è un gruppo cromoforo (assorbe nel visibile) ed è il gruppo funzionale della mioglobina.
41
42 Un po di chimica L'eme è un anello tetrapirrolico (protoporfirina) presenta: - quattro anelli pirrolici tenuti insieme da gruppi metilenici (-CH=); - due gruppi vinilici (CH2=CH), - quattro gruppi metilici (-CH3) e - due propionici (-CH2-CH2-COO-). Il legame tra protoporfirina e ferro è un legame tipico dei composti detti di coordinazione che sono composti chimici in cui un atomo (o ione) centrale, forma dei legami con altre specie chimiche in numero superiore al suo numero di ossidazione (carica elettrica). Nel caso dell eme, tali legami sono reversibili e deboli. Il numero di coordinazione (numero di legami di coordinazione) del ferro è sei: ci possono essere sei molecole attorno al ferro che mettono in condivisione gli elettroni di legame. Per formare un composto di coordinazione, ci vogliono due orbitali con orientamento corretto: uno in grado di "acquistare" elettroni e l altro in grado di donarli
43
44
45 vinilici propionici
46 Nell eme, il ferro forma: Il ferro nell eme - quattro legami planari con i quattro atomi di azoto che si trovano al centro dell anello della proto-porfirina ed - un quinto legame con un azoto dell istidina prossimale; il ferro ha il sesto legame di coordinazione libero e può legarsi all ossigeno. Quando il ferro è sottoforma di ione libero: i suoi orbitali di tipo d hanno tutti la stessa energia; nella mioglobina, lo ione ferro è legato alla protoporfirina e all istidina che perturbano magneticamente gli orbitali d del ferro; l entità della perturbazione sarà diversa per i vari orbitali d a seconda del loro orientamento spaziale e di quella delle specie perturbanti. Dato che: l energia totale degli orbitali deve rimanere costante, la perturbazione causa una separazione energetica tra i vari orbitali: l energia acquisita da alcuni orbitali, equivale all energia persa dagli altri. A rendere più o meno rossa la carne è il contenuto di emoproteine (è l eme che rende rossa la carne).
47
48
49
50 Struttura a 8 segmenti alfa dalla A alla H Con raccordi non alfa: gomiti e della emoglobina
51
52
53 Tasca idrofobica per l eme
54 La mioglobina è una proteina tipica dei muscoli (ma non si trova solo nei muscoli). La mioglobina si estrae dal capodoglio in cui è presente in gran quantità e poi viene purificata. La mioglobina lega in maniera reversibile l ossigeno ed è presente nei tessuti periferici in percentuale tanto maggiore quanto più quel tessuto è abituato a lavorare con approvvigionamenti di ossigeno distanti nel tempo.
55
56 L emoglobina ha molte analogie strutturali con la mioglobina ed è in grado di legare l ossigeno molecolare in modo reversibile; ma, mentre la mioglobina è confinata nei muscoli e nei tessuti periferici in generale, l emoglobina si trova negli eritrociti o globuli rossi (sono pseudo cellule cioè non sono cellule vere e proprie) che costituiscono il 40 % del sangue. Contrariamente alla mioglobina il lavoro dell emoglobina è quello di prelevare ossigeno nei polmoni, rilasciarlo nelle cellule ove ce ne sia bisogno, prelevare anidride carbonica e rilasciarla nel polmoni dove il ciclo ricomincia.
57
58 Emoglobina - L Hb contenuta nei globuli rossi incrementa da 5 ml a 250 ml (50 volte) la capacità di trasporto dell O 2 in un litro di sangue. - In presenza di O 2 si estrae 18 volte più Energia che in sua assenza. - La mioglobina serve da riserva di O 2 permette il movimento dell O 2 dalla superficie della cellula al mitocondrio. - Se l O 2 fosse trasportato alle cellule per semplice diffusione, la dimensione massima di un organismo aerobio sarebbe di 1 mm.
59 ml di O 2 consumato/min riposo lavoro muscoli scheletrici cuore 9 347
60 EMOGLOBINA E La 1^ proteina di cui è stato determinato il PM con accuratezza; - è un tetramero, 4 sub. 2-alfa e 2- beta (141 e 146 aa rispettivamente). - in cui è stata identificata una patologia molecolare; - la 1^ in cui è stata definita la struttura utilizzando la diffrazione ai raggi X. La cooperatività del suo legame all O 2 ha fornito un modello per la comprensione di molte regolazioni enzimatiche
61 Emoglobina umana alfa2(rosso) beta2 (giallo)
62 Nello sviluppo di un essere umano vi sono dei geni che vengono espressi solo per un determinato periodo di tempo; per tale motivo si hanno emoglobine diverse: fetali, embrionali, dell uomo adulto. Le catene che costituiscono queste diverse emoglobine, hanno delle strutture differenti, ma con delle similitudini, infatti la funzione che svolgono è più o meno la stessa.
63
64 Legame cooperativo Quando una proteina è funzionalmente attiva, può mutare la sua forma senza indurre cambi conformazionali nelle proteine vicine; (mioglobina ossigenata non influenza le mioglobine vicine). Invece in proteine associate come l emoglobina: quando una catena si ossigena e cambia la sua forma tale modificazione si ripercuote sulle altre catene del tetrametro. le altre catene del tetrametro assumono un "atteggiamento meno ostile" nei riguardi dell ossigeno: la difficoltà con cui una catena si ossigena diminuisce man mano che le catene ad essa vicine si ossigenano a loro volta. Lo stesso discorso è valido per la deossigenazione.
65 La struttura quaternaria della deossiemoglobina prende il nome di : forma T (tesa) mentre quella della ossiemoglobina viene chiamata forma R (rilasciata); nello stato teso vi sono una serie di interazioni elettrostatiche piuttosto forti tra amminoacidi acidi e amminoacidi basici che portano ad una struttura rigida della deossiemoglobina (ecco il perché del "forma tesa"), mentre quando si lega l ossigeno, l entità di queste interazioni diminuisce (ecco il perché della "forma rilasciata"). Inoltre, in assenza di ossigeno, la carica dell istidina (vedi struttura) viene stabilizzata dalla carica opposta dell acido aspartico mentre, in presenza di ossigeno, c è la tendenza da parte della proteina, a perdere un protone; tutto ciò comporta che l emoglobina ossigenata sia un acido più forte dell emoglobia deossigenata: effetto bohr
66
67
68
69
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Modello del collasso idrofobico. Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60
 Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE. Amminoacidi
 PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
Macromolecole Biologiche. I domini (I)
 I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
Macromolecole Biologiche. I domini (III)
 I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 7
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 7 La struttura delle proteine Concetti chiave: La struttura terziaria di una proteina descrive il ripiegamentodei suoi elementi
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 7 La struttura delle proteine Concetti chiave: La struttura terziaria di una proteina descrive il ripiegamentodei suoi elementi
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini.
 I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
la struttura tridimensionale può essere ottenuta solo per Un intero dominio in genere da 50 a 300 residui
 Durante la traduzione l informazione di ripiegamento codificata nella sequenza aminoacidica diventa disponibile in maniera vettoriale la struttura tridimensionale può essere ottenuta solo per Un intero
Durante la traduzione l informazione di ripiegamento codificata nella sequenza aminoacidica diventa disponibile in maniera vettoriale la struttura tridimensionale può essere ottenuta solo per Un intero
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
DNA - RNA. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi.
 DNA - RNA Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Esistono 4 basi azotate per il DNA e 4 per RNA Differenze
DNA - RNA Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Esistono 4 basi azotate per il DNA e 4 per RNA Differenze
strutture di Proteine
 Laboratorio di Bioinformatica I Database di strutture di Proteine Dott. Sergio Marin Vargas (2014 / 2015) Dal gene alla proteina La funzione della proteina è nella sua struttura 3D. Struttura delle proteine
Laboratorio di Bioinformatica I Database di strutture di Proteine Dott. Sergio Marin Vargas (2014 / 2015) Dal gene alla proteina La funzione della proteina è nella sua struttura 3D. Struttura delle proteine
Ogni globina ha una tasca in cui lega un gruppo EME, quindi l Hb può legare e trasportare 4 molecole di O 2
 Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
BIOLOGIA GENERALE 22-24 ottobre 2007
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
EMOGLOBINA ... www.pianetachimica.it
 EMGLBIA www.pianetachimica.it L'emoglobina è una proteina specializzata nel trasporto di ossigeno, si trova all interno dei globuli rossi del sangue ai quali conferisce il caratteristico colore rosso intenso.
EMGLBIA www.pianetachimica.it L'emoglobina è una proteina specializzata nel trasporto di ossigeno, si trova all interno dei globuli rossi del sangue ai quali conferisce il caratteristico colore rosso intenso.
Macromolecole Biologiche. I domini (II)
 I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
4) PROTEINE FERRO ZOLFO. Contengono Fe e S in quantità equimolecolari; fanno parte dei complessi respiratori. La NADH DH contiene diversi centri Fe-S.
 4) PROTEINE FERRO ZOLFO Contengono Fe e S in quantità equimolecolari; fanno parte dei complessi respiratori. La NADH DH contiene diversi centri Fe-S. Trasportano elettroni attraverso le transizioni Fe
4) PROTEINE FERRO ZOLFO Contengono Fe e S in quantità equimolecolari; fanno parte dei complessi respiratori. La NADH DH contiene diversi centri Fe-S. Trasportano elettroni attraverso le transizioni Fe
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Prof.ssa Gamba Sabrina. Lezione 7: IL DNA. Duplicazione e sintesi delle proteine
 Prof.ssa Gamba Sabrina Lezione 7: IL DNA Duplicazione e sintesi delle proteine concetti chiave della lezione Costituzione fisico-chimica del DNA Basi azotate Duplicazione Concetto di geni Rna Trascrizione
Prof.ssa Gamba Sabrina Lezione 7: IL DNA Duplicazione e sintesi delle proteine concetti chiave della lezione Costituzione fisico-chimica del DNA Basi azotate Duplicazione Concetto di geni Rna Trascrizione
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
GENOMA. c varia da pochi kb nei virus a milioni di kb in piante e animali
 GENOMA Insieme del materiale genetico presente in una cellula (DNA nucleare, plastidiale e mitocondriale) Contiene tutte le informazioni necessarie per consentire la vita alla cellula e all individuo Nei
GENOMA Insieme del materiale genetico presente in una cellula (DNA nucleare, plastidiale e mitocondriale) Contiene tutte le informazioni necessarie per consentire la vita alla cellula e all individuo Nei
Dal DNA all RNA. La trascrizione nei procarioti e negli eucarioti
 Dal DNA all RNA La trascrizione nei procarioti e negli eucarioti DOGMA CENTRALE DELLA BIOLOGIA MOLECOLARE Gene Regione di DNA che porta l informazione (= che CODIFICA) per una catena polipeptidica o per
Dal DNA all RNA La trascrizione nei procarioti e negli eucarioti DOGMA CENTRALE DELLA BIOLOGIA MOLECOLARE Gene Regione di DNA che porta l informazione (= che CODIFICA) per una catena polipeptidica o per
Rappresentazione dei Dati Biologici
 Rappresentazione dei Dati Biologici CORSO DI BIOINFORMATICA C.d.L. Ingegneria Informatica e Biomedica Outline Proteine ed Amminoacidi Rappresentazione di Amminoacidi Rappresentazione delle strutture Proteiche
Rappresentazione dei Dati Biologici CORSO DI BIOINFORMATICA C.d.L. Ingegneria Informatica e Biomedica Outline Proteine ed Amminoacidi Rappresentazione di Amminoacidi Rappresentazione delle strutture Proteiche
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
NUCLEOTIDI e ACIDI NUCLEICI
 NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
CELLULE EUCARIOTICHE
 CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Il metabolismo dell RNA. Prof. Savino; dispense di Biologia Molecolare, Corso di Laurea in Biotecnologie
 Il metabolismo dell RNA I vari tipi di RNA Il filamento di DNA che dirige la sintesi dello mrna è chiamato filamento stampo o filamento antisenso. L altro filamento che ha sequenza identica a quella dello
Il metabolismo dell RNA I vari tipi di RNA Il filamento di DNA che dirige la sintesi dello mrna è chiamato filamento stampo o filamento antisenso. L altro filamento che ha sequenza identica a quella dello
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
Lezione 4 *membrana cellulare *trasporti *specializzazioni del plasmalemma
 Lezione 4 *membrana cellulare *trasporti *specializzazioni del plasmalemma Lezione 3 membrana cellulare Le membrane, sia quelle che delimitano e costituiscono gli organuli cellulari che quelle che rivestono
Lezione 4 *membrana cellulare *trasporti *specializzazioni del plasmalemma Lezione 3 membrana cellulare Le membrane, sia quelle che delimitano e costituiscono gli organuli cellulari che quelle che rivestono
L adattamento dei batteri. Strategie di adattamento
 L adattamento dei batteri Strategie di adattamento mutazione trasferimento genico orizzontale regolazione dell espressione genica regolazione della trascrizione regolazione della traduzione regolazione
L adattamento dei batteri Strategie di adattamento mutazione trasferimento genico orizzontale regolazione dell espressione genica regolazione della trascrizione regolazione della traduzione regolazione
Riepilogo 1^ lezione
 Riepilogo 1^ lezione I 20 amminoacidi che si trovano comunemente nelle proteine sono uniti l uno all altro da legami peptidici. La sequenza lineare degli amminoacidi legati contiene l informazione necessaria
Riepilogo 1^ lezione I 20 amminoacidi che si trovano comunemente nelle proteine sono uniti l uno all altro da legami peptidici. La sequenza lineare degli amminoacidi legati contiene l informazione necessaria
- CINETICA ENZIMATICA
 - CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
- CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA)
 SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA) ORGANIZZAZIONE TERZIARIA DEL DNA Il DNA cellulare contiene porzioni geniche e intergeniche, entrambe necessarie per le funzioni vitali della
SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA) ORGANIZZAZIONE TERZIARIA DEL DNA Il DNA cellulare contiene porzioni geniche e intergeniche, entrambe necessarie per le funzioni vitali della
Rapporto Struttura/Funzione delle Proteine
 Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Rapporto Struttura/Funzione delle Proteine Struttura/Funzione delle Proteine Interazioni proteina-ligando come base della funzione di molte proteine
Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Rapporto Struttura/Funzione delle Proteine Struttura/Funzione delle Proteine Interazioni proteina-ligando come base della funzione di molte proteine
Figura 1. Rappresentazione della doppia elica di DNA e struttura delle differenti basi.
 Sommario La molecola di DNA è deputata a conservare le informazioni genetiche necessarie per lo sviluppo ed il funzionamento degli organismi viventi. Poiché contiene le istruzioni per la costruzione delle
Sommario La molecola di DNA è deputata a conservare le informazioni genetiche necessarie per lo sviluppo ed il funzionamento degli organismi viventi. Poiché contiene le istruzioni per la costruzione delle
Struttura delle proteine
 Struttura delle proteine I II III Copyright 2001-2015 by Giorgio Sartor. All rights reserved. Versione 1.0.2 oct 2015 Struttura quaternaria Èil livello di organizzazione per il quale si formano strutture
Struttura delle proteine I II III Copyright 2001-2015 by Giorgio Sartor. All rights reserved. Versione 1.0.2 oct 2015 Struttura quaternaria Èil livello di organizzazione per il quale si formano strutture
Alberto Viale I CROMOSOMI
 Alberto Viale I CROMOSOMI DA MENDEL ALLA GENETICA AL DNA ALLE MUTAZIONI I cromosomi sono dei particolari bastoncelli colorati situati nel nucleo delle cellule. Sono presenti nelle cellule di ogni organismo
Alberto Viale I CROMOSOMI DA MENDEL ALLA GENETICA AL DNA ALLE MUTAZIONI I cromosomi sono dei particolari bastoncelli colorati situati nel nucleo delle cellule. Sono presenti nelle cellule di ogni organismo
http://sds.coniliguria.it 1
 Aspetti metabolici dell esercizio fisico Genova 22 gennaio 2011 A cura di Attilio TRAVERSO http://sds.coniliguria.it 1 L allenamento produce modificazioni fisiologiche (adattamenti) in quasi tutti i sistemi
Aspetti metabolici dell esercizio fisico Genova 22 gennaio 2011 A cura di Attilio TRAVERSO http://sds.coniliguria.it 1 L allenamento produce modificazioni fisiologiche (adattamenti) in quasi tutti i sistemi
GENETICA seconda parte
 GENETICA seconda parte I cromosomi sono lunghe molecole di una sostanza l acido desossiribonucleico. DNA Il DNA è una lunga catena fatta da due lunghi fili avvolti su se stessi a doppia elica. Sembra una
GENETICA seconda parte I cromosomi sono lunghe molecole di una sostanza l acido desossiribonucleico. DNA Il DNA è una lunga catena fatta da due lunghi fili avvolti su se stessi a doppia elica. Sembra una
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
L APPARATO CIRCOLATORIO
 L APPARATO CIRCOLATORIO Tutte le cellule del nostro corpo hanno bisogno di sostanze nutritive e di ossigeno per svolgere le loro funzioni vitali. Così, esiste il sangue, un tessuto fluido che porta in
L APPARATO CIRCOLATORIO Tutte le cellule del nostro corpo hanno bisogno di sostanze nutritive e di ossigeno per svolgere le loro funzioni vitali. Così, esiste il sangue, un tessuto fluido che porta in
Dispensa di Informatica I.1
 IL COMPUTER: CONCETTI GENERALI Il Computer (o elaboratore) è un insieme di dispositivi di diversa natura in grado di acquisire dall'esterno dati e algoritmi e produrre in uscita i risultati dell'elaborazione.
IL COMPUTER: CONCETTI GENERALI Il Computer (o elaboratore) è un insieme di dispositivi di diversa natura in grado di acquisire dall'esterno dati e algoritmi e produrre in uscita i risultati dell'elaborazione.
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca
 INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Emoglobina e mioglobina
 Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Le proteine. Le proteine sono i mattoncini che costituiscono gli organismi viventi.
 Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
SINTESI DELL RNA. Replicazione. Trascrizione. Traduzione
 SINTESI DELL RNA Replicazione Trascrizione Traduzione L RNA ha origine da informazioni contenute nel DNA La TRASCRIZIONE permette la conversione di una porzione di DNA in una molecola di RNA con una sequenza
SINTESI DELL RNA Replicazione Trascrizione Traduzione L RNA ha origine da informazioni contenute nel DNA La TRASCRIZIONE permette la conversione di una porzione di DNA in una molecola di RNA con una sequenza
Il magnetismo nella materia
 Le orbite degli elettroni in atomo di idrogeno Forma spaziale degli Orbitali elettronici di atomo di idrogeno Un solido Il magnetismo nella materia ferrimagnetismo Dr. Daniele Di Gioacchino Istituto Nazionale
Le orbite degli elettroni in atomo di idrogeno Forma spaziale degli Orbitali elettronici di atomo di idrogeno Un solido Il magnetismo nella materia ferrimagnetismo Dr. Daniele Di Gioacchino Istituto Nazionale
SINTESI PROTEICA. Replicazione. Trascrizione. Traduzione
 Replicazione SINTESI PROTEICA Trascrizione Traduzione 61 codoni codificanti 3 triplette non senso (STOP) AUG codone di inizio codone per Met Caratteristiche del codice genetico Specificità Il codice genetico
Replicazione SINTESI PROTEICA Trascrizione Traduzione 61 codoni codificanti 3 triplette non senso (STOP) AUG codone di inizio codone per Met Caratteristiche del codice genetico Specificità Il codice genetico
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
in Terminazione Neurone Dendriti Soma Fessura sinaptica sinaptica Nucleo dendrite Segmento iniziale Sinapsi inibitoria Segmento mielinico Assone
 Le funzioni del sistema nervoso si basano sull attività dei neuroni che consiste nel generare, trasmettere ed elaborare informazioni nervose, che dipendono da modificazioni del potenziale di membrana,
Le funzioni del sistema nervoso si basano sull attività dei neuroni che consiste nel generare, trasmettere ed elaborare informazioni nervose, che dipendono da modificazioni del potenziale di membrana,
352&(662',&20%867,21(
 352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
Capitolo 17. Risposte alle domande interne al capitolo. 17.1 (p. 501) a. glicina. b. prolina. c. treonina. d. aspartato
 apitolo 17 Risposte alle domande interne al capitolo 17.1 (p. 501) a. glicina b. prolina c. treonina d. aspartato e. 17.2 (p. 501) a. La glicina è un aminoacido idrofobico. b. La prolina è un aminoacido
apitolo 17 Risposte alle domande interne al capitolo 17.1 (p. 501) a. glicina b. prolina c. treonina d. aspartato e. 17.2 (p. 501) a. La glicina è un aminoacido idrofobico. b. La prolina è un aminoacido
Regione cerniera monomero regione cerniera
 Regione cerniera Tutte le Ig, sia quelle secrete che quelle presenti sulla membrana plasmatica dei linfociti B, sono costituite da quattro catene proteiche, due pesanti (H, da heavy, in rosso nel disegno)
Regione cerniera Tutte le Ig, sia quelle secrete che quelle presenti sulla membrana plasmatica dei linfociti B, sono costituite da quattro catene proteiche, due pesanti (H, da heavy, in rosso nel disegno)
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
Proteine integrali di membrana legate sul versante esterno a gruppi di carboidrati. Formati da diverse subunità che circoscrivono un poro acquoso che
 Canali ionici Proteine integrali di membrana legate sul versante esterno a gruppi di carboidrati. Formati da diverse subunità che circoscrivono un poro acquoso che permette il passaggio selettivo di ioni.
Canali ionici Proteine integrali di membrana legate sul versante esterno a gruppi di carboidrati. Formati da diverse subunità che circoscrivono un poro acquoso che permette il passaggio selettivo di ioni.
BIOMOLECOLE STRUTTURA E FUNZIONE
 BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
RNA polimerasi operone. L operatore è il tratto
 La regolazione genica nei procarioti Alcune proteine vengono prodotte dalla cellula ad un ritmo relativamente costante e l attività dei geni che codificano queste proteine non è regolata in modo sofisticato.
La regolazione genica nei procarioti Alcune proteine vengono prodotte dalla cellula ad un ritmo relativamente costante e l attività dei geni che codificano queste proteine non è regolata in modo sofisticato.
«Macromolecole» Lipidi
 LIPIDI (1) «Macromolecole» Lipidi Biotecnologie Miscellanea di molecole biologiche che condividono la proprietà di non essere solubili in acqua. Molecole idrofobiche. Es: Grassi Oli (grasso liquido a temperatura
LIPIDI (1) «Macromolecole» Lipidi Biotecnologie Miscellanea di molecole biologiche che condividono la proprietà di non essere solubili in acqua. Molecole idrofobiche. Es: Grassi Oli (grasso liquido a temperatura
Il DNA e la duplicazione cellulare. Acidi nucleici: DNA, materiale ereditario
 Il DN e la duplicazione cellulare Il DN, materiale ereditario Struttura del DN Replicazione del DN Dal DN alla proteina Il odice genetico iclo cellulare Mitosi Meiosi Da Figura 8-11 ampbell & Reece cidi
Il DN e la duplicazione cellulare Il DN, materiale ereditario Struttura del DN Replicazione del DN Dal DN alla proteina Il odice genetico iclo cellulare Mitosi Meiosi Da Figura 8-11 ampbell & Reece cidi
Capitolo II. La forma del valore. 7. La duplice forma in cui si presenta la merce: naturale e di valore.
 Capitolo II La forma del valore 7. La duplice forma in cui si presenta la merce: naturale e di valore. I beni nascono come valori d uso: nel loro divenire merci acquisiscono anche un valore (di scambio).
Capitolo II La forma del valore 7. La duplice forma in cui si presenta la merce: naturale e di valore. I beni nascono come valori d uso: nel loro divenire merci acquisiscono anche un valore (di scambio).
Le Ig sono glicoproteine costituite da 4 catene polipeptidiche:
 Struttura delle Ig Le Ig sono glicoproteine costituite da 4 catene polipeptidiche: 2 catene pesanti H (heavy( heavy) di P.M. 50.000 D, formate da c/a 450 amminoacidi 2 catene leggere L (light) Di P.M.
Struttura delle Ig Le Ig sono glicoproteine costituite da 4 catene polipeptidiche: 2 catene pesanti H (heavy( heavy) di P.M. 50.000 D, formate da c/a 450 amminoacidi 2 catene leggere L (light) Di P.M.
LA GENETICA: DNA e RNA LA GENETICA. DNA e RNA. Prof. Daniele Verri
 LA GENETICA DNA e RNA Prof. Daniele Verri L'acido desossiribonucleico o deossiribonucleico (DNA) è un acido nucleico che contiene le informazioni necessarie per la formazione di RNA e proteine. LA GENETICA:
LA GENETICA DNA e RNA Prof. Daniele Verri L'acido desossiribonucleico o deossiribonucleico (DNA) è un acido nucleico che contiene le informazioni necessarie per la formazione di RNA e proteine. LA GENETICA:
LE MOLECOLE INFORMAZIONALI. Lezioni d'autore Treccani
 LE MOLECOLE INFORMAZIONALI Lezioni d'autore Treccani Introduzione (I) I pionieri della biologia molecolare, scoperta la struttura degli acidi nucleici, pensarono di associare al DNA una sequenza di simboli,
LE MOLECOLE INFORMAZIONALI Lezioni d'autore Treccani Introduzione (I) I pionieri della biologia molecolare, scoperta la struttura degli acidi nucleici, pensarono di associare al DNA una sequenza di simboli,
I database relazionali sono il tipo di database attualmente piu diffuso. I motivi di questo successo sono fondamentalmente due:
 Il modello relazionale I database relazionali sono il tipo di database attualmente piu diffuso. I motivi di questo successo sono fondamentalmente due: 1. forniscono sistemi semplici ed efficienti per rappresentare
Il modello relazionale I database relazionali sono il tipo di database attualmente piu diffuso. I motivi di questo successo sono fondamentalmente due: 1. forniscono sistemi semplici ed efficienti per rappresentare
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Regole della mano destra.
 Regole della mano destra. Macchina in continua con una spira e collettore. Macchina in continua con due spire e collettore. Macchina in continua: schematizzazione di indotto. Macchina in continua. Schematizzazione
Regole della mano destra. Macchina in continua con una spira e collettore. Macchina in continua con due spire e collettore. Macchina in continua: schematizzazione di indotto. Macchina in continua. Schematizzazione
CONOSCERE IL PROPRIO CORPO
 CONOSCERE IL PROPRIO CORPO Gli esseri viventi sono fatti di parti che funzionano assieme in modo diverso. Hanno parti diverse che fanno cose diverse. Il tuo corpo è fatto di molte parti diverse. Alcune
CONOSCERE IL PROPRIO CORPO Gli esseri viventi sono fatti di parti che funzionano assieme in modo diverso. Hanno parti diverse che fanno cose diverse. Il tuo corpo è fatto di molte parti diverse. Alcune
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
www.fisiokinesiterapia.biz TRASCRIZIONE
 www.fisiokinesiterapia.biz TRASCRIZIONE TRASCRIZIONE Processo mediante il quale una sequenza di DNA (un gene) viene copiata in una sequenza di RNA Dalla trascrizione derivano gli mrna, che verranno tradotti
www.fisiokinesiterapia.biz TRASCRIZIONE TRASCRIZIONE Processo mediante il quale una sequenza di DNA (un gene) viene copiata in una sequenza di RNA Dalla trascrizione derivano gli mrna, che verranno tradotti
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
a cura di : Gaia,Giulia, Lorenzo e Simone 2^ B ( LA MIGLIORE)
 a cura di : Gaia,Giulia, Lorenzo e Simone 2^ B ( LA MIGLIORE) I grassi nella piramide alimentare Forniscono molta ENERGIA!!! Danno gusto al cibo Trasportano alcune vitamine o LIPIDI Però se se ne mangiano
a cura di : Gaia,Giulia, Lorenzo e Simone 2^ B ( LA MIGLIORE) I grassi nella piramide alimentare Forniscono molta ENERGIA!!! Danno gusto al cibo Trasportano alcune vitamine o LIPIDI Però se se ne mangiano
Amminoacidi e Proteine
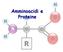 Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
I L I P I D I. Lipidi complessi: fosfolipidi e glicolipidi; sono formati da CHO e altre sostanze.
 I L I P I D I ASPETTI GENERALI I Lipidi o grassi sono la riserva energetica del nostro organismo; nel corpo umano costituiscono mediamente il 17% del peso corporeo dove formano il tessuto adiposo. In generale
I L I P I D I ASPETTI GENERALI I Lipidi o grassi sono la riserva energetica del nostro organismo; nel corpo umano costituiscono mediamente il 17% del peso corporeo dove formano il tessuto adiposo. In generale
La mutazione è una modificazione della sequenza delle basi del DNA
 La mutazione è una modificazione della sequenza delle basi del DNA Le mutazioni sono eventi rari e importanti in quanto sono alla base dell evoluzione biologica Le mutazioni possono essere spontanee (dovute
La mutazione è una modificazione della sequenza delle basi del DNA Le mutazioni sono eventi rari e importanti in quanto sono alla base dell evoluzione biologica Le mutazioni possono essere spontanee (dovute
Gli orbitali: modello atomico probabilistico
 1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 10
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 10 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 10 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Emoglobina e mioglobina
 Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Laboratorio di Tecniche Microscopiche AA 2007-2008 Lezione 12 Marzo 2008 Ore 15-16
 Laboratorio di Tecniche Microscopiche AA 2007-2008 Lezione 12 Marzo 2008 Ore 15-16 L'immunoistochimica e' una tecnica ampiamente utilizzata per l'identificazione e la localizzazione di costituenti cellulari
Laboratorio di Tecniche Microscopiche AA 2007-2008 Lezione 12 Marzo 2008 Ore 15-16 L'immunoistochimica e' una tecnica ampiamente utilizzata per l'identificazione e la localizzazione di costituenti cellulari
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas
 1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
Sistema di filtrazione abbinato ad una pompa del vuoto. Sistema semplice per la filtrazione
 Filtrazione: definizioni La FILTRAZIONE è un comune metodo di separazione basato sul seguente principio: le particelle più piccole di una determinata dimensione passano attraverso i pori di un filtro,
Filtrazione: definizioni La FILTRAZIONE è un comune metodo di separazione basato sul seguente principio: le particelle più piccole di una determinata dimensione passano attraverso i pori di un filtro,
IL RISPARMIO ENERGETICO E GLI AZIONAMENTI A VELOCITA VARIABILE L utilizzo dell inverter negli impianti frigoriferi.
 IL RISPARMIO ENERGETICO E GLI AZIONAMENTI A VELOCITA VARIABILE L utilizzo dell inverter negli impianti frigoriferi. Negli ultimi anni, il concetto di risparmio energetico sta diventando di fondamentale
IL RISPARMIO ENERGETICO E GLI AZIONAMENTI A VELOCITA VARIABILE L utilizzo dell inverter negli impianti frigoriferi. Negli ultimi anni, il concetto di risparmio energetico sta diventando di fondamentale
