Il legame chimico. Energia di legame
|
|
|
- Ilaria Dorotea Caputo
- 7 anni fa
- Visualizzazioni
Transcript
1 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta, se vi è un legame tra atomi diversi Energia di legame È l energia necessaria per rompere il legame chimico portando gli atomi neutri a distanza infinita E E E AB A + B A + B AB E
2 Si dice che tra due atomi A e B si forma un legame chimico quando essi tendono a formare un aggregato stabile AB tale che per ridurlo di nuovo allo stato di atomi isolati sia richiesta la spesa di una certa quantità di energia. Equazione di Mors E= D 0 [ a (r r ) a (r r ) ] 0 0 e e E elet = E cin +E Coulomb E elettronica del legame = E elettronica complessiva di AB E elet. di A E elet. di B E elettronica del legame > E per spezzare il legame AB
3 Le proprietà di un atomo sono determinate dalla sua struttura elettronica esterna. Tutti gli atomi tendono ad avere una configurazione elettronica stabile (n s n p 6 ) e a parte l He (1s ) e i gas nobili che già la detengono, tutti gli altri atomi cercano di raggiungerla. La formazione del legame chimico può essere quindi giustificata dalla così detta regola dell ottetto, che presuppone il raggiungimento di una configurazione elettronica stabile come quella degli elementi dell ottavo gruppo. Tipi di legami FORTI Trasferimento di elettroni Compartecipazione di elettroni LEGAME IONICO LEGAME COVALENTE Omeopolare ed Eteropolare DEBOLI LEGAME METALLICO LEGAME IDROGENO INTERAZIONI DI VAN DER WAALS
4 Il legame ionico Il bilancio complessivo della variazione d energia che accompagna la trasformazione di due atomi Na e Cl isolati allo stato gassoso in due ioni. I) Na + e - E I = E (Na) ion = 5.14 ev = 118 kcal/mol II) Cl + e - Cl E II = E (Cl) af.el = -3.8 ev = - 88 kcal/mol III) + E III = E Coulomb = ev = kcal/mol Cl E = E I + E II + E III = ev = kcal/mol
5 Il cristallo di cloruro di sodio e l'energia reticolare Na ( s ) + 1 Cl ( g ) ( s ) 1) Na (s) Na (g) E 1 = Calore di sublimazione = + 6 kcal/mol ) ½ Cl (g) Cl (g) E = ½ Energia di dissociazione = kcal/mol 3) Na (g) (g) + e- E 3 = Energia di ionizzazione = kcal/mol 4) Cl (g) +e - (g) E = Affinità elettronica = kcal/mol E 1 +E +E 3 +E 4 = kcal/mol Le interazioni elettrostatiche trà gli ioni e fanno si che questi si trovino sottoposti ai campi elettrici reciproci, producendo una ricerca di posizioni alle quali competono basse energie potenziali. Si ha quindi la costituzione di un reticolo cristallino al quale è associata una energia che chiameremo Energia reticolare
6 Cristallo di NaCl
7 E = 6 Mad e r e r 0 8 e 3 r e r Cl- Na + R Na Cl + - Cl R - 0 R o Cl R - 1 R 1 R 3 Cl- R1 = r0 = r0 ( ) r0 + r0 3 0 R = = r R 3 = r e E Mad = = 3 r0 - α e r 0
8 Interazione repulsive tra le nuvole elettroniche degli ioni vicini: E repulz. = 6 b e a Corrisponde al 10-15% dell E Mad r 0 Interazioni attrattive tra il nucleo di uno ione egli elettroni degli ioni vicini: Forze di London z z (q 1 e ar E = 0 Reticolare α 6 b e r + 0 ) London E London = -3% dell E Mad per il cloruro di sodio E reticolare = = -188 kcal/mol E E 1 +E +E 3 +E 4 +E ret = kcal/mol
9 I Tipi fondamentali di coordinazione propri dei reticoli cristallini ionici
10
11 Contributi all energia reticolare di diversi alogenuri alcalini (kcal mol -1 ) Cristallo E mad (1) Madelung E rep () Repulzione E london () Forz. di London E reticolare Calcolata E reticolare Sperimentale NaCl KCl RbCl CsCl NaF NaBr NaI (1) I valori riportati per l energia di Madelung sono stati calcolati in base all equazione vista introducendovi per r 0 la somma dei raggi ionici ( r + + r - ) () Osservare che la E Rep è ~ il 10-15% dell E mad e che E London ~ il -3% dell E Mad
12 Solidi ionici I solidi ionici sono caratterizzati da legami forti, di tipo ionico. Il solido ionico ha una struttura cristallina in cui, i nodi reticolari sono occupati da ioni positivi e negativi, tra i quali si esercita la forza di attrazione Coulombiana generando dei legami ionici direzionali, con coordinazione 8 come per il CsCl, 6 come per il NaCl, e 4 come per il ZnS. Sono solidi molto duri ma fragili a causa dell esistenza di superfici preferenziali di sfaldamento I solidi ionici sono solidi molto stabili e questo comporta temperature di fusione relativamente alte. I solidi ionici non sono conduttori di corrente mentre il suo stato fuso conduce molto bene. I solidi ionici conducono molto poco il calore. I solidi ionici sono molto solubili in solventi polari come per esempio l acqua F = 1 4πε q1 q r ε è la costante dielettrica (o permettività) ε Costante dielettrica del vuoto = 1 (in unità cgs) ε La costante dielettrica dell acqua =78 (in unità cgs)
13 Temperature di fusione ed ebollizione di alcuni composti ionici in relazione con la loro energia reticolare Composto Energia reticolare T f ( C) T eb ( C) (kcal/mol) NaF NaCl NaBr NaI CaO
14 Il legame covalente (o legame atomico) Teoria del legame di Valenza VB (Valence Bond) G.N. Lewis 1916 Teoria dell orbitale molecolare MO (Molecular Orbital) E.V. Condon, W. Heitler, F. London 197 La teoria VB ammette che gli atomi che costituiscono la molecola conservino intatta la struttura elettronica interna, e che si leghino fra loro mediante elettroni esterni dando luogo a legami fra coppie di atomi, che nel loro insieme costituiscono la struttura portante della molecola. La teoria MO, invece, ammette che nella formazione della molecola, gli atomi non conservino la loro identità, che tutti i loro elettroni si distribuiscano su nuovi orbitali, molecolari, che, estesi alla intera molecola, costituiscono nel loro insieme l elemento legante di tutti i nuclei. Nella teoria MO la struttura della molecola è concepita analoga alla struttura dell atomo: in questo esiste un nucleo attorno al quale gli elettroni sono distribuiti su orbitali atomici monocentrici; nella molecola esiste un insieme di nuclei attorno ai quali sono distribuiti, su orbitali molecolari policentrici, gli elettroni che appartenevano ai singoli atomi che la costituiscono.
15
16 Il legame covalente di tipo σ
17 Legami σ e π nella molecola N a) Legame π tra orbitali p e d b) Legame π tra orbitali d e d
18
19 Elettronegativitá Si indica con il nome di Elettronegatività la proprietà di un atomo, in una molecola, di addensare su di se la carica elettrica dell orbitale di legame. Può affermarsi, che tra due atomi A e B è piú elettronegativo quello che ha maggiore densità elettronica (carica elettrica per unità di volume). Surplus di energia L energia che si deve fornire per rompere un legame viene detta energia di legame. Per il calcolo dell energia di legame, per i legami covalenti puri, vale un postulato della media geometrica: E Esempio: per H E E E A B Dove E = EA A E A-A = energia del legame A-A B B e E B-B = energia del legame B-B E H-H = 436 kj/mol per il Cl E Cl-Cl = 4.7 kj/mol H Cl = H H Cl Cl = = 35.3 kj mol L energia sperimentale di legame per H--Cl vale kj/mol Si definisce Surplus di energia e si indica con la differenza tra il valore sperimentale e quello calcolato 1 = = kj/mol
20 L elettronegativitá di un atomo si manifesta quando questo si lega ad un altro atomo. L idrogeno è l elemento preso di paragone. I valori di elettronegativitá, che sono legati al surplus di energia, devono godere della propritá additiva. Relazione di Pauling per il calcolo dell elettronegativitá x A -.1 = 0.10 Per molecole biatomiche, sia pure con approssimazione, si può calcolare la percentuale elettrostatica dell energia di legame P = 1 - e - x A -x B Esempio: HF 55% ; HCl 0% ; HBr 10% ; HI 5%
21
22 Il dipolo elettrico Ogni volta che si forma un legame covalente tra atomi con diversa elettronegativitá lungo il legame si crea un dipolo elettrico. d q + q che è quantitativamente definito dal suo momento dipolare µ : µ : µ = q d Il dipolo, si può convenientemente rappresentare con un vettore diretto dall atomo positivo verso l atomo negativo d q + _ q + _ il cui modulo è proporzionale al prodotto q * d
23 + + + Somma geometrica di momenti dipolari = = = Risultante Zero + =
24 Molecole apolari Molecole polari
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico. Energia di legame E AB A + B A + B AB E
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
le SOSTANZE Sostanze elementari (ELEMENTI) COMPOSTI Costituiti da due o più atomi DIVERSI tra loro
 Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
LEGAMI CHIMICI. Gli elettroni esterni sono implicati nella formazione dei legami chimici
 LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
M M n+ + n e - X + n e - X n-
 IL LEGAME IONICO 1 Il legame ionico Descrizione generale La formazione di NaCl La valenza ionica L energia reticolare: definizione e esempio di calcolo Proprietà dei solidi ionici Il legame ionico si realizza
IL LEGAME IONICO 1 Il legame ionico Descrizione generale La formazione di NaCl La valenza ionica L energia reticolare: definizione e esempio di calcolo Proprietà dei solidi ionici Il legame ionico si realizza
Legame Covalente Polare e MOT. Polarità del legame aumenta con differenza di elettronegatività.
 Legame Covalente Polare e MOT Polarità del legame aumenta con differenza di elettronegatività. Legame Ionico Se differenza di elettronegatività è molto grande si ottiene un legame ionico. Legame Ionico
Legame Covalente Polare e MOT Polarità del legame aumenta con differenza di elettronegatività. Legame Ionico Se differenza di elettronegatività è molto grande si ottiene un legame ionico. Legame Ionico
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
PROPRIETA DEI MATERIALI
 PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
PROPRIETÀ PERIODICHE DEGLI ELEMENTI
 PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
Legame nei cristalli. Cosa tiene insieme un cristallo?
 Legame nei cristalli Cosa tiene insieme un cristallo? L energia di coesione, dovuta all interazione elettrostatica attrattiva fra gli elettroni, carichi negativamente, e i nuclei, carichi positivamente
Legame nei cristalli Cosa tiene insieme un cristallo? L energia di coesione, dovuta all interazione elettrostatica attrattiva fra gli elettroni, carichi negativamente, e i nuclei, carichi positivamente
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
LEGAME CHIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici.
 LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O?
 IL LEGAME CHIMICO Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O? Configurazione degli elettroni diversa ed energeticamente più favorevole di quella degli atomi isolati? Ionico (trasferimento di
IL LEGAME CHIMICO Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O? Configurazione degli elettroni diversa ed energeticamente più favorevole di quella degli atomi isolati? Ionico (trasferimento di
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
combinazione di atomi tenuti insieme da forze più o meno un insieme caratteristico di proprietà
 IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
1.039 g g/mol g g/mol
 Un campione di un liquido di massa 0.5438 g, formato da C, H e O, viene bruciato in ossigeno puro. Si ottengono 1.039 g di CO 2 ed 0.6369 g di H 2 O. Determinare la formula chimica (molecolare) Se X(C,H,O)
Un campione di un liquido di massa 0.5438 g, formato da C, H e O, viene bruciato in ossigeno puro. Si ottengono 1.039 g di CO 2 ed 0.6369 g di H 2 O. Determinare la formula chimica (molecolare) Se X(C,H,O)
Legame chimico. Geometrie molecolari
 Legame chimico Formule di Struttura Geometrie molecolari (He, Fe, Cu) (H 2, N 2, O 2 ) (H 2 O, NH 3, CO 2 ) (NaH, NaCl) La ragione per cui alcuni composti hanno strutture ioniche e non molecolari dipende
Legame chimico Formule di Struttura Geometrie molecolari (He, Fe, Cu) (H 2, N 2, O 2 ) (H 2 O, NH 3, CO 2 ) (NaH, NaCl) La ragione per cui alcuni composti hanno strutture ioniche e non molecolari dipende
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
I Legami intermolecolari
 I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Per comprendere le proprietà delle molecole è molto importante determinare:
 Legame chimico Per comprendere le proprietà delle molecole è molto importante determinare: la STRUTTURA, ovvero il modo in cui gli atomi sono disposti nello spazio la NATURA DEL LEGAME, ovvero il tipo
Legame chimico Per comprendere le proprietà delle molecole è molto importante determinare: la STRUTTURA, ovvero il modo in cui gli atomi sono disposti nello spazio la NATURA DEL LEGAME, ovvero il tipo
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Il legame chimico. Legame metallico
 Il legame chimico Legame ionico: un atomo cede elettroni e un altro li acquista con formazione di ioni di carica opposta che vengono tenuti insieme da forze elettrostatiche. Legame covalente: si realizza
Il legame chimico Legame ionico: un atomo cede elettroni e un altro li acquista con formazione di ioni di carica opposta che vengono tenuti insieme da forze elettrostatiche. Legame covalente: si realizza
Le forze intermolecolari Manifestazione delle forze intermolecolari
 1 Le forze intermolecolari Manifestazione delle forze intermolecolari 2 I gas nobili (He, Ne, Ar...) che NON formano legami chimici dovrebbero restare gassosi a qualsiasi temperatura. Invece a T molto
1 Le forze intermolecolari Manifestazione delle forze intermolecolari 2 I gas nobili (He, Ne, Ar...) che NON formano legami chimici dovrebbero restare gassosi a qualsiasi temperatura. Invece a T molto
= Atomo di idrogeno (H) molecola dell idrogeno (H 2 )
 IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
CARATTERISTICHE DEGLI ATOMI
 CARATTERISTICHE DEGLI ATOMI Isotopi: Z è lo stesso, A è diverso Isotopi dell O e loro abbondanza naturale 16 O = 99.76 % (15.99491) 17 O = 0.04 % (16.99913) 18 O = 0.20 % (17.99916) O = 15.9994 27/04/2007
CARATTERISTICHE DEGLI ATOMI Isotopi: Z è lo stesso, A è diverso Isotopi dell O e loro abbondanza naturale 16 O = 99.76 % (15.99491) 17 O = 0.04 % (16.99913) 18 O = 0.20 % (17.99916) O = 15.9994 27/04/2007
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più esterno
Olimpiadi di Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più esterno
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
FORMAZIONE DI LEGAMI. Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato.
 FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia
FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia
Legami secondari e lo stato fisico
 Legami secondari e lo stato fisico Gli stati aggregati (stato solido, liquido) richiedono la presenza di forze intermolecolari tra le molecole che compongono la sostanza. Legame ione dipolo (si forma fra
Legami secondari e lo stato fisico Gli stati aggregati (stato solido, liquido) richiedono la presenza di forze intermolecolari tra le molecole che compongono la sostanza. Legame ione dipolo (si forma fra
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
GLI STATI DI DI AGGREGAZIONE DELLA MATERIA. Dispense di Chimica Fisica per Biotecnologie I Anno- Dr.ssa R. Terracciano
 GLI STATI DI DI AGGREGAZIONE DELLA MATERIA GLI STATI DI AGGREGAZIONE DELLA MATERIA La materia esiste nei tre stati solido liquido e gassoso. Un solido ha volume e forma propri. Un liquido ha volume proprio,
GLI STATI DI DI AGGREGAZIONE DELLA MATERIA GLI STATI DI AGGREGAZIONE DELLA MATERIA La materia esiste nei tre stati solido liquido e gassoso. Un solido ha volume e forma propri. Un liquido ha volume proprio,
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Introduzione alla chimica organica. 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole
 Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
VIRT&L-COMM IL LEGAME CHIMICO. TFA II Ciclo a.a.2014/2016. Dott. Angela Casu ISSN:
 IL LEGAME CHIMICO TFA II Ciclo a.a.2014/2016 Dott. Angela Casu UN VIDEO INTRODUTTIVO Per vedere il video CLICCA QUI Sommario 1. Il legame chimico 2. L elettronegatività 3. Il legame ionico 4. Composti
IL LEGAME CHIMICO TFA II Ciclo a.a.2014/2016 Dott. Angela Casu UN VIDEO INTRODUTTIVO Per vedere il video CLICCA QUI Sommario 1. Il legame chimico 2. L elettronegatività 3. Il legame ionico 4. Composti
8. Il Legame Chimico
 8. Il Legame Chimico I legami ionici - simboli di Lewis - entalpia reticolare - proprietà dei composti ionici Il legame covalente - regola dell ottetto - struttura di Lewis Le specie poliatomiche - la
8. Il Legame Chimico I legami ionici - simboli di Lewis - entalpia reticolare - proprietà dei composti ionici Il legame covalente - regola dell ottetto - struttura di Lewis Le specie poliatomiche - la
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Che cosa è il Legame Chimico
 Che cosa è il Legame Chimico Le molecole sono aggregati stabili ed identici contenenti più atomi La loro geometria non cambia al cambiare dello stato di aggregazione Deve esistere una forma di interazione
Che cosa è il Legame Chimico Le molecole sono aggregati stabili ed identici contenenti più atomi La loro geometria non cambia al cambiare dello stato di aggregazione Deve esistere una forma di interazione
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
I legami chimici. Perché si formano i legami? Perché si formano i legami? 16/01/2019. Come e perché gli atomi si legano tra loro
 I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
Stati della materia. Stati della materia
 Stati della materia La materia può esistere in 3 diversi STATI DI AGGREGAZIONE: SOLIDO LIQUIDO GASSOSO MACROSCOPICHE MICROSCOPICHE Stati della materia Lo stato di aggregazione di una sostanza dipende dal
Stati della materia La materia può esistere in 3 diversi STATI DI AGGREGAZIONE: SOLIDO LIQUIDO GASSOSO MACROSCOPICHE MICROSCOPICHE Stati della materia Lo stato di aggregazione di una sostanza dipende dal
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 2 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 3 Numerazione gruppi
Le proprietà periodiche degli elementi 1 2 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 3 Numerazione gruppi
Gli elettroni della molecola sono quindi descritti da
 IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
Analisi Chimico Farmaceutica e Tossicologica con Laboratorio
 Analisi Chimico Farmaceutica e Tossicologica con Laboratorio corso di Laurea in Farmacia canale A-L anno accademico 2018-2019 Dr. Antonio Coluccia Dipartimento di Chimica e Tecnologie del Farmaco Sapienza
Analisi Chimico Farmaceutica e Tossicologica con Laboratorio corso di Laurea in Farmacia canale A-L anno accademico 2018-2019 Dr. Antonio Coluccia Dipartimento di Chimica e Tecnologie del Farmaco Sapienza
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 6. I legami chimici SEGUI LA MAPPA riconoscere valutare dativo puro 1 Gli atomi difficilmente
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 6. I legami chimici SEGUI LA MAPPA riconoscere valutare dativo puro 1 Gli atomi difficilmente
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
TIPI DI SOLIDI FORZE ENTRO LE PARTICELLE PARTICELLE AI NODI FORZE TRA LE PARTICELLE TIPO SOLIDO
 TIPI DI SOLIDI A seconda delle particelle che formano il solido cristallino, disponendosi in corrispondenza dei nodi delle celle elementari, si hanno i seguenti tipi di solidi: TIPO SOLIDO PARTICELLE AI
TIPI DI SOLIDI A seconda delle particelle che formano il solido cristallino, disponendosi in corrispondenza dei nodi delle celle elementari, si hanno i seguenti tipi di solidi: TIPO SOLIDO PARTICELLE AI
Teorie del legame chimico. Teorie del legame chimico
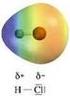 Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
APPUNTI DELLE LEZIONI DI. Scienza e Tecnologia dei Materiali (Energetica)
 Corso di Laurea in Ingegneria Energetica APPUNTI DELLE LEZIONI DI Scienza e Tecnologia dei Materiali (Energetica) Anno Accademico 2012/2013 Sito web: http://www.uniroma2.it/didattica/stm_ene Prof. Ing.
Corso di Laurea in Ingegneria Energetica APPUNTI DELLE LEZIONI DI Scienza e Tecnologia dei Materiali (Energetica) Anno Accademico 2012/2013 Sito web: http://www.uniroma2.it/didattica/stm_ene Prof. Ing.
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
 LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
Atomi e molecole. Gli atomi degli elementi si trovano in natura generalmente combinati tra loro in molecole o composti ionici
 IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Tavola periodica degli elementi
 Tavola periodica degli elementi!1 I chimici Mendeleev (russo) e Meyer (tedesco) scoprirono indipendentemente che ordinando gli elementi secondo peso atomico crescente in file orizzontali sovrapposte, si
Tavola periodica degli elementi!1 I chimici Mendeleev (russo) e Meyer (tedesco) scoprirono indipendentemente che ordinando gli elementi secondo peso atomico crescente in file orizzontali sovrapposte, si
= GEOMETRIA MOLECOLARE. (numero di legami) + (angolo di legame) = geometria. V.S.E.P.R.: Valence Shell Electron Pair Repulsion
 GEOMETRIA MOLECOLARE I legami covalenti sono direzionali I metodi sperimentali moderni permettono di conoscere sia la DISTANZA di legame (d) che l ANGOLO di legame (α), quindi una buona teoria del legame
GEOMETRIA MOLECOLARE I legami covalenti sono direzionali I metodi sperimentali moderni permettono di conoscere sia la DISTANZA di legame (d) che l ANGOLO di legame (α), quindi una buona teoria del legame
ORBITALE ATOMICO. Forma
 L ATOMO ORBITALE ATOMICO n (numero quantico principale) Energia e Dimensione l (numero quantico azimutale) Forma m l (numero quantico magnetico) Orientazione nello spazio l dipende da n assume n valori:
L ATOMO ORBITALE ATOMICO n (numero quantico principale) Energia e Dimensione l (numero quantico azimutale) Forma m l (numero quantico magnetico) Orientazione nello spazio l dipende da n assume n valori:
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
Il sistema periodico degli elementi
 Il sistema periodico degli elementi Cos è il sistema periodico? Che informazioni ne possiamo ricavare? Che predizioni possiamo trarne? 15/10/2012 Meyer: periodicità delle variazioni del volume molare atomico
Il sistema periodico degli elementi Cos è il sistema periodico? Che informazioni ne possiamo ricavare? Che predizioni possiamo trarne? 15/10/2012 Meyer: periodicità delle variazioni del volume molare atomico
Legame chimico: legame ionico, legame covalente, legame metallico
 Legame chimico: legame ionico, legame covalente, legame metallico Elettroni interni Categorie di elettroni elettroni del gas nobile che precede l elemento nella tavola periodica, riempiono tutti i livelli
Legame chimico: legame ionico, legame covalente, legame metallico Elettroni interni Categorie di elettroni elettroni del gas nobile che precede l elemento nella tavola periodica, riempiono tutti i livelli
Anche tra le molecole si instaurano forze di attrazione, meno intense dei legami chimici, che vengono chiamate legami secondari o legami deboli.
 I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
APPUNTI DELLE LEZIONI DI. Scienza e Tecnologia dei Materiali
 APPUNTI DELLE LEZIONI DI Scienza e Tecnologia dei Materiali Anno Accademico 2017/2018 dott. Francesca Romana Lamastra ufficio c/o Dip. Scienze e Tecnologie Chimiche (edifici Sogene) Settore E1 E-mail:
APPUNTI DELLE LEZIONI DI Scienza e Tecnologia dei Materiali Anno Accademico 2017/2018 dott. Francesca Romana Lamastra ufficio c/o Dip. Scienze e Tecnologie Chimiche (edifici Sogene) Settore E1 E-mail:
Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici.
 I blocchi s, p, d ed f della Tavola Periodica 1 La tavola periodica La tavola periodica La tavola periodica Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici. Si possono
I blocchi s, p, d ed f della Tavola Periodica 1 La tavola periodica La tavola periodica La tavola periodica Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici. Si possono
Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
 http://www.ptable.com/ LEGAME CIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici.
http://www.ptable.com/ LEGAME CIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici.
Primo presame di chimica
 1 1. Indicare quale tra le seguenti può essere la combinazione dei numeri quantici (n, l, m, s) di un elettrone in un atomo (0, -1, 1, +1/2) (2, -1, 1, +1/2) (4, 4, 1, -1/2) (5, 4, 1, -1/2) 2. Quale delle
1 1. Indicare quale tra le seguenti può essere la combinazione dei numeri quantici (n, l, m, s) di un elettrone in un atomo (0, -1, 1, +1/2) (2, -1, 1, +1/2) (4, 4, 1, -1/2) (5, 4, 1, -1/2) 2. Quale delle
Legame chimico e proprietà delle sostanze
 I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
Il Legame Ionico. Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B -
 Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più
La Vita è una Reazione Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
Il legame chimico I: il legame covalente. Capitolo 9
 Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Coesione nei solidi, energia di coesione
 Coesione nei solidi, energia di coesione Cosa tiene insieme un cristallo? La coesione in un solido è un fenomeno complesso, dovuta al bilancio di forze repulsive fra cariche dello stesso segno (nuclei-nuclei,
Coesione nei solidi, energia di coesione Cosa tiene insieme un cristallo? La coesione in un solido è un fenomeno complesso, dovuta al bilancio di forze repulsive fra cariche dello stesso segno (nuclei-nuclei,
Sommario delle lezioni Legami chimici
 Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Registration Evaluation Authorisation CHemicals
 Registration Evaluation Authorisation CHemicals Master in REACH 10/06/2011 B Prof. Anna Aiello 2.2. Informazioni relative alla formula molecolare e strutturale di ogni sostanza 2.2.1. Formula molecolare
Registration Evaluation Authorisation CHemicals Master in REACH 10/06/2011 B Prof. Anna Aiello 2.2. Informazioni relative alla formula molecolare e strutturale di ogni sostanza 2.2.1. Formula molecolare
Tavola Periodica degli Elementi
 Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
