Esame: Test con domande a risposta multipla o aperta
|
|
|
- Michele Parodi
- 7 anni fa
- Visualizzazioni
Transcript
1 Chimica Organica II - Programma ed esame 1 Parte Formazione del legame C-C mediante la chimica dei carbanioni (acidità degli H legati a C; attacco nucleofilo a centri elettrofili; applicazioni sintetiche) 2 Parte Chimica dei composti terociclici (Gli eterocicli aromatici reattività e sintesi; sintesi di altri eterocicli mediante reazioni di cicloaddizione) Esame: Test con domande a risposta multipla o aperta
2 CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in a un gruppo carbonilico (aldeidi, chetoni, esteri) chetone ione enolato (stabilizzato per risonanza) L acidità del protone legato al carbonio in α compete con la natura elettrofilica del carbonio carbonilico, analogamente a quanto accade con gli acidi carbossilici e le ammidi primarie e secondarie
3 ADDIZIONE AL CO DI UNA BASE/NUCLEOFILO aldeide acido carbossilico L atomo di carbonio elettrofilo è in grado di reagire con nucleofili
4 Acidità di acidi carbossilici, solfonici e fosforici Maggiore è la forza dell acido più basso è il valore di pka. Gli acidi carbossilici tendono a fornire reazioni acido-base con i nucleofili. Il pka di un acido carbossilico è circa 5, cosa che li rende le più acide molecole contenenti solamente C, H e O. acido carbossilico Questa acidità origina dalla stabilizzazione della base coniugata, lo ione carbossilato
5 Acidità di acidi solfonici (pka < 0) e fosforici (pka 2) Un acido solfonico Un acido fosforico Gli altri solfonici e fosforici sono ancora più forti. Gli acidi fosfonici in a basse concentrazioni posono anche perdere il secondo protone (cosa che accade ad esempio in condizioni fisiologiche)
6 Acidità di acidi carbossilici, solfonici e fosforici Reazione con H 2 O In acqua tutti questi acidi si dissociano
7 Variazione di acidità Effetti Induttivi Perchè l acido cloro acetico ha una pka più bassa? Una razionalizzazione semplificata si basa sull elettronegatività dei sostituenti: la maggior elettronegaticità del cloro rende più positivo il carbonio ad esso legati che a sua volta sottrae densità elettronica al carbonio carbonilico e all ossigeno, rendendo il legame O-H più debole e di consegnuenza il protone più acido. Un effetto analogo viene svolto sulla base coniugata che risulta quindi più stabile.
8 Variazione di acidità Effetti Induttivi Derivati acido acetico
9 Variazione di acidità Effetti Induttivi Derivati acido butanoico Possiamo quindi dire che gli effetti induttivi influenzano l acidità degli acidi carbossilici: gruppi elettron attrattori aumentano l acidità; elettron donatori la dimuiscono. Inoltre l effetto diminuisce all aumentare del numero di atomi che separano il sostituente dalla funzione carbossilica.
10 Anche nel caso dei derivati degli acidi benzoici possiamo individuare un effetto induttivo dei sostituenti in anello sull acidità del sistema. Anche in questo caso i sostituenti elettronattrattori (EWG, -I) aumentano l acidità mentre quelli elettron donatori la diminuiscono (EDG, +I). E interessante notare che la presenza di un sostituente in posizione orto porta ad una diminuzione sul valore della pka, indipendentemente dalla natura del sostituente. Questo fenomeno, conosciuto come effetto orto, deriva da interazioni di carattere sterico tra il sostituente e la funzione carbossilica. pka pka pka = 4.21
11 Acidi dicarbossilici Sulla base di quanto visto precedentemente, questi acidi sono più acidi dell acido acetico, per lo meno per quel che riguarda la dissociazione della prima funzione carbossilica, e l effetto del sostituente dipende fortemente dal numero di legami che lo separano dalla funzione acida. Il valore più alto della seconda pka dipende dalla presenza di un sostituente carbossilato e dalla solvatazione.
12 Confronto dei valori di pka di derivati carbonilici e dei loro analoghi metilenici Per quali di questi acidi si possono generare i corrispondenti anioni in H 2 O?
13 Come si forma un enolato? L enolato altro non è che il prodotto di una reazione acido base di un enolo. Un enolo può anche essere chiamato alcol vinilico. Si può ottenere per idratazione di un alchino: L enolo però non è un composto stabile e si trasforma velocemente in un composto carbonilico mediante una tautomeria (tautomeria cheto-enolica)
14 Meccanismo della tautomeria cheto-enolica (ambiente acido): H 2 O come nucleofilo H 2 O come base
15 Meccanismo della tautomeria cheto-enolica (ambiente basico): Formazione di enolati a partire da composti carbonilici:
16 Reazioni di isomerizzazione di composti carbonilici Processo di glicolisi: Isomerizzazioni di zuccheri mediante trasposizione della funzione carbonilica (D-glucosio fosfato a D-fruttosio fosfato) La reazione avviene via formazione di un endiolo acido catalizzata (l enzima utilizza funzioni acide)
17 Reazioni di racemizzazione di composti carbonilici Se un chetone enantiopuro viene trattato con un acido o una base racemizza attraverso la formazione di un intermedio achirale,, l enolol La racemizzazione è un processo energeticamente favorito poiché la concentrazione dell enantiomero di partenza si dimezza durante il processo G = H -T S H = O minima interazione intermolecolari in soluzione, S =-R x 1 lnx 1 R x 2 lnx 2 Per un racemo, all equilibrio, x 1 =x 2 =1/2 S =-1/2R ln1/2 1/2R ln1/2= -R ln1/2 = R ln2 G = - T S = - RT ln2 = Kcal/mol a 25 C
18 Reazioni di racemizzazione di composti carbonilici Racemizzazione dell (R)-Thalidomide sedativo teratogeno Anche gli ammino acidi possono racemizzare con questo tipo di meccanismo, anche se questo normalmente non avviene in condizioni fisiologiche
19 α-alogenazione di chetoni (via enolato, condizioni basiche) Formazione dell enolato Addizione elettrofila Formazione di un enolato (H più acido) Addizione elettrofila (Dibromo derivato) Ne consegue che la reazione di mono alogenazione non può essere ottenuta in condizioni basiche. La maggior reattività dei prodotti può essere sfruttata per la produzione di aloformio (iodoformio, bromoformio, cloroformio)
20 α-alogenazione di chetoni (condizioni acide) Protonazione del chetone Formazione dell enolo Addizione elettrofila Br - agisce da base e rigenera la funzione carbonilica
21 α-alogenazione di chetoni (condizioni acide) Cosa accade se Br - porta un attacco nucleofilo al carbonio carbonilico? Si genera una bromoidrina geminale che è instabile e rigenera la funzione carbonilica eliminando HBr L α-bromo-chetone enolizza più lentamente del chetone non sostituito e quindi si può ottenere il prodotto monoalogenato.
22 Sintesi di enolati con basi forti Se si vogliono utilizzare nucleofili diversi da un alogenuro si deve generare l enolato in presenza di una base forte (pka 20-25). Generalmente si utilizzano solventi aprotici quali il THF (nel quale LDA è solubile). Con l LDA e la HDA si utilizza una base non nucleofila, con NaH si ottiene H 2 come prodotto secondario La posizione di alchilazione al C è quella termodinamicamente favorita!
23 Cosa avviene se abbiamo un chetone non simmetrico? Si possono formare due enolati: il primo è quello che si forma più velocemente e viene chiamato prodotto cinetico (enolato cinetico) Il secondo è quello più stabile e viene chiamato prodotto termodinamico (alchene tetrasostituito). E quello che si forma principalmente se il sistema viene portato all equilibrio.
24 Prodotto cinetico e prodotto termodinamico I protoni in posizione 6 sono meno ingombrati da un punto di vista sterico, per cui possono essere rimossi più facilmente se si utilizza una base stericamente ingombrata come l LDA. Per cui scegliendo le condizioni di reazione possiamo favorire la formazione di un prodotto (prodotto cinetico) o dell altro (prodotto termodinamico). Se lavoriamo a bassa temperatura e con una base forte favoriamo il prodotto cinetico (diminuiamo l energia dello stato di transizione) se lavoriamo a temperature più elevate, eccesso di chetone e con basi deboli favoriamo il prodotto termodinamico.
25 Controllo cinetico Base forte e ingombrata, bassa temperatura Controllo termodinamico Base meno forte poco ingombrata, alta temperatura
26 Esercizio: Razionalizzare la selettività di queste due reazioni.
27 Reazione di un enolato con un alogenuro alchilico Se si stratta un enolato con un alogenuro alchilico si ottiene un prodotto di alchilazione. La reazione procede con un tipico meccanismo S N 2 se l alogenuro è primario. Con alogenuri secondari e terziari i prodotti di eliminazioni prevalgono poichè l enolato è una base forte. In realtà la reazione non si ferma a livello di mono alchilazione. Infatti l nolato di partenza può agire da base e deprotonare nuovamente il prodotto mono-alchilato
28 Il nuovo enolato può nuovamente essere alchilato portando al derivato dialchilato. Per cui si ottengono miscele di prodotti polialchilati. In alcuni casi si possono ottenere selettivamente prodotti di mono-alchilazione
29 Esercizio: Come preparereste questi composti utilizzando un alchilazione? Potete utilizzare composti organici fino a 8 atomi di carbonio e qualsiasi reagente inorganico
30 Enolati di esteri o nitrili La pka di un di un protone in α di un estere è 4-5 ordini di grandezza maggiore di quella di un chetone e aldeide (pka=24-25). Questo deriva dalla minore stabilizzazione che si ottiene poichè il sistema carbossilico è già parzialmente delocalizzato ancor prima della deprotonazione Una delle formule di risonanza pone una carica positiva sul carbonio carbonilico, aumentando per effetti induttivi l acidità dei protoni in α Una delle formule di risonanza pone la carica positiva sull atomo di ossigeno piuttosto che su quello carbonilico
31 Vi è comunque un elevato grado di stabilizzazione della caric negativa rispetto ad un alcano Per i protoni legati al carbonio in α ad un nitrile, anch esso stabilizzato per risonanza, si hanno valori di pka=
32 Se si utilizzano basi forti come LDA reazioni tipo condensazione usualmente non competono Una volta formato, l enolato puà reagire con un alogenuro alchilico con un tipico meccanismo S N 2 portando al prodotto alchilato. Se si utilizzano alogenuri secondari o terziari la reazione di eleminazione può competere poiché lavoriamo in presenza di una base forte.
33 Come elettrofili possono essere usati alogenuri alchilici o epossidi
34 Enolati di acidi Può essere generato l enolato di un acido? La pka dei protoni di un carbonio in α al carbonio di un acido ha un valore confrontabile con quella di un estere Per cui in presenza di 2 equiv. di base si ottiene l enolato
35 La reazione con un alogenuro alchilico seguita a trattamento acido porta all acido sostituito. La reazione è analoga alla formazione di un enolato di un estere, alchilazione e idrolisi. E quindi più semplice da un punto di vista operativo e la reazione di condensazione non compete. Esercizio: proporre delle vie sintetiche per i seguenti composti partendo sia da un acido che da un estere e da un arganoalogenuro con 5 o meno atomi di carbonio
36 Malonati, acetoacetati, cianoacetati In questi derivati la presenza di due gruppi elettron attrattori rende i protoni del carbonio metinico o metilenico particolarmente acidi e reattivi nella formazione di enolati. Questi protoni hanno una pka=
37 Reazioni di alchilazione con reagenti contenenti metileni attivati In questo caso l enolato che si forma è il prodotto cineticamente e termodinamicamente favorito. Inoltre la reazione richiede condizioni molto meno estreme, si usa una base molto meno forte (NaOEt). In presenza di un eccesso di base si ottiene la doppia sostituzione Se si utilizzano α-ω-dialoalcani in presenza di un eccesso di base si possono ottenere cicloacani (anelli da 3 a 6 atomi).
38 Anche la presenza di un gruppo fenile riesce ad attivare un metilene consentendo l ottenimento di α-chetoni e esteri Esercizio: Come preparereste i seguenti composti utilizzando un alogenuro alchilico e un derivato con metileni attivati?
39 Sostituenti solforati Diversi gruppi funzionali contenenti lo zolfo (e anche il fosforo) hanno proprietà elettron attrattrici e sono quindi capaci di attivare gli idrogeni di un carbonio in α. Lo stesso DMSO in condizioni basiche può essere deprotonato La presenza del gruppo carbonilico attiva ulteriormente i gruppi metilenici rendendoli più acidi
40 L etil fenilsolfoacetato viene deprotonato facilmente in presenza di NaH generando l enolato corrispondente: Quindi in generale:
41 Ad elevate temperature un solfossido elimina facilmente portando alla formazione di un doppio legame. Come posso ottenere un β-cheto solfossido?
42 Esercizio: un enolato di un estere reagisce con dimetil o difenildisolfuro producendo l analoga specie α-sulfenilica. Quale è il prodotto che vi attendete dalla seguente sequenza di reazioni?
43 Decarbossilazione di funzioni carbossiliche in β a gruppi carbonilici La presenza di due gruppi attivanti rende i protoni metilenici più acidi e quindi reattivi e elimina problemi di regiochimica o reazioni collaterali
44 Cosa possiamo fare se in realtà vogliamo il prodotto mono funzionalizzato? Fortunatamente la funzione esterea decarbossila facilmente per semplice riscaldamento in acido diluito
45 Decarbossilazione di funzioni carbossiliche in β a gruppi carbonilici Idrolisi acida L acido carbossilico che si forma ha una funzione C=O in posizione β che facilita la rimozione di CO 2 in ambiente acido grazie alla formazione di un enolo. Il processo può avvenire sia con l intervento dell H 2 O (2a) che per via intramolecolare (2b)
46 L enolo poi tautomerizza generando il chetone La stessa reazione più essere fatta con il dietilmalonato e l etil ciano acetato portando all ottenimento di un estere o un nitrile In questo caso si parla di ENOLATO EQUIVALENTE
47 Composti con metileni attivati che sono enolato equivalenti
48 Esempio: proporre una sintesi per il seguente composto utilizzando reagenti che abbiano fino a 7 atomi di carbonio
49 Esercizio: Come preparereste questi composti utilizzando un precursore dicarbonilico?
50 Decarbossilazione di beta-cheto acidi importante trasformazione metabolica in processi biologici Questo processo avviene a causa della intrinseca instabilità degli acidi carbossilici in β a una funzione carbonilica Ciclo dell acido citrico metabolismo aerobico Il citrato viene isomerizzato a isocitrato via formale eliminazione e addizione di acqua
51 Ossidazione della funzione alcolica a CO da parte del NAD+ produce un intermedio β-chetoacido che decarbossila fornendo l αchetoglutarrato. Il meccanismo di decarbossilazione non è molto diverso da quello che abbiamo visto avvenire in soluzione.
52 La perdita di CO 2 porta alla formazione di un enolato che è stabilizzato dalla presenza di un catione Mn(II) presente nel sito attivo dell enzima. Protonazione dell enolato porta ad ottenere il derivato carbonilico corrispondente
53 Addizioni Nucleofile di Enolati a Composti Carbonilici L addizione di nucleofili all ossigeno, azoto, zolfo a composti carbonilici è una reazione che avete già incontrato e studiato. Anche nucleofili al carbonio quali carbanioni (reagenti di Grignard, alchil litio) o gli enolati possono reagire con derivati carbonilici portando alla formazione di un nuovo legame C-C. C C. Questa classe di reazioni viene chiamata Condensazione Aldolica o Condensazione di Claisen a seconda che l elettrofilo sia un chetone/aldeide o un estere/tioestere tioestere
54 Condensazione aldolica base catalizzata (rivisitata) In ambiente basico si forma l enolato.. In ambiente acquoso la quantità di enolato presente è molto bassa poichè i protoni legati al carbonio in α al carbonile sono meno acidi di quelli dell acqua di diversi ordini di grandezza. Per cui nell ambiente di reazione vi è un elevata quantità di acetaldeide che può reagire con l enolato,, formando il nuovo legame carbonio-carbonio
55 Infine l alcolato risultante rimuove un protone dall acqua acqua producendo una β-idrossi aldeide e rigenerando il catalizzatore OH - β-idrossi aldeide prodotta ha ancora protoni acidi in α ad un carbonile: se l OHl - rimuove un altro protone, generando l enolato corrispondente, sono possibile due diverse reazioni: Condensazione con un altra molecola di aldeide, ottenendo trimeri o oligomeri Eliminazione di H 2 O producendo un aldeide α,β-insatura
56 La disidratazione del prodotto di una condensazione aldolica avviene con un meccanismo E1cb Si forma un doppio legame coniugato con il gruppo carbonilico. Il meccanismo di eliminazione è diverso da quelli visti in precedenza (E1 e E2) perchè vi è inizialmente la formazione di un carbanione, permessa dalla presenza della funzione carbonilica.. Inoltre il gruppo uscente è un OH -, un gruppo uscente non particolarmente buono. Questo meccanismo viene chiamato eliminazione unimolecolare,, base coniugata (E1cb).
57 E1 Eliminazione Unimolecolare Processo del tutto analogo alla S N 1 C è un ingombro troppo elevato per avere attacco nucleofilo al carbocatione Il nucleofilo è troppo debole Avviene invece la rimozione dell atomo di idrogeno in α e spostamento del doppietto elettronico che neutralizza la carica positiva
58 E1 Eliminazione Unimolecolare - regiochimica alchene interno alchene terminale Alchene terminale minor ingombro sterico e statisticamente favorito Alchene interno:alchene terminale = 70:30
59 Perché si forma preferenzialmente l alchene interno? La formazione dell alchene è una reazione di equilibrio La reazione procede sotto il controllo termodinamico
60 E2 Eliminazione Bimolecolare Eliminazione preferita alla sostituzione nucleofila, nucleofilo agisce da base La base estrae uno degli idrogeni in a al centro elettrofilo Il processo viene denominato deidroalogenazione ed è concertato La velocità dipende dalla concentrazione del substrato e della base e quindi è una eliminazione bimolecolare E2
61 Stereochimica delle eliminazioni bimolecolari Generalmente l E2 produce l alchene più sostituito L atomo di idrogeno e il gruppo uscente devono essere in posizione antiperiplanare nello stato di transizione
62 Stereochimica E2: processo stereospecifico
63 Eliminazione contro sostituzione
64 Condensazione aldolica acido catalizzata In ambiente acido si ha la formazione dell enolo enolo,, un nucleofilo molto meno forte dell enolato enolato.. Però l ambiente acido rende il C=O un elettrofilo più forte, a causa della protonazione dell ossigeno carbonilico
65 La deprotonazione porta alla β-idrossi aldeide Il processo acido base è difficile da fermare a livello di β-idrossi aldeide. L ambiente L acido favorisce la reazione di eliminazione (E1 o E2)
66 Reazione Retroaldolica La condensazione aldolica,, indipendentemente dalla catalisi acida o basica è una reazione di equilibrio. Il processo inverso è denominato reazione retroaldolica La facitiltà con cui questo processo avviene dipende da effetti sterici alle posizione α e β rispetto al carbonile.
67 Condensazione aldolica di chetoni Chetoni enolizzabili e reattivi possono anch essi fornire la condensazione aldolica anche se, molto spesso, i fattori sterici rendono la reazione inversa, la reazione retroaldolica,, più favorevole. La reazione può essere spostata a destra se si elimina acqua e si forma il derivato α,β-insaturo (condizioni acide). L applicazione più importante della condensazione aldolica di chetoni è l anellazione intremolecolare di Robinson.
68 Condensazione aldolica mista L utilizzo di due aldeidi enolizzabili porta ad ottenere una complessa miscela di reazione; derivante dalla reazione di entrambi gli enolati con le due aldeidi (4 prodotti) e dai prodotti di eliminazine di acqua, i corrispondenti derivati α,β-insaturi (4 prodotti).
69 Per rendere la condensazione aldolica mista un processo efficace dobbiamo utilizzare: Un aldeide che non sia enolizzabile Uno specifico enolato Un metodo enzimatico Aldeidi non enolizzabili: : benzaldeide Come si forma il derivato α,β-insaturo?
70 Se il chetone può formare solamente un enolato,, la reazione procede agevoltente e si ottengono elevate rese di un singolo prodotto.
71 La condensazione aldolica può anche essere controllata utilizzando acidi di Lewis. Per esempio se si utilizzano derivati del boro, quali dialchil boro triflati,, in presenza di una base debole quale la DIEA si ottiene l enolato di boro corrispondente. Il derivato di boro, acido di Lewis,, si coordina con l ossigenol carbonilico La base rimuove il protone acido generando il doppio legame con concomitante perdita dello ione triflato
72 Quindi l enolato di boro viene aggiunto ad un aldeide, coordinandola. In questo modo il boro svolge il duplice ruolo di attivatore del carbonile (acido di Lewis) ) e di templante,, portando i due reagenti vicini A questo punto avviene l attaccol nucleofilo al carbonile da parte dell enolato enolato e si forma il nuovo legame C-C. C C.
73 Ossidazione con H 2 O 2 in base porta ad ottenere la β-idrossi aldeide Se entrambi i composti carbonilici sono enolizzabili si riesce ad evitare la reazione di autocondensazione La reazione può anche decorrere con elevate stereoselezioni
74 La reazione può anche decorrere con elevate stereoselezioni L enolato Z si forma preferenzialmente.. La reazione con benzaldeide porta ad un solo prodotto, l addotto l sin (si formano contemporaneamente due stereocentri). sin
75 L enolato Z si forma preferenzialmente.. La reazione con benzaldeide porta ad un solo prodotto, l addotto l sin (si formano conteporaneamente due stereocentri). sin anti L interazione 1,3-diassiale sfavorisce la formazione dell addotto anti
76 Esercizi: Quale è il prodotto maggioritario atteso per ciascuna delle seguenti reazioni:
77 L addizione di un estere enolato ad un aldeide o chetone è una variante della condensazione aldolica assistita da un acido di Lewis Si ha produzione dell enolato enolato,, l addizionel nucleofila al carbonile e la protonazione per fornire l alcoll
78 Esercizio. Un carbanione derivato da un immina o da un ammide terziaria può anche reagire con un composto carbonilico.. Quale è il prodotto maggioritario atteso dalle seguenti reazioni?
79 Un enzima, la fruttosio-1,6 1,6-difosfato aldolasi, FDP-aldolasi aldolasi,, può essere utilizzata come catalizzatore in sintesi organica. In particolare essa utilizza l idrossiacetone fosfato come reagente nucleofilo,, insieme ad altri reagenti elettrofili. La reazione fornisce in maniera stereospecifica due stereocentri,, con completo controllo della stereochimica del processo.
80 Il meccanismo della reazione prevede la coordinazione del diidrossi fosfato all enzima attraverso un legame imminico,, il quale attraverso una reazione acido base viene convertito in enammina
81 L enolo reagisce con l elettrofilo generando due nuove funzioni alcoliche a geometria controllata. Dopo aver reagito con il composto carbonilico il diidrossi acetone fosfato viene idrolizzato rilasciando il prodotto della condensazione aldolica.
82 La condensazione di Claisen (rivisitata) Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione che è simile alla condensazione aldolica,, la Condensazione di Claisen. La condensazione di Claisen porta alla formazione di β-chetoesteri dopo trattamento acido.
83 Il meccanismo è simile a quello delle condensazioni aldoliche,, ma vi sono alcune differenze: a. Bassa concentrazione dell enolato enolato (pka 24) L enolato reagisce con un altra molecola di estere portando ad un intermedio tetraedrico
84 A questo punto la funzione carbonilica viene rigenerata con l uscita l di un gruppo etilato La reazione sembrerebbe fermarsi qui. Invece poiché il composto che si è formato ha un metilene attivato, nelle condizioni di reazione la base è in grado di deprotonarlo nuovamente generando un nuovo enolato,, altamente stabilizzato. Perchè questa reazione avvenga deve essere presente almeno un equivalente di base. Questa è un altra differenza rispetto alla condensazione alcolica dove vengono richieste solamente quantità catalitiche di base.
85 Dopo trattamento acido si ottiene il β-chetoestere. Se il reagente è l acetato di etile questa reazione viene chiamata condensazione acetoacetica o sintesi acetoacetica Nella Condensazione di Claisen la formazione dell enolato enolato stabilizzato per risonanza permette di spostare l equilibrio l della reazione a destra
86 Meccanismo della condensazione di Claisen La deprotonazione dell intermedio C in ambiente basico è irreversibile e quindi porta alla conversione completa in D.. Solo in ambiente acido si riesce ad ottenere C come prodotto finale
87 Condensazione di Claisen Retro Claisen Tutti i passaggi della condensazione di Claisen sono processi di equilibrio. La formazione di un dicarbonil enolato porta la reazione a completamento. Se questo processo non può avvenire allora l equilibrio l favorisce i reagenti. Etil isobutirrato contro etil acetato
88 In presenza di ioni EtO - vi è un ulteriore attacco nucleofilo al centro carbonilico anzichè deprotonazione e la reazione torna indietro oppure vi è la formazione di un enolato e la reazione procede verso i prodotti
89 Un metodo per prevenire la retro Claisen è l utilizzo di basi forti per la generazione dell enolato enolato L enolato viene quindi trattato con un equivalente di estere o, ancor meglio, l acill cloruro corrispondente.
90 Esercizio. Quale sarà il prodoto principale delle seguenti reazioni?
91 Ciclizzazione di Dieckmann: condensazione di Clasen intramolecolare Il meccanismo è del tutto analogo a quello della condensazione di Claisen: generazione dell enolato enolato,, formazione dell intermedio tetraedrico, espulsione del gruppo uscente, formazione del carbanione stabilizzato per risonanza
92 Un trattamento acquoso acido consente di ottenere il prodotto neutro nel quale la funzione carbonilica è all interno dell anello Poiché i β-chetoesteri possono essere facilmente decarbossilati,, questa è una strategia sintetica per ottenere cicloalcanoni
93 Condensazione di Claisen mista Analogamente a quato avviene nella condensazione aldolica anche nella condensazione di Claisen possono essere usati due diversi esteri. La reazione ha esiti migliori se uno degli esteri non ha idrogeni in i α al carbonile
94
95 Esempi di condenzazione di Claisen mista appaiono anche nella ciclizzazione di Dieckmann quando una delle funzioni esteree non ha protoni in posizione α.. Questo consente la formazione di un unico prodotto. Si può ottenere un singolo prodotto anche in presenza di due funzioni esteree enolozzabili se la reazione è reversibile Unico prodotto
96 Uno dei due prodotti non ha protoni enolizzabili,, per cui la retro-claisen è favorita. Per cui l equilibrio l si sposta verso la formazione del regioisomero 2,6-disostituito.
97 Nella condensazione di Claisen mista possiamo anche utilizzare un chetone come partner enolizzabile.. I chetoni cono circa 4 ordini di grandezza più acidi degli esteri, per cui formano l enolatol in modo preferenziale. Si preferisce utilizzare un estere non-enolizzabile enolizzabile,, anche se i chetoni forniscono la reazione di autocondensazione lentamente. Un applicazione comune di questa reazione è l idrossimetilenazione dei chetoni
98 Un trattamento acido fornisce prodotto che esiste principalmente in forma enolica
99 Esercizio: spiegare i seguenti processi
100 Condensazione di Claisen mista: Carbonilazione Gli enolati,, essendo nucleofili,, sono in grado di reagire con la CO 2. Però, poiché i composti β-carbossi carbonilico decarbossilano, lareazione è completamente reversibile Ci sono diversi modi per superare il problema. Il più semplice è quello di preparare un estere piuttosto che l acido l stesso, utilizzando l etill cloroformiato o il dietilcarbonato invece che la CO 2.
101 Gli enolati,, essendo nucleofili,, sono in grado di reagire con la CO 2. Però, poiché i composti β-carbossi carbonilico decarbossilano,, la reazione è completamente reversibile Un idrolisi controllata può portare all acido, acido, ma la reazione di decarbossilazione è sempre possibile
102 Reazione di Knoevenagel La reazione di Knoevenagel è una variante della condensazione aldolica nella quale la base coniugata di un composto con metileni attivi è il nucleofilo Il prodotto che si ottiene è un alchene che contiene due gruppi accettori geminali. La reazione avviene in condizioni debolmente basiche (basi organiche quali la piperidina) ) o neutre (acetato di piperidinio)
103 Reazione di Knoevenagel: : meccanismo
104 Reazione di Knoevenagel: : prodotti di reazione
105 Reazione di Henry La reazione di Henry è una variante della condensazione aldolica nella quale il nucleofilo è la base coniugata di un nitroalcano (pka<10) Meccanismo
106 Reazione di Perkin La reazione di Perkin è una condensazione aldolica mista tra un aldeide e anidride di un acido carbossilico in presenza di una base debole,, per esempio la base coniugata dell acido carbossilico corrispondente. L enolato dell anidride reagisce con l aldeide. l La presenza del gruppo carbonilico dell anidride a 6 atomi di distanza dall alcolato alcolato porta a una reazione di acilazione intramolecolare
107 Acilazione intramolecolare Il carbossilato è il miglior gruppo uscente La perdita di acido acetico porta alla formazione del derivato α,β-insaturo
108 Reazione di Darzens La reazione di Darzens è una condensazione aldolica mista tra un aldeide e l enolatol di un estere di un acido α-alocarbossilico,, seguita da ua reazione SN2 intramolecolare.. Porta alla formazione di epossidi. Proporre un meccansimo
La condensazione di Claisen
 La condensazione di Claisen Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione
La condensazione di Claisen Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Addizioni Nucleofile di Enolati a Composti Carbonilici L addizione di nucleofili all ossigeno, azoto, zolfo a composti carbonilici è una reazione che avete già incontrato e studiato. Anche nucleofili al
Addizioni Nucleofile di Enolati a Composti Carbonilici L addizione di nucleofili all ossigeno, azoto, zolfo a composti carbonilici è una reazione che avete già incontrato e studiato. Anche nucleofili al
Capitoli 18-20: reazione di addizione nucleofilo al gruppo carbonilico
 Capitoli 18-20: reazione di addizione nucleofilo al gruppo carbonilico Addizioni Nucleofile di Enolati a Composti Carbonilici L addizione di nucleofili come ossigeno, azoto, zolfo a composti carbonilici
Capitoli 18-20: reazione di addizione nucleofilo al gruppo carbonilico Addizioni Nucleofile di Enolati a Composti Carbonilici L addizione di nucleofili come ossigeno, azoto, zolfo a composti carbonilici
Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri)
 CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri) Che altra reazione può avvenire al centro carbonilico
CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri) Che altra reazione può avvenire al centro carbonilico
Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri)
 CHIMICA ACIDO BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri) Che altra reazione può avvenire al centro carbonilico
CHIMICA ACIDO BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri) Che altra reazione può avvenire al centro carbonilico
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri) Che altra reazione può avvenire al centro carbonilico
CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri) Che altra reazione può avvenire al centro carbonilico
Confronto dei valori di pkadi derivati carbonilici e dei loro analoghi metilenici
 ENOLATI Confronto dei valori di pkadi derivati carbonilici e dei loro analoghi metilenici Per quali di questi acidi si possono generare i corrispondenti anioni in H 2 O? Come si forma un enolato? L enolato
ENOLATI Confronto dei valori di pkadi derivati carbonilici e dei loro analoghi metilenici Per quali di questi acidi si possono generare i corrispondenti anioni in H 2 O? Come si forma un enolato? L enolato
Addizioni Nucleofile di Enolati a Composti Carbonilici
 Addizioni Nucleofile di Enolati a Composti Carbonilici L addizione di nucleofili all ossigeno, azoto, zolfo a composti carbonilici è una reazione che avete già incontrato e studiato. Anche nucleofili al
Addizioni Nucleofile di Enolati a Composti Carbonilici L addizione di nucleofili all ossigeno, azoto, zolfo a composti carbonilici è una reazione che avete già incontrato e studiato. Anche nucleofili al
Confronto dei valori di pkadi derivati carbonilici e dei loro analoghi metilenici
 ENOLATI Confronto dei valori di pkadi derivati carbonilici e dei loro analoghi metilenici Per quali di questi acidi si possono generare i corrispondenti anioni in H 2 O? Meccanismo della tautomeria cheto-enolica
ENOLATI Confronto dei valori di pkadi derivati carbonilici e dei loro analoghi metilenici Per quali di questi acidi si possono generare i corrispondenti anioni in H 2 O? Meccanismo della tautomeria cheto-enolica
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
Chimica acido-base dei composti carbonilici
 Chimica acido-base dei composti carbonilici Produzione di enolati: deprotonazione al carbonio in α ad un gruppo carbonilico (aldeidi, chetoni, esteri) L acidità del protone legato al carbonio in α compete
Chimica acido-base dei composti carbonilici Produzione di enolati: deprotonazione al carbonio in α ad un gruppo carbonilico (aldeidi, chetoni, esteri) L acidità del protone legato al carbonio in α compete
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Reazioni di Eliminazione: E1 e E2 Sintesi di alcheni (olefine) 1 E1 Eliminazione Unimolecolare Processo del tutto analogo alla S N 1 2 Reattività dei carbocationi 1. Sostituzione 2. Eliminazione 3. Addizione
Reazioni di Eliminazione: E1 e E2 Sintesi di alcheni (olefine) 1 E1 Eliminazione Unimolecolare Processo del tutto analogo alla S N 1 2 Reattività dei carbocationi 1. Sostituzione 2. Eliminazione 3. Addizione
Composti carbonilici: reazioni al carbonio in posizione a
 Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Alfa-alogenazionialogenazioni (sintesi aloformio)
 CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Acidità: Acidità di acidi, ammidi, ammine. Effetti induttivi e di risonanza. Acidità CH Enoli/enolati Tautomeria cheto enolica (acido o base catalizzata) (isomerizzazioni
CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Acidità: Acidità di acidi, ammidi, ammine. Effetti induttivi e di risonanza. Acidità CH Enoli/enolati Tautomeria cheto enolica (acido o base catalizzata) (isomerizzazioni
L acidità del protone legato al carbonio in α compete con la. quanto accade con gli acidi carbossilici e le ammidi primarie e secondarie
 CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in a ad un gruppo carbonilico (aldeidi, chetoni, esteri) L acidità del protone legato al carbonio in α compete
CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in a ad un gruppo carbonilico (aldeidi, chetoni, esteri) L acidità del protone legato al carbonio in α compete
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1
 CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
Enoli e Enolati. Reazioni di sostituzione nucleofila al carbonio a
 Enoli e Enolati Reazioni di sostituzione nucleofila al carbonio a Idrogeni in α ad un carbonile Perché vi è una reattività al carbonio in posizione a ad un carbonile? Perché solo gli idrogeni α sono acidi
Enoli e Enolati Reazioni di sostituzione nucleofila al carbonio a Idrogeni in α ad un carbonile Perché vi è una reattività al carbonio in posizione a ad un carbonile? Perché solo gli idrogeni α sono acidi
L addizione coniugata
 L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo?? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: : il carbonio carbonilico
L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo?? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: : il carbonio carbonilico
Sostituzione nucleofila Addizione a gruppi carbonilici Addizione a doppi legami attivati
 himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
Unità Didattica 10. I composti carbonilici. Struttura, nomenclatura e reattività
 I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni Il gruppo funzionale è il doppio legame C=O Il carbonile ha geometria planare (il carbonio è sp 2 ) Unità Didattica 10 I composti
I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni Il gruppo funzionale è il doppio legame C=O Il carbonile ha geometria planare (il carbonio è sp 2 ) Unità Didattica 10 I composti
Idrogeni in α a un carbonile
 Enoli e Enolati 1 Idrogeni in α a un carbonile Solo gli idrogeni α sono acidi Gli idrogeni β, γ e δ non sono acidi non possono essere rimossi da una base acido non acidi α β γ δ 2 Enoli Tutti i composti
Enoli e Enolati 1 Idrogeni in α a un carbonile Solo gli idrogeni α sono acidi Gli idrogeni β, γ e δ non sono acidi non possono essere rimossi da una base acido non acidi α β γ δ 2 Enoli Tutti i composti
Composti carbonilici. Composti carbonilici. Componente principale dell aceto. Principio attivo di molti farmaci. Resina per abbigliamento
 Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Composti carbonilici. Componente principale dell aceto. Principio attivo di molti farmaci. Resina per abbigliamento
 Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Composti carbonilici
 Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione
 Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Addizioni nucleofile. Addizioni a C=O
 Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Enoli e Enolati. Reazioni di sostituzione nucleofila al carbonio α di composti carbonilici
 Enoli e Enolati Reazioni di sostituzione nucleofila al carbonio α di composti carbonilici Idrogeni in α ad un carbonile q Perché vi è una reattività al carbonio in posizione α ad un carbonile? Perché solo
Enoli e Enolati Reazioni di sostituzione nucleofila al carbonio α di composti carbonilici Idrogeni in α ad un carbonile q Perché vi è una reattività al carbonio in posizione α ad un carbonile? Perché solo
Composti carbonilici. Componente principale dell aceto. Principio attivo di molti farmaci. Resina per abbigliamento
 Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
 SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
Composti Carbossilici. Reattività
 omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
CHIMICA DEGLI IONI ENOLATO, ENOLI E COMPOSTI CARBONILICI COMPOSTI AROMATICI POLICONDENSATI. α,β LEZIONE 2
 CHIMICA DEGLI IONI ENOLATO, ENOLI E COMPOSTI CARBONILICI COMPOSTI AROMATICI POLICONDENSATI α,β -INSATURI LEZIONE 2 SINTESI DEL DIAZEPAM!???!!!! Mo te spiego ALCHILAZIONE DI ENOLATI Enolati: reattivi nucleofili
CHIMICA DEGLI IONI ENOLATO, ENOLI E COMPOSTI CARBONILICI COMPOSTI AROMATICI POLICONDENSATI α,β -INSATURI LEZIONE 2 SINTESI DEL DIAZEPAM!???!!!! Mo te spiego ALCHILAZIONE DI ENOLATI Enolati: reattivi nucleofili
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
1
 1 2 3 4 5 ANSWERS 6 7 8 9 Fattori che determinano la forza acida Regola generale: Qualsiasi cosa che stabilizzi una base coniugata A: - rende l acido di partenza, H-A, più acido. Quattro fattori: [1] Effetti
1 2 3 4 5 ANSWERS 6 7 8 9 Fattori che determinano la forza acida Regola generale: Qualsiasi cosa che stabilizzi una base coniugata A: - rende l acido di partenza, H-A, più acido. Quattro fattori: [1] Effetti
REGISTRO DELLE LEZIONI 2005/2006. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso, libri di testo esami e propedeuticità La struttura elettronica dell'atomo, gli orbitali, tipi di legami, regola dell'ottetto Ibridizzazione strutture di Lewis, carica formale,
Presentazione del corso, libri di testo esami e propedeuticità La struttura elettronica dell'atomo, gli orbitali, tipi di legami, regola dell'ottetto Ibridizzazione strutture di Lewis, carica formale,
Aldeidi e Chetoni. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Unità didattica 7 (segue) Reattività del benzene. Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili
 Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Reazioni degli alcoli
 Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
COMPOSTI AROMATICI POLICICLICI
 CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di:
 Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
R-X ALOGENURI ALCHILICI. F Cl Br I. Nomenclatura. In genere si indicano con. + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo
 ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
Composti carbonilici Acidi carbossilici
 Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Stabilità. 1. più sostituito = più stabile. 2. trans più stabile del cis; E più stabile del Z. II. Relazione struttura-reattività R C R R R
 Alcheni 1 II. Relazione struttura-reattività 1. più sostituito = più stabile Stabilità R R R R R > > R R, R 2 2 > R 2 > R R 2 2 2. trans più stabile del cis; E più stabile del Z repulsione trans-2-butene
Alcheni 1 II. Relazione struttura-reattività 1. più sostituito = più stabile Stabilità R R R R R > > R R, R 2 2 > R 2 > R R 2 2 2. trans più stabile del cis; E più stabile del Z repulsione trans-2-butene
Aldeidi e Chetoni. Proprietà Chimico Fisiche Sostanze Polari L ossigeno carbonilico forma forti legami H Bassi pesi molecolari sono solubili in acqua
 Aldeidi e hetoni ' Gruppo carbonilico Aldeide hetone Proprietà himico Fisiche Sostanze Polari L ossigeno carbonilico forma forti legami Bassi pesi molecolari sono solubili in acqua Nomenclatura IUPA :
Aldeidi e hetoni ' Gruppo carbonilico Aldeide hetone Proprietà himico Fisiche Sostanze Polari L ossigeno carbonilico forma forti legami Bassi pesi molecolari sono solubili in acqua Nomenclatura IUPA :
Acidi carbossilici e derivati
 Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Acido maleico anidride maleica acido ftalico andidride ftalica
 Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Ammine. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
DERIVATI DEGLI ACIDI CARBOSSILICI gruppo acile
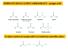 DERIVATI DEGLI ACIDI CARBOSSILICI gruppo acile Acido carbossilico, Alogenuro acilico, Anidride, Estere, Ammide, Tioestere, Fosfato acilico La tipica reazione dei gruppi acilici è la sostituzione nucleofila
DERIVATI DEGLI ACIDI CARBOSSILICI gruppo acile Acido carbossilico, Alogenuro acilico, Anidride, Estere, Ammide, Tioestere, Fosfato acilico La tipica reazione dei gruppi acilici è la sostituzione nucleofila
Gruppi funzionali. aldeidi
 Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
L addizione coniugata
 L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverrà l attacco di un nucleofilo?? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: : il carbonio carbonilico
L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverrà l attacco di un nucleofilo?? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: : il carbonio carbonilico
Reazioni degli Alogenuri Alchilici. Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici.
 Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Acidi carbossilici: nomenclatura. alcano -> acido alcanoico
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Si trovano generalmente come dimeri ciclici a causa dei legami a idrogeno
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
ALCHENI: Reazioni del doppio legame
 ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
Alchini. Suffisso: -ino. d. H 3 CCH 2 CC CH
 Alchini Suffisso: -ino Indicare la posizione del triplo legame con il numero che lo contraddistingue nella catena. La numerazione comincia sempre dall estremità più prossima al triplo legame. 3 3 2 2 2
Alchini Suffisso: -ino Indicare la posizione del triplo legame con il numero che lo contraddistingue nella catena. La numerazione comincia sempre dall estremità più prossima al triplo legame. 3 3 2 2 2
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Reattività degli alogenuri alchilici
 Reattività degli alogenuri alchilici 1 3 Meccanismo della Reazione di Sostituzione Nucleofila 4 5 Meccanismo unimolecolare: sostituzione nucleofila unimolecolare (SN1) Un alogenuro che reagisca con questo
Reattività degli alogenuri alchilici 1 3 Meccanismo della Reazione di Sostituzione Nucleofila 4 5 Meccanismo unimolecolare: sostituzione nucleofila unimolecolare (SN1) Un alogenuro che reagisca con questo
1. Per capire la chimica del gruppo carbonile bisogna ricordarsi che il legame C=O è polarizzato
 1. Per capire la chimica del gruppo carbonile bisogna ricordarsi che il legame C= è polarizzato elettrofili protoni, acidi di Lewis X Y X Y nucleofili Scrivere le formule di risonanza per acetaldeide,
1. Per capire la chimica del gruppo carbonile bisogna ricordarsi che il legame C= è polarizzato elettrofili protoni, acidi di Lewis X Y X Y nucleofili Scrivere le formule di risonanza per acetaldeide,
Composti carbonilici: Aldeidi Chetoni Acidi carbossilici Alogenuri acilici Esteri Ammidi Anidridi Nitrili
 Composti carbonilici: Aldeidi Chetoni Acidi carbossilici Alogenuri acilici Esteri Ammidi Anidridi Nitrili Struttura di composti carbonilici sp 2 sp 2 C = C H 3 C CH3 Il carbonile è un raggruppamento atomico
Composti carbonilici: Aldeidi Chetoni Acidi carbossilici Alogenuri acilici Esteri Ammidi Anidridi Nitrili Struttura di composti carbonilici sp 2 sp 2 C = C H 3 C CH3 Il carbonile è un raggruppamento atomico
Reazioni di eliminazione
 Reazioni di eliminazione Reazioni di eliminazione Gli alogenuri alchilici oltre ad essere buoni substrati per reazioni di sostituzione nucleofila alifatica sono anche buoni substrati per reazioni di eliminazione.
Reazioni di eliminazione Reazioni di eliminazione Gli alogenuri alchilici oltre ad essere buoni substrati per reazioni di sostituzione nucleofila alifatica sono anche buoni substrati per reazioni di eliminazione.
Reazioni degli alcani
 Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
p p s sp sp sp s p p 1
 p p s sp p sp sp p s 1 alcheni 63 kcal/mol alchini 2 nd 54 kcal/mol 2 Come per gli alcheni, gli alchini interni sostituiti sono più stabili di quelli esterni More stable Etino (acetilene) C 2 H 2 +O 2
p p s sp p sp sp p s 1 alcheni 63 kcal/mol alchini 2 nd 54 kcal/mol 2 Come per gli alcheni, gli alchini interni sostituiti sono più stabili di quelli esterni More stable Etino (acetilene) C 2 H 2 +O 2
PIANO DELLE UDA Quarto Anno
 ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica e biochimica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Quarto Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Titolo:
ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica e biochimica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Quarto Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Titolo:
Domanda 4 Dal punto di vista della reattività, il doppio legame si comporta spesso da:
 Tema svolto Domanda 1 Al punto isoelettrico la solubilità di una amminoacido in acqua è: 1. intermedia (-1) 2. doppia rispetto ad un ph più acido e dimezzata rispetto ad un ph più basico (-1) 3. la più
Tema svolto Domanda 1 Al punto isoelettrico la solubilità di una amminoacido in acqua è: 1. intermedia (-1) 2. doppia rispetto ad un ph più acido e dimezzata rispetto ad un ph più basico (-1) 3. la più
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
26 Aprile 1915, 81 compleanno
 Reazioni di addizione-eliminazione eliminazione di composti carbonilici Ammine primarie reagiscono con composti carbonilici per dare immine, anche denominate basi di Schiff 1 Ugo Shiff (1834-1915) 1915)
Reazioni di addizione-eliminazione eliminazione di composti carbonilici Ammine primarie reagiscono con composti carbonilici per dare immine, anche denominate basi di Schiff 1 Ugo Shiff (1834-1915) 1915)
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Teorie Acido-Base. valutazione degli acidi
 Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI E LORO MECCANISMI
 REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento
 PIRIDINE LEZIONE 6 PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento basico (pka=5.2) Nucleo della piridina
PIRIDINE LEZIONE 6 PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento basico (pka=5.2) Nucleo della piridina
Unità didattica 6. Cosa è una sostutizione? Reazioni di Sostituzione degli Alogenuri Alchilici
 Cosa è una sostutizione? Unità didattica 6 Reazioni di Sostituzione degli Alogenuri Alchilici Capitolo 7 e 8 di Brown e Poon L atomo o il gruppo che è sostituito o eliminato in queste reazioni è detto
Cosa è una sostutizione? Unità didattica 6 Reazioni di Sostituzione degli Alogenuri Alchilici Capitolo 7 e 8 di Brown e Poon L atomo o il gruppo che è sostituito o eliminato in queste reazioni è detto
14/11/2018. Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile.
 Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Aromaticità. Addizione elettrofila alcheni
 Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
1. COS È LA CHIMICA ORGANICA?
 Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Lezione: aldeidi e chetoni
 Lezione: aldeidi e chetoni Il gruppo funzionale carbonilico Nomenclatura Proprietà fisiche Principali reazioni eazioni con N eazioni con alcoli eazioni con tioli eazioni con ammine Tautomeria cheto-enolica
Lezione: aldeidi e chetoni Il gruppo funzionale carbonilico Nomenclatura Proprietà fisiche Principali reazioni eazioni con N eazioni con alcoli eazioni con tioli eazioni con ammine Tautomeria cheto-enolica
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Unità didattica 8. Alcoli ed eteri sono gli analoghi organici dell acqua. Alcoli eteri epossidi e composti solforati
 Unità didattica 8 Alcoli eteri epossidi e composti solforati Alcoli ed eteri sono gli analoghi organici dell acqua Un alcol si definisce primario, secondario o terziario a seconda del tipo di carbonio
Unità didattica 8 Alcoli eteri epossidi e composti solforati Alcoli ed eteri sono gli analoghi organici dell acqua Un alcol si definisce primario, secondario o terziario a seconda del tipo di carbonio
Figura. Alogenuri alchilici
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni Alogenuri alchilici: nomenclatura Alogenuri
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni Alogenuri alchilici: nomenclatura Alogenuri
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati 1 Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni 2 Alogenuri alchilici: nomenclatura Alogenuri
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati 1 Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni 2 Alogenuri alchilici: nomenclatura Alogenuri
Composti carbonilici: 1) addizione nucleofila. 2) addizione nucleofila-eliminazione
 Composti carbonilici: 1) addizione nucleofila 2) addizione nucleofila-eliminazione È importante considerare se l atomo del gruppo legato alla funzione acilica è fortemente elettronegativo (caso degli acidi
Composti carbonilici: 1) addizione nucleofila 2) addizione nucleofila-eliminazione È importante considerare se l atomo del gruppo legato alla funzione acilica è fortemente elettronegativo (caso degli acidi
H H. R R δ+ R H. δ Cl
 Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
Ammine R N + H. ammina terziaria ammina secondaria ammina primaria sale di ammonio quaternario
 AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
2. LA STRUTTURA DEI COMPOSTI ORGANICI E LE CARATTERISTICHE CHIMICO- FISICHE
 Università degli Studi di Bari Facoltà di Farmacia Corso di Laurea in Tecniche Erboristiche A.A. 2011-2012 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del corso è quello di evidenziare
Università degli Studi di Bari Facoltà di Farmacia Corso di Laurea in Tecniche Erboristiche A.A. 2011-2012 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del corso è quello di evidenziare
Capitolo 7 Composti organici alogenati
 himica Organica Informazione Scientifica sul Farmaco apitolo 7 omposti organici alogenati Organic hemistry, 5 th Edition L. G. Wade, Jr. Introduzione I composti organici alogenati sono importanti per vari
himica Organica Informazione Scientifica sul Farmaco apitolo 7 omposti organici alogenati Organic hemistry, 5 th Edition L. G. Wade, Jr. Introduzione I composti organici alogenati sono importanti per vari
Derivati degli acidi carbossilici
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Derivati degli acidi carbossilici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Derivati degli acidi carbossilici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze
Esercitazione n Reazioni e meccanismi di aldeidi e chetoni.
 19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Reattività degli acidi carbossilici e loro derivati. La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica
 Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Gli alogenuri alchilici R-X X= Cl, Br, F, I. Alogeno alcani o alogenuri alchilici
 Gli alogenuri alchilici R-X X= Cl, Br, F, I Alogeno alcani o alogenuri alchilici 1 CH 3 CH 2 CH 2 Cl cloropropano /cloruro dipropile CH 3 CH 3 C Cl 2,2-dimetil-1-cloroetano / terbutilcloruro CH 3 Cl 1-clorocicloesano
Gli alogenuri alchilici R-X X= Cl, Br, F, I Alogeno alcani o alogenuri alchilici 1 CH 3 CH 2 CH 2 Cl cloropropano /cloruro dipropile CH 3 CH 3 C Cl 2,2-dimetil-1-cloroetano / terbutilcloruro CH 3 Cl 1-clorocicloesano
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Reazioni degli epossidi
 12-04-2016 Reazioni degli epossidi Apertura dell anello acido-catalizzata, esempi Struttura intermedio: 3 forme limiti di risonanza H H a a O O b b H O CH 3 CH 3 CH 3 H H H H Struttura ibrido intermedio
12-04-2016 Reazioni degli epossidi Apertura dell anello acido-catalizzata, esempi Struttura intermedio: 3 forme limiti di risonanza H H a a O O b b H O CH 3 CH 3 CH 3 H H H H Struttura ibrido intermedio
È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica
 aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
