Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 14
|
|
|
- Gastone Pastore
- 7 anni fa
- Visualizzazioni
Transcript
1 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 14
2 Caratterizzazione strutturale delle proteine Concetti chiave: Per poter essere sequenziata, una proteina deve essere separata in singoli polipeptidi che possano essere scissi in un insieme di frammenti sovrapponibili. La sequenza amminoacidicapuò essere determinata utilizzando la degradazione di Edman, una procedura che rimuove i residui N-terminali uno alla volta. La spettrometria di massa èin grado di identificare le sequenze amminoacidichepartendo dal rapporto carica-massa dei frammenti di proteina in fase gassosa.
3 Caratterizzazione strutturale delle proteine La conoscenza della sequenza amminoacidica di una proteina costituisce il prerequisito per la determinazione della sua struttura tridimensionale ed è essenziale per comprenderne il suo meccanismo d azione molecolare. Il confronto tra sequenze di proteine analoghe ottenute da specie differenti consentono di approfondire le conoscenze sulla funzione di queste proteine e svelano le relazioni evolutive tra le proteine e gli organismi che le sintetizzano (sistematica molecolare). Numerose malattie ereditarie sono causate da mutazioni che determinano una sostituzione amminoacidica in una proteina. Le analisi delle sequenze amminoacidiche possono essere di ausilio nello sviluppo di test diagnostici e di terapie efficaci.
4 Caratterizzazione strutturale delle proteine La determinazione della sequenza dei 51 residui dell insulina, la prima proteina sequenziata nel 1953 da Sanger, richiese dieci anni e circa 100 g di proteina. Anche se oggi, con le nuove tecnologie automatizzate, la maggior parte delle proteine può essere sequenziata in pochi giorni o mesi di lavoro con pochi microgrammi di materiale, la strategia di sequenziamento è simile a quella utilizzata da Sanger. La proteina viene rotta in frammenti sufficientemente piccoli da poter essere sequenziati individualmente. La struttura primaria della proteina intatta si ricostruisce partendo dai tratti delle sequenze sovrapponibili.
5 Caratterizzazione strutturale delle proteine Sanger utilizzò il DNFB che reagisce con i gruppi amminici terminali dando origine a un derivato DNP giallo. La proteina veniva poi idrolizzata per rompere i legami peptidici e l amminoacido N-terminale identificato mediante cromatografia.
6 Frederick Sanger Sanger ricevette per i risultati delle sue ricerche un premio Nobel nel Un secondo premio nobel gli venne assegnato nel 1980 per aver messo a punto il metodo di sequenziamento degli acidi nucleici mediante terminazione di catena.
7 Fasi preliminari La determinazione della sequenza amminoacidica di una proteina prevede l esecuzione di alcune tappe preliminari che includono: L isolamento delle subunità per proteine con struttura quaternaria La determinazione della composizione amminoacidica L analisi dei residui N-terminali L analisi dei residui C-terminali La riduzione ed il blocco dei ponti disolfurici La determinazione del peso molecolare
8 Isolamento delle subunità per proteine multimeriche Una verifica della presenza di più subunità in una proteina può essere effettuata mediante SDS-PAGE in presenza di un agente riducente come DTT o mercaptoetanolo. Il successivo isolamento può essere effettuato mediante cromatografia per gel filtrazione (subunità con diverso peso molecolare) o altre tecniche cromatografiche nel caso le subunità hanno peso molecolare simile. Proteina multimerica Catena A Catena A Catena B Catena A Denaturazione con SDS in presenza di β-mercaptoetanolo Catena B Catena B
9 Determinazione della composizione amminoacidica La determinazione della composizione amminoacidica di una proteina prevede le seguenti fasi: Idrolisi dei legami peptidici per l ottenimento dei singoli amminoacidi Separazione mediante cromatografia Derivatizzazione degli amminoacidi (post-colonna) Rivelazione spettrofotometrica
10 Determinazione della composizione amminoacidica L idrolisi acida dei legami peptidici avviene in 6N HCla 110 Cper h sotto atmosfera di azoto o argon. La derivatizzazione degli amminoacidi può essere effettuata prima della separazione cromatografica degli amminoacidi (pre-colonna) oppure all uscita dalla colonna cromatografica (post-colonna).
11 Sistemi con derivatizzazione pre-colonna Sistemi con derivatizzazione pre-colonna Cromatografia a fase inversa ad alta pressione (RP-HPLC) 1 fluoro-2,4 dinitrobenzene(365 nm) dansil cloruro ( nm) Fluoresceina isotiocianato(495 nm) Ortoftalaldeide(340nm, Em 450nm)
12 Sistemi con derivatizzazione post-colonna Sistemi con derivatizzazione post-colonna Cromatografia a scambio ionico e colorazione con ninidrina H 2 SO 4 La cromatografia a scambio ionico viene effettuata utilizzando uno scambiatore cationico forte con resina di polistirene/divinil benzene cui sono legati gruppi solfonici
13 Sistemi con derivatizzazione post-colonna La miscela di amminoacidi viene caricata sulla colonna ad un ph acido (2.2) al quale tutti gli amminoacidi hanno una carica positiva (ph<pi) e si legano. L eluizione viene effettuata mediante un aumento di ph, forza ionica etemperatura. Saranno eluiti prima gli aa acidi, poi i neutri ed infine i basici che, con la loro carica positiva, interagiscono più fortemente con lo scambiatore cationico della colonna.
14 Sistemi con derivatizzazione post-colonna La derivatizzazione post-colonna viene effettuata con ninidrina che reagisce con gli amminoacidi liberi dando origine ad un colore coloreblu con gli α-amminoacidio giallo con gli imminoacidi (prolina). L assorbimento viene dunque letto ad una lunghezza d onda di 570(giallo) e 420(violetto) nm. Composto di Ruhemann(Blu-violetto) Vi è il largo impiego di questa reazione nei test per la rivelazione delle impronte digitali in quanto amminoacidi in tracce vengono depositati sulle superfici toccate.
15 Determinazione della composizione amminoacidica Poiché l assorbanza è proporzionale alla quantità di amminoacidi, la derivatizzazione con ninidrina consente di effettuare una determinazione quantitativa estremamente accurata degli amminoacidi rilevati come una serie di picchi (cromatogramma) che possono essere integrati per il calcolo della concentrazione. Tempo di ritenzione (min) Il tempo di ritenzione del picco identifica l'amminoacido dal punto di vista qualitativo, mentre l'area dello stesso è utilizzata per ricavarne la concentrazione. Il sistema deve essere calibrato con una miscela di amminoacidi standard, da cui ricavare successivamente i dati relativi al nostro campione.
16 Analizzatore automatico di amminoacidi Gli analizzatori automatici di amminoacidi sono costituiti da sistemi integrati per l analisi di amminoacidi. Lo schema a blocchiconsente di effettuare tutte le fasi dell analisi in maniera automatizzata. Sistema tamponi Ninidrina Colonna a scambio ionico Analizzatore di amminoacidi Reattore (a 100/130 C) Registratore Sistema di integrazione Fotometro
17 Analisi dei residui N-terminali I residui N-terminali di ogni catena polipeptidica (se non sono bloccati per via chimica) possono essere determinati mediante marcatura con composti rivelabili spettrofotometricamente. Il dansil cloruro reagisce con le ammine primarie formando peptidi dansilati.
18 Analisi dei residui N-terminali Il trattamento con un acido ad alta temperatura idrolizza i legami peptidici liberando il residuo N-terminale che può essere separato mediante cromatografia ed identificato mediante la fluorescenza gialla.
19 Analisi dei residui C-terminali I residui C-terminali non possono essere identificati per via chimica ma si utilizzano enzimi che tagliano in maniera sequenziale il residuo C-terminale. I residui rilasciati al C-terminale vengono identificati mediante reazione con ninidrina e successiva cromatografia a scambio ionico. Carbossipeptidasi A taglia tutti i residui eccetto Pro, Arg, e Lys Carbossipeptidasi B agisce solo su residui di Arg e Lys Carbossipeptidasi A
20 Riduzione dei ponti disolfurici I residui di cisteina possono formare ponti disolfurici intermolecolari ed intramolecolari
21 Riduzione dei ponti disolfurici I ponti disolfurici possono essere scissi mediante riduzione con mercaptani (composti che contengono gruppi SH) come ditiotreitolo(dtt) o β-mercaptoetanolo(β-me) DTT in eccesso
22 Riduzione dei ponti disolfurici I gruppi sulfidrilici liberi sono poi alchilati mediante trattamento con iodoacetato (o iodoacetamide) per impedire la riformazione dei ponti disolfuro mediante ossidazione da parte di O 2 Cisteina ridotta Iodoacetamide Cisteina Carboamidometilata
23 Degradazione di Edman 1. Il reagente di Edman fenilisotiocianato (PITC), reagisce con il gruppo amminico N- terminale di un polipeptide in condizioni blandamente alcaline. 2. Si forma così un addotto feniltiocarbamilico(ptc). 3. Tale composto trattato con acido trifluoroacetico (CF 3 COOH) anidro libera il residuo N- terminale sottoforma di derivato tiazolinonico, senza idrolizzare gli altri legami peptidici.
24 Degradazione di Edman Il derivato tiazolinone-amminoacido è estratto selettivamente con un solvente organico ed è convertito nel più stabile derivato feniltioidantoina (PTH) mediante trattamento con un acido in soluzione acquosa.
25 Degradazione di Edman E possibile risalire alla sequenza amminoacidica di una proteina partendo dall N-terminale e spostandosi verso l interno, sottoponendo il polipeptide a cicli ripetuti della degradazione di Edman e, dopo ogni ciclo, identificando il PTH-amminoacido liberato.
26 Degradazione di Edman Il tipo di amminoacido è identificato mediante confronto con i tempi di eluizione dei 20 PTHamminoacidistandard di riferimento separati mediante cromatografia a fase inversa. E possibile rilevare meno di una picomole di PTH-amminoacido. L analisi di sequenza può essere condotta su quantità dell ordine di 5-10 pmol di peptide (<0.1 µg).
27 Degradazione di Edman Oggi tutte le fasi della degradazione di Edman sono state automatizzate e possono essere effettuate utilizzando sequenziatori automatici.
28 Degradazione di Edman Dopo circa cicli diventa difficile determinare la sequenza amminoacidica. Ciò accade perché, dopo un numero elevato di cicli, gli effetti cumulativi di reazioni incomplete e di reazioni secondarie del processo di degradazione di Edman (carry over) rendono impossibile una identificazione certa dell amminoacido rilasciato e quindi della sequenza amminoacidica.
29 Strategia per il sequenziamento delle proteine La proteina da sequenziaredeve essere scissa in frammenti sufficientemente brevi da poter essere sequenziati individualmente.
30 Strategia per il sequenziamento delle proteine Poi, partendo dalla sequenza dei tratti sovrapposti, si ricostruisce la struttura primaria della proteina intatta.
31 Peptidasi Le endopeptidasisono enzimi che catalizzano l idrolisi dei legami peptidici interni, contrariamente alle esopeptidasiche rimuovono i residui N- o C-terminali.
32 DIGESTIONE DELLE PROTEINE proteina - amminoacido
33 DIGESTIONE DELLE PROTEINE proteina -arginina -lisina
34 DIGESTIONE DELLE PROTEINE Tripsina Riconosce e taglia con elevata specificitài legamipeptidicial terminale carbossilico dei residuidiarge Lys se ilresiduo successivo non è Pro -arginina -lisina
35 DIGESTIONE DELLE PROTEINE -arginina -lisina
36 DIGESTIONE DELLE PROTEINE -arginina -lisina
37 DIGESTIONE DELLE PROTEINE
38 DIGESTIONE DELLE PROTEINE
39 DIGESTIONE DELLE PROTEINE La digestione con tripsina di una proteina da luogo a frammenti di varia lunghezza che terminano, ad eccezione del C-terminale, con un residuo di lisina o arginina.
40 DIGESTIONE DELLE PROTEINE La digestione con tripsina di una proteina da luogo a frammenti di varia lunghezza che possono essere separati ed isolati mediante cromatografia a fase inversa e sequenziati individualmente N ter K K R R K C ter N ter K cter N ter K cter N ter R cter 1 peptide 2 peptide 3 peptide RP-HPLC N ter cter 4 peptide N ter -----K cter 5 peptide N ter C ter 6 peptide Sequenziamento
41 Peptidasi Altre endopeptidasi hanno specificità diversa e producono serie di frammenti peptidici con sequenze che si sovrappongono.
42 Idrolisi chimica con CNBr Molti reagenti chimici promuovono la scissione dei legami peptidici in corrispondenza di particolari residui. Uno dei più utilizzati è il bromuro di cianogeno (CNBr) che taglia sul lato carbossiterminale dei residui di metionina. Il C-terminale di nuova formazione dà origine ad una struttura ciclica (omoserina lattone).
43 Strategia per il sequenziamento delle proteine E necessario adoperare enzimi proteolitici diversi per generare una serie di frammenti peptidici sovrapposti Anche in questo caso si procederà alla determinazione della sequenza di ciascun peptide Le serie di sequenze peptidiche sovrapposte consentono di ricostruire la sequenza di ciascun polipeptide
44 Esempio N-Asp-Ala-Gly-Arg-His-Cys-Lys-Pro-Lys-Ser-Glu-Asn-Leu- Ala-Gly Arg-His Lys-Trp-Lys-Ser Glu-Asn-Leu- Ile-Arg-Thr-Tyr-C Tyr-C Tripsina N-Asp-Ala-Gly-Arg Ser-Glu Glu-Asn His-Cys Cys-Lys-Pro-Lys Asn-Leu-Ile-Arg Thr-Tyr Tyr-C I peptidi vengono separati mediante RP-HPLC e sequenziati mediante degradazione di Edman
45 Esempio Tripsina Tyr-Gly-Lys Ala-Lys Ile-Thr-Pro Ala-Asp-Phe-Ser-Arg Chimotripsina Ser-Arg-Ile-Thr-Pro Gly-Lys-Ala-Asp-Phe Ala-Lys-Tyr Ala-Lys-Tyr-Gly-Lys-Ala-Asp-Phe-Ser-Arg-Ile-Thr-Pro Ala-Asp-Phe-Ser-Arg-Ile-Thr-Pro
46 Banche dati di sequenze proteiche Le sequenze delle proteine possono essere depositate ed immagazzinate in specifiche banche dati consultabili via Internet (e.g. Molte sequenze proteiche sono state sequenziate direttamente, altre sono state dedotte dalle loro sequenze nucleotidiche (DNA).
47 Spettrometria di massa La spettrometria di massa è una tecnica che misura in maniera accurata il rapporto tra massa e carica (m/z) di ioni in fase gassosa. Viene utilizzata per la determinazione del peso molecolare delle proteine e anche per sequenziare i polipeptidi.
48 Spettrometria di massa Nella spettrometria di massacon ionizzazione per elettronebulizzazioneo elettrospray (ESI, electrospray ionization) una soluzione di una macromolecola come un polipeptide è vaporizzata in un capillare cui èapplicato un alto voltaggio sotto flusso di azoto per formare goccioline altamente cariche da cui il solvente evapora generando ioni in fase gassosa. L analizzatore dello spettrometro di massa determina poi il rapporto m/z di tali ioni con un accuratezza superiore allo 0.01%. Le cariche derivano dalla protonazione dei residui di Lyse Arg.
49 Spettrometria di massa Spettro ESI-MS della apomioglobina (mioglobina priva dello ione Fe) di cuore di cavallo. Sono indicati i rapporti m/z e le cariche dei picchi da cui è possibile ricavare il peso molecolare della proteina.
50 Spettrometria di massa in tandem (MS/MS) I peptidi possono essere sequenziati mediante spettrometri di massa con analizzatori disposti in serie. Il primo analizzatore seleziona lo ione (peptide) di interesse che viene poi frammentato in una cella di collisione (secondo analizzatore). Le masse dei frammenti vengono poi misurate nel terzo analizzatore.
51 Spettrometria di massa in tandem (MS/MS) Poiché la frammentazione avviene in determinate condizioni prevalentemente a livello dei legami peptidici, raffrontando le masse molecolari dei frammenti è possibile stabilire le identità dei residui amminoacidici dei peptide ad eccezione dei residui che la stessa massa molecolare (i.e. Ile e Leu).
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
La struttura covalente delle proteine (la sequenza amminoacidica)
 La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
Perché è importante determinare la struttura primaria delle proteine?
 Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle proteine è essenziale per comprendere i loro meccanismi di azione 2. Il confronto
Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle proteine è essenziale per comprendere i loro meccanismi di azione 2. Il confronto
Spettrofotometria e analisi di amminoacidi
 Spettrofotometria e analisi di amminoacidi Quantizzazione di proteine e di miscele di amminoacidi Antimo Di Maro Anno Accademico 2015-16 Assorbimento della luce ONDE ELETTROMAGNETICHE La radiazione elettromagnetica
Spettrofotometria e analisi di amminoacidi Quantizzazione di proteine e di miscele di amminoacidi Antimo Di Maro Anno Accademico 2015-16 Assorbimento della luce ONDE ELETTROMAGNETICHE La radiazione elettromagnetica
Distribuzione AA in banca dati
 Aminoacidi Distribuzione AA in banca dati Distribuzione AA in banca dati Aminoacidi Aminoacidi Aminoacidi Aminoacidi Aminoacidi (rappresenta l'assorbanza provocata da una soluzione a concentrazione molare
Aminoacidi Distribuzione AA in banca dati Distribuzione AA in banca dati Aminoacidi Aminoacidi Aminoacidi Aminoacidi Aminoacidi (rappresenta l'assorbanza provocata da una soluzione a concentrazione molare
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. Metodologie 1. DiSTABiF. Corso di Laurea in SCIENZE BIOLOGICHE.
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Anno Accademico 2016-17 Metodologie 1 Spettrofotometria e analisi di amminoacidi
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Anno Accademico 2016-17 Metodologie 1 Spettrofotometria e analisi di amminoacidi
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
LA SPETTROMETRIA DI MASSA
 LA SPETTROMETRIA DI MASSA Tecnica che consente di caratterizzare e identificare composti sconosciuti e noti in base alla determinazione della loro massa molecolare e alla loro caratterizzazione strutturale
LA SPETTROMETRIA DI MASSA Tecnica che consente di caratterizzare e identificare composti sconosciuti e noti in base alla determinazione della loro massa molecolare e alla loro caratterizzazione strutturale
Spettrometria di Massa applicata alla PROTEOMICA
 Spettrometria di Massa applicata alla PROTEOMICA 1. MALDI-TOF: Determinazione di mappe peptidiche mediante digestione in gel di spot separati su E-2D E da estratti proteici totali Identificazione rapida
Spettrometria di Massa applicata alla PROTEOMICA 1. MALDI-TOF: Determinazione di mappe peptidiche mediante digestione in gel di spot separati su E-2D E da estratti proteici totali Identificazione rapida
Rivelazione, identificazione, caratterizzazione strutturale
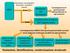 HPLC Separazione cromatografica di proteine e peptidi in miscela Eluato Rivelatore UV (fotodiodi) Cromatogramma UV (picchi generati dall assorbimento di ogni proteina) Eluato Spettrometro di massa ESI-Trappola
HPLC Separazione cromatografica di proteine e peptidi in miscela Eluato Rivelatore UV (fotodiodi) Cromatogramma UV (picchi generati dall assorbimento di ogni proteina) Eluato Spettrometro di massa ESI-Trappola
Modulo 3. Lavorare con le proteine
 Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Spettrofotometria e analisi di amminoacidi. Quantizzazione di proteine e di miscele di amminoacidi
 Spettrofotometria e analisi di amminoacidi Quantizzazione di proteine e di miscele di amminoacidi Assorbimento della luce ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è, dal punto di vista dell'elettromagnetismo
Spettrofotometria e analisi di amminoacidi Quantizzazione di proteine e di miscele di amminoacidi Assorbimento della luce ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è, dal punto di vista dell'elettromagnetismo
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Seminario di Cacciatore Rosalia
 Un organismo vivente è un sistema chimico complesso nel quale la materia organica viene sintetizzata, riprodotta, trasformata e decomposta in un incessante ed intenso susseguirsi di reazioni e processi
Un organismo vivente è un sistema chimico complesso nel quale la materia organica viene sintetizzata, riprodotta, trasformata e decomposta in un incessante ed intenso susseguirsi di reazioni e processi
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Gli amminoacidi ( 20) hanno proprietà strutturali comuni
 Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
ESERCIZI 2. Spiegare il principio di.
 ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
ESERCIZI 2. Spiegare il principio di.
 ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
CAPITOLO 2 STUDIO DELLA STRUTTURA PRIMARIA DELLE PROTEINE
 CAPITOLO 2 STUDIO DELLA STRUTTURA PRIMARIA DELLE PROTEINE Analisi della composizione amminoacidica delle proteine La determinazione della composizione amminoacidica di una proteina permette di sapere da
CAPITOLO 2 STUDIO DELLA STRUTTURA PRIMARIA DELLE PROTEINE Analisi della composizione amminoacidica delle proteine La determinazione della composizione amminoacidica di una proteina permette di sapere da
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
MS e Biomolecole FOLDING PROTEICO. Teoria e applicazioni APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE
 MS e Biomolecole Teoria e applicazioni Spettro ESI-MS della transferrina, una proteina ad alto peso molecolare (circa 80000Da). APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE Determinazione
MS e Biomolecole Teoria e applicazioni Spettro ESI-MS della transferrina, una proteina ad alto peso molecolare (circa 80000Da). APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE Determinazione
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA
 PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
AMMINO ACIDI. L equilibrio è regolato dal ph
 AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
Progetto Regione Emilia-Romagna. Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano
 Progetto Regione Emilia-Romagna Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano Azione 3: Aspetti enzimatici legati alla stagionatura del Parmigiano-Reggiano
Progetto Regione Emilia-Romagna Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano Azione 3: Aspetti enzimatici legati alla stagionatura del Parmigiano-Reggiano
Progetto Regione Emilia-Romagna. Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano
 Progetto Regione Emilia-Romagna Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano Azione 3: Aspetti enzimatici legati alla stagionatura del Parmigiano-Reggiano
Progetto Regione Emilia-Romagna Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano Azione 3: Aspetti enzimatici legati alla stagionatura del Parmigiano-Reggiano
cromatografia Esplorando le proteine
 Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
MS e Biomolecole FOLDING PROTEICO. Teoria e applicazioni APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE
 MS e Biomolecole Teoria e applicazioni APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE Determinazione del peso molecolare Individuazione di isoforme Mappatura peptidica e conferma della struttura
MS e Biomolecole Teoria e applicazioni APPLICAZIONI ESI E MALDI PER LO STUDIO DI PEPTIDI E PROTEINE Determinazione del peso molecolare Individuazione di isoforme Mappatura peptidica e conferma della struttura
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Selezione per le Olimpiadi Internazionali della Chimica 2010 Fase nazionale Soluzione dei problemi a risposta aperta
 Selezione per le limpiadi Internazionali della himica 2010 Fase nazionale Soluzione dei problemi a risposta aperta 1. SALI DPPI Identificare il sale GL x (S 4 ) y z 2 1.1 Dato che G reagisce con Mn 4 in
Selezione per le limpiadi Internazionali della himica 2010 Fase nazionale Soluzione dei problemi a risposta aperta 1. SALI DPPI Identificare il sale GL x (S 4 ) y z 2 1.1 Dato che G reagisce con Mn 4 in
ESAME DI MATURITÀ. Opzione specifica biologia e chimica. giugno 2011
 ESAME DI MATURITÀ Opzione specifica biologia e chimica giugno 2011 UCORRELAZIONI Cognome:.......... Nome:.......... Gruppo:.......... Numero:.......... Tempo a disposizione: 60 minuti Punteggio correlazioni:
ESAME DI MATURITÀ Opzione specifica biologia e chimica giugno 2011 UCORRELAZIONI Cognome:.......... Nome:.......... Gruppo:.......... Numero:.......... Tempo a disposizione: 60 minuti Punteggio correlazioni:
Applicazione della tecnica ESI-MS/MS all identificazione e quantificazione di molecole complesse Carla Zannoni
 Applicazione della tecnica ESI-MS/MS all identificazione e quantificazione di molecole complesse Carla Zannoni Eni SpA Spettrometria di massa con campione in fase liquida: principi di funzionamento ed
Applicazione della tecnica ESI-MS/MS all identificazione e quantificazione di molecole complesse Carla Zannoni Eni SpA Spettrometria di massa con campione in fase liquida: principi di funzionamento ed
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
2. SISTEMA DI PURIFICAZIONE CROMATOGRAFICA A MEDIA PRESSIONE (Biotage).
 1. APPARECCHIO PER REAZIONI A MICROONDE (Cem). Apparecchio per reazioni a microonde con sistema di sfiato automatico delle sovrappressioni, che consente di condurre reazioni che superano i 300 psi (20
1. APPARECCHIO PER REAZIONI A MICROONDE (Cem). Apparecchio per reazioni a microonde con sistema di sfiato automatico delle sovrappressioni, che consente di condurre reazioni che superano i 300 psi (20
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Complessi multienzimatici
 Complessi multienzimatici Complesso di enzimi caratterizzati da una precisa stechiometria e struttura che catalizza una serie di reazioni correlate Alcuni esistono come un insieme di polipeptidi altri
Complessi multienzimatici Complesso di enzimi caratterizzati da una precisa stechiometria e struttura che catalizza una serie di reazioni correlate Alcuni esistono come un insieme di polipeptidi altri
Ø Gel Elettroforesi (GE) Ø Spettrometria di Massa (MS)
 Tecniche di indagine nello studio delle PTMs Ø Gel Elettroforesi (GE) Ø Tecniche cromatografiche (LC, HPLC) Ø Spettrometria di Massa (MS) Possono essere utilizzate da sole o in combinazione, direttamente
Tecniche di indagine nello studio delle PTMs Ø Gel Elettroforesi (GE) Ø Tecniche cromatografiche (LC, HPLC) Ø Spettrometria di Massa (MS) Possono essere utilizzate da sole o in combinazione, direttamente
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione.
 Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi
 POTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,, O, N) macromolecole organiche, molecole informazionali, polimeri
POTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,, O, N) macromolecole organiche, molecole informazionali, polimeri
CLASSIFICAZIONE DEI PEPTIDI
 terminale). PEPTIDI Gli amminoacidi si legano tra di loro attraverso una reazione che coinvolge COOH di un amminoacido e NH 2 di un altro amminoacido, con la liberazione di una molecola di acqua per ogni
terminale). PEPTIDI Gli amminoacidi si legano tra di loro attraverso una reazione che coinvolge COOH di un amminoacido e NH 2 di un altro amminoacido, con la liberazione di una molecola di acqua per ogni
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI
 DIPARTIMENTO DI SCIENZE CHIMICHE Corso di laurea magistrale in Chimica organica e bioorganica Anno accademico 2017/2018-1 anno CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI CHIM/06-6 CFU
DIPARTIMENTO DI SCIENZE CHIMICHE Corso di laurea magistrale in Chimica organica e bioorganica Anno accademico 2017/2018-1 anno CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI CHIM/06-6 CFU
Cosa determina l assorbanza di un cromoforo?
 Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
REGISTRO DELLE LEZIONI 2005/2006. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
Strategie per la purificazione delle proteine
 Strategie per la purificazione delle proteine In una cellula ci possono essere molte proteine (ad esempio, ci sono circa 4300 geni in E. coli) Una singola proteina può rappresentare una frazione tra lo
Strategie per la purificazione delle proteine In una cellula ci possono essere molte proteine (ad esempio, ci sono circa 4300 geni in E. coli) Una singola proteina può rappresentare una frazione tra lo
Ionizzazione electrospray (ESI)
 Ionizzazione electrospray (ESI) Campione in fase liquida Analizzatore e - - Il potenziale applicato alla fine dell ago e e sufficientemente alto da nebulizzare la soluzione in una miriade di goccioline
Ionizzazione electrospray (ESI) Campione in fase liquida Analizzatore e - - Il potenziale applicato alla fine dell ago e e sufficientemente alto da nebulizzare la soluzione in una miriade di goccioline
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 5
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Biotecnologie applicate all ispezione degli alimenti di origine animale
 Prof.ssa Tiziana Pepe Tecniche molecolari Biotecnologie applicate all ispezione degli alimenti di origine animale Dip. di Medicina Veterinaria e Produzioni animali tiziana.pepe@unina.it Tecniche molecolari
Prof.ssa Tiziana Pepe Tecniche molecolari Biotecnologie applicate all ispezione degli alimenti di origine animale Dip. di Medicina Veterinaria e Produzioni animali tiziana.pepe@unina.it Tecniche molecolari
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di:
 Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
Analisi delle Proteine
 Analisi delle Proteine Elementi che costituiscono le proteine: idrogeno, carbonio, azoto, ossigeno e zolfo; tra cui l azoto è l elemento più distintivo nei cibi, l azoto varia da 13,4% a 19,1%. L analisi
Analisi delle Proteine Elementi che costituiscono le proteine: idrogeno, carbonio, azoto, ossigeno e zolfo; tra cui l azoto è l elemento più distintivo nei cibi, l azoto varia da 13,4% a 19,1%. L analisi
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
IL SEQUENZIAMENTO DEL DNA. Obiettivo: ottenere la sequenza nucleotidica di un frammento di DNA.
 IL SEQUENZIAMENTO DEL DNA Obiettivo: ottenere la sequenza nucleotidica di un frammento di DNA. Il DNA può essere sequenziato generando frammenti di DNA la cui lunghezza dipende dall ultima base della sequenza.
IL SEQUENZIAMENTO DEL DNA Obiettivo: ottenere la sequenza nucleotidica di un frammento di DNA. Il DNA può essere sequenziato generando frammenti di DNA la cui lunghezza dipende dall ultima base della sequenza.
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI Le proteine dovrebbero fornire circa il 12% delle calorie totali.
Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI Le proteine dovrebbero fornire circa il 12% delle calorie totali.
COMPOSTI AZOTATI. derivanti dall ammoniaca AMMINE. desinenza -INA AMMIDE
 COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
La classificazione delle proteine
 protidi 1 La classificazione delle proteine In base al valore biologico (ovvero al contenuto di AAE) si distinguono: - p. ad alto valore biologico contengono tutti gli AAE (es. carne, pesce, uova, latte
protidi 1 La classificazione delle proteine In base al valore biologico (ovvero al contenuto di AAE) si distinguono: - p. ad alto valore biologico contengono tutti gli AAE (es. carne, pesce, uova, latte
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
Schemi delle lezioni 1
 Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
GENERALITA SULLA CROMATOGRAFIA
 GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
moli OH - /mole amminoacido
 ) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
Il legame ammidico è planare con una rotazione parzialmente ristretta attorno al legame CO-N.
 Peptidi Polimeri costituiti da amminoacidi legati tra loro da legami ammidici (legame petidico). Si definiscono come di, tri, tetra.oligopeptidi.proteine (con PM >10000). Convenzionalmente vengono scritti
Peptidi Polimeri costituiti da amminoacidi legati tra loro da legami ammidici (legame petidico). Si definiscono come di, tri, tetra.oligopeptidi.proteine (con PM >10000). Convenzionalmente vengono scritti
O (PM:266,45), resina Dowex AG50W-X2, acido perclorico 65%.
 Parte sperimentale Reagenti CrCl 3 x 6H 2 O (PM:266,45), resina Dowex AG50W-X2, acido perclorico 65%. Procedura sperimentale Preparazione delle soluzioni eluenti Preparare le seguenti soluzioni madre di
Parte sperimentale Reagenti CrCl 3 x 6H 2 O (PM:266,45), resina Dowex AG50W-X2, acido perclorico 65%. Procedura sperimentale Preparazione delle soluzioni eluenti Preparare le seguenti soluzioni madre di
LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOACIDI
 LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu.
 PRINCIPI DELLA SPETTROMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
PRINCIPI DELLA SPETTROMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Protidi. Protidi 16/01/2019
 Protidi I protidi sono macromolecole costituite dall unione di amminoacidi tra loro. I protidi, a seconda del numero di amminoacidi che li costituiscono, sono distinti in: oligopeptidi, formati da pochi
Protidi I protidi sono macromolecole costituite dall unione di amminoacidi tra loro. I protidi, a seconda del numero di amminoacidi che li costituiscono, sono distinti in: oligopeptidi, formati da pochi
Elettroforesi = migrazione in campo elettrico
 Elettroforesi = migrazione in campo elettrico Molte molecole di interesse biologico possiedono gruppi ionizzabili. In opportune condizioni di ph presentano una carica elettrica + o e quindi sono in grado
Elettroforesi = migrazione in campo elettrico Molte molecole di interesse biologico possiedono gruppi ionizzabili. In opportune condizioni di ph presentano una carica elettrica + o e quindi sono in grado
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta)
 Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Chimica Analitica e Laboratorio 2. Modulo di Spettroscopia Analitica
 Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Determinazione della costante di dissociazione di un acido debole 2 Metodi di determinazione del pk d Potenziometria K d = + [ H ][ A
Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Determinazione della costante di dissociazione di un acido debole 2 Metodi di determinazione del pk d Potenziometria K d = + [ H ][ A
