APPUNTI DI CHIMICA CLASSE I
|
|
|
- Rosa Milani
- 7 anni fa
- Visualizzazioni
Transcript
1 APPUNTI DI CHIMICA CLASSE I 1
2 PESO DI UN ATOMO E la MASSA ATOMICA RELATIVA, che si esprime in U. o in U.M.A. (Unità di Massa Atomica). Si assegna per convenzione il valore di 12 all atomo più diffuso, il CARBONIO, e si confrontano le masse degli altri atomi con la massa dell atomo di carbonio. 1 U.M.A. = 1/12 dell atomo di 12 C (isotopo 12 del Carbonio, cioè carbonio con 6 protoni e 6 neutroni = 12 NUCLEONI); quindi un UMA equivale alla massa di un nucleone La MASSA ATOMICA RELATIVA di ogni elemento si trova sulla tavola periodica, molto spesso è rappresentata da un numero con la virgola perché viene ricavata facendo la media pesata degli isotopi di quegli elementi. Un UMA ha una massa assoluta (in g) paria a 1,6 x g. quindi è possibile calcolare la : MASSA ATOMICA ASSOLUTA moltiplicando la MASSA ATOMICA RELATIVA per la massa assoluta di un UMA (1,6 x g/uma) COME SI OTTIENE LA MASSA ATOMICA ASSOLUTA? Si ottiene facendo MASSA ATOMICA RELATIVA (M.A.R.) x 1,6 x g Oppure, se vogliamo esprimerla in KG. Si fa M.A.R. x 1,6 x Kg Esempio 1: Sodio (Na) = 22,99 U.M.A. x (1,6 x g ) = 3,68 x g Esempio 2: Calcola la Massa Atomica Assoluta di un atomo di Cl (Cloro) Massa Atomica Relativa Cl = 35,453 UMA (da Tavola Periodica) quindi MASSA ATOMICA ASSOLUTA Cl = 12 UMA*1,6 x g/uma = 1,96 x g QUAL E LA DIFFERENZA FRA MASSA E PESO? LA MASSA è una proprietà della materia: rimane la stessa a prescindere da dove si trova quel corpo (cioè a prescindere dal fatto che il corpo si trovi sulla terra o nello spazio). 2
3 IL PESO è una forza che si ottiene facendo: MASSA x ACCELERAZIONE DI GRAVITA (cioè 9,8 m/s 2 ), per cui dipende da dove si trova quel corpo (cioè se il corpo si trova sulla Luna, dove la forza di gravità è molto inferiore, il peso cambia). MASSA MOLECOLARE Una MOLECOLA è formata da più atomi legati fra di loro. Per calcolare la MASSA MOLECOLARE SI SOMMANO tutti gli atomi che costituiscono una molecola Esempio: molecola dell acqua = H 2 O (U.M.A. =1) (U.M.A. = 16) (1 x 2)= = 18 esempio: molecola del glucosio= C 6 H 12 O 6 (U.M.A. =12) (U.M.A. = 1) (U.M.A. = 16) (12 x 6)= 72 + (1x12) = 12 + (16 x 6) = 96 = 180 3
4 LA MOLE È la quantità di SOSTANZA PURA che contiene 6,02 x (ATOMI, MOLECOLE, IONI ) PARTICELLE ELEMENTARI QUANTE PARTICELLE CI SONO IN 1 MOLE? SONO 6,02 x LA MASSA MOLARE SI ESPRIME CON L UNITA DI MISURA g/mol (grammi su mole) A cosa e uguale la massa molare? E uguale numericamente alla massa atomica(molecolare), ma è espressa in g/mol In modo grossolano, possiamo dire che la massa molare è quanto pesa una mole in grammi. Come si esprime la massa molecolare? Si esprime in U.M.A. (Unità di Massa Atomica) Come si trova la massa totale? Facendo il n. di moli moltiplicato per la massa molare FORMULE MASSA TOTALE (g) = n. moli x massa molare (g/mol) N. MOLI = massa totale (g) massa molare (g/mol) 4
5 Esercizio: dati: massa molecolare di CO 2 = 44,01 n. moli di C O2 = 1,8?: g (massa totale)? Totale massa molecolare (che è anche la massa molare) di CO 2 = C= 12 U. O= 16 U (16 x 2) = = 44 U. (cioè 44 g come massa molare) MASSA TOTALE= N. MOLI x MASSA MOLECOLARE = 1,8 x 44g = 79,2 g ESERCIZIO: DATI: MASSA TOTALE = 14,5 g?: n. moli di CO 2? MASSA MOLECOLARE DI CO 2 = 44 U. MASSA MOLARE DI CO 2 = 44 g/mol n. moli= massa totale (g) massa molare (g/mol) n. moli = 14,5 g 44 g/mol = 0,329 moli (perché g sopra e sotto si semplificano) Esercizio: DATI: massa totale di Ca= 80,16 g? = n. moli? Massa molecolare di Ca= 40,084 U. Massa molare di Ca= 40,084 g/mol 5
6 n. moli= massa totale (g) massa molare (g/mol) n. moli = 80,16 g = 2 moli 40,08 g/mol COSTANTE DI AVOGADRO E IL NUMERO CHE INDICA LE PARTICELLE CONTENUTE IN 1 MOLE. L UNITA DI MISURA E : atomi/mol E CORRISPONDE A: 6,02 x IL VOLUME MOLARE è il volume occupato da una mole di gas in condizioni STP (standard, cioè pressione di 1 atmosfera e temperatura 0 ), e corrisponde a 22,4 l (l/mol). FORMULE NUMERO DI AVOGADRO = particelle/atomi Mole VOLUME (l) = n. moli x volume molare (l/mol) N. MOLI = volume (l) Volume molare (l/mol) N. ATOMI = Numero Avogadro (atomi/mol) x N. MOLI (mol) N. MOLECOLE 6
7 ESERCIZIO Dati: n. moli Al = 1,15 mol? = atomi Al? Numero atomi= N. Avogadro x n. moli = : 6,02 x x 1,5 = 9,03 x Esercizio DATI: n. moli = 1,5 mol?: n. molecole di C O2? n. molecole = numero di Avogadro x n. moli = 6,02 x x 1,5 = 9,03 x Esercizio DATI: n. moli O 2 = 1,58 mol?: V (l) di O 2 a STP? V (l) = n. moli x volume molare (l/mol) = 1,58 x 22,4 = 35,4 (l/mol) Esercizio DATI: V (l) di NH 3 = 32,5 l?: n. moli di NH 3 a STP? n. moli= volume (l) = 32,5 : 22,4 (l/mol) = 1,45 mol (perché l sopra e sotto 7
8 Volume molare l/mol si semplifica.) LE GRANDEZZE CHE CARATTERIZZANO UN ONDA LAMBDA : (SIMBOLO λ) è la lunghezza d onda e misura la distanza fra due picchi d onda successivi. La misura che si adotta è il nanometro (nm) cioè 1 miliardesimo di metro Vale 1 x 10-9 m (1 nm = 1 x 10-9 m ; 1m = 10-9 nm) LA FREQUENZA: (SIMBOLO Ni, si rappresenta con V ) Unità di misura: Hz (Hertz) Hertz = S -1 (la frequenza della luce data in secondi), cioè rappresenta quante onde passano in 1 secondo (quanti cicli avvengono in 1 secondo) L AMPIEZZA: (SIMBOLO A) rappresenta l intensità dell onda (la grandezza del fenomeno). L unità di misura dipende dal tipo di onda (se è un onda sonora = decibel ecc.) LA VELOCITA DELLA LUCE (SIMBOLO C) C= λ x V (lunghezza d onda x frequenza) C= 3,00 x 10 8 m/s ( km al secondo nel vuoto) Qual è il legame fra lunghezza d onda ed energia? (E la frequenza) FORMULE λ = C V V = C λ 8
9 C = V x λ C= 3,00 x 10 8 m/s h= 6,626 x j. s E = h x V (equazione di PLANCK) MA V = C quindi E= h x C λ λ ESERCIZIO DATI: E= 4,1 x j λ =? ci servono c, h, E c ed h li conosciamo, E lo dobbiamo trovare: c= 3,00 x 10 8 m/s h = 6,626 x j. s E = h x V (equazione di PLANCK) MA V = C λ quindi E= h x C λ e, formula inversa λ = h x C E λ = 6,626 x j. s x 3 x 10 8 m/s 4,1 x j Mettiamo a posto i 10: x 10 8 = = λ = 6,626 x 3 = 4,84 x 10-7 m 9
10 4,1 Poi, per passare da m a nm (1m = 10 9 ) : 4,84 x 10-7 x 10 9 = 4,84 x 10-2 = 4,84 x 100=484 LA DIFFRAZIONE DELLA LUCE E quando un onda passa in un punto più piccolo della sua lunghezza d onda, per cui l onda non si propaga più in linea retta ma si allarga formando zone chiare (più onde si sommano) e più scure (più onde si sottraggono). Esse sono chiamate frange d interferenza. La luce bianca è la luce del sole o della lampadina (non al neon). È formata da tutte le componenti cromatiche che vanno dalla lunghezza d onda di 400 nm (violetto) a 700 nm ( rosso). I colori che noi vediamo sono dati da una radiazione che ha una lunghezza d onda di quel colore. Il bianco riflette tutte le radiazioni, il nero assorbe tutte le radiazioni. Per scomporre la luce bianca nelle sue componenti colorate (cromatiche) si usa un prisma. Quando la luce bianca (che viaggia nel vuoto a 3 x 10 8 m/s) esce dal vuoto ed entra nel prisma, ne esce con colori diversi e dà luogo ad uno spettro continuo. Questo fenomeno è chiamato dispersione della luce. Cos è l effetto fotoelettrico? (E l emissione di elettroni emessa da un metallo esposto ad un fascio di luce ultravioletta) Che legame c è fra velocità della luce, frequenza e lunghezza d onda? Come calcolo cioè lambda se conosco V? ( λ = C ) V Cos è C? (E la velocità della luce nel vuoto) Quanto vale? 10
11 (Vale 3 x 10 8 m/s) Fra quali estremi della lunghezza d onda è compresa la luce visibile? (Fra 400 violetto- e 700 rosso- nm) Da cosa dipende l energia che trasporta un fotone (un onda)? (Dalla frequenza. Usiamo l equazione di Planck: E = h x V Costante di Planck Frequenza In che rapporto sono frequenza, energia e lunghezza d onda? (Maggiore è la frequenza, maggiore è l energia. Ma siccome sappiamo che V = C λ possiamo anche dire che E = h x C λ così maggiore è la lunghezza d onda, minore è l energia. Cos è l effetto fotoelettrico? (E l emissione di elettroni da parte di un metallo quando è colpito da una radiazione luminosa.) Cos è la frequenza di soglia? (E la frequenza minima che un fotone (radiazione luminosa) deve avere perché poter emettere/espellere elettroni). Qual è il valore di h? (cioè la costante di Planck)? (h = 6,63 x ) Come otteniamo uno spettro dall idrogeno? 11
12 (Si prende un ampolla di vetro, ci si mette l idrogeno rarefatto, ci si mettono 2 elettrodi e accendiamo la luce. Vediamo un spettro a 4 righe, cioè l h (idrogeno) emette 4 radiazioni ben definite e diverse, ognuna con una specifica lunghezza d onda.) Cosa ha modificato Bohr rispetto a Rutherford? (Secondo il modello di Rutherford, un elettrone girava solo su un orbita. Questo modello è risultato incompleto quando Bohr ha preparato il suo modello: siccome l elettrone dà energia, se si vedono 4 righe, allora ci sono 4 fotoni con 4 energie diverse e quindi non è vero che l elettrone sta solo su un orbita; esso può andare su orbite diverse ma quantizzate, cioè ognuno con un energia ben precisa). Cosa succede se stimolo un elettrone? (Esso viene promosso dal livello fondamentale (n=1) ad un livello superiore/orbita superiore (n=2; n=3 ). Quanto tempo ci sta? (Un tempo brevissimo (10-7 s), poi torna subito allo stato fondamentale e cede l energia/luce che aveva acquistato, cioè cede un fotone). Che luce emette l elettrone che passa da un livello all altro? (Emette una luce particolare a seconda del livello da cui scende: - dal 5 al 2 emette il blu - dal 6 al 2 emette il violetto - dal 4 al 2 emette il verde - dal 3 al 2 emette l arancio Cosa succede quando l atomo non viene eccitato? ( Che è/rimane allo stato fondamentale) Cosa sono gli stati eccitati? (Sono i livelli di energia superiore rispetto al livello fondamentale n = 1) 12
13 ESERCIZIO DATI: λ = 420 nm?: E =? 1 nm = 10-9 quindi λ = 420 x 10-9 usiamo equazione di Planck: E= h x V quindi E = h x C λ h= 6,626 x j.s C = 3 x 10 8 m/s λ = 420 nm E = 6,626 x j.s x 3 x 10 8 m/s 420 x 10-9 m mettiamo a posto i 10: = = -17 E = 6,626 j.s x 3 x m/s = 4,73 x j
14 QUANDO SI PARLA DI IONIZZAZIONE, SI INTENDE SEMPRE 1 ATOMO ALLO STATO GASSOSO. 1) Cosa succede se si dà più energia ad un elettrone di quella che gli serve per arrivare al 7 ed ultimo livello? (Succede che si allontana l elettrone dell atomo, cioè si ionizza. Lo ione è 1 atomo che atomo che ha una carica elettrica, cioè diventa 1 ione con carica positiva=catione). 2) Per avere 1 carica elettrica, 1 atomo cosa può fare? (Può acquistare o perdere elettroni. Se li acquista c è carica negativa, se li perde c è carica positiva) 3) Cos è l energia di ionizzazione? (Ei) (E la quantità di energia che serve per allontanare 1 elettrone dall atomo allo stato gassoso. E espressa in Kj/mol : chilojoul su mole). 4) Com è diventato l atomo che ha perduto 1 elettrone? (E diventato positivo) 5) Dove vanno i restanti elettroni? (Vanno più vicini al nucleo, perché mancando l energia negativa dell elettrone mancante, i restanti elettroni negativi sono attratti con più forza dai protoni, visto che ora sono più numerosi). 6) Se voglio strappare un altro elettrone? (Ci vuole più forza, perché gli elettroni sono attratti con più forza). 7) Esiste solo un energia di ionizzazione? (No, c è anche la seconda energia di ionizzazione, che è più forte della prima) 8) Cos è l attrazione elettrostatica? 14
15 (E l attrazione elettrica fra carica positiva e carica negativa) 9) Cos è 6,02 x 10 23? (E la mole) 10) Come viene determinata l energia di ionizzazione? (Non ci sono formule, ma siccome è stata determinata a livello sperimentale, esistono tabelle che possiamo consultare). (INTERROGAZIONE 3 FEBBRAIO 2010) 11) Cos è l energia di ionizzazione? (E l energia necessaria per spostare un elettrone al di là dell ultimo livello (il 7 e ultimo livello). 12) Perché da parte dell idrogeno c è l emissione di 4 colori? (perché l elettrone dopo che è passato allo stato eccitato, ritorna allo stato fondamentale e cede la stessa energia che aveva assorbito sotto forma di 1 fotone. Questo fotone avrà la stessa lunghezza d onda che aveva assorbito). 13) Cos è uno spettro continuo? (E la luce bianca che contiene tutte le radiazioni.) 14) Cos è l effetto fotoelettrico? (E l emissione di elettroni da parte di un metallo quando viene colpito da una luce con una frequenza ben precisa. Si tratta della frequenza di soglia, cioè la frequenza sotto la quale non vengono emessi elettroni). 15
16 CONFIGURAZIONE ELETTRONICA Prendiamo il numero atomico di un elemento della tavola periodica; mandiamo via gli elettroni dall atomo utilizzando la piramide (DIAGONALE) prendendo i vari gradini dal basso verso l alto e calcolando il n. all apice fino a raggiungere il n. atomico. REGOLA DELLA DIAGONALE 7s 2 7p 6 7d 10 7f 14 7g 18 7h 22 7i 26 6s 2 6p 6 6d 10 6f 14 6g 18 6h 22 5s 2 5p 6 5d 10 5f 14 5g 18 4s 2 4p 6 4d 10 4f 14 3s 2 3p 6 3d 10 2s 2 2p 6 1s 2 ESEMPIO: Prendiamo il Be 4Be= 1s 2 2s 2 ESEMPIO: Prendiamo l O 8O= 1s 2 2s 2 2p 4 (perchè manca 4 ad arrivare al totale 8) 16
17 INTERROGAZIONE 1) Quanti livelli ci sono al massimo in un atomo? (7) 2) Quanti sottolivelli ci sono nel settimo livello? (7) 3) Quanti sottolivelli ci sono nel quinto livello? (5) 4) E nel terzo? (3) 5) Quanti elettroni contiene s? (2) 6) Quanti elettroni contiene p? (6) 7) Quanti elettroni contiene d? (10) 8) Quanti elettroni contiene f? (14) 9) Se l idrogeno viene riscaldato, quante righe si ottengono? (4) 10) Come si chiama lo spettro che emette righe? (spettro a righe) 11) Come si chiama lo spettro che emette luce bianca? (spettro continuo) 12) A cosa sono dovute le righe emesse dallo spettro a righe? (dal fatto che un elettrone rilascia energia dopo essere stato eccitato) 13) Come si può definire l energia che l elettrone emette quando torna al livello fondamentale? (con l equazione di Planck, cioè E = h x V) 14) Come deve essere la frequenza della luce per avere un effetto fotoelettrico? (deve essere superiore alla frequenza di soglia) 17
18 MODELLO ATOMICO ORBITALE Gli elettroni non girano proprio come farebbe un orbita: ogni livello e sottolivello ha unna sua forma caratteristica (e da questo dipenderà poi il tipo di legame che esiste fra elettroni). L elettrone infatti non ha solo una forma corpuscolare, ma può anche essere un onda, la quale può essere descritta da un equazione di Planck modificata, chiamata EQUAZIONE DI DE BROGLIE: λ = h m x V massa velocità (della particella) e tanto più energia trasporta, tanto più piccola è la lunghezza d onda. Secondo il principio di AUTODETERMINAZIONE DI HEISENBERG, non possiamo sapere con certezza dove si trova un elettrone in un dato momento, perché la sua traettoria non è ben definita ma PROBABILE. L ORBITALE Se non è possibile determinare la posizione esatta di un elettrone, allora cade il concetto di orbita e si usa invece quello di ORBITALE. 18
19 Per descrivere la forma dell orbitale atomico (tenendo presente che si tratta sempre di possibilità), si usa l equazione di Schrödinger. I NUMERI QUANTICI Ogni elettrone ha un numero quantico diverso da tutti gli altri. Il primo numero quantico (simbolo n) è quello principale, indica il livello di energia e va da 1 a 7. (Fino ad ora noi avevamo parlato di livello ). Il numero quantico secondario (simbolo l), indica la forma o il tipo di orbitale e prende valori che vanno da 0 a n -1. (Fino ad ora avevamo parlato di sottolivelli s p d ecc.) Con i numeri quantici, s corrisponde a 0, p=1, d=2 e così via, cioè abbiamo numeri invece di lettere. E quindi comprensibile che il valore va da 0 a n -1, perché se per es. prendo il livello 3 s=0, p=1, d=2, noto subito che da un sottolivello all altro ho sempre -1. (s=0 d=2 p=1) Il numero magnetico (simbolo m) corrisponde al numero di orbitali in un certo sottolivello (fino ad ora avevamo parlato di letti matrimoniali ). Va d +l a -l Il numero quantico di Spin (simbolo ms). Descrive il fatto che gli elettroni ruotano intorno a se stessi, o in senso orario (verso destra e quindi sono destrorsi e in questo caso ciò corrisponde a + ½), oppure in senso antiorario (verso sinistra e quindi sono sinistrorsi e ciò corrisponde a -½ ) Quando 2 elettroni girano uno verso destra e l altro verso sinistra, si dice che hanno spin opposti. Se girano tutti nella stessa direzione (o tutti verso destra o tutti verso sinistra), si dice che hanno spin paralleli. 19
20 INTERROGAZIONE DEL 3 MARZO ) Cos è il principio di autodeterminazione di Heisemberg? (è quel principio secondo cui è impossibile calcolare contemporaneamente la posizione e la velocità di un elettrone). 2) Cos è l orbitale atomica? (E lo spazio attorno al nucleo in cui vi è almeno il 95% di probabilità di trovare l elettrone). 3) Cos è un orbitale atomico? (E una funzione matematica per cui non ha una realtà fisica). 4) Cos è un orbitale? (E la regione di elevata probabilità di trovare un elettrone in un atomo). 5) Come si può determinare la configurazione elettronica del titanio ( 22 Ti) (Si applica la regola della diagonale vedi pag. 16 per cui 22 Ti= 1s 2, 2s 2, 2p 6, 3s 2, 3p 6, 4s 2, 3d 2 ; 6) Cos è la configurazione elettronica? (E la rappresentazione completa dei sottolivelli occupati da tutti gli elettroni in un atomo o in uno ione). 7) Qual è l equazione di una particella in movimento? (E : λ = h m x V cioè l equazione di De Broglie). 8) Cos è l energia di ionizzazione? (E l energia necessaria all atomo- neutro e allo stato gassoso- per allontanare l elettrone). 9) Come si trovano i n. di moli? (Si fa massa totale in grammi diviso la massa molare in g/mol). 10) Qual è il volume molare di 1 gas? (E 22,14). 20
21 11) Quante particelle ci sono in una mole? 6,02 x Esercizi del 7 aprile s p p p d d d d d 1) Configurazione elettronica del magnesio 12Mg= 1s 2, 2s 2, 2p 6, 3s 2 2) quali sono i numeri quantici dell elettrone 2p 2? (n=n. quantico principale l= n. quantico secondario m= n. quantico magnetico ms= n. quantico di Spin) n= 2 l= 1 m= -1 21
22 ms = ½ 2) Configurazione elettronica del Bromo ( 35 Br= 1s 2,2s 2,2p 6,3s 2,3p 6,3d 10,4s 2,4p 5 Quanti elettroni ci sono nell ultimo livello? (7) Quali sono i numeri quantici dell elettrone 2p 2? (n= 2 l=1 m= -1 ms= +1/2) Quali sono i numeri quantici dell elettrone 3d 4? (n= 3 l= 2 m= -1 ms= - ½) LA TAVOLA PERIODICA Ci dice quali sono gli elettroni di un atomo che si trovano nell ultimo livello (livello più esterno). A noi interessa infatti sapere questo, perché gli atomi si legano fra di loro utilizzando gli elettroni più esterni (chiamati ELETTRONI DEL LIVELLO DI VALENZA). La tavola periodica è divisa in VERTICALI (COLONNE) ed ORIZZONTALI (RIGHE). Le COLONNE sono chiamate GRUPPI. Quando si parla di gruppi, ci si riferisce alle righe più alte e notiamo che nel gruppo I c è 1 elettrone nell ultimo livello, nel gruppo II ci sono 2 elettroni, nel III 3 elettroni ecc.ecc. Nel gruppo VIII (0) ci sono 8 elettroni ed è il livello saturo (pieno). Le RIGHE sono chiamate PERIODI ed indicano a che livello si trovano gli elettroni. Per esempio, gli elementi del 1 periodo hanno gli elettroni di valenza nel 1 livello ecc. (esercizi pag 158 1/d 2/b 3/d 4/b 5/b-f 6/falso 7/a falso b vero c falso d vero) 22
23 La tavola periodica è stata pensata da Mendeleev che stabilì la relazione esistente fra proprietà degli elementi e le masse atomiche (il n. di massa è la somma di protoni e neutroni e non compare sulla T.P.). Mendeleev classificò questa relazione e così nacque la tavola periodica. Successivamente, Mosley scoprì che le proprietà di un elemento dipendono dal numero atomico (cioè dal n. di protoni presenti nel nucleo dell atomo) e non dalla massa atomica. La tavola periodica è divisa in COLONNE chiamate GRUPPI. Ci sono 8 gruppi A, 7 gruppi B e 1 gruppo 8B. Le RIGHE invece sono chiamate PERIODI. Nella Tavola periodica i periodi sono 7. Alcuni gruppi della Tavola Periodica hanno nomi particolari: - gruppo 8A = gas nobili - gruppo 1 A = metalli alcalini - gruppo 2 A = metalli alcalino-terrosi - gruppo 7 A = alogeni Fra il II e il III gruppo, ci sono molti elementi di transizione. La posizione di un elemento nella Tavola Periodica non è quindi casuale. Essa è stabilita da: - ultimo livello occupato - n. di elettroni presenti sull ultimo livello. Dalla posizione di un elemento nella Tavola Periodica si può capire: - la sua proprietà fisico-chimica. (Non a caso Mendeleev lasciò dei vuoti nella Tavola Periodica per elementi all epoca sconosciuti). - La configurazione elettronica del livello esterno - La proprietà degli elementi adiacenti (cioè dell elemento che segue e precede quello considerato). Nella T.P. appartengono allo stesso gruppo gli elementi che hanno proprietà simili, cioè quelli che hanno un uguale configurazione elettronica dell ultimo livello, (cioè stesso numero di elettroni sull ultimo livello/nello strato esterno, chiamato stato di valenza). 23
24 E molto più facile strappare un elettrone da un elemento dei primi gruppi piuttosto che da uno degli ultimi (gas nobili), perché gli ultimi elementi sono stabili mentre i primi diventano stabili proprio se tolgo un elettrone. (Stabili= ultimo livello diventa pieno). Siccome in natura tutti gli elementi tendono a diventare stabili, è chiaro che man mano che occorre strappare più elettroni, si fa più fatica. PROPRIETA DEL PERIODO AFFINITA ELETTRONICA E il grado di affinità che un atomo ha di acquistare un elettrone (tendenza a formare ioni negativi). Gli elementi dei primi gruppi (da sinistra verso destra) hanno una bassa affinità elettronica, perché hanno più interesse a cedere che non ad acquistare elettroni. Gli elementi degli ultimi gruppi hanno viceversa alta affinità elettronica. L ENERGIA DI IONIZZAZIONE E QUELLA NECESSARIA A STRAPPARE UN ELETTRONE DALL ATOMO (contrario dell affinità elettronica), all interno del periodo, AUMENTA da sinistra verso destra. ELETTRONEGATIVITA E la tendenza che ha un elemento ad attirare gli elettroni nel legame con altri elementi.(simile all affinità elettronica). RAGGIO ATOMICO E la metà della distanza minima che possono avere 2 atomi dello stesso elemento. La sua particolarità sta nel momento in cui un atomo perde o acquista elettroni. Se acquista un elettrone, il suo raggio atomico aumenta. Se lo perde, diminuisce. Nel periodo esso diminuisce da sinistra verso destra perché aumentano gli elettroni nello stesso livello e quindi sono maggiormente attirati verso il nucleo. ALL INTERNO DEL GRUPPO 24
25 L ENERGIA DI IONIZZAZIONE (che è quella contraria all affinità elettronica), diminuisce andando dall alto verso il basso. IL RAGGIO ATOMICO Aumenta dall alto verso il basso. L ENERGIA DI IONIZZAZIONE DIMINUISCE dall alto verso il basso (perché gli elettroni esterni sono più lontani dal nucleo e quindi più facilmente estraibili). APPUNTI DEL 21 APRILE ) quali sono gli elementi di transizione?(fra il 2 e il 3 gruppo) 2) come sono questi elementi? (hanno l orbitale di tipo d semipieno) 3) qual e la configurazione elettronica del 20 Ca? s p p p d d d d d 4) QUAL E LA CONFIGURAZIONE ELETTRONICA DELLO SCAMBIO 21 Sc? s p p p d d d d d 5) E quella dello zinco 30 Zn? 25
26 s p p p d d d d d 6)Quanti elettroni ha il C i -? (18, perché Cl ha 17 elettroni ma siccome ha 1 carica negativa, vuol dire che ha 1 elettrone in più). 7) Con chi è ISOLETTRONICO (cioè che ha lo stesso numero di elettroni?) (con S, che lo precede a sinistra) 8) Quanti elettroni ha Na +? (10, perché 11-1) 9) Con chi è isoelettronico? (con Ne) 10) Quanti ne ha Ca ++? (18, perché 20-2) 11) Con chi è isoelettronico? (con K + e con Ar) 12) Quanti ne ha Mg ++ o Mg +2? (ne ha 10, perché 12-2) 12) Con chi è isoelettronico? (con F -, con Ne, con Na + ). 26
27 LA SIMBOLOGIA DI LEWIS Serve a rappresentare gli atomi con gli elettroni di valenza (cioè quelli che stanno all ultimo livello). Si rappresenta con puntini (. ) e barrette ( _ ) Per esempio: H (idrogeno) ha un elettrone per cui: H. Be ha due elementi (è del secondo gruppo) per cui: Be. E poi il B (Boro) (terzo gruppo, 3 elementi).. Bo. E il C (quarto gruppo, 4 elementi).. C.. fino a considerare N che è del quinto gruppo, ha 5 elementi per cui. posso scriverlo. N : oppure posso scrivere i due puntini/elettroni appaiati.. cioè posso fare il doppietto. N. Poi c è O (6 elementi) _. O. C è Cl (7 elementi) _. 27
28 . Cl _ E c è Ne (8 elementi) _ Ne _ I LEGAMI Gli atomi si legano fra di loro per raggiungere la stabilità perché da soli non sono stabili (ad eccezione dei gas nobili, che essendo già stabili, ovvero avendo l ultimo livello saturo, non hanno bisogno di legarsi con alcuno). Regola dell OTTETTO: 1 atomo è particolarmente stabile quando ha 8 elettroni nel livello di valenza (ultimo livello), come succede ai gas nobili tranne che all elio. Quando un atomo compie un legame, cerca di raggiungere la configurazione stabile, cioè quella del gas nobile ad esso più vicino. Per esempio il Be cerca di raggiungere l Elio, quindi cerca di perdere 2 elettroni. I legami possono essere di tre tipi: 1) COVALENTE 2) IONICO 3) METALLICO 1) COVALENTE Il legame covalente è caratteristico dei NON METALLI. E il legame fatto da una coppia di atomi che mettono in compartecipazione una coppia o più di elettroni. Prendiamo l esempio di due atomi di H. Essi hanno la stessa elettronegatività ed essendo uguali non possono strappare un elettrone all altro, quindi possono solo legarsi: H.. H = H _ H = H : H In questo modo la coppia di elettroni appartiene ad entrambi ed entrambi diventano stabili. 28
29 IL LEGAME COVALENTE DATIVO: è quello in cui la coppia di elettroni condivisa e messa a disposizione da un solo atomo, detto datore, ed accettato dall altro, detto accettore, naturalmente il datore deve essere meno elettronegativo dell accettore. Una volta formato il legame dativo è per tutto indistinguibile da un normale legame covalente singolo; graficamente viene rappresentato da una freccia (->) che va dal datore all accettore. ELETTRONEGATIVITA E la tendenza che ha un atomo di attirare verso di se gli elettroni di un legame covalente. Molto grossolanamente è simile all affinità elettronica. Più un atomo attira gli elettroni, più è elettronegativo. Viene espressa con una scale convenzionale elaborata da Pauling; il valore di elettronegatività di ogni singolo elemento è riportato nella Tavola Periodica degli Elementi Sulla tavola periodica l elettronegatività aumenta da sinistra verso destra. I metalli hanno bassa elettronegatività; al contrario i non metalli hanno maggiore elettronegatività. LA DISTANZA DI LEGAME E la distanza che si crea fra i 2 nuclei degli atomi. Essa è determinata dalla FORZA DI REPULSIONE che esiste fra i due atomi (che hanno entrambi nuclei positivi), dalla FORZA DI REPULSIONE che si crea fra i due elettroni (che sono entrambi negativi) e dalla FORZA DI ATTRAZIONE che esiste invece fra atomi ed elettroni. Esempi di legami Il Cl per diventare stabile ha bisogno di un elettrone: _ Cl. _ Cl : Cl. _ Cl _ oppure 29
30 Cl Cl Il C per diventare stabile ha bisogno di 4 elettroni; l H ha invece bisogno di 1 elettrone. Se si legano insieme:.. C. + H.. H H C H H perché con un legame H ha due elettroni e diventa stabile, C con un legame ne ha cinque e quindi devo fare altri 3 legami (cioè aggiungere altre 3 volte H), così ho: 4 H. +. C... altro esempio: O (6 elettroni) Legame con altro O = O. +. O.. lego 2 volte per arrivare a 8 elettroni: O = O altro esempio è l Azoto (5 elettroni). N.. se lego con 3 H faccio l ammoniaca: 30
31 H N H H Se lego altri 3 N : N N quindi il legame covalente può essere DOPPIO O AL MASSIMO TRIPLO (non esiste quadruplo o più) il legame covalente può essere: - PURO, cioè gli elettroni sono uguali oppure ho una differenza di elettronegatività (si legge sulla T.P.) fra i due elementi 0,4 - POLARE, cioè la differenza di elettronegatività fra i due elementi è > 0,4 Quindi tanto più è alta la differenza di elettronegatività, tanto più un legame è polare (gli elettroni si spostano sempre verso l atomo più elettronegativo). FORMULE MASSA TOTALE (g) = n. moli x massa molare (g/mol) N. MOLI = massa totale (g) massa molare (g/mol) NUMERO DI AVOGADRO = particelle/atomi Mole VOLUME (l) = n. moli x volume molare (l/mol) N. MOLI = volume (l) Volume molare (l/mol) N. ATOMI = Numero Avogadro (atomi/mol) x N. MOLI (mol) N. MOLECOLE 31
32 λ = C V V = C λ C = V x λ C= 3,00 x 10 8 m/s h = 6,626 x j. s E = h x V (equazione di PLANCK) MA V = C quindi E = h x C λ λ EQUAZIONE DI DE BROGLIE: λ = h m x V 32
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
combinazione di atomi tenuti insieme da forze più o meno un insieme caratteristico di proprietà
 IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una
 Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
STRUTTURA ATOMICA. tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica
 STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
(98,9x12) + (1,1x13) = 12,01 100
 5 GLI ISOTOPI Le proprietà di un elemento non dipendono dal numero di massa, ma dal numero atomico; infatti è sufficiente il numero dei protoni a caratterizzare un atomo, in quanto esso condiziona un uguale
5 GLI ISOTOPI Le proprietà di un elemento non dipendono dal numero di massa, ma dal numero atomico; infatti è sufficiente il numero dei protoni a caratterizzare un atomo, in quanto esso condiziona un uguale
GLI ELEMENTI CHIMICI
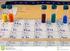 I costituenti degli elementi chimici GLI ELEMENTI CHIMICI Gli elementi chimici si differenziano per il numero di protoni nel nucleo. Il numero dei protoni definisce il numero atomico (Z) di un elemento.
I costituenti degli elementi chimici GLI ELEMENTI CHIMICI Gli elementi chimici si differenziano per il numero di protoni nel nucleo. Il numero dei protoni definisce il numero atomico (Z) di un elemento.
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
L'atomo è la parte più piccola della materia che ne conserva tutte le caratteristiche. Esso è formato da particelle più piccole:
 L'atomo è la parte più piccola della materia che ne conserva tutte le caratteristiche. Esso è formato da particelle più piccole: PROTONI NEUTRONI ELETTRONI I protoni e i neutroni si trovano nella parte
L'atomo è la parte più piccola della materia che ne conserva tutte le caratteristiche. Esso è formato da particelle più piccole: PROTONI NEUTRONI ELETTRONI I protoni e i neutroni si trovano nella parte
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole
 Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Configurazione elettronica e Tabella Periodica Negli elementi di transizione, il numero
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Configurazione elettronica e Tabella Periodica Negli elementi di transizione, il numero
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Configurazioni elettroniche e periodicità
 Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
con la sostanza di partenza (fig. 6). Fig. 1 Fig. 2 Fig. 3 Fig. 4 Fig. 5 Fig. 6 Fig. 7
 Cap. 6 Dentro la materia saperi essenziali 6.1 Le caratteristiche della materia La materia è tutto ciò che ha una massa e occupa un volume 6.2 La teoria atomica della materia Se immaginiamo di spezzare
Cap. 6 Dentro la materia saperi essenziali 6.1 Le caratteristiche della materia La materia è tutto ciò che ha una massa e occupa un volume 6.2 La teoria atomica della materia Se immaginiamo di spezzare
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
ATOMO POLIELETTRONICO. Numero quantico di spin m s
 ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
Principio dell Aufbau (riempimento)
 LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton),
 Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton), particelle subatomiche, protone, neutrone, elettronie, nucleo. 2. Decidi se tra
Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton), particelle subatomiche, protone, neutrone, elettronie, nucleo. 2. Decidi se tra
Unbowed, Unbent, Unbroken
 Unbowed, Unbent, Unbroken L ATOMO E LE SUE PROPRIETÀ STRUTTURA DELL ATOMO Carica Massa Protoni = particelle a carica positiva +1,6 x 10-19 C 1,67 x 10-27 Kg Elettroni = particelle a carica negativa -1,6
Unbowed, Unbent, Unbroken L ATOMO E LE SUE PROPRIETÀ STRUTTURA DELL ATOMO Carica Massa Protoni = particelle a carica positiva +1,6 x 10-19 C 1,67 x 10-27 Kg Elettroni = particelle a carica negativa -1,6
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
L atomo di Bohr. Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913)
 L atomo di Bohr Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913) L atomo di Bohr L atomo di idrogeno presenta un solo elettrone 1. L elettrone
L atomo di Bohr Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913) L atomo di Bohr L atomo di idrogeno presenta un solo elettrone 1. L elettrone
LA TAVOLA PERIODICA. Ingegneria delle costruzioni
 LA TAVOLA PERIODICA Chimica Applicata Dr. Lucia Tonucci Ingegneria delle costruzioni Evidenza sperimentale: alcune proprietà degli elementi chimici hanno andamento periodico Elencando gli elementi secondo
LA TAVOLA PERIODICA Chimica Applicata Dr. Lucia Tonucci Ingegneria delle costruzioni Evidenza sperimentale: alcune proprietà degli elementi chimici hanno andamento periodico Elencando gli elementi secondo
Grandezze e unità di misura
 Grandezze e unità di misura La misura di una grandezza è costituita da un valore numerico e un appropriata unità di misura Esiste un sistema metrico denominato Sistema Internazionale di Unità (SI) basato
Grandezze e unità di misura La misura di una grandezza è costituita da un valore numerico e un appropriata unità di misura Esiste un sistema metrico denominato Sistema Internazionale di Unità (SI) basato
TAVOLA PERIODICA. 118 elementi, di cui 92 presenti in natura
 TAVOLA PERIODICA 118 elementi, di cui 92 presenti in natura L ordine della tavola periodica: individuare un criterio per classificare gli elementi! L ordine della tavola periodica: individuare un criterio
TAVOLA PERIODICA 118 elementi, di cui 92 presenti in natura L ordine della tavola periodica: individuare un criterio per classificare gli elementi! L ordine della tavola periodica: individuare un criterio
CHIMICA E BIOCHIMICA
 CHIMICA E BIOCHIMICA CHIMICA: studia la materia Materia= ogni cosa che ha massa Proprietà Struttura Trasformazioni (Reazioni) BIOCHIMICA: studia la chimica degli organismi viventi Di cosa è composta la
CHIMICA E BIOCHIMICA CHIMICA: studia la materia Materia= ogni cosa che ha massa Proprietà Struttura Trasformazioni (Reazioni) BIOCHIMICA: studia la chimica degli organismi viventi Di cosa è composta la
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
Configurazione elettronica e Tavola periodica. Lezioni 13-16
 Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
Un nuclide è un atomo caratterizzato dal numero atomico Z (numero di protoni) e dal numero di massa A (numero di neutroni e di protoni).
 L atomo Il nucleo è costituito da neutroni e protoni (nucleoni). Il neutrone non ha carica e la sua massa è,675 0-27 Kg. Il protone ha una carica positiva di,6022 0-9 C e una massa di,673 0-27 Kg. L'elettrone
L atomo Il nucleo è costituito da neutroni e protoni (nucleoni). Il neutrone non ha carica e la sua massa è,675 0-27 Kg. Il protone ha una carica positiva di,6022 0-9 C e una massa di,673 0-27 Kg. L'elettrone
Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi
 Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi Gli elementi sono ordinati secondo numero atomico Z ( numero dei protoni ) crescente Il numero
Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi Gli elementi sono ordinati secondo numero atomico Z ( numero dei protoni ) crescente Il numero
Gruppo costituito da elementi con uguale configurazione elettronica esterna.
 SISTEMA PERIODICO Ciascun elemento è caratterizzato dal n atomico Z, che esprime il n di cariche positive (protoni), presenti nel nucleo dell'atomo. La tabella periodica si articola in gruppi e periodi
SISTEMA PERIODICO Ciascun elemento è caratterizzato dal n atomico Z, che esprime il n di cariche positive (protoni), presenti nel nucleo dell'atomo. La tabella periodica si articola in gruppi e periodi
I legami chimici. Perché si formano i legami? Perché si formano i legami? 16/01/2019. Come e perché gli atomi si legano tra loro
 I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
ATOMO. Avogadro (1811) Volumi uguali di gas diversi contengono un ugual numero di MOLECOLE (N A =6,022*10 23 )
 ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
Struttura dell atomo atomo particelle sub-atomiche - protoni positiva - neutroni } nucleoni - elettroni negativa elemento
 Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
A Z. L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone. +1e e.
 L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
Le sostanze chimiche prof. Matteo Scapellato
 1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
Chimica e laboratorio
 Chimica e laboratorio L atomo: configurazione elettronica Classi Terze Lic. Sc. Tecnologico Anno Scolastico 2007/2008 Prerequisiti Conoscere l evoluzione delle conoscenze sulla costituzione dell atomo,
Chimica e laboratorio L atomo: configurazione elettronica Classi Terze Lic. Sc. Tecnologico Anno Scolastico 2007/2008 Prerequisiti Conoscere l evoluzione delle conoscenze sulla costituzione dell atomo,
L'atomo. La materia che ci circonda (aria, acqua, terra, oggetti, esseri viventi,...) é costituita da
 L'atomo La materia che ci circonda (aria, acqua, terra, oggetti, esseri viventi,...) é costituita da particelle elementari chiamate atomi; nella maggior parte dei casi gli atomi sono riuniti in gruppi
L'atomo La materia che ci circonda (aria, acqua, terra, oggetti, esseri viventi,...) é costituita da particelle elementari chiamate atomi; nella maggior parte dei casi gli atomi sono riuniti in gruppi
LUCE E ONDE ELETTROMAGNETICHE
 LUCE E ONDE ELETTROMAGNETICHE QUASI TUTTO QUELLO CHE SAPPIAMO SULLA STRUTTURA DELL ATOMO DERIVA DALL ANALISI DELLA LUCE EMESSA O ASSORBITA DALLE SOSTANZE CHI FU IL PRIMO AD ACCORGERSI CHE I SINGOLI ELEMENTI
LUCE E ONDE ELETTROMAGNETICHE QUASI TUTTO QUELLO CHE SAPPIAMO SULLA STRUTTURA DELL ATOMO DERIVA DALL ANALISI DELLA LUCE EMESSA O ASSORBITA DALLE SOSTANZE CHI FU IL PRIMO AD ACCORGERSI CHE I SINGOLI ELEMENTI
Forma e proprietà dell orbitale 1s
 Riassumendo Forma e proprietà dell orbitale 1s Proprietà degli orbitali 2s Forma e proprietà degli orbitali 2p Forma e proprieta degli orbitali d Orbitali di tipo f Comportamento degli elettroni in un
Riassumendo Forma e proprietà dell orbitale 1s Proprietà degli orbitali 2s Forma e proprietà degli orbitali 2p Forma e proprieta degli orbitali d Orbitali di tipo f Comportamento degli elettroni in un
IL LEGAME COVALENTE A-A A + A - Legame covalente. Il legame covalente. H 2 Cl 2 O 2 N 2 H 2 O CO 2 NH 3 CH 4
 IL LEGAME COVALENTE 1 Il legame covalente 2 Cl 2 O 2 N 2 A-A A + A - 2 O CO 2 N 3 C 4 Legame covalente Teoria di Lewis Teoria del Legame di Valenza Teoria degli Orbitali Molecolari 2 1 I simboli di Lewis
IL LEGAME COVALENTE 1 Il legame covalente 2 Cl 2 O 2 N 2 A-A A + A - 2 O CO 2 N 3 C 4 Legame covalente Teoria di Lewis Teoria del Legame di Valenza Teoria degli Orbitali Molecolari 2 1 I simboli di Lewis
Struttura dell'atomo a cura di Petr Ushakov
 Struttura dell'atomo a cura di Petr Ushakov Struttura dell'atomo Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: protone, neutrone e elettrone. particelle elementari
Struttura dell'atomo a cura di Petr Ushakov Struttura dell'atomo Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: protone, neutrone e elettrone. particelle elementari
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
La quantità chimica LA MOLE
 La quantità chimica LA MOLE 1 QUANTO PESA UN ATOMO? Se lo misurassimo in grammi, l atomo di H, il più piccolo, avrebbe una massa di 1,6 x10-24 g. Per convenzione, si assegna un valore arbitrario (12) alla
La quantità chimica LA MOLE 1 QUANTO PESA UN ATOMO? Se lo misurassimo in grammi, l atomo di H, il più piccolo, avrebbe una massa di 1,6 x10-24 g. Per convenzione, si assegna un valore arbitrario (12) alla
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Chimica. Lezione 2 Il legame chimico Parte I
 Chimica Lezione 2 Il legame chimico Parte I Gli ioni Uno ione è un ATOMO o una MOLECOLA che possiede una CARICA (positiva o negativa) È quindi una specie chimica che ha acquistato o ceduto uno o più elettroni
Chimica Lezione 2 Il legame chimico Parte I Gli ioni Uno ione è un ATOMO o una MOLECOLA che possiede una CARICA (positiva o negativa) È quindi una specie chimica che ha acquistato o ceduto uno o più elettroni
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro
 Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
the power of ten Prof.ssa Patrizia Gallucci
 https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
La tavola periodica. 1- Introduzione
 La tavola periodica 1- Introduzione La legge periodica (1869, Mendeleiev in Russia e Meyer in Germania) stabilisce che gli elementi, quando vengono disposti in ordine di massa atomica, mostrano una periodicità
La tavola periodica 1- Introduzione La legge periodica (1869, Mendeleiev in Russia e Meyer in Germania) stabilisce che gli elementi, quando vengono disposti in ordine di massa atomica, mostrano una periodicità
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
mvr = n h e 2 r = m v 2 e m r v = La configurazione elettronica r = e 2 m v 2 (1) Quantizzazione del momento angolare (2) 4 πε.
 La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
ATOMI E PARTICELLE SUBATOMICHE
 ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
Gruppo costituito da elementi con uguale configurazione elettronica esterna.
 SISTEMA PERIODICO Ciascun elemento è caratterizzato dal n atomico Z, che esprime il n di cariche positive (protoni), presenti nel nucleo dell'atomo. La tabella periodica si articola in gruppi e periodi
SISTEMA PERIODICO Ciascun elemento è caratterizzato dal n atomico Z, che esprime il n di cariche positive (protoni), presenti nel nucleo dell'atomo. La tabella periodica si articola in gruppi e periodi
La struttura dell atomo
 La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LEGAMI CHIMICI. Gli elettroni esterni sono implicati nella formazione dei legami chimici
 LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Quinta unità didattica. Tavola periodica
 Quinta unità didattica Tavola periodica Storia della Tavola periodica Il primo tentativo di ordinare gli elementi conosciuti si deve a Wolfgang Dobereiner nella prima metà dell Ottocento: egli rilevò
Quinta unità didattica Tavola periodica Storia della Tavola periodica Il primo tentativo di ordinare gli elementi conosciuti si deve a Wolfgang Dobereiner nella prima metà dell Ottocento: egli rilevò
le SOSTANZE Sostanze elementari (ELEMENTI) COMPOSTI Costituiti da due o più atomi DIVERSI tra loro
 Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Quarta unità didattica. Disposizione degli elettroni nell atomo
 Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Registration Evaluation Authorisation CHemicals
 Registration Evaluation Authorisation CHemicals Master in REACH 10/06/2011 B Prof. Anna Aiello 2.2. Informazioni relative alla formula molecolare e strutturale di ogni sostanza 2.2.1. Formula molecolare
Registration Evaluation Authorisation CHemicals Master in REACH 10/06/2011 B Prof. Anna Aiello 2.2. Informazioni relative alla formula molecolare e strutturale di ogni sostanza 2.2.1. Formula molecolare
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
La materia. https://www.youtube.com/watch?v=sfvvxv2deaa
 La materia https://www.youtube.com/watch?v=sfvvxv2deaa Un materiale sottoposto a filtrazione, si suddivide in un solido bianco A e in un liquido B. Il liquido B, per mezzo della distillazione, è separato
La materia https://www.youtube.com/watch?v=sfvvxv2deaa Un materiale sottoposto a filtrazione, si suddivide in un solido bianco A e in un liquido B. Il liquido B, per mezzo della distillazione, è separato
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
Diametro del nucleo: m. Diametro dell atomo: m
 Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107
 LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107 4.1 LA TEORIA ATOMICA La materia è formata da atomi, a loro volta costituiti da particelle subatomiche; Esistono tanti tipi di atomi quanti sono gli
LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107 4.1 LA TEORIA ATOMICA La materia è formata da atomi, a loro volta costituiti da particelle subatomiche; Esistono tanti tipi di atomi quanti sono gli
Chimica. Lezione 09/11/2010
 Chimica Lezione 09/11/2010 Se la differenza di elettronegatività ( x) è 1,9 il legame è IONICO Se 0,5 x < 1,9 il legame è covalente polare Se x < 0,5 il legame è covalente puro Massa atomica.. Massa
Chimica Lezione 09/11/2010 Se la differenza di elettronegatività ( x) è 1,9 il legame è IONICO Se 0,5 x < 1,9 il legame è covalente polare Se x < 0,5 il legame è covalente puro Massa atomica.. Massa
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
COMPORTAMENTO DUALISTICO della MATERIA
 COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
Carica e massa di particelle atomiche
 Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
Testi Consigliati. I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli. Qualsiasi altro testo che tratti gli argomenti elencati nel programma
 Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
gruppo ELEMENTI periodo
 gruppo ELEMENTI periodo METALLI NON-METALLI Metalli: duttili, malleabili, conducono corrente elettrica e calore, sono lucenti. Se un elemento non possiede nessuna delle proprietà sopra elencate è
gruppo ELEMENTI periodo METALLI NON-METALLI Metalli: duttili, malleabili, conducono corrente elettrica e calore, sono lucenti. Se un elemento non possiede nessuna delle proprietà sopra elencate è
Massa atomica. Unità di massa atomica: 1/12 della massa del 12 C
 Massa atomica Unità di massa atomica: 1/12 della massa del 12 C Il peso atomico, o più correttamente la massa atomica dei vari elementi si riporta sotto forma di una media ponderata tra i vari isotopi
Massa atomica Unità di massa atomica: 1/12 della massa del 12 C Il peso atomico, o più correttamente la massa atomica dei vari elementi si riporta sotto forma di una media ponderata tra i vari isotopi
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A Prova scritta del corso di Fondamenti di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
L Atomo Nucleare. Rutherford protoni James Chadwick neutroni 1932
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Negli ultimi anni dell Ottocento gli scienziati capiscono che gli atomi sono formati da: neutroni protoni elettroni
 L ATOMO Negli ultimi anni dell Ottocento gli scienziati capiscono che gli atomi sono formati da: neutroni protoni elettroni Neutroni e protoni si trovano nel nucleo Gli elettroni ruotano intorno al nucleo
L ATOMO Negli ultimi anni dell Ottocento gli scienziati capiscono che gli atomi sono formati da: neutroni protoni elettroni Neutroni e protoni si trovano nel nucleo Gli elettroni ruotano intorno al nucleo
Corso di CHIMICA LEZIONE 3
 Corso di CHIMICA LEZIONE 3 1 2 3 4 5 6 7 H Li Na K Fr Be Ma g Ca Ba TAVOLA PERIODICA He I II s 1 s 2 III IV V VI VII VIII p 1 p 2 p 3 p 4 p 5 p 6 blocco s La Ac 6 7 d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9
Corso di CHIMICA LEZIONE 3 1 2 3 4 5 6 7 H Li Na K Fr Be Ma g Ca Ba TAVOLA PERIODICA He I II s 1 s 2 III IV V VI VII VIII p 1 p 2 p 3 p 4 p 5 p 6 blocco s La Ac 6 7 d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9
ATOMO. Viene considerato Elemento fondamentale della materia (solidi, liquidi e gas)
 http://riccardocavallaro.weebly.com ATOMO Viene considerato Elemento fondamentale della materia (solidi, liquidi e gas) Il tipo di atomi e la loro combinazione determina il tipo di materiale/materia. Struttura
http://riccardocavallaro.weebly.com ATOMO Viene considerato Elemento fondamentale della materia (solidi, liquidi e gas) Il tipo di atomi e la loro combinazione determina il tipo di materiale/materia. Struttura
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 6. I legami chimici SEGUI LA MAPPA riconoscere valutare dativo puro 1 Gli atomi difficilmente
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 6. I legami chimici SEGUI LA MAPPA riconoscere valutare dativo puro 1 Gli atomi difficilmente
