COMPORTAMENTO ANFOTERO DEGLI AA
|
|
|
- Aurelia Orlandi
- 7 anni fa
- Visualizzazioni
Transcript
1 Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA -1 1
2 pi = ½ (pk 1 + pk 2 ) ½ ( ) = 5.97 EQUAZIONE DI HENDERSON-HASSELBALCH 2
3 pi = ½ (pk 1 + pk R ) pi = ½ ( ) = pi = ½ (pk R + pk 2 ) pi = ½ ( ) = 9.7 3
4 pi = ½ (pk R + pk 2 ) pi = ½ ( ) = 7.6 Per quasi tutti gli aa, il pi corrisponde al minimo di: - potere tampone - solubilità 4
5 EQUAZIONE DI HENDERSON-HASSELBALCH Le diverse funzioni delle proteine dipendono essenzialmente dalla diversità (dimensioni, reattività, carica) degli aa costituenti 5
6 Per quanto riguarda la carica: pk R Asp 3.7 Glu 4.3 His 6.0 Lys 10.5 Arg 12.5 His è l unico aa che ha un valore di pk R vicino ai valori fisiologici di ph. SEMPLICI PROTEINE - CATENA POLIPEPTIDICA CONIUGATE - CATENA POLIPEPTIDICA - GRUPPO PROSTETICO 6
7 PROTEINE CONIUGATE CLASSE Glico-P Lipo-P Fosfo-P Eme-P Flavo-P Metallo-P GRUPPO PROSTETICO Carboidrato Lipide Gruppi fosforici Eme (Fe-porfirina) Nucleotidi flavinici Ioni metallici (Fe, Zn, Cu) 7
8 Residuo di Val Residuo di Ala OLIGOPEPTIDI POLIPEPTIDI PROTEINE 2-12 aa aa aa 8
9 OLIGOPEPTIDI Glutatione Fattori di rilascio ipotalamici Ormoni dell ipofisi posteriore POLIPEPTIDI Glucagone (29 aa) ACTH (39 aa) Insulina (51 aa) 9
10 legame isopeptidico Glutatione ridotto (GSH) -Glutamil-Cisteinil-Glicina Glutatione ridotto Glutatione ossidato 10
11 Il GSH, particolarmente abbondante negli eritrociti, funziona da tampone sulfidrilico, preservando i gruppi sulfidrilici delle proteine ed altre molecole ossidabili dall azione nociva dei ROS. Proteina N aa N catene PM Citocromo c Emoglobina Titina ~ x 10 6 La titina è la proteina a più alto PM trovata finora. 11
12 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 12
13 La struttura primaria è data dalla sequenza degli aa legati tra loro da legami peptidici e, eventualmente, da ponti disolfuro. Il ponte disolfuro è l unico altro legame covalente che può unire due aa in una catena polipeptidica. 13
14 Dall analisi della struttura primaria di una determinata proteina possiamo trarre importanti dati relativi alla sua evoluzione. Citocromo c comparsa 1.5 miliardi di anni fa è una delle proteine più conservate presente in tutti gli organismi aerobi CITOCROMO c catena polipeptidica di aa esaminate 100 specie diverse (dal lievito all uomo) in 38 posizioni è presente lo stesso aa L omologia è tanto maggiore quanto più le specie sono vicine. 14
15 La sequenza aminoacidica di una proteina ne determina la struttura tridimensionale e questa, a sua volta, ne determina l attività biologica e quindi la funzione. Per quanto riguarda la struttura tridimensionale, distinguiamo le proteine in globulari e fibrose. P. globulari: catene ripiegate in forme sferiche P. fibrose: catene disposte in forme allungate 15
16 Gli studi cristallografici di PAULING E COREY furono fondamentali per il chiarimento delle caratteristiche del legame peptidico. Legame C-N 1,32 Å intermedio tra un legame singolo (1.49 Å) e un legame doppio (1.27 Å) 16
17 Un legame singolo può rotare Un legame doppio non può rotare Il legame peptidico è un ibrido di risonanza: 17
18 - O ha una parziale carica negativa - - la coppia di e - del legame C=O è parzialmente spostata verso O - N ha una parziale carica positiva + - la coppia di e - del legame tra C e N è in parte spostata verso il C carbonilico 18
19 A causa della risonanza la nube e - si estende su tutti e tre gli atomi Il legame C-N, presentando un parziale (40%) carattere di doppio legame, non è in grado di ruotare liberamente 19
20 Il C, l N, e i 4 atomi ad essi legati (O, H e i due C ) giacciono tutti su uno stesso piano: i legami peptidici sono dunque rigidi e planari. Possono ruotare solo i legami: C -C (angolo ψ) C -N (angolo φ) 20
21 Teoricamente φ e ψ possono assumere tutti i valori tra -180 e Praticamente molti di questi valori risultano proibiti per interferenze steriche. La conformazione in cui φ e ψ sono uguali a 0 non è consentita 21
22 Quasi tutti i legami peptidici assumono la configurazione trans, in cui H e O si trovano sui lati opposti: è così ridotta al minimo l interferenza sterica tra catene laterali adiacenti. Per convenzione φ e ψ sono uguali a 180 quando la catena è nella forma estesa. In realtà le catene polipeptidiche si avvolgono nello spazio assumendo un ripiegamento regolare e ripetitivo (struttura secondaria). 22
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
30/10/2015 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE
 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Diagramma di Ramachandran
 Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 6
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
Macromolecole Biologiche. I domini (I)
 I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
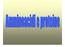 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico
 gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
ACIDI GRASSI INSATURI
 LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Costituenti chimici della materia vivente
 Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Emoglobina e mioglobina
 Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Amminoacidi - Peptidi - Proteine. Emoglobina
 Amminoacidi - Peptidi - Proteine Emoglobina 1 Emoglobina Gli amminoacidi sono le sostanze di base che costituiscono le proteine. Ogni proteina è caratterizzata da una precisa sequenza di mattoni di amminoacidi.
Amminoacidi - Peptidi - Proteine Emoglobina 1 Emoglobina Gli amminoacidi sono le sostanze di base che costituiscono le proteine. Ogni proteina è caratterizzata da una precisa sequenza di mattoni di amminoacidi.
Il metalloma Struttura e reattività di metalloproteine. Il trasporto dell O 2
 Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
FUNZIONI DELLE PROTEINE
 FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
La struttura delle proteine e. organizzazione. ramificati di aminoacidi
 La struttura delle proteine e descritta da quattro livelli di organizzazione Struttura Primaria- la sequenza di aminoacidi Struttura Secondaria - strutture locali stabilizzate da legami H che coinvolgono
La struttura delle proteine e descritta da quattro livelli di organizzazione Struttura Primaria- la sequenza di aminoacidi Struttura Secondaria - strutture locali stabilizzate da legami H che coinvolgono
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
La struttura delle proteine viene suddivisa in quattro livelli di organizzazione:
 Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
BIOMOLECOLE LE BASI DELLA BIOCHIMICA. Capitolo 1 Dal Carbonio agli OGM PLUS
 BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Le proteine che legano l ossigenol
 Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Parametri dell α-elica. residui/giro 3.6. passo dell elica
 GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
La biochimica è anche definita la chimica del C :
 Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini.
 I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
PROTEINE. Amminoacidi
 PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
BIOMOLECOLE. I mattoni delle cellule.
 BIMLECLE I mattoni delle cellule PRINCIPALI GRUPPI FUNZINALI I gruppi funzionali sono gruppi di atomi, uniti da legami covalenti, che conferiscono alla molecola di cui fanno parte un comportamento chimico
BIMLECLE I mattoni delle cellule PRINCIPALI GRUPPI FUNZINALI I gruppi funzionali sono gruppi di atomi, uniti da legami covalenti, che conferiscono alla molecola di cui fanno parte un comportamento chimico
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
Macromolecole Biologiche Interazioni non covalenti
 Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE
 Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
LIVELLI DI STRUTTURA DELLE PROTEINE
 FUNZIONI E STRUTTURA DELLE PROTEINE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 LIVELLI
FUNZIONI E STRUTTURA DELLE PROTEINE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 LIVELLI
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
α-cheratine (α-elica) collageni e cheratine β-cheratine (conformazione β) M.N. Gadaleta
 Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
SOSTEGNO proteine strutturali (collagene, cheratina, elastina, fibroina) CATALISI (enzimi)
 PROTEINE STRUTTURA E FUNZIONE DELLE PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica
PROTEINE STRUTTURA E FUNZIONE DELLE PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE
 MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
L'energia media V di interazione fra uno ione avente carica q e un dipolo permanente ad una distanza r Ä
 Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Daniela Carotti. Dipartimento di Scienze Biochimiche III piano - stanza 310.
 Daniela Carotti Dipartimento di Scienze Biochimiche III piano - stanza 310 06 49910969 daniela.carotti@uniroma1.it organismo cellula componenti biochimiche acqua ioni carboidrati riserva di energia ruolo
Daniela Carotti Dipartimento di Scienze Biochimiche III piano - stanza 310 06 49910969 daniela.carotti@uniroma1.it organismo cellula componenti biochimiche acqua ioni carboidrati riserva di energia ruolo
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Il DNA conserva l informazione genetica
 Il DNA conserva l informazione genetica Gli esperimenti di Frederick Griffith (1928) Gli esperimenti di Oswald Avery (1944) + Estratti dal ceppo IIIS ucciso al calore di Polisaccaridi Lipidi Proteine Acidi
Il DNA conserva l informazione genetica Gli esperimenti di Frederick Griffith (1928) Gli esperimenti di Oswald Avery (1944) + Estratti dal ceppo IIIS ucciso al calore di Polisaccaridi Lipidi Proteine Acidi
Acquisizione e Stabilità della struttura terziaria delle proteine
 Acquisizione e Stabilità della struttura terziaria delle proteine FORZE CHE STABILIZZANO LA STRUTTURA TERZIARIA DELLE PROTEINE 1. Legame covalente S-S (forte): non è presente in tutte le proteine che,
Acquisizione e Stabilità della struttura terziaria delle proteine FORZE CHE STABILIZZANO LA STRUTTURA TERZIARIA DELLE PROTEINE 1. Legame covalente S-S (forte): non è presente in tutte le proteine che,
1. Le biomolecole: Struttura e funzione delle proteine
 1. Le biomolecole: Struttura e funzione delle proteine Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) Le biomolecole Biomolecola:
1. Le biomolecole: Struttura e funzione delle proteine Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) Le biomolecole Biomolecola:
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE
 FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Fondamentali in ogni organismo, hanno molteplici ruoli:
 Le proteine Fondamentali in ogni organismo, hanno molteplici ruoli: Componenti strutturali (collagene, tessuto connettivo, citoscheletro, pelle) Trasportatori (emoglobina, albumina) Trasmettitori di messaggi
Le proteine Fondamentali in ogni organismo, hanno molteplici ruoli: Componenti strutturali (collagene, tessuto connettivo, citoscheletro, pelle) Trasportatori (emoglobina, albumina) Trasmettitori di messaggi
BIOCHIMICA BIOCHIMICA APPLICATA
 BIOCHIMICA BIOCHIMICA APPLICATA Corso di Laurea in Farmacia Prof. Ivano F. Santarelli Introduzione Testi consigliati -I principi di Biochimica di Lehninger. D.L.Nelson, M.M. Cox. Zanichelli -Biochimica
BIOCHIMICA BIOCHIMICA APPLICATA Corso di Laurea in Farmacia Prof. Ivano F. Santarelli Introduzione Testi consigliati -I principi di Biochimica di Lehninger. D.L.Nelson, M.M. Cox. Zanichelli -Biochimica
Rappresentazione dei Dati Biologici
 Rappresentazione dei Dati Biologici CORSO DI BIOINFORMATICA C.d.L. Ingegneria Informatica e Biomedica Outline Proteine ed Amminoacidi Rappresentazione di Amminoacidi Rappresentazione delle strutture Proteiche
Rappresentazione dei Dati Biologici CORSO DI BIOINFORMATICA C.d.L. Ingegneria Informatica e Biomedica Outline Proteine ed Amminoacidi Rappresentazione di Amminoacidi Rappresentazione delle strutture Proteiche
Struttura delle proteine
 Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
aa 2013-14 Proteine Struttura delle Proteine α Amminoacidi
 Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
