Estrazione di proteine da matrici alimentari, determinazione ed analisi
|
|
|
- Battistina Gioia
- 7 anni fa
- Visualizzazioni
Transcript
1 Estrazione di proteine da matrici alimentari, determinazione ed analisi Laboratorio di Biochimica Generale (Responsabile attività: Prof. Rocco Rossano, Tutor: Dr.ssa Marilena Larocca) 1. Omogeneizzazione della matrice (kiwi) in waringblendor 1.1 Rimuovere la buccia del kiwi e tagliare la polpa in cubetti di 2-3 cm. 1.2 Pesare all interno di un beker 40 g di campione cubettato e trasferirlicon l ausilio di una spatola a cucchiaio nell omogeneizzatore (waringblendor). 1.3 Dopo aver chiuso il bicchiere dell omogeneizzatore con l apposito tappo in teflon, omogeneizzare per 1 minuto alla massima velocità (4 step da 15 secondi). 2. Recupero della frazione proteica solubile mediante centrifugazione 2.1 Recuperare tutto l omogenato e ripartirlo in quantità uguali in 2 tubi da centrifuga, avendo cura di pesare accuratamente fino alla seconda cifra decimale. 2.2 Trasferire i tubi in centrifuga avendo cura di alloggiarli in diagonale. Dopo aver avvitato il coperchio del rotore e chiuso lo sportello della centrifuga, impostare i seguenti parametri (premere enter dopo ogni settaggio): rotor: 20; speed: rpm; time: 20 min; T: 4 C. 3. Filtrazione del supernatante 3.1 A fine centrifugazione recuperare i due tubi ed alloggiarli nell appositoporta-campioni (giallo) avendo cura di non scuoterli. 3.2 Recuperare il surnatante con una pipetta Pasteur e trasferirlo in cilindro da 50 ml. 3.3 Preparare un filtro di carta piegando in quattro il dischetto Whatman, posizionarlo all interno di un beker da 100mLe raccogliere il filtrato. 4. Dosaggio delle proteine con il metodo Bradford 4.1 Per l esecuzione del dosaggio utilizzareprovette da 10 ml ed aggiungere nell ordine (in triplicato): 800 µl di acqua deionizzata (utilizzare l apposito dispensatore) 20 µl di campione (utilizzare una micropipetta P20) 200 µl del reattivo Bradford (utilizzare l apposito dispensatore),
2 per la preparazione del bianco (riferimento) aggiungere acqua al posto del campione. 4.2 Agitare su vortex e trasferire il contenuto in cuvettesemimicro di plastica. 4.3 Effettuare le letture di assorbanza allo spettrofotometro alla lunghezza d onda di 595 nmdopo 5 min di incubazione con il reattivo (il colore blu è stabile per circa 45 min). 4.4 Leggere prima l assorbanza del bianco (riferimento), quindi azzerare lo spettrofotometro (Set Ref) e procedere con le letture del campione (Run). 4.5 Per il calcolo della concentrazione proteica utilizzare l equazione indicata, corrispondente alla retta di taratura ottenuta con una proteina di riferimento.
3 5. Separazione delle proteine mediante SDS-PAGE(Sodio DodecilSolfato- PoliAcrilammide Gel Elettroforesi) 5.1 Preparazione del gel -Assemblare all interno dell apposito supporto il sistema per la gelificazione (slab), costituito dalle due lastrine separate lateralmente dagli spaziatori da 1 mm e in basso chiuso da una striscia di gomma. -Versare all interno dello spazio tra i due vetrini, la soluzione di acrilammide per il gel di separazione inferiore (running gel), avendo cura di lasciarne 1-2 mlin una provetta per controllare l avvenuta polimerizzazione. -A polimerizzazione completata versare la soluzione per il gel di impaccamento superiore (stacking gel)al di sopra del gel di separazione. -Inserisce il pettine nel gel superiore per la formazione dei pozzetti per il caricamento dei campioni proteici. -Terminata la polimerizzazione rimuovere lo slab dal supporto ed inserirlo nella camera di elettroforesi, rimuovere il pettine ed aggiunge il tampone di corsa. 5.2 Preparazione del campione In una provettina del tipo Eppendorf aggiungere 10 µl di campione e 20 µl di tampone di lisi, dopo aver agitato su vortex incubare in acqua bollente per 5 min. 5.3 Caricamento su gel Prelevare il campione con una micropipetta e caricarlo all interno di un pozzetto del gel. 5.4 Caricare 7.5 µl di proteine standard (LowRange, Bio-Rad; kda). 5.5 Avvio della corsa elettroforetica -Chiudere la camera elettroforetica avendo cura di far combaciare gli elettrodi in base allo stesso colore -Collegare la camera all alimentatore, avviare la corsa impostando 150 V. -Bloccare la corsa quando il tracciante blu (bromofenolo) avrà raggiunto la fine del gel. 5.5 Colorazione del gel Immergere il gel nella soluzione colorante, incubare per 15 min. Recuperare la soluzione colorante ed aggiungere la soluzione decolorante, lasciare in agitazione tutta la notte.
4 6 Acquisizione ed analisi dell immagine 6.4 Acquisire l immagine del gel allo scanner, avendo cura di seguire le istruzioni indicate. 6.5 Effettuarel analisi d immagine computerizzata con il programma Image Master 1D (Pharmacia Biotech, Uppsala, Sweden) seguendo le istruzioni riportate. 7 Discussione dei risultati Soluzioni per la preparazione del gel 1) Soluzione di acrilammide/bisacrilammide 30 / 08%. 2) Tampone per il gel inferiore: 1.5 M Tris-HClpH 8.8, 0.4% SDS. 3) Tampone per il gel superiore: 0.5 M Tris-HClpH 6.8, 0.4% SDS. 4) Tampone di corsa: 25 mm Tris-HCl,192 mm Glicina, 0.1% SDS, ph ) Tampone di lisi per i campioni:4% SDS, 20% glicerolo, 10% 2-mercaptoetanolo, 0.004% bromofenoloblu, M TrisHCl, ph ) Soluzione per la colorazione del gel: 0,26% Coomassie Blue R-250, 10% acido acetico glaciale, 25% metanolo, 65 % H 2 O. 7) Soluzione per la decolorazione del gel: 10% acido acetico glaciale, 25% metanolo, 65 % H 2 O.
5 Elettroforesi L'elettroforesi è la tecnica che si basa sulla diversa migrazione, attraverso un mezzo fluido e sotto l'influsso di un campo elettrico, di particelle cariche, siano esse ioni o polielettroliti macromolecolari. Le proteine, essendo dei polielettroliti anfoteri, migrano in un campo elettrico in funzione della loro carica, la quale a sua volta dipende dai pk e dal ph del mezzo. Per definizione al ph isoelettrico (pi) le proteine hanno carica netta uguale a zero; a valori di ph inferiori al piprevalgono le cariche positive, cioè le proteine sono in forma cationica e migrano verso il catodo; a valori di ph maggiori del pi prevalgono le cariche negative, le proteine quindi sono in forma anionica e migrano verso l'anodo. Quindi il comportamento elettroforetico di una molecola non è funzione del valore assoluto del ph del mezzo ma è funzione del rapporto tra ph del mezzo e pi. La velocità di migrazione dipende, in definitiva, da una serie di parametri come campo elettrico, carica, temperatura, che aumentano la velocità di migrazione, dimensioni, viscosità del mezzo e forza ionica, che ostacolano la separazione e diminuiscono quindi la velocità di migrazione. Possiamo distinguere due tipi fondamentali di elettroforesi: l'elettroforesi in fase libera e l'elettroforesi zonale. Quest'ultima si distingue dalla prima per la presenza di un supporto solido inerte e poroso attraverso il quale sono costrette a migrare le particelle. L elettroforesi zonale garantisce una risoluzione maggiore rispetto all'elettroforesi in fase libera, perchè consente una separazione netta di una specie proteica in una zona ben distinta rispetto ad un'altra specie. Il supporto ha la funzione stabilizzante, evita il verificarsi di fenomeni convettivi durante l'elettroforesi e impedisce la diffusione dei soluti. Esso deve avere delle caratteristiche particolari:non disciogliersi nel tampone usato, essere formato da particelle di forma e distribuzione uniformi e non adsorbire soluti. Elettroforesi su gel di poliacrilamide in sodio dodecil- solfato(sds-page) In questo tipo di elettroforesi si usa il gel di poliacrilamide che ha delle caratteristiche particolari quali trasparenza, termostabilità, porosità variabile entro ampi limiti. Il gel è ottenuto dalla copolimerizzazione della acrilamide con N-Nmetilenbisacrilamide. Nel processo di polimerizzazione intervengono un iniziatore che è l ammonio persolfato, ed un catalizzatore che è la tetrametiletilendiamina (TEMED). Nel primo stadio di questa reazione si ha l attivazione del TEMED ad opera dell ammonio persolfato il quale agisce determinando la formazione di radicali. In seguito a questa attivazione il TEMED presenta un elettrone spaiato che viene trasferito ad una molecola di acrilamide o bisacrilamide. L acrilamide così attivata reagisce con
6 un altra molecola di acrilamide innescando una serie di reazioni a catena che continueranno fino a quando non si saranno esaurite le molecole di acrilamide. La presenza della bisacrilamide determina la formazione di un vero e proprio reticolo a maglie. La grandezza di queste maglie e quindi la porosità del gel, dipende dal rapporto acrilamide/bisacrilamide. Il tempo di polimerizzazione del gel è di circa 30 minuti. Il gel funge da setaccio molecolare, per cui la mobilità elettroforetica sarà funzione non solo della carica, ma anche delle dimensioni delle macromolecole. Questa tecnica consente pertanto di separare le proteine sulla base dei loro differenti pesi molecolari. Molto interessante si è rivelata la possibilità di utilizzare in questa tecnica elettroforetica il sodio dodecil-solfato (SDS), un detergente anionico. Esso agisce legandosi alle proteine con legami idrofobici di tipo cooperativo che ne determinano la denaturazione in seguito allo svolgimento delle catene polipeptidiche. L aggiunta di -mercaptoetanolo completa la denaturazione determinando la rottura dei ponti disolfuro intra ed inter-molecolari. Il complesso polipeptide-sds cosi formato, assume la forma di un bastoncello in cui le catene idrocarburiche dell SDS legate alle porzioni idrofobiche del polipeptide sono rivolte verso l interno, mentre i gruppi idrofilici S0 4 = sono esposti all esterno, verso il mezzo acquoso circostante. In questo modo le proteine risultano essere cariche negativamente. Sottoposte all azione di un campo elettrico migreranno tutte verso il polo positivo (anodo). La loro separazione avverrà solo in funzione dei diversi pesi molecolari, dato che il rapporto SDS/proteina, fatta eccezione per alcune proteine, è costante.l uso di gels piatti (slab-gel), offre la possibilità di esaminare contemporaneamente più campioni e di confrontarli con i markers. Procedura Si pipetta la soluzione per il gel inferiore nell intercapedine, creata da due spaziatori tra due lastrine di vetro. Dopo la polimerizzazione, si pipetta la soluzione per il gel superiore e si inserisce un pettine a 10 denti. Si lascia polimerizzare. La presenza del pettine determina la formazione di 10 pozzetti. Avvenuta la polimerizzazione del gel superiore, si sfila il pettine e si lava il gel con H 2 O distillata. La quantità di campione da applicare per ogni pozzetto è generalmente molto piccola; nell ordine dei µg. Le due lastrine che racchiudono il gel vengono inserite nella camera elettroforetica. In seguito si provvede con l aggiunta del tampone di corsa.
7 L elevata quantità di tampone utilizzato impedisce che si abbia una variazione di ph prima che la corsa sia finita evitando così il viraggio del gel; inoltre la corsa elettroforetica ha una durata inferiore in quanto il potere tampone è più elevato. Prima dell applicazione sul gel i campioni proteici vengono solubilizzati in un medium contenente SDS, -mercaptoetanolo, tampone e colorante a ph 6.8; poi per mezzo di una microsiringa o micropipetta vengono iniettati nei pozzetti del gel i campioni da analizzare. La cameretta viene chiusa con un coperchio che presenta due elettrodi i quali vengono collegati ad un generatore di corrente. La corsa elettroforetica viene fatta avvenire applicando a voltaggio o amperaggio costante. Essa viene seguita considerando la migrazione del Bromofenolo Blu presente nel medium solubilizzante. In genere la durata della corsa è di circa minuti. Terminata l elettroforesi, il gel viene rimosso dalle due lastre e immerso in una vaschetta contenente una soluzione colorante contenente CoomassieBrillant Blue. Infine il gel viene decolorato con una soluzione costituita da acido acetico-metanolo- H 2 O. La decolorazione risulta più efficace se effettuata sotto agitazione. Dopo la decolorazione l immagine del gel viene acquisita, quindi si procede all analisi dell immagine mediante densitometria. Il gel può essere conservato oppure utilizzato per il prelievo di spot dalle bande proteiche per studi di proteomica.
3. ELETTROFORESI DI PROTEINE
 3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
Elettroforesi di Tamara Benincasa
 Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Genomica e Proteomica
 Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Metodi di studio delle proteine :
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Decreto 1 luglio 1994.
 Decreto 1 luglio 1994. Approvazione metodo di analisi per il riconoscimento e il dosaggio del latte vaccino nella mozzarella di bufala per elettroforesi della caseina del formaggio. (pubbl. in Gazz. Uff.
Decreto 1 luglio 1994. Approvazione metodo di analisi per il riconoscimento e il dosaggio del latte vaccino nella mozzarella di bufala per elettroforesi della caseina del formaggio. (pubbl. in Gazz. Uff.
Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva.
 OBIETTIVO DEL LAVORO SPERIMENTALE: TIPIZZAZIONE DEI CROMOSOMI SESSUALI X e Y Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva. Cromosoma X Cromosoma y La tipizzazione
OBIETTIVO DEL LAVORO SPERIMENTALE: TIPIZZAZIONE DEI CROMOSOMI SESSUALI X e Y Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva. Cromosoma X Cromosoma y La tipizzazione
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
VALUTAZIONE DELLA INTERAZIONE TRA ANTIGENE E ANTICORPO MEDIANTE TECNICA IMMUNOCHIMICA WESTERN BLOTTING
 VALUTAZIONE DELLA INTERAZIONE TRA ANTIGENE E ANTICORPO MEDIANTE TECNICA IMMUNOCHIMICA WESTERN BLOTTING Laboratorio di Biochimica Cellulare (Responsabile attività: Prof. Angela Ostuni; Tutor: Dr.ssa Agata
VALUTAZIONE DELLA INTERAZIONE TRA ANTIGENE E ANTICORPO MEDIANTE TECNICA IMMUNOCHIMICA WESTERN BLOTTING Laboratorio di Biochimica Cellulare (Responsabile attività: Prof. Angela Ostuni; Tutor: Dr.ssa Agata
L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche.
 L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. L elettroforesi è una tecnica che viene usata per separare molecole
L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. L elettroforesi è una tecnica che viene usata per separare molecole
Elettroforesi proteine ed acidi nucleici
 Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
WESTERN BLOT o IMMUNOFISSAZIONE
 WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007. Corso di: Laboratorio di Biologia II Chimica Biologica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria
 1. Tecniche elettroforetiche: SDS-PAGE 2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria Testo consigliato Keith
1. Tecniche elettroforetiche: SDS-PAGE 2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria Testo consigliato Keith
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
RISOLUZIONE ENO 24/2004
 RICERCA DI SOSTANZE PROTEICHE DI ORIGINE VEGETALE NEI VINI E NEI MOSTI L'ASSEMBLEA GENERALE, Visto l'articolo 2 paragrafo 2 iv dell'accordo del 3 aprile 2001 che istituisce l'organizzazione internazionale
RICERCA DI SOSTANZE PROTEICHE DI ORIGINE VEGETALE NEI VINI E NEI MOSTI L'ASSEMBLEA GENERALE, Visto l'articolo 2 paragrafo 2 iv dell'accordo del 3 aprile 2001 che istituisce l'organizzazione internazionale
Laboratorio di Bioinorganica (Responsabile attività: Prof. Angelo Bracalello, Tutor: Dr.ssa M. Antonietta Vaccaro)
 ESPRESSIONE DI UNA PROTEINA RICOMBINANTE IN CELLULE BATTERICHE Laboratorio di Bioinorganica (Responsabile attività: Prof. Angelo Bracalello, Tutor: Dr.ssa M. Antonietta Vaccaro) Grandi quantità di polipeptidi
ESPRESSIONE DI UNA PROTEINA RICOMBINANTE IN CELLULE BATTERICHE Laboratorio di Bioinorganica (Responsabile attività: Prof. Angelo Bracalello, Tutor: Dr.ssa M. Antonietta Vaccaro) Grandi quantità di polipeptidi
Elettroforesi. Migrazione di particelle cariche sotto l influenza di un campo elettrico
 Migrazione di particelle cariche sotto l influenza di un campo elettrico La velocità di una molecola carica che si muove in un campo elettrico è direttamente proporzionale alla forza del campo elettrico
Migrazione di particelle cariche sotto l influenza di un campo elettrico La velocità di una molecola carica che si muove in un campo elettrico è direttamente proporzionale alla forza del campo elettrico
PROTOCOLLI del Lab di BIOLOGIA MOLECOLARE
 PROTOCOLLI del Lab di BIOLOGIA MOLECOLARE a.a. 2013/2014 GIORNO 1: A) Rivitalizzione dei batteri precedentemente trasformati con il vettore plasmidico di interesse B) Induzione con IPTG dell'espressione
PROTOCOLLI del Lab di BIOLOGIA MOLECOLARE a.a. 2013/2014 GIORNO 1: A) Rivitalizzione dei batteri precedentemente trasformati con il vettore plasmidico di interesse B) Induzione con IPTG dell'espressione
Perche usare Gel di Poliacrilammide per separare le proteine?
 Perche usare Gel di Poliacrilammide per separare le proteine? I gel di poliacrilammide hanno una trama piu compatta I pori hanno dimensioni minori che nei gel di agarosio Le proteine sono molto piu piccole
Perche usare Gel di Poliacrilammide per separare le proteine? I gel di poliacrilammide hanno una trama piu compatta I pori hanno dimensioni minori che nei gel di agarosio Le proteine sono molto piu piccole
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2007/2008. Corso di: Laboratorio di Biologia II Chimica Biologica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2007/2008 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2007/2008 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
SDS-PAGE/Western blot
 SDS-PAGE/Western blot preparare 2 gels: 7.5% di acrilamide, SPACERS 1.5 mm. Uno verrà utilizzato per il trasferimento su nitrocellulosa, l altro colorato con il blu di coomassie. caricare i campioni dell
SDS-PAGE/Western blot preparare 2 gels: 7.5% di acrilamide, SPACERS 1.5 mm. Uno verrà utilizzato per il trasferimento su nitrocellulosa, l altro colorato con il blu di coomassie. caricare i campioni dell
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Corso STEM Il papilloma virus (Prof.ssa Gabriella Di Cola)
 Corso STEM Il papilloma virus (Prof.ssa Gabriella Di Cola) Il papilloma virus (HPV) interessa maggiormente le donne intorno ai 25 anni di età; esso intacca la zona genitale, in particolare le cellule dell
Corso STEM Il papilloma virus (Prof.ssa Gabriella Di Cola) Il papilloma virus (HPV) interessa maggiormente le donne intorno ai 25 anni di età; esso intacca la zona genitale, in particolare le cellule dell
ELETTROFORESI. Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico.
 ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
RACCOLTA E PROCESSAMENTO CAMPIONE URINE PER ANALISI OMICHE
 RACCOLTA E PROCESSAMENTO CAMPIONE URINE PER ANALISI OMICHE 00049 Autori Vittorio Sirolli Contenuti Abstract raccolta e processamento dei campioni urinari Abstract release 1 pubblicata il 20 luglio 2012
RACCOLTA E PROCESSAMENTO CAMPIONE URINE PER ANALISI OMICHE 00049 Autori Vittorio Sirolli Contenuti Abstract raccolta e processamento dei campioni urinari Abstract release 1 pubblicata il 20 luglio 2012
Rottura del tessuto. Omogeneizzazione e rottura delle cellule. Centrifugazione 600 x G per 10 a 4 C. Pellet. Lavaggio.
 OBIETTIVO Scopo di questo laboratorio è simulare l isolamento e la separazione di proteine da materiale biologico di partenza. Si parte da tessuto e si procede fino alla separazione della frazione mitocondriale.
OBIETTIVO Scopo di questo laboratorio è simulare l isolamento e la separazione di proteine da materiale biologico di partenza. Si parte da tessuto e si procede fino alla separazione della frazione mitocondriale.
Estrazione di acido salicilico con acetato di n-butile
 S.A.G.T. Anno Accademico 2009/2010 Laboratorio Ambientale II A Dottoressa Valentina Gianotti Marco Soda Matricola num. 10015062 Estrazione di acido salicilico con acetato di n-butile L estrazione liquido-liquido
S.A.G.T. Anno Accademico 2009/2010 Laboratorio Ambientale II A Dottoressa Valentina Gianotti Marco Soda Matricola num. 10015062 Estrazione di acido salicilico con acetato di n-butile L estrazione liquido-liquido
XVII ZOLFO. Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE. Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI
 XVII ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI XVII - ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE 1. Principio Il campione viene
XVII ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI XVII - ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE 1. Principio Il campione viene
VALUTAZIONE DELLA BIODIVERSITÀ MICROBICA MEDIANTE L UTILIZZO DI TECNICHE MOLECOLARI
 VALUTAZIONE DELLA BIODIVERSITÀ MICROBICA MEDIANTE L UTILIZZO DI TECNICHE MOLECOLARI Laboratorio di Genetica dei Microrganismi (Responsabile attività: Prof. Giovanni Salzano; Tutor: Dr.ssa Maria Grazia
VALUTAZIONE DELLA BIODIVERSITÀ MICROBICA MEDIANTE L UTILIZZO DI TECNICHE MOLECOLARI Laboratorio di Genetica dei Microrganismi (Responsabile attività: Prof. Giovanni Salzano; Tutor: Dr.ssa Maria Grazia
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
PROTOCOLLO RACCOLTA SANGUE PER ANALISI OMICHE
 PROTOCOLLO RACCOLTA SANGUE PER ANALISI OMICHE 00028 Autori Vittorio Sirolli Gianluigi Zaza Contenuti Premesse - Introduzione separazione del plasma Premesse - Introduzione separazione del plasma release
PROTOCOLLO RACCOLTA SANGUE PER ANALISI OMICHE 00028 Autori Vittorio Sirolli Gianluigi Zaza Contenuti Premesse - Introduzione separazione del plasma Premesse - Introduzione separazione del plasma release
Isolamento della caffeina dalle foglie di tè
 SOMMARIO Isolamento della caffeina dalle foglie di tè L esperienza consiste nell isolamento e determinazione della quantità di caffeina, solido bianco cristallino, dalle foglie di tè (Camellia sinensis).
SOMMARIO Isolamento della caffeina dalle foglie di tè L esperienza consiste nell isolamento e determinazione della quantità di caffeina, solido bianco cristallino, dalle foglie di tè (Camellia sinensis).
Analisi di proteine:
 Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
Tra nm Nucleotidi mono-fosfato
 Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
GENERALITA SULLA CROMATOGRAFIA
 GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
Metodologie di microbiologia e genetica
 Metodologie di microbiologia e genetica Modulo Metodologie di Genetica Prof.ssa Antonella Furini ESERCITAZIONE N 3 PREPARAZIONE DEL FRAMMENTO E DEL taglio con enzimi di restrizione 1. Taglio del plasmide
Metodologie di microbiologia e genetica Modulo Metodologie di Genetica Prof.ssa Antonella Furini ESERCITAZIONE N 3 PREPARAZIONE DEL FRAMMENTO E DEL taglio con enzimi di restrizione 1. Taglio del plasmide
Estrazione rapida di DNA plasmidico da Escherichia coli. (QIAscreen) ESERCITAZIONE DI LAB. N.1. Corso di INGEGNERIA GENETICA, Prof.
 Estrazione rapida di DNA plasmidico da Escherichia coli (QIAscreen) Corso di INGEGNERIA GENETICA, Prof. Renato Fani, ESERCITAZIONE DI LAB. N.1 PLASMIDI IN NUMEROSE SPECIE BATTERICHE SONO PRESENTI I PLASMIDI,
Estrazione rapida di DNA plasmidico da Escherichia coli (QIAscreen) Corso di INGEGNERIA GENETICA, Prof. Renato Fani, ESERCITAZIONE DI LAB. N.1 PLASMIDI IN NUMEROSE SPECIE BATTERICHE SONO PRESENTI I PLASMIDI,
TIPI di CROMATOGRAFIA
 Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
Elettroforesi degli acidi nucleici
 Elettroforesi degli acidi nucleici Una volta che i frammenti del DNA o del RNA da analizzare sono stati amplificati con la reazione PCR è necessario separarli ed identificarli. A tale scopo si utilizza
Elettroforesi degli acidi nucleici Una volta che i frammenti del DNA o del RNA da analizzare sono stati amplificati con la reazione PCR è necessario separarli ed identificarli. A tale scopo si utilizza
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
Tecniche elettroforetiche. Applicazione: Proteolisi limitata
 Tecniche elettroforetiche Applicazione: Proteolisi limitata PRINCIPI GENERALI Elettroforesi: Migrazione di particelle cariche sotto l azione di un campo elettrico Il campo elettrico è generato applicando
Tecniche elettroforetiche Applicazione: Proteolisi limitata PRINCIPI GENERALI Elettroforesi: Migrazione di particelle cariche sotto l azione di un campo elettrico Il campo elettrico è generato applicando
INGEZIM Gluten Quanti Test Guida all utilizzo
 INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
Allegato 4.1. Analisi della frazione gluteninica (Glutenine ad alto peso molecolare APM)
 Allegato 4.1 PROTOCOLLO TECNICO PER LA CARATTERIZZAZIONE DELLE VARIETÀ DI FRUMENTO TENERO, FRUMENTO DURO, SPELTA, FARRO DICOCCO E FARRO PICCOLO MEDIANTE ELETTROFORESI DELLE PROTEINE DI RISERVA DEL SEME.
Allegato 4.1 PROTOCOLLO TECNICO PER LA CARATTERIZZAZIONE DELLE VARIETÀ DI FRUMENTO TENERO, FRUMENTO DURO, SPELTA, FARRO DICOCCO E FARRO PICCOLO MEDIANTE ELETTROFORESI DELLE PROTEINE DI RISERVA DEL SEME.
ELETTROFORESI. Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico.
 ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
Tecniche Centrifugative
 Tecniche Centrifugative Metodologie Biochimiche 29 Novembre 2015 Il materiale contenuto in queste diapositive è ad esclusivo uso didattico per l università di Teramo Centrifugazione Permette la separazione
Tecniche Centrifugative Metodologie Biochimiche 29 Novembre 2015 Il materiale contenuto in queste diapositive è ad esclusivo uso didattico per l università di Teramo Centrifugazione Permette la separazione
LARS BIOTEC Laboratorio di Ricerca sperimentale nel settore delle Biotecnologie
 LARS BIOTEC Laboratorio di Ricerca sperimentale nel settore delle Biotecnologie! Indice 1. Introduzione 2. Bioinformatica 3. SDS Page: Elettroforesi 4. Soluzione, diluizioni e Biureto 5. Analisi utilizzo
LARS BIOTEC Laboratorio di Ricerca sperimentale nel settore delle Biotecnologie! Indice 1. Introduzione 2. Bioinformatica 3. SDS Page: Elettroforesi 4. Soluzione, diluizioni e Biureto 5. Analisi utilizzo
LUMINESCENZA. semiconduttore
 LUMINESCENZA LUMINESCENZA Elettroluminescenza Radioluminescenza Chemiluminescenza Bioluminescenza Termoluminescenza Triboluminescenza Sonoluminescenza Fotoluminescenza corrente elettrica in gas ionizzato
LUMINESCENZA LUMINESCENZA Elettroluminescenza Radioluminescenza Chemiluminescenza Bioluminescenza Termoluminescenza Triboluminescenza Sonoluminescenza Fotoluminescenza corrente elettrica in gas ionizzato
2. LA PURIFICAZIONE DI PROTEINE:
 2. LA PURIFICAZIONE DI PROTEINE: LA CROMATOGRAFIA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) LA PURIFICAZIONE DI PROTEINE Purificare
2. LA PURIFICAZIONE DI PROTEINE: LA CROMATOGRAFIA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) LA PURIFICAZIONE DI PROTEINE Purificare
FLUIDO MAGNETICO Sintesi del Ferrofluido
 Università degli Studi di Genova Dipartimento di chimica e chimica industriale Progetto Lauree Scientifiche Laboratori Regionali 2009-2010 Scienza dei Materiali FLUIDO MAGNETICO Sintesi del Ferrofluido
Università degli Studi di Genova Dipartimento di chimica e chimica industriale Progetto Lauree Scientifiche Laboratori Regionali 2009-2010 Scienza dei Materiali FLUIDO MAGNETICO Sintesi del Ferrofluido
Estrazione di pigmenti vegetali da sostanze naturali
 Estrazione di pigmenti vegetali da sostanze naturali Il cavolo rosso deve il suo colore agli antociani o antocianine, che sono una classe di pigmenti idrosolubili appartenente alla famiglia dei flavonoidi.
Estrazione di pigmenti vegetali da sostanze naturali Il cavolo rosso deve il suo colore agli antociani o antocianine, che sono una classe di pigmenti idrosolubili appartenente alla famiglia dei flavonoidi.
DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO
 DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO OBIETTIVO: determinare i grammi di acido acetico presenti in 1 litro di aceto comune (concentrazione in g/l). Approccio al problema:
DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO OBIETTIVO: determinare i grammi di acido acetico presenti in 1 litro di aceto comune (concentrazione in g/l). Approccio al problema:
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
DETERMINAZIONE DEL CONTENUTO IN CAFFEINA
 DETERMINAZIONE DEL CONTENUTO IN CAFFEINA (PER VIA SPETTROFOTOMETRICA ATTRAVERSO LA COSTRUZIONE DELLA RETTA DI TARATURA). O CH 3 H 3 C 1 6 N N 7 5 2 8 O N N 3 4 9 CH 3 Caffeina (1,3,7-trimetil-3,7-diidro-1H-purin-2,6-dione)
DETERMINAZIONE DEL CONTENUTO IN CAFFEINA (PER VIA SPETTROFOTOMETRICA ATTRAVERSO LA COSTRUZIONE DELLA RETTA DI TARATURA). O CH 3 H 3 C 1 6 N N 7 5 2 8 O N N 3 4 9 CH 3 Caffeina (1,3,7-trimetil-3,7-diidro-1H-purin-2,6-dione)
A) Preparazione di una soluzione di NaOH 0.05 M
 UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2016/17 Laurea triennale in Preparazione e standardizzazione di una soluzione di Esercitazione n 2 NaOH 0.05 M. Determinazione della concentrazione di
UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2016/17 Laurea triennale in Preparazione e standardizzazione di una soluzione di Esercitazione n 2 NaOH 0.05 M. Determinazione della concentrazione di
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
 ACIDITA su burro, margarine, panna e grassi semilavorati PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA PREPARAZIONE DEL CAMPIONE CONDIZIONI DI REAZIONE (Edit) Gli acidi grassi del campione, in
ACIDITA su burro, margarine, panna e grassi semilavorati PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA PREPARAZIONE DEL CAMPIONE CONDIZIONI DI REAZIONE (Edit) Gli acidi grassi del campione, in
Sviluppo di un sistema di acquisizione ed analisi di immagini digitali per gel elettroforesi
 Sviluppo di un sistema di acquisizione ed analisi di immagini digitali per gel elettroforesi Nicola Franchini Relatore Prof. Claudio Rivetti INTRODUZIONE Tra le tecniche utilizzate nei laboratori di biologia
Sviluppo di un sistema di acquisizione ed analisi di immagini digitali per gel elettroforesi Nicola Franchini Relatore Prof. Claudio Rivetti INTRODUZIONE Tra le tecniche utilizzate nei laboratori di biologia
Esercitazioni di Chimica Biologica AA PURIFICAZIONE DI UNA PROTEINA DI FUSIONE GST-CATECOLO 1,2 DIOSSIGENASI
 Esercitazioni di Chimica Biologica AA 2005-06 PURIFICAZIONE DI UNA PROTEINA DI FUSIONE GST-CATECOLO 1,2 DIOSSIGENASI Viene utilizzato il pellet cellulare congelato ottenuto dalla crescita di cellule di
Esercitazioni di Chimica Biologica AA 2005-06 PURIFICAZIONE DI UNA PROTEINA DI FUSIONE GST-CATECOLO 1,2 DIOSSIGENASI Viene utilizzato il pellet cellulare congelato ottenuto dalla crescita di cellule di
A) Determinazione gravimetrica di manganese(ii) e di zinco(ii)
 UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Determinazione della percentuale di manganese(ii) e Esercitazione n 15
UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Determinazione della percentuale di manganese(ii) e Esercitazione n 15
CORSO DI LAUREA IN SCIENZE DELLA FORMAZIONE PRIMARIA LEZIONE SECONDA PARTE. Dott.ssa A. Fiarè
 CORSO DI LAUREA IN SCIENZE DELLA FORMAZIONE PRIMARIA LEZIONE SECONDA PARTE Dott.ssa A. Fiarè CELLULA VEGETALE FASE PRELIMINARE: ETICHETTARE IL MATERIALE I FASE: PREPARAZIONE DELLA SOLUZIONE DI ESTRAZIONE
CORSO DI LAUREA IN SCIENZE DELLA FORMAZIONE PRIMARIA LEZIONE SECONDA PARTE Dott.ssa A. Fiarè CELLULA VEGETALE FASE PRELIMINARE: ETICHETTARE IL MATERIALE I FASE: PREPARAZIONE DELLA SOLUZIONE DI ESTRAZIONE
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA ] / [H 2 PO 4- ] HPO 4
![ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA ] / [H 2 PO 4- ] HPO 4 ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA ] / [H 2 PO 4- ] HPO 4](/thumbs/55/35880910.jpg) ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA Si titola con NaOH. H 3 PO 4 H + + H 2 PO 4 - K a1 = 1.1 x 10-2 = [H + ] [H 2 PO 4- ] / [H 3 PO 4 ] H 2 PO 4- H + + HPO 4 2- K a2 = 7.5
ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA Si titola con NaOH. H 3 PO 4 H + + H 2 PO 4 - K a1 = 1.1 x 10-2 = [H + ] [H 2 PO 4- ] / [H 3 PO 4 ] H 2 PO 4- H + + HPO 4 2- K a2 = 7.5
Quantizzazione del DNA con spettrofotometro
 Quantizzazione del DNA ed elettroforesi 1 Quantizzazione del DNA con spettrofotometro Al termine della metodica di estrazione, occorre quantificare il DNA isolato. Un metodo per quantificare in modo preciso
Quantizzazione del DNA ed elettroforesi 1 Quantizzazione del DNA con spettrofotometro Al termine della metodica di estrazione, occorre quantificare il DNA isolato. Un metodo per quantificare in modo preciso
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Traduzione integrale ( non ufficiale) del metodo L35 LMBG Gennaio 1995 L (include l errata corrige del dicembre 2002)
 Traduzione integrale ( non ufficiale) del metodo L35 LMBG Gennaio 1995 L 00.00-6 (include l errata corrige del dicembre 2002) Ricerche su Alimenti ( L35LMBG ) Determinazione di Ammine Aromatiche Primarie
Traduzione integrale ( non ufficiale) del metodo L35 LMBG Gennaio 1995 L 00.00-6 (include l errata corrige del dicembre 2002) Ricerche su Alimenti ( L35LMBG ) Determinazione di Ammine Aromatiche Primarie
Biochimica delle proteine Prof. M. Bolognesi a.a. 2006/2007. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2006/2007 Eloise Mastrangelo Elettroforesi monodimensionale SDS-PAGE: Sodio DodecilSolfato-PoliAcrilammide Gel Elettroforesi L`elettroforesi su gel di
Biochimica delle proteine Prof. M. Bolognesi a.a. 2006/2007 Eloise Mastrangelo Elettroforesi monodimensionale SDS-PAGE: Sodio DodecilSolfato-PoliAcrilammide Gel Elettroforesi L`elettroforesi su gel di
Materiale occorrente: una bilancia tecnica; due matracci da 250 ml; una pipetta tarata con propipetta.
 Materiale occorrente: una bilancia tecnica; due matracci da 250 ml; una pipetta tarata con propipetta. Reattivi: acido acetico; acetato di sodio; idrossido di ammonio e cloruro di ammonio; acqua distillata.
Materiale occorrente: una bilancia tecnica; due matracci da 250 ml; una pipetta tarata con propipetta. Reattivi: acido acetico; acetato di sodio; idrossido di ammonio e cloruro di ammonio; acqua distillata.
Determinazione dell azoto totale e ammoniacale in spettrofotometria: modalità di calibrazione e confrontabilità nel tempo
 UNIVERSITÀ DEGLI STUDI DI PAVIA CORSO DI LAUREA INTERFACOLTÀ IN BIOTECNOLOGIE Determinazione dell azoto totale e ammoniacale in spettrofotometria: modalità di calibrazione e confrontabilità nel tempo Relatore:
UNIVERSITÀ DEGLI STUDI DI PAVIA CORSO DI LAUREA INTERFACOLTÀ IN BIOTECNOLOGIE Determinazione dell azoto totale e ammoniacale in spettrofotometria: modalità di calibrazione e confrontabilità nel tempo Relatore:
Metodo VII.1. Determinazione dello ione cloro in assenza di sostanza organica
 METODI VII METODI DI DETERMINAZIONE DEL CLORO Metodo VII.1 Determinazione dello ione cloro in assenza di sostanza organica 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare
METODI VII METODI DI DETERMINAZIONE DEL CLORO Metodo VII.1 Determinazione dello ione cloro in assenza di sostanza organica 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare
ISTRUZIONI COLONNE IMMUNOAFFINITA PER AFLATOSSINE (WIDE) NEOCOLUMN FOR AFLATOXIN (COD 8043) (rev. 05/08)
 ISTRUZIONI COLONNE IMMUNOAFFINITA PER AFLATOSSINE (WIDE) NEOCOLUMN FOR AFLATOXIN (COD 8043) (rev. 05/08) Materiali forniti: 50 colonne d immunoaffinità 1 adattatore per siringa libretto istruzioni Materiali
ISTRUZIONI COLONNE IMMUNOAFFINITA PER AFLATOSSINE (WIDE) NEOCOLUMN FOR AFLATOXIN (COD 8043) (rev. 05/08) Materiali forniti: 50 colonne d immunoaffinità 1 adattatore per siringa libretto istruzioni Materiali
METODICHE DI IMMUNOCHIMICA
 METODICHE DI IMMUNOCHIMICA IMMUNOCHIMICA permette la determinazione quantitativa di proteine in tessuti e omogenati INTERAZIONI ANTIGENE-ANTICORPO L immunochimica si basa sulle interazioni antigene-anticorpo
METODICHE DI IMMUNOCHIMICA IMMUNOCHIMICA permette la determinazione quantitativa di proteine in tessuti e omogenati INTERAZIONI ANTIGENE-ANTICORPO L immunochimica si basa sulle interazioni antigene-anticorpo
Estrazione con solvente 18/01/2010. Laboratorio di chimica. Prof. Aurelio Trevisi
 Laboratorio di chimica Prof. Aurelio Trevisi Estrazione con solvente SCOPO: Estrarre mediante cicloesano lo iodio da una soluzione idroalcolica L estrazione con solventi si basa sulla diversa affinità
Laboratorio di chimica Prof. Aurelio Trevisi Estrazione con solvente SCOPO: Estrarre mediante cicloesano lo iodio da una soluzione idroalcolica L estrazione con solventi si basa sulla diversa affinità
Molti ceramici sono sempre più utilizzati nel settore dell elettrotecnica e dell elettronica. La conducibilità di tipo elettronica o ionica può
 Molti ceramici sono sempre più utilizzati nel settore dell elettrotecnica e dell elettronica. La conducibilità di tipo elettronica o ionica può essere molto variabile a seconda della composizione: si passa
Molti ceramici sono sempre più utilizzati nel settore dell elettrotecnica e dell elettronica. La conducibilità di tipo elettronica o ionica può essere molto variabile a seconda della composizione: si passa
IL BINDING RECETTORIALE VIENE EFFETTUATO ATTRAVERSO L UTILIZZO DI LIGANDI SELETTIVI MARCATI CON UN RADIOISOTOPO E CI PERMETTE:
 IL BINDING RECETTORIALE VIENE EFFETTUATO ATTRAVERSO L UTILIZZO DI LIGANDI SELETTIVI MARCATI CON UN RADIOISOTOPO E CI PERMETTE: Ø VALUTAZIONE DELLA PRESENZA DI SITI DI RICONOSCIMENTO SPECIFICI PER UN LIGANDO
IL BINDING RECETTORIALE VIENE EFFETTUATO ATTRAVERSO L UTILIZZO DI LIGANDI SELETTIVI MARCATI CON UN RADIOISOTOPO E CI PERMETTE: Ø VALUTAZIONE DELLA PRESENZA DI SITI DI RICONOSCIMENTO SPECIFICI PER UN LIGANDO
L'attività di queste proteine, a sua volta è modulata dalla composizione dei fosfolipidi della membrana
 La funzione di ogni membrana biologica è determinata principalmente dall insieme di proteine integrali incorporate e dalle proteine periferiche collegate alla superficie della membrana L'attività di queste
La funzione di ogni membrana biologica è determinata principalmente dall insieme di proteine integrali incorporate e dalle proteine periferiche collegate alla superficie della membrana L'attività di queste
EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni
 IT Istruzioni d uso EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni REF 7059 1. Descrizione del prodotto EXTRA-GENE è un kit per l estrazione veloce del DNA genomico senza l utilizzo di
IT Istruzioni d uso EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni REF 7059 1. Descrizione del prodotto EXTRA-GENE è un kit per l estrazione veloce del DNA genomico senza l utilizzo di
Spettroscopia nell ultravioletto e nel visibile
 Spettroscopia nell ultravioletto e nel visibile Sono le regioni dello spettro elettromagnetico maggiormente utilizzate nelle ricerche in campo biomedico Le radiazioni elettromagnetiche e lo spettro Una
Spettroscopia nell ultravioletto e nel visibile Sono le regioni dello spettro elettromagnetico maggiormente utilizzate nelle ricerche in campo biomedico Le radiazioni elettromagnetiche e lo spettro Una
Laurea Magistrale in Biologia
 Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Laboratorio di Genetica Molecolare: Prof. Davide Bizzaro, Prof. Anna La Teana
 Laboratorio di Genetica Molecolare: Prof. Davide Bizzaro, Prof. Anna La Teana Determinazione del polimorfismo del gene TAS2R38 coinvolto nella percezione dell amaro. I mammiferi riconoscono soltanto 5
Laboratorio di Genetica Molecolare: Prof. Davide Bizzaro, Prof. Anna La Teana Determinazione del polimorfismo del gene TAS2R38 coinvolto nella percezione dell amaro. I mammiferi riconoscono soltanto 5
Tecniche elettroforetiche
 Tecniche elettroforetiche L'elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. Molte molecole di interesse biologico, come
Tecniche elettroforetiche L'elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. Molte molecole di interesse biologico, come
Corning 50 ml Centrifuge Tubes 500 pz
 Q.TA'/ANNO Corning 15 ml Centrifuge Tubes 500 pz Corning 50 ml Centrifuge Tubes 500 pz Costar 5mL Stripette Serological Pipets, Polystyrene, Individually Paper/Plastic Wrapped, 200/Case (Product #4487)
Q.TA'/ANNO Corning 15 ml Centrifuge Tubes 500 pz Corning 50 ml Centrifuge Tubes 500 pz Costar 5mL Stripette Serological Pipets, Polystyrene, Individually Paper/Plastic Wrapped, 200/Case (Product #4487)
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
- determinazione colorimetrica della concentrazione di una miscela proteica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2013/2014 Laboratorio di Chimica Biologica - Cromatografia a scambio ionico - determinazione colorimetrica della concentrazione di una miscela
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2013/2014 Laboratorio di Chimica Biologica - Cromatografia a scambio ionico - determinazione colorimetrica della concentrazione di una miscela
1. Cromatografia per gel-filtrazione
 1. Cromatografia per gel-filtrazione La gel filtrazione è un metodo cromatografico che separa le sostanze in base alle loro dimensioni molecolari. I materiali che costituiscono il supporto per la gel-filtrazione
1. Cromatografia per gel-filtrazione La gel filtrazione è un metodo cromatografico che separa le sostanze in base alle loro dimensioni molecolari. I materiali che costituiscono il supporto per la gel-filtrazione
IN QUESTA PROVA ANDREMO A DETERMINARE L ACIDITA DI UN CAMPIONE DI LATTE MEDIANTE UNA TITOLAZIONE ACIDO-BASE
 IN QUESTA PROVA ANDREMO A DETERMINARE L ACIDITA DI UN CAMPIONE DI LATTE MEDIANTE UNA TITOLAZIONE ACIDO-BASE Prima di passare però al procedimento vero e proprio è necessario fornire alcune definizioni
IN QUESTA PROVA ANDREMO A DETERMINARE L ACIDITA DI UN CAMPIONE DI LATTE MEDIANTE UNA TITOLAZIONE ACIDO-BASE Prima di passare però al procedimento vero e proprio è necessario fornire alcune definizioni
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Analisi omiche su sangue e urine
 Analisi omiche su sangue e urine 00051 Autori Vittorio Sirolli Massimo Papale (redattore) Gianluigi Zaza (redattore) Francesco Trepiccione (collaboratore) Contenuti 1. Abstract 2. Sangue Separazione Plasma
Analisi omiche su sangue e urine 00051 Autori Vittorio Sirolli Massimo Papale (redattore) Gianluigi Zaza (redattore) Francesco Trepiccione (collaboratore) Contenuti 1. Abstract 2. Sangue Separazione Plasma
Buone regole. -nel dubbio, chiedere! LEGGERE BENE IL PROTOCOLLO PRIMA DI INIZIARE
 Precauzioni da adottare in laboratorio: -non mangiare nè bere -indossare il camice -indossare sempre i guanti quando si maneggiano i tubini, i gel, le micropipette -nel dubbio, chiedere! Buone regole LEGGERE
Precauzioni da adottare in laboratorio: -non mangiare nè bere -indossare il camice -indossare sempre i guanti quando si maneggiano i tubini, i gel, le micropipette -nel dubbio, chiedere! Buone regole LEGGERE
MANUALE DELLA SICUREZZA NEI LABORATORI DI BIOCHIMICA LINEE GUIDA PER GLI UTENTI - NORME GENERALI
 MANUALE DELLA SICUREZZA NEI LABORATORI DI BIOCHIMICA LINEE GUIDA PER GLI UTENTI - NORME GENERALI 1) Non mangiare, non bere, non fumare in laboratorio 2) tenere il posto di lavoro sempre pulito e sgombro
MANUALE DELLA SICUREZZA NEI LABORATORI DI BIOCHIMICA LINEE GUIDA PER GLI UTENTI - NORME GENERALI 1) Non mangiare, non bere, non fumare in laboratorio 2) tenere il posto di lavoro sempre pulito e sgombro
Estrazione del DNA. A)Resine (Chelex 100) B) Solven: organici. C) Sali (sal:ng out)
 Estrazione del DNA A)Resine (Chelex 100) B) Solven: organici C) Sali (sal:ng out) La Chelex 100 è una resina cara4erizzata da biglie a carica nega:va (ioni imminoaceta: contenu: nei copolimeri di s:rene
Estrazione del DNA A)Resine (Chelex 100) B) Solven: organici C) Sali (sal:ng out) La Chelex 100 è una resina cara4erizzata da biglie a carica nega:va (ioni imminoaceta: contenu: nei copolimeri di s:rene
COS E LA PROTEOMICA? The total PROTEIN complement of a GENOME Proteoma proteine codificate modificazioni post-traduzionali
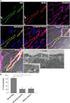 COS E LA PROTEOMICA? The total PROTEIN complement of a GENOME (M. Wilkins et al. Electrophoresis 1995,16 1090-95) La Proteomica è lo studio del PROTEOMA Ud'A [Biochimica Applicata 1] dia n. 1 Proteoma
COS E LA PROTEOMICA? The total PROTEIN complement of a GENOME (M. Wilkins et al. Electrophoresis 1995,16 1090-95) La Proteomica è lo studio del PROTEOMA Ud'A [Biochimica Applicata 1] dia n. 1 Proteoma
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Corso di insegnamento di Biochimica e Biotecnologie degli Alimenti. Tecniche elettroforetiche. Lezione n. XXIV-04.06.14
 Corso di insegnamento di Biochimica e Biotecnologie degli Alimenti Tecniche elettroforetiche Lezione n. XXIV-04.06.14 L ELETTROFORESI E la separazione di molecole cariche in soluzione Principio Si basa
Corso di insegnamento di Biochimica e Biotecnologie degli Alimenti Tecniche elettroforetiche Lezione n. XXIV-04.06.14 L ELETTROFORESI E la separazione di molecole cariche in soluzione Principio Si basa
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
BENZILPENICILLINA BENZATINICA PREPARAZIONE INIETTABILI. Benzilpenicillina Benzatinica polvere sterile per preparazioni iniettabili
 1 1 1 1 1 1 1 1 0 1 0 1 0 1 1 01/FU Maggio 00 Commenti entro il 0 Settembre 00 NOTA: Corretta in seguito ai commenti della Dott.ssa Mozzetti La monografia è stata revisionata per armonizzarla con le altre
1 1 1 1 1 1 1 1 0 1 0 1 0 1 1 01/FU Maggio 00 Commenti entro il 0 Settembre 00 NOTA: Corretta in seguito ai commenti della Dott.ssa Mozzetti La monografia è stata revisionata per armonizzarla con le altre
