Le proteine. Sintetizzate nei ribosomi come una sequenza lineare di amminoacidi assumono in seguito una struttura tridimensionale
|
|
|
- Bernarda Baroni
- 7 anni fa
- Visualizzazioni
Transcript
1 Le proteine Elementi funzionali e strutturali di fondamentale importanza per lo svolgimento di funzioni metaboliche, di trasporto, di trasmissione nervosa o contrattile, ormonale o immunitaria Sintetizzate nei ribosomi come una sequenza lineare di amminoacidi assumono in seguito una struttura tridimensionale Tutte sono costituite dallo stesso gruppo di 20 amminoacidi uniti in sequenze lineari diverse
2 AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche basiche; quindi gli amminoacidi sono in definitiva degli anfoliti. In natura, tutti gli amminoacidi sono a-amminoacidi, cioè il gruppo amminico è sempre legato al carbonio a (il carbonio a è il carbonio che viene dopo il gruppo carbossilico). R Struttura generale di un a-amminoacido : NH 2 C a COOH H Gli amminoacidi si distinguono in base alla diversità della catena laterale R in ciascuno di essi. Gli aminoacidi (AA) presenti nella cellula possono essere il prodotto di idrolisi delle proteine (aaa proteici o standard e aaa rari o non standard) o di peptidi o metaboliti liberi (AA non proteici). Gli a-amminoacidi hanno proprietà strutturali comuni
3
4 A ph neutro gli amminoacidi sono prevalentemente in forma dipolare (anfoioni) : gruppo amminico protonato (-NH 3+ ) e gruppo carbossilico deprotonato (-COO - ).
5 Amminoacidi proteici
6
7
8 Catene laterali non polari Formano interazioni idrofobiche Alanina Valina Leucina Isoleicina Glicina Metionina Prolina
9 Catene laterali aromatiche Sono relativamente non polari. Interazioni idrofobiche; Fenilalanina Tirosina Triptofano
10 Catene laterali polari non cariche I gruppi R sono molto più solubili in acqua rispetto a quelli degli aa non polari. I gruppi funzionali formano legami idrogeno con l acqua. Serina Treonina Cisteina Asparagina Glutamina
11 Catene laterali cariche positivamente (basiche) La catena laterale ha carica netta positiva a ph=7 Lisina Arginina Istidina
12 Catene laterali cariche negativamente La catena laterale ha carica netta negativa a ph=7 Si ottengono per idrolisi acida o basica dalle ammidi asparagina e glutammina Aspartato Glutammato
13 I gruppi SH idrofilici della cisteina formano un ponte disolfuro (non idrofilico), per formare la cistina (non polare). La cistina si forma secondariamente per ossidazione di due residui di cisteina (cistina=aa postsintetico).
14 La prolina è in realtà un imminoacido, contiene il gruppo imminico: -NH- (che è parte della struttura dell anello eterociclico pirrolidinico). Fase postsintetica delle proteine: i residui di alcuni aa possono essere modificati generando nuovi aa detti postsintetici o derivati (es.: cistina, idrossiprolina, idrossilisina, ac. Carbossiglutammico, fosfoserina, fosfotreonina, trimetillisina).
15 Amminoacidi non proteici Esistono aa che non si riscontrano nelle proteine: aa non proteici. Ornitina Citrullina
16
17 Gli amminoacidi possono agire da acidi o basi deboli. Gli amminoacidi che non possiedono un gruppo R ionizzabile, in soluzione a ph neutro esistono sotto forma di ioni dipolari detti zwitterioni (elettricamente neutro). I composti che hanno questa natura sono detti anfoterici
18 L amminoacido zwitterione può comportarsi come acido (cedere protoni) o come base (accettare protoni)
19 Punto isoelettrico (pi): valore di ph in corrispondenza del quale l aa si trova in forma dipolare (anfoione) Quando cioè la carica negativa del gruppo carbossilico e la carica positiva del gruppo amminico si equivalgono e la carica netta è pari a zero
20 Altre classificazioni di amminoacidi AA acidi: glutammato e aspartato: AA monoamminodicarbossilici AA basici: arginina e lisina: AA diamminomonocarbossilici istidina (anello imidazolico) AA solforati: AA aromatici: cisteina e metionina fenilalanina, triptofano e tirosina
21 GLUTAMMATO MONOSODICO *(MSG) casa * aumenta il sapore dei cibi dadi ristorante GLUTAMMATO Amminoacido proteine Neurotrasmettitore (versatilità delle biomolecole, principio d i economia) Idrolizzati proteici vegetali (dadi) > 40% di MSG Sindrome da ristorante cinese (eccessivo uso di MGS) dai capogiri al mal di testa all affaticamento 2% popolazione umana Esempio di amminoacido estremamente sensibile evitare : questo condimento funghi piselli altri vegetali ricchi in MSG utile all organismo dannoso in quantità eccessiva
22
23 STEREOISOMERIA NEGLI AMMINOACIDI Ad esclusione dell amminoacido GLICINA, che presenta come catena laterale R solo un atomo di idrogeno : H NH 2 C a COOH H tutti gli altri amminoacidi presentano, legati al carbonio in a, 4 sostituenti diversi e il carbonio in a è quindi un carbonio chirale (carbonio asimmetrico), Poichè la disposizione degli orbitali di legame intorno al Ca è tetraedrico i 4 gruppi sostituenti possono disporsi nello spazio in 2 modi diversi e quindi gli AA presentano 2 possibili stereoisomeri. Questi stereoisomeri sono immagini speculari non sovrapponibili = enantiomeri Secondo la proiezione di Fisher possiamo distinguere una serie sterica D e una serie sterica L. COOH COOH H C NH 2 NH 2 C H R R FORMA D FORMA L Tutti gli amminoacidi incorporati dagli organismi nelle proteine sono nella forma L.
24
25
26 SPETTRI DI ASSORBIMENTO DEGLI AMMINOACIDI Gli amminoacidi non assorbono nel visibile Tutti gli amminoacidi assorbono nell estremo U.V. < 220 nm a causa del doppio legame del gruppo COOH Tre amminoacidi assorbono nell U.V. intorno a 280 nm; Trp BANDA DEL TRIPTOFANO Tyr Phe Queste caratteristiche si riflettono nelle proteine che possono essere dosate attraverso lettura spettrofotometrica a 280 nm.
27 (A) LEGGE DI LAMBERT BEER Legge valida solo ad A = A max A λ max = ε c l l = percorso ottico ε = coefficiente di estinzione molare c = concentrazione sostanza in esame A = log I 0 / I t I 0 = intensità luce incidente nell U.V. (A max ) I = intensità luce t trasmessa da: Nelson & Cox
28
29
30 L unico Aminoacido che può funzionare da tampone è l istidina
31 Un semplice amminoacido mono amino-monocarbossilico, come la GLICINA, è di fatto un acido diprotico quando è completamente protonato, in questa forma ha, cioè, due gruppi che possono ionizzarsi per dare protoni. La CURVA DI TITOLAZIONE DELLA GLICINA presenta due distinti stadi, corrispondenti ciascuno alla rimozione di un protone. all inizio della titolazione la Glicina è nella forma completamente protonata al punto di flesso della I a sigmoide sono presenti quantità equimolecolari di COO - e COOH; questo ph è il pk del gruppo che viene titolato. (pk 1 = 2.34) a ph = 5.97 è completa la titolazione del primo gruppo e si inizia a rimuovere il secondo protone. La forma prevalente è NH 3 -CHR-COO - al punto di flesso della II a parte si avrà quantità equimolecolare di NH 3+ e NH 2. Questo ph è il pk del gruppo NH 3+ (pk 2 = 9.60) la titolazione è completa quando la forma predominante diventerà NH 2 -CHR-COO - (completamente deprotonata) da: Nelson & Cox
32 da: Nelson & Cox
33 da: Nelson & Cox
34 La curva di titolazione predice la carica elettrica degli AA A ph = 5.97 la forma prevalente è lo ZWITTERIONE (cioè senza carica netta). Questo ph è detto PUNTO ISOELETTRICO (pi) ed è dato dalla media aritmetica dei due valori di pk (nel caso di amminoacidi privi di gruppi R dissociabili). Es. Glicina pi = / 2 = 5.97 pi = pk 1 + pk 2 2 a ph = pi di un amminoacido 1. carica netta = 0 2. non si muove in un campo elettrico 3. presenta la minima solubilità a ph > pi la carica netta della Glicina sarà -, pertanto si muoverà verso il polo + a ph < pi la carica netta della Glicina sarà +, pertanto si muoverà verso il polo a ph = 1 la Glicina sarà completamente protonata con carica netta + = 1 a ph = 2.34 dove [NH 3 + -CHR-COOH] = [NH 3 + -CHR-COO - ], la Glicina avrà carica netta + = 0.5 così per tutti i valori di ph si può calcolare la frazione di carica netta posseduta dall amminoacido. Importante per la separazione elettroforetica.
35 VALORI DI pk A DI ALCUNI AMMINOACIDI E LORO pi AMMINOACIDI PK 1 -COOH PK 2 -NH 3 PK R PI Glicina Alanina Leucina Serina Treonina Glutamina a. aspartico a. glutammico Istidina Cisteina Tirosina Lisina Arginina nessun amminoacido mono amino mono carbossilico ha capacità tamponante nelle zone di ph fisiologico (7.4) da 6.0 a 8.0 tranne l ISTIDINA il cui pk R è = 6. E un amminoacido raro ma molto importante (per es. in Hb e nel sito attivo degli enzimi) il pi degli amminoacidi acidi è uguale a pk 1 + pk R 2 il pi degli amminoacidi basici è uguale a pk 2 + pk R 2
36 GENERALITA sulle proprietà acido-basiche degli AA il pi degli amminoacidi neutri non è esattamente 7 (come ci si aspetterebbe se COOH e NH 2 avessero la stessa forza), ma COOH come acido è un pò più forte di NH 2 come base il gruppo α COOH è un acido più forte di altri gruppi carbossilici (es. acido acetico ha il pk = 4.76). Ciò è dovuto alla repulsione che si instaura tra i protoni che vengono liberati e la carica positiva del gruppo α aminico (con le sue cariche + stabilizza la carica del COO - dissociato) il pka del gruppo aminico della Glicina viene modificato verso il basso rispetto ai valori medi di un gruppo aminico primario: ciò è dovuto alla forza di attrazione degli atomi elettronegativi dell ossigeno del -COOH, aumentando contemporaneamente la tendenza del gruppo NH 3 a cedere un H + tutti gli amminoacidi mono amino mono carbossilici con gruppi R privi di carica hanno valori di pk 1 quasi uguali ( ) così per i valori di pk 2 (8.8-11). Le curve di titolazione sono simili a quelle della Glicina il gruppo - carbossilico dall a. aspartico e il - carbossilico dell a. glutammico sebbene completamente ionizzati a ph 7 hanno valori di pk molto più alti dei gruppi α COOH, cioè molto più simili a quelli degli acidi carbossilici semplici come a. acetico il gruppo SH delle cisteine e il gruppo OH della tirosina sono debolissimi acidi. A ph 7 SH è ionizzato all 8%, mentre l -OH è ionizzato all 0.01% Queste considerazioni sono importanti per spiegare, per esempio, il meccanismo di catalisi nel sito attivo degli enzimi.
37 Metodi per l analisi qualitativa e quantitativa degli AA 1. SEPARAZIONE e ANALISI QUALITATIVA degli AA Tecniche basate sulle proprietà di adsorbimento e miscibilità (o ripartizione) 1. cromatografia su carta 2. su strato sottile (TLC) 3. liquida ad alta pressione (HPLC) Principi in base ai quali operano le suddette tecniche: 1. principio di ripartizione 2. di ripartizione o di adsorbimento 3. di ripartizione o di adsorbimento (sc. ionico) Tecniche basate sulle proprietà di carica 1. elettroforesi su carta 2. cromatografia a scambio ionico 2. ANALISI QUANTITATIVA Analisi spettrofotometrica per tirosina, triptofano fenilalanina 1. colorimetrica (ninidrina fino a 1 mmole) 2. fluorimetrica (fluorescamina fino a 1 pmoli) (cloruro di dansile fino a 1 pmoli)
38 Analisi degli amminoacidi Reazione con la ninidrina per l analisi quantitativa colorimetrica degli amminoacidi La reazione con la ninidrina distrugge la molecola degli amminoacidi. Il composto colorato si sviluppa dopo esposizione degli amminoacidi a 100 C. La prolina, che è un imminoacido dà un composto giallo ( max = 440 nm). Sensibilità: micromole (10-6moli ); mg
39 Gli aminoacidi sono legati da un legame amidico Gruppo carbossilico attivato da: Nelson & Cox Nella cellula ha luogo grazie al macchinario di sintesi proteica.
40 Il legame peptidico è rigido e planare
41 L ossigeno carbonilico ha una parziale carica negativa e l azoto amidico una parziale carica positiva, formando un dipolo elettrico. Praticamente tutti i legami peptidici nelle proteine si formano in configurazione trans, favorita date le minori interazioni steriche
42 I legami C-N a causa del loro parziale carattere di doppio legame non possono ruotare liberamente. È invece permessa la rotazione dei legami N-Ca e Ca-C La rigidità del legame peptidico limita notevolmente il numero di conformazioni che una catena polipeptidica può assumere
43 PEPTIDI E PROTEINE Quando un amminoacido si lega con il suo gruppo a-carbossilico al gruppo a-amminico di un altro amminoacido si forma un legame peptidico con eliminazione di una molecola d acqua. 2 amminoacidi dipeptide 3 amminoacidi tripeptide 4 amminoacidi tetrapeptide e così via. Sono chiamati oligopeptidi le catene formate da pochi (10-20) residui amminoacidici. Un polipeptide è formato invece da residui amminoacidici. Una catena formata dall unione di molti amminoacidi (più di 100) prende il nome di proteina. I polipeptidi, e i peptidi in genere, presentano ad una estremità della catena un gruppo amminico libero (estremità amminoterminale o N-terminale) che identifica l inizio della catena, e all altra estremità un gruppo carbossilico libero (estremità carbossiterminale o C-terminale) che identifica la fine della catena.
44 I peptidi sono polimeri costituiti da 2 a 11 amminoacidi. Catene più lunghe sono denominate polipeptidi o proteine. Dal p.d.v. funzionale si distinguono in base alla sequenza degli AA: ROMA RAMO: stesse lettere, diversa sequenza, diverso significato Es. polipeptidi secreti del pancreas ad azione antagonista: Glucagone 29 AA Insulina AA (una proteina con 2 catene polipeptidiche)
45 Nel peptidi distinguiamo una catena principale, o scheletro, dovuta ai gruppi amminici e carbossilici legati al Ca che si ripetono in sequenza e una parte variabile costituita dalle catene laterali di ciascun amminoacido. Ogni amminoacido che fa parte di un peptide è chiamato residuo da: Nelson & Cox Ogni catena peptidica presenta 2 estremità differenti = i peptidi sono polimeri polari
46 PROPRIETA DEI PEPTIDI CHIMICHE L NH 2 terminale e COOH terminale dei peptidi danno le stesse reazioni caratteristiche degli a-ammino e a-carbossi gruppi degli AA. Caratteristica dei peptidi reazione del BIURETO (N.B. :AA ninidrina)
47 Classificazione e caratteristiche dei peptidi I peptidi possono essere di origine proteica (prodotti dalla idrolisi enzimatica o chimica delle proteine) o essere presenti come tali nella cellula con uno specifico ruolo biologico (peptidi di origine non proteica) I peptidi di origine non proteica biologicamente attivi hanno in genere una struttura diversa da quelli che derivano dalla idrolisi delle proteine: D-AA, -AA, legami -peptidici, possono essere ciclici. Queste caratteristiche li proteggono dalle proteasi. I peptidi di origine non proteica sono sintetizzati da un complesso di enzimi diversi dal macchinario della sintesi proteica (ribosomi, ecc.).
48 Bradichinina (antinfiammatorio) Ossitocina TRH peptidi oppiacei; Met-encefaline (analgesici endogeni) Leuencefaline GRAMICIDINA S (antibiotico)
49 Vasopressina e Ossitocina sono un esempio di relazione fra struttura e funzione: sono entrambi nonapeptidi ; differiscono solo per 2 amminoacidi.
50 . La Vasopressina, detta anche ormone antidiuretico (ADH), è un nonapeptide modificato prodotto dalla ghiandola pituitaria: stimola il riassorbimento dell acqua nei reni (azione antidiuretica) e la contrazione del muscolo liscio. Quest ultima attività contribuisce alla regolazione della pressione sanguigna. E un neuropeptide: influenza anche il sistema nervoso centrale.
51 (Arg) (Phe) L Ossitocina è l ormone pituitario che stimola la lattazione e la contrazione dei muscoli dell utero nelle donne in gravidanza. E un neuropeptide: influenza anche il sistema nervoso centrale.
52 Oltre che la funzione, il cambiamento di 1 o pochi amminoacidi può avere sui peptidi effetti drastici su: carica netta, solubilità, stabilità, reattività, legami a recettori
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Aminoacidi. Struttura generale Sono 20 e formano le
 Aminoacidi Struttura generale Sono 20 e formano le proteine. Oltre a questi ne esistono altri meno comuni Alcuni subiscono modificazioni dopo essere stati inseriti nelle proteine Altri stanno nell organismo
Aminoacidi Struttura generale Sono 20 e formano le proteine. Oltre a questi ne esistono altri meno comuni Alcuni subiscono modificazioni dopo essere stati inseriti nelle proteine Altri stanno nell organismo
AMINOACIDI Struttura. Funzione. Classificazione. Proprietà
 AMINOACIDI Struttura Funzione Classificazione Proprietà 1 STRUTTURA Composti caratterizzati dalla presenza di un gruppo aminico (NH 2 ) e di un gruppo acido (COOH) legati al medesimo carbonio (C). In soluzione
AMINOACIDI Struttura Funzione Classificazione Proprietà 1 STRUTTURA Composti caratterizzati dalla presenza di un gruppo aminico (NH 2 ) e di un gruppo acido (COOH) legati al medesimo carbonio (C). In soluzione
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
AMMINO ACIDI. L equilibrio è regolato dal ph
 AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
Gli amminoacidi ( 20) hanno proprietà strutturali comuni
 Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 5
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Antimo Di Maro. Lezione 3. Corso di Laurea in Scienze Biologiche
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
DETERMINAZIONE SPERIMENTALE DEI pka E DEL pi DI UN AMMINOACIDO DIPROTICO: CURVA DI TITOLAZIONE DELLA GLICINA COO - + Zwitterione
 DETERMINAZIONE SPERIMENTALE DEI pka E DEL pi DI UN AMMINOACIDO DIPROTICO: CURVA DI TITOLAZIONE DELLA GLICINA p 1 2.34 5.97 9.6 14 pka1 pka2 pi COO + 3 N- C + 3 N- C 2 N- C AA +1 Catione AA 0 Zwitterione
DETERMINAZIONE SPERIMENTALE DEI pka E DEL pi DI UN AMMINOACIDO DIPROTICO: CURVA DI TITOLAZIONE DELLA GLICINA p 1 2.34 5.97 9.6 14 pka1 pka2 pi COO + 3 N- C + 3 N- C 2 N- C AA +1 Catione AA 0 Zwitterione
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
AMMINOACIDI. Gli amminoacidi si distinguono in base alla diversità della catena laterale R in ciascuno di essi.
 AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche
AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche
Schemi delle lezioni 1
 Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Amminoacidi, peptidi, proteine
 Amminoacidi, peptidi, proteine a-amminoacidi che costituiscono le proteine A-amminoacido primario, Prolina Al carbonio a sono legati: Carbossile Ammina Catena laterale Piccin Nuova Libraria S.p.A. a-amminoacidi
Amminoacidi, peptidi, proteine a-amminoacidi che costituiscono le proteine A-amminoacido primario, Prolina Al carbonio a sono legati: Carbossile Ammina Catena laterale Piccin Nuova Libraria S.p.A. a-amminoacidi
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
moli OH - /mole amminoacido
 ) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
COMPOSTI AZOTATI. derivanti dall ammoniaca AMMINE. desinenza -INA AMMIDE
 COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
LE PROTEINE: copolimeri di AMMINOACIDI
 LE PROTEINE: copolimeri di AMMINOACIDI Albumina Dr. Paola Rota e-mail: paola.rota@unimi.it Riassunto lipidi Classe eterogenea di composti (trigliceridi, fosfolipidi, alcune vitamine, alcuni ormoni, colesterolo,
LE PROTEINE: copolimeri di AMMINOACIDI Albumina Dr. Paola Rota e-mail: paola.rota@unimi.it Riassunto lipidi Classe eterogenea di composti (trigliceridi, fosfolipidi, alcune vitamine, alcuni ormoni, colesterolo,
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
Struttura degli Amminoacidi
 Amminoacidi Struttura degli Amminoacidi Amminoacido (o α-amminoacido): molecola che possiede un gruppo amminico primario (-NH 2 ) come sostituente dell atomo di carbonio α, e un gruppo carbossilico acido
Amminoacidi Struttura degli Amminoacidi Amminoacido (o α-amminoacido): molecola che possiede un gruppo amminico primario (-NH 2 ) come sostituente dell atomo di carbonio α, e un gruppo carbossilico acido
lezione Prof. Spina miliardi di anni fa l universo comparve sotto forma di eruzioni
 Biochimica Matricole dispari 1 1^ lezione Prof. Spina LA BIOCHIMICA 15 20 miliardi di anni fa l universo comparve sotto forma di eruzioni d l f d inimmaginabili di particele subatomiche ricche di energia
Biochimica Matricole dispari 1 1^ lezione Prof. Spina LA BIOCHIMICA 15 20 miliardi di anni fa l universo comparve sotto forma di eruzioni d l f d inimmaginabili di particele subatomiche ricche di energia
LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOACIDI
 LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
COOH. Sono tutti α-amminoacidi possiedono un gruppo amminico e un carbossilico entrambi legati allo stesso atomo di carbonio (il carbonio α)
 AMMINOACIDI Gi amminoacidi comuni o standard che tutti gi organismi viventi utiizzano per assembaggio dee PROTEINE sono 20 e sono codificati da codice genetico. Sono tutti α-amminoacidi possiedono un gruppo
AMMINOACIDI Gi amminoacidi comuni o standard che tutti gi organismi viventi utiizzano per assembaggio dee PROTEINE sono 20 e sono codificati da codice genetico. Sono tutti α-amminoacidi possiedono un gruppo
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Lezione 2. Bioinformatica. Mauro Ceccanti e Alberto Paoluzzi
 Lezione 2 Bioinformatica Mauro Ceccanti e Alberto Paoluzzi Dip. Informatica e Automazione Università Roma Tre Dip. Medicina Clinica Università La Sapienza Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi
Lezione 2 Bioinformatica Mauro Ceccanti e Alberto Paoluzzi Dip. Informatica e Automazione Università Roma Tre Dip. Medicina Clinica Università La Sapienza Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, Padova. Tel.
 Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: fulvio.ursini@unipd.it Funzioni delle
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: fulvio.ursini@unipd.it Funzioni delle
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
BIOCHIMICA BIOCHIMICA APPLICATA
 BIOCHIMICA BIOCHIMICA APPLICATA Corso di Laurea in Farmacia Prof. Ivano F. Santarelli Introduzione Testi consigliati -I principi di Biochimica di Lehninger. D.L.Nelson, M.M. Cox. Zanichelli -Biochimica
BIOCHIMICA BIOCHIMICA APPLICATA Corso di Laurea in Farmacia Prof. Ivano F. Santarelli Introduzione Testi consigliati -I principi di Biochimica di Lehninger. D.L.Nelson, M.M. Cox. Zanichelli -Biochimica
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
Protidi. Protidi 16/01/2019
 Protidi I protidi sono macromolecole costituite dall unione di amminoacidi tra loro. I protidi, a seconda del numero di amminoacidi che li costituiscono, sono distinti in: oligopeptidi, formati da pochi
Protidi I protidi sono macromolecole costituite dall unione di amminoacidi tra loro. I protidi, a seconda del numero di amminoacidi che li costituiscono, sono distinti in: oligopeptidi, formati da pochi
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa
 Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Cap. 1 Interazioni delle molecole con l acqua
 Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
AMMINOACIDI. Sono tutti α-amminoacidi il carbonio α (C-2) è un carbonio con. α-amminoacido generico scritto nella sua forma completamente protonata
 AMMINOACIDI Gi amminoacidi comuni o standard che tutti gi organismi viventi utiizzano per assembaggio dee PROTEINE sono 20 e sono codificati da codice genetico. Sono tutti α-amminoacidi i carbonio α (C-2)
AMMINOACIDI Gi amminoacidi comuni o standard che tutti gi organismi viventi utiizzano per assembaggio dee PROTEINE sono 20 e sono codificati da codice genetico. Sono tutti α-amminoacidi i carbonio α (C-2)
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
4x4x4=4 3 =64 codoni. 20 aminoacidi
 4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
La biochimica è anche definita la chimica del C :
 Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
Proteine. Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana)
 Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA
 PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH
 Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
Test di ingresso LM Scienze Chimiche A. A
 Università degli Studi di Cagliari Test di ingresso LM Scienze Chimiche A. A. 2009-2010 Test di ingresso alla LM in Scienze Chimiche A.A. 2009 2010 1 Chimica Analitica 1) Indicare, tra quelle riportate
Università degli Studi di Cagliari Test di ingresso LM Scienze Chimiche A. A. 2009-2010 Test di ingresso alla LM in Scienze Chimiche A.A. 2009 2010 1 Chimica Analitica 1) Indicare, tra quelle riportate
Le biomolecole si trovano negli organismi viventi
 Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
COMPORTAMENTO ANFOTERO DEGLI AA
 Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
Jay Phelan, Maria Cristina Pignocchino. Scopriamo la biologia
 Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Lezione 39 Chimica organica - stereoisomeria
 Lezione 39 Chimica organica - stereoisomeria 1. La stereoisomeria In un atomo di carbonio ibridato sp 3 i quattro orbitali ibridi, e quindi i quattro legami da essi formati sono orientati, come detto,
Lezione 39 Chimica organica - stereoisomeria 1. La stereoisomeria In un atomo di carbonio ibridato sp 3 i quattro orbitali ibridi, e quindi i quattro legami da essi formati sono orientati, come detto,
CENNI SUL TIPO DI FORZE
 CENNI SUL TIPO DI FORZE Forze deboli che influenzano la struttura delle proteine: le interazioni di van der Waals repulsione attrazione Forze attrattive dovute a interazioni istantanee che si generano
CENNI SUL TIPO DI FORZE Forze deboli che influenzano la struttura delle proteine: le interazioni di van der Waals repulsione attrazione Forze attrattive dovute a interazioni istantanee che si generano
aa 2013-14 Proteine Struttura delle Proteine α Amminoacidi
 Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Università Telematica Pegaso. Indice
 LE PROTEINE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 TRASCRIZIONE--------------------------------------------------------------------------------------------------------------
LE PROTEINE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 TRASCRIZIONE--------------------------------------------------------------------------------------------------------------
PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi
 POTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,, O, N) macromolecole organiche, molecole informazionali, polimeri
POTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,, O, N) macromolecole organiche, molecole informazionali, polimeri
La biochimica è anche definita la chimica del C :
 Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C carbonio
Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C carbonio
Biochimica. studio della vita a livello molecolare
 Biochimica studio della vita a livello molecolare studio della composizione molecolare dei sistemi viventi studio delle reazioni chimiche cui vanno incontro i sistemi viventi ALCUNI QUESITI DELLA BIOCHIMICA
Biochimica studio della vita a livello molecolare studio della composizione molecolare dei sistemi viventi studio delle reazioni chimiche cui vanno incontro i sistemi viventi ALCUNI QUESITI DELLA BIOCHIMICA
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 4
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 4 Scoperta degli amminoacidi: gli amminoacidi essenziali Gli amminoacidi essenziali sono quegli amminoacidi che un
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 4 Scoperta degli amminoacidi: gli amminoacidi essenziali Gli amminoacidi essenziali sono quegli amminoacidi che un
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
LEZIONE DEL 16/03/2017 Prosieguo sugli amminoacidi Tre amminoacidi con gruppo laterale basico Lisina (Lys, K) Arginina (Arg, R) Istidina (His, H)
 LEZIONE DEL 16/03/2017 Prosieguo sugli amminoacidi Tre amminoacidi con gruppo laterale basico Lisina (Lys, K) Ovviamente carica nel gruppo carbossile, amminico implicati in eventuali legami peptidici,
LEZIONE DEL 16/03/2017 Prosieguo sugli amminoacidi Tre amminoacidi con gruppo laterale basico Lisina (Lys, K) Ovviamente carica nel gruppo carbossile, amminico implicati in eventuali legami peptidici,
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Amminoacidi e proteine Dagli amminoacidi come building-blocks alla struttura quaternaria
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Amminoacidi e proteine Dagli amminoacidi come building-blocks alla struttura quaternaria
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Amminoacidi e proteine Dagli amminoacidi come building-blocks alla struttura quaternaria
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
Amminoacidi - Peptidi - Proteine. Emoglobina
 Amminoacidi - Peptidi - Proteine Emoglobina 1 Emoglobina Gli amminoacidi sono le sostanze di base che costituiscono le proteine. Ogni proteina è caratterizzata da una precisa sequenza di mattoni di amminoacidi.
Amminoacidi - Peptidi - Proteine Emoglobina 1 Emoglobina Gli amminoacidi sono le sostanze di base che costituiscono le proteine. Ogni proteina è caratterizzata da una precisa sequenza di mattoni di amminoacidi.
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
La struttura covalente delle proteine (la sequenza amminoacidica)
 La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
Di cosa è fatta una cellula?
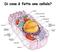 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. Metodologie 1. DiSTABiF. Corso di Laurea in SCIENZE BIOLOGICHE.
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Anno Accademico 2016-17 Metodologie 1 Spettrofotometria e analisi di amminoacidi
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Anno Accademico 2016-17 Metodologie 1 Spettrofotometria e analisi di amminoacidi
SOLUZIONI DEGLI ESERCIZI
 Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
LE MACROMOLECOLE BIOLOGICHE Le cellule contengono 4 famiglie principali di molecole organiche:
 LEZIONE n 1 LE MACROMOLECOLE BIOLOGICHE Le cellule contengono 4 famiglie principali di molecole organiche: macromolecole Macromolecole macromolecole I componenti chimici di una cellula -Le macromolecole
LEZIONE n 1 LE MACROMOLECOLE BIOLOGICHE Le cellule contengono 4 famiglie principali di molecole organiche: macromolecole Macromolecole macromolecole I componenti chimici di una cellula -Le macromolecole
