Prescrivere News - NUOVE ENTITA TERAPEUTICHE - IN OSPEDALE
|
|
|
- Guido Mauro
- 7 anni fa
- Visualizzazioni
Transcript
1 RANIBIZUMAB IL NOSTRO GIUDIZIO RUOLO INCERTO Sostanze contro le malattie vascolari oculari S01LA04 Lucentis NOVARTIS iniet 10 mg/ml 1 flaconcino 0,3 ml 1.230,00 (prezzo ospedaliero) Classe C Tipo ricetta: OSP-1 Tipo di registrazione: procedura centralizzata europea Indicazioni Trattamento della degenerazione maculare neovascolare (essudativa) correlata all età (AMD). IL NOSTRO GIUDIZIO Ranibizumab è un derivato di bevacizumab 6 ed è costituito da un frammento di un anticorpo monoclonale ricombinante umanizzato diretto contro il VEGF-A di cui impedisce il legame con i recettori VEGFR-1 e VEGFR-2 8. Al contrario di pegaptanib, ranibizumab, come bevacizumab, inibisce tutte le isoforme di VEGF 5. Lo sviluppo clinico comprende 3 RCT di fase III 9,12-14, di cui 2 controllati versus placebo (MARINA, PIER) e uno in cui ranibizumab è stato confrontato alla terapia fotodinamica con verteporfina (ANCHOR), comparator anche in uno studio di fase I/II (FOCUS) 15. Lo studio MARINA 12, su 716 pazienti, è l unico che ha fornito dati di efficacia e sicurezza a 24 mesi, evidenziando un tasso di responder significativamente maggiore con entrambe le dosi di ranibizumab testate: a 12 mesi il 94,5% dei trattati alla dose di 0,3 mg e il 94,6% alla dose di 0,5 mg ha perso <15 lettere di acuità visiva della tavola ETDRS rispetto al 62,2% del placebo. A 24 mesi è stato osservato un trend simile, con il mantenimento di una differenza statisticamente significativa tra i bracci (p<0,0001) 12. Nello studio ANCHOR 13, di non inferiorità, il confronto rispetto alla terapia fotodinamica con verteporfina, unico trattamento finora disponibile, oltre a pegaptanib, per la terapia dell AMD, ha confermato, a 12 mesi, su 423 pazienti, un efficacia maggiore di ranibizumab sia in termini di minore perdita che di guadagno in acuità visiva. Non si dispone di confronti diretti con pegaptanib che, durante la sperimentazione clinica, non ha dimostrato benefici clinici oltre un anno ed il cui rapporto costo/efficacia è stato ritenuto sfavorevole dal NICE. Il profilo di sicurezza oculare di ranibizumab sia allinea a quanto già osservato con pegaptanib evidenziando soprattutto l aumento della pressione endoculare e reazioni infiammatorie (iriti, uveiti); rispetto a pegaptanib l incidenza di endoftalmite sembra minore (1%) 21. Come per pegaptanib e per bevacizumab (per il quale non è approvata l indicazione), rimangono da approfondire gli aspetti legati agli effetti sistemici del farmaco (soprattutto eventi trombotici arteriosi ed emorragici), visto il suo meccanismo di inibizione non selettiva di tutte le isoforme del VEGF. A questo proposito suscita perplessità la Nota Informativa dell FDA in cui viene rilevato un aumento dell incidenza di ictus nel corso di uno studio ancora in corso, maggiore con la dose di 0,5 mg di ranibizumab rispetto al dosaggio da 0,3 mg 20. Tale aspetto è stato evidenziato anche dal NICE 19, che pur ritenendo che ranibizumab sia costo/efficace nella AMD prevalentemente classica, rileva delle questioni ancora aperte quali lo stabilire la durata di trattamento e la frequenza di somministrazione appropriate. DIALOGO SUI FARMACI n. 5/2007 (profilo aggiornato al 10 novembre 2007) 1
2 COSTO Un ciclo di trattamento di 3 mesi con ranibizumab costa 3.690, il 60% in più circa rispetto a pegaptanib ( 1.395) e quasi il triplo di verteporfina ( 1.060,20). Il farmaco più economico è bevacizumab, che per tale indicazione è inserito nell elenco della legge 648/96 e per il quale il costo di una iniezione intravitreale è di I costi calcolati considerano i prezzi ex factory. Al costo della terapia con pegaptanib va aggiunto quello relativo all impiego di un anestetico e di un antibiotico ad ampio spettro. CONFRONTO COSTI PER DI 3 MESI DI TRATTAMENTO ranibizumab 0,5 mg/mese 3.690,00 pegaptanib 0,3 mg/6 sett verteporfina* 1 sir ogni 3 mesi 1.060, ,00 bevacizumab 1 fl/mese 60, *utilizzato solamente per lesioni subfoveali. La dose calcolata considera un paziente di 65 Kg. farmaco inserito nella legge 648/96; il costo ad iniezione è stato calcolato di ( ) VISTO DAGLI ALTRI The Medical Letter 2006; 24: Il ranibizumab è il primo farmaco che ha dimostrato di migliorare la vista in pazienti con AMD essudativa. Non sono ancora disponibili dati sul suo impiego per un periodo superiore a due anni. La Revue Prescrire 2007; 284: Apporta qualcosa. Australian Prescriber 2007; 3: Ranibizumab sembra offrire una promettente alternativa nell attuale trattamento dell AMD. DTB 2007; 7: La sicurezza di ranibizumab oltre 2 anni non è stata stabilita. Scottish Medicine Consortium L efficacia maggiore in termini di guadagno in acuità visiva è stata evidenziata nei primi 3 mesi di trattamento. NUOVO PRINCIPIO ATTIVO La degenerazione maculare correlata all età (Age-related Macular Degeneration - AMD) è una malattia degenerativa della porzione centrale della retina (macula) che determina una perdita progressiva della visione centrale 1 la cui prevalenza, nei paesi industrializzati, viene stimata nel 2% dei soggetti >50 anni 2. I principali fattori di rischio sono l età, l ipertensione, le malattie cardiovascolari, il fumo e una storia familiare della malattia 2. Le due forme principali di AMD 3 sono quella non DIALOGO SUI FARMACI n. 5/2007 (profilo aggiornato al 10 novembre 2007) 2
3 essudativa o atrofica, che costituisce il 90% dei casi e quella essudativa o neovascolare, molto più rara (10% circa) ma con la maggiore incidenza di cecità legale a. Rispetto alla forma secca, la cui progressione è lenta (tempo di insorgenza di cecità altamente variabile, 5-10 anni), nella AMD essudativa la perdita della visione fino a cecità totale può essere molto più rapida 4. Le lesioni dell AMD vengono suddivise in classiche (100%), prevalentemente classiche (>50% classiche), minimamente classiche (<50% classiche) o occulte in base al loro aspetto all angiografia con fluoresceina ed in subfoveali, iuxtafoveali o extrafoveali in funzione della localizzazione a livello della fovea 4. Nell AMD essudativa sembra rivestire un ruolo chiave il fattore di crescita vascolare endoteliale (VEGF) 3, responsabile della neovascolarizzazione coroidale, della permeabilità vascolare e dell infiammazione 5 ; il VEGF, comunque, regola l angiogenesi anche nei tessuti extraoculari e la sua soppressione potrebbe compromettere la formazione di vasi collaterali a livello di lesioni ischemiche e del miocardio 6. Al contrario della forma atrofica per la quale attualmente non è disponibile alcun trattamento di provata efficacia 3, l AMD essudativa dispone di diverse opzioni 4 : la fotocoagulazione termica con laser (nelle lesioni classiche ed extrafoveali e iuxtafoveali ma non subfoveali), la terapia fotodinamica con verteporfina (nelle lesioni subfoveali; è possibile trattare simultaneamente entrambi gli occhi) e gli inibitori dell angiogenesi. Esponenti di questa nuova classe terapeutica sono, oltre a ranibizumab, pegaptanib (DsF 3/2007, pag. 192) e bevacizumab (già in commercio in Italia per la terapia del carcinoma metastatico del colon-retto e del carcinoma mammario metastatico e recentemente autorizzato dall EMEA per il trattamento del tumore del polmone non a piccole cellule), non autorizzato nella AMD ma incluso da maggio 2007 nell elenco dei farmaci erogabili ai sensi della Legge 648/96 per il trattamento delle maculopatie essudative e del glaucoma neovascolare 7. Ranibizumab è un derivato di bevacizumab 6 ed è costituito da un frammento di un anticorpo monoclonale ricombinante umanizzato diretto contro il VEGF-A di cui impedisce il legame con i recettori VEGFR-1 e VEGFR-2 sulla superficie delle cellule endoteliali 8. Al contrario di pegaptanib, ranibizumab, come bevacizumab, inibisce tutte le isoforme di VEGF 5 ; presenta un emivita media di eliminazione dal vitreo di circa 10 giorni 9. In Italia, l AIFA ha classificato ranibizumab, come pegaptanib, in classe C OSP1 per sfavorevole rapporto costo/beneficio 11. Posologia: la dose raccomandata è 0,5 mg (0,05 ml) per iniezione intravitreale nell occhio, da trattare in condizioni asettiche, somministrando un antimicrobico topico ad ampio spettro e un anestesia adeguata 9. Il paziente deve autosomministrarsi un collirio antibiotico ad ampio spettro 4 volte/die nei 3 giorni precedenti e successivi ad ogni iniezione. Il trattamento prevede una fase di attacco di un iniezione al mese per 3 mesi consecutivi, seguita da una fase di mantenimento caratterizzata da un controllo mensile per l acuità visiva. In presenza di perdita di acuità visiva >5 lettere, il farmaco va somministrato nuovamente; l intervallo tra 2 dosi non deve essere inferiore a 1 mese 9. EFFICACIA Gli studi pivotal a supporto dell autorizzazione all immissione in commercio di ranibizumab da parte dell EMEA 9 comprendono 3 RCT di fase III, MARINA, ANCHOR e lo studio PIER 12-14, non pubblicato, e 1 studio di fase I/II (FOCUS) 15. Tutti gli studi prevedevano una durata di trattamento di 24 mesi e un end point I rappresentato dalla percentuale di pazienti che a 12 mesi perdevano <15 lettere di acutà visiva della tavola ETDRS b rispetto al valore basale 9. I a Cecità legale: acuità visiva <20/200; nella carta di Snellen una capacità di lettura di 20/200 piedi (6/600 in metri) significa che un soggetto è in grado di vedere a 20 piedi (6 metri) quello che un altro con una vista normale vede a 200 piedi (60 metri) 2. b btavola ETDRS (Early Treatment of Diabetic Retinopathy Study): ottotipi per lontano nei quali le dimensioni dei caratteri hanno una progressione logaritmica, in cui la variazione percentuale della dimensione del carattere tra lettere adiacenti è la DIALOGO SUI FARMACI n. 5/2007 (profilo aggiornato al 10 novembre 2007) 3
4 risultati a 24 mesi sono disponibili solo per lo studio MARINA 9,12. Nello studio MARINA 12, di superiorità, 716 pazienti con lesioni minimamente classiche o occulte, sono stati randomizzati a ranibizumab alle dosi di 0,3 mg o 0,5 mg o a placebo per iniezione intravitrale mensile in un solo occhio. A 12 mesi tra i trattati con ranibizumab il 94,5% alla dose di 0,3 mg e il 94,6% alla dose di 0,5 mg ha raggiunto l end point I rispetto al 62,2% del placebo (p<0,001). I corrispondenti valori a 24 mesi sono risultati 92% e 90% con il farmaco vs 52,9% con il placebo (p<0,001) 12. Relativamente all end point II, a 12 mesi nel braccio trattato con la dose di 0,3 mg è stato rilevato un guadagno 15 lettere di acuità visiva nel 25% dei pazienti, nel 34% dei soggetti che assumevano 0,5 mg vs il 5% del placebo (p<0,0001) 14. La percentuale di soggetti con perdita grave della visione ( 30 lettere) a 12 mesi è stata rispettivamente dello 0,8% con 0,3 mg e 1,2% con 0,5 mg di ranibizumab vs 14,3% con placebo mentre a 24 mesi i corrispondenti tassi erano 3,4% e 2,5% con il farmaco rispetto a 22,7% con placebo 12. Un analisi retrospettiva 16 dei risultati del MARINA a 24 mesi, ha valutato l efficacia del farmaco in funzione di sesso, età, tipo ed entità delle lesioni e storia dell AMD. I dati conclusivi hanno mostrato che il più importante fattore predittivo degli esiti del trattamento era il livello di acuità visiva al baseline seguito dall entità delle lesioni e dall età. La durata dell AMD non sembrava influenzare l efficacia del trattamento 16. Nello studio ANCHOR 13, di non inferiorità 9, ranibizumab alle dosi di 0,3 mg o 0,5 mg è stato confrontato alla terapia fotodinamica con verteporfina (PDT) in 423 pazienti con lesioni prevalentemente classiche. A 12 mesi il tasso di responder per l end point I alla dose di 0,3 mg di ranibizumab è stato del 94,3% e del 96,4% con 0,5 mg rispetto a 64,3% del controllo (p<0,001) 13. Dal baseline, il guadagno 15 stessa per tutti i livelli di acuità visiva. La tavola consiste di 14 righe di 5 lettere ciascuna; è ancora poco usata nella pratica clinica quotidiana, mentre è richiesta, per la sua precisione ed attendibilità soprattutto nelle acuità visive basse, nella maggior parte degli studi clinici. lettere di acuità visiva si è verificato nel 35,7% dei soggetti randomizzati alla dose di 0,3 mg e nel 40,3% con la dose da 0,5 mg vs il 5,6% del comparator (p<0,001) 13. La perdita grave della visione non si è verificata in nessuno dei pazienti trattati con ranibizumab rispetto al 13,3% con PDT (p<0,001) 13. In entrambi gli RCT 12,13 non è stata rilevata alcuna differenza statisticamente significativa tra le due dosi di ranibizumab 17,18. Lo studio PIER della durata di 2 anni, controllato vs placebo ed il cui obiettivo era quello di valutare un regime posologico del farmaco meno frequente, ha randomizzato 184 pazienti (con lesioni minimamente classiche, occulte o prevalentemente classiche) 10 a ranibizumab 0,3 mg o 0,5 mg 1 volta/mese per i primi 3 mesi e in seguito ogni 3 mesi, per un totale di 24 mesi di terapia 14. Sono disponibili solo i risultati a 12 mesi che hanno evidenziato un tasso di responder del 90,2% con 0,5 mg, 83,3% con 0,3 mg vs 49,2% con placebo (p<0,0001) 9. La differenza tra i bracci in termini di guadagno 15 lettere di acuità visiva non è stata, invece, statisticamente significativa (13,1% e 11,7% con le due dosi di ranibizumab vs 9,5% con placebo) 8,9, rilevando un efficacia minore rispetto a quella osservata negli studi MARINA e ANCHOR 19. Lo studio FOCUS 15, RCT di fase I/II, della durata di 24 mesi, ha randomizzato 162 pazienti con lesioni prevalentemente classiche, pretrattati con PDT seguita, 1 settimana più tardi, da ranibizumab 0,5 mg 1 volta/mese o placebo. Ogni 3 mesi, in seguito alla valutazione dello sperimentatore, i soggetti ricevevano o meno un altra somministrazione di PDT 14. Sono disponibili solo i risultati a 12 mesi che hanno evidenziato, nei trattati con l associazione ranibizumab + PDT un tasso di responder del 90,5% rispetto al 67,9% con PDT da sola (p<0,001) 15. La percentuale di soggetti con guadagno 15 lettere di acuità visiva è stato il 23,8% con l associazione rispetto al 5,4% con PDT da sola (p=0,003) mentre i corrispondenti valori relativi a perdita severa della visione sono stati 1% vs 8,9% (p=0,01) 15. Un piccolo studio in aperto (PRONTO) 14, ancora in corso, della durata prevista di 2 anni, sta valutando, su 40 pazienti pretrattati con DIALOGO SUI FARMACI n. 5/2007 (profilo aggiornato al 10 novembre 2007) 4
5 ranibizumab 0,5 mg per tre mesi consecutivi, l opportunità di un ri-trattamento con il farmaco in funzione della tomografia ottica a coerenza di fase (OCT), metodica diagnostica che dovrebbe essere in grado di rilevare precocemente le manifestazioni di neovascolarizzazione ricorrente. SICUREZZA E TOLLERABILITÀ I dati di sicurezza presentati all EMEA sono relativi a un totale di pazienti trattati con ranibizumab 9. I dati maggiormente rappresentativi sono relativi ai 2 RCT pivotal, MARINA e ANCHOR 9. Nello studio MARINA 12, a 24 mesi, gli eventi avversi oculari a maggiore incidenza tra i trattati sono stati infiammazioni severe (1,3% con entrambe le dosi vs nessun caso con placebo), endoftalmiti (1,3% nel braccio trattato 0,5 mg, 0,8% con 0,3 mg vs nessun caso con placebo), uveite (1,3% con entrambe le dosi vs nessun caso con placebo). La differenza tra i gruppi relativamente all aumento della pressione endoculare, in media a 1 ora dalla procedura iniettiva, è risultata particolarmente rilevante per valori 30 mmhg (13% dei trattati con 0,5 mg e 17,6% con 0,3 mg di ranibizumab vs 3,4% con placebo) 12. L aumento della pressione endoculare, maggiore con il farmaco, è stata confermata anche dallo studio non pubblicato, il PIER, nel quale i tassi di incidenza dell evento sono stati 21,3% con la dose di 0,5 mg, 8,5% con 0,3 mg vs 4,8% con placebo 9. Complessivamente, nello studio MARINA, i decessi sono stati 17, tra cui 2 stroke tra i soggetti randomizzati a 0,5 mg di ranibizumab 12. La differenza tra i bracci nell incidenza di eventi tromboembolici arteriosi (infarto del miocardio non fatale+ictus non fatale+morte vascolare) non è risultata statisticamente significativa: relativamente all infarto del miocardio i tassi di incidenza sono stati 1,3% e 2,5% con ranibizumab (0,5 mg e 0,3 mg, rispettivamente) vs 1,7% con placebo e per l ictus 2,5% e 1,3% vs 0,8%. Il tasso di eventi emorragici totali (gravi e non) con il farmaco è stato 8,8% alla dose di 0,5 mg, 9,2% alla dose 0,3 mg vs 5,5% con placebo 12. Nella valutazione EMEA, si afferma che i dati ad 1 anno hanno rilevato un aumento di eventi tromboembolici arteriosi gravi e di emorragie non oculari, soprattutto alla dose di 0,5 mg di ranibizumab (dati non mostrati), trend non più osservato a 2 anni di trattamento 9. Nello studio ANCHOR 13, a 12 mesi, il tasso di infiammazione oculare (es. iriti, iridocicliti, uveiti) è risultato maggiore nei soggetti trattati con ranibizumab (10,2% alla dose di 0,3 mg e 15% con 0,5 mg) rispetto al 2,8% dei pazienti randomizzati a verteporfina; anche in questo trial, è stato osservato un aumento maggiore della pressione endoculare con ranibizumab e, al contrario dello studio MARINA, anche un incremento della formazione di cataratta. Si è verificato 1 caso di endoftalmite solo nel braccio trattato con 0,5 mg di ranibizumab 13. La mortalità è risultata simile tra i gruppi mentre l incidenza di emorragie non oculari, che riflette l inibizione sistemica del VEGF, è stata maggiore con ranibizumab (5,1% alla dose di 0,3 mg e 6,4% alla dose da 0,5 mg) rispetto a verteporfina (2,1%) 13. L incidenza di eventi tromboembolici arteriosi è stata rispettivamente il 2,2% e 4,3% con ranibizumab 0,3 e 0,5 mg vs 2,1% con verteporfina 13. Nello studio FOCUS 15, il tasso di infiammazione oculare è risultato notevolmente maggiore nel braccio trattato con il farmaco vs la terapia fotodinamica da sola (38,1% vs 5,4%); in seguito ad un analisi preliminare dei dati, infatti, a causa di un aumento dell incidenza di uveite nei trattati con ranibizumab+verteporfina rispetto a verteporfina da sola, il protocollo è stato emendato, vietando ulteriori somministrazioni di ranibizumab in associazione a verteporfina (la verteporfina era stata somministrata 7 giorni prima di iniziare con ranibizumab o placebo) 14. Sono stati rilevati 2 i casi di endoftalmite con il farmaco vs nessuno con il controllo. Relativamente alle ADR non oculari l ipertensione è risultata più frequente tra i trattati (12,4% vs 7,1%,) così come il tasso di eventi cardiovascolari gravi (8,6% vs 5,4%) tra cui gli accidenti cerebrovascolari (3,8% vs nessun caso con il controllo). Il NICE 19 ha evidenziato che, allo stato attuale non è possibile trarre conclusioni in merito agli effetti sistemici di ranibizumab, soprattutto a DIALOGO SUI FARMACI n. 5/2007 (profilo aggiornato al 10 novembre 2007) 5
6 livello cardio-cerobrovascolare, pur evidenziando l aumento del rischio di ictus con la dose di 0,5 mg di ranibizumab rispetto a quella da 0,3 mg (1,2% vs 0,3%, p=0,02) rilevato durante l analisi ad interim di un studio in corso, il SAILOR, oggetto di una Nota Informativa in USA 20. Il Risk Management Plan sottoposto all EMEA 9 include la conduzione di 3 studi osservazionali (2 in USA di cui 1 da programmare e 1, già completato, con l obiettivo di valutare l incidenza di infarto del miocardio e di eventi cardiovascolari e 1 europeo, di coorte di tipo prospettico, già completato), l estensione di studi già conclusi per la rilevazione di ADR correlate alla procedura iniettiva, a reazioni gravi di ipersensiblità, oculari e sistemiche in seguito ad overdose e somministrazione bilaterale, all inibizione sistemica del VEGF e l attuazione di un piano educazionale rivolto agli operatori sanitari (protocollo per la procedura iniettiva) e ai pazienti (guida per il paziente) già implementato mediante distribuzione di materiale informativo. STUDI IN CORSO In totale, risultano attualmente in corso 63 studi di cui 31 per l indicazione autorizzata (di cui 2 anche in Italia) Tra i 18 studi di fase III, 3 sono delle estensioni in aperto di trial già conclusi il cui obiettivo è la valutazione della sicurezza, 11 vedono il confronto di ranibizumab versus comparator attivi (in 5 RCT la monoterapia vs l associazione con verteporfina, in 2 trial vs la tripla terapia con desametasone + verteporfina, nei rimanenti vs l associazione con imatinib, vs l associazione con bevasiranib, l associazione con radiazione β di Sr 90 ed in 1 solo vs bevacizumab) Sono in corso altri 32 studi in cui ranibizumab viene valutato in patologie oculari diverse dall AMD (di cui 1 anche in Italia) di cui le condizioni con un livello di sperimentazione di fase II o III sono: edema maculare diabetico, retinopatia diabetica proliferativi, occlusione della vena retinica centrale. Studi di fase I o I/II sono condotti nella: proliferazione angiomatosa retinica, edema maculare cistoide da retinopatia non ischemica, telangiectasia maculare idiopatica di tipo 2, neoplasia congiuntivale maligna, corioretinopatia seriosa centrale, neovascolarizzazione da Sindrome di Groenblad-Strandberg e coroidale emorragica, edema maculare infiammatorio, vasculopatia coroidale polipoidale, maculopatie varie BIBLIOGRAFIA 1. Arroyo JG. Age-related macular degeneration. UpToDate Age related macular degeneration. Clinical Evidence 2006; 15: The Royal College of Ophthalmologists interim raccomandations for the management of patients with agerelated macular degeneration (AMD). Updated 7 th June Guidelines-WMA-June_2007.pdf (accesso del ). 4. Ranibizumab and pegaptanib for the treatment of age-related macular degeneration: a systematic review and economic evaluation. Technology Assessment Report commissioned by the NHS R&D HTA Programme on behalf of the NICE, November A view on new drugs for macular degeneration. DTB 2007; 7: Van Wijngaarden P et al. Inhibitors of ocular neovascularization. JAMA 2005; 293: GU n. 122 del Ranibizumab per la degenerazione maculare. The Medical Letter 2006; 24: Lucentis. European Public Assessment Report (EPAR)-EMEA. en6.pdf (accesso del ). 10. Lucentis. Riassunto delle caratteristiche del prodotto. 11. Terapia della degenerazione maculare correlata all età. BIF 2007; 3: Rosenfeld PJ et al for the MARINA Study Group. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006; 355: Brown DM et al for the ANCHOR Study Group. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med 2006; 355: Rosenfeld PJ et al. Ranibizumab: phase III clinical trial results. Ophthalmol Clin N Am 2006; 19: Heier JS et al. Ranibizumab combined with verteporfin photodynamic therapy in neovascular age-related macular degeneration. Arch Ophthalmol 2006; 124: Boyer DS et al. Subgroup analysis of the MARINA study of ranibizumab in neovascular age-related macular degeneration. Ophthalmology 2007; 114: Ranibizumab. Australian Prescriber 2007; 3: DIALOGO SUI FARMACI n. 5/2007 (profilo aggiornato al 10 novembre 2007) 6
7 18. Ranibizumab. La Revue Prescrire 2007; 284: Macular degeneration (age-related)-pegaptaninb and ranibizumab. Appraisal consultation. NICE, 18 June (accesso del ). 20. MedWatch, January 2007: Lucentis. (accesso del ). 21. Ranibizumab. DTB 2007; 7: US National Institutes of Health. (accesso del ). 23. WHO. (accesso del ). 24. Osservatorio Nazionale sulla Sperimentazione Clinica dei medicinali. (accesso del ). 7
Prescrivere News - NUOVE ENTITA TERAPEUTICHE - IN OSPEDALE
 IL NOSTRO GIUZIZIO PEGAPTANIB NON SIAMO D ACCORDO Sostanze contro le malattie vascolari oculari S01LA03 Macugen PFIZER intravitreo 0,3 mg/90 microl 1 sir preriempita 697,5 (prezzo ex factory IVA esclusa)
IL NOSTRO GIUZIZIO PEGAPTANIB NON SIAMO D ACCORDO Sostanze contro le malattie vascolari oculari S01LA03 Macugen PFIZER intravitreo 0,3 mg/90 microl 1 sir preriempita 697,5 (prezzo ex factory IVA esclusa)
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI PEGAPTANIB, RANIBIZUMAB (MACUGEN, LUCENTIS ) Presentata dalla Commissione Terapeutica Provinciale di Cagliari e Commissione Terapeutica Provinciale di Sassari In data
RICHIESTA DI INSERIMENTO IN PTR DI PEGAPTANIB, RANIBIZUMAB (MACUGEN, LUCENTIS ) Presentata dalla Commissione Terapeutica Provinciale di Cagliari e Commissione Terapeutica Provinciale di Sassari In data
MINI SCHEDA HTA AFLIBERCEPT (EYLEA )
 MINI SCHEDA HTA AFLIBERCEPT (EYLEA ) 1/9 NOME COMMERCIALE Principio Attivo Ditta Produttrice ATC Formulazione Dosaggio Categoria Terapeutica Indicazione in Esame Classificazione ai fini della rimborsabilità
MINI SCHEDA HTA AFLIBERCEPT (EYLEA ) 1/9 NOME COMMERCIALE Principio Attivo Ditta Produttrice ATC Formulazione Dosaggio Categoria Terapeutica Indicazione in Esame Classificazione ai fini della rimborsabilità
RANIBIZUMAB (Rivalutazione del 07 aprile 2009) ( )
 RANIBIZUMAB (Rivalutazione del 07 aprile 2009) (17-04-2009) Specialità: LUCENTIS (NOVARTIS FARMA SPA) Forma farmaceutica: 1 flaconcino da 0,23 ml 10 mg/ml - Prezzo: euro 1638.45 ATC: S01LA04 Categoria
RANIBIZUMAB (Rivalutazione del 07 aprile 2009) (17-04-2009) Specialità: LUCENTIS (NOVARTIS FARMA SPA) Forma farmaceutica: 1 flaconcino da 0,23 ml 10 mg/ml - Prezzo: euro 1638.45 ATC: S01LA04 Categoria
Bevacizumab vs Ranibizumab: esperienze dello studio CATT
 Bevacizumab vs Ranibizumab: esperienze dello studio CATT E stato pubblicato sul New England Journal of Medicine il risultato di un trial clinico randomizzato, multicentrico il cui scopo era confrontare
Bevacizumab vs Ranibizumab: esperienze dello studio CATT E stato pubblicato sul New England Journal of Medicine il risultato di un trial clinico randomizzato, multicentrico il cui scopo era confrontare
Loading phase: ancora attuale? Alessandro Randazzo MD Humanitas Research Hospital Rozzano
 Loading phase: ancora attuale? Alessandro Randazzo MD Humanitas Research Hospital Rozzano No ho interessi finanziari in questa comunicazione Alessandro Randazzo MD Humanitas Research Hospital Rozzano MARINA
Loading phase: ancora attuale? Alessandro Randazzo MD Humanitas Research Hospital Rozzano No ho interessi finanziari in questa comunicazione Alessandro Randazzo MD Humanitas Research Hospital Rozzano MARINA
Occhioallaretina.it, Il Magazine Italiano delle Patologie della Retina Numero
 di Massimo Nicolò Il trattamento della Degenerazione Maculare legata all età essudativa: da dove siamo partiti e a che punto siamo. Più di mezzo secolo fa, Ago, Chao e Flocks, negli animali, e Novotony
di Massimo Nicolò Il trattamento della Degenerazione Maculare legata all età essudativa: da dove siamo partiti e a che punto siamo. Più di mezzo secolo fa, Ago, Chao e Flocks, negli animali, e Novotony
DEGENERAZIONE MACULARE SENILE
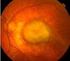 DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
Commissione Regionale Farmaco LAPATINIB
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
di sicurezza di bevacizumab e ranibizumab per uso intravitreale
 XXIII Seminario Nazionale LA VALUTAZIONE DELL USO E DELLA SICUREZZA DEI FARMACI: ESPERIENZE IN ITALIA Roma, ISS 9 dicembre 2014 Revisione sistematica delle evidenze di sicurezza di bevacizumab e ranibizumab
XXIII Seminario Nazionale LA VALUTAZIONE DELL USO E DELLA SICUREZZA DEI FARMACI: ESPERIENZE IN ITALIA Roma, ISS 9 dicembre 2014 Revisione sistematica delle evidenze di sicurezza di bevacizumab e ranibizumab
Farmaci biologici ed edema maculare diabetico. Prof. Giovanni Calabria Università di Genova
 Farmaci biologici ed edema maculare diabetico Prof. Giovanni Calabria Università di Genova Edema maculare diabetico L'edema maculare diabetico si osserva in entrambe le forme di diabete (tipo I e II) e
Farmaci biologici ed edema maculare diabetico Prof. Giovanni Calabria Università di Genova Edema maculare diabetico L'edema maculare diabetico si osserva in entrambe le forme di diabete (tipo I e II) e
Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6
 giunta regionale Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
giunta regionale Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
Clinica e terapia. malattie. retiniche. delle. Direttore Scientifico Alfredo Pece
 Clinica e terapia delle malattie retiniche Direttore Scientifico Alfredo Pece 5 Terapie: Laser TERAPIE PER L AMD NEOVASCOLARE Fotocoagulazione laser Terapia Fotodinamica con verteporfina Terapie antiangiogeniche
Clinica e terapia delle malattie retiniche Direttore Scientifico Alfredo Pece 5 Terapie: Laser TERAPIE PER L AMD NEOVASCOLARE Fotocoagulazione laser Terapia Fotodinamica con verteporfina Terapie antiangiogeniche
Efficacia e sicurezza di una nuova formulazione di Triamcinolone Acetonide nella risoluzione dell edema maculare diabetico
 Azienda Ospedaliero-Universitaria Policlinico - Vittorio Emanuele Ospedale Santa Marta, Catania Direttore Prof. T. Avitabile Efficacia e sicurezza di una nuova formulazione di Triamcinolone Acetonide nella
Azienda Ospedaliero-Universitaria Policlinico - Vittorio Emanuele Ospedale Santa Marta, Catania Direttore Prof. T. Avitabile Efficacia e sicurezza di una nuova formulazione di Triamcinolone Acetonide nella
Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7
 giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO
 Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO ANGELO ü 68 aa ü da 14 aa in pensione ü non familiarità per diabete, IA e dislipidemia Durante la vita lavorativa ha praticato annualmente
Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO ANGELO ü 68 aa ü da 14 aa in pensione ü non familiarità per diabete, IA e dislipidemia Durante la vita lavorativa ha praticato annualmente
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE.
 Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE)
 April 2007 International Council of Ophthalmology ICO International Clinical Guidelines DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE) (Valutazioni: A: estremamente importante, B:
April 2007 International Council of Ophthalmology ICO International Clinical Guidelines DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE) (Valutazioni: A: estremamente importante, B:
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*.
Terapia intravitrale. Anti VEGF verso quale scelta? Dott. Marcello Prantera
 + Terapia intravitrale. Anti VEGF verso quale scelta? Dott. Marcello Prantera + 4 th cause of blindness 50 million people worldwide Proportion of cases of blindness due to each major cause (2008) Principali
+ Terapia intravitrale. Anti VEGF verso quale scelta? Dott. Marcello Prantera + 4 th cause of blindness 50 million people worldwide Proportion of cases of blindness due to each major cause (2008) Principali
Allegato A al Decreto n. 145 del 21 DICEMBRE 2017 pag. 1/8
 giunta regionale Allegato A al Decreto n. 145 del 21 DICEMBRE 2017 pag. 1/8 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO Aggiornamento novembre 2017 FOGLIO
giunta regionale Allegato A al Decreto n. 145 del 21 DICEMBRE 2017 pag. 1/8 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO Aggiornamento novembre 2017 FOGLIO
Luca Leonardi VI Congresso SIFACT Milano Ottobre 2018
 VI Congresso SIFACT La centralità del paziente nei percorsi di cura: quali risposte dalle sanità regionali? MILANO 11-13 OTTOBRE 2018 MICO Fiera Milano City Sicurezza dell uso intravitreale di Bevacizumab
VI Congresso SIFACT La centralità del paziente nei percorsi di cura: quali risposte dalle sanità regionali? MILANO 11-13 OTTOBRE 2018 MICO Fiera Milano City Sicurezza dell uso intravitreale di Bevacizumab
Gentile Signora/e, I disturbi che Lei ha notato nella Sua visione sono dovuti ad una condizione patologica chiamata:
 Gentile Signora/e, I disturbi che Lei ha notato nella Sua visione sono dovuti ad una condizione patologica chiamata: La malattia che La affligge ha una evoluzione naturale peggiorativa che causa gravi
Gentile Signora/e, I disturbi che Lei ha notato nella Sua visione sono dovuti ad una condizione patologica chiamata: La malattia che La affligge ha una evoluzione naturale peggiorativa che causa gravi
ALLEGATO CONCLUSIONI SCIENTIFICHE PRESENTATE DALL'EMEA
 ALLEGATO CONCLUSIONI SCIENTIFICHE PRESENTATE DALL'EMEA 1 CONCLUSIONI SCIENTIFICHE PRESENTATE DALL EMEA RIASSUNTO COMPLESSIVO DELLA VALUTAZIONE SCIENTIFICA DI RESCUPASE Qualità Si ritiene che la qualità
ALLEGATO CONCLUSIONI SCIENTIFICHE PRESENTATE DALL'EMEA 1 CONCLUSIONI SCIENTIFICHE PRESENTATE DALL EMEA RIASSUNTO COMPLESSIVO DELLA VALUTAZIONE SCIENTIFICA DI RESCUPASE Qualità Si ritiene che la qualità
Gestione e follow-up del paziente con degenerazione maculare
 Gestione e follow-up del paziente con degenerazione maculare Ranibizumab: linee guida Mean change in VA (letters) Mean change in VA (letters) I migliori risultati si hanno con un trattamento più frequente
Gestione e follow-up del paziente con degenerazione maculare Ranibizumab: linee guida Mean change in VA (letters) Mean change in VA (letters) I migliori risultati si hanno con un trattamento più frequente
 www.fisiokinesiterapia.biz DIABETE MELLITO Ne sono affetti 14 milioni di americani Ogni anno 8.000 individui vanno incontro a cecità da retinopatia Patogenesi Elevati livelli glicemici potrebbero danneggiare
www.fisiokinesiterapia.biz DIABETE MELLITO Ne sono affetti 14 milioni di americani Ogni anno 8.000 individui vanno incontro a cecità da retinopatia Patogenesi Elevati livelli glicemici potrebbero danneggiare
MONOGRAFIA SINTESI. IBRANCE (palbociclib) Carcinoma Mammario. A cura della Commissione Terapeutica Oncologica
 MONOGRAFIA SINTESI IBRANCE (palbociclib) Carcinoma Mammario A cura della Commissione Terapeutica Oncologica 1 SINTESI DELLA VALUTAZIONE 1.1 SINTESI DELLE EVIDENZE Palbociclib è indicato per il trattamento
MONOGRAFIA SINTESI IBRANCE (palbociclib) Carcinoma Mammario A cura della Commissione Terapeutica Oncologica 1 SINTESI DELLA VALUTAZIONE 1.1 SINTESI DELLE EVIDENZE Palbociclib è indicato per il trattamento
SCHEDA FARMACO. (a cura di UOS Farmacoeconomia e HTA, Area Centro. Nepafenac. Prezzo: 18,50 euro. Regime rimborsabilità: H
 SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Nepafenac (nevanac)
SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Nepafenac (nevanac)
Questa scheda informativa è destinata ai genitori del bambino/a affetto da Retinopatia del Pretermine o agli aventi diritto
 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLA RETINOPATIA DEL PRETERMINE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE Redatte dal Gruppo di Studio Italiano per la Retinopatia
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLA RETINOPATIA DEL PRETERMINE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE Redatte dal Gruppo di Studio Italiano per la Retinopatia
per uso intravitreale
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.224 relativo a: FLIBERCEPT per uso intravitreale ggiornamento Luglio
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.224 relativo a: FLIBERCEPT per uso intravitreale ggiornamento Luglio
SCHEDA FARMACO. Principio attivo (nome commerciale) Ponatinib. (Iclusig) 30 cpr da 45 mg 60cpr da 15 mg
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Ponatinib SCHEDA FARMACO (Iclusig) 30 cpr da 45 mg 60cpr da 15 mg Posologia: La dose
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Ponatinib SCHEDA FARMACO (Iclusig) 30 cpr da 45 mg 60cpr da 15 mg Posologia: La dose
Documento PTR n. 167 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n. 167 relativo a: DESAMETASONE IMPIANTO INTRAVITREALE Settembre 2012
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n. 167 relativo a: DESAMETASONE IMPIANTO INTRAVITREALE Settembre 2012
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*.
EFFICACIA E SICUREZZA DEI TRATTAMENTI DISPONIBILI PER L EDEMA MACULARE DIABETICO. a cura della Dr.ssa Mariarosanna De Fina
 EFFICACIA E SICUREZZA DEI TRATTAMENTI DISPONIBILI PER L EDEMA MACULARE DIABETICO a cura della Dr.ssa Mariarosanna De Fina BACKGROUND La Degenerazione Maculare (MD) è una malattia retinica che provoca un
EFFICACIA E SICUREZZA DEI TRATTAMENTI DISPONIBILI PER L EDEMA MACULARE DIABETICO a cura della Dr.ssa Mariarosanna De Fina BACKGROUND La Degenerazione Maculare (MD) è una malattia retinica che provoca un
Presidente Dott. A. Galan. Roma, 3 novembre Chiar.mo Prof. Luca Pani Direttore Generale AIFA. Vicepresidente Dott. L.
 Roma, 3 novembre 2015 Chiar.mo Prof. Luca Pani Direttore Generale AIFA Gent.ma Dr.ssa Patrizia Popoli della Commissione Consultiva Tecnico Scientifica (CTS) Egregio Dottor Pani, le scriviamo in merito
Roma, 3 novembre 2015 Chiar.mo Prof. Luca Pani Direttore Generale AIFA Gent.ma Dr.ssa Patrizia Popoli della Commissione Consultiva Tecnico Scientifica (CTS) Egregio Dottor Pani, le scriviamo in merito
Ritrattamento con Ranibizumab intravitreale della Degenerazione Maculare Legata all Età
 Bollettino della Società Medico Chirurgica di Pavia 126(1):199-205 Comunicazione presentata all adunanza del 29 gennaio 2013 Ritrattamento con Ranibizumab intravitreale della Degenerazione Maculare Legata
Bollettino della Società Medico Chirurgica di Pavia 126(1):199-205 Comunicazione presentata all adunanza del 29 gennaio 2013 Ritrattamento con Ranibizumab intravitreale della Degenerazione Maculare Legata
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
Documento PTR n. 167 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n. 167 relativo a: DESAMETASONE IMPIANTO INTRAVITREALE Agg. Maggio
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n. 167 relativo a: DESAMETASONE IMPIANTO INTRAVITREALE Agg. Maggio
REPORT HTA REGIONALE REGISTRO AIFA: NO. MODALITA PRESCRITTIVE: Osp-uso ospedaliero.
 REPORT HTA REGIONALE Decisioni CTR Data riunione: 20/12/2011 Decisione: Inserito con compilazione della scheda di monitoraggio regionale. Nota ufficiale: La prescrizione dovrà avvenire previa compilazione
REPORT HTA REGIONALE Decisioni CTR Data riunione: 20/12/2011 Decisione: Inserito con compilazione della scheda di monitoraggio regionale. Nota ufficiale: La prescrizione dovrà avvenire previa compilazione
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE
 Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008 Terzo Aggiornamento Aprile 2011 Quarto Aggiornamento - Ottobre 2012 Quinto
Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008 Terzo Aggiornamento Aprile 2011 Quarto Aggiornamento - Ottobre 2012 Quinto
DOMUS NOVA Ospedale Privato Accreditato. SAN FRANCESCO Ospedale Privato Accreditato. Gentile Sig./Sig.ra
 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE C079 Rev.0 data applicazione 16/10/2018 Pag. 1 a 5 Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE C079 Rev.0 data applicazione 16/10/2018 Pag. 1 a 5 Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento
Coccaglio (BS), 2 Marzo 2018 LA PROGRAMMAZIONE DELLA GRAVIDANZA NELLA DONNA CON DIABETE PREGESTAZIONALE COMPLICATO. L. Giannì
 Coccaglio (BS), 2 Marzo 2018 LA PROGRAMMAZIONE DELLA GRAVIDANZA NELLA DONNA CON DIABETE PREGESTAZIONALE COMPLICATO LA GRAVIDANZA NELLA PAZIENTE COMPLICATA DA RETINOPATIA DIABETICA I SESSIONE L. Giannì
Coccaglio (BS), 2 Marzo 2018 LA PROGRAMMAZIONE DELLA GRAVIDANZA NELLA DONNA CON DIABETE PREGESTAZIONALE COMPLICATO LA GRAVIDANZA NELLA PAZIENTE COMPLICATA DA RETINOPATIA DIABETICA I SESSIONE L. Giannì
Neuropatia Ottica Ischemica Anteriore Diagnosi Differenziale Terapia
 Neuropatia Ottica Ischemica Anteriore Diagnosi Differenziale Terapia Fai clic per aggiungere del testo Dott.ssa Eleonora Baldi UO Neurologia Dip Neuroscienze/Riabilitazione AOU S.Anna Diagnosi differenziale
Neuropatia Ottica Ischemica Anteriore Diagnosi Differenziale Terapia Fai clic per aggiungere del testo Dott.ssa Eleonora Baldi UO Neurologia Dip Neuroscienze/Riabilitazione AOU S.Anna Diagnosi differenziale
La degenerazione maculare neovascolare nella miopia patologica
 La degenerazione maculare neovascolare nella miopia patologica Passato, presente e futuro Breve riepilogo La neovascolarizzazione coroidale (CNV) è uno delle più importanti complicanze della miopia patologica
La degenerazione maculare neovascolare nella miopia patologica Passato, presente e futuro Breve riepilogo La neovascolarizzazione coroidale (CNV) è uno delle più importanti complicanze della miopia patologica
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF
 giunta regionale Allegato A al Decreto n. 97 del 8 agosto 2017 pag. 1/17 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Linee di indirizzo regionali per l impiego dei farmaci intravitreali
giunta regionale Allegato A al Decreto n. 97 del 8 agosto 2017 pag. 1/17 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Linee di indirizzo regionali per l impiego dei farmaci intravitreali
DEGENERAZIONE MACULARE SENILE
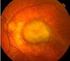 DEGENERAZIONE MACULARE SENILE La degenerazione maculare senile è ad oggi nei Paesi Occidentali, la principale causa di abbassamento progressivo ed irreversibile della capacità visiva nelle persone con
DEGENERAZIONE MACULARE SENILE La degenerazione maculare senile è ad oggi nei Paesi Occidentali, la principale causa di abbassamento progressivo ed irreversibile della capacità visiva nelle persone con
REPORT DI VALUTAZIONE AFLIBERCEPT
 REPORT DI VALUTAZIONE AFLIBERCEPT Aflibercept (Eylea flac.no) richiesto dal dott. Roberto Fozzer (U.O. Oculistica Ospedale Trento) con la seguente motivazione: il trattamento negli adulti della degenerazione
REPORT DI VALUTAZIONE AFLIBERCEPT Aflibercept (Eylea flac.no) richiesto dal dott. Roberto Fozzer (U.O. Oculistica Ospedale Trento) con la seguente motivazione: il trattamento negli adulti della degenerazione
La Retinopatia Diabetica. Edoardo Midena Università degli Studi di Padova
 La Retinopatia Diabetica Edoardo Midena Università degli Studi di Padova Il diabete mellito Diabete mellito: l epidemia del XXI secolo 439 milioni diabetici nel 2030 Un nuovo diabetico ogni 9,9 secondi
La Retinopatia Diabetica Edoardo Midena Università degli Studi di Padova Il diabete mellito Diabete mellito: l epidemia del XXI secolo 439 milioni diabetici nel 2030 Un nuovo diabetico ogni 9,9 secondi
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
DALLA FARMACOVIGILANZA AGLI INTERVENTI REGOLATORI
 Farmacovigilanza, FAD e farmacisti: i risultati del Progetto della Regione Toscana DALLA FARMACOVIGILANZA AGLI INTERVENTI REGOLATORI Loredano Giorni Monteriggioni, Il Piccolo Castello Hotel, 9 Maggio 2009
Farmacovigilanza, FAD e farmacisti: i risultati del Progetto della Regione Toscana DALLA FARMACOVIGILANZA AGLI INTERVENTI REGOLATORI Loredano Giorni Monteriggioni, Il Piccolo Castello Hotel, 9 Maggio 2009
Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali
 Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
I T A L I A N J O U R N A L O F P U B L I C H E A L T H. Aspetti biotecnologici di Lucentis. Maria Cristina Parravano, Monica Varano
 Aspetti biotecnologici di Lucentis Maria Cristina Parravano, Monica Varano Il ranibizumab (Lucentis) Ranibizumab (Lucentis) è un frammento di un anticorpo monoclonale ricombinante umanizzato diretto contro
Aspetti biotecnologici di Lucentis Maria Cristina Parravano, Monica Varano Il ranibizumab (Lucentis) Ranibizumab (Lucentis) è un frammento di un anticorpo monoclonale ricombinante umanizzato diretto contro
MINI-REPORT - Tafluprost
 MINI-REPORT - Tafluprost PRINCIPIO ATTIVO: Tafluprost NOME COMMERCIALE: Saflutan (Merck Sharp & Dohme) FORMULAZIONE: collirio monodose- 30 fl 15 mcg/ml 0,3-priva di conservante (unico in commercio in Italia)
MINI-REPORT - Tafluprost PRINCIPIO ATTIVO: Tafluprost NOME COMMERCIALE: Saflutan (Merck Sharp & Dohme) FORMULAZIONE: collirio monodose- 30 fl 15 mcg/ml 0,3-priva di conservante (unico in commercio in Italia)
Farmaco più prescritto al mondo
 Farmaco più prescritto al mondo Farmaco diversamente giovane Facciamo il punto su nella fase acuta MANO Mortalità (%) 13,2 ASA riduce mortalità ad 1 mese 10,4 10,7 8 Placebo + placebo Placebo + ASA Placebo
Farmaco più prescritto al mondo Farmaco diversamente giovane Facciamo il punto su nella fase acuta MANO Mortalità (%) 13,2 ASA riduce mortalità ad 1 mese 10,4 10,7 8 Placebo + placebo Placebo + ASA Placebo
CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA
 CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA Venezia, venerdì 7 dicembre 2012 TEST DI APPRENDIMENTO Il test si supera se le risposte esatte sono 25 sul totale dei 31 quesiti. Barrare una sola
CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA Venezia, venerdì 7 dicembre 2012 TEST DI APPRENDIMENTO Il test si supera se le risposte esatte sono 25 sul totale dei 31 quesiti. Barrare una sola
Anticorpo. Chimerico. Murino mab. Umanizzato. ..tinib 18/05/09. Totalmente umano
 Anticorpo Murino mab Chimerico ximab Umanizzato zumab Totalmente umano mumab..tinib Anticorpi monoclonali anti EGFR Vengono somministrati per via endovenosa ogni settimana o ogni 2 Sono specifiche per
Anticorpo Murino mab Chimerico ximab Umanizzato zumab Totalmente umano mumab..tinib Anticorpi monoclonali anti EGFR Vengono somministrati per via endovenosa ogni settimana o ogni 2 Sono specifiche per
Milano 15 settembre Dr. Enrico Franciosi
 Milano 15 settembre 2012 Dr. Enrico Franciosi 1 OSPEDALE FATEBENEFRATELLI E OFTALMICO Azienda Ospedaliera di Rilievo Nazionale C.so di Porta Nuova 23 20121 Milano U.C. Diabetologia e malattie del metabolismo
Milano 15 settembre 2012 Dr. Enrico Franciosi 1 OSPEDALE FATEBENEFRATELLI E OFTALMICO Azienda Ospedaliera di Rilievo Nazionale C.so di Porta Nuova 23 20121 Milano U.C. Diabetologia e malattie del metabolismo
! Per i clinici è frequente andare incontro a delle difficoltà nel tradurre i risultati della ricerca sperimentale sulle terapie nella loro pratica
 ! Per i clinici è frequente andare incontro a delle difficoltà nel tradurre i risultati della ricerca sperimentale sulle terapie nella loro pratica clinica.! I risultati dei clinical trial sono descritti
! Per i clinici è frequente andare incontro a delle difficoltà nel tradurre i risultati della ricerca sperimentale sulle terapie nella loro pratica clinica.! I risultati dei clinical trial sono descritti
Sinossi Studio MAS TITOLO DELLO STUDIO CODICE DELLO STUDIO
 Sinossi Studio MAS TITOLO DELLO STUDIO CODICE DELLO STUDIO SPONSOR BACKGROUND E RAZIONALE Misura dei livelli di anticoagulazione in pazienti con fibrillazione atriale in trattamento con farmaci anticoagulanti
Sinossi Studio MAS TITOLO DELLO STUDIO CODICE DELLO STUDIO SPONSOR BACKGROUND E RAZIONALE Misura dei livelli di anticoagulazione in pazienti con fibrillazione atriale in trattamento con farmaci anticoagulanti
SCHEDA FARMACO Decitabina (Dacogen)
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO Decitabina (Dacogen) Dacogen 50 mg polvere per concentrato per soluzione
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO Decitabina (Dacogen) Dacogen 50 mg polvere per concentrato per soluzione
Eylea. aflibercept. Che cos'è Eylea? Per che cosa si usa Eylea? Riassunto destinato al pubblico
 EMA/677928/2015 EMEA/H/C/002392 Riassunto destinato al pubblico aflibercept Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/677928/2015 EMEA/H/C/002392 Riassunto destinato al pubblico aflibercept Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11
 Allegato B ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11 REGIONE: Sardegna RESPONSABILI TECNICO-SCIENTIFICO DEL PROGETTO nome: Michela cognome: Pellecchia
Allegato B ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11 REGIONE: Sardegna RESPONSABILI TECNICO-SCIENTIFICO DEL PROGETTO nome: Michela cognome: Pellecchia
farmaci per uso intravitreale
 farmaci per uso intravitreale Carlo Incorvaia Dipartimento di Scienze Biomediche e Chirurgico-Specialistiche Sezione di Clinica Oculistica Antonio Rossi Direttore: P. Perri Arcispedale S.Anna 4 marzo 2017
farmaci per uso intravitreale Carlo Incorvaia Dipartimento di Scienze Biomediche e Chirurgico-Specialistiche Sezione di Clinica Oculistica Antonio Rossi Direttore: P. Perri Arcispedale S.Anna 4 marzo 2017
Corte di Giustizia Popolare per il Diritto alla Salute. Tavolo Tecnico Cataratta e Maculopatia 20 Marzo 2014
 Corte di Giustizia Popolare per il Diritto alla Salute Tavolo Tecnico Cataratta e Maculopatia 20 Marzo 2014 INDICE Contesto ed epidemiologia Il percorso del paziente Gestione appropriata e sostenibilità:
Corte di Giustizia Popolare per il Diritto alla Salute Tavolo Tecnico Cataratta e Maculopatia 20 Marzo 2014 INDICE Contesto ed epidemiologia Il percorso del paziente Gestione appropriata e sostenibilità:
Terapia antiaggregante: quando?
 La clinica nel Diabete Terapia antiaggregante: quando? Massimo Marci U.O.C. di Medicina Interna e Geriatria Ospedale San Giovanni Evangelista - Tivoli A.S.L. Roma 5 Tivoli Terme, 30 settembre 2017 Terapia
La clinica nel Diabete Terapia antiaggregante: quando? Massimo Marci U.O.C. di Medicina Interna e Geriatria Ospedale San Giovanni Evangelista - Tivoli A.S.L. Roma 5 Tivoli Terme, 30 settembre 2017 Terapia
AIFA - Agenzia Italiana del Farmaco
 Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
SCHEDA INFORMATIVA ED ATTO DI CONSENSO PER LA SOMMINISTRAZIONE DI FARMACI PER VIA INTRAVITREALE
 Dr. Dario Surace Medico Chirurgo - Oculista Specialista Direttore U.O.Oculistica - Ospedale di Rovereto SCHEDA INFORMATIVA ED ATTO DI CONSENSO PER LA SOMMINISTRAZIONE DI FARMACI PER VIA INTRAVITREALE Gentile
Dr. Dario Surace Medico Chirurgo - Oculista Specialista Direttore U.O.Oculistica - Ospedale di Rovereto SCHEDA INFORMATIVA ED ATTO DI CONSENSO PER LA SOMMINISTRAZIONE DI FARMACI PER VIA INTRAVITREALE Gentile
Laser-terapia. Terapia della retinopatia diabetica: quando e come. G. Addabbo. Bari, 7-10 novembre 2013
 Terapia della retinopatia diabetica: quando e come Laser-terapia G. Addabbo Bari, 7-10 novembre 2013 ASL TA P.O. Centrale Stabilimento San G. Moscati S.C. di Oftalmologia Cos è il laser Ligth Amplification
Terapia della retinopatia diabetica: quando e come Laser-terapia G. Addabbo Bari, 7-10 novembre 2013 ASL TA P.O. Centrale Stabilimento San G. Moscati S.C. di Oftalmologia Cos è il laser Ligth Amplification
Stefano Miglior. Il glaucoma neovascolare SMI
 Stefano Miglior Il glaucoma neovascolare Glaucoma Neovascolare e un glaucoma secondario ad angolo chiuso Inizialmente una membrana fibrovascolare si sviluppa davanti al trabecolato a tal punto l angolo
Stefano Miglior Il glaucoma neovascolare Glaucoma Neovascolare e un glaucoma secondario ad angolo chiuso Inizialmente una membrana fibrovascolare si sviluppa davanti al trabecolato a tal punto l angolo
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab.
Medicina di genere e appropriatezza nel setting della Medicina Generale e Cure Primarie
 Medicina di genere e appropriatezza nel setting della Medicina Generale e Cure Primarie Dr Marchi Rita Medico di Medicina Generale Presidente S.I.M.G di Ferrara 24 settembre 2016 Dati ISTAT 2012-2013,
Medicina di genere e appropriatezza nel setting della Medicina Generale e Cure Primarie Dr Marchi Rita Medico di Medicina Generale Presidente S.I.M.G di Ferrara 24 settembre 2016 Dati ISTAT 2012-2013,
Fattori di rischio comuni a uomini e donne
 Uomini e donne: affari di cuore Varese, 3 Dicembre 2014 Fattori di rischio comuni a uomini e donne Andrea M. Maresca Dipartimento di Medicina Clinica e Sperimentale Università degli Studi dell Insubria
Uomini e donne: affari di cuore Varese, 3 Dicembre 2014 Fattori di rischio comuni a uomini e donne Andrea M. Maresca Dipartimento di Medicina Clinica e Sperimentale Università degli Studi dell Insubria
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
PEGAPTANIB (Rivalutazione del 07 aprile 2009) (07-04-2009)
 PEGAPTANIB (Rivalutazione del 07 aprile 2009) (07-04-2009) Specialità: MACUGEN (PFIZER) Forma farmaceutica: 1 siringa 0.3 mg - Prezzo: euro 1.122 ATC: S01LA03 Categoria terapeutica: Sostanze antineovascolarizzanti
PEGAPTANIB (Rivalutazione del 07 aprile 2009) (07-04-2009) Specialità: MACUGEN (PFIZER) Forma farmaceutica: 1 siringa 0.3 mg - Prezzo: euro 1.122 ATC: S01LA03 Categoria terapeutica: Sostanze antineovascolarizzanti
RISPOSTA E RESISTENZA:QUANDO FERMARSI? RAFFAELE FORMICOLA MICHELE MELILLO C.D.C. FABIA MATER ROMA OPI NAPOLI 2016
 RISPOSTA E RESISTENZA:QUANDO FERMARSI? RAFFAELE FORMICOLA MICHELE MELILLO C.D.C. FABIA MATER ROMA OPI NAPOLI 2016 L antivegf rappresenta la terapia a lungo termine maggiormente impiegata dell amd neovascolare*
RISPOSTA E RESISTENZA:QUANDO FERMARSI? RAFFAELE FORMICOLA MICHELE MELILLO C.D.C. FABIA MATER ROMA OPI NAPOLI 2016 L antivegf rappresenta la terapia a lungo termine maggiormente impiegata dell amd neovascolare*
Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici
 Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici Gruppo Multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia Romagna C. Salvarani,
Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici Gruppo Multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia Romagna C. Salvarani,
Trapianto di cellule dell epitelio pigmentato retinico nella malattia di Stargardt
 Trapianto di cellule dell epitelio pigmentato retinico nella malattia di Stargardt E in corso di pubblicazione sulla rivista Ophthalmology un articolo che descrive i risultati ottenuti con il trapianto
Trapianto di cellule dell epitelio pigmentato retinico nella malattia di Stargardt E in corso di pubblicazione sulla rivista Ophthalmology un articolo che descrive i risultati ottenuti con il trapianto
AGENZIA ITALIANA DEL FARMACO
 AGENZIA ITALIANA DEL FARMACO DETERMINA 28 aprile 2017 Inserimento di una indicazione terapeutica del medicinale per uso umano «Bevacizumab Avastin» nell'elenco ex lege n. 648/1996 parziale modifica alla
AGENZIA ITALIANA DEL FARMACO DETERMINA 28 aprile 2017 Inserimento di una indicazione terapeutica del medicinale per uso umano «Bevacizumab Avastin» nell'elenco ex lege n. 648/1996 parziale modifica alla
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 59 Conclusioni scientifiche Informazioni di base Ponatinib è un inibitore delle tirosin-chinasi (Tyrosine Kinase Inhibitor, TKI), concepito per inibire l attività tirosin-chinasica
Allegato IV Conclusioni scientifiche 59 Conclusioni scientifiche Informazioni di base Ponatinib è un inibitore delle tirosin-chinasi (Tyrosine Kinase Inhibitor, TKI), concepito per inibire l attività tirosin-chinasica
Medicinale non più autorizzato. Allegato I
 Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI METILAMINOLEVULINATO L01XD (Metvix ) Presentata da Commissione Terapeutica Provinciale di Cagliari In data novembre 2008 Per le seguenti motivazioni: Terapia delle neoplasie
RICHIESTA DI INSERIMENTO IN PTR DI METILAMINOLEVULINATO L01XD (Metvix ) Presentata da Commissione Terapeutica Provinciale di Cagliari In data novembre 2008 Per le seguenti motivazioni: Terapia delle neoplasie
La BPCO e le comorbilità. Federico Sciarra
 La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
Effetti degli NSAIDs sulla pressione arteriosa
 Effetti degli NSAIDs sulla pressione arteriosa Le malattie cardiovascolari sono le cause più comuni di morte nel mondo e la valutazione dell ipertensione è uno dei parametri più importanti da valutare.
Effetti degli NSAIDs sulla pressione arteriosa Le malattie cardiovascolari sono le cause più comuni di morte nel mondo e la valutazione dell ipertensione è uno dei parametri più importanti da valutare.
MALATTIE DELL APPARATO VISIVO Direttore: Prof. Luciano Cerulli L EPIDEMIOLOGIA NAZIONALE DELLE MALATTIE DELLA VISTA
 U UNIVERSITÀ TOR VERGATA DI ROMA MALATTIE DELL APPARATO VISIVO Direttore: Prof. Luciano Cerulli L EPIDEMIOLOGIA NAZIONALE DELLE MALATTIE DELLA VISTA DEFINIZIONE DI CECITÀ MACULOPATIE VISUS < 1/20 IN AMBEDUE
U UNIVERSITÀ TOR VERGATA DI ROMA MALATTIE DELL APPARATO VISIVO Direttore: Prof. Luciano Cerulli L EPIDEMIOLOGIA NAZIONALE DELLE MALATTIE DELLA VISTA DEFINIZIONE DI CECITÀ MACULOPATIE VISUS < 1/20 IN AMBEDUE
Schema dello studio clinico di Fase 2b
 Sommario dei risultati dello studio clinico di Fase 2b di Ataluren presentato in occasione dell American Academy of Neurology Meeting il 16 Aprile 2010 Toronto, 16 Aprile 2010 - Un nuovo farmaco sperimentale
Sommario dei risultati dello studio clinico di Fase 2b di Ataluren presentato in occasione dell American Academy of Neurology Meeting il 16 Aprile 2010 Toronto, 16 Aprile 2010 - Un nuovo farmaco sperimentale
Capitolo 3.2. La valutazione economica dei Nuovi Anticoagulanti Orali (NOACs) nella prevenzione di ictus in pazienti con fibrillazione atriale (SPAF)
 La valutazione economica dei Nuovi Anticoagulanti Orali (NOACs) nella prevenzione di ictus in pazienti con fibrillazione atriale (SPAF) Analisi di Budget Impact a livello nazionale e regionale 159 Analisi
La valutazione economica dei Nuovi Anticoagulanti Orali (NOACs) nella prevenzione di ictus in pazienti con fibrillazione atriale (SPAF) Analisi di Budget Impact a livello nazionale e regionale 159 Analisi
I FARMACI ANTIANGIOGENETICI profilo di tossicità e selezione dei pazienti. Cristiano Oliva
 I FARMACI ANTIANGIOGENETICI profilo di tossicità e selezione dei pazienti Cristiano Oliva AntiAngiogentici g nella pratica Bevacizumab (2017): N= 804 Ziv aflibercept 6 Regorafenib 4 Ramucirumab 4 52 (41
I FARMACI ANTIANGIOGENETICI profilo di tossicità e selezione dei pazienti Cristiano Oliva AntiAngiogentici g nella pratica Bevacizumab (2017): N= 804 Ziv aflibercept 6 Regorafenib 4 Ramucirumab 4 52 (41
UNA ATTENTA VALUTAZIONE DI BASE NELLA DMLE NEOVASCOLARE E FONDAMENTALE PER SCEGLIERE L APPROCCIO TERAPEUTICO PIU IDONEO
 UNA ATTENTA VALUTAZIONE DI BASE NELLA DMLE NEOVASCOLARE E FONDAMENTALE PER SCEGLIERE L APPROCCIO TERAPEUTICO PIU IDONEO A cura di Massimo Nicolò e Daniela Zoli Negli ultimi anni, la gestione e il trattamento
UNA ATTENTA VALUTAZIONE DI BASE NELLA DMLE NEOVASCOLARE E FONDAMENTALE PER SCEGLIERE L APPROCCIO TERAPEUTICO PIU IDONEO A cura di Massimo Nicolò e Daniela Zoli Negli ultimi anni, la gestione e il trattamento
ATTO D ACQUISTO N. 6/SPE DEL
 ATTO D ACQUISTO OGGETTO: Fornitura annuale, dalla data del presente atto, del farmaco OZURDEX 700 mcg. impianto intravitreale (p.a. Desametasone) Il Direttore di Farmacia Ospedaliera, Dottoressa Daniela
ATTO D ACQUISTO OGGETTO: Fornitura annuale, dalla data del presente atto, del farmaco OZURDEX 700 mcg. impianto intravitreale (p.a. Desametasone) Il Direttore di Farmacia Ospedaliera, Dottoressa Daniela
SAN FRANCESCO Ospedale Privato Accreditato. DOMUS NOVA Ospedale Privato Accreditato. Gentile Sig./Sig.ra. Lei è affetto da
 C025 Rev.1 data applicazione 12/03/2019 Pag. 1 a 8 Approvato dalla Società Oftalmologica Italiana - Giugno 2013 Primo Aggiornamento Luglio 2014 Secondo Aggiornamento Marzo 2015 Terzo Aggiornamento Gennaio
C025 Rev.1 data applicazione 12/03/2019 Pag. 1 a 8 Approvato dalla Società Oftalmologica Italiana - Giugno 2013 Primo Aggiornamento Luglio 2014 Secondo Aggiornamento Marzo 2015 Terzo Aggiornamento Gennaio
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE. MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE
 MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Giugno 2013 Lei è affetto in OD/OS/OO da Gentile Sig./Sig.ra Questa scheda
MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Giugno 2013 Lei è affetto in OD/OS/OO da Gentile Sig./Sig.ra Questa scheda
IIMPIANTO INTRAVITREALE DI DESAMETASONE PER IL TRATTAMENTO DELL EDEMA MACULARE E DELL INFIAMMAZIONE DOPO CHIRURGIA EPISCLERALE
 IIMPIANTO INTRAVITREALE DI DESAMETASONE PER IL TRATTAMENTO DELL EDEMA MACULARE E DELL INFIAMMAZIONE DOPO CHIRURGIA EPISCLERALE M FALLICO, V DE GRANDE, S FICHERA, M REIBALDI, V BONFIGLIO Paziente: donna,
IIMPIANTO INTRAVITREALE DI DESAMETASONE PER IL TRATTAMENTO DELL EDEMA MACULARE E DELL INFIAMMAZIONE DOPO CHIRURGIA EPISCLERALE M FALLICO, V DE GRANDE, S FICHERA, M REIBALDI, V BONFIGLIO Paziente: donna,
Riabilitazione dopo sindrome coronarica acuta
 Riabilitazione dopo sindrome coronarica acuta INTRODUZIONE Le malattie cardiovascolari sono la causa principale di morte e disabilità in tutti i paesi del mondo occidentale,inclusa l Italial Le malattie
Riabilitazione dopo sindrome coronarica acuta INTRODUZIONE Le malattie cardiovascolari sono la causa principale di morte e disabilità in tutti i paesi del mondo occidentale,inclusa l Italial Le malattie
Allegato III. Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Una Medicina su Misura
 2 aprile 2011 Una Medicina su Misura Ogni paziente ha la sua Malattia Dott.ssa Sara Mazzoldi Una Medicina su Misura per In questa parte prenderemo in esame 3 tipi di pazienti: paziente con diabete mellito
2 aprile 2011 Una Medicina su Misura Ogni paziente ha la sua Malattia Dott.ssa Sara Mazzoldi Una Medicina su Misura per In questa parte prenderemo in esame 3 tipi di pazienti: paziente con diabete mellito
