Struttura delle proteine
|
|
|
- Alfredo Bono
- 8 anni fa
- Visualizzazioni
Transcript
1 Struttura delle proteine
2 Nelle proteine vi sono quattro livelli di organizzazione strutturale
3 Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti derivano da combinazioni diverse dei 20 aminoacidi naturali
4 Perché è estremamente importante conoscere la struttura primaria di una proteina: - La sequenza amminoacidica è l anello che congiunge il messaggio genetico sul DNA e la struttura tridimensionale direttamente correlata alla funzione biologica di una proteina Quindi la funzione di una proteina dipende dalla struttura primaria - Per comprendere il meccanismo di azione - Possibilità di costruire in laboratorio peptidi e proteine difficilmente estraibili da materiali biologici - Alterazioni della sequenza primaria possono produrre anomalie di funzione e malattie - Per studiare le correlazioni evolutive tra le diverse specie
5 Variazioni della struttura primaria di una proteina possono provocare stati patologici Es. Anemia falciforme L emoglobina è costituita da 4 catene: 2 catene α di 141 AA 2 catene β di 146 AA Nei malati di anemia falciforme un residuo di acido glutammico (polare) nella catena β è sostituito da un residuo di valina (apolare) a causa di un errore genetico Emoglobina normale.val-his-leu-thr-pro-glu-gly-lys. Emoglobina anormale.val-his-leu-thr-pro-val-gly-lys. tratto di catena β dell emoglobina
6 Piccole differenze nella struttura primaria implicano funzioni biologiche completamente diverse Es.: ossitocina e vasopressina sono due oligopeptidi con struttura molto simile e funzioni biologiche ed usi molto differenti OSSITOCINA S S Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH2 Causa la contrazione dell utero Causa la produzione del latte dalle ghiandole mammarie Viene somministrato per indurre il parto VASOPRESSINA S S Cys-Tyr-Phe-Gln-Asn-Cys-Pro-Arg-Gly-NH2 Regola il riassorbimento di acqua dalle urine Viene somministrato nel trattamento del diabete insipido (eccesso di produzione di urine)
7 L evoluzione degli organismi è legata a mutazioni spontanee che avvengono nei loro geni. Le differenze nella struttura primaria sono la memoria dei cambiamenti avvenuti a livello genetico nel corso dell evoluzione. In specie legate da notevole affinità le strutture primarie delle proteine comuni sono simili. Il Citocromo C è una buona proteina per studi evolutivi comparati perché si trova nella catena respiratoria di trasporto degli elettroni di tutti gli organismi. Quando le linee evolutive divergono aumenta il numero di differenze tra le sequenze. Albero filogenetico del Citocromo C
8 La duplicazione genica e le famiglie di proteine Proteine con funzioni analoghe presentano sequenze simili E molto probabile che queste sequenze siano evolute a partire da un progenitore comune Duplicazione genica: evento di ricombinazione genetica in cui un cromosoma acquisisce entrambe le copie del gene primordiale. Modalità evolutiva particolarmente efficiente poiché una copia del gene sviluppa una nuova funzione, mentre la sua controparte continua a dirigere la sintesi della proteina originale
9 Famiglia delle globine: esempio di evoluzione mediante duplicazione genica Emoglobina: tetramero α 2 β 2 ; trasporta ossigeno dai polmoni ai tessuti Mioglobina: monomero; consente la diffusione dell ossigeno nel tessuto muscolare Emoglobina fetale: tetramero α 2 γ 2 Emoglobina ε 2 ζ 2 : prodotta nelle prime fasi dell embriogenesi Emoglobina α 2 δ 2 : nei primati; rappresenta l 1% dell emoglobina totale dell adulto
10 STRUTTURA SECONDARIA La catena polipeptidica può assumere nello spazio strutture che hanno carattere di regolarità. Il carattere periodico e regolare dipende dal ripetersi nella catena della parte comune a tutti gli amminoacidi e che, impegnata nel legame peptidico, dà origine allo scheletro peptidico -NH-CH(R1)-CO-NH-CH(R2)-CO-
11 Il legame peptidico è POLARE, PLANARE e STABILIZZATO per RISONANZA Nella situazione intermedia gli elettroni sono coinvolti tra O carbonilico, C carbossilico e N ammidico La differenza di elettronegatività tra O e N conferisce polarità al legame peptidico; ciò rende possibile,la formazione di legami a H sia a livello di O che a livello di N
12 Il carattere di doppio legame parziale del legame peptidico impedisce, alle temperature fisiologiche, la rotazione del legame C-N, mentre è possibile la rotazione dei legami C α1 -C e C α2 -N Data la NON possibilità di rotazione intorno al legame CO-N si ha possibilità di isomeria cis trans
13 Delle due configurazioni possibili, la trans è quella favorita dal punto di vista energetico (minima repulsione sterica) Oltre il 99% dei legami peptidici delle proteine naturali hanno configurazione trans Fanno eccezione alcuni legami amidici in cui è coinvolto l N imidico della prolina
14 δ δ Le due configurazioni hanno contenuto energetico simile La configurazione trans è destabilizzata dalla repulsione sterica tra il carbonio δ dell anello pirrolidinico e la catena laterale del residuo aa adiacente
15 Nei solventi acquosi, e quindi anche nell ambiente cellulare, la catena polipeptidica assume strutture regolari e ripetitive (strutture elicoidali, strutture a pieghe) che comportano massima stabilità derivante da uno stato di minima energia interna della molecola; per il raggiungimento di questa condizione le strutture sono tali da consentire: 1.Minima repulsione sterica tra i gruppi delle catene laterali 2.Massima possibilità di formazione di legami a H
16 α-elica - può essere teoricamente destrorsa o sinistrorsa, ma sempre composta da L-aa - la sinistrorsa è meno stabile per motivi di ingombro sterico - l α-elica destrorsa è quella piu frequente nelle proteine naturali PASSO: distanza tra due posizioni equivalenti (una spira dell elica) = 0,54 nm; contiene 3,6 residui - ogni residuo prolunga l elica di 0,15 nm rispetto all asse longitudinale - ogni O carbonilico nello scheletro polipeptidico è unito mediante legame H con un H ammidico dell AA che si trova, lungo la catena polipeptidica, a 3 residui AA di distanza
17 RESIDUI AA PIU FREQUENTI NELLE α-eliche ALANINA LEUCINA piccoli o elettricamente neutri FENILALANINA RESIDUI AA POCO FREQUENTI NELLE α-eliche ARGININA A.GLUTAMMICO polari a ph fisiologico SERINA destabilizzano l elica LISINA La PROLINA interrompe l elica perché la sua struttura non può assumere la conformazione richiesta Alcune molecole proteiche sono interamente organizzate come α-elica Es.: le α-cheratine, costituenti principali della pelle e dei suoi annessi
18 STRUTTURA β A FOGLIETTO PIEGHETTATO - le catene polipeptidiche non sono avvolte a elica ma sono quasi completamente distese - la struttura è pieghettata a causa degli angoli di legame - O carbonilico e H ammidico sporgono quasi ad angolo retto rispetto all asse longitudinale della catena distesa - tra O carbonilico e H ammidico di due o più catene adiacenti si instaurano legami H che stabilizzano la struttura - le catene laterali dei vari residui amminoacidici sporgono alternativamente sopra e sotto il piano del foglietto pieghettato in modo che le catene laterali di residui adiacenti si trovino, rispetto al foglietto, su lati opposti il legame tra NH e C=O decorre nella stessa direzione il legame tra NH e C=O decorre in direzioni opposte
19 RESIDUI AA PRESENTI NELLE STRUTTURE β: - Predominano piccoli residui non polari (METIONINA, VALINA ISOLEUCINA) - sono meno frequenti gli AA con catene laterali polari o ingombranti - la PROLINA è talvolta presente ma tende a interrompere l andamento regolare della struttura producendo gomiti e inversioni di direzione
20 Ripiegamenti o anse: Presenti principalmente nelle proteine globulari. Provocano una inversione della direzione della catena polipeptidica. I ripiegamenti β uniscono segmenti consecutivi di un foglietto β antiparallelo. Il tipo II ha sempre un residuo di Gly nella terza posizione. La struttura è stabilizzata dal legame H tra il residuo 1 e il residuo 4
21 Considerando un singolo residuo AA, Cα funziona da perno unendo due piani ammidici adiacenti. L angolo di rotazione Cα-C=O è indicato con Ψ (psi), quello Cα-NH con Φ (phi). Gli angoli sono calcolati rispetto ad un piano di riferimento che contiene entrambi i legami ammidici (Ψ e Φ =0 ) conformazioni ideali (in cui non vi sono interazioni tra catene laterali) α-elica: Φ= -57 Ψ= -47 β- parallelo: Φ= -119 Ψ= +113 β-antiparallelo: Φ= -139 Ψ= +135
22 Oltre alla α-elica e alla struttura β, la flessibilità della catena rende possibili altre strutture meno regolari. La conformazione della catena polipeptidica in corrispondenza di un dato residuo è determinata dalla posizione reciproca assunta dai gruppi liberi di muoversi e da molte interazioni non covalenti.
23 In conformazioni diverse, c è un limite al numero delle combinazioni possibili dei due angoli di rotazione, perché alcune hanno effetti destabilizzanti a causa delle forze di repulsione tra gli O. Vi sono quindi conformazioni più stabili di altre perché favorite da un punto di vista energetico. Conformazioni proibite sono anche quelle in cui si svilupperebbe una forte repulsione tra le catene laterali Delle moltissime conformazioni teoricamente possibili per un residuo AA in una catena polipeptidica solo alcune sono stabili
24 Grafico di Ramachandran
25 STRUTTURA TERZIARIA Si origina dal ripiegamento nello spazio della catena polipeptidica, che assume una struttura tridimensionale Il ripiegamento avviene dopo che la catena ha già stabilite le sue strutture primaria e secondaria La struttura tridimensionale di una proteina appare come un groviglio casuale della catena, ma in realtà è predeterminata e dipende dalla struttura primaria La struttura terziaria di una proteina è quella che, tra le numerosissime possibili, ha il minor contenuto energetico che corrisponde alla massima stabilità della proteina
26 Un importante caratteristica della struttura terziaria è il ripiegamento a distanza, in conseguenza del quale residui AA molto distanti nella struttura primaria vengono a trovarsi vicini La proprietà di ripiegamento permette alla molecola proteica di avere uno o più siti a livello dei quali può legarsi con altre molecole Stretta correlazione con la funzione biologica Possibilità di modificare la conformazione per modificare la funzione
27 La struttura terziaria è stabilizzata da legami tra catene laterali di residui AA che si trovano spazialmente vicini LEGAME IONICO: tra gruppi che portano una carica netta positiva (residui ionizzati di lisina, arginina, istidina e gruppo NH2 terminale) e gruppi che portano una carica netta negativa (residui ionizzati di a.glutammico, a.aspartico, e gruppo COOH terminale) L energia del legame dipende fortemente dalla distanza tra il gruppo + e il gruppo che di solito è 2-3 Angstrom. Poiché l acqua ha una fortissima tendenza a rompere i legami ionici e quelli H la loro esistenza dipende in larga misura dall esclusione di contatti con il solvente acquoso. LEGAME H: tra gruppi donatori di H e gruppi accettori di H presenti nelle catene laterali. La capacità di formare legami H può dipendere dallo stato di ionizzazione del gruppo e quindi dal ph
28 LEGAME IDROFOBICO: tendenza delle catene laterali non polari ad unirsi tra loro in modo da offrire la minore superficie al solvente acquoso. Es.: catene laterali di alanina, valina, leucina, isoleucina, fenilalanina PONTE S-S: legame covalente. Importante nella stabilizzazione della struttura terziaria. Si forma quando, dopo che la proteina ha assunto la struttura terziaria, due gruppi SH vengono a trovarsi spazialmente vicini e si ossidano. La quantità di ponti S-S che si possono formare in una proteina dipende dal numero di residui di cisteina presenti e dalla loro disposizione spaziale. LEGAMI CON IONI METALLICI: in alcune proteine contenenti ioni metallici come Zn++, Cu++, Fe++, i legami coordinativi che questi ioni formano con catene laterali di AA possono avere un ruolo importante nel mantenimento della struttura terziaria
29 Sulla base dei diversi livelli strutturali assunti, le proteine sono classificate in FIBROSE e GLOBULARI Differenze strutturali e funzionali Differenti caratteristiche di idrosolubilità
30 PROTEINE FIBROSE La struttura secondaria è prevalente rispetto a livelli di organizzazione superiore Sono costituite da lunghe catene polipeptidiche disposte in lunghi fasci o foglietti Struttura estremamente ordinata Funzione di protezione e sostegno Rappresentano fino a 1/3 del peso in proteine dei vertebrati
31 Sono costituiti prevalentemente da proteine fibrose: Pelle Piume Capelli Corna PROTEZIONE Unghie Squame Cartilagine Tendini Ossa SOSTEGNO Insolubili in acqua perché costituite prevalentemente da AA con radicali idrofobici che sporgono verso l esterno della struttura
32
33 La permanente è il risultato di una serie di reazioni chimiche
34 Struttura del collageno Componente principale del tessuto connettivo (ossa, tendini, legamenti e vasi sanguigni). Ciascun filamento forma una conformazione elicoidale (sinistrorsa) e tre filamenti si avvolgono l uno intorno all altro (legami intercatena idrofobici e legami H). L effetto è la creazione di una proteina fibrosa di grande resistenza alla rottura, ma capacità di allungamento nulla
35 Elastina Principale costituente dei tendini Simile per composizione al collagene, ma possiede elasticità grazie alla presenza della DESMOSINA, presente solo in questo tipo di struttura La molecola della desmosina funziona da fulcro sul quale si innestano le catene di elastina
36 FIBROINA Costituente principale della seta e della tela di ragno Organizzata esclusivamente come struttura β I foglietti sono impilati in maniera estremamente ordinata La Fibroina è: FLESSIBILE perché le lamine sovrapposte sono unite tra loro da interazioni di Van der Waals fra le catene laterali RESISTENTE a causa dei legami H fra le catene adiacenti di ogni lamina e per l effetto globale delle forze di Van der Waals tra catene sovrapposte Le catene sono ricche di Ala e Gly. Le piccole catene laterali di questi due residui consentono un ammassamento perfetto degli strati di foglietti
37 PROTEINE GLOBULARI Assumono struttura terziaria e qualche volta quaternaria Sono macromolecole compatte di forma più o meno sferica Struttura meno ordinata delle fibrose con necessità di variare conformazione Funzione di trasporto catalisi tutte le proteine che intervengono nella regolazione delle attività della cellula
38 Sono proteine globulari: Enzimi Trasportatori di ossigeno e lipidi nel sangue Alcuni ormoni Recettori di membrana Anticorpi Sono proteine solubili nel citosol e nella fase lipidica delle membrane biologiche (la struttura tridimensionale può variare al variare dell ambiente in cui si trova) La struttura è caratterizzata da brevi tratti di α-elica e struttura β, collegate da tratti non organizzati in struttura secondaria
39
40 Albumina del siero umano PM AA
41 La struttura terziaria di una proteina può essere rappresentata in maniera diversa
42 Proteina G di Stafilococco Blu= N-terminale Rosso = C-terminale
43 AraC Trioso fosfato isomerasi
44 Struttura terziaria della mioglobina di capodoglio
45 STRUTTURE SUPERSECONDARIE (motivi, ripiegamenti) Livello strutturale intermedio tra la struttura secondaria e la terziaria Presenti nelle proteine globulari. Organizzazioni particolarmente stabili, correlate con la funzione
46 STRUTTURA QUATERNARIA Stabilisce il modo in cui due o più catene polipeptidiche si associano tramite interazioni non covalenti. La struttura che ne risulta è spesso detta OLIGOMERO e le catene polipeptidiche costituenti sono dette MONOMERI o PROTOMERI o SUBUNITA. I monomeri di una proteina oligomerica possono avere struttura primaria, secondaria e terziaria identiche o completamente diverse
47 CARATTERISTICHE: - il numero e il tipo di catene è programmato e definito - le subunità sono unite mediante legami H, ionici, idrofobici - i rapporti spaziali tra le subunità sono fissi - la geometria della molecola intera è definita - l unione delle subunità può permettere l insorgere di proprietà non possedute dai singoli monomeri - l unione o la separazione delle subunità può mediare la regolazione di alcuni processi cellulari
48 Struttura quaternaria della deossiemoglobina
49 La perdita della struttura di una proteina determina la perdita della sua funzione DENATURAZIONE La maggior parte delle proteine può essere denaturata con il calore, che altera i legami deboli, in particolare i legami H. La perdita della struttura avviene in maniera brusca ed in un intervallo molto ristretto di temperatura (ipotesi di meccanismo cooperativo). Il valore T m è caratteristico di ogni proteina.
50 Altri agenti denaturanti: valori di ph estremi: alterazioni dello stato di ionizzazione delle catene laterali, alterazioni della carica netta della proteina, che determinano repulsioni elettrostatiche e rottura di legami H solventi organici (alcool o acetone) urea idrocloruro di guanidina, detergenti alterazioni delle interazioni idrofobiche che stabilizzano il nucleo interno delle proteine globulari Lo stato denaturato cambia a seconda del denaturante usato e della proteina
51 LA DENATURAZIONE E UN PROCESSO REVERSIBILE Le proteine globulari, una volta denaturate, possono riacquistare la loro struttura nativa e la loro attività biologica se vengono riportate nelle condizioni in cui la conformazione attiva è stabile RINATURAZIONE E la prova più importante a supporto del concetto che la struttura terziaria di una proteina globulare è determinata dalla sua sequenza amminoacidica Rinaturazione della Ribonucleasi
52
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
PROTEINE. Amminoacidi
 PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 9
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 9 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 9 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Macromolecole Biologiche. I domini (I)
 I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
Macromolecole Biologiche. I domini (II)
 I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
Macromolecole Biologiche. I domini (III)
 I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini.
 I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
Modello del collasso idrofobico. Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60
 Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
Peptidi, proteine ed e nzim i i 1
 Peptidi, proteine ed enzimi 1 Gli amminoacidi possono formare catene Due amminoacidi possono unirsi tra loro attraverso il legame ammidico detto legame peptidico, tra il gruppo NH 2 di un amminoacido e
Peptidi, proteine ed enzimi 1 Gli amminoacidi possono formare catene Due amminoacidi possono unirsi tra loro attraverso il legame ammidico detto legame peptidico, tra il gruppo NH 2 di un amminoacido e
Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine.
 Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
Amminoacidi e Proteine
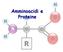 Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Regione cerniera monomero regione cerniera
 Regione cerniera Tutte le Ig, sia quelle secrete che quelle presenti sulla membrana plasmatica dei linfociti B, sono costituite da quattro catene proteiche, due pesanti (H, da heavy, in rosso nel disegno)
Regione cerniera Tutte le Ig, sia quelle secrete che quelle presenti sulla membrana plasmatica dei linfociti B, sono costituite da quattro catene proteiche, due pesanti (H, da heavy, in rosso nel disegno)
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 7
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 7 La struttura delle proteine Concetti chiave: La struttura terziaria di una proteina descrive il ripiegamentodei suoi elementi
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 7 La struttura delle proteine Concetti chiave: La struttura terziaria di una proteina descrive il ripiegamentodei suoi elementi
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
aa 2013-14 Proteine Struttura delle Proteine α Amminoacidi
 Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE
 Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
NUCLEOTIDI e ACIDI NUCLEICI
 NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
LE MOLECOLE INFORMAZIONALI. Lezioni d'autore Treccani
 LE MOLECOLE INFORMAZIONALI Lezioni d'autore Treccani Introduzione (I) I pionieri della biologia molecolare, scoperta la struttura degli acidi nucleici, pensarono di associare al DNA una sequenza di simboli,
LE MOLECOLE INFORMAZIONALI Lezioni d'autore Treccani Introduzione (I) I pionieri della biologia molecolare, scoperta la struttura degli acidi nucleici, pensarono di associare al DNA una sequenza di simboli,
Rappresentazione dei Dati Biologici
 Rappresentazione dei Dati Biologici CORSO DI BIOINFORMATICA C.d.L. Ingegneria Informatica e Biomedica Outline Proteine ed Amminoacidi Rappresentazione di Amminoacidi Rappresentazione delle strutture Proteiche
Rappresentazione dei Dati Biologici CORSO DI BIOINFORMATICA C.d.L. Ingegneria Informatica e Biomedica Outline Proteine ed Amminoacidi Rappresentazione di Amminoacidi Rappresentazione delle strutture Proteiche
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca
 INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
«Macromolecole» Lipidi
 LIPIDI (1) «Macromolecole» Lipidi Biotecnologie Miscellanea di molecole biologiche che condividono la proprietà di non essere solubili in acqua. Molecole idrofobiche. Es: Grassi Oli (grasso liquido a temperatura
LIPIDI (1) «Macromolecole» Lipidi Biotecnologie Miscellanea di molecole biologiche che condividono la proprietà di non essere solubili in acqua. Molecole idrofobiche. Es: Grassi Oli (grasso liquido a temperatura
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
DNA - RNA. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi.
 DNA - RNA Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Esistono 4 basi azotate per il DNA e 4 per RNA Differenze
DNA - RNA Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Esistono 4 basi azotate per il DNA e 4 per RNA Differenze
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura
LA CHERATINA. CORSO COSMETOLOGIA- DOTT.SSA B. SCARABELLI (www.cosmesinice.it) PROTEINA: unione di più aminoacidi
 PROTEINA: unione di più aminoacidi LA CHERATINA AMINOACIDO: molecola unità di base; ce ne sono 20 di cui 8 sono essenziali (da introdurre solo con i cibi) La struttura delle proteine vien suddivisa in
PROTEINA: unione di più aminoacidi LA CHERATINA AMINOACIDO: molecola unità di base; ce ne sono 20 di cui 8 sono essenziali (da introdurre solo con i cibi) La struttura delle proteine vien suddivisa in
Capitolo 17. Risposte alle domande interne al capitolo. 17.1 (p. 501) a. glicina. b. prolina. c. treonina. d. aspartato
 apitolo 17 Risposte alle domande interne al capitolo 17.1 (p. 501) a. glicina b. prolina c. treonina d. aspartato e. 17.2 (p. 501) a. La glicina è un aminoacido idrofobico. b. La prolina è un aminoacido
apitolo 17 Risposte alle domande interne al capitolo 17.1 (p. 501) a. glicina b. prolina c. treonina d. aspartato e. 17.2 (p. 501) a. La glicina è un aminoacido idrofobico. b. La prolina è un aminoacido
4x4x4=4 3 =64 codoni. 20 aminoacidi
 4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa
 Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Lezione 4 *membrana cellulare *trasporti *specializzazioni del plasmalemma
 Lezione 4 *membrana cellulare *trasporti *specializzazioni del plasmalemma Lezione 3 membrana cellulare Le membrane, sia quelle che delimitano e costituiscono gli organuli cellulari che quelle che rivestono
Lezione 4 *membrana cellulare *trasporti *specializzazioni del plasmalemma Lezione 3 membrana cellulare Le membrane, sia quelle che delimitano e costituiscono gli organuli cellulari che quelle che rivestono
SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA)
 SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA) ORGANIZZAZIONE TERZIARIA DEL DNA Il DNA cellulare contiene porzioni geniche e intergeniche, entrambe necessarie per le funzioni vitali della
SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA) ORGANIZZAZIONE TERZIARIA DEL DNA Il DNA cellulare contiene porzioni geniche e intergeniche, entrambe necessarie per le funzioni vitali della
Ogni globina ha una tasca in cui lega un gruppo EME, quindi l Hb può legare e trasportare 4 molecole di O 2
 Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
SINTESI DELL RNA. Replicazione. Trascrizione. Traduzione
 SINTESI DELL RNA Replicazione Trascrizione Traduzione L RNA ha origine da informazioni contenute nel DNA La TRASCRIZIONE permette la conversione di una porzione di DNA in una molecola di RNA con una sequenza
SINTESI DELL RNA Replicazione Trascrizione Traduzione L RNA ha origine da informazioni contenute nel DNA La TRASCRIZIONE permette la conversione di una porzione di DNA in una molecola di RNA con una sequenza
Le Ig sono glicoproteine costituite da 4 catene polipeptidiche:
 Struttura delle Ig Le Ig sono glicoproteine costituite da 4 catene polipeptidiche: 2 catene pesanti H (heavy( heavy) di P.M. 50.000 D, formate da c/a 450 amminoacidi 2 catene leggere L (light) Di P.M.
Struttura delle Ig Le Ig sono glicoproteine costituite da 4 catene polipeptidiche: 2 catene pesanti H (heavy( heavy) di P.M. 50.000 D, formate da c/a 450 amminoacidi 2 catene leggere L (light) Di P.M.
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
BIOMOLECOLE STRUTTURA E FUNZIONE
 BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
EMOGLOBINA ... www.pianetachimica.it
 EMGLBIA www.pianetachimica.it L'emoglobina è una proteina specializzata nel trasporto di ossigeno, si trova all interno dei globuli rossi del sangue ai quali conferisce il caratteristico colore rosso intenso.
EMGLBIA www.pianetachimica.it L'emoglobina è una proteina specializzata nel trasporto di ossigeno, si trova all interno dei globuli rossi del sangue ai quali conferisce il caratteristico colore rosso intenso.
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
la struttura tridimensionale può essere ottenuta solo per Un intero dominio in genere da 50 a 300 residui
 Durante la traduzione l informazione di ripiegamento codificata nella sequenza aminoacidica diventa disponibile in maniera vettoriale la struttura tridimensionale può essere ottenuta solo per Un intero
Durante la traduzione l informazione di ripiegamento codificata nella sequenza aminoacidica diventa disponibile in maniera vettoriale la struttura tridimensionale può essere ottenuta solo per Un intero
Proteine integrali di membrana legate sul versante esterno a gruppi di carboidrati. Formati da diverse subunità che circoscrivono un poro acquoso che
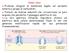 Canali ionici Proteine integrali di membrana legate sul versante esterno a gruppi di carboidrati. Formati da diverse subunità che circoscrivono un poro acquoso che permette il passaggio selettivo di ioni.
Canali ionici Proteine integrali di membrana legate sul versante esterno a gruppi di carboidrati. Formati da diverse subunità che circoscrivono un poro acquoso che permette il passaggio selettivo di ioni.
La biochimica è anche definita la chimica del C :
 Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di
 Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di materiali per fare funzionare il nostro corpo È il carboidrato
Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di materiali per fare funzionare il nostro corpo È il carboidrato
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
in Terminazione Neurone Dendriti Soma Fessura sinaptica sinaptica Nucleo dendrite Segmento iniziale Sinapsi inibitoria Segmento mielinico Assone
 Le funzioni del sistema nervoso si basano sull attività dei neuroni che consiste nel generare, trasmettere ed elaborare informazioni nervose, che dipendono da modificazioni del potenziale di membrana,
Le funzioni del sistema nervoso si basano sull attività dei neuroni che consiste nel generare, trasmettere ed elaborare informazioni nervose, che dipendono da modificazioni del potenziale di membrana,
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Dal DNA all RNA. La trascrizione nei procarioti e negli eucarioti
 Dal DNA all RNA La trascrizione nei procarioti e negli eucarioti DOGMA CENTRALE DELLA BIOLOGIA MOLECOLARE Gene Regione di DNA che porta l informazione (= che CODIFICA) per una catena polipeptidica o per
Dal DNA all RNA La trascrizione nei procarioti e negli eucarioti DOGMA CENTRALE DELLA BIOLOGIA MOLECOLARE Gene Regione di DNA che porta l informazione (= che CODIFICA) per una catena polipeptidica o per
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Metalli in medicina. L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il
 Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
TEST BIOLOGIA 1 ANNO ABEI Da inviare a connesso@alice.it entro e non oltre il 6 novembre 2015
 1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
MUTAZIONI ED EVOLUZIONE
 MUTAZIONI ED EVOLUZIONE Durante la duplicazione del DNA possono verificarsi errori di copiatura se ad esempio al posto di una base azotata ne viene inserita un altra. In questo caso può succedere che cambi
MUTAZIONI ED EVOLUZIONE Durante la duplicazione del DNA possono verificarsi errori di copiatura se ad esempio al posto di una base azotata ne viene inserita un altra. In questo caso può succedere che cambi
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
La mutazione è una modificazione della sequenza delle basi del DNA
 La mutazione è una modificazione della sequenza delle basi del DNA Le mutazioni sono eventi rari e importanti in quanto sono alla base dell evoluzione biologica Le mutazioni possono essere spontanee (dovute
La mutazione è una modificazione della sequenza delle basi del DNA Le mutazioni sono eventi rari e importanti in quanto sono alla base dell evoluzione biologica Le mutazioni possono essere spontanee (dovute
VERIFICA La struttura generale e il rivestimento
 ERIICA La struttura generale e il rivestimento Cognome Nome Classe Data I/1 ero o also? Gli organismi unicellulari sono costituiti da tessuti In un organo ci sono tessuti di tipo diverso Un sistema è costituito
ERIICA La struttura generale e il rivestimento Cognome Nome Classe Data I/1 ero o also? Gli organismi unicellulari sono costituiti da tessuti In un organo ci sono tessuti di tipo diverso Un sistema è costituito
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
Alberto Viale I CROMOSOMI
 Alberto Viale I CROMOSOMI DA MENDEL ALLA GENETICA AL DNA ALLE MUTAZIONI I cromosomi sono dei particolari bastoncelli colorati situati nel nucleo delle cellule. Sono presenti nelle cellule di ogni organismo
Alberto Viale I CROMOSOMI DA MENDEL ALLA GENETICA AL DNA ALLE MUTAZIONI I cromosomi sono dei particolari bastoncelli colorati situati nel nucleo delle cellule. Sono presenti nelle cellule di ogni organismo
dominio strutturale dominio modulo
 Riepilogo 2^lezione DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali
Riepilogo 2^lezione DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali
AMMINOACIDI. Gli amminoacidi si distinguono in base alla diversità della catena laterale R in ciascuno di essi.
 AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche
AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche
Valitutti, Taddei, Kreuzer, Massey, Sadava, Hills, Heller, Berenbaum
 Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
Livello di organizzazione degli esseri viventi
 Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
DOMINI E MODULI 02/04/2014. Domini modulari delle proteine 2
 Domini modulari delle proteine 1 Proteine della matrice DOMINI E MODULI La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette domini,
Domini modulari delle proteine 1 Proteine della matrice DOMINI E MODULI La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette domini,
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Il rischio cancerogeno e mutageno
 Il rischio cancerogeno e mutageno Le sostanze cancerogene Un cancerogeno è un agente capace di provocare l insorgenza del cancro o di aumentarne la frequenza in una popolazione esposta. Il cancro è caratterizzato
Il rischio cancerogeno e mutageno Le sostanze cancerogene Un cancerogeno è un agente capace di provocare l insorgenza del cancro o di aumentarne la frequenza in una popolazione esposta. Il cancro è caratterizzato
Figura 1. Rappresentazione della doppia elica di DNA e struttura delle differenti basi.
 Sommario La molecola di DNA è deputata a conservare le informazioni genetiche necessarie per lo sviluppo ed il funzionamento degli organismi viventi. Poiché contiene le istruzioni per la costruzione delle
Sommario La molecola di DNA è deputata a conservare le informazioni genetiche necessarie per lo sviluppo ed il funzionamento degli organismi viventi. Poiché contiene le istruzioni per la costruzione delle
AREA PROFESSIONALE - COMPETENZE FINALI GENERALI
 Acconciatore/trice AREA PROFESSIONALE - COMPETENZE FINALI GENERALI PER MACROSETTORE, FAMIGLIA E QUALIFICA Scienze 1 MACROSETTORE: SERVIZI AllA PERSONA FAMIGLIA PROFESSIONALE: SERVIZI ALLA PERSONA QUALIFICA
Acconciatore/trice AREA PROFESSIONALE - COMPETENZE FINALI GENERALI PER MACROSETTORE, FAMIGLIA E QUALIFICA Scienze 1 MACROSETTORE: SERVIZI AllA PERSONA FAMIGLIA PROFESSIONALE: SERVIZI ALLA PERSONA QUALIFICA
Forza. Forza. Esempi di forze. Caratteristiche della forza. Forze fondamentali CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA
 Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
Farmaci del sistema nervoso autonomo
 Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
Il magnetismo nella materia
 Le orbite degli elettroni in atomo di idrogeno Forma spaziale degli Orbitali elettronici di atomo di idrogeno Un solido Il magnetismo nella materia ferrimagnetismo Dr. Daniele Di Gioacchino Istituto Nazionale
Le orbite degli elettroni in atomo di idrogeno Forma spaziale degli Orbitali elettronici di atomo di idrogeno Un solido Il magnetismo nella materia ferrimagnetismo Dr. Daniele Di Gioacchino Istituto Nazionale
10) Se ad una soluzione aumentiamo la temperatura cosa succede? Dire quale delle seguenti affermazioni è corretta.
 Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: mail@antoniotucci.net - www.agora.lesina.org
Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: mail@antoniotucci.net - www.agora.lesina.org
Seminario. Domini modulari delle proteine 1
 Seminario Proteine della matrice DOMINI E MODULI Domini modulari delle proteine 1 La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette
Seminario Proteine della matrice DOMINI E MODULI Domini modulari delle proteine 1 La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Teoria del campo cristallino (CFT)
 Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
