Le molecole ed il legame chimico
|
|
|
- Bernarda Palmisano
- 7 anni fa
- Visualizzazioni
Transcript
1 LA MOLECOLA DI IDROGENO X r A2 e 2 r A1 r 12 r B2 e 1 r B1 È il primo caso di molecola bielettronica da noi incontrato ed è la base per lo studio di ogni altra molecola. A R AB B Z Y Se si applica l approssimazione di Born-Oppenheimer si ottiene un operatore Hamiltoniano (in u.a.) della forma ˆ r A1 r A2 r B1 r B2 r 12 R AB
2 L equazione agli autovalori con questa forma non è risolvibile in forma analitica a causa della presenza del termine di repulsione elettronica e perciò bisogna ricorrere a metodi approssimati: 1) L. C. A. O. o metodo MO 2) Legame di valenza (VB) o metodo di Heiler-London (HL) 3)Nel metodo MO applicato alla molecola di idrogeno si cercano inizialmente le soluzioni dell equazione agli autovalori usando l hamiltoniano approssimato in cui si omette il termine 1/r 12. L operatore Hamiltoniano può essere scritto nella forma seguente: ˆ r A1 1 r B r A2 1 r B2 1 R AB
3 Se si aggiunge e si sottrae il termine 1/R AB l hamiltoniano approssimato può essere scritto nella forma: ˆ 0 h ˆ 0 1 h ˆ R AB h ˆ r A1 r B1 R AB h ˆ r A2 r B2 R AB Il termine 1/R AB risulta costante ed il suo contributo, dovuto alla distanza internucleare, è negativo.
4 Ricorrendo al teorema di separazione delle variabili si può dimostrare che l equazione agli autovalori che include l Hamiltoniano precedente è soddisfatta da una funzione prodotto del tipo: A i 1 i 2 dove i sono le soluzione di H 2 + ed A è una appropriata costante di normalizzazione S A S 1S B 1 Sostituendo ad 1 ed 2 le rispettive funzioni si ottiene: 1 1S A 1 1S B 1 A 2 2S 1S A 21S B 2
5 A questo punto deve essere introdotto lo spin elettronico in modo tale che il risultato rispetti il principio di Pauli MO S 1S A1 1S B 1 1S A 21S B La funzione d onda MO è un autofunzione dell Hamiltoniano approssimato, che non è altro che l <<Hamiltoniano esatto>> da cui è stato omesso il termine 1/r 12. Il calcolo dell energia è analogo a quello dell atomo di elio in quanto il valore di aspettazione di E è calcolato in funzione di R AB impiegando la funzione d onda MO e l operatore hamiltoniano esatto. E MO ˆ MO 1 2E' R AB MO r MO 1 12 R AB Dove E (R AB ) è l espressione dell energia di H 2 + in funzione della distanza internucleare R AB..
6 Operando così si ottiene: E MO =-1,0985 H E legame =E-2E H =-1,0985+1,000=-0,0985H=-2,681 ev r e =0,850 Å Mentre i valori sperimentali sono: E totale =-1,174 H E legame = energia totale - energia di due atomi di idrogeno isolati=-1,174-(-1,000)=-4,75 ev r e =0,740 Å L accordo con i dati sperimentali è per ora scadente, l errore commesso è del 40%.
7 È istruttivo esplicitare la funzione MO della molecola di idrogeno e sviluppando soltanto la parte spaziale si ottiene: MO (parte spaziale) 1 2 2S 1S A1 1S A 2 1S A 1 1S B 2 1S B 1 1S A 2 1S B 1 1S B 2 Il primo e il quarto termine rappresentano la probabilità di trovare entrambi gli elettroni vicini ad un solo nucleo. Ciò equivale a scrivere le strutture ioniche della molecola di idrogeno nella forma H A + H B - e H A - H B +. Una delle più serie limitazioni della funzione MO consiste nel fatto che questi <<termini ionici>> contribuiscono alla funzione d onda con un peso uguale a quello dei termini covalenti. Questo è contrario all esperienza chimica che ci dice che l idrogeno è una molecola covalente. Inoltre tale funzione prevede che alla dissociazione metà delle molecole di idrogeno si dissocino in ioni H - ed H+, mentre è noto che una molecola di idrogeno si dissocia sempre in due atomi di idrogeno.
8 Tenendo conto di queste approssimazioni possiamo scrivere una seconda funzione d onda che descrive lo stato fondamentale della molecola di idrogeno che include soltanto la parte covalente. Si ottiene la funzione d onda VB della molecola di idrogeno: HL N A 1 B 2 B 1 A 2 dove N è la costante di normalizzazione e A e B rappresentano le funzioni orbitali 1s A e 1s B. Si può verificare che la parte spaziale di questa funzione d onda è simmetrica e quindi la parte di spin deve risultare antisimmetrica per soddisfare il principio di Pauli. Introducendo nel calcolo di E l Hamiltoniano esatto e la funzione VB si ottiene: E VB =-1,1160 H E legame =-0,1160H=-3,140 ev r e =0,869 Å Risulta che questo calcolo dà il 70% dell energia totale, un risultato non ancora abbastanza buono, ma migliore del precedente MO al primo livello di approssimazione.
9 Una funzione d onda migliore si ha se i termini ionici sono inclusi moltiplicando per un coefficiente variazionale ʎ arbitrario. Tale funzione è detta di Weinbraun. Trascurando il termine di spin si ha: 1) (2) (1) (2) (1) (2) (1) (2) w N A( B B A ʎ A A B B Dove ʎ è un parametro variazionale arbitrario. Minimizzando il valore dell energia si ottiene: E = - 1,1187 H Energia di legame = - 0,1187 H = - 3,229 ev Possiamo dire di aver mescolato una piccola parte di termini ionici H H A B
10 In realtà si può ottenere una energia migliore di quella di Weinbraun con una completamente covalente detta di Rosen che introducendo una parte del contributo dei 2p, ottenne: R N s k P (1) 1 s k P 1 A 2 za B 2 zb (2) tertermini isimmetrizzanti N = costante di normalizzazione. Ottimizzando K si minimizza l energia, infatti i valori ottenuti sono: E = - 1,1123 H Energia di legame = - 0,123 H = -3,40 ev Come si vede questi ultimi risultati sono migliori di quelli finora ottenuti.
11 Riassumendo si ha per la molecola di idrogeno: Dati sperimentali: Energia totale = - 1,174 H Energia di legame = - 4,75 ev Distanza internucleare di equilibrio = 0,740 Å Dati metodo M.O.: Energia totale = -1,0985 H Energia di legame = - 2,681 ev Distanza internucleare di equilibrio = 0,850 Å Dati metodo V.B.: Energia totale = -1,116H Energia di legame= - 3,14 ev Distanza internucleare di equilibrio = 0,869 Å Dati ottenuti introducendo ʎ: Energia totale = -1,1187 H Energia di legame = - 3,229 ev Dati ottenuti introducendo 2p: Energia totale= - 1,1125 H Energia di legame = - 3,40 ev
12 I risultati indicano che la funzione d onda VB dà un valore migliore dell energia della funzione MO e prevede il comportamento corretto a grandi distanze internucleari. Si potrebbe pensare che il metodo VB sia migliore del metodo MO. La conclusione non sarebbe giustificata in quanto in entrambi i membri sono state introdotte approssimazioni troppo drastiche. Si può concludere che è meglio escludere dalla funzione d onda della molecola di idrogeno i termini ionici piuttosto che includerli con peso uguale a quelli covalenti.
13 Sfruttando la funzione d onda VB l energia del sistema è così espressa: E A 1 B 2 B 1 A 2 ˆ A 1 B 2 B 1 A 2 A 1 B 2 B 1 A 2 A 1 B 2 B 1 A 2 A 1 B 2 ˆ A 1 B 2 J A 1 B 2 ˆ B 1 A 2 K A 1 B 2 A 1 B 2 A 1 B 2 1 B 1 A 2 S E 2(J K) 2(1 S 2 ) J K 1 S 2 J= integrale coulombiano,corrisponde all energia di una molecola di idrogeno se gli elettroni non potessero scambiarsi di posto. K= integrale di scambio, compete a questo la maggior parte della stabilità calcolata della molecola di idrogeno. S= integrale di sovrapposizione, indica quanto le funzioni siano simili tra loro.
14 J e K rendono negativo il valore dell energia, il valore di S non contribuisce al segno dell energia essendo al quadrato. S 1 0,8 0,6 0,4 0,2 0-0, Andamento degli orbitali s in funzione della distanza internucleare per diverse coppie di orbitali. Per ogni combinazione di funzioni d onda atomiche che porta alla formazione di un legame, esiste una combinazione lineare di funzioni che porta alla formazione di una orbitale di antilegame ad energia maggiore. J K 1 S 2 E' E R AB Å
Le molecole ed il legame chimico
 La meccanica quantistica è in grado di determinare esattamente i livelli energetici dell atomo di idrogeno e con tecniche matematiche più complesse è anche in grado di descrivere l atomo di elio trovando
La meccanica quantistica è in grado di determinare esattamente i livelli energetici dell atomo di idrogeno e con tecniche matematiche più complesse è anche in grado di descrivere l atomo di elio trovando
La struttura elettronica degli atomi
 1 In unità atomiche: a 0 me 0,59A unità di lunghezza e H 7, ev a H=Hartree unità di energia L energia dell atomo di idrogeno nello stato fondamentale espresso in unità atomiche è: 4 0 me 1 e 1 E H 13,
1 In unità atomiche: a 0 me 0,59A unità di lunghezza e H 7, ev a H=Hartree unità di energia L energia dell atomo di idrogeno nello stato fondamentale espresso in unità atomiche è: 4 0 me 1 e 1 E H 13,
Metodi Pseudopotenziale
 Oltre HF Metodi Pseudopotenziale Il moto degli elettroni interni è poco influenzato dall'intorno molecolare Il calcolo può essere semplificato modificando lo hamiltonano: limitandosi a calcolare solo il
Oltre HF Metodi Pseudopotenziale Il moto degli elettroni interni è poco influenzato dall'intorno molecolare Il calcolo può essere semplificato modificando lo hamiltonano: limitandosi a calcolare solo il
I legami chimici. Programma: a che punto siamo? Funzioni di stato. Corso di Studi di Fisica Corso di Chimica. Luigi Cerruti
 Corso di Studi di Fisica Corso di Chimica Programma: a che punto siamo? Luigi Cerruti www.minerva.unito.it Lezioni 11-12 2010 I legami chimici Un volume di gas, una certa quantità di soluzione, un cristallo
Corso di Studi di Fisica Corso di Chimica Programma: a che punto siamo? Luigi Cerruti www.minerva.unito.it Lezioni 11-12 2010 I legami chimici Un volume di gas, una certa quantità di soluzione, un cristallo
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 11-12 2010 Programma: a che punto siamo? I legami chimici Un volume di gas, una certa quantità di soluzione, un cristallo
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 11-12 2010 Programma: a che punto siamo? I legami chimici Un volume di gas, una certa quantità di soluzione, un cristallo
Funzione d onda dello stato fondamentale (trascurando l interazione elettrone-elettrone)
 -e -e +2e ATOMO DI ELIO. Considero il nucleo fisso (sistema di riferimento del centro di massa, circa coincidente col nucleo). I due elettroni vanno trattati come indistinguibili. -e -e +2e SENZA il termine
-e -e +2e ATOMO DI ELIO. Considero il nucleo fisso (sistema di riferimento del centro di massa, circa coincidente col nucleo). I due elettroni vanno trattati come indistinguibili. -e -e +2e SENZA il termine
LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI
 LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI Il legame covalente e la geometria delle molecole possono essere descritti dalla teoria del legame di valenza: i legami risultano dalla condivisione di
LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI Il legame covalente e la geometria delle molecole possono essere descritti dalla teoria del legame di valenza: i legami risultano dalla condivisione di
Enrico Silva - diritti riservati - Non è permessa, fra l altro, l inclusione anche parziale in altre opere senza il consenso scritto dell autore
 Particelle della presente identiche. opera. Principio di Pauli. 1 Particelle identiche: sommario Finora: proprietà di particella singola. Volendo ottenere il comportamento di più particelle, è necessario
Particelle della presente identiche. opera. Principio di Pauli. 1 Particelle identiche: sommario Finora: proprietà di particella singola. Volendo ottenere il comportamento di più particelle, è necessario
Struttura del sistema periodico Stato fondamentale degli elementi
 Struttura del sistema periodico Stato fondamentale degli elementi Singolo elettrone: 1)Numero quantico principale n 2)Numero quantico del momento angolare orbitale l = 0, 1,, n-1 3)Numero quantico magnetico
Struttura del sistema periodico Stato fondamentale degli elementi Singolo elettrone: 1)Numero quantico principale n 2)Numero quantico del momento angolare orbitale l = 0, 1,, n-1 3)Numero quantico magnetico
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
Molecole. 04/09/13 3-MOL-0.doc 0
 Molecole 04/09/13 3-MOL-0.doc 0 Legame covalente H 2 + Il potenziale cui è soggetto l elettrone ha 2 minimi equivalenti 1) H + si avvicina a H 2) Se la barriera diventa abbastanza sottile la probabilità
Molecole 04/09/13 3-MOL-0.doc 0 Legame covalente H 2 + Il potenziale cui è soggetto l elettrone ha 2 minimi equivalenti 1) H + si avvicina a H 2) Se la barriera diventa abbastanza sottile la probabilità
Metodo variazionale e applicazione all atomo di elio
 Metodo variazionale e applicazione all atomo di elio Descrizione del metodo Il metodo detto variazionale è un metodo approssimato che si usa per ottenere una stima dell energia dello stato fondamentale
Metodo variazionale e applicazione all atomo di elio Descrizione del metodo Il metodo detto variazionale è un metodo approssimato che si usa per ottenere una stima dell energia dello stato fondamentale
Con riferimento alla figura 1, l Hamiltoniano della molecola di idrogeno in unità atomiche ha la forma. r a1 r b
 Molecola di idrogeno Nel capitolo precedente, partendo dagli orbitali molecolari della molecolaione idrogeno, è stata possibile una trattazione qualitativa delle molecole biatomiche e quindi anche della
Molecola di idrogeno Nel capitolo precedente, partendo dagli orbitali molecolari della molecolaione idrogeno, è stata possibile una trattazione qualitativa delle molecole biatomiche e quindi anche della
Teorie del legame chimico. Teorie del legame chimico
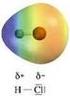 Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
CALCOLO DELLA STRUTTURA MOLECOLARE: 1. LE SUPERFICI DI ENERGIA POTENZIALE E L APPROSSIMAZIONE DI BORN-OPPENHEIMER
 CALCOLO DELLA STRUTTURA MOLECOLARE: 1. LE SUPERFICI DI ENERGIA POTENZIALE E L APPROSSIMAZIONE DI BORN-OPPENHEIMER 1 COSA E UNA MOLECOLA Tutti gli atomi a piccola distanza si attraggono (forze di van der
CALCOLO DELLA STRUTTURA MOLECOLARE: 1. LE SUPERFICI DI ENERGIA POTENZIALE E L APPROSSIMAZIONE DI BORN-OPPENHEIMER 1 COSA E UNA MOLECOLA Tutti gli atomi a piccola distanza si attraggono (forze di van der
Metalli come gas di elettroni liberi
 Metalli come gas di elettroni liberi I metalli sono caratterizzati da elevata conducibilità elettrica e termica. La conducibilità elettrica in particolare (o il suo inverso, la resistività) è una delle
Metalli come gas di elettroni liberi I metalli sono caratterizzati da elevata conducibilità elettrica e termica. La conducibilità elettrica in particolare (o il suo inverso, la resistività) è una delle
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
STRUTTURA ATOMICA. tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica
 STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
Elettrone fortemente legato
 Elettrone fortemente legato Introduzione Vogliamo studiare un altra strada, cioè un altra approssimazione per ottenere le bande elettroniche, e cioè quella del metodo dell elettrone fortemente legato.
Elettrone fortemente legato Introduzione Vogliamo studiare un altra strada, cioè un altra approssimazione per ottenere le bande elettroniche, e cioè quella del metodo dell elettrone fortemente legato.
Esercizio 1. CF 2 CS 2 CCl 4 ClF 3
 Esercizio 1 Determinare in base al metodo del legame di valenza la forma delle seguenti molecole, tenendo conto delle repulsioni coulombiane tra le coppie elettroniche di valenza CF 2 CS 2 CCl 4 ClF 3
Esercizio 1 Determinare in base al metodo del legame di valenza la forma delle seguenti molecole, tenendo conto delle repulsioni coulombiane tra le coppie elettroniche di valenza CF 2 CS 2 CCl 4 ClF 3
LA STRUTTURA ELETTRONICA DEGLI ATOMI
 LA STRUTTURA ELETTRONICA DEGLI ATOMI 127 Possiamo trattare insieme l atomo di idrogeno e gli atomi idrogenoidi He +, Li 2+, ecc., in quanto differiscono l uno dall altro solo per la carica nucleare. Protone
LA STRUTTURA ELETTRONICA DEGLI ATOMI 127 Possiamo trattare insieme l atomo di idrogeno e gli atomi idrogenoidi He +, Li 2+, ecc., in quanto differiscono l uno dall altro solo per la carica nucleare. Protone
Chimica quantistica. Loriano Storchi.
 Chimica quantistica Loriano Storchi loriano@storchi.org http://www.storchi.org/ FISICA CLASSICA Meccanica Classica La meccanica classica descrive il movimento di oggetti macroscopici come veicoli spaziali,
Chimica quantistica Loriano Storchi loriano@storchi.org http://www.storchi.org/ FISICA CLASSICA Meccanica Classica La meccanica classica descrive il movimento di oggetti macroscopici come veicoli spaziali,
ORBITA ORBIT LI ALI MOLECOLARI
 ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Molecola Idrogeno (struttura elettronica) R P 2. P r 1 b
 Molecola Idrogeno (struttura elettronica) (vedi Slater e Bransden) r b r a rp r rb a rp a R P r a P r + R P P r a P r + R P b P r b P r R P P r b P r R P L Hamiltoniana del sistema è H L L r a r b r a
Molecola Idrogeno (struttura elettronica) (vedi Slater e Bransden) r b r a rp r rb a rp a R P r a P r + R P P r a P r + R P b P r b P r R P P r b P r R P L Hamiltoniana del sistema è H L L r a r b r a
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno:
 La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
E. SCHRODINGER ( )
 E. SCHRODINGER (1887-1961) Elettrone = onda le cui caratteristiche possono essere descritte con un equazione simile a quella delle onde stazionarie le cui soluzioni, dette funzioni d onda ψ, rappresentano
E. SCHRODINGER (1887-1961) Elettrone = onda le cui caratteristiche possono essere descritte con un equazione simile a quella delle onde stazionarie le cui soluzioni, dette funzioni d onda ψ, rappresentano
TEORIA DEL LEGAME DI VALENZA
 TERIA DEL LEGAME DI VALENZA ( Strutture di LEWIS ) Tutti gli atomi tendono ad acquisire la struttura elettronica dei gas nobili Il tipo di legame è correlato alla elettronegatività degli atomi che si legano
TERIA DEL LEGAME DI VALENZA ( Strutture di LEWIS ) Tutti gli atomi tendono ad acquisire la struttura elettronica dei gas nobili Il tipo di legame è correlato alla elettronegatività degli atomi che si legano
GEOMETRIA MOLECOLARE. Ibridazione La teoria VSEPR
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
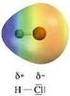
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
Lezione 3. Legame Chimico. Teoria degli Orbitali Molecolari
 Lezione 3 Legame Chimico Teoria degli Orbitali Molecolari 1 Perchè si formano i legami? Un diagramma di energia mostra che un legame fra due atomi si forma se l energia del sistema diminuisce quando i
Lezione 3 Legame Chimico Teoria degli Orbitali Molecolari 1 Perchè si formano i legami? Un diagramma di energia mostra che un legame fra due atomi si forma se l energia del sistema diminuisce quando i
Teoria del legame di valenza (VB) Ibridazione Geometria molecolare. Teoria dell orbitale molecolare (MO)
 IL LEGAME CHIMICO Parte 2 a Teoria del legame di valenza (VB) Ibridazione Geometria molecolare Teoria dell orbitale molecolare (MO) 1 Struttura molecolare Nella nostra discussione sulle teorie del legame
IL LEGAME CHIMICO Parte 2 a Teoria del legame di valenza (VB) Ibridazione Geometria molecolare Teoria dell orbitale molecolare (MO) 1 Struttura molecolare Nella nostra discussione sulle teorie del legame
La forma delle molecole
 La forma delle molecole Geometria molecolare: disposizione relativa nello spazio degli atomi costituenti una molecola o un composto covalente a struttura infinita La geometria delle molecole si esprime
La forma delle molecole Geometria molecolare: disposizione relativa nello spazio degli atomi costituenti una molecola o un composto covalente a struttura infinita La geometria delle molecole si esprime
Effetto Stark (1) H 0 nlm > = E n nlm > (4) Ricordiamo che. E n = me4 2 h 2 n 2 = E 1
 Effetto Stark Studiamo l equazione di Schrödinger per l atomo di idrogeno in presenza di un campo elettrico costante e diretto lungo l asse z, E = E k. La hamiltoniana di Schrödinger per l atomo di idrogeno
Effetto Stark Studiamo l equazione di Schrödinger per l atomo di idrogeno in presenza di un campo elettrico costante e diretto lungo l asse z, E = E k. La hamiltoniana di Schrödinger per l atomo di idrogeno
Struttura molecolare
 Struttura molecolare Nella discussione sulle teorie del legame covalente dobbiamo ternere in considerazione che le teorie che abbiamo discusso rappresentano un tentativo di spiegare e organizzare quello
Struttura molecolare Nella discussione sulle teorie del legame covalente dobbiamo ternere in considerazione che le teorie che abbiamo discusso rappresentano un tentativo di spiegare e organizzare quello
Chimica quantistica. Loriano Storchi.
 Chimica quantistica Loriano Storchi loriano@storchi.org http://www.storchi.org/ LCAO e set di base Abbiamo appena visto che data una geometria molecolare in pratica il metodo HF SCF, partendo da un set
Chimica quantistica Loriano Storchi loriano@storchi.org http://www.storchi.org/ LCAO e set di base Abbiamo appena visto che data una geometria molecolare in pratica il metodo HF SCF, partendo da un set
Campo elettromagnetico
 Campo elettromagnetico z y Classicamente, è formato da un campo elettrico E e da un campo magnetico B oscillanti B E λ E = E 0 cos 2π(νt x/λ) B = B 0 cos 2π(νt x/λ) νλ = c ν, frequenza x λ, lunghezza d
Campo elettromagnetico z y Classicamente, è formato da un campo elettrico E e da un campo magnetico B oscillanti B E λ E = E 0 cos 2π(νt x/λ) B = B 0 cos 2π(νt x/λ) νλ = c ν, frequenza x λ, lunghezza d
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole
 Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
La teoria del legame di valenza
 La teoria del legame di valena 1 Limiti della teoria di Lewis Nessuna informaione quantitativa: Energia di legame; Lunghea del legame; Geometria molecolare. Informaioni quantitative MECCNIC ONDULTORI La
La teoria del legame di valena 1 Limiti della teoria di Lewis Nessuna informaione quantitativa: Energia di legame; Lunghea del legame; Geometria molecolare. Informaioni quantitative MECCNIC ONDULTORI La
Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà.
 Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà. Nell atomo l energia associata ad un elettrone (trascurando
Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà. Nell atomo l energia associata ad un elettrone (trascurando
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
I POSTULATI DELLA MECCANICA QUANTISTICA
 68 I POSTULATI DELLA MECCANICA QUANTISTICA Si intende per postulato una assunzione da accettarsi a priori e non contraddetta dall esperienza. I postulati trovano la loro unica giustificazione nella loro
68 I POSTULATI DELLA MECCANICA QUANTISTICA Si intende per postulato una assunzione da accettarsi a priori e non contraddetta dall esperienza. I postulati trovano la loro unica giustificazione nella loro
Riassunto modelli atomici.
 Lezione 6 1. La teoria atomica moderna 2. Il modello quantomeccanico dell atomo 3. Gli orbitali 4. Carica nucleare efficace 5. Principi di Pauli e Hund 6. Configurazioni elettroniche 7. AUFBAU Riassunto
Lezione 6 1. La teoria atomica moderna 2. Il modello quantomeccanico dell atomo 3. Gli orbitali 4. Carica nucleare efficace 5. Principi di Pauli e Hund 6. Configurazioni elettroniche 7. AUFBAU Riassunto
Le molecole ed il legame chimico
 TEORIA DELL ORBITALE MOLECOLARE PER MOLECOLE COMPLESSE Per predire molte delle proprietà delle molecole biatomiche si può eleborare una teoria semplice che ricalca il modello della teoria dell elettrone
TEORIA DELL ORBITALE MOLECOLARE PER MOLECOLE COMPLESSE Per predire molte delle proprietà delle molecole biatomiche si può eleborare una teoria semplice che ricalca il modello della teoria dell elettrone
TEORIA DEGLI ORBITALI MOLECOLARI
 TEORIA DEGLI ORBITALI MOLECOLARI La teoria VB è la teoria più semplice basata sulla meccanica quantistica. Essa riesce a descrivere correttamente la geometria di moltissime molecole ma non permette di
TEORIA DEGLI ORBITALI MOLECOLARI La teoria VB è la teoria più semplice basata sulla meccanica quantistica. Essa riesce a descrivere correttamente la geometria di moltissime molecole ma non permette di
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
Corso di Laurea in Chimica e Tecnologie Chimiche - A.A Chimica Fisica II. Esame scritto del 25 Febbraio P = i.
 1 Corso di Laurea in Chimica e Tecnologie Chimiche - A.A. 212-213 Chimica Fisica II Esame scritto del 25 Febbraio 213 Quesiti d esame: 1. Definire gli operatori componente del momento cinetico P x e del
1 Corso di Laurea in Chimica e Tecnologie Chimiche - A.A. 212-213 Chimica Fisica II Esame scritto del 25 Febbraio 213 Quesiti d esame: 1. Definire gli operatori componente del momento cinetico P x e del
Interazione luce- atomo
 Interazione luce- atomo Descrizione semiclassica L interazione predominante è quella tra il campo elettrico e le cariche ASSORBIMENTO: Elettrone e protone formano un dipolo che viene messo in oscillazione
Interazione luce- atomo Descrizione semiclassica L interazione predominante è quella tra il campo elettrico e le cariche ASSORBIMENTO: Elettrone e protone formano un dipolo che viene messo in oscillazione
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
Cenni sulla teoria dell orbitale molecolare
 Cenni sulla teoria dell orbitale molecolare Legame chimico: teoria dell orbitale molecolare (MO) La formazione della molecola genera ORBITALI MOLECOLARI che derivano dalla combinazione degli ORBITALI ATOMICI.
Cenni sulla teoria dell orbitale molecolare Legame chimico: teoria dell orbitale molecolare (MO) La formazione della molecola genera ORBITALI MOLECOLARI che derivano dalla combinazione degli ORBITALI ATOMICI.
Modelli semplici dell interazione elettrone-elettrone
 Università degli Studi di Roma La Sapienza Facoltà di Scienze Matematiche Fisiche e Naturali Dissertazione di laurea triennale in Fisica Anno Accademico 2005-2006 Modelli semplici dell interazione elettrone-elettrone
Università degli Studi di Roma La Sapienza Facoltà di Scienze Matematiche Fisiche e Naturali Dissertazione di laurea triennale in Fisica Anno Accademico 2005-2006 Modelli semplici dell interazione elettrone-elettrone
Legame covalente: la teoria del legame di valenza
 Legame covalente: la teoria del legame di valenza La teoria di Lewis, un legame è costituito da una coppia di elettroni (postulata prima della meccanica quantistica), considera gli elettroni di valenza
Legame covalente: la teoria del legame di valenza La teoria di Lewis, un legame è costituito da una coppia di elettroni (postulata prima della meccanica quantistica), considera gli elettroni di valenza
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole.
 4.1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione
4.1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione
Legame e struttura molecolare
 2016 2017 CCS Biologia CCS-Scienze Geologiche 1 Legame e struttura molecolare Orbitali atomici Molecole Cap 9. 1-3, 15-16, 18, 21-23, 40 CONSIDERAZIONI PRELIMINARI 2 Le strutture di Lewis e la teoria VSEPR
2016 2017 CCS Biologia CCS-Scienze Geologiche 1 Legame e struttura molecolare Orbitali atomici Molecole Cap 9. 1-3, 15-16, 18, 21-23, 40 CONSIDERAZIONI PRELIMINARI 2 Le strutture di Lewis e la teoria VSEPR
un legame covalente due legami covalenti? tre legami covalenti due legami covalenti un legame covalente
 e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
Sommario delle lezioni Legami chimici
 Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Comunicazioni Docente - Studenti
 Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
FORMAZIONE DI LEGAMI. Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato.
 FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia
FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Risultati della teoria di Hartree
 Risultati della teoria di Hartree Il potenziale è a simmetria sferica, come nell atomo di idrogeno, quindi: ψ n, l, m = Rn, l ( r) Θ l, m ( θ ) Φ m ( ϕ ) l l l La dipendenza angolare delle autofunzioni
Risultati della teoria di Hartree Il potenziale è a simmetria sferica, come nell atomo di idrogeno, quindi: ψ n, l, m = Rn, l ( r) Θ l, m ( θ ) Φ m ( ϕ ) l l l La dipendenza angolare delle autofunzioni
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Solidi Es. 7. Esercizi Materia Condensata 2009/2010 Mario Capizzi
 Gli stati elettronici di valenza di una catena lineare monoatomica con N 10 23 siti e di passo reticolare a = 0,2 nm con condizioni periodiche al bordo sono ben descritti, in approssimazione a elettroni
Gli stati elettronici di valenza di una catena lineare monoatomica con N 10 23 siti e di passo reticolare a = 0,2 nm con condizioni periodiche al bordo sono ben descritti, in approssimazione a elettroni
Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti)
 Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti) la teoria del campo cristallino (CFT) adotta un modello fisico irreale considerando i leganti come cariche puntiformi un modello
Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti) la teoria del campo cristallino (CFT) adotta un modello fisico irreale considerando i leganti come cariche puntiformi un modello
Caratteristiche dei Metalli. Possibilità di formare un numero elevato di legami. Lavorabilità (slittamento di piani) Lucentezza (riflettono la luce)
 Caratteristiche dei Metalli Possibilità di formare un numero elevato di legami Lavorabilità (slittamento di piani) Lucentezza (riflettono la luce) Conducibilità elettrica e termica Limiti della Teoria
Caratteristiche dei Metalli Possibilità di formare un numero elevato di legami Lavorabilità (slittamento di piani) Lucentezza (riflettono la luce) Conducibilità elettrica e termica Limiti della Teoria
Legame chimico unità 1, modulo D del libro
 Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Aspetti generali della Chimica Organica 1 parte
 Aspetti generali della Chimica Organica 1 parte Struttura e Legame: Il Carbonio nella Tabella Periodica Il Modello di Lewis Calcolo delle cariche formali Teoria della Risonanza Dove troviamo il carbonio
Aspetti generali della Chimica Organica 1 parte Struttura e Legame: Il Carbonio nella Tabella Periodica Il Modello di Lewis Calcolo delle cariche formali Teoria della Risonanza Dove troviamo il carbonio
Consideriamo un sistema composto da due particelle identiche. Due particelle sono identiche se hanno le stesse proprietà intrinseche (massa, carica,
 Consideriamo un sistema composto da due particelle identiche. Due particelle sono identiche se hanno le stesse proprietà intrinseche (massa, carica, spin, ). Esempi: due elettroni, due protoni, due neutroni,
Consideriamo un sistema composto da due particelle identiche. Due particelle sono identiche se hanno le stesse proprietà intrinseche (massa, carica, spin, ). Esempi: due elettroni, due protoni, due neutroni,
LA STRUTTURA DELLE MOLECOLE
 LA STRUTTURA DELLE MOLECOLE Per studiare la struttura delle molecole procederemo con lo stesso schema utilizzato per gli atomi. Cominceremo con la molecola più semplice, cioè la molecola-ione idrogeno,
LA STRUTTURA DELLE MOLECOLE Per studiare la struttura delle molecole procederemo con lo stesso schema utilizzato per gli atomi. Cominceremo con la molecola più semplice, cioè la molecola-ione idrogeno,
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
Configurazioni elettroniche e periodicità
 Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
TEORIA DEGLI ORBITALI MOLECOLARI (MO).
 TEORIA DEGLI ORBITALI MOLECOLARI (MO). La teoria MO rappresenta l approccio quantomeccanico alle molecole in maniera analoga a quanto visto per la teoria atomica. Gli MO si considerano derivati da combinazioni
TEORIA DEGLI ORBITALI MOLECOLARI (MO). La teoria MO rappresenta l approccio quantomeccanico alle molecole in maniera analoga a quanto visto per la teoria atomica. Gli MO si considerano derivati da combinazioni
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O?
 IL LEGAME CHIMICO Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O? Configurazione degli elettroni diversa ed energeticamente più favorevole di quella degli atomi isolati? Ionico (trasferimento di
IL LEGAME CHIMICO Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O? Configurazione degli elettroni diversa ed energeticamente più favorevole di quella degli atomi isolati? Ionico (trasferimento di
ALTRI TIPI DI IBRIDAZIONE. Trigonale bipiramidale 1(s)+3(p)+1(d)d5(sp 3 d) P [Ne] 3s 2 3p 3 d[ne]3s 1 3p 3 3d 1 (Es. PCl 5 )
![ALTRI TIPI DI IBRIDAZIONE. Trigonale bipiramidale 1(s)+3(p)+1(d)d5(sp 3 d) P [Ne] 3s 2 3p 3 d[ne]3s 1 3p 3 3d 1 (Es. PCl 5 ) ALTRI TIPI DI IBRIDAZIONE. Trigonale bipiramidale 1(s)+3(p)+1(d)d5(sp 3 d) P [Ne] 3s 2 3p 3 d[ne]3s 1 3p 3 3d 1 (Es. PCl 5 )](/thumbs/85/92177402.jpg) ALTRI TIPI DI IBRIDAZIONE Trigonale bipiramidale 1(s)+3(p)+1(d)d5(sp 3 d) P [Ne] 3s 2 3p 3 d[ne]3s 1 3p 3 3d 1 (Es. PCl 5 ) Ottaedrica 1(s)+3(p)+2(d)d6(sp 3 d 2 ) S [Ne]3s 2 3p 4 d[ne] 3s 1 3p 3 3d 2 (Es.
ALTRI TIPI DI IBRIDAZIONE Trigonale bipiramidale 1(s)+3(p)+1(d)d5(sp 3 d) P [Ne] 3s 2 3p 3 d[ne]3s 1 3p 3 3d 1 (Es. PCl 5 ) Ottaedrica 1(s)+3(p)+2(d)d6(sp 3 d 2 ) S [Ne]3s 2 3p 4 d[ne] 3s 1 3p 3 3d 2 (Es.
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 3-4 2009 Schema del funzionamento di uno spettrometro di massa Spettro di massa del mercurio 196 Hg 0,146 % 202 Hg 29,80
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 3-4 2009 Schema del funzionamento di uno spettrometro di massa Spettro di massa del mercurio 196 Hg 0,146 % 202 Hg 29,80
Atomi a più elettroni
 Chapter 7 Atomi a più elettroni 7.1 Lo spin Gli esperimenti indicano che alle particelle si deve associare un momento angolare intrinseco, o spin, indipendentemente dalla loro natura (particelle elementari
Chapter 7 Atomi a più elettroni 7.1 Lo spin Gli esperimenti indicano che alle particelle si deve associare un momento angolare intrinseco, o spin, indipendentemente dalla loro natura (particelle elementari
I legami chimici. (parte seconda) Lezioni d'autore
 I legami chimici (parte seconda) Lezioni d'autore Introduzione (I) La teoria del legame di Lewis considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente dal fatto che
I legami chimici (parte seconda) Lezioni d'autore Introduzione (I) La teoria del legame di Lewis considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente dal fatto che
Funzione d'onda per N elettroni
 Funzione d'onda per elettroni Funzione d'onda per più particelle Particelle identiche sono indistiguibili La probabilità deve essere invariante rispetto allo scambio degli indici delle particelle Es.:
Funzione d'onda per elettroni Funzione d'onda per più particelle Particelle identiche sono indistiguibili La probabilità deve essere invariante rispetto allo scambio degli indici delle particelle Es.:
CHIMICA ORGANICA (CANALE M-Z)
 CHIMICA ORGANICA (CANALE M-Z) Durata corso (8 marzo-10 maggio) + settimana recupero Orario lezioni Esercitazioni Modalità d esame Esoneri Libri di testo Ricevimento studenti e-mail/telefono docente: Michela.Salamone@uniroma2.it
CHIMICA ORGANICA (CANALE M-Z) Durata corso (8 marzo-10 maggio) + settimana recupero Orario lezioni Esercitazioni Modalità d esame Esoneri Libri di testo Ricevimento studenti e-mail/telefono docente: Michela.Salamone@uniroma2.it
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
(98,9x12) + (1,1x13) = 12,01 100
 5 GLI ISOTOPI Le proprietà di un elemento non dipendono dal numero di massa, ma dal numero atomico; infatti è sufficiente il numero dei protoni a caratterizzare un atomo, in quanto esso condiziona un uguale
5 GLI ISOTOPI Le proprietà di un elemento non dipendono dal numero di massa, ma dal numero atomico; infatti è sufficiente il numero dei protoni a caratterizzare un atomo, in quanto esso condiziona un uguale
Lezioni di Meccanica Quantistica
 Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
STRUTTURA E FORMA DELLE MOLECOLE
 Ricapitolando Z numero atomico = n. di protoni A numero di massa = n. di protoni n. di neutroni 1 UMA = 1/12 x1.99 10 23 g = 1.66 10 24g = 1/12 massa 12C PA peso atomico massa media degli atomi contenuti
Ricapitolando Z numero atomico = n. di protoni A numero di massa = n. di protoni n. di neutroni 1 UMA = 1/12 x1.99 10 23 g = 1.66 10 24g = 1/12 massa 12C PA peso atomico massa media degli atomi contenuti
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Gli accoppiamenti di spin. e i sistemi di spin nucleari
 Gli accoppiamenti di spin e i sistemi di spin nucleari l momento magnetico di un nucleo interagisce con i momenti magnetici dei nuclei vicini. sistono due tipi di interazioni: nterazione diretta, anisotropa
Gli accoppiamenti di spin e i sistemi di spin nucleari l momento magnetico di un nucleo interagisce con i momenti magnetici dei nuclei vicini. sistono due tipi di interazioni: nterazione diretta, anisotropa
Il Legame Ionico. Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B -
 Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Sistema, equilibrio e fase Tre concetti fondamentali. Spettro di massa del mercurio. Schema del funzionamento di uno spettrometro di massa
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare studio. Es.: un
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare studio. Es.: un
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 3-4 2010 Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 3-4 2010 Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare
Ĥ = r r 2
 Due elettroni interagenti (lezione 1) Giovanni Bachelet, 7 ottobre 2005 Per due elettroni 1 e 2 soggetti al potenziale esterno v ext ed interagenti fra loro con potenziale coulombiano, in assenza di campo
Due elettroni interagenti (lezione 1) Giovanni Bachelet, 7 ottobre 2005 Per due elettroni 1 e 2 soggetti al potenziale esterno v ext ed interagenti fra loro con potenziale coulombiano, in assenza di campo
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
