Corso di Chimica Generale, Modulo B
|
|
|
- Letizia Forti
- 7 anni fa
- Visualizzazioni
Transcript
1 Università degli Studi dell Insubria Corso di Laurea Triennale in Chimica e Chimica Industriale Corso di Chimica Generale, Modulo B A.A Simona Galli
2 Orario delle Lezioni: Giovedì, 14:16, Aula Magna, via Valleggio 11, edificio Torre, piano terra (Venerdì, 10:12, Aula Magna, via Valleggio 11, edificio Torre, piano terra) Studio della Docente: Via Valleggio, 9 III Piano Tel.: simona.galli@uninsubria.it Orario di Ricevimento: Su appuntamento con la docente Testi Consigliati: Clerici, Morrocchi, Esercitazioni di Chimica, Ed. Schonefeld & Ziegler Bertini, Luchinat, Mani, Stechiometria. Un avvio allo studio della chimica, Ed. CEA Freni, Sacco, Stechiometria, Ed. CEA. Materiale Didattico: scienze-como.uninsubria.it/sgalli/chimica_generale_b
3 Il Sistema Metrico Internazionale Sistema Internazionale (SI) delle unità di misura, creato nel 1960 dall Ufficio Internazionale dei Pesi e delle Misure. Contempla sette unità fondamentali: Grandezza Fisica Unità SI Simbolo Lunghezza metro m Massa chilogrammo kg Tempo secondo s Temperatura kelvin K Corrente Elettrica ampere A Quantità di Sostanza mole mol Intensità Luminosa candela cd
4 Il Sistema Metrico Internazionale Dalle sette unità fondamentali è possibile definire le unità derivate, per esempio: Grandezza Fisica Unità SI Simbolo Definizione Forza Newton N kg m s -2 Lavoro Joule J N m = kg m 2 s -2 Frequenza Hertz Hz s -1 Resistenza Elettrica Ohm Ω m 2 kg s -3 A -2 = V/A Energia Joule J N m = kg m 2 s -2 Potenza Watt W J/s = kg m 2 s -3 Pressione Pascal Pa N m -2 = kg m -1 s -2 Carica Elettrica Coulomb C A s Potenziale Elettrico Volt V kg m 2 s -3 A -1
5 Multipli o Sottomultipli delle Unità SI Sottomultiplo Prefisso Simbolo 10-1 deci d 10-2 centi c 10-3 milli m 10-6 micro µ 10-9 nano n pico p Multiplo Prefisso Simbolo 10 1 deca da 10 2 etto h 10 3 chilo k 10 6 mega M 10 9 giga G tera T femto f atto a
6 Unità Ausiliarie Utili per un Chimico Unità Simbolo Definizione Atmosfera atm Pa Angstrom Å m Carica dell Elettrone 1, C Caloria cal 1/4,184 J Elettonvolt ev 1, J L'elettronvolt (ev) è un'unità di misura dell'energia, molto usata in ambito atomico e subatomico. Viene definito come l'energia guadagnata (o persa) da un elettrone quando viene mosso nel vuoto tra due punti di una regione in cui ha sede un potenziale elettrostatico e tra i quali vi è una differenza di 1 volt.
7 Affidabilità delle Misure e dei Calcoli Si siano misurati la massa (2,5 g) e il volume (1,14 cm 3 ) di un campione di cloruro di sodio (NaCl). Qual è la sua densità? d = m/v = 2,5/1,14 = 2,19298 g/cm 3 È la risposta corretta? 2,5 g in realtà è compreso tra 2,4 g e 2,6 g. 1,14 cm 3 è in realtà compreso tra 1,13 cm 3 e 1,15 cm 3. Quindi ho: d min = 2,4/1,15 = 2,1 g/cm 3 d max = 2,6/1,13 = 2,3 g/cm 3 La densità va dunque riportata come 2,2 g/cm 3 e non come 2,19298 g/cm 3. Le cifre significative (insieme delle cifre certe più una) con cui posso esprimere la densità sono solo 2.
8 Particella Simbolo Carica (C) Carica a Massa (g) Massa (u.m.a.) b Protone p + 1, , , Neutrone n , , Elettrone e - -1, , = = 1/1836 m(p + ) 1,007/1836 1/1836 (a) Unità di carica: 1, C (b) 1 u.m.a. = 1 Dalton = 1/12 della massa di un atomo di 12 C = 1, g A = Numero di Massa (Numero * Unità di di carica: Protoni 1, Neutroni) -19 C Simbolo dell elemento Z = Numero Atomico (Numero di Protoni o Elettroni)
9 Isotopi: ripasso Si definiscono isotopi quegli atomi aventi lo stesso numero atomico Z ma diverso numero di massa A. Gli isotopi, dunque: 1) appartengono allo stesso elemento (i.e. hanno lo stesso numero di p + ed e - ) * 2) Differiscono nel numero di neutroni (Dalton aveva torto: gli atomi di un elemento non sono completamente identici) Si definisce abbondanza isotopica dell isotopo X di un elemento A la percentuale di tale isotopo (in termini di numero atomi, % X ) presente in un dato campione di A: % X = (n atomi isotopo X)/(n totale atomi di tutti gli isotopi di A nel campione) Si definisce abbondanza isotopica naturale dell isotopo X di un elemento A la percentuale di tale isotopo in un campione presente in natura * Isotopo, dal greco nello stesso luogo. In quanto appartenenti allo stesso elemento, occupano infatti la stessa posizione nella tavola periodica (sistema di raggruppamento degli elementi)
10 Definizione di Massa Atomica o Peso Atomico Si definisce massa atomica (o peso atomico, PA) di un elemento la massa media di un atomo dell elemento in un campione naturale, espressa in u.m.a. (o Dalton). Isotopo Z n 0 A m (u.m.a.) % X PA (u.m.a.) Idrogeno ,008 99,985 Deuterio ,014 0,015 Trizio ,016 Instabile, radioattivo Carbonio esatte 98,90 Carbonio ,00 1,10 Cloro ,97 75,77 Cloro ,97 24,33 Uranio ,72 Uranio ,05 99,27 1,01 12,01 35,45 238,03
11 Per un elemento: Massa Molare o PA Per un composto A n B m : Massa Molare o Peso Molecolare (PM) = PM(A n B m ) = PAR(A) n + PAR(B) m Es. 1: Calcolare la massa molare (PM) di CaCl 2. PM(CaCl 2 ) = 1 PA(Ca) + 2 PA(Cl) = 40, ,45 = 110,98 u.m.a. Es. 2: Calcolare la massa molare (PM) di Na 2 SO 4. PM(Na 2 SO 4 ) = 2 PA(Na) + 1 PA(S) + 4 PA(O) = 2 22, , , ,01 = 145,02 u.m.a. Es. 3: Calcolare la massa molare (PM) di CH 3 COCH 3. PM(CH 3 COCH 3 ) = 3 PA(C) + 6 PA(H) +1 PA(O) = 3 12, , ,00 = 58,09 u.m.a.
12 Esercizi di autovalutazione: Calcolare la massa molare dell acqua, H 2 O. Calcolare la massa molare dell ammoniaca, NH 3. Calcolare la massa molare del metano, CH 4. Calcolare la massa molare dell alcol etilico (o etanolo), CH 3 CH 2 OH. Calcolare la massa molare del pirazolo, C 3 H 4 N 2. Calcolare la massa molare del glucosio, C 6 H 12 O 6. Calcolare la massa molare dell acido solforico, H 2 SO 4. Calcolare la massa molare dell acido acetico, CH 3 COOH.
13 Definizione Rigorosa di Mole Si definisce mole la quantità di sostanza di un sistema che contiene un numero di entità elementari pari al numero di atomi presente in 12 g di 12 C. Quanti atomi ci sono in 12 g di 12 C? Numero atomi di 12 C in 12 g di 12 C = = massa del campione / massa di un atomo di 12 C = = (12 g di atomi di 12 C) / (12 1, g) = 6, Ne consegue: Numero atomi contenuti in 12 g di 12 C = 6, Numero entità contenute in una mole di sostanza = 6, ovvero una mole contiene sempre lo stesso numero di entità, indipendentemente dalla sostanza in esame. Il numero 6, è una quantità fondamentale per i chimici e prende il nome di Numero di Avogadro.
14 Definizione Pratica di Mole Una mole di un individuo chimico corrisponde a quella quantità in grammi numericamente uguale alla sua massa atomica (o molecolare) espressa in u.m.a. Ne consegue che a) per ottenere una mole di un qualsiasi elemento, basta pesare una massa in grammi pari alla suo massa atomica (o peso atomico, PA) espressa in u.m.a. b) per ottenere una mole di un qualsiasi composto, basta pesare una massa in grammi pari alla sua massa molare (peso molecolare, PM) espressa in u.m.a. Es.: 1 mol di magnesio (Mg, PA = 24,31 u.m.a) corrisponde a 24,31 g di magnesio [u.m.a] = [g/mol] = [mg/mol] Es.: 1 mol di acqua (H 2 O, PM = 18,02 u.m.a) corrisponde a 18,02 g di acqua [u.m.a] = [g/mol] = [mg/mol] Es.: 1 mol di metanolo (CH 3 OH, PM = 32,05 u.m.a) corrisponde a 32,05 g di metanolo [u.m.a] = [g/mol] = [mg/mol]
15 Un Passaggio Fondamentale GRAMMI (grandezza fisica) Massa = moli PM (o PA) [g] = [mol g/mol] MOLI (grandezza chimica) Moli = massa / PM (o PA) [mol] = [g/(g/mol)]/mol)] Nelle reazioni chimiche, vi è conservazione delle masse, non già delle moli. Es. 1:: Calcolare a quanti grammi corrispondono 10,7 moli di argento (Ag). m(ag) = PA(Ag) mol(ag) = 107,87 g mol -1 10,7 mol = 1,2 kg Es. 2:: Calcolare quante moli sono contenute in 7,12 g di cloruro di sodio (NaCl). mol(nacl) = m(nacl)/pm(nacl) PM(NaCl) = 22,99 g mol ,45 g mol -1 = 58,44 g mol -1 mol = 7,12 g / 58,44 g mol -1 = 0,12 mol
16 Esercizi di autovalutazione: Calcolare quante moli sono contenute in 7,63 g di acqua, H 2 O. Calcolare la massa di 4,31 moli di ammoniaca, NH 3. Calcolare la massa di 3,24 millimoli di metano, CH 4. Calcolare quante moli sono contenute in 2,91 dg di alcol etilico, CH 3 CH 2 OH. Calcolare quante moli sono contenute in 3,28 kg di pirazolo, C 3 H 4 N 2. Calcolare quante moli ottengo se peso 7,24 g glucosio, C 6 H 12 O 6. Calcolare la massa di 0,27 moli di acido solforico, H 2 SO 4. Calcolare la massa di 0,034 moli di acido acetico, CH 3 COOH.
17 La Percentuale in Peso Secondo la legge della composizione costante (Proust e Berthollet, 1815) ogni campione di un composto puro è costituito da quantità ponderali definite e costanti dei suoi elementi, indipendentemente dalla provenienza del composto. Esistono (almeno) tre modalità per esprimere la composizione di un composto: Numero di atomi di ogni elemento presenti in un unità del composto; Massa degli atomi di ogni elemento in una mole del composto; Massa degli atomi di ogni elemento rispetto alla massa totale del composto: si parla di composizione percentuale: Per una specie A n B m C p avente massa molare PM(A n B m C p ) nota: % in massa di A = n PA(A) / PM(A n B m C p ) 100 % in massa di B = m PA(B) / PM(A n B m C p ) 100 % in massa di C = p PA(C) / PM(A n B m C p ) 100 Naturalmente, deve risultare: Σ i (% in massa) i = 100%
18 Es. 1: Determinare la % in massa di zolfo in SO 3. % S = 1 PA(S) / PM(SO 3 ) 100 = 32,06/[32, ,01] 100 = 40,0% Es. 2: Determinare la % in massa di potassio in K 4 [Fe(CN) 6 ]. % K = 4 PA(K) / PM(K 4 [Fe(CN) 6 ]) 100 = 4 39,10/[4 39, , , ,01] 100 = 42,3% Es. 3: Determinare la % in massa di acqua in Na 2 SO 4 12H 2 O. % H 2 O = 12 PM(H 2 O) / PM(Na 2 SO 4 12H 2 O) 100 = 12 18,02/358,28 = 60,4% Esercizi di autovalutazione: Calcolare la % in massa di ossigeno nell acqua, H 2 O. Calcolare la % in massa di azoto nell ammoniaca, NH 3. Calcolare la % in massa di idrogeno nel metano, CH 4. Calcolare la % in massa di idrogeno nell alcol etilico, CH 3 CH 2 OH.
19 Differenti Tipi di Formule Chimiche La formula minima (o bruta o empirica) rappresenta il rapporto molare minimo tra gli elementi costitutivi del composto ed è ricavabile nota la composizione % in massa di tutti gli elementi presenti nel composto. La formula molecolare rappresenta il rapporto molare tra gli elementi costitutivi del composto in una molecola del composto. È possibile che non vi sia coincidenza tra formule minima e molecolare, ma che la formula molecolare sia un multiplo di quella minima. Il passaggio dalla formula minima alla formula molecolare è possibile nota la massa molare (PM) del composto. La formula di struttura è rappresentativa della disposizione reciproca degli atomi all interno della molecola.
20 Composto Formula Minima Formula Molecolare Formula di Struttura Acqua H 2 O H 2 O H-O-H (Angolare) Acetilene CH C 2 H 2 H-C C-H (Lineare) Benzene CH C 6 H 6 Esagonale Butenino CH C 4 H 4 H C C CH=CH 2 Formaldeide CH 2 O CH 2 O H 2 C=O Acido Acetico CH 2 O C 2 H 4 O 2 CH 3 COOH 2-Idrossietanale CH 2 O C 2 H 4 O 2 O=CH CH 2 OH Glucosio CH 2 O C 6 H 12 O 6 Complessa Nicotina C 5 H 7 N C 10 H 14 N 2 Complessa
21 Calcolo della Formula Minima dalle Percentuali in Peso Es. 1: Un composto ha dato all analisi chimica i seguenti risultati: C 76,93%; H 5,12 %; N 17,95 %. Determinare la formula più semplice che ne esprime la composizione. Supponiamo di avere 100 g del composto. Di essi: 76,93 g sono C 5,12 g sono H 17,95 g sono N Ricordando m(e)/pa(e) = mol(e) (E = elemento) si può calcolare: 76,93 g /(12,01 g/mol) = 6,41 mol di C 5,12 g /( 1,01 g/mol) = 5,07 mol di H 17,95 g /(14,01 g/mol) = 1,28 mol di N La formula è dunque C 6,41 H 5,07 N 1,28? No. Dobbiamo trovare degli interi semplici tali che 6,41 : 5,07: 1,28 = nc : nh : 1 nc = 6,41/1,28 = 4,99 nh = 5,07/1,28 = 3,96 La formula cercata è C 5 H 4 N
22 In forma tabulare: Elemento % PA, g/mol Moli Moli Normalizzate N Intero C 76,93 12,01 6,41 4,99 5 H 5,12 1,01 5,07 3,96 4 N 17,95 14,01 1,28 1,00 1 Es. 2: Un ossido di ferro (Fe x O y ) possiede il 72,80% in massa di Fe. Determinarne la formula minima. Elemento % PA, g/mol Moli Moli Normalizzate N Intero Fe 72,80 55,85 1,30 1,00 3 O 27,20 16,01 1,70 1,30 4 Trattasi di Fe 3 O 4, magnetite.
23 Es. 3: Un solfato di cromo e potassio ha dato, per via analitica, i seguenti risultati: K 7,82%; Cr 10,41%; SO ,40%; H 2 O 43,30%. Calcolarne la formula minima. Specie % PA o PM, g/mol Moli Moli Normalizzate N Intero K + 7,82 39,10 0,20 1,00 1 Cr 3+ 10,41 52,01 0,20 1,00 1 SO ,40 98,06 0,39 1,96 2 H 2 O 43,30 18,02 2,40 12,00 12 Es. 4: Un solfuro di antimonio contiene 0,962 g di S e 2,435 g di Sb. Calcolarne la formula minima. La formula cercata è KCr(SO 4 ) 2 12H 2 O Elemento Massa, g PA, g/mol Moli Moli Normalizzate N Intero S 0,962 32,01 0,03 1,50 3 Sb 2, ,75 0,02 1,00 2 La formula cercata è Sb 2 S 3
24 Miscele e Purezza di un Campione A) Calcolo della purezza da dati di analisi elementare Es.: Un campione di HgS impuro contiene il 78,47% in massa di Hg. Trovare la purezza percentuale del campione. Purezza% = m(hgs)/m(totale) 100 m(hgs) = m(hg) + m(s) m(hg) = 78,47% m(totale) m(s) = mol(s) PA(S) mol(s) = mol(hg) = m(hg) PA(Hg) = 78,47% m(totale) PA(Hg) Si supponga di avere 100 g di campione HgS impuro: 78,47 g sono Hg. mol(hg) = m(hg)/pa(hg) = 78,47 g / 200,59 g mol -1 = 0,39 = mol(s) m(s) = mol(s) PA(S) = 0,39 mol 32,06 g mol -1 = 12,54 g m(hgs) = 78, ,54 = 91,01 g La purezza è del 91,01 %
25 B) Calcolo del contenuto percentuale dalla purezza Es. 1: Un campione di Cu 2 S è puro al 67,0% in massa. Quanto rame posso estrarre da 1,38 kg di tale campione? Qual è la percentuale in massa di rame nel campione? m(cu) = mol(cu) PA(Cu) mol(cu) = 2 mol(cu 2 S) = 2 m(cu 2 S)/PM(Cu 2 S) m(cu 2 S) = 67,0% m(totale) = m(totale) 0,67 PM(Cu 2 S) = 2 PA(Cu) + 1 PA(S) 2 m(cu 2 S) = 1,38 kg 0,67 = 0,93 kg = 930 g mol Cu 2 S = m(cu 2 S)/PM(Cu 2 S) = 930 g / 159,16 g mol -1 = 5,81 mol mol Cu = 5,81 2 mol = 11,62 mol m(cu) = 11,62 63,55 = 738 g 738 g di rame in 1380 g di campione = 53% in massa di rame
26 Es. 2: Siano dati a) 3 g di KCl al 50%, b) 2 g di K 2 SO 4 puro al 97% in massa. Quale dei due campioni contiene più potassio? a) m(k) = %(K in KCl) m(kcl) = PA(K)/PM(KCl) m(kcl) PA(K) = 39,10 g/mol PM(KCl) = 1 PA(K) + 1 PA(Cl) = 39, ,45 = 74,55 g/mol m(k) = (39,10/74,55) 1,5 = 0,79 g b) m(k) = %(K in K 2 SO 4 ) m(k 2 SO 4 ) = 2 PA(K)/PM(K 2 SO 4 ) m(k 2 SO 4 ) PA(K) = 39,10 g/mol PM(K 2 SO 4 ) = 2 PA(K)+1 PA(S)+4 PA(O) = 4 39,10+32, ,00 = 174,26 g/mol m(k 2 SO 4 ) = 97% m(totale) = m(totale) 0,97 m(k) = (2 39,10/174,26) m(totale) 0,97 = 0,87 g
27 Reazioni Chimiche: Esempi Scambio: NaCl + AgNO 3 AgCl + NaNO 3 Acido-Base o Neutralizzazione: HCl + NaOH H 2 O + NaCl Ossidoriduzione: 2 H 2 + O 2 2 H 2 O Sintesi: 3 H 2 + N 2 2 NH 3 Decomposizione: BaCO 3 BaO + CO 2 Combustione: CH O 2 CO H 2 O
28 1) Equazione Chimica non Bilanciata A + B C +D 2) Equazione Chimica Bilanciata aa + bb cc +dd a, b, c, d: Coefficienti di Reazione 3) aa (x) + bb (y) Condizioni cc (z) +dd (w) x, y, z, w = s: solido l: liquido g: gas aq: in soluzione acquosa... Condizioni: temperatura pressione solvente catalizzatore... La relazione quantitativa tra reagenti e prodotti di una reazione chimica, rappresentabile mediante un equazione chimica, viene definita stechiometria della reazione.
29 Un equazione chimica completa contiene tre tipi di informazioni: 1) Natura dei reagenti e dei prodotti (info qualitativa) 2) Rapporto atomico di combinazione (info a livello microscopico): per fornire informazioni a livello quantitativo sulla reazione chimica che descrive, un equazione chimica deve essere bilanciata 3) Metodo quantitativo ed operativo (info a livello macroscopico) Non informa su meccanismo o spontaneità
30 Per esempio: Ferro + Zolfo Disolfuro di zolfo Ferro Fe (s) + 2 S (s) FeS 2(s) Fe S FeS 2 Numero moli sostanza 1 mol 2 mol 1 mol Massa molare sostanza 55,85 g/mol 32,06 g/mol 119,87 g/mol Massa totale sostanza 55,85 g 64,12 g 119,97 g Massa totale 119,97 g 119,97 g Si ha conservazione della massa Non si conserva necessariamente il numero di moli
31 Es. 1: Si consideri la reazione: Fe (s) + 2 S (s) FeS 2(s) Dati 3 kg di ferro, stabilire a) quanto zolfo è necessario perché la reazione sia completa; b) quanta pirite si forma. a) mol(fe) = m(fe)/pa(fe) = 3000 g / 55,85 g mol -1 = 53,71 mol Per ogni mole di Fe si necessitano 2 moli di S, i.e.: mol(s) = 2 mol(fe) = 107,42 mol m(s) = mol(s) PA(S) = 107,42 32,06 = 3440 g b) m(fes 2 ) = m(fe) + m(s) = 3000 g g = 6440 g Oppure 1 mole di Fe forma 1 mole di FeS 2 mol(fes 2 ) = mol(fe) = 53,71 mol m(fes 2 ) = mol(fes 2 ) PM(FeS 2 ) = 53,71 mol 119,17 g mol -1 = 6440 g Oppure 1 mole di S forma 0,5 moli di FeS 2 mol(fes 2 ) = mol(s)/2 = 53,71 mol m(fes 2 ) = mol(fes 2 ) PM(FeS 2 ) = 53,71 mol 119,17 g mol -1 = 6440 g
32 Es. 2: Si consideri la reazione: 4 Ce (s) + 3 S (s) Ce 4 S 3(s) a) Determinare la quantità di zolfo necessaria per reagire a completezza con 7,50 g di cerio. b) Calcolare quanto prodotto si forma. a) mol(ce) = m(ce)/pa(ce) = 7,50 g (Ce) / 140,12 g mol -1 = 5, mol Per ogni 4 moli di Ce si necessitano 3 moli di S, i.e.: 4 : 3 = 5, : mol(s) mol(s) = 5, ¾ = 4, mol m(s) = mol(s) PA(S) = 4, mol 32,06 g mol -1 = 1,28 g b) 4 moli di Ce formano 1 mole di Ce 4 S 3 mol(ce 4 S 3 ) = ¼ mol(ce) = ¼ 5, mol = 1, mol m(ce 4 S 3 ) = mol(ce 4 S 3 ) PM(Ce 4 S 3 ) = 1, mol 656,66 g mol -1 = 8,80 g Oppure: 3 moli di S formano 1 mole di Ce 4 S 3 mol(ce 4 S 3 ) = 1/3 mol(s) = 1/3 4, mol = 1, mol m(ce 4 S 3 ) = mol(ce 4 S 3 ) PM(Ce 4 S 3 ) = 1, mol 656,66 g mol -1 = 8,80 g Oppure: m(ce 4 S 3 ) = m(ce) + m(s) = 7,50 g + 1,28 g = 8,78 g
33 Es. 3: Quando il ferro (Fe) viene riscaldato all aria, reagisce con l ossigeno (O 2 ) contenuto nell aria a formare un ossido; si consumano 2 atomi di ferro ogni 3 atomi di ossigeno. Si supponga di avere 1,51 g di Fe: a) quanto ossido di ferro si forma [2,16 g]? b) Quanto ossigeno si consuma [0,65 g]? 2 Fe + 3/2 O 2 Fe 2 O 3 a) m(fe 2 O 3 ) = mol(fe 2 O 3 ) PM(Fe 2 O 3 ) Ogni 2 moli di ferro si forma 1 mole di Fe 2 O 3 mol(fe 2 O 3 ) = mol(fe)/2 mol(fe) = m(fe)/pa(fe) b) m(o 2 ) = mol(o 2 ) PM(O 2 ) Ogni 2 moli di ferro si consumano 3/2 moli di ossigeno mol(o 2 ) = mol(fe)/2 3/2 mol(fe) = m(fe)/pa(fe)
34 Es. 4: L elemento X reagisce con l ossigeno a dare un ossido la cui formula minima è X 3 O 5. Quando 0,36 g di X reagiscono, si formano 0,56 g di ossido. Calcolare il peso atomico di X [47,87 g/mol]. 3 X + 5/2 O 2 X 3 O 5 PA(X) = m(x)/mol(x) Ogni 3 moli di X reagiscono 5/2 moli di O 2 mol(x) = 2/5 mol(o 2 ) 3 mol(o 2 ) = m(o 2 )/PM(O 2 ) Poiché si ha conservazione della massa m(o 2 ) = m(x 3 O 5 ) m(x)
35 La Resa di una Reazione La quantità massima di prodotto ottenibile in presenza di date quantità di reagenti definisce la resa teorica di una reazione. È quasi inevitabile che vengano commessi errori sperimentali (travaso di solidi o liquidi, pesate, misurazioni ) tali da portare a una resa effettiva inferiore a quella teorica attesa. Si parla di resa percentuale: Resa percentuale = (resa effettiva / resa teorica) 100 La resa percentuale è uno dei dati che si indica normalmente nella ricetta di una sintesi chimica, in quanto orienta chi la deve eseguire rispetto alle attese.
36 L Agente Limitante di una Reazione I reagenti possono non essere tutti presenti in quantità stechiometriche: il reagente presente in quantità molari inferiori, i.e. quello che limita la quantità di prodotto ottenibile, prende il nome di agente limitante. Gli altri sono ovviamente in eccesso. Di fronte a una reazione sono dunque possibili le seguenti domande: 1) Si è in presenza di quantità stechiometriche per tutti i reagenti o è individuabile un agente limitante? 2) Quanto prodotto si forma in funzione dell agente limitante eventualmente presente? 3) Quanto(i) reagente(i) in eccesso resta(no) quanto l agente limitante è stato completamente consumato? In generale, data la reazione bilanciata: aa + bb cc +dd Se il rapporto (mol A disponibili)/(mol B disponibili) è superiore ad a/b, allora A è in eccesso e B è l agente limitante. Se il rapporto (mol A disponibili)/(mol B disponibili) è inferiore ad a/b, allora B è in eccesso e A è l agente limitante.
37 Es. 1: Si consideri la reazione: Al + Cr 2 O 3 Cr + Al 2 O 3 Si calcoli: a) quale reattivo risulta in eccesso; b) quanto cromo si ottiene facendo reagire 5,4 g di Al con 30,4 g di Cr 2 O 3 ; c) quanto reattivo in eccesso è presente alla fine della reazione. Al Cr 2 O 3 Cr Al 2 O 3 Massa (g) 5,4 30,4 - - PA o PM (g mol -1 ) Moli iniziali (mol) 0,2 0,2 - - Moli reagite (mol) -0,2-0,1 +0,2 +0,1 Moli finali (mol) 0 0,1 0,2 0,1 PA o PM (g mol -1 ) Massa (g) - 15,2 10,4 10,2 Controllo con bilancio di massa: Inizio: 5,4 + 30,4 = 35,8 g Fine: 15,2 + 10,4 + 10,2 = 35,8 g
38 Es. 2: Si consideri la reazione: C + O 2 CO 2 Si supponga di far reagire 100 g di C con 190 g di O 2. a) Qual è l agente limitante? b) Quanto prodotto si forma? c) Qual è la resa di reazione? C O 2 CO 2 Massa (g) PA o PM (g mol -1 ) 12,01 32,00 44,01 Moli iniziali (mol) 8,33 5,94 - Moli reagite (mol) -5,94-5,94 +5,94 Moli finali (mol) 2,39 0 5,94 PA o PM (g mol -1 ) 12,01 32,00 44,01 Massa (g) 28, ,42 La resa di reazione si calcola sull agente NON limitante: Resa % su C = 5,94/8, = 71,3%
39 Es. 3: Si consideri la reazione: BaCl 2 + H 2 SO 4 BaSO 4 + HCl Si supponga di far reagire 1,07 g di BaCl 2 con 0,25 g di H 2 SO 4. a) Qual è l agente limitante? b) Quanto prodotto si forma? c) Qual è la resa di reazione? BaCl 2 H 2 SO 4 BaSO 4 HCl Massa (g) 1,07 0,25 - PM (g mol -1 ) 208,33 98,02 233,33 36,46 millimoli iniziali (mol) 5,14 2, millimoli reagite (mol) -2,55-2,55 +2,55 +5,10 millimoli finali (mol) 2,59 0 2,55 5,10 PM (g mol -1 ) 208,33 98,02 233,33 36,46 Massa (mg) 538, ,1 186,2 La resa di reazione si calcola sull agente NON limitante: Resa % su BaCl 2 = 2,55/5, = 50,4%
40 Esercizi Aggiuntivi Es. 1: 1. Calcolare la massa molare e la composizione percentuale di ogni elemento nei seguenti composti: a. metano, CH 4 b. diossido di carbonio, CO 2 c. acqua, H 2 O d. acetone, CH 3 COCH 3 2. Quanti grammi di metano sono contenuti in 45,00 moli? 3. Quante moli di acetone sono contenute in 10 g di acetone? 4. Quante moli e quante molecole sono contenute in 1 kg di acqua?
41 Es. 2: Si calcolino quante moli di idrossido di sodio (NaOH) sono contenute in 3200 g di tale sostanza. Es. 3: Si calcolino quante moli di diossido di carbonio (CO 2 ) sono contenute in 1,1 dg di tale sostanza. Es. 4: Si calcolino quanti grammi di acido solforico (H 2 SO 4 ) sono presenti in 0,05 moli di tale sostanza.
42 Es. 5: Si determinino la formula minima e la formula molecolare di un composto di massa molare 132,16 g/mol e composizione percentuale H = 9,15%, C = 54,53%, O = 36,32%. Es. 6: Calcolare la formula minima della sostanza che presenta la seguente composizione percentuale: Ca = 40%, C = 12 %, O = 48%. Es. 7: Calcolare la formula minima del composto organico avente la seguente composizione percentuale: C = 26,67%, H = 2,22%, O = 71,11%. Es. 8: Calcolare la formula minima del composto organico avente la seguente composizione percentuale: C = 92,3%, H = 7,7%.
43 Es. 9: Calcolare la formula minima del minerale avente la seguente composizione percentuale: Na = 8,74%; Al = 10,29%; Si = 32,15%; O = 48,79%. Es. 10: Sia dato un campione di idrossido di potassio (KOH) puro al 12% in massa. Quanto potassio contiene? Es. 11: Si consideri la reazione: 2 Ag + S Ag 2 S Si supponga di far reagire 5,00 g di C con 1,00 g di S. a) Qual è l agente limitante? [Ag] b) Quanto prodotto si forma? c) Qual è la resa di reazione? Es. 12: Si consideri la reazione: BaCO HCl BaCl 2 + CO 2 + H 2 O Si supponga di far reagire 120,00 g di BaCO 3 con 62,80 g di HCl. a) Qual è l agente limitante? b) Quanto BaCl 2 si forma? c) Qual è la resa di reazione?
Il Sistema Metrico Internazionale. Grandezza Fisica Unità SI Simbolo
 Il Sistema Metrico Internazionale Sistema Internazionale (SI) delle unità di misura, creato nel 1960 dall Ufficio Internazionale dei Pesi e delle Misure. È un sistema con sette unità fondamentali: Grandezza
Il Sistema Metrico Internazionale Sistema Internazionale (SI) delle unità di misura, creato nel 1960 dall Ufficio Internazionale dei Pesi e delle Misure. È un sistema con sette unità fondamentali: Grandezza
Definizione rigorosa di Mole. Definizione rigorosa di u.m.a. = Dalton. 1 u.m.a. = 1/12 della massa di un atomo di 12 C
 Definizione rigorosa di Mole Quantità di sostanza di un sistema che contiene un numero di entità elementari pari al numero di atomi presente in 0.012 kg di carbonio(12). Quant è grande questo numero? N
Definizione rigorosa di Mole Quantità di sostanza di un sistema che contiene un numero di entità elementari pari al numero di atomi presente in 0.012 kg di carbonio(12). Quant è grande questo numero? N
Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 1: mole, bilanciamento di equazioni chimiche non redox, formule minime e
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 1: mole, bilanciamento di equazioni chimiche non redox, formule minime e
Esercizi di. Stechiometria dei composti. mercoledì 9 dicembre 2015
 Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Carica e massa di particelle atomiche
 Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
MASSE ATOMICHE. Oggi è possibile misurare accuratamente le masse atomiche tramite uno strumento chiamato spettrometro di massa
 Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Relazioni di massa nelle reazioni chimiche. Capitolo 3
 Relazioni di massa nelle reazioni chimiche Capitolo 3 Micro mondo atomi & molecole Macro mondo grammi Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo
Relazioni di massa nelle reazioni chimiche Capitolo 3 Micro mondo atomi & molecole Macro mondo grammi Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo
Pesi atomici e molecolari La mole
 Pesi atomici e molecolari La mole Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 QUALE
Pesi atomici e molecolari La mole Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 QUALE
Reazioni chimiche e stechiometria
 Reazioni chimiche e stechiometria REAZIONI CHIMICHE Trasformazione di una o più sostanze (reagenti) in una o più sostanze (prodotti) EQUAZIONE CHIMICA Una equazione chimica è la rappresentazione simbolica
Reazioni chimiche e stechiometria REAZIONI CHIMICHE Trasformazione di una o più sostanze (reagenti) in una o più sostanze (prodotti) EQUAZIONE CHIMICA Una equazione chimica è la rappresentazione simbolica
Problema 1 Mg + 2HCl H 2 + MgCl 2. di Mg 1 Mg 1 H 2 quindi 0,823 moli di H 2 di H 2
 REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro
 Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro Trovare una bilancia che possa pesare un atomo è un sogno irrealizzabile. Non potendo determinare
Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro Trovare una bilancia che possa pesare un atomo è un sogno irrealizzabile. Non potendo determinare
Calcoli stechiometrici su: La mole Composizione percentuale dei composti chimici Formule molecolari ed empiriche Composizione di miscele
 Calcoli stechiometrici su: La mole Composizione percentuale dei composti chimici Formule molecolari ed empiriche Composizione di miscele La mole (mol) è l unità di misura della grandezza fondamentale quantità
Calcoli stechiometrici su: La mole Composizione percentuale dei composti chimici Formule molecolari ed empiriche Composizione di miscele La mole (mol) è l unità di misura della grandezza fondamentale quantità
Calcoli applicati alla chimica analitica. Unità di misura del Sistema Internazionale
 Calcoli applicati alla chimica analitica Unità di misura del Sistema Internazionale Soluzioni e loro concentrazioni Stechiometria chimica 1 Unità di misura SI Il Sistema Internazionale delle Unità (SI)
Calcoli applicati alla chimica analitica Unità di misura del Sistema Internazionale Soluzioni e loro concentrazioni Stechiometria chimica 1 Unità di misura SI Il Sistema Internazionale delle Unità (SI)
LEGGI PONDERALI DELLA CHIMICA
 LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
Chimica. Scienza che studia: proprietà, composizione e struttura della materia, e le trasformazioni che in essa avvengono
 Chimica Scienza che studia: proprietà, composizione e struttura della materia, e le trasformazioni che in essa avvengono La Chimica è una scienza sperimentale: Si basa su misure ottenute da esperimenti
Chimica Scienza che studia: proprietà, composizione e struttura della materia, e le trasformazioni che in essa avvengono La Chimica è una scienza sperimentale: Si basa su misure ottenute da esperimenti
IL SISTEMA INTERNAZIONALE DI MISURA
 IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. Massa atomica MOLE. a.a.
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Misure e Unità di Misura
 2. La Mole Misure e Unità di Misura L Incertezza delle Misure - come utilizzare le cifre significative nel calcolo Le Quantità Chimiche - la MOLE - la MASSA MOLARE - la misura dei composti La Determinazione
2. La Mole Misure e Unità di Misura L Incertezza delle Misure - come utilizzare le cifre significative nel calcolo Le Quantità Chimiche - la MOLE - la MASSA MOLARE - la misura dei composti La Determinazione
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
Le leggi ponderali, la mole e il calcolo stechiometrico. Lezioni 33-38
 Le leggi ponderali, la mole e il calcolo stechiometrico Lezioni 33-38 Isotopi Atomi che hanno lo stesso numero di protoni, ma differente numero di neutroni, sono definiti isotopi Gli isotopi di uno stesso
Le leggi ponderali, la mole e il calcolo stechiometrico Lezioni 33-38 Isotopi Atomi che hanno lo stesso numero di protoni, ma differente numero di neutroni, sono definiti isotopi Gli isotopi di uno stesso
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Le reazioni chimiche
 Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Una reazione chimica è un processo in cui una serie di sostanza (dette reagenti) viene convertita in altre sostanza (dette
Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Una reazione chimica è un processo in cui una serie di sostanza (dette reagenti) viene convertita in altre sostanza (dette
Le unità fondamentali SI. Corrente elettrica
 ESERITAZIONE 1 1 Le unità fondamentali SI Grandezza fisica Massa Lunghezza Tempo Temperatura orrente elettrica Quantità di sostanza Intensità luminosa Nome dell unità chilogrammo metro secondo Kelvin ampere
ESERITAZIONE 1 1 Le unità fondamentali SI Grandezza fisica Massa Lunghezza Tempo Temperatura orrente elettrica Quantità di sostanza Intensità luminosa Nome dell unità chilogrammo metro secondo Kelvin ampere
Chimica. 1) Il simbolo del Carbonio è: A) C B) Ca. C) Ce D) Cu. 2) Secondo il principio della conservazione della materia:
 Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
REAZIONI ED EQUAZIONI CHIMICHE
 REAZIONI ED EQUAZIONI CHIMICHE Per reazione chimica si intende la trasformazione di una o più sostanze chiamate REAGENTI in una o più sostanze chiamate PRODOTTI. Le equazioni chimiche sono la traduzione
REAZIONI ED EQUAZIONI CHIMICHE Per reazione chimica si intende la trasformazione di una o più sostanze chiamate REAGENTI in una o più sostanze chiamate PRODOTTI. Le equazioni chimiche sono la traduzione
Alcune informazioni utili
 Alcune informazioni utili DATE 12 incontri 10-17-24 ottobre 2016 7-14-21-28 novembre 2016 5-12-19 dicembre 2016 9-16 gennaio 2017 ogni lunedì ORARIO dalle 8.30 alle 10.30 Aula VM1 Dove trovarmi E-mail:
Alcune informazioni utili DATE 12 incontri 10-17-24 ottobre 2016 7-14-21-28 novembre 2016 5-12-19 dicembre 2016 9-16 gennaio 2017 ogni lunedì ORARIO dalle 8.30 alle 10.30 Aula VM1 Dove trovarmi E-mail:
Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ).
 Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ). moli Zn = massa Zn / m.m. Zn = 5,50 / 65,409 g mol -1 = 8,41 10-2 mol Calcolare a quante moli
Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ). moli Zn = massa Zn / m.m. Zn = 5,50 / 65,409 g mol -1 = 8,41 10-2 mol Calcolare a quante moli
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza?
 Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Corso di chimica generale
 Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
U.M.A. e le masse ATOMICHE
 U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione. Composti: specie chimiche definite formate da due o più elementi
 Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione Composti: specie chimiche definite formate da due o più elementi Elemento Simbolo nomi con radici latine nomi derivati dalla
Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione Composti: specie chimiche definite formate da due o più elementi Elemento Simbolo nomi con radici latine nomi derivati dalla
Capitolo 10. Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni 1
 Capitolo 10 N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni
Capitolo 10 N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni
Cosa è una reazione chimica?
 Cosa è una reazione chimica? Una reazione chimica è un processo o trasformazione della materia che porta alla formazione di nuove sostanze, i prodotti, trasformando profondamente le sostanze di partenza,
Cosa è una reazione chimica? Una reazione chimica è un processo o trasformazione della materia che porta alla formazione di nuove sostanze, i prodotti, trasformando profondamente le sostanze di partenza,
Esempio: L analisi di un campione ha rivelato che esso contiene 4.50 moli. di O e 1.80 moli di P. Calcolare la formula minima.
 Esempio: L analisi di un campione ha rivelato che esso contiene 4.50 moli di O e 1.80 moli di P. Calcolare la formula minima. 13 Esercizio: Un campione di Uranio del peso di 2.50 g viene scaldato all aria.
Esempio: L analisi di un campione ha rivelato che esso contiene 4.50 moli di O e 1.80 moli di P. Calcolare la formula minima. 13 Esercizio: Un campione di Uranio del peso di 2.50 g viene scaldato all aria.
C (preso come riferimento); esso corrisponde a 1, kg.
 UNITÀ DI MASSA ATOMICA Si definisce: Unità di massa atomica: ( u.m.a.) = 2 della massa del nuclide 2 6 C (preso come riferimento); esso corrisponde a,6605 0-27 kg. Peso atomico : (PA) Il peso dell atomo
UNITÀ DI MASSA ATOMICA Si definisce: Unità di massa atomica: ( u.m.a.) = 2 della massa del nuclide 2 6 C (preso come riferimento); esso corrisponde a,6605 0-27 kg. Peso atomico : (PA) Il peso dell atomo
In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono.
 ESERCITAZIONE 6 RAPPORTI PONDERALI E VOLUMETRICI NELLE REAZIONI In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono. 1) Quanto acido solforico reagisce con 100g
ESERCITAZIONE 6 RAPPORTI PONDERALI E VOLUMETRICI NELLE REAZIONI In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono. 1) Quanto acido solforico reagisce con 100g
Esercizi di stechiometria
 Esercizi di stechiometria La reazione globale da bilanciare) per ottenere il carbonato di sodio secondo il processo di Solvay è la seguente: Calcolare quanto cloruro di sodio NaCl) occorre per ottenere
Esercizi di stechiometria La reazione globale da bilanciare) per ottenere il carbonato di sodio secondo il processo di Solvay è la seguente: Calcolare quanto cloruro di sodio NaCl) occorre per ottenere
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio:
 Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Struttura atomica della materia
 Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
UNITA DI MISURA. Le unità di misura sono molto importanti
 Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
- Un atomo legato con altri atomi modifica la struttura elettronica esterna che possedeva prima di dare luogo al legame.
 NUMERO DI OSSIDAZIONE - Un atomo legato con altri atomi modifica la struttura elettronica esterna che possedeva prima di dare luogo al legame. - Nei composti ionici la modifica di tale struttura é evidente:
NUMERO DI OSSIDAZIONE - Un atomo legato con altri atomi modifica la struttura elettronica esterna che possedeva prima di dare luogo al legame. - Nei composti ionici la modifica di tale struttura é evidente:
+ + Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria. CH 4 (g)+ 2 O 2 (g) CO 2 (g) + 2 H 2 O(l) 1
 Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria + + 1 molecola di metano (CH 4 ) 2 molecole di ossigeno (O 2 ) 1 molecola di biossido di carbonio (CO 2 ) 2 molecole
Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria + + 1 molecola di metano (CH 4 ) 2 molecole di ossigeno (O 2 ) 1 molecola di biossido di carbonio (CO 2 ) 2 molecole
Struttura atomica della materia
 Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Massa degli atomi e delle molecole
 Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
ESERCIZI I PARTE. 1 Bilanciamento
 ESERCIZI I PARTE 1 1 Bilanciamento 1. H 3 PO 3 + CuO Cu 3 (PO 3 ) 2 +3H 2 O ) 2. Cs 2 O + H 2 O CsOH 3. P 2 O 5 + H 2 O HPO 3 4. NaCl + H 2 SO 4 Na 2 SO 4 + HCl 5. NaF + Mg(OH) 2 MgF 2 + NaOH 6. Al(OH)
ESERCIZI I PARTE 1 1 Bilanciamento 1. H 3 PO 3 + CuO Cu 3 (PO 3 ) 2 +3H 2 O ) 2. Cs 2 O + H 2 O CsOH 3. P 2 O 5 + H 2 O HPO 3 4. NaCl + H 2 SO 4 Na 2 SO 4 + HCl 5. NaF + Mg(OH) 2 MgF 2 + NaOH 6. Al(OH)
Soluzioni. capitolo La massa assoluta di una molecola si calcola moltiplicando M r per u.
 Soluzioni capitolo 8 VERIFICA LE TUE CONOSCENZE LA MASSA ATOMICA ASSOLUTA E RELATIVA 1 La massa atomica assoluta è la massa di un atomo espressa in kg; il suo simbolo è m a. 2 Affermazione falsa: B Corrisponde
Soluzioni capitolo 8 VERIFICA LE TUE CONOSCENZE LA MASSA ATOMICA ASSOLUTA E RELATIVA 1 La massa atomica assoluta è la massa di un atomo espressa in kg; il suo simbolo è m a. 2 Affermazione falsa: B Corrisponde
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
La mole e la massa molare
 La mole e la massa molare Un concetto strettamente correlato al peso relativo e fondamentale in chimica per i calcoli quantitativi è quello di mole. La mole è l unità di misura di una delle sette grandezze
La mole e la massa molare Un concetto strettamente correlato al peso relativo e fondamentale in chimica per i calcoli quantitativi è quello di mole. La mole è l unità di misura di una delle sette grandezze
CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO
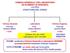 CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO Chimica Generale Laboratorio Chimica Organica Prof.ssa Barbara Milani 7 CFU Prof. Tiziano Montini 2 CFU Lezione: 8/11
CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO Chimica Generale Laboratorio Chimica Organica Prof.ssa Barbara Milani 7 CFU Prof. Tiziano Montini 2 CFU Lezione: 8/11
Massa assoluta e relativa e mole
 Massa assoluta e relativa e mole Massa atomica assoluta.. Massa di un atomo di un dato elemento. In questo caso si parla spesso di peso atomico assoluto, che viene espresso in grammi: l'ordine dei valori
Massa assoluta e relativa e mole Massa atomica assoluta.. Massa di un atomo di un dato elemento. In questo caso si parla spesso di peso atomico assoluto, che viene espresso in grammi: l'ordine dei valori
Laboratorio di Chimica Generale ed Inorganica. Lezione 3. Atomi ed elementi Unità di massa atomica Mole
 Laboratorio di Chimica Generale ed Inorganica Lezione 3 Atomi ed elementi Unità di massa atomica Mole Dott.ssa Lorenza Marvelli Dipartimento di Scienze Chimiche e Farmaceutiche Laboratorio di Chimica Generale
Laboratorio di Chimica Generale ed Inorganica Lezione 3 Atomi ed elementi Unità di massa atomica Mole Dott.ssa Lorenza Marvelli Dipartimento di Scienze Chimiche e Farmaceutiche Laboratorio di Chimica Generale
1) Calcola la massa molecolare relativa e la massa molare delle seguenti sostanze: NH ( x3) = u.m.a 17.
 1) Calcola la massa molecolare relativa e la massa molare delle seguenti sostanze: NH3 14.0067+(1.00797x3) = 17.03 u.m.a 17.03 gr mol -1 2) Qual è la massa in grammi di 1,00 mol di atomi di fosforo (P)
1) Calcola la massa molecolare relativa e la massa molare delle seguenti sostanze: NH3 14.0067+(1.00797x3) = 17.03 u.m.a 17.03 gr mol -1 2) Qual è la massa in grammi di 1,00 mol di atomi di fosforo (P)
Testi Consigliati. I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli. Qualsiasi altro testo che tratti gli argomenti elencati nel programma
 Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Una reazione chimica rappresenta un processo di trasformaczioni in cui si rompono e si formano legami chimici. γc + δd
 Una reazione chimica rappresenta un processo di trasformaczioni in cui si rompono e si formano legami chimici αa + βb γc + δd - A e B: reagenti - C e D: prodotti - α,β,γ e δ: coefficienti stechiometrici
Una reazione chimica rappresenta un processo di trasformaczioni in cui si rompono e si formano legami chimici αa + βb γc + δd - A e B: reagenti - C e D: prodotti - α,β,γ e δ: coefficienti stechiometrici
struttura atomica della materia La chimica
 Struttura atomica della materia 1 La chimica La chimica è la scienza che si occupa dello studio della composizione e delle proprietà delle varie forme della materia 2 bbvbsxbfxbfx 1 Classificazione della
Struttura atomica della materia 1 La chimica La chimica è la scienza che si occupa dello studio della composizione e delle proprietà delle varie forme della materia 2 bbvbsxbfxbfx 1 Classificazione della
Scritto chimica generale
 Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Intro & Stechiometria
 CHIMICA Studio della materia (composizione, stru7ura e proprietà) e dei suoi cambiamen; (trasformazioni) Azione: su due livelli macroscopico (proprietà e trasformazioni della materia visibile) microscopico
CHIMICA Studio della materia (composizione, stru7ura e proprietà) e dei suoi cambiamen; (trasformazioni) Azione: su due livelli macroscopico (proprietà e trasformazioni della materia visibile) microscopico
COME SI STABILISCE IL VALORE DELLA MOLE DI UNA SOSTANZA (anche detta MASSA MOLARE)?
 LA MOLE quantità di sostanza che contiene un numero di particelle uguale al numero di atomi presenti in 12 g di carbonio 12 (= valore mole del carbonio 12). una mole quindi contiene sempre 6,02 x 10 23
LA MOLE quantità di sostanza che contiene un numero di particelle uguale al numero di atomi presenti in 12 g di carbonio 12 (= valore mole del carbonio 12). una mole quindi contiene sempre 6,02 x 10 23
Stechiometria. Stechiometria. Stechiometria
 Stechiometria attendibilità: è la qualità globale di un dato. Dipende da: sensibilità: è la più piccola quantità che si riesce a determinare, cioè a distinguere sicuramente da zero. accuratezza: è la concordanza
Stechiometria attendibilità: è la qualità globale di un dato. Dipende da: sensibilità: è la più piccola quantità che si riesce a determinare, cioè a distinguere sicuramente da zero. accuratezza: è la concordanza
Sommario della lezione 5. Esercizi sui concetti di Mole e Composizione percentuale. Formule chimiche
 Sommario della lezione 5 Esercizi sui concetti di Mole e Composizione percentuale Formule chimiche Qual è la massa molecolare del glucosio? Il glucosio è costituito da molecole di formula C 6 H 12 O 6.
Sommario della lezione 5 Esercizi sui concetti di Mole e Composizione percentuale Formule chimiche Qual è la massa molecolare del glucosio? Il glucosio è costituito da molecole di formula C 6 H 12 O 6.
MASSE ATOMICHE RELATIVE - MOLE
 MASSE ATOMICHE RELATIVE - MOLE Massa Atomica Massa Molecolare La mole Massa Molare Composizione percentuale dei composti chimici Formula Minima e Formula Molecolare MASSA ATOMICA Pur essendo ormai note
MASSE ATOMICHE RELATIVE - MOLE Massa Atomica Massa Molecolare La mole Massa Molare Composizione percentuale dei composti chimici Formula Minima e Formula Molecolare MASSA ATOMICA Pur essendo ormai note
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Atomi, Molecole e Ioni. Capitolo 2
 Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
Esercizi sui Bilanci di Massa
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Bilanci di Massa Prof. Dipartimento CMIC Giulio Natta http://iscamap.corsi.chem.polimi.it/citterio Punti
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Bilanci di Massa Prof. Dipartimento CMIC Giulio Natta http://iscamap.corsi.chem.polimi.it/citterio Punti
SINTESI C4. La quantità di materia: la mole
 La massa degli atomi Al momento della prima stesura della tavola periodica, Mendeleev non era a oscenza dell esistenza dei protoni, scoperti solo alcuni anni più tardi. Il criterio di classificazione degli
La massa degli atomi Al momento della prima stesura della tavola periodica, Mendeleev non era a oscenza dell esistenza dei protoni, scoperti solo alcuni anni più tardi. Il criterio di classificazione degli
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
Programma Didattico Annuale
 LICEO SCIENTIFICO STATALE GALILEO GALILEI PdQ - 7.06 Ediz.: 1 Rev.: 0 Data 02/09/05 Alleg.: D01 PROG. M2 PROCEDURA della QUALITA' Programma Didattico Annuale Anno Scolastico 2011/2012 MATERIA : Scienze
LICEO SCIENTIFICO STATALE GALILEO GALILEI PdQ - 7.06 Ediz.: 1 Rev.: 0 Data 02/09/05 Alleg.: D01 PROG. M2 PROCEDURA della QUALITA' Programma Didattico Annuale Anno Scolastico 2011/2012 MATERIA : Scienze
See more about
 See more about www.scienzaescuola.it ESERCIZI DI STECHIOMETRIA CON ESEMPI DI SOLUZIONI TIPO. Prof. Gabrielli Luciano (Lic. Scientifico L. da Vinci -Sora FR) P.M : Calcola il P.M. di: Al 2 (SO 4 ) 3 Fe(NO
See more about www.scienzaescuola.it ESERCIZI DI STECHIOMETRIA CON ESEMPI DI SOLUZIONI TIPO. Prof. Gabrielli Luciano (Lic. Scientifico L. da Vinci -Sora FR) P.M : Calcola il P.M. di: Al 2 (SO 4 ) 3 Fe(NO
SOLUZIONI COMPITO A DI CHIMICA DEL
 SOLUZIONI COMPITO A DI CHIMICA DEL 26-11-10 1A) Il permanganato di potassio reagisce con il perossido di idrogeno in presenza di acido solforico dando luogo alla formazione di ossigeno, diossido di manganese
SOLUZIONI COMPITO A DI CHIMICA DEL 26-11-10 1A) Il permanganato di potassio reagisce con il perossido di idrogeno in presenza di acido solforico dando luogo alla formazione di ossigeno, diossido di manganese
La mole è definita come quella quantità di sostanza che contiene un numero di Avogadro di atomi o
 CHIMICA GENERALE ED INORGANICA Corso di Laurea Triennale in Biotecnologie Esercizi I Parte 1. a) Cosa si intende per mole di una sostanza? Anche più di una risposta! La mole è definita come quella quantità
CHIMICA GENERALE ED INORGANICA Corso di Laurea Triennale in Biotecnologie Esercizi I Parte 1. a) Cosa si intende per mole di una sostanza? Anche più di una risposta! La mole è definita come quella quantità
CHIMICA QUANTITATIVA. Massa atomica. Unità di massa atomica. Massa molare
 CHIMICA QUANTITATIVA Unità di massa atomica Massa atomica Mole Massa molare 1 L unità di misura della massa è pari a 1/12 della massa dell isotopo 12 6C Questa quantità si chiama unità di massa atomica
CHIMICA QUANTITATIVA Unità di massa atomica Massa atomica Mole Massa molare 1 L unità di misura della massa è pari a 1/12 della massa dell isotopo 12 6C Questa quantità si chiama unità di massa atomica
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 9. L unità di misura dei chimici: la mole SEGUI LA MAPPA La concentrazione delle
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 9. L unità di misura dei chimici: la mole SEGUI LA MAPPA La concentrazione delle
Corso di CHIMICA INORGANICA
 Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
UNIVERSITÀ DEGLI STUDI DI ROMA TOR VERGATA
 I prova in itinere - Compito A - 21.01.2008 1. Calcolare la quantità in grammi di Cl 2 che occupa un volume di 682mL alla temperatura di 38,2C e alla pressione di 435 torr. Quale sarebbe la pressione del
I prova in itinere - Compito A - 21.01.2008 1. Calcolare la quantità in grammi di Cl 2 che occupa un volume di 682mL alla temperatura di 38,2C e alla pressione di 435 torr. Quale sarebbe la pressione del
Compiti estivi di chimica classe 1Ag
 Compiti estivi di chimica classe Ag Separare un miscuglio secondo le tecniche studiate. Quale metodo di separazione potrebbe essere utilizzato per separare un miscuglio formato da sale mescolato con frammenti
Compiti estivi di chimica classe Ag Separare un miscuglio secondo le tecniche studiate. Quale metodo di separazione potrebbe essere utilizzato per separare un miscuglio formato da sale mescolato con frammenti
Il passaggio al mondo macroscopico
 Il passaggio al mondo macroscopico Possiamo pesare un atomo? L atomo più piccolo (idrogeno, H) pesa 1.67 10 24 g!!! LA MOLE La mole La MOLE è la quantità di sostanza che contiene lo stesso numero di specie
Il passaggio al mondo macroscopico Possiamo pesare un atomo? L atomo più piccolo (idrogeno, H) pesa 1.67 10 24 g!!! LA MOLE La mole La MOLE è la quantità di sostanza che contiene lo stesso numero di specie
Prova in itinere di Chimica Generale 8 Gennaio 2014
 Prova in itinere di Chimica Generale 8 Gennaio 2014 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 A Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 8 Gennaio 2014 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 A Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Atomo La più piccola particella di un elemento che resta inalterata nelle trasformazioni chimiche.
 Atomo La più piccola particella di un elemento che resta inalterata nelle trasformazioni chimiche. Molecola La più piccola particella di un individuo chimico (elemento o composto) capace di una propria
Atomo La più piccola particella di un elemento che resta inalterata nelle trasformazioni chimiche. Molecola La più piccola particella di un individuo chimico (elemento o composto) capace di una propria
Fondamenti di Chimica T-A T A (A-K) Formula minima Moli
 Università degli Studi di Bologna Anno Accademico 2009/2010 Facoltà di Ingegneria orso di Laurea in Ingegneria Gestionale Fondamenti di himica T-A T A (A-K) Formula minima Moli Dott. Enzo Papandrea Dipartimento
Università degli Studi di Bologna Anno Accademico 2009/2010 Facoltà di Ingegneria orso di Laurea in Ingegneria Gestionale Fondamenti di himica T-A T A (A-K) Formula minima Moli Dott. Enzo Papandrea Dipartimento
4) 8 g di idrogeno reagiscono esattamente con 64 g di ossigeno secondo la seguente reazione:
 Esercizi Gli esercizi sulla legge di Lavoisier che seguono si risolvono ricordando che la massa iniziale, prima della reazione, deve equivalere a quella finale, dopo la reazione. L uguaglianza vale anche
Esercizi Gli esercizi sulla legge di Lavoisier che seguono si risolvono ricordando che la massa iniziale, prima della reazione, deve equivalere a quella finale, dopo la reazione. L uguaglianza vale anche
ESERCIZI SU. le soluzioni e la loro composizione
 ESERCIZI SU le soluzioni e la loro composizione martedì 15 dicembre 2015 Composizione delle soluzioni definita da grandezze di primario interesse fisico Composizione percentuale in massa % di A = (m A
ESERCIZI SU le soluzioni e la loro composizione martedì 15 dicembre 2015 Composizione delle soluzioni definita da grandezze di primario interesse fisico Composizione percentuale in massa % di A = (m A
LA MISURA DELLE GRANDEZZE FISICHE. Prof Giovanni Ianne
 LA MISURA DELLE GRANDEZZE FISICHE Prof Giovanni Ianne Il metodo scientifico La Fisica studia i fenomeni naturali per: fornire una descrizione accurata di tali fenomeni interpretare le relazioni fra di
LA MISURA DELLE GRANDEZZE FISICHE Prof Giovanni Ianne Il metodo scientifico La Fisica studia i fenomeni naturali per: fornire una descrizione accurata di tali fenomeni interpretare le relazioni fra di
La quantità chimica LA MOLE
 La quantità chimica LA MOLE 1 QUANTO PESA UN ATOMO? Se lo misurassimo in grammi, l atomo di H, il più piccolo, avrebbe una massa di 1,6 x10-24 g. Per convenzione, si assegna un valore arbitrario (12) alla
La quantità chimica LA MOLE 1 QUANTO PESA UN ATOMO? Se lo misurassimo in grammi, l atomo di H, il più piccolo, avrebbe una massa di 1,6 x10-24 g. Per convenzione, si assegna un valore arbitrario (12) alla
B) calcola la massa in grammi dei seguenti numeri di particelle, ovviamente a partire dalla massa in grammi di ogni singola particella.
 Esercizi Vengono di seguito proposti esercizi per un rapido passaggio dalle masse al numero di particelle e viceversa; le masse possono essere espresse in grammi o in uma; le particelle in mol o in atomi
Esercizi Vengono di seguito proposti esercizi per un rapido passaggio dalle masse al numero di particelle e viceversa; le masse possono essere espresse in grammi o in uma; le particelle in mol o in atomi
LE REAZIONI CHIMICHE
 LE REAZIONI CHIMICHE Una reazione chimica è una trasformazione che comporta una nuova distribuzione degli atomi in una o più determinate sostanze Una reazione chimica è un processo dinamico in cui alcune
LE REAZIONI CHIMICHE Una reazione chimica è una trasformazione che comporta una nuova distribuzione degli atomi in una o più determinate sostanze Una reazione chimica è un processo dinamico in cui alcune
reazioni Sostanze Reazioni di sintesi Reazioni di decomposizione
 Si consumano nelle reazioni Si formano nelle reagenti Si trasformano con prodotti Sostanze Sostanze semplici Sostanze composte Non ottenibili con Non decomponibili con Reazioni di sintesi Reazioni di decomposizione
Si consumano nelle reazioni Si formano nelle reagenti Si trasformano con prodotti Sostanze Sostanze semplici Sostanze composte Non ottenibili con Non decomponibili con Reazioni di sintesi Reazioni di decomposizione
Tutte le altre grandezze fisiche derivano da queste e sono dette grandezze DERIVATE (es. la superficie e il volume).
 Grandezze fisiche e misure La fisica studia i fenomeni del mondo che ci circonda e ci aiuta a capirli. Tutte le grandezze che caratterizzano un fenomeno e che possono essere misurate sono dette GRANDEZZE
Grandezze fisiche e misure La fisica studia i fenomeni del mondo che ci circonda e ci aiuta a capirli. Tutte le grandezze che caratterizzano un fenomeno e che possono essere misurate sono dette GRANDEZZE
Composti chimici. Formula minima: CH 3 molecolare: C 2 H 6 di struttura: H H H C C H H H
 Stechiometria Composti chimici Formula minima: CH 3 molecolare: C H 6 di struttura: H H H C C H H H Formula di struttura Formula minima molecolare: C H 6 O Formula di struttura H O H H H H Reazioni
Stechiometria Composti chimici Formula minima: CH 3 molecolare: C H 6 di struttura: H H H C C H H H Formula di struttura Formula minima molecolare: C H 6 O Formula di struttura H O H H H H Reazioni
1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2.
 1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2. H 2 SO 3 Pm = 2 1 + 32 + 16 3 = 82 H 3 PO 4 Pm = 3 1 +
1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2. H 2 SO 3 Pm = 2 1 + 32 + 16 3 = 82 H 3 PO 4 Pm = 3 1 +
Chimica. Lezione 1 La materia
 Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
La chimica analitica risponde, occupandosi di determinare formule e strutture
 Domane e risposte della CHIMICA Dato un composto sconosciuto come determinarne la formula? La chimica analitica risponde, occupandosi di determinare formule e strutture ChimicaGenerale_lezione2 1 Determinazione
Domane e risposte della CHIMICA Dato un composto sconosciuto come determinarne la formula? La chimica analitica risponde, occupandosi di determinare formule e strutture ChimicaGenerale_lezione2 1 Determinazione
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
11. Un composto contiene il 43,64% di fosforo ed il 56,36% di ossigeno. Qual è la sua formula empirica? (P 2 O 5 )
 ESERCIZI DI CHIMICA 1. Scrivere le formule brute e le formule di struttura corrispondenti ai seguenti composti: ortofosfato di calcio, ossido di sodio, silicato di alluminio, nitrito di magnesio, pirofosfato
ESERCIZI DI CHIMICA 1. Scrivere le formule brute e le formule di struttura corrispondenti ai seguenti composti: ortofosfato di calcio, ossido di sodio, silicato di alluminio, nitrito di magnesio, pirofosfato
