a. La Piruvato chinasi catalizza il trasferimento di un gruppo fosfato dal fosfoenolpiruvato all adenosina
|
|
|
- Carla Neri
- 7 anni fa
- Visualizzazioni
Transcript
1 apitolo 18 Risposte a Domande interne al capitolo 18.1 (p. 548) a. La Piruvato chinasi catalizza il trasferimento di un gruppo fosfato dal fosfoenolpiruvato all adenosina difosfato. b. L alanina transaminasi catalizza il trasferimento di un gruppo amminico dall alanina all αchetoglutarato, con produzione di piruvato e glutammato. c. La Trioso fosfato isomerasi catalizza l isomerizzazione del chetone diidrossiacetone fosfato all aldeide gliceraldeide-3-fosfato. d. La Piruvato deidrogenasi catalizza l ossidazione e decarbossilazione del piruvato, producendo acetil coenzima A e 2.
2 18.2 (p. 548) a. La Fosfofruttochinasi catalizza il trasferimento di un gruppo fosforile da ATP al fruttosio-6-fosfato: ~ P ~ P ~ P 2 2 ATP ADP 2 2 Phosphofructokinase Fructose-6-phosphate Fructose-1,6-bisphosphate b. La lipasi catalizza l idrolisi del legame estere tra glicerolo e un acido grasso. ( 2 ) Lipase + ( 2 ) 14 3 Monoglyceride Glycerol Fatty acid Water c. L aceto acetato decarbossilasi catalizza la rimozione di un gruppo carbossilico da acetoacetato, producendo acetone e anidride carbonica: - Acetoacetate decarboxylase Acetoacetate Acetone arbon dioxide
3 d. La succinato deidrogenasi catalizza l ossidazione da succinato a fumarato. Il coenzima FAD è ridotto in questa reazione, producendo FAD2. - FAD FAD Succinate dehydrogenase - - Succinate Fumarate 18.3 (p. 548) a. saccarosio b. piruvato c. succinato 18.4 (p. 548) a. La saccarasi catalizza l idrolisi del saccarosio in glucosio e fruttosio. b. La piruvato decarbossilasi rimuove un gruppo carbossilico dal piruvato. c. La succinato deidrogenasi ossida succinato (p. 555) Il modello ad adattamento indotto presuppone che l enzima sia flessibile. L enzima e il substrato sono in grado di cambiare forma per formare il complesso enzima-substrato. Il modello chiaveserratura presuppone che l enzima (il blocco) sia flessibile e che il substrato (la chiave) si inserisca in un sito specifico rigido (il sito attivo) sull enzima per formare il complesso enzima substrato (p. 555) La grandezza, la forma e la distribuzione di carica del sito attivo dell enzima sono complementari a quelle del substrato (p. 559) Un enzima può distorcere un legame in modo da catalizzare la rottura del legame stesso. Un enzima è in grado di portare due molecole vicine e nel corretto orientamento affinché la reazione avvenga.
4 Infine, un enzima può alterare il p del microambiente del sito attivo agendo come donatore o accettore di protoni (p. 559) Lo stato di transizione è l intermedio instabile in una reazione catalizzata da un enzima. Nello stato di transizione il substrato condivide proprietà sia del substrato originale sia del prodotto finale (p. 561) Le vitamine solubili in acqua sono richieste dall organismo per la sintesi di coenzimi necessari per la funzione di vari enzimi (p. 561) a. Il coenzima A è prodotto dall acido pantotenico. b. La nicotinammide adenina dinucleotide (NAD +) e la nicotinammide adenina dinucleotide fosfato (NADP +) sono sintetizzate dalla niacina. c. La flavina adenina dinucleotide e flavina mononucleotide sono prodotte dalla riboflavina (p. 564) Una diminuzione del p può cambiare il grado di ionizzazione dei gruppi R all interno di una catena peptidica. Questo disturba le interazioni deboli che mantengono la struttura dell enzima, denaturandolo. Alterazioni meno drastiche della carica dei gruppi R nel sito attivo dell enzima possono inibire il legame enzima-substrato o alterare la capacità catalitica del sito attivo (p. 565) L alto calore denatura le proteine, compresi gli enzimi, delle cellule viventi. osì, riscaldare gli strumenti chirurgici è un mezzo efficace per la sterilizzazione se il trattamento termico è eseguito in condizioni di temperatura e di tempo sufficienti a uccidere forme di vita microbiche (p. 580) Gli inibitori irreversibili si legano molto forte, talvolta anche in modo covalente, a gruppi R nel sito attivo di diversi enzimi. La perdita di attività enzimatica impedisce il normale metabolismo cellulare, con conseguente morte della cellula o dell individuo.
5 18.14 (p. 580) Un inibitore irreversibile lega fortemente, spesso covalentemente, un enzima, disattivando permanentemente il sito attivo. Un inibitore non competitivo reversibile si lega più debolmente all enzima. L attività enzimatica è ripristinata quando l inibitore si dissocia dall enzima (p. 580) Un analogo strutturale è una molecola che ha una struttura e la distribuzione di carica molto simile a quella del substrato naturale di un enzima. Generalmente gli analoghi strutturali sono in grado di legarsi al sito attivo dell enzima. Questo inibisce l attività enzimatica poiché il substrato normale deve competere con l analogo strutturale per formare il complesso enzima-substrato (p. 580) Un analogo strutturale assomiglia alla dimensione, forma e distribuzione di carica del normale substrato per un enzima. A causa di questa somiglianza è in grado di legarsi al sito attivo. Tuttavia, quando l analogo strutturale si lega al sito attivo, non avviene alcuna reazione. osì l enzima è inibito dalla formazione del complesso enzima-analogo strutturale (p. 587)
6 18.18 (p. 588) a. trp-val-gly hymotrypsin N + 3 N N Glycine Valine N Tryptophan b. phe-ala-pro hymotrypsin - N + 3 N N 2 3 Alanine Proline Phenylalanine (p. 588)
7 18.20 (p. 588) trp-val-lys-ala-ser hymotrypsin Trypsin Elastase N + 3 N N N N N 3 Valine 2 2 Alanine Serine 2 Tryptophan N + 3 Lysine Risposte a Domande ed Esercizi di fine capitolo 18.1 Gli enzimi sono normalmente classificati dal tipo di reazioni che catalizzano E; 2-; 3-A; 4-F, 5-B; 6-D 18.3 Le classi di enzimi basate sul tipo di reazione che catalizzano: a. Le ossidoriduttasi catalizzano reazioni di ossidoriduzione. La lattato deidrogenasi è una ossidoriduttasi. b. Le transferasi catalizzano il trasferimento di gruppi chimici da una molecola all altra. L alanina transaminasi è una transferasi. c. Le idrolasi catalizzano l addizione di una molecola d acqua ad un legame, con conseguente rottura del legame stesso. La tripsina è una idrolasi. d. Le liasi catalizzano l addizione di un gruppo ad un doppio legame o la rimozione di un gruppo per formare un doppio legame. La citrato liasi è una liasi. e. Le isomerasi catalizzano la conversione di un isomero in un altro. La Trioso fosfato isomerasi è una isomerasi. f. Le ligasi catalizzano l unione di due molecole. La DNA ligasi è una ligasi.
8 18.4 Un substrato è il reagente in una reazione catalizzata da enzima che si lega al sito attivo dell enzima ed è convertito in prodotto Il prodotto è la specie che deriva da una reazione chimica e che appare sul lato destro di un equazione chimica L energia di attivazione di una reazione è l energia necessaria perché la reazione avvenga Un enzima abbassa l energia di attivazione di una reazione La costante di equilibrio per una reazione chimica riflette la differenza di energia dei reagenti e dei prodotti. Si consideri la seguente reazione: aa + bb c + dd La costante di equilibrio per questa reazione è: d c a b K eq = [D] [] /[A] [B] = [products]/[reactants] Poiché la differenza di energia tra i reagenti e i prodotti è la medesima, indipendentemente dal percorso della reazione, un enzima non altera la costante di equilibrio della reazione Un enzima, fornendo un percorso alternativo alla reazione, aumenta la velocità di una reazione chimica, abbassando così l energia di attivazione della reazione La velocità di una reazione chimica catalizzata tipicamente raddoppia ogni volta che raddoppia la concentrazione del substrato A una certa concentrazione del substrato, la velocità di reazione raggiunge un livello massimo. A questa velocità massima, ogni sito attivo è occupato da una molecola substrato Il fattore limitante è lo step più lento in una reazione catalizzata da un enzima, e quindi limita la velocità con cui il substrato può essere convertito in prodotto Il grafico che mostra l attività di un enzima rispetto alla concentrazione del substrato suggerisce che la velocità di una reazione catalizzata da un enzima è limitata dal tempo richiesto alla reazione per avvenire e/o dal tempo richiesto dal prodotto per essere rilasciato.
9 18.14 Il complesso enzima-substrato è l aggregato molecolare che si forma quando il substrato si lega al sito attivo di un enzima Il sito attivo di un enzima è la tasca o il solco sulla superficie di un enzima, che è il sito di legame del substrato I siti attivi sono tasche sulla superficie dell enzima che coinvolgono gruppi R aminoacidici coinvolti nel legame con Il substrato e gruppi R coinvolti nella catalisi. La forma del sito attivo è complementare a quella del substrato e ne determina la specificità. Il legame enzima substrato coinvolge legami deboli Il modello ad adattamento indotto del legame enzima substrato è più accurate rispetto al modello chiave-serratura perché considera anche le proteine e in particolare gli enzimi sono molecole flessibili La specificità enzimatica è la capacità di un enzima di legarsi ad un solo, o pochissimi, substrati e quindi catalizzare solo una singola reazione La specificità del gruppo è la catalizzazione, da parte di un enzima, di reazioni che coinvolgono molecole simili aventi lo stesso gruppo funzionale La specificità di legame è la catalizzazione, da parte di un enzima, della formazione e della rottura di un solo tipo di legame La specificità assoluta è la catalizzazione, da parte di un enzima, della reazione di un unico substrato La specificità stereochimica è la distinzione, da parte di un enzima, di un enantiomero da un altro Fase 1: formazione del complesso enzima-substrato. Fase 2: formazione dello stato di transizione. Durante questa fase il substrato assume una forma intermedia tra il substrato e il prodotto originale. Fase 3: conversione del substrato in prodotto e formazione del complesso enzima-prodotto. Fase 4: rilascio del prodotto e rigenerazione dell enzima nella sua forma originale Lo stato di transizione è uno stato ad alta energia in cui il substrato è costretto in una forma intermedia simile al substrato e al prodotto. Lo stato di transizione favorisce la conversione del substrato in prodotto Un amminoacido nel sito attivo che presenta un gruppo R acido o basico potrebbe alterare il p locale accettando o rilasciando un protone.
10 18.26 Un cofattore aiuta a mantenere la forma del sito attivo di un enzima Un coenzima si lega transitoriamente a un enzima e accetta o dona gruppi chimici al substrato in una reazione biochimica La tiamina (B1) si trova nel coenzima tiamina pirofosfato. La riboflavina (B2) si trova sia nella flavina mononucleotide e nella flavina adenina dinucleotide. La niacina (B3) è presente nella nicotinammide adenina dinucleotide e nella nicotinammide adenina dinucleotide fosfato. La piridossina (B6) si trova nel piridossal fosfato e nella piridossammina fosfato. La cianocobalamina (B12) si trova nel coenzima deossiadenosil cobalamina. L acido folico si trova nell acido tetraidrofolico. L acido pantotenico si trova nel coenzima A. La biotina si trova nella biocitina Nelle reazioni chimiche i coenzimi possono donare gruppi al substrato o accettare gruppi che vengono rimossi dal substrato. Il coenzima tiamina pirofosfato è coinvolto nelle reazioni di decarbossilazione. La flavina mononucleotide e la flavina adenina dinucleotide portano atomi di idrogeno. La nicotinammide adenina dinucleotide e nicotinammide adenina dinucleotide fosfato sono portatori di ioni idruro. Il piridossal fosfato e la fosfato piridossammina sono portatori di gruppi amminici e carbossilici. La deossiadenosil cobalamina è un coenzima coinvolto nel metabolismo degli amminoacidi. L acido tetraidrofolico è un coenzima coinvolto nel trasferire gruppi con un atomo di carbonio. Il oenzima A trasferisce gruppi acilici. La biocitina è un coenzima della fissazione di gnuna delle seguenti risposte presuppone che l enzima sia stato purificato da un organismo le cui condizioni ottimali per la vita sono: 37, p 7. a. Diminuendo la temperatura da 37 a 10 si causerà la diminuzione della velocità dell enzima reazione perché la frequenza di collisioni tra enzima e substrato diminuirà al diminuire della velocità di movimento molecolare. b. Aumentando il p da 7 a 11 generalmente si causerà una diminuzione della velocità della reazione catalizzata dall enzima. In realtà, la maggior parte degli enzimi sarebbe denaturato da un p di 11 e l attività enzimatica cesserebbe. c. Riscaldando l enzima da 37 a 100 si distruggerà l attività enzimatica perché l enzima è
11 denaturato dal calore estremo L alta temperatura denatura gli enzimi batterici e le proteine strutturali. Poiché la vita delle cellule dipende dalla funzione di queste proteine, in queste condizioni la cellula muore ltre una certa temperatura il calore può alterare o denaturare il sito attivo di un enzima distruggendone l attività, modificando la struttura tridimensionale della proteina a. Le cellule regolano il livello di attività enzimatica per risparmiare energia. La produzione di un enzima, se il suo substrato non è presente o se il suo prodotto è in eccesso, è uno spreco di energia cellulare. b. La produzione di enzimi digestivi proteolitici deve essere attentamente controllata perché l enzima attivo potrebbe distruggere la cellula che lo produce. Pertanto, sono prodotti in una forma inattiva e sono attivati solo nel sito in cui effettuano la digestione L enzima allosterico ha un sito di legame per un effettore nonché un sito attivo. Il legame dell effettore modifica la forma del sito attivo, rendendolo attivo (allosterismo positivo) o inattivo (allosterismo negativo) Nell allosterismo positivo, il legame della molecola effettrice attiva l enzima. Nell allosterismo negativo, il legame della molecola effettrice disattiva l enzima Un proenzima è la forma inattiva di un enzima che convertito in forma attiva solo nel sito dove deve catalizzare la reazione Il vantaggio di produrre enzimi digestivi in forme inattive (proenzimi) è che in questo stato non possono danneggiare le cellule che li producono. Essi possono quindi essere facilmente convertiti nella forma attiva solo nel sito che necessita la loro attività L inibizione enzimatica competitiva si verifica quando un analogo strutturale del substrato normale occupa il sito attivo dell enzima in modo che la reazione non possa avvenire. L analogo strutturale e il substrato normale competono per il sito attivo. In questo modo la velocità di reazione dipende dalle concentrazioni relative delle due molecole Un analogo strutturale assomiglia alla dimensione, forma e distribuzione di carica del normale substrato per un enzima. A causa di questa somiglianza è in grado di legarsi al sito attivo. Tuttavia,
12 quando l analogo strutturale si lega al sito attivo, non avviene alcuna reazione. osì l enzima è inibito dalla formazione del complesso enzima-analogo strutturale Gli inibitori irreversibili si legano fortemente e bloccano il sito attivo di un enzima, eliminando la catalisi Gli inibitori irreversibili vengono chiamati veleni perché distruggono permanentemente l attività di molti enzimi. L interruzione delle reazioni biochimiche essenziali provoca malattie e morte a. La polifenolossidasi richiede ioni rame come cofattori, perché l attività dell enzima è bloccata quando la feniltiourea rimuove tutti gli ioni rame disponibili. b. La feniltiourea è un inibitore irreversibile non competitivo Un enzima proteolitico catalizza la scissione del legame peptidico che stabilizza la struttura primaria della proteina himotripsina, tripsina ed elastasi hanno tutte strutture tridimensionali molto simili. Sono proteasi, che tagliano il legame peptidico sul lato carbonilico di particolari amminoacidi Le elastasi tagliano i legami peptidici sul lato carbonilico di alanina e glicina. La tripsina taglia i legami peptidici sul lato carbonilico di lisina e arginina. La chimotripsina taglia i legami peptidici sul lato carbonilico di triptofano e fenilalanina La conformazione del sito attivo dona specificità agli enzimi proteolitici: per esempio il sito attivo della tripsina è lungo e stretto, adatto per gruppi R di aminoacidi come la lisina o l arginina, mentre il sito attivo della chimotripsina può legare gruppi R aromatici La terapia di sostituzione enzimatica può essere utilizzata per trattare determinate malattie. Per esempio nella malattia di Gaucher, che mostra una carenza dell enzima glucocerebrosidasi, i pazienti ricevono l enzima lisosomiale umano β-glucocerebrosidasi per via endovenosa reatina-chinasi MB, e aspartato aminotransferasi (AST / SGT) a. transferasi b. transferasi c. isomerasi d. ossidoreduttasi
13 e. idrolasi f. transferasi g. esterasi h. decarbossilasi i. ossidoreduttasi
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA
 Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
2015 /2016. scaricato da
 Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in Scienze Biologiche. Insegnamento di. Anno Accademico
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
CLASSIFICAZIONE ENZIMI
 CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico
 Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico Dalla glicolisi alla fosforilazione ossidativa NAD + e NADP + Sono coinvolti nelle reazioni di trasferimento dell idruro H: -. Tutte le reazioni
Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico Dalla glicolisi alla fosforilazione ossidativa NAD + e NADP + Sono coinvolti nelle reazioni di trasferimento dell idruro H: -. Tutte le reazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
Cap.16 GLICOLISI. Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP H 2 O 2 NAD + 2 NADH + 2H +
 Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
Seminario. Ciclo di Krebs 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A
 Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI
 METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Introduzione allo studio del metabolismo Parte I
 Introduzione allo studio del metabolismo Parte I FOTOTROFI Le piante ed alcuni tipi di batteri ricavano l energia libera dal Sole mediante la fotosintesi, un processo in cui l energia luminosa è convertita
Introduzione allo studio del metabolismo Parte I FOTOTROFI Le piante ed alcuni tipi di batteri ricavano l energia libera dal Sole mediante la fotosintesi, un processo in cui l energia luminosa è convertita
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
PIRIDOSSALE-FOSFATO (PLP)
 PIRIDOSSALE-FOSFATO (PLP) Deriva dalla famiglia delle Vitamine B 6 (piridossale, piridossina) Il PLP è il gruppo prostetico di enzimi che catalizzano transamminazione, decarbossilazione, racemizzazione
PIRIDOSSALE-FOSFATO (PLP) Deriva dalla famiglia delle Vitamine B 6 (piridossale, piridossina) Il PLP è il gruppo prostetico di enzimi che catalizzano transamminazione, decarbossilazione, racemizzazione
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Termodinamica ENTALPIA...6
 Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Il trasporto del glucosio
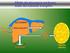 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
CICLO DI KREBS (o DELL ACIDO CITRICO)
 CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
prodotto finale della glicolisi
 Piruvato: prodotto finale della glicolisi Può andare incontro a vari destini: -in condizioni anaerobie: il piruvato viene ridotto a lattato (fermentazione lattica) o ad etanolo (fermentazione alcolica)
Piruvato: prodotto finale della glicolisi Può andare incontro a vari destini: -in condizioni anaerobie: il piruvato viene ridotto a lattato (fermentazione lattica) o ad etanolo (fermentazione alcolica)
Cap.19. Ciclo di Krebs. o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico
 Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Carboidrati! Oligosaccaridi Polisaccaridi. B) Carboidrati complessi
 Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
Respirazione cellulare
 Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Il metabolismo cellulare
 Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
IL METABOLISMO. Dal carbonio agli OGM Capitolo 2
 IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento più o meno elevata 4 classi sulla
Applicazioni biotecnologiche degli enzimi: le proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento più o meno elevata 4 classi sulla
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
Energia di attivazione
 1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli
1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia.
 La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
Cap.21 CATABOLISMO DEI LIPIDI
 Cap.21 CATABOLISMO DEI LIPIDI Glucosio= forma di energia immediatamente disponibile LIPIDI= Deposito energetico utilizzabile da tutti i tessuti, tranne cervello e globuli rossi Rispetto ai carboidrati,
Cap.21 CATABOLISMO DEI LIPIDI Glucosio= forma di energia immediatamente disponibile LIPIDI= Deposito energetico utilizzabile da tutti i tessuti, tranne cervello e globuli rossi Rispetto ai carboidrati,
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
MANTENIMENTO DELLA STRUTTURA CRESCITA SVILUPPO RIPRODUZIONE
 BIOENERGETICA MANTENIMENTO DELLA STRUTTURA CRESCITA SVILUPPO RIPRODUZIONE GLI ORGANISMI VIVENTI POSSONO UTILIZZARE SOLO DUE FORME DI ENERGIA: LUMINOSA (radiazioni di determinate lunghezze d onda) (ORGANISMI
BIOENERGETICA MANTENIMENTO DELLA STRUTTURA CRESCITA SVILUPPO RIPRODUZIONE GLI ORGANISMI VIVENTI POSSONO UTILIZZARE SOLO DUE FORME DI ENERGIA: LUMINOSA (radiazioni di determinate lunghezze d onda) (ORGANISMI
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
La termodinamica studia i flussi/trasformazioni di energia. Bioenergetica: termodinamica applicata ai sistemi biologici
 LA CAPACITÀ DI USARE ENERGIA È CARATTERISTICA DEI SISTEMI VIVENTI Bisogni degli esseri viventi: Energia (luce, molecole organiche) Catalizzatori biologici (enzimi) La termodinamica studia i flussi/trasformazioni
LA CAPACITÀ DI USARE ENERGIA È CARATTERISTICA DEI SISTEMI VIVENTI Bisogni degli esseri viventi: Energia (luce, molecole organiche) Catalizzatori biologici (enzimi) La termodinamica studia i flussi/trasformazioni
Come le cellule traggono energia dal cibo: produzione di ATP
 Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore)
 Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore) La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato
Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore) La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato
L ATTIVITA DELLA CELLULA
 L ATTIVITA DELLA CELLULA nutrizione crescita eliminare i rifiuti mantenimento delle strutture movimento riproduzione comunicazione per svolgere tutte queste attività, le cellule hanno bisogno di ENERGIA
L ATTIVITA DELLA CELLULA nutrizione crescita eliminare i rifiuti mantenimento delle strutture movimento riproduzione comunicazione per svolgere tutte queste attività, le cellule hanno bisogno di ENERGIA
Energia di attivazione
 Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
ENZIMI. Catalizzatori delle reazioni biologiche
 ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
GLICOLISI ADP ATP. Condizioni aerobiche. Condizioni anaerobiche ATP
 GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
AGISCONO NEL SISTEMA NAVETTA 2 ISOFORME DELL ENZIMA: UNA FORMA MITOCONDRIALE ( MEMBRANA MIT. INTERNA) FAD-dipendente
 METABOLISMO AEROBIO I NADH prodotti durante la glicolisi nel citosol, in condizioni aerobiche (respirazione mitocondriale attiva), possono trasferire elettroni all interno del mitocondrio attraverso i
METABOLISMO AEROBIO I NADH prodotti durante la glicolisi nel citosol, in condizioni aerobiche (respirazione mitocondriale attiva), possono trasferire elettroni all interno del mitocondrio attraverso i
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Utilizzo del glucosio: la glicolisi
 Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
Catabolismo dei carboidrati Glicolisi
 Catabolismo dei carboidrati Glicolisi Principali vie di utilizzo del Glucosio L estrazione dell energia dai composti organici può essere divisa in tre stadi Metabolismo del glucosio C 6 H 12 O 6 + 6O 2
Catabolismo dei carboidrati Glicolisi Principali vie di utilizzo del Glucosio L estrazione dell energia dai composti organici può essere divisa in tre stadi Metabolismo del glucosio C 6 H 12 O 6 + 6O 2
COENZIMI. Molti enzimi richiedono l associazione con particolari cofattori per poter esplicare la loro attività catalitica.
 COENZIMI Molti enzimi richiedono l associazione con particolari cofattori per poter esplicare la loro attività catalitica. Ioni essenziali Coenzimi Ioni attivatori, Mg 2+, K +, Ca 2+ (legati debolmente)
COENZIMI Molti enzimi richiedono l associazione con particolari cofattori per poter esplicare la loro attività catalitica. Ioni essenziali Coenzimi Ioni attivatori, Mg 2+, K +, Ca 2+ (legati debolmente)
Catalisi. Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A Modulo di Biologia Strutturale
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Fegato e metabolismo lipidico
 Fegato e metabolismo lipidico LIPIDI : Acidi grassi liberi o esterificati ad Acil gliceroli ( mono, di, tri) Fosfolipidi e colesterolo FONTI : Grassi della dieta Depositati sotto forma di goccioline (tessuto
Fegato e metabolismo lipidico LIPIDI : Acidi grassi liberi o esterificati ad Acil gliceroli ( mono, di, tri) Fosfolipidi e colesterolo FONTI : Grassi della dieta Depositati sotto forma di goccioline (tessuto
Acido maleico anidride maleica acido ftalico andidride ftalica
 Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Metabolismo del Glucosio
 Metabolismo del Glucosio Schema generale del metabolismo del glucosio Una panoramica della glicolisi Conce2 chiave La glicolisi consiste nella degradazione del glucosio a piruvato e utilizza, al contempo,
Metabolismo del Glucosio Schema generale del metabolismo del glucosio Una panoramica della glicolisi Conce2 chiave La glicolisi consiste nella degradazione del glucosio a piruvato e utilizza, al contempo,
(2 x) (2 x) (2 x) Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi. Gliceraldeide 3-fosfato deidrogenasi
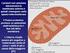 Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi (2 x) (2 x) Gliceraldeide 3-fosfato Fosfato inorganico Gliceraldeide 3-fosfato deidrogenasi Reazione di ossidoriduzione:
Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi (2 x) (2 x) Gliceraldeide 3-fosfato Fosfato inorganico Gliceraldeide 3-fosfato deidrogenasi Reazione di ossidoriduzione:
Il metabolismo cellulare
 Il metabolismo cellulare 1 Il metabolismo cellulare CATABOLISMO Processo esoergonico (per produrre energia) Nutriliti NAD FAD NADP e - +H + ANABOLISMO Processo endoergonico Biopolimeri (x es. proteine)
Il metabolismo cellulare 1 Il metabolismo cellulare CATABOLISMO Processo esoergonico (per produrre energia) Nutriliti NAD FAD NADP e - +H + ANABOLISMO Processo endoergonico Biopolimeri (x es. proteine)
6 H 2. con G=-686 kcal/mole di H 12 O 6 O + 6 CO O 2. glucosio La respirazione avviene in tre stadi principali; ognuno di questi
 La respirazione La respirazione è un processo di ossidoriduzione nel quale i riducenti sono molecole organiche altamente ridotte e ricche di energia e gli ossidanti sono molecole inorganiche come O 2 Il
La respirazione La respirazione è un processo di ossidoriduzione nel quale i riducenti sono molecole organiche altamente ridotte e ricche di energia e gli ossidanti sono molecole inorganiche come O 2 Il
Il ciclo di Krebs e la fosforilazione ossidativa
 Il ciclo di Krebs e la fosforilazione ossidativa La respirazione cellulare Sono i processi molecolari in cui è coinvolto il consumo di O 2 e la formazione di CO 2 e H 2 O da parte della cellula. E suddivisa
Il ciclo di Krebs e la fosforilazione ossidativa La respirazione cellulare Sono i processi molecolari in cui è coinvolto il consumo di O 2 e la formazione di CO 2 e H 2 O da parte della cellula. E suddivisa
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
 Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Principali vie di utilizzo del Glucosio
 Principali vie di utilizzo del Glucosio DESTINO DEL PIRUVATO Il piruvato, può seguire due vie. La via fermentativa La via della respirazione cellulare In presenza di ossigeno, il piruvato, viene ossidato
Principali vie di utilizzo del Glucosio DESTINO DEL PIRUVATO Il piruvato, può seguire due vie. La via fermentativa La via della respirazione cellulare In presenza di ossigeno, il piruvato, viene ossidato
Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine
 Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine Struttura di alcuni antibiotici -lattamici Meccanismo d azione della penicillina La penicillina inibisce la transpeptidasi,
Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine Struttura di alcuni antibiotici -lattamici Meccanismo d azione della penicillina La penicillina inibisce la transpeptidasi,
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
NADH e NADPH. ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente)
 NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI
 FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI ZIMOGENI ATTIVATI NEL LUME INTESTINALE DURANTE LA DIGESTIONE DELLE PROTEINE ESOGENE Tripsina, chimotripsina,
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI ZIMOGENI ATTIVATI NEL LUME INTESTINALE DURANTE LA DIGESTIONE DELLE PROTEINE ESOGENE Tripsina, chimotripsina,
La quantità di glu presente nei liquidi extracellulari è di circa 20g, 80kcal.
 I principali nutrienti metabolici sono il glucosio e gli acidi grassi. In circostanze normali il glucosio è l unico nutriente che possa essere utilizzato dal cervello. E anche utilizzato preferenzialmente
I principali nutrienti metabolici sono il glucosio e gli acidi grassi. In circostanze normali il glucosio è l unico nutriente che possa essere utilizzato dal cervello. E anche utilizzato preferenzialmente
DESTINI DEL PIRUVATO
 DESTINI DEL PIRUVATO LA GLICOLISI RILASCIA SOLO UNA PICCOLA PARTE DELL ENERGIA TOTALE DISPONIBILE NELLA MOLECOLA DI GLUCOSIO Le due molecole di piruvato prodotte dalla glicolisi sono ancora relativamente
DESTINI DEL PIRUVATO LA GLICOLISI RILASCIA SOLO UNA PICCOLA PARTE DELL ENERGIA TOTALE DISPONIBILE NELLA MOLECOLA DI GLUCOSIO Le due molecole di piruvato prodotte dalla glicolisi sono ancora relativamente
Biosintesi dei carboidrati
 Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
Le tre funzioni termodinamiche che descrivono le variazioni di energia che avvengono in una reazione sono:
 Le tre funzioni termodinamiche che descrivono le variazioni di energia che avvengono in una reazione sono: G= energia libera di Gibbs H= entalpia S= entropia ΔG = ΔH TΔS ΔH < 0 ΔS > 0 Condizione tipica
Le tre funzioni termodinamiche che descrivono le variazioni di energia che avvengono in una reazione sono: G= energia libera di Gibbs H= entalpia S= entropia ΔG = ΔH TΔS ΔH < 0 ΔS > 0 Condizione tipica
Catabolismo di proteine
 Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
