MEMBRANE osmosi. MEMBRANE osmosi. elio giroletti
|
|
|
- Agostina Corradini
- 7 anni fa
- Visualizzazioni
Transcript
1 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, pavia, italy tel girolett@unipv.it - webgiro 1 elio giroletti EBRANE osmosi FISICA EDICA e RADIOPROTEZIONE elio giroletti,, 2005 Classe Lauree di INFERIERISTICA e OSTETRICIA corso integrato FISICA, STATISTICA e INFORATICA disciplina: FISICA EDICA e RADIOPROTEZIONE EBRANE osmosi FISICA EDICA e RADIOPROTEZIONE elio giroletti,, Il fenomeno dell'osmosi - Le leggi dell'osmosi - Flussi osmotici lucidi di Domenico Scannicchio, rivisti da Elio Giroletti
2 OSOSI 1 2 membrana semipermeabile: permeabile al solvente impermeabile al soluto h h = h 2 h 1 0 h 2 h 1 le molecole di soluto (troppo grandi) sono respinte dalla membrana e vanno in direzione opposta al gradiente di concentrazione in prossimità del foro si crea una depressione, che fa fluire il solvente verso il compartimento a maggior concentrazione OSOSI 1 membrana semipermeabile: permeabile al solvente impermeabile al soluto C 1 < C 2 solvente migra dalla soluzione a concentrazione inferiore (C 1 ) verso quella a maggiore c. (C 2 ) h 2 C 1 C 2 h 1 solvente OSOSI 1 membrana semipermeabile: permeabile al solvente impermeabile al soluto h h = h 2 h 1 0 h 2 h 1 J s =0 J V =0 = attraverso la membrana pressione idrostatica dg (h 2 h 1 ) = dg h
3 OSOSI 3 π pressione osmotica dg h π h = h 2 h 1 h 2 h 1 dg (h 2 h 1 ) = dg h = pressione richiamo solvente π soluto solvente C 2 0 OSOSI J V C = 1 0 soluzione miscela gas C (solvente puro) 1 > C (solvente puro) 2 p (solvente puro) 1 > p (solvente puro) 2??? ingresso solvente in compartimento dove C soluto 0 2 OSOSI J s = 0 C 2 > C 1 INIZIO soluzione solvente h 2 h 1 FINE soluzione C 2 h J V C 1 = 0 solvente equilibrio membrana semipermeabile dg (h 2 h 1 ) = dg h = pressione richiamo solvente π π pressione osmotica 3
4 OSOSI osmosi e vita cellulare 4 se circondata da soluzione ipotonica cellula si rigonfia (fino a rottura) cellula attorniata da soluzione isotonica (concentrazione salina uguale a quella interna) se circondata da soluzione ipertonica tonica, cellula si disidrata, perde H 2 O EQUILIBRI OSOTICI NEL SANGUE 1 composizione del plasma concentrazione totale NTP = 310 m litro π sangue = 0,310 osmolarità π plasma = π eritrociti π plasma > π eritrociti π plasma < π eritrociti isotonica ipertonica ipotonica eritrocita normale uscita J V collasso eritrociti (disidratazione) ingresso J V rottura eritrociti (emolisi) LEGGI DELL'OSOSI 1 leggi di Van't Hoff (soluzioni diluite) π = k C T = costante π(t) = π o (1 + α t) C = costante Avogadro (T e C uguali uguale π) α = SOLUZIONE DILUITA ~ GAS PERFETTO equazione di stato per le soluzioni π V = n R T dissociazione elettrolitica: n n δ δ = coefficiente di dissociazione elettrolitica δ = ν ο + ν + + ν π V = δ n R T Ν
5 LEGGI DELL'OSOSI 2 5 molti soluti π = π 1 + π 2 + π = R T δ 1 n 1 δ 2 n 2 V δ 3 n 3 V V +... unità di misura di π -baria - pascal - atmosfera - mmhg, cmh2o - osmolarità π n =1, δ =1, V=1 litro, T=273 K 1 osmole = 22.4 atm - molarità NaCl π n =1, δ =2, V=1 litro, T=273 K 1 molarità NaCl = 44.8 atm FLUSSI ATTRAVERSO EBRANE COPARTIENTO 1 COPARTIENTO 2 J 1 2 C 1 C 2 J J V, J s n moli soluto flusso di soluto J s = tempo x superficie unità di misura C.G.S. moli cm 2 s 1 J 2 1 flusso di volume J V = volume soluzione tempo x superficie unità di misura C.G.S. cm s 1 ECCANISO GRADIENTE DI PRESSIONE OSOTICA 1 membrana 2 1 semipermeabile J V = L p π 1 C 1 π 1 C 2 π J V = L p π 2 x x 2 L p = n π R4 8η x J V = J V + J V = L p π 2 L p π 1 = L p π J V = L p π meccanismo osmosi
6 FLUSSI OSOTICI 1 6 osmosi + filtrazione J s = 0 J V = L p ( p π) L p = n π R4 8η x (coefficiente di filtrazione) pressione idraulica: (p 2 > p 1 ) J V da p 2 a p 1 osmosi: (C 2 > C 1 ) J V da π 1 a π 2 FLUSSI OSOTICI 3 EBRANE BIOLOGICHE parzialmente semipermeabili parzialmente permeabili coefficiente di hindrance ε permeabilità di membrana semipermeabilità di membrana ε 1 ε = φ fattore riflessione FLUSSI OSOTICI 4 diffusione + filtrazione + osmosi J s = P C C ε L p p = P C C (1 φ)l p p J V = L p ( p (1 ε) π) ) = L p ( p φ π) per ogni tipo di soluto φ + ε = 1 φ = coefficiente di riflessione P = α ε D = n π R 2 ε D x x 1 C concentrazione media nella membrana = α 2 (C 1 + C 2 ) coefficiente di filtrazione L p = n π R4 8η x
7 EBRANE equilibri osmotici osmosi FISICA EDICA e RADIOPROTEZIONE elio giroletti,, Equilibri osmotici nel sangue - Equilibri di membrana capillare - icrocircolazione - Capillari polmonari e intestinali - embrane renali 7 lucidi di D.Scannicchio, rivisti da E.Giroletti EQUILIBRI OSOTICI NEL SANGUE 1 composizione del plasma concentrazione totale NTP = 310 m litro π sangue = 0,310 osmolarità π plasma = π eritrociti π plasma > π eritrociti π plasma < π eritrociti eritrocita normale uscita J V collasso eritrociti ingresso J V rottura eritrociti EQUILIBRI OSOTICI NEL SANGUE 2 esempio perfusioni, flebo, trasfusioni: soluzioni isotoniche (π = 0,310 Osm NTP) 0,166 moli NaCl + 1 litro H2O (T=273 K) π = n δ R T = V δ = 1,86 0,166 moli 1,86 1 atm 22,4 litri 273 K = 1 litro 273 = 0,310 22,4 atm = 7 atm = 0,310 Osm π tot = i π = i i bini RT V
8 EQUILIBRI OSOTICI NEL SANGUE cellule epiteliali del capillare eritrociti cellule dei tessuti 3 8 lume capillare membrana capillare liquido interstiziale permeabile ai cristalloidi (acidi, basi, sali) non permeabile ai colloidi (proteine del plasma) C (proteine plasma) = 1 m litro 1 pressione osmotica π EQUILIBRI OSOTICI NEL SANGUE PRESSIONE ONCOTICA 4 C (proteine plasma) = 1 m litro 1 T = = 310 K nrt 3 moli litri atm π tot = = , K = 0,025atm 19mmHg V litro mole K in realtà π = mmhg π proteine plasma pressione oncotica = mmhg (discrepanza spiegata dall equilibrio elettrochimico) le proteine sono in forma ionica, valenza 18, e non passano membrana) EQUILIBRIO DI EBRANA CAPILLARE pressione osmotica plasma (H 2 O+cristalloidi) verso il capillare pressione idraulica capillare (H 2 O+cristalloidi) verso i tessuti equilibrio : J V = L p ( p π) = 0 ipotesi di Starling : p π PLASA π 1 =25 30 mmhg TESSUTI π 2 0mmHg equilibrio stabilito in media π= π 2 π 1 p 1 = mmhg p 2 2mmHg p= p 2 p 1 turgore dei tessuti membrana capillare
9 ICROCIRCOLAZIONE 1 9 p A 40mmHg p V 15 mmhg p 2 2 mmhg π 2 0 mmhg arteriola Q π 1 25 mmhg π 25 mmhg Q venula J V = L p ( p π) p=p 2 -p A 38 mmhg J V + L p (13 mmhg) p=p V -p 2 13 mmhg J V L p (12 mmhg) p=p V -p A 25 mmhg J V 0 ICROCIRCOLAZIONE A, Arteriola Venula, V J V = L p ( p π) Q Q (mmhg) p p 40 A p V 10 2 ο Arteriosa x x/3 π x Venosa ICROCIRCOLAZIONE Le presioni creano una microcirco- lazione che favorisce lo scambio ossigeno e anidride carbonica AAVV, Enciclopedia del corpo umano, cd-rom, 1997
10 ICROCIRCOLAZIONE 3 stima dei flussi di volume 10 stima della portata in uscita/entrata dal capillare Q c coefficiente di filtrazione della membrana capillare: capillare: X = 0,5 cm, r = 7 µm L p = 6, cm s 1 atm 1 ( p π)= 6,5 mmhg (valore medio) portata Q nel capillare (plasma) velocità del sangue nel capillare: v = 0,05 cm s 1 valore ematocrito 40% = 0,4 Q c = J V S = J x V 2πr = L p ( p π)x π r = 2 = 6, ,5 0,5 x 3,14 x = 6, cm 3 s Q=πr 2 v (1 0,4) = 3,14 ( ) 2 0,05 x 0,6 = 4, cm 3 s 1 Q c frazione soluzione scambiata Q = 6, cm 3 s 1 4, cm 3 s 1 = 1, (molto piccola) ICROCIRCOLAZIONE 4 edema: stima volume accumulato in 24 ore π: 25 mmhg 20 mmhg (deficienza proteine nel plasma calo pressione oncotica) ( p π) = 5 mmhg (in media) 2 x(uscita) 1 1 X (ingresso) = X superficie totale capillari circolo = 880 m 2 = 8, cm 2 V=L p ( p 1 π) 8, cm s 1 = 3 =6, mmhg 1 8, cm s 1 = 760 mmhg 3 = 1, cm 3 = 11,5 litri/g (H2O + cristalloidi)!! PLASA π 1 =25 30 mmhg p= p 2 p 1 p 1 = mmhg CAPILLARI POLONARI membrana alveolare ARIA ALVEOLARE surfactant π 2 0 mmhg π=π 2 π 1 p 2 5 mmhg membrana capillare * p 1 e p 2 relative alla pressione atmosferica esterna aumento p 1 oppure diminuzione π 1 edema polmonare (liquido negli alveoli)
11 PLASA CAPILLARI INTESTINALI membrana capillare INTESTINO 11 π 1 = mmhg π 2 0 mmhg π = π 2 π 1 assorbimento p 1 = mmhg p mmhg p = p 2 p 1 presenza di chimo (NB: durante digestione) π 1 = mmhg π 2 0 mmhg π = π 2 π 1 equilibrio p 1 = mmhg p 2 0 mmhg p= p 2 p 1 assenza di chimo RENE AAVV, Enciclopedia del corpo umano, cd-rom, 1997 EBRANE RENALI gomerulare: p sangue >π enorme flusso verso membrana tubolare tubolare: recupero di H 2 O e soluti indispensabili (diffusione, osmosi e meccanismi attivi) passano 180 l di urina al giorno; viene recuperata, ne espelliamo 1,5 l/g NaCl: ritorna in circolo 1,2 kg/g e ne espelliamo 15 g/g AAVV, Enciclopedia del corpo umano, cd-rom, 1997
12 EBRANE RENALI membrana glomerulare 12 PLASA CAPSULA DI BOWANN π 1 = mmhg π 2 0 mmhg π=π 2 π 1 p 1 = mmhg membrana glomerulare Permeabile ai cristalloidi Impermeabile ai colloidi p 2 0 mmhg filtrazione p = p 2 p 1 (urina diluita nel tubulo) Enorme flusso di volume (H 2 O) LINFA VEGETALE perchè sale nelle piante? membrana delle radici è semipermeabile concentrazione sostanze discolte nella linfa >> concentrazione delle sostanze nel terreno esiste π che richiama H 2 O verso l alto l in primavera, C=0,14 osmole e δ=1 π=dgh h= π/dg h π 1 = = C δ RT = m dg dg 30 AAVV, Enciclopedia del corpo umano, cd-rom, 1997 ECCANISI DI TRASPORTO PASSIVO J si = P i C C i (1 φ i )L p p µ i C i (1 φ i ) V x diffusione (grad C) filtrazione (grad p) J V = L p p + i osmosi (grad π) campo elettrico (grad V) L p φ i π φ i + ε i = 1 φ i = coefficiente di riflessione soluto i-esimo P = α n π R 2 i = ε i D x ε i D i x i = coeff. permeabilità 1 C =α concentrazione media nella membrana 2 (C 1 + C 2 ) = n π R coefficiente di filtrazione L p = 4 8η x µ i = Ze No D mobilità elettrolitica soluto-ione i-esimo R T i = i = 1, 2,... soluti diversi
13 13 OSOSI ostrare vari soluti insieme???? C 0 solutoi solutoi solvente C1 = 0 JV EBRANE osmosi FISICA EDICA e RADIOPROTEZIONE elio giroletti, giroletti, 2005 dispense su internet elio giroletti. Università Università degli Studi di Pavia dip. Fisica nucleare e teorica girolett@unipv.it - tel
MEMBRANE MEMBRANE. elio giroletti. Elio GIROLETTI - Università degli Studi di Pavia, Dip. Fisica nucleare e teorica
 1 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy tel. 038/98.7905 - girolett@unipv.it - www.unipv.it/webgiro MEMBRANE diffusione e filtrazione
1 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy tel. 038/98.7905 - girolett@unipv.it - www.unipv.it/webgiro MEMBRANE diffusione e filtrazione
FENOMENI ELETTRICI. FENOMENI ELETTRICI eq. elettroch.. e soluz.elettr. elio giroletti
 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via bassi 6, 700 pavia, tel. 03898.7905 girolett@unipv.it - www.unipv.it/webgiro webgiro FENOMENI ELETTRICI eq. elettroch..
elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via bassi 6, 700 pavia, tel. 03898.7905 girolett@unipv.it - www.unipv.it/webgiro webgiro FENOMENI ELETTRICI eq. elettroch..
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
Esercitazioni Infermieristica
 Esercitazioni Infermieristica Novara: Gruppo A 28/1 9-13 29/1 14-18 Gruppo B 28/1 14-18 29/1 9-13 Alba 7/12/2012 11-13 14-17 25/01/2013 15-18 a Novara Alessandria 18/12/2012 10-13 14-16 14/01/2013 10-13
Esercitazioni Infermieristica Novara: Gruppo A 28/1 9-13 29/1 14-18 Gruppo B 28/1 14-18 29/1 9-13 Alba 7/12/2012 11-13 14-17 25/01/2013 15-18 a Novara Alessandria 18/12/2012 10-13 14-16 14/01/2013 10-13
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
TERMODINAMICA stato gassoso. TERMODINAMICA stato gassoso. Elio GIROLETTI - Università degli Studi di Pavia, Dip. Fisica nucleare e teorica
 UNIERSITÀ DEGLI STUDI DI PAIA dip. Fisica nucleare e teorica via Bassi 6, 27100 Pavia, Italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro 1 elio giroletti TERMODINAMICA stato gassoso FISICA
UNIERSITÀ DEGLI STUDI DI PAIA dip. Fisica nucleare e teorica via Bassi 6, 27100 Pavia, Italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro 1 elio giroletti TERMODINAMICA stato gassoso FISICA
Fisicaa Applicata, Area Tecnica, M. Ruspa Esercizio. Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli. 2) il numero di molecole
 Esercizio Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli 2) il numero di molecole 1 GAS PERFETTO volume occupato dalle molecole è trascurabile; forze di attrazione tra molecole sono
Esercizio Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli 2) il numero di molecole 1 GAS PERFETTO volume occupato dalle molecole è trascurabile; forze di attrazione tra molecole sono
Temperatura. Il legame con le grandezze microscopiche è di tipo statistico. Pressione Volume Temperatura
 Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
elio giroletti effetti del sangue reale MECCANICA FLUIDI effetti del sangue reale MECCANICA FLUIDI
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via bassi 6, 27100 pavia, italy - tel. 038298.7905 girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti effetti del sangue reale
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via bassi 6, 27100 pavia, italy - tel. 038298.7905 girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti effetti del sangue reale
UNITA DI MISURA DEL CALORE
 UNITA DI MISURA DEL CALORE S.I >>> Unita pratica: caloria Esercizio Trasformare 2500 cal in J CAMBIAMENTI DI STATO I cambiamenti di stato avvengono a temperatura costante! CALORE LATENTE Il calore fornito
UNITA DI MISURA DEL CALORE S.I >>> Unita pratica: caloria Esercizio Trasformare 2500 cal in J CAMBIAMENTI DI STATO I cambiamenti di stato avvengono a temperatura costante! CALORE LATENTE Il calore fornito
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Alcuni esempi di ruoli fisiologici. Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale
 Alcuni esempi di ruoli fisiologici Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale Formazione e riassorbimento del liquido interstiziale Cellule
Alcuni esempi di ruoli fisiologici Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale Formazione e riassorbimento del liquido interstiziale Cellule
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costante il volume dei liquidi corporei attraverso il bilancio tra assunzione ed eliminazione di H 2 O. I reni giocano
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costante il volume dei liquidi corporei attraverso il bilancio tra assunzione ed eliminazione di H 2 O. I reni giocano
Capitolo 14 Le proprietà delle soluzioni
 Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
ESCLUSIVO USO DIDATTICO INTERNO - Meccanica dei fluidi nei sistemi biologici
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 700 Pavia, Italy - tel. 03898.7905 girolett@unipv.it - www.unipv.it/webgiro webgiro elio giroletti fluidi nei sistemi biologici
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 700 Pavia, Italy - tel. 03898.7905 girolett@unipv.it - www.unipv.it/webgiro webgiro elio giroletti fluidi nei sistemi biologici
Modalità di trasporto di acqua attraverso la membrana plasmatica
 Modalità di trasporto di acqua attraverso la membrana plasmatica Membrana plasmatica H 2 O H 2 O acquaporina In genere la membrana plasmatica che riveste tutte le cellule di un organismo è permeabile all
Modalità di trasporto di acqua attraverso la membrana plasmatica Membrana plasmatica H 2 O H 2 O acquaporina In genere la membrana plasmatica che riveste tutte le cellule di un organismo è permeabile all
1. Perché le sostanze si sciolgono?
 1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
STATO LIQUIDO. Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso
 STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Struttura del territorio circolatorio terminale
 Struttura del territorio circolatorio terminale Canale preferenziale passaggio principale Numero complessivo capillari nell uomo 30 40.10 9 Superficie di scambio 1000 m 2. Densità capillare funzionale
Struttura del territorio circolatorio terminale Canale preferenziale passaggio principale Numero complessivo capillari nell uomo 30 40.10 9 Superficie di scambio 1000 m 2. Densità capillare funzionale
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Si definisce soluzione un sistema omogeneo (costituito da una sola fase) con più di un componente
 Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea.
 Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le
 Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Corso di Laurea Magistrale in Medicina e Chirurgia. Biofisica e Fisiologia I A.A ESERCITAZIONE. Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
MECCANICA dei FLUIDI nei SISTEMI BIOLOGICI
 MECCANICA dei FLUIDI nei SISTEMI BIOLOGICI parte II a parte I! - EQUAZIONE DI CONTINUITA - PRESSIONE IDROSTATICA Lucidi del Prof. D. Scannicchio MASSA, PESO, DENSITA' m kg massa g massa p = m g kg peso
MECCANICA dei FLUIDI nei SISTEMI BIOLOGICI parte II a parte I! - EQUAZIONE DI CONTINUITA - PRESSIONE IDROSTATICA Lucidi del Prof. D. Scannicchio MASSA, PESO, DENSITA' m kg massa g massa p = m g kg peso
ESCLUSIVO USO DIDATTICO INTERNO - CENNI DI DINAMICA DEI FLUIDI Elio GIROLETTI - Università degli Studi di Pavia, Dip. Fisica nucleare e teorica
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 700 Pavia, Italy - tel. 038/98.7905 girolett@unipv.it - www.unipv.it/webgiro 004 elio giroletti dinamica dei fluidi RISCHI FISICI,
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 700 Pavia, Italy - tel. 038/98.7905 girolett@unipv.it - www.unipv.it/webgiro 004 elio giroletti dinamica dei fluidi RISCHI FISICI,
COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO
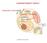 COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO OMEOSTASI Stato di stabilità locale che tende a mantenersi lontano dallo stato di equilibrio EQUILIBRIO Stato di stabilità energetica, massima entropia
COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO OMEOSTASI Stato di stabilità locale che tende a mantenersi lontano dallo stato di equilibrio EQUILIBRIO Stato di stabilità energetica, massima entropia
MEMBRANE. MEMBRANE equilibri gas-liquido. elio giroletti
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 27100 Pavia, Italy tel. 0382/98.7905 - girolett@unipv.it - www.unipv.it/webgiro 1 elio giroletti MEMBRANE equilibri gas- FISICA
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 27100 Pavia, Italy tel. 0382/98.7905 - girolett@unipv.it - www.unipv.it/webgiro 1 elio giroletti MEMBRANE equilibri gas- FISICA
Lezione n. 12. Proprietà colligative Variazione del punto crioscopico. Pressione osmotica. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Osmometria ed Emolisi
 Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
MECCANICA DEI FLUIDI lavoro cardiaco. MECCANICA DEI FLUIDI lavoro cardiaco. elio giroletti
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via bassi 6, 271 pavia, italy - tel. 38298.795 girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti MECCANICA DEI FLUIDI lavoro
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via bassi 6, 271 pavia, italy - tel. 38298.795 girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti MECCANICA DEI FLUIDI lavoro
PROPRIETA DELLE SOLUZIONI
 1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
Lezione 11 Soluzioni. Diffusione ed osmosi.
 Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
STATI DI AGGREGAZIONE
 STATI DI AGGREGAZIONE SOLIDO ha volume e forma propri SUBLIMAZIONE FUSIONE SOLIDIFICAZIONE EVAPORAZIONE LIQUIDO Ha volume proprio, forma del recipiente BRINAMENTO VAPORE E GAS CONDENSAZIONE FLUIDI non
STATI DI AGGREGAZIONE SOLIDO ha volume e forma propri SUBLIMAZIONE FUSIONE SOLIDIFICAZIONE EVAPORAZIONE LIQUIDO Ha volume proprio, forma del recipiente BRINAMENTO VAPORE E GAS CONDENSAZIONE FLUIDI non
Le soluzioni e il loro comportamento
 2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
PROPEDEUTICO meccanica. PROPEDEUTICO meccanica. elio giroletti. Elio GIROLETTI - Università di Pavia, Dip. Fisica nucleare e teorica
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy - tel. 03898.7905 elio.giroletti@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti PROPEDEUTICO meccanica
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy - tel. 03898.7905 elio.giroletti@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti PROPEDEUTICO meccanica
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA
 COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 MECCANISMI DI TRASPORTO Trasporto transmembranario Le membrane biologiche sono barriere di permeabilità che impediscono a gran parte delle molecole
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 MECCANISMI DI TRASPORTO Trasporto transmembranario Le membrane biologiche sono barriere di permeabilità che impediscono a gran parte delle molecole
Importanza dell acqua per le cellule vegetali
 L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
Attivi (non equilibranti) Passivi (equilibranti) Migrazione attraverso canali membran. Diffusione semplice. Tasporto attivo secondario
 TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
Le proprietà colligative delle soluzioni
 Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
Proprietà colligative
 Proprietà colligative Le proprietà che dipendono dalla proporzione tra le molecole del soluto e quelle del solvente ma non dall identità chimica del soluto si dicono proprietà colligative. Le proprietà
Proprietà colligative Le proprietà che dipendono dalla proporzione tra le molecole del soluto e quelle del solvente ma non dall identità chimica del soluto si dicono proprietà colligative. Le proprietà
PORTA AGLI ORGANI E AI TESSUTI: RIMUOVE: OMEOTERMI INTERVIENE NELLA TERMOREGOLAZIONE FUNZIONI DELLA CIRCOLAZIONE SANGUIGNA IL GLOBULO ROSSO
 FUNZIONI DELLA CIRCOLAZIONE SANGUIGNA IL GLOBULO ROSSO PORTA AGLI ORGANI E AI TESSUTI: a. L OSSIGENO (O 2 ), b. LE SOSTANZE NUTRITIZIE ASSORBITE, c. I SECRETI DELLE GHIANDOLE ENDOCRINE. RIMUOVE: a. L ANIDRIDE
FUNZIONI DELLA CIRCOLAZIONE SANGUIGNA IL GLOBULO ROSSO PORTA AGLI ORGANI E AI TESSUTI: a. L OSSIGENO (O 2 ), b. LE SOSTANZE NUTRITIZIE ASSORBITE, c. I SECRETI DELLE GHIANDOLE ENDOCRINE. RIMUOVE: a. L ANIDRIDE
Fisiologia Renale 6. Bilancio idro-elettrolitico I. Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona
 Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento.
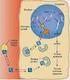 Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A. 2017-18 Osmosi Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unicampania.it Equilibrio
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A. 2017-18 Osmosi Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unicampania.it Equilibrio
Il Sangue e il plasma 2. Eritrociti, pressione osmotica del plasma, tonicità. Carlo Capelli Fisiologia Facoltà di Università di Verona
 Il Sangue e il plasma 2. Eritrociti, pressione osmotica del plasma, tonicità Carlo Capelli Fisiologia Facoltà di Università di Verona Obiettivi 1. Eritrociti: caratteristiche morfologiche e life span 2.
Il Sangue e il plasma 2. Eritrociti, pressione osmotica del plasma, tonicità Carlo Capelli Fisiologia Facoltà di Università di Verona Obiettivi 1. Eritrociti: caratteristiche morfologiche e life span 2.
Il binomio di van t Hoff Le proprietà colligative dipendono dal numero di particelle effettivamente presenti nella soluzione. Nel caso in cui il solut
 Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative. Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura
 Proprietà colligative Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura Grandezze colligative abbassamento della tensione di vapore innalzamento
Proprietà colligative Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura Grandezze colligative abbassamento della tensione di vapore innalzamento
Anatomia funzionale del rene
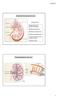 Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
GLI STATI DELLA MATERIA
 GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
L APPARATO CIRCOLATORIO
 L APPARATO CIRCOLATORIO I SISTEMI CIRCOLATORI Negli organismi più complessi si sono evoluti due tipi di sistemi circolatori: i SISTEMI APERTI ed i SISTEMI CHIUSI Entrambi questi sistemi sono caratterizzati
L APPARATO CIRCOLATORIO I SISTEMI CIRCOLATORI Negli organismi più complessi si sono evoluti due tipi di sistemi circolatori: i SISTEMI APERTI ed i SISTEMI CHIUSI Entrambi questi sistemi sono caratterizzati
Esercizi Concentrazioni e diluizioni
 Esercizi Concentrazioni e diluizioni Una soluzione 0.300 m di acido fosforico ha densità 1.010 g/ml. Calcolare la frazione molare, la percentuale in peso, la molarità. Molalità 0.300 m 0.300 moli di acido
Esercizi Concentrazioni e diluizioni Una soluzione 0.300 m di acido fosforico ha densità 1.010 g/ml. Calcolare la frazione molare, la percentuale in peso, la molarità. Molalità 0.300 m 0.300 moli di acido
Proprietà colligative. Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura
 Proprietà colligative Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura Grandezze colligative abbassamento della tensione di vapore innalzamento
Proprietà colligative Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura Grandezze colligative abbassamento della tensione di vapore innalzamento
Trasporto epiteliale
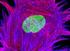 Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Proprietà colligative
 roprietà colligative Fra i sistemi reali è utile esaminare il comportamento di soluzioni diluite ottenuti da solidi o liquidi poco volatili rispetto al solvente. Le proprietà di tali soluzioni dipendono
roprietà colligative Fra i sistemi reali è utile esaminare il comportamento di soluzioni diluite ottenuti da solidi o liquidi poco volatili rispetto al solvente. Le proprietà di tali soluzioni dipendono
25/05/2018. IL GLICOCALICE solo danno del microcircolo o anche guida nel fluid replacement
 25/05/2018 IL GLICOCALICE solo danno del microcircolo o anche guida nel fluid replacement A cosa NON pensiamo quando «riempiamo» un paziente? Starling Principles Secondo la teoria di Starling, quando
25/05/2018 IL GLICOCALICE solo danno del microcircolo o anche guida nel fluid replacement A cosa NON pensiamo quando «riempiamo» un paziente? Starling Principles Secondo la teoria di Starling, quando
Soluzioni semplici. Soluzioni liquide
 Soluzioni semplici Definizione di soluzione: dispersione omogenea di due (o più) specie chimiche in proporzioni variabili ma entro un campo finito di valori Soluto Solvente G. Sotgiu 1 Soluzioni liquide
Soluzioni semplici Definizione di soluzione: dispersione omogenea di due (o più) specie chimiche in proporzioni variabili ma entro un campo finito di valori Soluto Solvente G. Sotgiu 1 Soluzioni liquide
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Importanza della pressione osmotica. Turgore delle cellule e dei tessuti Volume del sangue Scambio di liquidi tra il sangue e i tessuti Rene
 Importanza della pressione osmotica Turgore delle cellule e dei tessuti Volume del sangue Scambio di liquidi tra il sangue e i tessuti Rene Quali sono le forze che spingono le sostanze a spostarsi? Lo
Importanza della pressione osmotica Turgore delle cellule e dei tessuti Volume del sangue Scambio di liquidi tra il sangue e i tessuti Rene Quali sono le forze che spingono le sostanze a spostarsi? Lo
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana
 Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Anatomia funzionale del rene
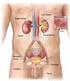 Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
IL MOTO DEI FLUIDI. con applicazione al sistema circolatorio
 IL MOTO DEI FLUIDI con applicazione al sistema circolatorio Portata Pressione Moto stazionario: equazione di continuità Applicazione al sistema circolatorio: pressione e velocità del sangue Moto laminare
IL MOTO DEI FLUIDI con applicazione al sistema circolatorio Portata Pressione Moto stazionario: equazione di continuità Applicazione al sistema circolatorio: pressione e velocità del sangue Moto laminare
DINAMICA DEI FLUIDI con applicazioni al sistema circolatorio
 CLASSE DELLE LAUREE TRIENNALI DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE DINAMICA DEI FLUIDI con applicazioni al sistema circolatorio PORTATA PRESSIONE MOTO STAZIONARIO APPLICAZIONI AL SISTEMA CIRCOLATORIO
CLASSE DELLE LAUREE TRIENNALI DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE DINAMICA DEI FLUIDI con applicazioni al sistema circolatorio PORTATA PRESSIONE MOTO STAZIONARIO APPLICAZIONI AL SISTEMA CIRCOLATORIO
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
STATO GASSOSO. parte I a. - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio
 STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
struttura e composizione della membrana cellulare Prof. Davide Cervia - Fisiologia Fisiologia della cellula: trasporti di membrana
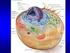 struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
Le soluzioni e il loro comportamento
 A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
PROPRIETA DELLE SOLUZIONI ACQUOSE. Prof.ssa Patrizia Gallucci
 PROPRIETA DELLE SOLUZIONI ACQUOSE Prof.ssa Patrizia Gallucci L'acqua è un composto chimicamente semplice, formato da due atomi di idrogeno e uno di ossigeno (H2O), che riveste fondamentale importanza in
PROPRIETA DELLE SOLUZIONI ACQUOSE Prof.ssa Patrizia Gallucci L'acqua è un composto chimicamente semplice, formato da due atomi di idrogeno e uno di ossigeno (H2O), che riveste fondamentale importanza in
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Il potenziale di membrana è la differenza di potenziale elettrico a cavallo della membrana cellulare (negatività interna), determinato da una diversa
 Il potenziale di membrana è la differenza di potenziale elettrico a cavallo della membrana cellulare (negatività interna), determinato da una diversa distribuzione ionica ai due lati della membrana. Nelle
Il potenziale di membrana è la differenza di potenziale elettrico a cavallo della membrana cellulare (negatività interna), determinato da una diversa distribuzione ionica ai due lati della membrana. Nelle
Trasporto di membrana
 Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
OSMOREGOLAZIONE DEI LIQUIDI CORPOREI
 OSMOREGOLAZIONE DEI LIQUIDI CORPOREI Lezione 25 1 Distribuzione dei liquidi corporei L H 2 O contenuta nel corpo è circa il 60% del peso totale ed è così ripartita: 67% 33% EXTRACELLULARE 33% INTRACELLULARE
OSMOREGOLAZIONE DEI LIQUIDI CORPOREI Lezione 25 1 Distribuzione dei liquidi corporei L H 2 O contenuta nel corpo è circa il 60% del peso totale ed è così ripartita: 67% 33% EXTRACELLULARE 33% INTRACELLULARE
Scambi gassosi e regolazione del respiro
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ventilazione polmonare Ruolo del Sistema Respiratorio: 1 2 - fornire O 2 - rimuovere
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ventilazione polmonare Ruolo del Sistema Respiratorio: 1 2 - fornire O 2 - rimuovere
LE PROPRIETÀ DELLE SOLUZIONI
 LE PROPRIETÀ DELLE SOLUZIONI Le Soluzioni o Miscugli omogenei Solvente e soluto Energia sprigionata e acquisita Solvatazione e idratazione Le Soluzioni 3) 1. Composti Ionici (Dissociazione) 2. Composti
LE PROPRIETÀ DELLE SOLUZIONI Le Soluzioni o Miscugli omogenei Solvente e soluto Energia sprigionata e acquisita Solvatazione e idratazione Le Soluzioni 3) 1. Composti Ionici (Dissociazione) 2. Composti
Dinamica dei fluidi viscosi
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori:
 Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
Per una mole di AB 1 - α α α. Per n moli di AB n (1 α) n α n α. Il numero totale delle particelle, all'equilibrio, sono:
 Elettroliti AB A + + B - Grado di dissociazione α è la frazione di mole che all equilibrio ha subito dissociazione α : 1 = n mol dissociate : n mol iniziali AB A + + B - Per una mole di AB 1 - α α α Per
Elettroliti AB A + + B - Grado di dissociazione α è la frazione di mole che all equilibrio ha subito dissociazione α : 1 = n mol dissociate : n mol iniziali AB A + + B - Per una mole di AB 1 - α α α Per
Caratteristiche delle membrane biologiche
 Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
-PROPRIETA COLLIGATIVE-
 -PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
-PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
CONCENTRAZIONE. Le proprietà delle soluzioni di pendono dalle quantità relative delle sostanze che le compongono.
 1 CONCENTRAZIONE Le proprietà delle soluzioni di pendono dalle quantità relative delle sostanze che le compongono. La concentrazione esprime la composizione quantitiva soluzione. di una Unità di concentrazione
1 CONCENTRAZIONE Le proprietà delle soluzioni di pendono dalle quantità relative delle sostanze che le compongono. La concentrazione esprime la composizione quantitiva soluzione. di una Unità di concentrazione
Termodinamica Chimica
 Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Miscele e Soluzioni dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Miscele e Soluzioni dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
GAS. H 2 N 2 O 2 F 2 Cl 2 CO CO 2 NO 2 SO 2 CH 4
 GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
L anatomia dell apparato urinario
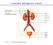 L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
Lo stato liquido. i liquidi molecolari con legami a idrogeno: le interazioni tra le molecole si stabiliscono soprattutto attraverso legami a idrogeno
 Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Il glomerulo. Membrana di filtrazione è formata da:
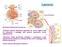 Il glomerulo Fessure di filtrazione Membrana di filtrazione è formata da: Endotelio capillare (fenestrato, tappezzato da cariche negative fisse che ostacolano il passaggio delle proteine plasmatiche, cariche
Il glomerulo Fessure di filtrazione Membrana di filtrazione è formata da: Endotelio capillare (fenestrato, tappezzato da cariche negative fisse che ostacolano il passaggio delle proteine plasmatiche, cariche
I VASI SANGUIGNI. Giovanni Mirabella,PhD Dip. di Fisiologia e Farmacologia V. Espamer
 I VASI SANGUIGNI Giovanni Mirabella,PhD (giovanni.mirabella@uniroma1.it) Dip. di Fisiologia e Farmacologia V. Espamer Istituto Neurologico Mediterraneo Dipartimento di Neuroscienze SISTEMA CARDIOVASCOLARE:
I VASI SANGUIGNI Giovanni Mirabella,PhD (giovanni.mirabella@uniroma1.it) Dip. di Fisiologia e Farmacologia V. Espamer Istituto Neurologico Mediterraneo Dipartimento di Neuroscienze SISTEMA CARDIOVASCOLARE:
Fisiologia dell apparato urinario
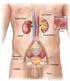 Fisiologia dell apparato urinario Funzioni del Rene Nefroni Corticale Midollare Pelvi renale Uretere Capsula Escrezione prodotti di scarto del metabolismo (urea, creatinina, acido urico, prodotti finali
Fisiologia dell apparato urinario Funzioni del Rene Nefroni Corticale Midollare Pelvi renale Uretere Capsula Escrezione prodotti di scarto del metabolismo (urea, creatinina, acido urico, prodotti finali
SOLUZIONI. solide (es. leghe)
 SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
