GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUAL VOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA
|
|
|
- Stefania Marchese
- 7 anni fa
- Visualizzazioni
Transcript
1 Il Legame Chimico Per raggiungere configurazioni elettroniche stabili gli elementi tendono a reagire fra loro formando legami chimici. Configurazione stabile = situazione di minima energia Il legame chimico è l interazione fra due atomi che porta ad uno stato di minima energia Il legame chimico è la forza risultante fra le forze attrattive (e - - nucleo) e repulsive (nucleo nucleo) ed (e - - e - )
2 GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUAL VOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA CONDIZIONE DI MAGGIORE STABILITA ENERGETICA. QUESTO PROCESSO DA LUOGO AL LEGAME CHIMICO
3 Il Legame Chimico Ma bisogna spiegare anche perché esistono interazioni interatomiche di forza diversa perché le interazioni sono direzionali perché i legami si formano fra certe coppie di atomi e non fra altre
4 La maggior parte delle sostanze che ci circondano sono fatte da molecole Che cos è una molecola? una molecola è un aggregato distinto di atomi, uniti da legami chimici, che è dotato di proprietà caratteristiche che lo rendono riconoscibile
5 Teoria del Legame Chimico La teoria del legame chimico ha come obiettivo quello di dare una spiegazione di tali fatti e di prevedere quali interazioni e di che tipo possono avvenire fra una data coppia di atomi
6 Parlando di legami chimici, un'utile rappresentazione degli atomi è costituita dalle formule di Lewis (dal nome dello scienziato che per primo le adottò). Queste sono costituite dal simbolo dell'elemento al centro e da tanti puntini disposti intorno ad esso quanti sono gli elettroni più esterni Ricordate che il numero di questi elettroni di un elemento è uguale al numero del gruppo a cui appartiene (per gli elementi dei blocchi s e p). Le formule di Lewis degli elementi potassio (gruppo I), alluminio (gruppo III) zolfo (gruppo VI) e argon (gruppo VIII) sono quindi le seguenti: Es legame covalente
7 Esistono tipi differenti di legame chimico ma in ogni caso le forze che tengono uniti gli atomi sono sempre dovute ad attrazioni elettriche fra particelle (di volta in volta vedremo quali) di carica opposta. Quando due atomi si legano, la molecola risultante è un sistema ad energia minore e quindi più stabile rispetto ai due atomi isolati; questo è il motivo per cui in natura si trovano pochissimi atomi isolati. La differenza di energia che esiste tra gli atomi isolati e quelli legati, mostrata nella figura con la freccia a doppia punta, rappresenta sia l'energia che si libera nella formazione del legame sia l'energia che bisogna fornire per spezzarlo e riottenere gli atomi liberi
8 Energia di Legame Energia necessaria per portare a distanza infinita i due atomi che costituiscono una molecola biatomica allo stato gassoso E' detta quindi energia di legame l'energia che bisogna fornire per rompere un legame; questa quantità è uguale a quella che si libera quando lo stesso legame viene costituito. è di norma misurata in kj/mol.
9 1. LEGAME ATOMICO Classificazione dei legami chimici (SCHEMA importante) Quando due atomi legati condividono degli elettroni (formazione di ORBITALE MOLECOLARE) a. legame covalente (Omeopolare e Eteropolare)/La condivisione può avvenire in ugual misura o in misura parziale (un atomo di più e l altro di meno) b. legame dativo 2. LEGAME ELETTROSTATICO Quando due atomi sono legati NON da elettroni ma da una FORZA ELETTROSTATICA (NO Orbitale Molecolare) a. Legame ionico b. Legame idrogeno c. Legami dipolo vari (Legame ione dipolo e legami di Wan der Waals) 3. LEGAME METALLICO Avviene nei metalli, quando un elettrone lega i cationi circostanti con questo tipo di legame (NON HA INTERESSE biologico) 4. Legame ( INTERAZIONE ) idrofobico Legame tra orbitali ibridi Ø LEGAME SIGMA E un legame covalente che si forma tra due atomi in cui l orbitale molecolare che si forma occuperà lo spazio tra i due atomi, o meglio se la nuvola elettronica avvolge omogeneamente la retta idela che unisce i due nuclei Ø LEGAME PI GRECO E un legame addizionale che avviene dopo che è avvenuto un legame sigma in cui la nuvola elettronica si trova ai lati (sopra e sotto)della retta ideale che congiunge i due nuclei
10 Energia di Legame Energia media di alcuni legami singoli (kj/mol)
11 Energia di Legame E d livelli vibrazionali energia del punto 0 distanza di legame Energia di legame r
12 L'atomo di idrogeno ha configurazione elettronica 1s: è cioè costituito da un protone e un elettrone. Quando due atomi di idrogeno si avvicinano l'uno all'altro, le forze di attrazione che il nucleo di un atomo esercita sulla nuvola elettronica dell'altro vanno via via aumentando man mano che diminuisce la distanza fra di loro (vedi il grafico dell'energia potenziale, Ep, in funzione della distanza fra i nuclei). Giunti ad una distanza di 0.74 Å, l'attrazione è massima, mentre la repulsione fra i due nuclei è ancora relativamente bassa. In queste condizioni, le nuvole elettroniche dei due atomi si fondono in modo che i due orbitali atomici danno origine ad un nuovo orbitale, orbitale molecolare, che ospita entrambi gli elettroni e occupa una regione dello spazio che comprende i due nuclei. Al di sotto di questa distanza, la repulsione internucleare prenderebbe a crescere rapidamente, per cui i due nuclei tendono a rimanere alla distanza di minima energia potenziale Come si può capire dall'esempio dell'idrogeno, affinché fra due atomi possa formarsi un legame covalente, è necessario che entrambi posseggano nel livello esterno almeno un orbitale atomico occupato da UN SOLO elettrone. Ovviamente il legame covalente non è esclusivo di molecole biatomiche. Anche gli elementi non metallici del 2 e 3 periodo (C, N, O, F, e Si, P, S, Cl) fanno legami covalenti.
13 Esempio Formazione legame covalente H-H H separati, gli e - si appaiano formazione del legame
14 Gli elettroni hanno il massimo di probabilità di trovarsi tra i due nuclei: le forze attrattive sono più forti di quelle repulsive Le forze repulsive hanno il sopravvento su quelle attrattive: destabilizzazione del legame
15 LEGAMI COVALENTI OMOPOLARI : coinvolgono atomi uguali
16 Proprietà del legame L ordine di legame è il numero di legami tra due atomi (1, singolo; 2, doppio; 3, triplo). L ordine di legame può anche essere frazionale come nelle specie dove gli elettroni sono delocalizzati. La lunghezza di legame è la distanza tra i nuclei di atomi legati. I legami di ordine maggiore sono più corti. Energia di legame (o entalpia di legame): è l energia richiesta per rompere il legame tra 2 atomi. I legami di ordine maggiore sono più forti. Le energie di legame (entalpie) sono sempre positive
17 In generale, a maggiore ordine di legame corrisponde maggiore energia di legame e minore distanza.
18 Rottura del legame covalente L energia del legame è misurata dall energia per romperlo
19 Ordine di legame E uguale al numero di coppie di elettroni di legame condivise fra due atomi. C - C C=C C C Legame singolo Legame doppio Legame triplo 1,54 Å 1,34 Å 1,20 Å La distanza di legame in genere diminuisce all aumentare dell ordine di legame
20 Energia di legame L energia di dissociazione di un legame è una misura della forza di un particolare legame e, riferito ad una mole, è essenzialmente il H della reazione in fase gassosa di rottura del legame. Per H 2 H 2 2H H =436 kj/mol
21 Un altro importante impiego delle energie di legame consiste nel permettere di prevedere se una reazione sarà esotermica o endotermica. In generale, se Legami deboli Legami forti H<0 (reagenti) (prodotti) esotermica Legami forti Legami deboli H>0 (reagenti) (prodotti) endotermica
22 1. LEGAME ATOMICO Classificazione dei legami chimici (SCHEMA importante) Quando due atomi legati condividono degli elettroni (formazione di ORBITALE MOLECOLARE) a. legame covalente (Omeopolare e Eteropolare)/La condivisione può avvenire in ugual misura o in misura parziale (un atomo di più e l altro di meno) b. legame dativo 2. LEGAME ELETTROSTATICO Quando due atomi sono legati NON da elettroni ma da una FORZA ELETTROSTATICA (NO Orbitale Molecolare) a. Legame ionico b. Legame idrogeno c. Legami dipolo vari (Legame ione dipolo e legami di Wan der Waals) 3. LEGAME METALLICO Avviene nei metalli, quando un elettrone lega i cationi circostanti con questo tipo di legame (NON HA INTERESSE biologico) 4. Legame ( INTERAZIONE ) idrofobico Legame tra orbitali ibridi Ø LEGAME SIGMA E un legame covalente che si forma tra due atomi in cui l orbitale molecolare che si forma occuperà lo spazio tra i due atomi, o meglio se la nuvola elettronica avvolge omogeneamente la retta idela che unisce i due nuclei Ø LEGAME PI GRECO E un legame addizionale che avviene dopo che è avvenuto un legame sigma in cui la nuvola elettronica si trova ai lati (sopra e sotto)della retta ideale che congiunge i due nuclei
23 LEGAME COVALENTE Nella configurazione elettronica esterna si definisce: Singoletto o elettrone spaiato Doppietto Il legame covalente si realizza tra due atomi che abbiano nell ultimo livello energetico almeno un elettrone spaiato I due orbitali atomici si fondono, per formare un orbitale di legame, che circonda entrambi i nuclei, al suo interno si trovano i due elettroni spaiati, con spin opposto (vale sempre il principio di Pauli) detto orbitale molecolare I due elettroni risentono dell attrazione di ambo i nuclei atomici e ruotano intorno ad entrambi. Essi non appartengono più ai singoli atomi, bensì ad ambedue: i due atomi hanno messo ognuno in compartecipazione un orbitale con un elettrone H H H 1S 1 H 1S 1 Atomi isolati Molecola d idrogeno 23
24 Molecola: gruppo di atomi legati da legame covalente Legame singolo I due atomi sono legati tramite una sola coppia di legame Gli elettroni non coinvolti nel legame formano coppie di non legame Cl Cl Molecola di cloro Cl 2 C H Molecola di acido cloridrico HCl Legame doppio I due atomi sono legati tramite due coppie di legame H N H H ammoniaca O H H acqua Legame triplo I due atomi sono legati tramite tre coppie di legame N N Molecola di azoto N 2 24
25 Le cariche negative degli elettroni si trovano a contatto Se non avviene niente tra gli elettroni, i due atomi si respingono Oppure, e non si possono ha nessun verificare legame. due casi limite:
26 I due atomi hanno elettronegatività paragonabile: se si verificano le condizioni adatte, gli elettroni possano localizzarsi in mezzo ai due atomi e formare gli orbitali molecolari LEGAME COVALENTE
27 I due atomi hanno elettronegatività diversa, ma non troppo: gli elettroni si localizzano in mezzo ai due atomi, ma un po spostati verso quello più elettronegativo LEGAME COVALENTE-POLARE
28 H H + H H H Legame dativo: è un legame covalente polare che si realizza tra un atomo con un orbitale pieno ed un atomo con un orbitale vuoto H N H H N Ione ammonio NH + 4 A parte la differente appartenenza degli elettroni, un legame dativo ha le stesse proprietà di un legame covalente normale. 28
29 Se Uno dei due atomi è molto più elettronegativo dell altro: uno o più elettroni passano all atomo più elettronegativo
30 Uno dei due atomi è molto più elettronegativo dell altro: + - si forma uno ione positivo ed uno negativo che si attraggono LEGAME IONICO
31 Legame ionico Formazione del legame in NaCl Na + Cl > Na + + Cl - Na + + Cl - > NaCl N.B. La formula NaCl fornisce solo informazioni sul rapporto tra ioni sodio e ioni cloro all interno del solido cristallino. Non è quindi da intendersi come formula di una molecola, intesa come entità chimica individuale. Inoltre, l energia della singola coppia ionica non raggiunge il minimo di energia possibile. - +
32 Cl - Na + Qual e lo ione sodio?
33 INTERAZIONI TRA MOLECOLE E TRA IONI E MOLECOLE Sono attrazioni più deboli dei legami veri e propri, poiché si instaurano fra specie che già possiedono legami capaci di esistere in forma stabile. Sono importanti nel determinare le proprietà fisiche delle sostanze (stati di aggregazione, temperature di fusione, ebollizione, ). Sono di natura elettrostatica e si dividono in: 1. Interazioni tra molecole polari (ione-dipolo). 2. Legami a idrogeno (o a ponte di idrogeno) 3. Forze di van der Waals
34 (detti Ioni idratati) 3. Le INTERAZIONI FRA IONI E MOLECOLE POLARI: forze elettrostatiche che si esercitano fra uno ione e più molecole polari. Un esempio classico è l idratazione degli ioni del sale da cucina NaCl sciolto in acqua: in soluzione, gli ioni sono circondati da molecole d acqua che rivolgono la loro estremità polarizzata di segno opposto alla carica dello ione: H H +d -d O Na + O -d +d H H Cl - +d H O -d H Si dice che in acqua gli ioni non sono nudi, ma circondati da un guscio di molecole d acqua legate con interazione ione-dipolo.
35 Importanza biologica degli ioni idratati Volume ione Na + + Li + K Volume ione idratato
36 Na + + Li + K Volume ione idratato La mobilità di un catione in acqua diminuisce all aumentare del suo diametro: Na + Un catione idrato più grande es si muove più lentamente in una soluzione e nella cellula attraversa con più fatica i pori delle membrane cellulari di uno ione idrato più piccolo es + K
37 2. Il LEGAME A IDROGENO: attrazione che si esercita fra una atomo di idrogeno, legato covalentemente ad una atomo N, O, F (fortemente elettronegativi) di una molecola e un atomo di N, O, F, di un altra molecola. Esempi: fra molecole d acqua, fra molecole di ammoniaca, fra molecole di alcoli e nei legami intramolecolari di proteine, polisaccaridi o acidi nucleici. A causa della presenza del legame idrogeno, l acqua ha un punto di ebollizione maggiore rispetto a composti aventi lo stesso peso molecolare o poco maggiore (H 2 S).
38 Legame a idrogeno Si hanno legami a idrogeno nei seguenti casi: N-H X < O-H X < F-H X S-H X < Cl-H X dove X può essere N, O, F,Cl,talvolta anche P, S Si osservano comunque deboli legami a idrogeno anche con C-H, P-H, Se-H, Br-H, I-H etc. Leagame a idrogeno: è un legame dipolo-dipolo particolarmente forte che si stabilisce tra molecole in cui il polo positivo è sull H e quello negativo su uno dei seguenti atomi: F, O, N, Cl caratterizzati da una elevata elettronegatività.
39 LEGAME IDROGENO: Legame elettrostatico che si forma quando l H legato fa da ponte tra un atomo molto elettronegativo con cui è legato covalentemente e un altro atomo molto elettronegativo
40 Il legame ad idrogeno è alla base del codice genetico La struttura secondaria delle proteine viene definita sulla base del network di legami ad idrogeno
41 Legame dipolo - dipolo: si realizza nelle molecole polari e consiste nell attrazione tra le parti caricate con segno opposto dei dipoli delle varie molecole, che si orientano opportunamente E un legame piuttosto debole Un particolare tipo di legame dipolo-dipolo è il già citato Legame idrogeno (o ponte di idrogeno): si realizza tra molecole nelle quali vi è dell idrogeno legato ad elementi molto elettronegativi L esempio più importante è l acqua, dove un atomo di idrogeno di una molecola si lega ad una coppia di non legame di un ossigeno di un altra molecola δ - O H H δ + H F H F H F H F Acido fluoridrico H O H H O H H O H 41
42 1. Le FORZE DI VAN DER WAALS (o attrazioni fra molecole): forze elettrostatiche che si esercitano fra molecole non polari o polari. (dipolo-dipolo indotto) - Fra molecole non polari (gas nobili allo stato liquido, iodio..) si instaurano perché si può ritenere che, in istanti definiti, il movimento degli elettroni provoca la formazione di dipoli istantanei che cambiano continuamente e polarizzano le molecole vicine. - Fra molecole polari, l estremità positiva di una molecola attrae l estremità negativa di un altra:
43 L intensità delle forze di van der Waals aumenta con l aumentare delle dimensioni della molecola. Quando si esercitano fra molecole polari (H 2 O) e molecole apolari (gas come O 2 ), si ritiene che le molecole polari inducano un dipolo nelle molecole apolari. Queste interazioni spiegano i casi di solubilità di molecole apolari in acqua (benzene, ossigeno, azoto, )
44 Interazioni deboli
45 Possiamo ricapitolare i vari tipi di forze chimiche che giustificano la struttura e il comportamento della materia, menzionandole in ordine di forza all'incirca decrescente: legame covalente, molto forte e direzionale, agisce a distanza breve; formazione di orbitali molecolari E kcal/mole (omeopolare, eteropolare e dativo) legame ionico, molto forte, non direzionale, E = z + z - /r diminuisce in funzione inversa alla distanza r ;no orbitali molecolari interazione ione-dipolo, più debole del legame ionico (sono coinvolte cariche frazionarie) ma con caratteristiche simili legame a idrogeno interazioni dipolo-dipolo, abbastanza debole, non direzionale; diminuisce con 1/r 3 (Van der Waals) interazioni ione-dipolo indotto, debole, cala con 1/r 4 interazione dipolo-dipolo indotto, molto debole, cala con 1/r 6 (wan der waals) interazione dipolo istantaneo-dipolo indotto (forze di London) molto debole, cala con 1/r 6
46 Il "LEGAME" IDROFOBICO o meglio interazione idrofobica Si chiama"legame idrofobico" una forza che tiene legate più molecole (o parti di molecole), senza che tra di esse si istauri un tipico legame chimico. Per spiegare questo legame (che non è un vero legame) ricorriamo a un esempio. Abbiamo acqua in cui ogni molecola è legata ad altre 4 da forti legami H. Per inserire in acqua un composto (incapace di formare legami con le molecole di acqua), dobbiamo rompere questi legami e quindi consumare energia. Se il composto con l'acqua formasse legami (ionici, ione-di polo, H, dipolari etc) l'energia che ricaveremmo dalla formazione di questi nuovi legami compenserebbe quella spesa per rompere i legami tra le molecole dell'acqua, quindi il processo sarebbe energeticamente favorito e il composto si scioglierebbe in acqua. Immaginiamo ora di mettere in acqua 2 molecole di benzene (un composto organico di forma esagonale e planare, privo di gruppi chimici capaci di formare legami di qualsiasi tipo con le molecole di acqua). Ognuna di queste 2 molecole (schematizzate con un ovale nella figura A), insinuandosi come indicato in figura, tra le molecole di acqua, rompe legami acqua-acqua. Immaginiamo che ognuna ne rompa 6. Abbiamo avuto la rottura di 12 legami senza che se ne formino altri, quindi il processo è energeticamente sfavorevole. Ma se le 2 molecole,invece di esser separate si mettono adiacenti, l'una attaccata ali'altra, senza molecole di acqua tra di esse (parte B della fig.) il n dei legami acqua-acqua rotti è 6 e non 12.
47 RISULTATO Per evitare di rompere molti legami acqua-acqua,le 2 molecole rimangono attaccate tra loro come se fossero legate, come se vi fosse un legame chimico, che non c'è Le molecole rimangono attaccate non perché formano un legame chimico, ma perché non riescono a formare legami con le molecole del solvente, che le respingono. Si chiama legame idrofobico quella forza che tiene unite molecole che non riescono a formare legami con le molecole di acqua.
48 Quando mettiamo in acqua goccioline di olio (fatto da composti chimici che non riescono a formare legami con le molecole di acqua), queste goccioline non si sciolgono in acqua e non restano separate tra loro, ma si riuniscono per formare goccie più grandi, che, avendo una densità minore di quelle dell'acqua, salgono alla superficie e formano uno strato formato da solo olio. Il legame idrofobico ha una enorme importanza in biologia - stabilizza la struttura delle proteine e degli acidi nucleici - mantiene la struttura delle membrane biologiche
49 LEGAME METALLICO Un metallo può essere descritto come un reticolo di ioni positivi (nucleo più elettroni di core) circondati dagli elettroni più esterni delocalizzati attorno a tutti i cationi. Gli elettroni sono liberi di muoversi attraverso l'intero reticolo: - Conduzione elettrica -Conduzione di calore - -A livello un po' più approfondito, si può pensare a un sistema di orbitali di legame e di antilegame delocalizzati sull'intero cristallo del metallo. Queste due serie di orbitali costituiscono delle bande; quella superiore, di antilegame, è ad energia di poco più alta, perciò è possibile che vengano facilmente utilizzati orbitali di antilegame per la conduzione, cioè per lo spostamento di elettroni in quanto la spesa di energia è molto bassa
50
51 E il punto di partenza per quasi tutti i processi biologici. Le molecole interagiscono in una maniera altamente specifica: modello CHIAVE-SERRATURA (Fisher e Ehrilch)
52 La complementarità geometrica e chimica fra piccole molecole biologiche (LIGANDI) e le strutture dei loro bersagli macromolecolari (RECETTORI) gioca un ruolo molto importante all interno dei processi biologici.
53 La capacità di un recettore di agganciarsi al suo ligando selettivamente e con alta affinità è dovuta alla formazione di una serie di legami deboli (legami H, ionici, interazioni di Van der Waals) sommati ad interazioni favorevoli (es. idrofobiche). Gli atomi del sito di legame forniscono l impalcatura necessaria per conferire alla superficie un dato contorno e particolari proprietà chimiche Variazioni anche piccole di tali amminoacidi spesso compromettono la funzionalità del recettore
54 Ligando e recettore N(CH 3 ) 2 N(CH 3 ) 2 Legame dipolo-dipolo O Legame idrofobico O O Interazione ione-dipolo HO HO O 2 N Complesso con trasferimento di carica Cl N H Legame idrogeno NH 2 N + COO- Legame ionico Esempi di alcune comuni forme di legame trovate nelle interazioni farmaco-recettore
55 Ligando e recettore Legame covalente: è di gran lunga il più forte dei legami ligando-recettore. Forma un legame irreversibile. Raramente viene cercato nell azione di un farmaco (eccezione: chemioterapici nel trattamento del cancro) Legame ionico o elettrostatico: è molto importante nelle interazioni ligando-recettore in quanto molti gruppi funzionali dei recettori sono ionizzati a ph fisiologico. Si formano interazioni reversibili. Interazioni elettrostatiche: in forma di forze attrattive ione-dipolo, interazioni dipolo-dipolo e legame H. Formano legami più deboli del legame ionico. Sono le interazioni ligando-recettore più diffuse.
56 Ligando e recettore Complessi a trasferimento di carica: si formano quando un gruppo elettron donatore è adiacente a un gruppo elettron accettore. Il parziale trasferimento di carica crea un debole legame elettrostatico. I donatori sono specie ricche di e - p e gruppi chimici con doppietti elettronici. Legame idrofobico: legame molto debole che si forma quando parti non-polari delle molecole interagiscono in un ambiente privo di acqua. Si crea un abbassamento dell energia del sistema e, quindi, una struttura più stabile. Forze dispersive di London: deboli interazioni dipolo-dipolo dovute alla formazione di dipoli transienti in una struttura. I dipoli transienti sono tempo-dipendenti e si formano a causa della variazione nel tempo della distribuzione elettronica nelle molecole.
57 Ligando e recettore Farmaco Farmaco-Recettore Il legame è dipendente dalla concentrazione [C] del farmaco: man mano che [C] aumenta nei fluidi extracellulari, l equilibrio si sposta a destra e il farmaco si lega al recettore. Quando [C] diminuisce, a causa del metabolismo e dell escrezione, l equilibrio si sposta verso sinistra e il complesso si dissocia. A basse concentrazioni un basso numero di recettori è impegnato dal ligando. I farmaci con lunga durata d azione sono quelli che formano legami stabili con il recettore.
58 Lewin, IL GENE VIII, Zanichelli editore S.p.A. Copyright 2006
59 Figura riportata nella pubblicazione originale di Watson e Crick Nature, Aprile 1953
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
Atomi e molecole. Gli atomi degli elementi si trovano in natura generalmente combinati tra loro in molecole o composti ionici
 IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
LEGAME CHIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici.
 LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Introduzione alla chimica organica. 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole
 Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
PROPRIETA DEI MATERIALI
 PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Forze intermolecolari
 Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Interazioni deboli. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Interazioni deboli 1 Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012 Legami deboli o interazioni deboli La forza di un legame chimico viene stabilita in base alla energia del
Interazioni deboli 1 Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012 Legami deboli o interazioni deboli La forza di un legame chimico viene stabilita in base alla energia del
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
Trasformazioni chimiche:
 Il legame chimico 1 Trasformazioni chimiche Trasformazioni chimiche: Le sostanze si trasformano in altre sostanze aventi proprietà differenti (livello macroscopico). Le trasformazioni chimiche avvengono
Il legame chimico 1 Trasformazioni chimiche Trasformazioni chimiche: Le sostanze si trasformano in altre sostanze aventi proprietà differenti (livello macroscopico). Le trasformazioni chimiche avvengono
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Idrogeno (H) Azoto (N) La materia è costituita da elementi chimici. In natura sono presenti 92 elementi
 Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Le sostanze chimiche prof. Matteo Scapellato
 1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
= Atomo di idrogeno (H) molecola dell idrogeno (H 2 )
 IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
Legame chimico e proprietà delle sostanze
 I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LEGAME COVALENTE. ( Elettronegatività tra gli atomi < 2)
 LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
Anche tra le molecole si instaurano forze di attrazione, meno intense dei legami chimici, che vengono chiamate legami secondari o legami deboli.
 I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
Il potenziale di membrana a riposo
 Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Legame covalente. H 1s un protone e un elettrone
 Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA
 FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Configurazioni elettroniche e periodicità
 Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
ESEMPI DI QUIZ sulle precedenti lezioni
 ESEMPI DI QUIZ sulle precedenti lezioni I numeri quantici sono: A.2 B.5 C.6 D.4 Il numero di neutroni è pari a: A.Il numero di protoni B.Il numero di elettroni C.Il numero di nuclei D.La differenza fra
ESEMPI DI QUIZ sulle precedenti lezioni I numeri quantici sono: A.2 B.5 C.6 D.4 Il numero di neutroni è pari a: A.Il numero di protoni B.Il numero di elettroni C.Il numero di nuclei D.La differenza fra
Corso di Chimica Generale CL Biotecnologie
 Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Lezione 3 - Legame chimico
 Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
I LEGAMI CHIMICI. A cura della prof. C. Viscardi
 I LEGAMI CIMICI A cura della prof. C. Viscardi 1 ATOMI E MOLECOLE È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti
I LEGAMI CIMICI A cura della prof. C. Viscardi 1 ATOMI E MOLECOLE È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
LE MOLECOLE. 5.1 I legami molecolari 5.2 Le forze di Van der Walls 5.3 Il legame idrogeno 5.4 La teoria VSEPR
 LE MOLECOLE 5.1 I legami molecolari 5.2 Le forze di Van der Walls 5.3 Il legame idrogeno 5.4 La teoria VSEPR 5.1 I legami molecolari Si ha un legame chimico quando una forza di natura elettrostatica tiene
LE MOLECOLE 5.1 I legami molecolari 5.2 Le forze di Van der Walls 5.3 Il legame idrogeno 5.4 La teoria VSEPR 5.1 I legami molecolari Si ha un legame chimico quando una forza di natura elettrostatica tiene
Tavola Periodica degli Elementi
 Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Chimica e chimica della vita. Chimica della vita. Atomi. Materia ed elementi. Tavola periodica degli elementi. Elementi ed atomi
 Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
ATOMO POLIELETTRONICO. Numero quantico di spin m s
 ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
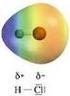 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Forze interioniche ed intermolecolari
 Forze interioniche ed intermolecolari Forze interioniche ed intermolecolari Le interazioni ione-dipolo sono forti nel caso di ioni piccoli e di carica elevata. Una conseguenza è che i cationi piccoli e
Forze interioniche ed intermolecolari Forze interioniche ed intermolecolari Le interazioni ione-dipolo sono forti nel caso di ioni piccoli e di carica elevata. Una conseguenza è che i cationi piccoli e
Energia di ionizzazione
 Energia di ionizzazione Si definisce energia di ionizzazione il lavoro necessario per allontanare un elettrone da un atomo. L atomo a cui è stato tolto un elettrone diviene uno ione positivo. L energia
Energia di ionizzazione Si definisce energia di ionizzazione il lavoro necessario per allontanare un elettrone da un atomo. L atomo a cui è stato tolto un elettrone diviene uno ione positivo. L energia
Tavola Periodica degli Elementi: Gruppi e Periodi
 La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi
 LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione7 1 Il legame e la struttura La struttura
LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione7 1 Il legame e la struttura La struttura
PROVA 1. Dati i composti con formula KBr e HClO 2 :
 PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
Configurazione elettronica e Tavola periodica. Lezioni 13-16
 Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
(2) cubico a facce centrate (3) esagonale compatto
 IL LEGAME METALLICO La maggior parte dei metalli cristallizza in strutture a massimo impacchettamento, ovvero in solidi in cui si può considerare che gli ioni metallici che occupano le posizioni reticolari,
IL LEGAME METALLICO La maggior parte dei metalli cristallizza in strutture a massimo impacchettamento, ovvero in solidi in cui si può considerare che gli ioni metallici che occupano le posizioni reticolari,
Cos è la chimica organica
 Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Si possono distinguere tre tipi di legame con caratteristiche notevolmente diverse:
 LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
Legame chimico unità 1, modulo D del libro
 Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica. Mod. 1 CHIMICA. Mod. 2 CHIMICA FISICA.
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
 LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Istituto d Istruzione Secondaria Superiore M.BARTOLO PACHINO (SR) A cura del Prof S. Giannitto
 Istituto d Istruzione Secondaria Superiore M.BARTOLO PACHINO (SR) APPUNTI DI TDP- TEORIA 3 ANNO A cura del Prof S. Giannitto La molecola è la più piccola parte che si può ottenere da un corpo conservandone
Istituto d Istruzione Secondaria Superiore M.BARTOLO PACHINO (SR) APPUNTI DI TDP- TEORIA 3 ANNO A cura del Prof S. Giannitto La molecola è la più piccola parte che si può ottenere da un corpo conservandone
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI
 ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
ORBITA ORBIT LI ALI MOLECOLARI
 ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
Legame metallico. Metalli
 LEGAME METALLICO Un metallo può essere descritto come un reticolo di ioni positivi (nucleo più elettroni di core) immersi in una nube di elettroni di valenza mobili (delocalizzati) attorno ai cationi.
LEGAME METALLICO Un metallo può essere descritto come un reticolo di ioni positivi (nucleo più elettroni di core) immersi in una nube di elettroni di valenza mobili (delocalizzati) attorno ai cationi.
CENNI SUL TIPO DI FORZE
 CENNI SUL TIPO DI FORZE Forze deboli che influenzano la struttura delle proteine: le interazioni di van der Waals repulsione attrazione Forze attrattive dovute a interazioni istantanee che si generano
CENNI SUL TIPO DI FORZE Forze deboli che influenzano la struttura delle proteine: le interazioni di van der Waals repulsione attrazione Forze attrattive dovute a interazioni istantanee che si generano
