Farmaco in studio GA 101. Studio ID: FIL_GA101_DHAP. Versione 1, 22 novembre EudraCT:
|
|
|
- Giovanni Patti
- 7 anni fa
- Visualizzazioni
Transcript
1 Studio di Fase II con Ga101-DHAP in pazienti affetti da linfoma diffuso a grandi cellule B (DLBCL) ricaduti/refrattari, come terapia di induzione prima della chemioterapia ad alte dosi BEAM seguita da trapianto autologo di cellule staminali (ASCT). (Studio GIOTTO) Farmaco in studio GA 101 Studio ID: FIL_GA101_DHAP Versione 1, 22 novembre 2013 EudraCT: SPONSOR Fondazione Italiana Linfomi Onlus (FIL) Segreteria: c/o SC Ematologia Azienda Ospedaliera SS. Antonio e Biagio e Cesare Arrigo Indirizzo: via Venezia 16, Alessandria, Italy Tel. no.: Fax no.: segreteria@filinf.it P.I. Maurizio Martelli, MD Indirizzo: Hematology Department Università degli Studi La Sapienza, Roma Tel. no.: Fax no.: martelli@bce.uniroma1.it Sinossi FIL_GA101_DHAP v Novembre 2013 pag. 1
2 Co-Investigatori Luigi Rigacci, MD Indirizzo: SOD Ematologia 2, Azienda Ospedaliero Universitaria Careggi Firenze Tel. no.: Fax no.: Massimo Federico, MD Indirizzo: Oncologia Medica ed Ematologia, Centro Oncologico, Modena Tel. no.: Fax no.: Umberto Vitolo, MD Indirizzo: SC Ematologia 2, A.O. Città della Salute e della Scienza di Torino San Giovanni Battista, Torino Tel. no.: Fax no.: uvitolo@cittadellasalute.to.it Comitato di stesura 1. Luigi Rigacci, MD, SOD Ematologia, Azienda Ospedaliero Universitaria Careggi, Firenze 2. Maurizio Martelli, MD, UO Ematologia, Università La Sapienza, Roma 3. Umberto Vitolo, MD, SC Ematologia 2, Azienda Ospedaliero Universitaria San Giovanni Battista Torino 4. Massimo Federico, MD, Oncologia e Ematologia, Centro Oncologico Modenese, Modena 5. Massimo Di Nicola, MD, SC Medicina Oncologica 2, Istituto Nazionale dei Tumori. Milano 6. Benedetta Puccini, MD, SOD Ematologia, Azienda Ospedaliero Universitaria Careggi, Firenze Sinossi FIL_GA101_DHAP v Novembre 2013 pag. 2
3 DISEGNO STATISTICO Responsabile: Giovannino Ciccone, MD Indirizzo: SCDU Epidemiologia dei Tumori Università degli Studi di Torino e Azienda Ospedaliero Universitaria San Giovanni Battista Torino Tel no.: Fax no.: FARMACOVIGILANZA Responsabile: Alessandro Levis, MD Indirizzo: Segreteria Fondazione Italiana Linfomi ONLUS c/o Ematologia Azienda Ospedaliera SS. Antonio e Biagio e Cesare Arrigo via Venezia 16, Alessandria Tel. no.: (6156) Fax no.: ISTOPATOLOGIA Responsabile: Stefano Pileri, MD Indirizzo: Istituto di Ematologia e Oncologia Medica L. e A. Seragnoli Bologna, e mail:stefano.pileri@aosp.bo.it BACKGROUND E RAZIONALE Il linfoma a grandi cellule B è il sottotipo di linfoma più frequente. L aggiunta dell anticorpo monoclonale anti- CD20 (rituximab) alla chemioterapia di prima linea, CHOP, ha significativamente migliorato la prognosi di questi linfomi. Nonostante ciò una parte di questi linfomi recidiva e necessita di ulteriori trattamenti. Nei pazienti giovani la terapia di salvataggio è rappresentata da una chemioterapia di seconda linea che utilizzi farmaci non cross resistenti con quelli di prima linea e la successiva terapia ad alte dosi con supporto di cellule staminali periferiche. L aggiunta del rituximab alla terapia di salvataggio permette di ottenere risultati migliori soprattutto in quel gruppo di pazienti non precedentemente trattati con il rituximab stesso. Poichè al momento attuale nessuno dei pazienti in recidivati o refrettari alla terapia di prima linea non ha fatto rituximab, l utilizzo di un nuovo anticorpo dovrebbe poter migliorare i risultati della terapia di salvataggio. DISEGNO DELLO STUDIO E ANALISI STATISTICA Si tratta di uno studio prospettico, multicentrico, di fase II non randomizzato in pazienti giovani (18-65 anni) affetti da linfoma a grandi cellule B (DLBCL) recidivato o refrattario alla diagnosi, eleggibili per una terapia ad alte dosi. Scopo dello studio è quello di determinare l efficacia e la sicurezza del nuovo anticorpo anti-cd20 Sinossi FIL_GA101_DHAP v. 122 Novembre 2013 pag. 3
4 (GA 101) in associazione con la chemioterapia DHAP in pazienti con DLBCL, recidivato o refrattario, come terapia di induzione prima della terapia ad alte dosi con BEAM e ASCT. Obiettivo primario: L'obiettivo primario è valutare se il trattamento raggiunge un incremento assoluto delle RC nella proporzione di almeno il 20% (da 30 a 50%) rispetto al trattamento standard. Obiettivi secondari: Risposta globale (ORR) prima del consolidamento con BEAM e ASCT Sopravvivenza libera da progressione: PFS Sopravvivenza globale: OS Fattibilità e tossicità Mobilizzazione cellule emopoietiche Tasso di pazienti da avviare al ASCT Analisi statistica Lo scopo principale dello studio è quello di testare se l efficacia dello schema sperimentale sia superiore alla terapia standard in termini di remissione completa. Sulla base del test di Briant e Day, con un errore alfa=0.05, un errore beta=0.15, una percentuale di risposta inaccettabile del 30% e con un errore alfa=0.10 una tossicità inaccettabile del 40%, le dimensioni del campione nella prima fase saranno di 29 pazienti. Alla fine della prima fase lo studio sarà sospeso se il numero di pazienti in RC sarà <10/29 o il numero di pazienti che presenteranno tossicità sarà superiore a 19/29. Con più di 10 RC e con meno di 19 pazienti che presenteranno tossicità lo studio proseguirà nel reclutamento nella seconda fase fino a un campione di 78 pazienti. Alla fine dello studio la terapia sperimentale non sarà considerate efficace se il numero totale di RC sarà inferiore a 31 o il numero totale di pazienti che presenteranno tossicità superiore a 52. La durata dello studio sarà di 36 mesi. Il reclutamento dei 78 pazienti dovrebbe avvenire in 24 mesi con successivi 12 mesi di follow-up dall ultimo paziente arruolato nel protocollo. Saranno coinvolti dai 20 ai 30 centri della Fondazione Italiana Linfomi Onlus. L analisi di efficacia sarà effettuata su tutti i pazienti arruolati (Intention to treat); l analisi di sicurezza si baserà su tutti i pazienti che abbiano ricevuto almeno una dose della terapia sperimentale. CRITERI DI INCLUSIONE Età < Linfoma diffuso a grandi cellule B refrettario o recidivato dopo un qualsiasi trattamento di prima linea. 3. Linfoma diffuso a grandi cellule alla ricaduta. Il paziente deve aver ripetuto la biopsia prima di entrare nello studio. Questa è particolarmente raccomandata se la recidiva risale a più di un anno prima della remissione completa. Se questa costituisce un danno per il paziente, è possibile arruolare se il campione del tumore o il blocchetto della prima diagnosi sono disponibili. 4. Malattia misurabile e/o valutabile. Sinossi FIL_GA101_DHAP v Novembre 2013 pag. 4
5 5. Qualsiasi stadio di Ann Arbor o gruppo IPI alla recidiva 6. ECOG Performance status < 2 a meno che non sia dovuto al linfoma 7. Assenza di interessamento del sistema nervoso centrale (SNC) (coinvolgimento del linfoma cerebrale/meningeo) 8. Valori ematologici adeguati: neutrofili > 1.5 x 10 9 /L, emoglobina > 10.5 g/dl (indipendente dalla trasfusione), conta piastrinica > 75 x 10 9 /L (indipendente dalla trasfusione), con eccezione della pancitopenia dovuta a conivolgimento midollare da parte del linfoma 9. Normale funzionalità epatica (ALP, AST, ALT, GGT, bilirubina totale < 2 x ULN) se non dovuta al linfoma. 10. Normale funzionalità renale (clearance della creatinina > 45 ml/min) 11. Frazione di eiezione > 50% (MUGA scan o ecocardiografia) 12. Normale funzionalità polmonare 13. Assenza di infezioni opportunistiche 14. Assenza di neuropatia periferica o malattia neurologica attiva non neoplastica del SNC 15. Nessun intervento chirurgico entro tre mesi dalla randomizzazione a meno che non sia dovuta al linfoma e/o ad altre patologie per pericolo di vita che possano compromettere il trattamento chemioterapico 16. Assenza di malattie neoplastiche nei precedenti tre anni ad eccezione del linfoma o carcinoma squamocellulare della cute o carcinoma in sito di cervice o mammella 17. Aspettativa di vita > 6 mesi 18. Assenza di malattie psichiatriche che precludano la possibilità di comprendere lo studio o firmare il consenso informato 19. Consenso informato scritto 20. Le donne devono essere: - in menopausa da almeno 1 anno (assenza di una mestruazione naturale per almeno 12 mesi) - Chirurgicamente sterili (hanno avuto una isterectomia o ovariectomia bilaterale, legatura delle tube, o altrimenti impossibilitate ad una gravidanza), - Astinenti (a discrezione dello sperimentatore / per le normative locali), o - Se sessualmente attive, praticanti un metodo altamente efficace di controllo delle nascite come ad esempio, contraccettivi orali, iniezioni contraccettive, cerotto contraccettivo, dispositivo intrauterino, metodo a doppia barriera (ad esempio, preservativi, diaframma o cappuccio cervicale, con schiuma, crema, o gel spermicida, sterilizzazione del partner maschile), come ammesso dalle normative locali, prima dell arruolamento, e devono accettare di continuare a utilizzare lo stesso metodo di contraccezione durante lo studio. Essi devono anche essere pronte a continuare le misure di contraccezione per almeno 12 Sinossi FIL_GA101_DHAP v Novembre 2013 pag. 5
6 mesi dopo la cessazione del trattamento. 21. Le donne potenzialmente fertili devono avere un siero negativo o lo screening test di gravidanza della gonadotropina corionica umana (beta-hcg) negativa nelle urine. 22. Gli uomini devono acconsentire all utilizzo di un metodo contraccettivo adeguato (per sé o partner femminili come elencato sopra) per tutta la durata dello studio. Gli uomini devono accettare di utilizzare un doppio metodo di barriera di controllo delle nascite e non donare sperma durante lo studio e per 3 mesi dopo l'ultima dose del farmaco in studio. CRITERI DI ESCLUSIONE 1. Diagnosi di linfoma linfoblastico, Linfoma di Burkitt, Linfoma non-hodgkin CD20 negativo, Linfoma mantellare, Linfoma follicolare, Linfoma primitivo del mediastino 2. Età > 65 anni 3. Paziente non elegibile per terapie ad alte dosi 4. ECOG Performance status > 2 se non dovuto al linfoma 5. Pazienti che hanno precedentemente ricevuto un trattamento con GA101 (obinutuzumab) 6. Sospetta o nota ipersensibilità o intolleranza al Rituximab 7. Avere ricevuto un farmaco sperimentale entro 4 settimane dall inizio della terapia programmata. La concomitante partecipazione in studi non interventistici è permessa, se questo non comprometterà la partecipazione a questo studio. 8. Malattia al SNC (coinvolgimento del linfoma cerebrale/meningeo). 9. Storia di patologie clinicamente rilevanti a livello epatico o renale; cardiaco, vascolare, polmonare, gastrointestinale, endocrino, neurologico, reumatologico, ematologico, psichiatrico o metabolico. 10. test positivo per l'infezione da epatite B cronica (HBsAg sierologica positiva). I pazienti con infezione da epatite B occulta o precedentemente infettati (positivi agli anticorpi totali dell'epatite B e HBsAg negativi) possono essere compresi se il DNA dell'hbv non è rilevabile. Questi pazienti devono essere disposti a sottoporsi al test del DNA mensilmente 11. Risultati positivi al test per la diagnosi di EpatiteC (test sierologico degli anticorpi HCV). I pazienti positivi per gli anticorpi HCV sono eleggibili solo se la PCR RNA HCV è negativa. 12. Storia di sieropositività per l infezione da HIV. Per i pazienti con HIV positivi, il test verrà eseguito al momento dello screening, se richiesto dalle normative locali. 13. Diabete scompensato (se trattati con agenti antidiabetici, i soggetti devono essere su una dose stabile per almeno 3 mesi prima della prima dose del farmaco in studio). 14. Cardiopatia severa e scompensata: includendo infarto del miocardio entro sei mesi dall arruolamento, angina instabile, classe NYHA III o IV, malattia pericardica clinicamente significativa, amiloidosi cardiaca 15. Frazione di eiezione < 45% (MUGA scan o ecocardiografia) Sinossi FIL_GA101_DHAP v Novembre 2013 pag. 6
7 16. Clearance della creatinina < 45 ml/min 17. Presenza di disturbi neurologici maggiori 18. Infezioni opportunistiche attive 19. Interventi chirurgici maggiori entro tre mesi dalla randomizzazione non dovuti al linfoma e/o ad altre patologie per pericolo di vita che possano compromettere il trattamento chemioterapico 20. Precedenti malattie neoplastiche diverse dal linfoma nei precedenti tre anni ad eccezione del carcinoma squamocellulare della cute o carcinoma in sito di cervice o mammella 21. Aspettativa di vita < 6 mesi 22. Ogni altra condizione medica o psicologica che comprometta la possibilità di partecipare allo studio o comprometta la capacità di firmare il consenso informato. 23. Se donna, la gravidanza o l allattamento al seno. SCHEMA DI TRATTAMENTO I pazienti ricevono: GA101-DHAP x 2, ristadiazione, mobilizzazione e raccolta di cellule staminali periferiche, + GA101- DHAP x 2, ristadiazione con PET e TC e consolidamento con BEAM e ASCT nei pazienti in risposta (RC + RP) Schema GA101-DHAP Versione paziente ricoverato - GA mg iv giorno 1, 8, 15 (dal secondo ciclo GA mg iv solo giorno 1) - Cisplatino 100 mg/sqm iv giorno 2 in infusione di 24-ore - Cytarabina 2000 mg/sqm in infusion di 3-ore ogni 12 ore iv giorno 3 - Desametazone 40 mg giorni Peg-G-CSF al terzo giorno di terapia o G-CSF dal giorno 5 fino a recupero dei neutrofili o fino ad avvenuta raccolta di cellule staminali durante il ciclo mobilizzante (II o III ciclo GA101-DHAP) - GA mg/sqm iv 24 ore prima dell aferesi di staminali come purging in vivo Versione paziente esterno - GA mg iv giorni 1, 8, 15 (dal secondo ciclo GA mg iv solo giorno 1) - Cisplatino 100 mg/sqm iv giorno 2 in infusion di 3-ore - Cytarabina 2000 mg/sqm in infusion di 3-ore nei giorni 3 e 4 - Desametazone 40 mg day 2-4 Sinossi FIL_GA101_DHAP v Novembre 2013 pag. 7
8 - Peg-G-CSF al giorno 4 della terapia oppure G-CSF dal giorno 5 fino a recupero dei neutrofili o fino alla raccolta delle cellule staminali durante il ciclo di mobilizzazione - GA mg/sqm iv 24 ore prima dell aferesi come purging in vivo La chemioterapia GA101-DHAP sarà ripetuta ogni 28 giorni. Mobilizzazione ed aferesi La mobilizzazione avverrà dopo il II o III ciclo di GA101-DHAP, la quota di cellule raccolte dovrà essere almeno di 2.5x10 6 cellule CD34+/kg (or 4x10 6 cells CD34+/kg). Se, in caso di recidiva o di progressione della malattia, la biopsia del midollo osseo è positiva, dopo il secondo ciclo di GA101-DHAP deve essere effettuata una nuova biopsia al fine di definire la negativizzazione del midollo osseo e di programmare l aferesi dopo il terzo ciclo di terapia. Schema di condizionamento pre-asct: BEAM o FEAM + ASCT - BCNU 300 mg/sqm iv giorno -7 - Cytarabina 200 mg/sqm ogni 12 ore iv giorni -6, -5, -4, -3 (8 dosi totali) - VP mg/sqm ogni 12 ore iv giorni -6, -5, -4, -3 (8 dosi totali) - Melphalan 140 mg/sqm iv giorno -2 - Reinfusione di PBSC (CD34+ >= 2.5 x10 6 /Kg) giorno 0 - Pefilgrastim 6 mg sc giorno +1 Sinossi FIL_GA101_DHAP v Novembre 2013 pag. 8
9 VALUTAZIONE CLINICA, ESAMI DI LABORATORIO E FOLLOW-UP Stadio Basale Trattamento con GA101 DHAP Trapianto ASCT Follow-Up Periodo gg 1 Ciclo 1 gg 8 gg 15 Ciclo 2 Valutazione della risposta intermedia Ciclo 3 Ciclo 4 Pre- Post- Ogni 3 mesi per il 1 e il 2 anno alla fine del trattamento Ogni 4-6 mesi per il 3 anno alla fine del trattamento Consenso informato Analisi dei criteri di inclusione ed esclusione Test di gravidanza (se applicabile) Sierologia virologica Ecg/Echo/MUGA Attività anti-tumorale C Esame clinico Aspirato midollare e biopsia osteomidollare A A A Analisi GC/ABC PET B CT (collo, torace, addome e inguine) C Eventi avversi Ematologia Biochimica Esame fisico, storia medica completa, ECOG performance status, segni vitali Biopsia del linfonodo o del tessuto patologico (revisione patologica centralizzata) Puntura lombare RMN cervello/colonna vertebrale, endoscopia, visita ORL, ecc secondo il giudizio del medico curante e solo se Sinossi FIL_GA101_DHAP v Novembre 2013 pag. 9
10 clinicamente rilevante A : se positivo al basale B : consigliata e non mandatoria C : ogni 6 mesi durante i primi due anni dopo la fine della chemioterapia (al mese ) Sinossi FIL_GA101_DHAP v Novembre 2013 pag. 10
Protocollo clinico. Codice dello studio: FIL R2-B Fase II Numero EudraCT: VERSIONE N MARZO 2012
 Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
STUDY ID: FIL_RENOIR12 EUDRACT NUMBER
 Studio randomizzato multicentrico di fase III con combinazione di Rituximab e Lenalidomide vs solo Rituximab come terapia di mantenimento dopo chemioimmunoterapia con Rituximab e Bendamustina per pazienti
Studio randomizzato multicentrico di fase III con combinazione di Rituximab e Lenalidomide vs solo Rituximab come terapia di mantenimento dopo chemioimmunoterapia con Rituximab e Bendamustina per pazienti
Studio di fase II con Ribomustin in combinazione con Bortezomib e Rituximab (WM-BBR)
 Studio di fase II con Ribomustin in combinazione con Bortezomib e Rituximab (WM-BBR) in pazienti affetti da linfoma non Hodgkin linfoplasmocitico/morbo di Waldenstrom in seconda linea. Lorella Orsucci
Studio di fase II con Ribomustin in combinazione con Bortezomib e Rituximab (WM-BBR) in pazienti affetti da linfoma non Hodgkin linfoplasmocitico/morbo di Waldenstrom in seconda linea. Lorella Orsucci
Fondazione Italia Fondazione It alia Linf omi Linf ONLUS
 Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
SINOSSI. EudraCT number Versione del protocollo Version Octobre 2013
 SINOSSI Codice Studio Titolo IELSG38 EudraCT number 2012 004896 38 Versione del protocollo Version 1.3 18 Octobre 2013 Farmaci in studio Sponsor Fase Disegno Coordinatori Studio di fase II di combinazione
SINOSSI Codice Studio Titolo IELSG38 EudraCT number 2012 004896 38 Versione del protocollo Version 1.3 18 Octobre 2013 Farmaci in studio Sponsor Fase Disegno Coordinatori Studio di fase II di combinazione
SINOSSI. BR-DHAP + BEAM + ASCT versus R-DHAP + BEAM + ASCT. Farmaco in studio Bortezomib. ID Protocollo : FIL_VERAL12. V.
 SINOSSI Studio di fase II randomizzato con R-DHAP +/- bortezomib nei Linfomi Diffusi a Grandi Cellule B (DLBCL) recidivate/refrattari come terapia di induzione pre-consolidamento ad alte dosi con BEAM
SINOSSI Studio di fase II randomizzato con R-DHAP +/- bortezomib nei Linfomi Diffusi a Grandi Cellule B (DLBCL) recidivate/refrattari come terapia di induzione pre-consolidamento ad alte dosi con BEAM
PROGETTO PROGNOSTICO SUI LINFOMI INDOLENTI NON-FOLLICOLARI
 PROGETTO PROGNOSTICO SUI LINFOMI INDOLENTI NON-FOLLICOLARI SINOSSI NF2010 Sponsor: Coordinatori dello studio: Writing committee: Biostatico: Data Management: Fondazione Italiana Linfomi Luca Arcaini (Pavia)
PROGETTO PROGNOSTICO SUI LINFOMI INDOLENTI NON-FOLLICOLARI SINOSSI NF2010 Sponsor: Coordinatori dello studio: Writing committee: Biostatico: Data Management: Fondazione Italiana Linfomi Luca Arcaini (Pavia)
Sinopsi TITOLO VERSIONE PROTOCOLLO INDICAZIONI
 Sinopsi TITOLO VERSIONE PROTOCOLLO INDICAZIONI DISEGNO DELLO OBIETTIVI DIMENSIONI DEL CAMPIONE NUMERO DI CENTRI Studio multicentrico randomizzato di fase III che compara le alte dosi di chemioterapia con
Sinopsi TITOLO VERSIONE PROTOCOLLO INDICAZIONI DISEGNO DELLO OBIETTIVI DIMENSIONI DEL CAMPIONE NUMERO DI CENTRI Studio multicentrico randomizzato di fase III che compara le alte dosi di chemioterapia con
EMR Merck KGaA, Darmstadt, Germania. Fase clinica IIIb
 1/7 Sinossi Titolo della Numero della NEXT NSCLC ErbituX Trial Sperimentazione in aperto, randomizzata, multinazionale, di fase IIIb, di valutazione dell attività e della sicurezza di cetuximab come terapia
1/7 Sinossi Titolo della Numero della NEXT NSCLC ErbituX Trial Sperimentazione in aperto, randomizzata, multinazionale, di fase IIIb, di valutazione dell attività e della sicurezza di cetuximab come terapia
STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI
 STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI ( 65 E
STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI ( 65 E
SINOSSI. Istituto Clinico Humanitas - Humanitas Cancer Center Dr.ssa Monica Balzarotti. Versione 2.0 / 11 Novembre 2013
 SINOSSI Title Investigator Sponsor Coordinatore dello studio Numero identificativo Versione del protocollo Razionale Fase Popolazione in studio e selezione dei pazienti Ofatumumab-Bendamustina nei linfomi
SINOSSI Title Investigator Sponsor Coordinatore dello studio Numero identificativo Versione del protocollo Razionale Fase Popolazione in studio e selezione dei pazienti Ofatumumab-Bendamustina nei linfomi
SINOSSI Protocollo MO19390 SAIL
 SINOSSI Protocollo MO19390 SAIL TITOLO INDICAZIONE OBIETTIVI DISEGNO DELLO STUDIO Studio in aperto con bevacizumab (Avastin ) in combinazione con un regime chemioterapico contenente platino per il trattamento
SINOSSI Protocollo MO19390 SAIL TITOLO INDICAZIONE OBIETTIVI DISEGNO DELLO STUDIO Studio in aperto con bevacizumab (Avastin ) in combinazione con un regime chemioterapico contenente platino per il trattamento
Versione PROTOCOLLO DI STUDIO
 Versione 04.06.2012 PROTOCOLLO DI STUDIO Studio randomizzato di fase III di chemio-radioterapia nel carcinoma squamoso dell orofaringe in stadio localmente avanzato: IGRT-IMRT con moderato ipofrazionamento
Versione 04.06.2012 PROTOCOLLO DI STUDIO Studio randomizzato di fase III di chemio-radioterapia nel carcinoma squamoso dell orofaringe in stadio localmente avanzato: IGRT-IMRT con moderato ipofrazionamento
(CRICKET) - EUDRACT Gruppo Oncologico Nord-Ovest (G.O.N.O.)
 APPENDI II: SINOSSI (ITALIAN VERSION) STUDIO DI FASE II, A SINGOLO BRACCIO, DI TERAPIA DI III LINEA CON RECHALLENGE DI CETUIMAB ED IRINOTECANO IN PAZIENTI CON CARCINOMA COLORETTALE METASTATICO KRAS, NRAS
APPENDI II: SINOSSI (ITALIAN VERSION) STUDIO DI FASE II, A SINGOLO BRACCIO, DI TERAPIA DI III LINEA CON RECHALLENGE DI CETUIMAB ED IRINOTECANO IN PAZIENTI CON CARCINOMA COLORETTALE METASTATICO KRAS, NRAS
Fondazione Italiana Linfomi ONLUS. Fondazione Italiana Linfomi ONLUS
 Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
Sinossi Protocollo LEGA Versione No. 1 Finale, 11 Novembre 2011
 1. SINOSSI 1.1. Identificativi del Protocollo Prodotto: Indicazione: Codice Protocollo: EudraCT No.: 2011-005537-39 Titolo dello Studio: 1.2. Razionale dello Studio Combinazioni chemioterapiche: Epirubicina
1. SINOSSI 1.1. Identificativi del Protocollo Prodotto: Indicazione: Codice Protocollo: EudraCT No.: 2011-005537-39 Titolo dello Studio: 1.2. Razionale dello Studio Combinazioni chemioterapiche: Epirubicina
II GOIM Prof. Giuseppe Colucci Direttore Dipartimento Oncologia Medica Istituto Tumori G.PaoloII, Bari
 1 Sinossi TITOLO FASE CLINICA SPONSOR CENTRO COORDINATORE AREA TERAPEUTICA OBIETTIVI Strategia terapeutica ottimale nei pazienti con tumore del colon-retto metastatico K ras wild type: cetuximab in associazione
1 Sinossi TITOLO FASE CLINICA SPONSOR CENTRO COORDINATORE AREA TERAPEUTICA OBIETTIVI Strategia terapeutica ottimale nei pazienti con tumore del colon-retto metastatico K ras wild type: cetuximab in associazione
STUDIO RANDOMIZZATO DI FASE II CON CARBOPLATINO E PACLITAXEL +/- CETUXIMAB NEL CARCINOMA DELLA CERVICE AVANZATO E/O RECIDIVATO
 Multicentre Italian Trials in Ovarian Cancer MITO CERV-2 STUDIO RANDOMIZZATO DI FASE II CON CARBOPLATINO E PACLITAXEL +/- CETUXIMAB NEL CARCINOMA DELLA CERVICE AVANZATO E/O RECIDIVATO NONA RELAZIONE DI
Multicentre Italian Trials in Ovarian Cancer MITO CERV-2 STUDIO RANDOMIZZATO DI FASE II CON CARBOPLATINO E PACLITAXEL +/- CETUXIMAB NEL CARCINOMA DELLA CERVICE AVANZATO E/O RECIDIVATO NONA RELAZIONE DI
Linfomi di Hodgkin e Linfomi anaplastici sistemici ricaduti e refrattari
 Linfomi di Hodgkin e Linfomi anaplastici sistemici ricaduti e refrattari Meldola 24 Settembre 2016 Sabati Ematologici della Romagna Letizia Gandolfi Istututo di Ematologia e Oncologia L. & A. Seràgnoli
Linfomi di Hodgkin e Linfomi anaplastici sistemici ricaduti e refrattari Meldola 24 Settembre 2016 Sabati Ematologici della Romagna Letizia Gandolfi Istututo di Ematologia e Oncologia L. & A. Seràgnoli
Studio ID: FIL_FOLL12 VERSIONE E DATA: VERSIONE LUGLIO 2012 EUDRACT NUMBER:
 Studio multicentrico, randomizzato di fase III per valutare l efficacia di una strategia di mantenimento modulata sulla base della risposta al trattamento di induzione con chemioimmunoterapia standard
Studio multicentrico, randomizzato di fase III per valutare l efficacia di una strategia di mantenimento modulata sulla base della risposta al trattamento di induzione con chemioimmunoterapia standard
Il trattamento della ITP con Romiplostim:
 Nuovo farmaco brentuximab-vedotin: iniziale esperienza della Ematologia di Trento di trattamento del Linfoma di Hodgkin e del Linfoma anaplastico CD30 positivo. Il trattamento della ITP con Romiplostim:
Nuovo farmaco brentuximab-vedotin: iniziale esperienza della Ematologia di Trento di trattamento del Linfoma di Hodgkin e del Linfoma anaplastico CD30 positivo. Il trattamento della ITP con Romiplostim:
-Sinossi del Protocollo-
 -Sinossi del Protocollo- CHEMIO-IMMUNOTERAPIA INTENSIVA PER IL TRATTAMENTO IN PRIMA LINEA DI PAZIENTI ADULTI CON LINFOMA NON HODGKIN A CELLULE T PERIFERICHE (PTCL) Studio Clinico A Tipo di studio Scopo
-Sinossi del Protocollo- CHEMIO-IMMUNOTERAPIA INTENSIVA PER IL TRATTAMENTO IN PRIMA LINEA DI PAZIENTI ADULTI CON LINFOMA NON HODGKIN A CELLULE T PERIFERICHE (PTCL) Studio Clinico A Tipo di studio Scopo
Gruppo Italiano per lo Studio dei Linfomi
 Gruppo Italiano per lo Studio dei Linfomi PROTOCOLLO: R-COMP05 STUDIO DI FASE II PER IL TRATTAMENTO DI PAZIENTI CON LINFOMA MARGINALE SPLENICO CON LA COMBINAZIONE DI CICLOFOSFAMIDE, VINCRISTINA, DOXORUBICINA
Gruppo Italiano per lo Studio dei Linfomi PROTOCOLLO: R-COMP05 STUDIO DI FASE II PER IL TRATTAMENTO DI PAZIENTI CON LINFOMA MARGINALE SPLENICO CON LA COMBINAZIONE DI CICLOFOSFAMIDE, VINCRISTINA, DOXORUBICINA
MODELLO UNICO DI PRESCRIZIONE SERVIZIO SANITARIO REGIONE CAMPANIA A.S.L.
 REGIONE CAMPANIA - SANI.A.R.P. MODELLO UNICO DI PRESCRIZIONE SERVIZIO SANITARIO REGIONE CAMPANIA A.S.L. Codice a barra N.: CENTRO PRESCRITTORE (DEMINAZIONE):... CODICE STRUTTURA:... IL/LA SOTTOSTRITT0/A
REGIONE CAMPANIA - SANI.A.R.P. MODELLO UNICO DI PRESCRIZIONE SERVIZIO SANITARIO REGIONE CAMPANIA A.S.L. Codice a barra N.: CENTRO PRESCRITTORE (DEMINAZIONE):... CODICE STRUTTURA:... IL/LA SOTTOSTRITT0/A
MODELLO UNICO DI PRESCRIZIONE SERVIZIO SANITARIO REGIONE CAMPANIA A.S.L.
 Data di Stampa: REGIONE CAMPANIA - SANI.A.R.P. MODELLO UNICO DI PRESCRIZIONE SERVIZIO SANITARIO REGIONE CAMPANIA A.S.L. Codice a barra N.: CENTRO PRESCRITTORE (DEMINAZIONE):... CODICE STRUTTURA:... IL/LA
Data di Stampa: REGIONE CAMPANIA - SANI.A.R.P. MODELLO UNICO DI PRESCRIZIONE SERVIZIO SANITARIO REGIONE CAMPANIA A.S.L. Codice a barra N.: CENTRO PRESCRITTORE (DEMINAZIONE):... CODICE STRUTTURA:... IL/LA
Sinossi Protocollo Sperimentale GOIM 21002
 1 Sinossi Protocollo Sperimentale GOIM 21002 STUDIO MULTICENTRICO DI FASE II SULL UTILIZZO DI NANOPARTICLE ALBUMIN- BOUND PACLITAXEL (ABX) IN ASSOCIAZIONE A CAPECITABINA NEL TRATTAMENTO DI PRIMA LINEA
1 Sinossi Protocollo Sperimentale GOIM 21002 STUDIO MULTICENTRICO DI FASE II SULL UTILIZZO DI NANOPARTICLE ALBUMIN- BOUND PACLITAXEL (ABX) IN ASSOCIAZIONE A CAPECITABINA NEL TRATTAMENTO DI PRIMA LINEA
GICAT / I.I.L. Sinossi dello studio
 GICAT / I.I.L. PROTOCOLLO DI TERAPIA DI PRIMA LINEA IN PAZIENTI HIV+ CON LINFOMA NON-HODGKIN A GRANDI CELLULE AD ALTO RISCHIO, COMPRENDENTE UN CONSOLIDAMENTO PRECOCE CON CHEMIOTERAPIA AD ALTE DOSI E SUPPORTO
GICAT / I.I.L. PROTOCOLLO DI TERAPIA DI PRIMA LINEA IN PAZIENTI HIV+ CON LINFOMA NON-HODGKIN A GRANDI CELLULE AD ALTO RISCHIO, COMPRENDENTE UN CONSOLIDAMENTO PRECOCE CON CHEMIOTERAPIA AD ALTE DOSI E SUPPORTO
CRITERI DI IDONEITÀ E GESTIONE DELLA PERIFERICHE IN AMBITO FAMILIARE: ANALISI RETROSPETTIVA SU 500 CANDIDATI DONATORI.
 CRITERI DI IDONEITÀ E GESTIONE DELLA DONAZIONE DI CELLULE STAMINALI PERIFERICHE IN AMBITO FAMILIARE: ANALISI RETROSPETTIVA SU 500 CANDIDATI DONATORI. Paola Coluccia Fondazione IRCCS Istituto Nazionale
CRITERI DI IDONEITÀ E GESTIONE DELLA DONAZIONE DI CELLULE STAMINALI PERIFERICHE IN AMBITO FAMILIARE: ANALISI RETROSPETTIVA SU 500 CANDIDATI DONATORI. Paola Coluccia Fondazione IRCCS Istituto Nazionale
COMITATO ETICO Modulo informativo-consenso informato tipo riguardante i rischi della donna in gravidanza arruolata in una sperimentazione clinica
 COMITATO ETICO In data 05-05-2014 il Comitato Etico ha approvato la stesura definitiva del Modulo informativo-consenso informato tipo riguardante i rischi della donna in gravidanza arruolata in una sperimentazione
COMITATO ETICO In data 05-05-2014 il Comitato Etico ha approvato la stesura definitiva del Modulo informativo-consenso informato tipo riguardante i rischi della donna in gravidanza arruolata in una sperimentazione
SINOSSI TITOLO DELLO STUDIO VERSIONE DEL PROTOCOLLO SPONSOR FASE DELLO STUDIO POPOLAZIONE ARRUOLABILE
 Studio Clinico STUDIO INTERNAZIONALE DI FASE II CHE VALUTA LA TOLLERABILITÀ E L EFFICACIA DI UNA CHEMIOTERAPIA SEQUENZIALE CON METHOTREXATE-CITARABINA SEGUITA DALLO SCHEMA R-ICE, CUI SEGUE UNA CHEMIOTERAPIA
Studio Clinico STUDIO INTERNAZIONALE DI FASE II CHE VALUTA LA TOLLERABILITÀ E L EFFICACIA DI UNA CHEMIOTERAPIA SEQUENZIALE CON METHOTREXATE-CITARABINA SEGUITA DALLO SCHEMA R-ICE, CUI SEGUE UNA CHEMIOTERAPIA
Gruppo Oncologico Nord Ovest (G.O.N.O.) Italy. Studio di fase II randomizzato, open-label. Carcinoma Colorettale (CCR) Metastatico
 VERS. PROTOCOLLO 3.0 25 Novembre 2013 SPONSOR FASE STUO INCAZIONE RAZIONALE DELLO STUO Gruppo Oncologico Nord Ovest (G.O.N.O.) Italy Studio di fase II randomizzato, open-label Carcinoma Colorettale (CCR)
VERS. PROTOCOLLO 3.0 25 Novembre 2013 SPONSOR FASE STUO INCAZIONE RAZIONALE DELLO STUO Gruppo Oncologico Nord Ovest (G.O.N.O.) Italy Studio di fase II randomizzato, open-label Carcinoma Colorettale (CCR)
SINOSSI. Studio di Fase II: Obiettivo primario Determinare l attività antitumorale della combinazione in termini di tempo alla progressione
 SINOSSI TITOLO Studio di fase I-II con Lapatinib in combinazione con capecitabina e vinorelbina come seconda linea di trattamento in pazienti con carcinoma mammario con iperespressione di ErbB2 localmente
SINOSSI TITOLO Studio di fase I-II con Lapatinib in combinazione con capecitabina e vinorelbina come seconda linea di trattamento in pazienti con carcinoma mammario con iperespressione di ErbB2 localmente
SINOSSI DEL PROTOCOLLO ML21868
 TITOLO SPONSOR FASE CLINICA INDICAZIONE OBIETTIVI SINOSSI DEL PROTOCOLLO ML21868 Studio clinico randomizzato di fase II con bevacizumab (AVASTIN ) in combinazione con gemcitabina o con dosi ridotte di
TITOLO SPONSOR FASE CLINICA INDICAZIONE OBIETTIVI SINOSSI DEL PROTOCOLLO ML21868 Studio clinico randomizzato di fase II con bevacizumab (AVASTIN ) in combinazione con gemcitabina o con dosi ridotte di
SINOSSI. Titolo. Coordinatori e Promotori dello studio
 SINOSSI Titolo PLERIXAFOR (PLX) IN MODALITA ON DEMAND PER LA RACCOLTA DI CELLULE STAMINALI EMOPOIETICHE AUTOLOGHE IN PAZIENTI AFFETTI DA MIELOMA MULTIPLO DA LINFOMA CHE MOSTRINO POVERA MOBILIZZAZIONE DOPO
SINOSSI Titolo PLERIXAFOR (PLX) IN MODALITA ON DEMAND PER LA RACCOLTA DI CELLULE STAMINALI EMOPOIETICHE AUTOLOGHE IN PAZIENTI AFFETTI DA MIELOMA MULTIPLO DA LINFOMA CHE MOSTRINO POVERA MOBILIZZAZIONE DOPO
Mieloma Multiplo. Trattamento del Mieloma Multiplo SCHEDA 12/28/2016 TERAPIA DI PRIMA LINEA IN PAZIENTI CANDIDABILE A TRAPIANTO AUTOLOGO
 TERAPIA DI PRIMA LINEA IN PAZIENTI CANDIDABILE A TRAPIANTO AUTOLOGO 1 di 6 INDUZIONE STANDARD : VTD 4/6 cicli (In label, 648, monitorato AIFA per Talidomide schema Rosinol) Velcade 1.3 mg/mq SC gg 1, 4,
TERAPIA DI PRIMA LINEA IN PAZIENTI CANDIDABILE A TRAPIANTO AUTOLOGO 1 di 6 INDUZIONE STANDARD : VTD 4/6 cicli (In label, 648, monitorato AIFA per Talidomide schema Rosinol) Velcade 1.3 mg/mq SC gg 1, 4,
Approssimativamente 20 sperimentatori (oncologi o pneumologi). Approssimativamente 20 centri in tutto il mondo.
 SINOSSI Nome dello sponsor/azienda: Eisai Inc. Riservato alle Autorità Titolo dello studio: N. di protocollo: Sperimentatori: Centri dello studio: Studio in aperto, multicentrico, randomizzato, di fase
SINOSSI Nome dello sponsor/azienda: Eisai Inc. Riservato alle Autorità Titolo dello studio: N. di protocollo: Sperimentatori: Centri dello studio: Studio in aperto, multicentrico, randomizzato, di fase
Sergio Storti Fondazione di Ricerca e Cura Giovanni Paolo II Università Cattolica del Sacro Cuore Campobasso
 R-BENDA FRAIL: Studio di fase II con Rituximab + Bendamustina per il trattamento di prima linea di pazienti anziani fragili (> 70 anni) affetti da linfoma non Hodgkin diffuso a grandi cellule B Sergio
R-BENDA FRAIL: Studio di fase II con Rituximab + Bendamustina per il trattamento di prima linea di pazienti anziani fragili (> 70 anni) affetti da linfoma non Hodgkin diffuso a grandi cellule B Sergio
O.R.I.A. OSSERVATORIO RICERCA E INNOVAZIONE AZIENDALE. Reggio Emilia 4 giugno 2008
 O.R.I.A. OSSERVATORIO RICERCA E INNOVAZIONE AZIENDALE Reggio Emilia 4 giugno 2008 Protocollo I.R.M.A. Innovazione in Radioterapia Mammaria CARCINOMA DELLA MAMMELLA A BASSO RISCHIO DI RECIDIVA LOCALE: IRRADIAZIONE
O.R.I.A. OSSERVATORIO RICERCA E INNOVAZIONE AZIENDALE Reggio Emilia 4 giugno 2008 Protocollo I.R.M.A. Innovazione in Radioterapia Mammaria CARCINOMA DELLA MAMMELLA A BASSO RISCHIO DI RECIDIVA LOCALE: IRRADIAZIONE
EMOPATIE MALIGNE NEL PAZIENTE ANZIANO
 EMOPATIE MALIGNE NEL PAZIENTE ANZIANO EMOPATIE MALIGNE NEL PAZIENTE ANZIANO Il progressivo invecchiamento della popolazione aumenta l incidenza delle patologie dell anziano Netto incremento delle emopatie
EMOPATIE MALIGNE NEL PAZIENTE ANZIANO EMOPATIE MALIGNE NEL PAZIENTE ANZIANO Il progressivo invecchiamento della popolazione aumenta l incidenza delle patologie dell anziano Netto incremento delle emopatie
Specialità: Mabthera (Roche SpA) Forma farmaceutica: 1fl ev 500mg - Prezzo: euro fl 10ml 100mg - Prezzo: euro
 RITUXIMAB Linfoma non-hodgkin: La terapia di mantenimento per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza Rituximab. (09-01-2007)
RITUXIMAB Linfoma non-hodgkin: La terapia di mantenimento per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza Rituximab. (09-01-2007)
MODELLO UNICO DI PRESCRIZIONE SERVIZIO SANITARIO REGIONE CAMPANIA A.S.L.
 Data di Stampa: REGIONE CAMPANIA - SANI.A.R.P. MODELLO UNICO DI PRESCRIZIONE SERVIZIO SANITARIO REGIONE CAMPANIA A.S.L. Codice a barra N.: CENTRO PRESCRITTORE (DEMINAZIONE):... CODICE STRUTTURA:... IL/LA
Data di Stampa: REGIONE CAMPANIA - SANI.A.R.P. MODELLO UNICO DI PRESCRIZIONE SERVIZIO SANITARIO REGIONE CAMPANIA A.S.L. Codice a barra N.: CENTRO PRESCRITTORE (DEMINAZIONE):... CODICE STRUTTURA:... IL/LA
PERCORSO DIAGNOSTICO TERAPEUTICO ASSISTENZIALE (PDTA) PER I PAZIENTI AFFETTI DA CARCINOMA DELLA PROSTATA
 PERCORSO DIAGNOSTICO TERAPEUTICO ASSISTENZIALE (PDTA) PER I PAZIENTI AFFETTI DA CARCINOMA DELLA PROSTATA Unità destinatarie e competenze Urologia (prevenzione, diagnosi e stadiazione), trattamento, riabilitazione,
PERCORSO DIAGNOSTICO TERAPEUTICO ASSISTENZIALE (PDTA) PER I PAZIENTI AFFETTI DA CARCINOMA DELLA PROSTATA Unità destinatarie e competenze Urologia (prevenzione, diagnosi e stadiazione), trattamento, riabilitazione,
ADENOCARCINOMA DEL RETTO
 ADENOCARCINOMA DEL RETTO GASTOENTEROLOGO- PATOLOGO CHIRURGO-RADIOLOGO- PATOLOGO GIOG ONCOLOGO-PATOLOGO- RADIOLOGO RADIOTERAPISTA 1. esame endoscopico richiesto dal Curante e/o per screening programmato.
ADENOCARCINOMA DEL RETTO GASTOENTEROLOGO- PATOLOGO CHIRURGO-RADIOLOGO- PATOLOGO GIOG ONCOLOGO-PATOLOGO- RADIOLOGO RADIOTERAPISTA 1. esame endoscopico richiesto dal Curante e/o per screening programmato.
CLASSI DI PRIORITÀ CLINICA PER L ESECUZIONE DEL TRATTAMENTO RADIOTERAPICO
 giunta regionale Allegato A al Decreto n. 0018 del 13 GIU 2016 pag. 1/6 CLASSI DI PRIORITÀ CLINICA PER L ESECUZIONE DEL TRATTAMENTO RADIOTERAPICO L'erogazione di trattamenti radioterapici in regime di
giunta regionale Allegato A al Decreto n. 0018 del 13 GIU 2016 pag. 1/6 CLASSI DI PRIORITÀ CLINICA PER L ESECUZIONE DEL TRATTAMENTO RADIOTERAPICO L'erogazione di trattamenti radioterapici in regime di
Nuovi obie)vi clinici nell impiego del Brentuximab Vedo7n Meldola, IRST- IRCSS, 24 SeBembre 2016
 Nuovi obie)vi clinici nell impiego del Brentuximab Vedo7n Meldola, IRST- IRCSS, 24 SeBembre 2016 Risposta a lungo termine nel Linfoma di Hodgkin ricaduto/refrabario. Caso Clinico Dr.ssa Beatrice Casadei
Nuovi obie)vi clinici nell impiego del Brentuximab Vedo7n Meldola, IRST- IRCSS, 24 SeBembre 2016 Risposta a lungo termine nel Linfoma di Hodgkin ricaduto/refrabario. Caso Clinico Dr.ssa Beatrice Casadei
Tabelle delle condizioni di rischio e vaccinazioni raccomandate
 Tabelle delle condizioni di e vaccinazioni raccomandate INDICE TAB.1 - VACCINI VS CONDIZIONE... 2 ANTIPNEUMOCOCCO... 2 ANTIMENINGOCOCCO... 3 ANTIVARICELLA... 3 ANTI MORBILLO PAROTITE ROSOLIA (MPR)... 4
Tabelle delle condizioni di e vaccinazioni raccomandate INDICE TAB.1 - VACCINI VS CONDIZIONE... 2 ANTIPNEUMOCOCCO... 2 ANTIMENINGOCOCCO... 3 ANTIVARICELLA... 3 ANTI MORBILLO PAROTITE ROSOLIA (MPR)... 4
Dott. Francesco Fiorica
 Dottorato di ricerca XXII ciclo Università degli Studi di Catania: Approccio Oncologico Multimodale in età geriatrica FATTIBILITA ED EFFICACIA DI UN TRATTAMENTO DI RADIOTERAPIA IN PAZIENTI ANZIANI CON
Dottorato di ricerca XXII ciclo Università degli Studi di Catania: Approccio Oncologico Multimodale in età geriatrica FATTIBILITA ED EFFICACIA DI UN TRATTAMENTO DI RADIOTERAPIA IN PAZIENTI ANZIANI CON
STUDIO GRUPPO ITALIANO PANCREAS GIP-2
 STUDIO ITALIANO MULTICENTRICO RANDOMIZZATO DI FASE III DI CONFRONTO TRA LA COMBINAZIONE DI 5- FLUOROURACILE/ACIDO FOLINICO, OXALIPLATINO E IRINOTECAN (FOLFOXIRI) VERSO GEMCITABINA NEL TRATTAMENTO ADIUVANTE
STUDIO ITALIANO MULTICENTRICO RANDOMIZZATO DI FASE III DI CONFRONTO TRA LA COMBINAZIONE DI 5- FLUOROURACILE/ACIDO FOLINICO, OXALIPLATINO E IRINOTECAN (FOLFOXIRI) VERSO GEMCITABINA NEL TRATTAMENTO ADIUVANTE
29/05/2017 ASSISTENZA AL PAZIENTE SOTTOPOSTO A TRAPIANTO DI CELLULE STAMINALI EMATOPOIETICHE
 Assistenza al paziente oncologico: complessità assistenziale e cure integrate ASSISTENZA AL PAZIENTE SOTTOPOSTO A TRAPIANTO DI CELLULE STAMINALI EMATOPOIETICHE RELATORE : FACCA VALENTINO ASSISTENZA AL
Assistenza al paziente oncologico: complessità assistenziale e cure integrate ASSISTENZA AL PAZIENTE SOTTOPOSTO A TRAPIANTO DI CELLULE STAMINALI EMATOPOIETICHE RELATORE : FACCA VALENTINO ASSISTENZA AL
RICHIESTA DI PARERE SU SPERIMENTAZIONE CLINICA DI DISPOSITIVO MEDICO
 COMITATO ETICO INTERAZIENDALE (istituito con Delibera n. 236 del 10/09/13 e successiva Delibera n. 267 del 25/10/13 ed iscritto al Registro Regionale al n. 2) Sede: Via Venezia n.16, 15121 tel.0131206974-6651
COMITATO ETICO INTERAZIENDALE (istituito con Delibera n. 236 del 10/09/13 e successiva Delibera n. 267 del 25/10/13 ed iscritto al Registro Regionale al n. 2) Sede: Via Venezia n.16, 15121 tel.0131206974-6651
Francesco Baudo S.C. Ematologia, A.O. Ospedale Niguarda Ca Granda, Milano
 LA REL e L ITP Francesco Baudo S.C. Ematologia, A.O. Ospedale Niguarda Ca Granda, Milano REL - RETE EMATOLOGICA LOMBARDA La REL, istituita nel 2008, è un modello di collaborazione finalizzato alla realizzazione
LA REL e L ITP Francesco Baudo S.C. Ematologia, A.O. Ospedale Niguarda Ca Granda, Milano REL - RETE EMATOLOGICA LOMBARDA La REL, istituita nel 2008, è un modello di collaborazione finalizzato alla realizzazione
Curriculum Vitae Maurizio Martelli
 Dati Personali Nome_Cognome Maurizio Martelli Data di nascita 30 Luglio, 1956 Luogo di nascita, Italia Nazionalità Stato civile Contatti: Italiana Coniugato con Roberta Caruso; due figli, Lorenzo e Maria
Dati Personali Nome_Cognome Maurizio Martelli Data di nascita 30 Luglio, 1956 Luogo di nascita, Italia Nazionalità Stato civile Contatti: Italiana Coniugato con Roberta Caruso; due figli, Lorenzo e Maria
Linfoma di Hodgkin (LH) Criticità della registrazione
 corso per operatori dei Registri Tumori AIRTUM I TUMORI EMATOLOGICI criticità nella diagnosi, registrazione e classificazione Linfoma di Hodgkin (LH) Criticità della registrazione Simona Nuzzo Registro
corso per operatori dei Registri Tumori AIRTUM I TUMORI EMATOLOGICI criticità nella diagnosi, registrazione e classificazione Linfoma di Hodgkin (LH) Criticità della registrazione Simona Nuzzo Registro
STUDIO PANDA. Sinossi
 Titolo Studio di fase II randomizzato di prima linea con FOLFO/panitumumab e 5FU/panitumumab in pazienti anziani con carcinoma colorettale metastatico RAS e BRAF wild-type. Versione 2.2 del 18.04.2016
Titolo Studio di fase II randomizzato di prima linea con FOLFO/panitumumab e 5FU/panitumumab in pazienti anziani con carcinoma colorettale metastatico RAS e BRAF wild-type. Versione 2.2 del 18.04.2016
Lotto N. Data di scadenza: Dosaggio: Frequenza:
 MODULO INIZIALE PER SEGNALARE UNA GRAVIDANZA INFORMAZIONI SUL SEGNALATORE: Nome del segnalatore: Indirizzo: Occupazione: Città, Paese: Telefono N.: Fax N.: Indirizzo Email: INFORMAZIONI SUL PAZIENTE FEMMINA
MODULO INIZIALE PER SEGNALARE UNA GRAVIDANZA INFORMAZIONI SUL SEGNALATORE: Nome del segnalatore: Indirizzo: Occupazione: Città, Paese: Telefono N.: Fax N.: Indirizzo Email: INFORMAZIONI SUL PAZIENTE FEMMINA
Trapianto. Stefano Guidi TMO. AOU Careggi. Firenze. Sesta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche
 Sesta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Sabato 9 Aprile 2016 CRIMM Centro di Ricerca e Innovazione per le Malattie Mieloproliferative AOU Careggi Trapianto
Sesta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Sabato 9 Aprile 2016 CRIMM Centro di Ricerca e Innovazione per le Malattie Mieloproliferative AOU Careggi Trapianto
Allo stato attuale la casistica consta di 60 casi trattati con peritonectomia e chemioipetermia intraoperatoria.
 I dati sintetizzati nella tabella sopra riportata nel contesto delle esperienze internazionali sono relativi alla casistica di 47 casi relativa al periodo 2000-20007 analizzata nell articolo: Cytoreductive
I dati sintetizzati nella tabella sopra riportata nel contesto delle esperienze internazionali sono relativi alla casistica di 47 casi relativa al periodo 2000-20007 analizzata nell articolo: Cytoreductive
Commissione Regionale Farmaco LAPATINIB
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Versione numero: Data Titolo dello studio 1. SYNOPSIS 1.0 HD 0607
 1. SYNOPSIS Versione numero: 1.0 HD 0607 Data 07.05.2008 Titolo dello Titolo in breve Data di inizio e fine dello Registrazione dei pazienti Obiettivo principale dello Obiettivi (Endpoint) secondari Tipologia
1. SYNOPSIS Versione numero: 1.0 HD 0607 Data 07.05.2008 Titolo dello Titolo in breve Data di inizio e fine dello Registrazione dei pazienti Obiettivo principale dello Obiettivi (Endpoint) secondari Tipologia
Proposta di un percorso HCV nei pazienti nefropatici. Anastasio Grilli UO Malattie Infettive Universitaria FERRARA 26 maggio 2017
 Anastasio Grilli UO Malattie Infettive Universitaria FERRARA 26 maggio 2017 L infezione da virus dell epatite C (HCV) è una delle principali cause di malattia cronica del fegato nel mondo L impatto clinico
Anastasio Grilli UO Malattie Infettive Universitaria FERRARA 26 maggio 2017 L infezione da virus dell epatite C (HCV) è una delle principali cause di malattia cronica del fegato nel mondo L impatto clinico
Storia naturale del tumore della mammella. diagnosi. +/-trattamento/i. preclinica. nascita del tumore. diagnosi. exitus. clinica
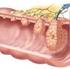 Storia naturale del tumore della mammella diagnosi preclinica +/-trattamento/i? nascita del tumore diagnosi clinica exitus Trattamento carcinoma della mammella chirurgia radioterapia terapia medica MASSIMO
Storia naturale del tumore della mammella diagnosi preclinica +/-trattamento/i? nascita del tumore diagnosi clinica exitus Trattamento carcinoma della mammella chirurgia radioterapia terapia medica MASSIMO
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI
 ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
PROTOCOLLO DELLO STUDIO
 PROTOCOLLO DELLO STUDIO TITOLO DELLO STUDIO TRATTAMENTO CON IMMUNOGLOBULINE NELLA SINDROME POST-POLIO DISEGNO DELLO STUDIO Studio clinico randomizzato, in doppio cieco, a due bracci (trattamento vs placebo)
PROTOCOLLO DELLO STUDIO TITOLO DELLO STUDIO TRATTAMENTO CON IMMUNOGLOBULINE NELLA SINDROME POST-POLIO DISEGNO DELLO STUDIO Studio clinico randomizzato, in doppio cieco, a due bracci (trattamento vs placebo)
SCHEDA DI SEGNALAZIONE DI CASO PER ESPOSIZIONE IN OPERATORE SANITARIO
 Le schede per la segnalazione di caso di profilassi post.-esposizione (PPE) ad HIV sono due; una per le esposizioni occupazionali in operatore sanitario, l altra per le esposizioni occupazionali in non
Le schede per la segnalazione di caso di profilassi post.-esposizione (PPE) ad HIV sono due; una per le esposizioni occupazionali in operatore sanitario, l altra per le esposizioni occupazionali in non
La Rete di Oncologia e Oncoematologia Pediatrica del Piemonte e della Valle d Aosta
 La gestione del catetere venoso centrale e delle infezioni ad esso correlate Torino, 3 marzo 2011 La Rete di Oncologia e Oncoematologia Pediatrica del Piemonte e della Valle d Aosta La vita non é una questione
La gestione del catetere venoso centrale e delle infezioni ad esso correlate Torino, 3 marzo 2011 La Rete di Oncologia e Oncoematologia Pediatrica del Piemonte e della Valle d Aosta La vita non é una questione
VALUTAZIONE E DIGIUNO
 POLO UNICO OSPEDALIERO UNIVERSITARIO DI PERUGIA Sezione di Anestesia, Analgesia e Terapia Intensiva Scuola di Specializzazione in Anestesia e Rianimazione Struttura Complessa di Anestesia e Rianimazione
POLO UNICO OSPEDALIERO UNIVERSITARIO DI PERUGIA Sezione di Anestesia, Analgesia e Terapia Intensiva Scuola di Specializzazione in Anestesia e Rianimazione Struttura Complessa di Anestesia e Rianimazione
INduction chemotherapy followed by CEtuximab Plus definitive radiotherapy versus radiation plus cisplatin N EUDRACT:
 Gruppo Oncologico Nord Ovest Azienda Ospedaliera S. Croce e Carle di Cuneo INduction chemotherapy followed by CEtuximab Plus definitive radiotherapy versus radiation plus cisplatin Chemioterapia di induzione
Gruppo Oncologico Nord Ovest Azienda Ospedaliera S. Croce e Carle di Cuneo INduction chemotherapy followed by CEtuximab Plus definitive radiotherapy versus radiation plus cisplatin Chemioterapia di induzione
CRITERI RECIST E IMAGING
 CRITERI RECIST E IMAGING Negrar 11 ottobre 2017 L. ROMANO E. DEMOZZI CRITERI RECIST 1.1 Tecnica standardizzata per la misura dei Tumori Scopo: garantire l obiettività e ridurre la variabilità inter-osservatore
CRITERI RECIST E IMAGING Negrar 11 ottobre 2017 L. ROMANO E. DEMOZZI CRITERI RECIST 1.1 Tecnica standardizzata per la misura dei Tumori Scopo: garantire l obiettività e ridurre la variabilità inter-osservatore
U.O. Emato-oncologia Pediatrica, I.R.C.S.S Burlo Garofolo, Trieste Dr. Marco RABUSIN
 TITOLO Studio prospettico IRCSS Burlo Garofolo di Trieste S V I L U P P O D I S T R AT E G I E FA R M A C O L O G I C H E P E R L A PERSONALIZZAZIONE DEL TRATTAMENTO DELLA LEUCEMIA LINFOBLASTICA ACUTA
TITOLO Studio prospettico IRCSS Burlo Garofolo di Trieste S V I L U P P O D I S T R AT E G I E FA R M A C O L O G I C H E P E R L A PERSONALIZZAZIONE DEL TRATTAMENTO DELLA LEUCEMIA LINFOBLASTICA ACUTA
AMPHOTERICIN B (AMBISOME
 SYNOPSIS Titolo dello Studio LIPOSOMAL AMPHOTERICIN B (AMBISOME ) 10 mg/kg once a week for 10 weeks as maintenance antifungal therapy for Proven/Probable Invasive Fungal Infection in hematologic patients
SYNOPSIS Titolo dello Studio LIPOSOMAL AMPHOTERICIN B (AMBISOME ) 10 mg/kg once a week for 10 weeks as maintenance antifungal therapy for Proven/Probable Invasive Fungal Infection in hematologic patients
PROTOCOLLO SPERIMENTALE DI IMPIEGO CLINICO MN3
 PROTOCOLLO SPERIMENTALE DI IMPIEGO CLINICO MN3 DIAGNOSTICA CON ANALOGHI DELLA SOMATOSTATINA MARCATI CON 68 Ga DI TUMORI CON PROBABILE ESPRESSIONE DI RECETTORI SSTR2 e/o 5, DA INDIRIZZARE AL TRATTAMENTO
PROTOCOLLO SPERIMENTALE DI IMPIEGO CLINICO MN3 DIAGNOSTICA CON ANALOGHI DELLA SOMATOSTATINA MARCATI CON 68 Ga DI TUMORI CON PROBABILE ESPRESSIONE DI RECETTORI SSTR2 e/o 5, DA INDIRIZZARE AL TRATTAMENTO
COMITATO ETICO PER LE SPERIMENTAZIONI CLINICHE DELLA PROVINCIA DI VICENZA
 COMITATO ETICO PER LE SPERIMENTAZIONI CLINICHE DELLA PROVINCIA DI VICENZA SEDUTA 24 MARZO 2014 Dott.ssa Eleonora Benetti Pediatra - indicato dall'ordine dei Medici P Dott. Salvatore Castronovo Ematologo
COMITATO ETICO PER LE SPERIMENTAZIONI CLINICHE DELLA PROVINCIA DI VICENZA SEDUTA 24 MARZO 2014 Dott.ssa Eleonora Benetti Pediatra - indicato dall'ordine dei Medici P Dott. Salvatore Castronovo Ematologo
SINOSSI DEL PROTOCOLLO
 SINOSSI DEL PROTOCOLLO TITOLO DELLO STUDIO: CODICE DEL PROTOCOLLO: SPONSOR: FASE DELLO STUDIO: CENTRI PARTECIPANTI ALLO STUDIO: PERIODO DI STUDIO PIANIFICATO (PRIMO ARRUOLAMENTO ULTIMO PAZIENTE USCITO
SINOSSI DEL PROTOCOLLO TITOLO DELLO STUDIO: CODICE DEL PROTOCOLLO: SPONSOR: FASE DELLO STUDIO: CENTRI PARTECIPANTI ALLO STUDIO: PERIODO DI STUDIO PIANIFICATO (PRIMO ARRUOLAMENTO ULTIMO PAZIENTE USCITO
Corso di Tecniche diagnostiche in ematologia
 Corso di Tecniche diagnostiche in ematologia Struttura e funzione del sistema emopoietico Inquadramento fisiopatologico Tecniche di studio, cliniche e sperimentali Trapianto di cellule staminali Principali
Corso di Tecniche diagnostiche in ematologia Struttura e funzione del sistema emopoietico Inquadramento fisiopatologico Tecniche di studio, cliniche e sperimentali Trapianto di cellule staminali Principali
CARTELLA PER INSERIMENTO IN LISTA DI ATTESA TRAPIANTO DI RENE
 CARTELLA PER INSERIMENTO IN LISTA DI ATTESA TRAPIANTO DI RENE cognome nome sesso M F c.f nato a prov. il domiciliato a prov. CAP via n. tel. centro di dialisi Nefrologo di riferimento Attività lavorativa
CARTELLA PER INSERIMENTO IN LISTA DI ATTESA TRAPIANTO DI RENE cognome nome sesso M F c.f nato a prov. il domiciliato a prov. CAP via n. tel. centro di dialisi Nefrologo di riferimento Attività lavorativa
Indicatori di qualità nei carcinomi genitali femminili"
 Indicatori di qualità nei carcinomi genitali femminili" Corso DAS Oncologia 19.04.2010 Registro Tumori Canton Ticino Istituto Cantonale di Patologia Via in Selva 24 6600 Locarno Indicatori di qualità Introduzione"
Indicatori di qualità nei carcinomi genitali femminili" Corso DAS Oncologia 19.04.2010 Registro Tumori Canton Ticino Istituto Cantonale di Patologia Via in Selva 24 6600 Locarno Indicatori di qualità Introduzione"
Coordinatori Michela Cinquini, Simon Spazzapan. Presentatori Valentina Fanotto, Marta Pestrin, Alessia Levaggi
 2- QUESITO GRADE: Nelle pazienti con carcinoma mammario triplo negativo, candidate a chemioterapia neoadiuvante, è raccomandabile un regime contenente platino? Coordinatori Michela Cinquini, Simon Spazzapan
2- QUESITO GRADE: Nelle pazienti con carcinoma mammario triplo negativo, candidate a chemioterapia neoadiuvante, è raccomandabile un regime contenente platino? Coordinatori Michela Cinquini, Simon Spazzapan
Allegato B al Decreto n. 48 del 17 maggio 2016 pag. 1/6
 giunta regionale Allegato B al Decreto n. 48 del 17 maggio 2016 pag. 1/6 ELENCO FARMACI ONCO-EMATOLOGICI SOGGETTI A REGISTRO AIFA E DEI RELATIVI CENTRI AUTORIZZATI ALLA PRESCRIZIONE NOME FARMACO PRINCIPIO
giunta regionale Allegato B al Decreto n. 48 del 17 maggio 2016 pag. 1/6 ELENCO FARMACI ONCO-EMATOLOGICI SOGGETTI A REGISTRO AIFA E DEI RELATIVI CENTRI AUTORIZZATI ALLA PRESCRIZIONE NOME FARMACO PRINCIPIO
Terapia radiorecettoriale in 117 pazienti affetti da carcinoide bronchiale avanzato: efficacia e tossicità a lungo termine
 Terapia radiorecettoriale in 117 pazienti affetti da carcinoide bronchiale avanzato: efficacia e tossicità a lungo termine Annapaola Mariniello (1), Lisa Bodei (1), Silvia Melania Baio (1), Laura Gilardi
Terapia radiorecettoriale in 117 pazienti affetti da carcinoide bronchiale avanzato: efficacia e tossicità a lungo termine Annapaola Mariniello (1), Lisa Bodei (1), Silvia Melania Baio (1), Laura Gilardi
Clinical Protocol. ID Study: FIL_MIRO. EudraCT number: 2012-001676-11 VERSIONE 1.1 DATA 12/11/2014
 Clinical Protocol Studio MIRO (Molecularly Immuno-radio-therapy Oriented): studio multicentrico di fase II per il trattamento su base molecolare dei Linfomi Follicolari stadio I/II con radioterapia locale
Clinical Protocol Studio MIRO (Molecularly Immuno-radio-therapy Oriented): studio multicentrico di fase II per il trattamento su base molecolare dei Linfomi Follicolari stadio I/II con radioterapia locale
Complicanze extraepatiche di HCV
 PROGETTO EDUCAZIONALE NAZIONALE savethedate Complicanze extraepatiche di HCV Napoli 14-15 settembre 2017 Università della Campania Luigi Vanvitelli Faculty Giuseppina Brancaccio, Azienda Ospedaliera Università
PROGETTO EDUCAZIONALE NAZIONALE savethedate Complicanze extraepatiche di HCV Napoli 14-15 settembre 2017 Università della Campania Luigi Vanvitelli Faculty Giuseppina Brancaccio, Azienda Ospedaliera Università
RAD001. Sinossi del protocollo dello studio CRAD001N2301. Codice EUDRACT 2008-000498-40. Fase di sviluppo
 RAD001 Sinossi protocollo lo studio CRAD001N2301 Studio multicentrico, randomizzato, in doppio cieco, controllato versus placebo, di fase III, con terapia adiuvante con RAD001 in pazienti con linfoma diffuso
RAD001 Sinossi protocollo lo studio CRAD001N2301 Studio multicentrico, randomizzato, in doppio cieco, controllato versus placebo, di fase III, con terapia adiuvante con RAD001 in pazienti con linfoma diffuso
1 Sinossi. Numero dello studio EMR Merck KGaA, Darmstadt, Germania. Fase di studio
 1 Sinossi Titolo dello studio Uno studio aperto, randomizzato, di Fare II in soggetti affetti da carcinoma polmonare a piccole cellule malattia estesa (ED-SCLC), dopo una risposta iniziale (risposta completa
1 Sinossi Titolo dello studio Uno studio aperto, randomizzato, di Fare II in soggetti affetti da carcinoma polmonare a piccole cellule malattia estesa (ED-SCLC), dopo una risposta iniziale (risposta completa
PROTOCOLLO DELLA SPERIMENTAZIONE CLINICA
 PROTOCOLLO DELLA SPERIMENTAZIONE CLINICA Titolo Studio di fase 1/2 su brentuximab vedotin (SGN-35) in pazienti pediatrici con linfoma a grandi cellule anaplastico sistemico o linfoma di Hodgkin recidivo
PROTOCOLLO DELLA SPERIMENTAZIONE CLINICA Titolo Studio di fase 1/2 su brentuximab vedotin (SGN-35) in pazienti pediatrici con linfoma a grandi cellule anaplastico sistemico o linfoma di Hodgkin recidivo
STUDI CLINICI IN CORSO nella MIELOFIBROSI
 Quinta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Sabato 9 Maggio 2015 STUDI CLINICI IN CORSO nella MIELOFIBROSI Paola Guglielmelli Laboratorio Congiunto MMPC, AOU
Quinta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Sabato 9 Maggio 2015 STUDI CLINICI IN CORSO nella MIELOFIBROSI Paola Guglielmelli Laboratorio Congiunto MMPC, AOU
ABRAXANE (nab-paclitaxel) - Carcinoma pancreas esocrino
 Campo obbligatorio ai fini dell'eleggibilità Campo obbligatorio ABRAXAN (nab-paclitaxel) - Carcinoma pancreas esocrino Abraxane in associazione con gemcitabina è indicato per il trattamento di prima linea
Campo obbligatorio ai fini dell'eleggibilità Campo obbligatorio ABRAXAN (nab-paclitaxel) - Carcinoma pancreas esocrino Abraxane in associazione con gemcitabina è indicato per il trattamento di prima linea
STUDY ID: FIL_FLAZ-12 DATE: 12/03/2012 V.1.1 EUDRACT NUMBER
 Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
Scelta della terapia di 1 linea
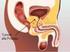 Scelta della terapia di 1 linea Uomo di 45 anni anamnesi patologica muta Giugno 2009: dolore emicostato a dx FANS (scarsa risposta) Luglio 2009: dolore emicostato sin rx mostra frattura costale emocromo
Scelta della terapia di 1 linea Uomo di 45 anni anamnesi patologica muta Giugno 2009: dolore emicostato a dx FANS (scarsa risposta) Luglio 2009: dolore emicostato sin rx mostra frattura costale emocromo
IDENTIFICAZIONE DI UNA NUOVA SOGLIA CLINICO-DIAGNOSTICA PER LA PREVENZIONE TERAPEUTICA DI FRATTURE VERTEBRALI: LA PRE-FRATTURA VERTEBRALE
 IDENTIFICAZIONE DI UNA NUOVA SOGLIA CLINICO-DIAGNOSTICA PER LA PREVENZIONE TERAPEUTICA DI FRATTURE VERTEBRALI: LA PRE-FRATTURA VERTEBRALE Marco Ceccarelli 1, Nardo Letari 1, Claudia Davini 1, Daniela Melchiorrre
IDENTIFICAZIONE DI UNA NUOVA SOGLIA CLINICO-DIAGNOSTICA PER LA PREVENZIONE TERAPEUTICA DI FRATTURE VERTEBRALI: LA PRE-FRATTURA VERTEBRALE Marco Ceccarelli 1, Nardo Letari 1, Claudia Davini 1, Daniela Melchiorrre
C.O.E.S. CENTRO ONCOLOGICO EMATOLOGICO SUBALPINO
 C.O.E.S. CENTRO ONCOLOGICO EMATOLOGICO SUBALPINO SONO STATI TRASFERITI PRESSO I LOCALI DELL'EX MEDICINA D'URGENZA (ENTRATA DA INGRESSO CENTRALE CORSO BRAMANTE 88): - LA SEGRETERIA C.A.S. E G.I.C. - UNO
C.O.E.S. CENTRO ONCOLOGICO EMATOLOGICO SUBALPINO SONO STATI TRASFERITI PRESSO I LOCALI DELL'EX MEDICINA D'URGENZA (ENTRATA DA INGRESSO CENTRALE CORSO BRAMANTE 88): - LA SEGRETERIA C.A.S. E G.I.C. - UNO
PERCORSO DIAGNOSTICO-TERAPEUTICO PER IL PAZIENTE CON MIELOMA MULTIPLO REVISIONE SCHEDA DI TRATTAMENTO
 PERCORSO DIAGNOSTICO-TERAPEUTICO PER IL PAZIENTE CON MIELOMA MULTIPLO REVISIONE SCHEDA DI TRATTAMENTO A cura del Gruppo di Studio sul Mieloma Multiplo: Coordinatori: Mario Boccadoro, Sara Bringhen, Marinella
PERCORSO DIAGNOSTICO-TERAPEUTICO PER IL PAZIENTE CON MIELOMA MULTIPLO REVISIONE SCHEDA DI TRATTAMENTO A cura del Gruppo di Studio sul Mieloma Multiplo: Coordinatori: Mario Boccadoro, Sara Bringhen, Marinella
SINOSSI DEL PROTOCOLLO MO28457
 SINOSSI DEL PROTOCOLLO MO28457 TITOLO STUDIO RANDOMIZZATO, IN APERTO, MULTICENTRICO PER VALUTARE LA PREFERENZA DELLA SOMMINISTRAZIONE SOTTOCUTANEA DI RITUXIMAB RISPETTO ALLA SOMMINISTRAZIONE ENDOVENOSA
SINOSSI DEL PROTOCOLLO MO28457 TITOLO STUDIO RANDOMIZZATO, IN APERTO, MULTICENTRICO PER VALUTARE LA PREFERENZA DELLA SOMMINISTRAZIONE SOTTOCUTANEA DI RITUXIMAB RISPETTO ALLA SOMMINISTRAZIONE ENDOVENOSA
Il dato di laboratorio
 Corso di Laurea Triennale in Biotecnologie per la salute Biochimica clinica Il ciclo analitico: dalla richiesta al dato di laboratorio Il dato di laboratorio È un segno che contribuisce a distinguere tra
Corso di Laurea Triennale in Biotecnologie per la salute Biochimica clinica Il ciclo analitico: dalla richiesta al dato di laboratorio Il dato di laboratorio È un segno che contribuisce a distinguere tra
Allegato A al Decreto n. 107 del 8 agosto 2017 pag. 1/6
 giunta regionale Allegato A al Decreto n. 107 del 8 agosto 2017 pag. 1/6 ELENCO FARMACI ONCO-EMATOLOGICI* PRINCIPIO ATTIVO Adcetris (Brentuximab vedotin) Atriance (Nelarabina) Arzerra (Ofatumumab) Arzerra
giunta regionale Allegato A al Decreto n. 107 del 8 agosto 2017 pag. 1/6 ELENCO FARMACI ONCO-EMATOLOGICI* PRINCIPIO ATTIVO Adcetris (Brentuximab vedotin) Atriance (Nelarabina) Arzerra (Ofatumumab) Arzerra
Possibilità terapeutiche attuali nelle sindromi mielodisplastiche
 Possibilità terapeutiche attuali nelle sindromi mielodisplastiche Luca Malcovati, Professore Associato di Ematologia, Dipartimento di Ematologia e Oncologia, Fondazione IRCCS Policlinico San Matteo & Dipartimento
Possibilità terapeutiche attuali nelle sindromi mielodisplastiche Luca Malcovati, Professore Associato di Ematologia, Dipartimento di Ematologia e Oncologia, Fondazione IRCCS Policlinico San Matteo & Dipartimento
Specialista in Radioterapia Oncologica
 Dott.ssa Pierina Navarria Specialista in Radioterapia Oncologica Ruolo Aiuto Io in Humanitas Unità operativa Radioterapia Aree mediche di interesse Aree di ricerca di interesse Ruolo attuale Aiuto Area
Dott.ssa Pierina Navarria Specialista in Radioterapia Oncologica Ruolo Aiuto Io in Humanitas Unità operativa Radioterapia Aree mediche di interesse Aree di ricerca di interesse Ruolo attuale Aiuto Area
RITUXIMAB in associazione a metotressato è indicato per il trattamento dell artrite reumatoide attiva di grado severo in pazienti adulti.
 RITUXIMAB in associazione a metotressato è indicato per il trattamento dell artrite reumatoide attiva di grado severo in pazienti adulti. (28-02-2007) Specialità: Mabthera (Roche SpA) Forma farmaceutica:
RITUXIMAB in associazione a metotressato è indicato per il trattamento dell artrite reumatoide attiva di grado severo in pazienti adulti. (28-02-2007) Specialità: Mabthera (Roche SpA) Forma farmaceutica:
MANIPOLAZIONE IN VITRO ED IMPIEGO PER L AUTOTRAPIANTO DEI PROGENITORI EMOPOIETICI CIRCOLANTI
 Università degli Studi di Torino Facoltà di Medicina e Chirurgia MANIPOLAZIONE IN VITRO ED IMPIEGO PER L AUTOTRAPIANTO DEI PROGENITORI EMOPOIETICI CIRCOLANTI esperienza in linfomi indolenti (follicolari
Università degli Studi di Torino Facoltà di Medicina e Chirurgia MANIPOLAZIONE IN VITRO ED IMPIEGO PER L AUTOTRAPIANTO DEI PROGENITORI EMOPOIETICI CIRCOLANTI esperienza in linfomi indolenti (follicolari
DERMO ONCOLOGIA MELANOMA MALIGNO CUTANEO: PET TAC quando. Dr. Pietro Bianchi - U.O.C. Medicina Nucleare USL 1- Massa Carrara
 DERMO ONCOLOGIA MELANOMA MALIGNO CUTANEO: PET TAC quando Dr. Pietro Bianchi - U.O.C. Medicina Nucleare USL 1- Massa Carrara Melanoma: PET-TC quando? Sangue membrana cellulare Cellula FDG FDG Esochinasi
DERMO ONCOLOGIA MELANOMA MALIGNO CUTANEO: PET TAC quando Dr. Pietro Bianchi - U.O.C. Medicina Nucleare USL 1- Massa Carrara Melanoma: PET-TC quando? Sangue membrana cellulare Cellula FDG FDG Esochinasi
E possibile chiedere meno elettroforesi. senza danni per la salute dei cittadini?
 V.Zanardi, Core-Lab AUSL della Romagna E possibile chiedere meno elettroforesi senza danni per la salute dei cittadini? 1 Valutazione generale dello stato del paziente (flogosi, sindrome nefrosica, epatopatia,
V.Zanardi, Core-Lab AUSL della Romagna E possibile chiedere meno elettroforesi senza danni per la salute dei cittadini? 1 Valutazione generale dello stato del paziente (flogosi, sindrome nefrosica, epatopatia,
