Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi
|
|
|
- Bernarda Villani
- 7 anni fa
- Visualizzazioni
Transcript
1 LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione7 1
2 Il legame e la struttura La struttura si riferisce al modo in cui gli atomi sono disposti nello spazio Il legame si riferisce alle forze che tengono insieme atomi adiacenti ChimicaGenerale_lezione7 2
3 Dalla formula molecolare alla struttura bidimensionale Si può convertire la formula molecolare in una struttura bidimensionale, detta struttura di Lewis, che mostra come gli atomi sono legati tra loro. ChimicaGenerale_lezione7 3
4 ll legame chimico Quando gli atomi si combinano per formare composti sono tenuti insieme in proporzioni fisse da forze di attrazione chiamate legami chimici. Un legame chimico si forma se l'insieme di atomi legati assume un energia minore di quella che avevano gli atomi isolati. ChimicaGenerale_lezione7 4
5 ChimicaGenerale_lezione7 5
6 I legami sono formati dagli elettroni di valenza, cioè quelli degli orbitali più esterni. Per gli elementi dei gruppi principali (ad eccezione di quelli di transizione) possono essere da 1 a 8. ChimicaGenerale_lezione7 6
7 Il legame chimico CASI ESTREMI Legame ionico: quando 1 o più elettroni di valenza si trasferiscono da un atomo ad un altro, creando ioni Legame covalente: quando 1 o più elettroni di valenza sono messi in comune tra gli atomi ChimicaGenerale_lezione7 7
8 Identifichiamo tre tipi di legame che si ottengono combinando i due tipi di atomo: * metallo con non metallo (legame a carattere ionico); * non metallo con non metallo (legame a carattere covalente); * metallo con metallo (legame metallico). ChimicaGenerale_lezione7 8
9 Il legame ionico Metallo con Non metallo Se il legame è realizzato trasferendo completamente un elettrone da un atomo all'altro, si formano ioni e il composto è tenuto insieme dall'attrazione elettrostatica tra ioni. Si parla in questo caso di legame ionico. ChimicaGenerale_lezione7 9
10 Un legame ionico si forma tra due atomi con grandi differenze nella loro tendenza a cedere o ad acquistare elettroni, ossia tra metalli del I o II gruppo e Non metalli del VII gruppo (alogeni). Il trasferimento di un elettrone dal metallo al non metallo porta alla formazione di ioni, catione ed anione, ciascuno con configurazione di gas nobile ChimicaGenerale_lezione7 10
11 Il legame ionico nel solido ionico Un solido ionico è formato da cationi e anioni, che generalmente sono disposti in maniera ordinata e regolare: si parla in questo caso di solido cristallino. Il legame ionico non è direzionale, e ogni anione non è specificamente legato ad un certo catione, ma a tutti i cationi che lo circondano. ChimicaGenerale_lezione7 11
12 Il legame covalente Non metallo con Non metallo Se invece il legame è realizzato attraverso la condivisione di elettroni, si parla di legame covalente. Questo tipo di legame si forma tra atomi che hanno una piccola o nessuna differenza nella loro tendenza ad acquistare o cedere elettroni. Una coppia di elettroni condivisa è considerata localizzata tra i due atomi. ChimicaGenerale_lezione7 12
13 Il legame metallico Metallo con metallo: messa in comune di elettroni di valenza tra molti atomi Nel più semplice modello del legame metallico, tutti gli atomi mettono in comune i loro elettroni di valenza in un mare di elettroni uniformemente distribuito. A differenza del legame covalente, gli elettroni sono delocalizzati, ossia si muovono liberamente in tutto il campione di metallo. ChimicaGenerale_lezione7 13
14 Il legame chimico ChimicaGenerale_lezione7 14
15 Valenza Gli elettroni presenti in un atomo possono essere distinti in: Elettroni interni (elettroni di core) Elettroni di valenza (sono coinvolti nel legame e nelle reazioni chimiche) ChimicaGenerale_lezione7 15
16 Per gli elementi dei gruppi principali il numero di elettroni di valenza è uguale al numero del gruppo Per gli elementi di transizione gli elettroni di valenza comprendono quelli negli orbitali ns e (n-1)d ChimicaGenerale_lezione7 16
17 Valenza e strutture di Lewis Il fluoro (settimo gruppo) ha 7 elettroni di valenza Sei di questi formano 3 coppie di elettroni, mentre il settimo può essere usato per formare un legame covalente: si dice quindi che il fluoro ha valenza 1, o anche che il fluoro è monovalente. ChimicaGenerale_lezione7 17
18 Strutture di Lewis ChimicaGenerale_lezione7 18
19 ChimicaGenerale_lezione7 19
20 Quali ioni si formano? La configurazione elettronica degli atomi permette di prevedere gli ioni formati dai vari elementi. Abbiamo già detto che i gas nobili non sono reattivi, e questo vuol dire che la loro configurazione elettronica, in cui sono completi gli orbitali s e p dello strato più esterno, è una configurazione molto stabile. ChimicaGenerale_lezione7 20
21 Regola dell'ottetto Gli atomi dei vari elementi tendono a cedere o acquistare elettroni in modo da raggiungere la configurazione elettronica del gas nobile più vicino. Poiché tutti i gas nobili (tranne l'elio) hanno 8 elettroni nello strato più esterno, possiamo anche dire che configurazioni elettroniche con l'ottetto completo sono particolarmente stabili. ChimicaGenerale_lezione7 21
22 Anche l'idrogeno è monovalente e forma molecole biatomiche, ma in questo caso non si raggiunge l'ottetto, ma il duetto, poiché l'idrogeno è nel primo periodo ed il gas nobile più vicino è l'elio. ChimicaGenerale_lezione7 22
23 Gli ioni Mg 2+, Na +, F e O 2 hanno tutti la stessa configurazione elettronica del neon (sono isoelettronici con il neon), e quindi l'ottetto completo, così come Ca 2+, K +, Cl e S 2 hanno tutti la stessa configurazione elettronica dell'argon. ChimicaGenerale_lezione7 23
24 Si capisce ora perché i metalli (a sinistra del sistema periodico) formano cationi, mentre i non metalli formano anioni. Anche l'idrogeno, che è un non metallo, è capace di formare un anione, l'idruro H, che è isoelettronico con l'elio, e forma composti ionici noti come idruri. Gli elementi di transizione hanno comportamento più complesso, e possono generalmente formare più di un catione. ChimicaGenerale_lezione7 24
25 L elettronegatività Proprietà egli elementi legati, si indica con la lettere greca chi χ è la capacità relativa di attrarre gli elettroni di legame. Linus Pauling determinò una scala di elettronegatività, in base alla quale essa aumenta lungo un gruppo dal basso verso l alto e lungo un periodo da sinistra verso destra. ChimicaGenerale_lezione7 25
26 Ne consegue che il fluoro è l elemento più elettronegativo, seguito dall ossigeno. Maggiore è la differenza di elettronegatività tra due atomi legati, maggiore sarà il carattere polare del legame. Esiste, quindi, una gradazione dal legame ionico a quello covalente apolare, e covalente polare. ChimicaGenerale_lezione7 26
27 L'elettronegatività permette di prevedere anche se un composto binario sarà di tipo ionico o covalente. Per una differenza di elettronegatività al di sopra di 2 il composto sarà decisamente ionico. Se invece la differenza di elettronegatività tra i due elementi è minore di 1.5 (e i due elementi non sono metalli), ci aspettiamo un legame covalente, con un carattere polare tanto maggiore quanto maggiore è la differenza di elettronegatività. ChimicaGenerale_lezione7 27
28 ChimicaGenerale_lezione7 28
29 Legami covalenti polari Finora abbiamo descritto il legame covalente come formato da una coppia di elettroni condivisa tra due atomi, che si colloca a metà tra i due atomi. ChimicaGenerale_lezione7 29
30 Questo è certamente vero nei legami covalenti tra due atomi uguali, come in H 2 o Cl 2, ma se i due atomi sono diversi, è molto probabile che uno dei due atomi tenda ad attirare la coppia di elettroni più dell'altro. Per esempio in HCl il cloro attrae la coppia di elettroni più fortemente, e questa quindi si trova più vicina al cloro che all'idrogeno. ChimicaGenerale_lezione7 30
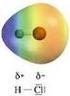
31 Acido cloridrico HCl ChimicaGenerale_lezione7 31
32 Si ha quindi una piccola carica negativa sul cloro, e una piccola carica positiva sull'idrogeno (indicate con i simboli δ+ e δ ). Nel suo complesso, la molecola è un dipolo elettrico. Un legame covalente del genere è detto legame covalente polare. Poiché si ha un parziale trasferimento di elettroni da un atomo ad un altro, questo tipo di legame è intermedio tra il legame covalente e il legame ionico. ChimicaGenerale_lezione7 32
33 ChimicaGenerale_lezione7 33
34 Scrivere le strutture di Lewis Data una formula molecolare, come si scrive la sua struttura di Lewis? Innanzitutto bisogna stabilire come sono legati gli atomi, poi seguiamo delle regole generali... ChimicaGenerale_lezione7 34
35 Strutture di Lewis per le molecole Determinare la posizione degli atomi della molecola (in genera al centro c'è atomo con minor affinità elettronica) Determinare il numero totale di e - di valenza della molecola (o ione) Porre una coppia di e - tra ogni coppia di atomi legati da legame singolo Usare le restanti coppie di e - come coppie solitarie intorno ad atomo terminale Se l'atomo centrale ha meno di 8 e - allora realizzare legami multipli tra atomo centrale e atomo terminale che ha coppie solitarie ChimicaGenerale_lezione7 35
36 Strutture di Lewis per le molecole ChimicaGenerale_lezione7 36
37 Come esempio usiamo PCl 3 * Contiamo poi tutti gli elettroni di valenza degli atomi che compongono la molecola. Qui sono 5 per P, e 7 per ogni Cl, per un totale di 26. * Di questi, 6 sono stati già usati per scrivere i 3 legami covalenti. * I rimanenti 20 vengono aggiunti come coppie solitarie fino a completamento dell'ottetto, cominciando dagli atomi terminali (in questo ne usiamo 18). * I rimanenti (2 in questo caso) elettroni vanno sull'atomo centrale. ChimicaGenerale_lezione7 37
38 Strutture di Lewis di ioni Si possono scrivere le strutture di Lewis anche di ioni. Le regole sono le stesse, ma bisogna aggiungere un elettrone in più per ogni carica negativa di un anione, o sottrarre un elettrone per ogni carica positiva di un catione. ChimicaGenerale_lezione7 38
39 Per esempio nello ione ammonio NH 4 + dobbiamo considerare 8 elettroni di valenza ( =8) che servono a formare i 4 legami covalenti: non ci sono coppie solitarie. ChimicaGenerale_lezione7 39
40 Strutture di Lewis di ioni poliatomici Nello ione SO 4 2 abbiamo 32 elettroni di valenza ( =32). Di questi, 8 servono a formare i 4 legami covalenti, e gli altri 24 formano 3 coppie solitarie su ogni ossigeno. ChimicaGenerale_lezione7 40
41 Legami multipli In alcuni casi affinché l atomo centrale abbia otto elettroni è necessaria la presenza di un legame doppio o anche triplo. Se le coppie di elettroni condivise sono due, si parla di doppio legame, se le coppie condivise sono 3, si parla di triplo legame. ChimicaGenerale_lezione7 41
42 Legami doppi e tripli Per formare legami doppi e tripli convertiamo una o due coppie non condivise in coppia di legame. In queste due molecole, come nelle precedenti, tutti gli atomi sono circondati da 8 elettroni (tranne gli idrogeni, che sono circondati da due elettroni). ChimicaGenerale_lezione7 42
43 Per verificare se ogni atomo ha l'ottetto completo, tutti gli elettroni dei legami covalenti vanno contati per ciascun atomo. ChimicaGenerale_lezione7 43
44 Strati di valenza espansi Finora abbiamo detto che si formano legami covalenti fino al raggiungimento dell'ottetto: gli otto elettroni sono gli elettroni s e p dello strato elettronico più esterno. ChimicaGenerale_lezione7 44
45 A partire dal terzo periodo, gli elettroni possono occupare anche gli orbitali d: ecco perché gli elementi del terzo periodo o successivi possono avere più legami di quanti sarebbero attesi dalla regola dell'ottetto (espansione dell'ottetto). ChimicaGenerale_lezione7 45
46 ChimicaGenerale_lezione7 46
47 ChimicaGenerale_lezione7 47
48 Le cariche formali Si dice allora che nella struttura di Lewis dello ione solfato che abbiamo scritto, ogni atomo di ossigeno ha un carica formale 1. Si parla di "carica formale" e non soltanto di "carica", perché questa non è l'unica struttura di Lewis che si può scrivere per il solfato (lo vedremo), e poi la carica formale è calcolata supponendo che gli elettroni siano equamente distribuiti tra i due atomi, questo non è sempre vero ChimicaGenerale_lezione7 48
49 Le cariche formali La carica formale va calcolata considerando che all'atomo "appartengano" tutti gli elettroni delle coppie solitarie, e un solo elettrone per ogni legame (cioè la metà degli elettroni di legame). Il numero totale di elettroni ottenuto va confrontato con gli elettroni di valenza dell'elemento: ogni elettrone in più rappresenta una carica negativa, ogni elettrone in meno rappresenta una carica positiva. ChimicaGenerale_lezione7 49
50 Carica formale= numero elettroni di valenza - [ numero elettroni di coppie solitarie - (elettroni di legame intorno all'atomo/2) ] ChimicaGenerale_lezione7 50
51 Le cariche formali Per fare un altro esempio, lo zolfo in questa struttura di Lewis non ha coppie di elettroni non condivise, ha quattro legami, per un totale di quattro elettroni "appartenenti" allo zolfo. Visto che l'atomo di zolfo neutro ha 6 elettroni di valenza, in questa struttura di Lewis lo zolfo ha una carica formale +2 (mancano 2 elettroni). ChimicaGenerale_lezione7 51
52 ChimicaGenerale_lezione7 52
53 Cariche formali e strutture di Lewis Le cariche formali ci danno un mezzo per decidere quale, tra due possibili strutture di Lewis della stessa molecola, sia la migliore (cioè quella più simile alla molecola reale). Infatti una struttura di Lewis è tanto migliore quanto minori sono le cariche formali sugli atomi della molecola. ChimicaGenerale_lezione7 53
54 Ione solfato abbiamo scritto la struttura di Lewis ChimicaGenerale_lezione7 54
55 Tuttavia se una delle coppie solitarie di un ossigeno viene utilizzata per dare origine ad un secondo legame con lo zolfo (che quindi espande l'ottetto), la struttura che si ottiene ha cariche formali minori, e quindi è preferibile. ChimicaGenerale_lezione7 55
56 La cosa può essere ripetuta una seconda volta, per dare una struttura in cui l'atomo di zolfo ha carica formale 0, e che è quindi ancora migliore. ChimicaGenerale_lezione7 56
57 Strutture limite di risonanza In realtà nessuna delle tre strutture rappresenta adeguatamente lo ione solfato. Le misure sperimentali delle lunghezze e delle energie di legame indicano che i quattro legami sono identici e con proprietà intermedie tra quelle di un legame singolo e quelle di un legame doppio. Per forza di legame si intende la quantità di energia necessaria a rompere quel legame. ChimicaGenerale_lezione7 57
58 Lunghezza di legame Per lunghezza di legame si intende la distanza tra i nuclei degli atomi legati da un legame covalente. Per esempio, la distanza di legame C-O è sempre intorno a 143 pm, mentre l'energia necessaria per romperlo è sempre intorno ai 360 kj mol-1. ChimicaGenerale_lezione7 58
59 Tuttavia, questo vale per un legame singolo, e se i due atomi sono legati da un legame doppio i due valori diventano rispettivamente 112 pm e 743 kj mol-1: il legame si accorcia, e contemporaneamente diventa più forte. ChimicaGenerale_lezione7 59
60 ChimicaGenerale_lezione7 60
61 Risonanza Si usano strutture di risonanza per rappresentare il legame in una molecola o in uno ione quando una singola struttura di Lewis non riesce a descrivere correttamente la struttura elettronica. La struttura reale della molecola è una combinazione o un ibrido di risonanza di strutture di risonanza ChimicaGenerale_lezione7 61
62 Risonanza ChimicaGenerale_lezione7 62
63 ChimicaGenerale_lezione7 63
64 ChimicaGenerale_lezione7 64
65 Lo ione nitrato è quindi rappresentato scrivendo tutte le sue possibili strutture di Lewis, che sono dette strutture limite di risonanza. ChimicaGenerale_lezione7 65
66 Ibrido di risonanza È importante capire che il problema non sta nello ione nitrato, ma nelle strutture di Lewis, che non sono capaci di descriverlo adeguatamente. In questo ione le varie coppie di elettroni non sono localizzate su un atomo (coppie solitarie) o tra due atomi (legame covalente), ma sono delocalizzate tra più di due atomi, e una sola struttura di Lewis non è in grado di descrivere questa situazione. Le tre strutture limite prese insieme sono una rappresentazione dell'ibrido, prese una per una non corrispondono a nessuna realtà fisica. ChimicaGenerale_lezione7 66
67 In definitiva, la risonanza non è un fenomeno, cioè qualcosa che succede realmente. È solo un modo che utilizziamo per descrivere la struttura di molecole che non sono descritte adeguatamente dalle strutture di Lewis. ChimicaGenerale_lezione7 67
68 Perchè delle strutture di Lewis siano strutture di risonanza, è necessario che: * gli atomi siano nelle stesse posizioni e legati nella stessa sequenza e geometria; * le strutture differiscano solo per la posizione degli elettroni (normalmente coppie di elettroni e/o legami multipli). ChimicaGenerale_lezione7 68
69 ChimicaGenerale_lezione7 69
70 ChimicaGenerale_lezione7 70
71 Riepilogo risonanza * La teoria della risonanza proposta da Linus Pauling utilizza strutture di risonanza per creare una rappresentazione bidimensionale delle molecole o di ioni. ChimicaGenerale_lezione7 71
72 * Quando una singola struttura di Lewis non riesce a descrivere correttamente la struttura elettronica reale, la molecola può essere descritta da più strutture con la stessa disposizione relativa degli atomi, ma diversa disposizione delle coppie di elettroni di valenza. * La struttura reale della molecola è un insieme o ibrido delle strutture di risonanza. ChimicaGenerale_lezione7 72
73 Eccezioni alla regola dell'ottetto Composti in cui un atomo ha meno di 8e - di valenza (B) Composti in cui un atomo ha più di 8e - di valenza (solo elementi non metalli da III periodo in poi: Si, P, S, Cl) Molecole con numero dispari di e - (radicali liberi) ChimicaGenerale_lezione7 73
74 Molecole carenti di elettroni ChimicaGenerale_lezione7 74
75 ChimicaGenerale_lezione7 75
76 Molecole con eccesso di elettroni SiF 5 - PF 5 SF 4 ClF 3 Dal III periodo abbiamo a disposizione gli orbitali d che danno modo di sistemare fino a 12 elettroni di valenza ChimicaGenerale_lezione7 76
77 Radicali In tutte le molecole e ioni visti finora, gli elettroni sono sempre appaiati, o in coppie solitarie o in legami covalenti. Esistono però specie chimiche che hanno numero di elettroni dispari, ed in cui quindi un elettrone rimane spaiato: queste specie sono dette radicali. ChimicaGenerale_lezione7 77
78 ChimicaGenerale_lezione7 78
Il legame chimico legame ionico
 Il legame chimico Il legame chimico è ciò che tiene insieme gli atomi. Esso si forma se l'insieme di atomi legati assume un energia minore di quella che avevano gli atomi isolati. Se il legame è realizzato
Il legame chimico Il legame chimico è ciò che tiene insieme gli atomi. Esso si forma se l'insieme di atomi legati assume un energia minore di quella che avevano gli atomi isolati. Se il legame è realizzato
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
LEGAMI CHIMICI e GEOMETRIA MOLECOLARE
 DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
Atomi e molecole. Gli atomi degli elementi si trovano in natura generalmente combinati tra loro in molecole o composti ionici
 IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Il legame chimico I: il legame covalente. Capitolo 9
 Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Tutorial per disegnare le struttura di LEWIS. Trattazione valida per le specie che rispettano le regola dell ottetto
 Tutorial per disegnare le struttura di LEWIS Trattazione valida per le specie che rispettano le regola dell ottetto Le formule di Lewis sono rappresentazioni bidimensionali delle formule di struttura che
Tutorial per disegnare le struttura di LEWIS Trattazione valida per le specie che rispettano le regola dell ottetto Le formule di Lewis sono rappresentazioni bidimensionali delle formule di struttura che
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
LEGAME CHIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici.
 LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
Legame covalente. H 1s un protone e un elettrone
 Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
Tutorial per disegnare le strutture di LEWIS. Trattazione valida per le specie che rispettano le regola dell ottetto
 Tutorial per disegnare le strutture di LEWIS Trattazione valida per le specie che rispettano le regola dell ottetto Gli step da seguire per la costruzione sono: 1. Conoscere lo scheletro della molecola
Tutorial per disegnare le strutture di LEWIS Trattazione valida per le specie che rispettano le regola dell ottetto Gli step da seguire per la costruzione sono: 1. Conoscere lo scheletro della molecola
LEGAME COVALENTE. ( Elettronegatività tra gli atomi < 2)
 LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 13-14 2010 Configurazioni elettroniche Descrizioni diverse Sistema periodico Configurazioni elettroniche Il modello
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 13-14 2010 Configurazioni elettroniche Descrizioni diverse Sistema periodico Configurazioni elettroniche Il modello
PROVA 1. Dati i composti con formula KBr e HClO 2 :
 PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
Trasformazioni chimiche:
 Il legame chimico 1 Trasformazioni chimiche Trasformazioni chimiche: Le sostanze si trasformano in altre sostanze aventi proprietà differenti (livello macroscopico). Le trasformazioni chimiche avvengono
Il legame chimico 1 Trasformazioni chimiche Trasformazioni chimiche: Le sostanze si trasformano in altre sostanze aventi proprietà differenti (livello macroscopico). Le trasformazioni chimiche avvengono
Approfondimenti capitolo 9 (Formule di Lewis) e capitolo 11 (interazioni intermolecolari
 Approfondimenti capitolo 9 (Formule di Lewis) e capitolo 11 (interazioni intermolecolari Scrivere le Strutture di Lewis 1. Disegna la struttura dello scheletro del composto posizionando gli atomi legati
Approfondimenti capitolo 9 (Formule di Lewis) e capitolo 11 (interazioni intermolecolari Scrivere le Strutture di Lewis 1. Disegna la struttura dello scheletro del composto posizionando gli atomi legati
Le sostanze chimiche prof. Matteo Scapellato
 1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
CHIMICA ORGANICA PER BIOTECNOLOGIE con esercitazioni di LABORATORIO D. Savoia
 CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
Configurazioni elettroniche e periodicità
 Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Massa atomica. Unità di massa atomica: 1/12 della massa del 12 C
 Massa atomica Unità di massa atomica: 1/12 della massa del 12 C Il peso atomico, o più correttamente la massa atomica dei vari elementi si riporta sotto forma di una media ponderata tra i vari isotopi
Massa atomica Unità di massa atomica: 1/12 della massa del 12 C Il peso atomico, o più correttamente la massa atomica dei vari elementi si riporta sotto forma di una media ponderata tra i vari isotopi
Introduzione alla chimica organica. 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole
 Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Chimica. Lezione 2 Il legame chimico Parte I
 Chimica Lezione 2 Il legame chimico Parte I GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUALVOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA CONDIZIONE
Chimica Lezione 2 Il legame chimico Parte I GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUALVOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA CONDIZIONE
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
IBRIDAZIONE e GEOMETRIA MOLECOLARE
 IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi
 LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
Legame chimico unità 1, modulo D del libro
 Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
ATOMO POLIELETTRONICO. Numero quantico di spin m s
 ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica. Mod. 1 CHIMICA. Mod. 2 CHIMICA FISICA.
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Configurazione elettronica e Tavola periodica. Lezioni 13-16
 Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
VERIFICA Dalla tavola periodica al modello atomico
 VERIFICA Dalla tavola periodica al modello atomico Cognome Nome Classe Data I/1 Vero o Falso? Scegli per ciascuna risposta l'alternativa corretta V F Nella tavola periodica ogni elemento è contrassegnato
VERIFICA Dalla tavola periodica al modello atomico Cognome Nome Classe Data I/1 Vero o Falso? Scegli per ciascuna risposta l'alternativa corretta V F Nella tavola periodica ogni elemento è contrassegnato
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
Numeri quantici. Numero quantico principale n: determina l'energia dell'elettrone e può assumere qualsiasi valore intero positivo.
 Numeri quantici Numero quantico principale n: determina l'energia dell'elettrone e può assumere qualsiasi valore intero positivo. n= 1, 2, 3,. Numero quantico del momento angolare : Determina la forma
Numeri quantici Numero quantico principale n: determina l'energia dell'elettrone e può assumere qualsiasi valore intero positivo. n= 1, 2, 3,. Numero quantico del momento angolare : Determina la forma
Le reazioni di ossido-riduzione
 Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici.
 I blocchi s, p, d ed f della Tavola Periodica 1 La tavola periodica La tavola periodica La tavola periodica Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici. Si possono
I blocchi s, p, d ed f della Tavola Periodica 1 La tavola periodica La tavola periodica La tavola periodica Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici. Si possono
TAVOLA PERIODICA. 118 elementi, di cui 92 presenti in natura
 TAVOLA PERIODICA 118 elementi, di cui 92 presenti in natura L ordine della tavola periodica: individuare un criterio per classificare gli elementi! L ordine della tavola periodica: individuare un criterio
TAVOLA PERIODICA 118 elementi, di cui 92 presenti in natura L ordine della tavola periodica: individuare un criterio per classificare gli elementi! L ordine della tavola periodica: individuare un criterio
Corso di CHIMICA INORGANICA
 Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Introduzione alla Chimica Organica V Ed.
 William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
Reazioni di ossido-riduzione
 Reazioni di ossido-riduzione Con reazioni di ossido riduzione si intende una vasta classe di reazioni che implicano un trasferimento elettronico più o meno evidente. Ad esempio il trasferimento elettronico
Reazioni di ossido-riduzione Con reazioni di ossido riduzione si intende una vasta classe di reazioni che implicano un trasferimento elettronico più o meno evidente. Ad esempio il trasferimento elettronico
Si possono distinguere tre tipi di legame con caratteristiche notevolmente diverse:
 LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
= Atomo di idrogeno (H) molecola dell idrogeno (H 2 )
 IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton),
 Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton), particelle subatomiche, protone, neutrone, elettronie, nucleo. 2. Decidi se tra
Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton), particelle subatomiche, protone, neutrone, elettronie, nucleo. 2. Decidi se tra
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
Gli elementi presenti in natura sono 120, di cui:
 Gli elementi presenti in natura sono 120, di cui: 92 naturali 18 prodotti artificialmente 4 incerti poiché non ne è stata provata l'esistenza a causa della loro brevissima vita 3 ipotetici 3 scoperti nel
Gli elementi presenti in natura sono 120, di cui: 92 naturali 18 prodotti artificialmente 4 incerti poiché non ne è stata provata l'esistenza a causa della loro brevissima vita 3 ipotetici 3 scoperti nel
Appunti di Stechiometria per Chimica Numero d ossidazione
 Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
TAVOLA PERIODICA. Lo strumento principe della chimica
 TAVOLA PRIODICA Lo strumento principe della chimica Classificazione degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile metalli non-metalli solidi (escluso mercurio)
TAVOLA PRIODICA Lo strumento principe della chimica Classificazione degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile metalli non-metalli solidi (escluso mercurio)
Quinta unità didattica. Tavola periodica
 Quinta unità didattica Tavola periodica Storia della Tavola periodica Il primo tentativo di ordinare gli elementi conosciuti si deve a Wolfgang Dobereiner nella prima metà dell Ottocento: egli rilevò
Quinta unità didattica Tavola periodica Storia della Tavola periodica Il primo tentativo di ordinare gli elementi conosciuti si deve a Wolfgang Dobereiner nella prima metà dell Ottocento: egli rilevò
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
Sistema, equilibrio e fase Tre concetti fondamentali. Spettro di massa del mercurio. Schema del funzionamento di uno spettrometro di massa
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare studio. Es.: un
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare studio. Es.: un
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 3-4 2010 Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 3-4 2010 Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
H 2 O 2 (aq) 2e - + O 2 (g) H + (aq) MnO 2 (s) +2e H + (aq Mn 2+ (aq) +2 H 2 O (l).
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Il Legame Ionico. Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B -
 Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 2 Numerazione gruppi tradizionale, n coincide con gli elettroni esterni
Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 2 Numerazione gruppi tradizionale, n coincide con gli elettroni esterni
Elementi di Chimica. Lezione 03
 Elementi di Chimica Lezione 03 Elementi atomi e molecole Come si è detto tutta la materia esistente in natura è costituita da 92 elementi. Tuttavia ben pochi di questi elementi si trovano in natura sotto
Elementi di Chimica Lezione 03 Elementi atomi e molecole Come si è detto tutta la materia esistente in natura è costituita da 92 elementi. Tuttavia ben pochi di questi elementi si trovano in natura sotto
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 9 Il sistema periodico 1. Verso il sistema periodico 2. La moderna tavola periodica 3. I simboli
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 9 Il sistema periodico 1. Verso il sistema periodico 2. La moderna tavola periodica 3. I simboli
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
La struttura di Lewis
 La struttura di Lewis Scritto dal Prof. Lombardo Per disegnare la struttura delle molecole uno dei sistemi che preferisco è il metodo di Lewis. Spesso però vedo che gli studenti hanno notevoli difficoltà,
La struttura di Lewis Scritto dal Prof. Lombardo Per disegnare la struttura delle molecole uno dei sistemi che preferisco è il metodo di Lewis. Spesso però vedo che gli studenti hanno notevoli difficoltà,
LE REAZIONI DI OSSIDO-RIDUZIONE O REAZIONI REDOX
 LE REAZIONI DI OSSIDO-RIDUZIONE O REAZIONI REDOX Sono delle reazioni chimiche in cui si ha trasferimento di elettroni da una specie riducente che si ossida ad un altra specie ossidante, che si riduce:
LE REAZIONI DI OSSIDO-RIDUZIONE O REAZIONI REDOX Sono delle reazioni chimiche in cui si ha trasferimento di elettroni da una specie riducente che si ossida ad un altra specie ossidante, che si riduce:
Capitolo 9 Il sistema periodico
 Capitolo 9 Il sistema periodico 1. La classificazione degli elementi 2. Il sistema periodico di Mendeleev 3. La moderna tavola periodica 4. I simboli di Lewis 5. Le proprietà periodiche 6. Metalli, non
Capitolo 9 Il sistema periodico 1. La classificazione degli elementi 2. Il sistema periodico di Mendeleev 3. La moderna tavola periodica 4. I simboli di Lewis 5. Le proprietà periodiche 6. Metalli, non
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
VERIFICA La struttura della materia: atomi e molecole
 ERIICA La struttura della materia: atomi e molecole Cognome Nome Classe Data I/1 ero o falso? La massa atomica indica quanti neutroni sono presenti nel nucleo La massa atomica indica la massa in grammi
ERIICA La struttura della materia: atomi e molecole Cognome Nome Classe Data I/1 ero o falso? La massa atomica indica quanti neutroni sono presenti nel nucleo La massa atomica indica la massa in grammi
PROF. ALFONSO ANGUILLA ELEMENTI DI CHIMICA: I MATTONI DELLA MATERIA
 http://www.youtube.com/watch?v=q4ki1fa4yj0 PROF. ALFONSO ANGUILLA ELEMENTI DI CHIMICA: I MATTONI DELLA MATERIA 1 Gli elettroni ruotano intorno al nucleo, trattenuti dalla loro carica elettrica negativa,
http://www.youtube.com/watch?v=q4ki1fa4yj0 PROF. ALFONSO ANGUILLA ELEMENTI DI CHIMICA: I MATTONI DELLA MATERIA 1 Gli elettroni ruotano intorno al nucleo, trattenuti dalla loro carica elettrica negativa,
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
