delle interazioni accoppiate dell intorno dei due atomi nell ambito della molecola.
|
|
|
- Ornella Arcuri
- 7 anni fa
- Visualizzazioni
Transcript
1 FATTORI CHE INFLUENZANO LA FREQUANZA DI ASSORBIMENTO Torniamo ora alla legge di Hooke: : abbiamo detto che questa relazione ci permette di conoscere la frequenza alla quale assorbirà un oscillatore di tipo X Y. Tuttavia bisogna anche tenere conto : delle interazioni accoppiate dell intorno dei due atomi nell ambito della molecola. Analizziamo quindi i diversi fattori che determinano una variazione del valore della frequenza di assorbimento di un gruppo rispetto al valore teorico. 1
2 FATTORI CHE INFLUENZANO LA FREQUANZA DI ASSORBIMENTO effetto induttivo ed effetto mesomerico coniugazione effetti di tensione sterica FATTORI INTERNI ALLA MOLECOLA ibridazione formazione di legami idrogeno stato fisico del campione effetto del solvente FATTORI ESTERNI ALLA MOLECOLA 2
3 1. EFFETTO INDUTTIVO ED EFFETTO MESOMERICO Fattori che influenzano la frequenza di assorbimento Consideriamo ora la serie del gruppo C=O,, prendendo come valore di riferimento 1715 cm - 1, il valore di assorbimento del carbonile chetonico: Aumento dell effetto mesomerico Aumento dell effetto induttivo Rispetto al valore di assorbimento del carbonile chetonico,, vediamo che la banda di stretching del C=O dipende da: effetti induttivo effetto di risonanza (mesomerico( mesomerico) coniugazione 3
4 Fattori che influenzano la frequenza di assorbimento Nei composti carbonilici,, fatta eccezione per la formaldeide, R è normalmente un gruppo in grado di esercitare effetti induttivi e/o mesomerici O R R' 4
5 Fattori che influenzano la frequenza di assorbimento 1.1 Effetto induttivo eletronattrattore Se escludiamo i chetoni, in cui R ha solo un debole effetto induttivo di tipo elettrondonatore,, in tutti questi composti l'effetto induttivo è di tipo elettronattrattore: riduce il legame C=O e determina, quindi, un aumento della frequenza vibrazionale del gruppo C=O. Negli esteri prevale l effetto induttivo elettronattrattore,, e quindi ciò riduce la lunghezza del legame C=O. 5
6 1.2 Effetto mesomerico eletrondonatore Fattori che influenzano la frequenza di assorbimento Al contrario, l'effetto mesomerico è sempre elettrondonatore: aumenta la lunghezza del legame C=O e determina una diminuzione della frequenza vibrazionale... A A + C O O cm -1 (chetone) ν. A = elettrondonatore R più basse 6
7 Fattori che influenzano la frequenza di assorbimento Negli acidi e nelle ammidi l'effetto mesomerico prevale sull'effetto induttivo. La separazione di carica fa perdere la natura di doppio legame del C=O e questo fa diminuire il valore della costante di forza e diminuire la frequenza di assorbimento. Nel caso dell acido però si ha una carica positiva sull ossigeno,, che mal tollera una carenza di elettroni; questo farebbe prevalere la natura di doppio legame, determinando un aumento della costante di forza e quindi della frequenza di assorbimento! 7
8 Fattori che influenzano la frequenza di assorbimento La frequenza di stretching del gruppo C=O degli alogenuri acilici è superiore a quella dei chetoni.. Negli alogenuri acilici l'effetto induttivo prevale su quello mesomerico; Aumento dell effetto mesomerico Aumento dell effetto induttivo Esteri ed acidi avranno infine valori intermedi risentendo del contributo di entrambi di effetti. 8
9 Fattori che influenzano la frequenza di assorbimento 3. Coniugazione la coniugazione produce una delocalizzazione degli elettroni π, π riducendo il carattere di doppio legame,, e quindi spostando le frequenze a valori più bassi di circa cm -1 Nei composti carbonilici α,β-insaturi la coniugazione determina una diminuzione del carattere di doppio legame di entrambi i gruppi funzionali coniugati (C=O e C=C) con conseguente diminuzione del valore delle relative frequenze vibrazionali. 9
10 Fattori che influenzano la frequenza di assorbimento Le stesse considerazioni si possono fare anche quando il gruppo carbonilico è coniugato con un anello aromatico: se la frequenza di stretching tipica di un chetone dialchilico è 1715 cm - 1, quella di un chetone alchilarilico è 1680 cm - 1. O R 1680 cm
11 Fattori che influenzano la frequenza di assorbimento 4. Effetti di tensione d anello In composti con isomeri ramificati o ciclici la tensione dell angolo di legame è variabile, e questo si ripercuote sulla forza di legame. Al crescere della tensione, la frequenza di assorbimento si sposta verso valori maggiori. La variazione del valore dell'angolo di legame provocherà una variazione nell'ibridazione del carbonio. La percentuale con cui gli orbitali p e s entrano nell'orbitale ibrido determina la lunghezza del legame e quindi la frequenza di stretching del legame stesso. Negli alcani lineari, gli orbitali degli atomi di carbonio hanno sempre ibridazione sp 3, mentre nei cicloalcani l'ibridazione dipende dalle dimensioni del ciclo. L'aumento della la componente s nei legami C-H C H provoca un accorciamento del legame e, quindi, 11 un aumento della frequenza di stretching.
12 Fattori che influenzano la frequenza di assorbimento La tensione d'anello determina un aumento della componente p negli orbitali ibridi che formano i legami C-C del ciclo, mentre aumenta la componente s negli orbitali che formano i legami C-H ed il doppio legame carbonio-carbonio. carbonio. Il legame C=C diviene quindi più corto e la frequenza vibrazionale aumenta al diminuire della dimensione del ciclo. Effetti del tutto analoghi si osservano per r il legame C=O nei chetoni ciclici e negli esteri ciclici (lattoni( lattoni). 12
13 Fattori che influenzano la frequenza di assorbimento 5. L Ibridizzazione influenza la frequenza di assorbimento C-H: C-C-H 2900 cm -1 C=C H 3100 cm -1 C C-H 3300 cm -1 il legame Csp 3 H ha minor carattere s ed è quindi più lungo il legame Csp 2 H il legame Csp H ha maggior carattere s ed è quindi più corto l'orbitale s è di geometria sferica, a differenza dell'orbitale p che presenta una simmetria bilobale,, direzionale allungata. Nel legame C-H di un alchino si sovrappongono l orbitale sp del carbonio (che ha un forte carattere s) con l orbitale s dell idrogeno Il legame C-H risulta essere più corto e dunque più forte (cioè con energia di legame superiore) rispetto a quello di un -C-H ibridato sp 3 e di un =C-H= ibridato sp 2 (che hanno minore carattere s) 13
14 Riassumendo abbiamo che: Fattori che influenzano la frequenza di assorbimento l effetto induttivo riduce la lunghezza del legame C=O: aumenta la costante di forza e la frequenza di assorbimento l effetto mesomerico aumenta la lunghezza del legame C=O e riduce la frequenza la coniugazione (O=C C=C C=C )) produce una delocalizzazione degli elettroni π di entrambi gruppi insaturi, riducendo il carattere di doppio legame del C=O L ibridazione. Un n maggior carattere s riduce la lunghezza del legame: aumenta la costante di forza e la frequenza di assorbimento 14
15 6. LEGAME IDROGENO Fattori che influenzano la frequenza di assorbimento Il legame idrogeno si forma in qualsiasi sistema contenente un gruppo g donatore di protoni (X H)( ) e un gruppo accettore Y X-H.. Y Sia X che Y sono elementi elettronegativi, e Y possiede un doppietto elettronico non condiviso. Gruppi donatori X carbossili, ossidrili, ammine, ammidi Gruppi accettori Y ossigeno,, azoto, alogeni.. O H O
16 Fattori che influenzano la frequenza di assorbimento Il legame idrogeno modifica la COSTANTE DI FORZA K di entrambi i gruppi, perciò vengono alterate le frequenze di vibrazione. Si osserva uno spostamento dello stretching del X-H X H a frequenze più basse,, dovuto ad un indebolimento del legame, cosa che porta a bande più intense e allargate. X-H Y H 3650 cm cm -1 16
17 Fattori che influenzano la frequenza di assorbimento Le molecole all interno di un campione possono instaurare dei legami FRA DI LORO,, e in particolare possono formare dei legami idrogeno, sia intermolecolari (come accade nel caso degli acidi carbossilici), ci), sia intramolecolari. 6.1 LEGAME IDROGENO INTERMOLECOLARE Il legame idrogeno intermolecolare comporta l'associazione di due e o più molecole dello stesso composto. Il legame intermolecolare può produrre specie dimeriche (es. acidi carbossilici) R O H N R N R H O R Ammide secondaria cis 17
18 6.2 LEGAME IDROGENO INTRAMOLECOLAR MOLECOLARE Fattori che influenzano la frequenza di assorbimento I legami idrogeno intramolecolari si formano quando il donatore di protone e l'accettore sono presenti nella stessa molecola in condizioni spaziali che permettano la necessaria sovrapposizione degli orbitali con, per esempio, formazione di un anello a cinque o sei atomi. H 3 C O H O o-idrossiacetofenone L'effetto della concentrazione sui legami idrogeno intermolecolari ri e intramolecolari è molto differente: Il legame idrogeno intramolecolare si conserva anche a basse concentrazioni, essendo un fenomeno interno alla molecola. 18
19 Fattori che influenzano la frequenza di assorbimento L'effetto della concentrazione sui legami idrogeno intermolecolari ri e intramolecolari è molto differente: Le bande che derivano da legami idrogeno intermolecolari scompaiono generalmente a basse concentrazioni (al di sotto di circa 0.01 M nei solventi non polari) (A). Il legame idrogeno intramolecolare si conserva anche a basse concentrazioni, essendo un fenomeno interno alla molecola (B). A B H 0,03 M 1 M 0,03 M 1 M 19
20 20
21 Fattori che influenzano la frequenza di assorbimento 6.3. STATO FISICO DEL CAMPIONE (modifica la forma delle bande) L effetto dovuto allo stato fisico del campione può essere compreso tenendo conto del fatto che gli spettri IR sono spettri vibro-rotazionali rotazionali e sono perciò influenzati non solo dal comportamento vibrazionale delle molecole, ma anche da quello rotazionale. Le sostanze allo stato gassoso hanno un elevata libertà di movimento e lo spettro IR permette di valutarne la struttura rotazionale fine. Passando allo stato condensato gli spettri appaiono più semplici perché la struttura rotazionale fine viene perduta.. Nei solidi non avvengono rotazioni e nei liquidi le molecole si urtano prima di aver compiuto una rotazione completa. 21
22 7. SOLVENTE Fattori che influenzano la frequenza di assorbimento Le interazioni soluto-solvente solvente possono rendere lo spettro di una sostanza registrato in soluzione sensibilmente diverso da quello della stessa sostanza registrato allo stato puro. Per questo motivo si utilizzano solventi quanto più possibile inerti. Un solvente polare può formare un legame ad idrogeno tra la porzione che possiede una densità di carica negativa maggiore (cioè l'atomo più elettronegativo) e l'idrogeno acido. 22
23 L'effetto del solvente polare sul carbonile porterà ad una diminuzione del numero d'onda dovuto all'indebolimento del legame C=O causato dal ponte a idrogeno. Lo stiramento dell'idrogeno acido del fenilacetilene si trova a frequenze minori in soluzione eterea,, per formazione di legami di idrogeno che provocano un leggero allungamento del legame C-H. C C 6 H 5 -C C-H O(C 2 H 5 ) 23
24 Gli ac.. Carbossilici e gli alcoli possono formare legami idrogeno con eteri (diossano( o THF) ) mostrando l assorbimento dell OH associato. 24
25 L INTENSITA DEL SEGNALE 25
26 ordinate 26
27 L intensità di una banda di assorbimento corrisponde all altezza del picco. Dipende dalla probabilità che avvenga la transizione che provoca l'assorbimento. In base alla loro intensità le bande vengono classificate : forti (s, strong) medie (m, medium) deboli (w, weak) Intensità di un assorbimento IR 27
28 Intensità di un assorbimento IR La intensità di un assorbimento IR dipende dalla entità della variazione del momento dipolare provocata dalla vibrazione. (grande variazione del momento dipolare = intensità maggiore) Variazione del momento dipolare = Variazione della distribuzione della carica. Maggiore è la variazione della distribuzione della carica più forte è l assorbimento 28
29 Legami polarizzati Sono intensi gli assorbimenti relativi a vibrazione di legami polarizzati Ad es. il carbonile (C=O) è un gruppo polare il cui momento dipolo può variare sensibilmente e per questo genera bande di assorbimento intense C=O Maggiore è la polarità del legame, tanto maggiore è l intensità 29 dell assorbimento.
30 LA FORMA delle BANDE DI ASSORBIMENTO 30
31 Le bande IR possono essere di due forme: strette (sharp( sharp) larghe (broad( broad) La forma è legata all interazione del gruppo funzionale con l intorno; gruppo funzionale isolato = banda stretta gruppo funzionale con forti interazioni = banda larga 31
32 La forma delle bande dipende, tra l'altro, dall'unità scelta per la registrazione dello spettro: lunghezza d'onda o numero d'onda. Gli spettri del polistirene sotto riportati mostrano come cambia l aspetto delle bande, soprattutto nella zona dell impronta digitale. 32
33 Spettroscopia IR RIEPILOGO 33
34 Massa degli atomi Masse, ν C-H C-C C-O C-Cl C-Br C-I cm -1 Forza di legame: ( k, forza, ν) C-C C=C C C cm -1 34
35 Ibridazione: (sp > sp2 > sp3) C-H(sp) C-H(sp2) C-H(sp3) cm-1 Risonanza: (la coniugazione abbassa l energia di vibrazione) Chetoni isolati chetoni α,β-insaturi chetoni α,β,γ,δ-insaturi cm -1 35
CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO. Fig. 4
 CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO Fig. 4 1 E PERCE BANDE E NON RIGE? E 3 Nell pratica : E 2 E 1 E 0 4000 600 cm -1 4000 600 cm -1 Tra 2 livelli vibrazionali puliti Sottolivelli rotazionali 2
CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO Fig. 4 1 E PERCE BANDE E NON RIGE? E 3 Nell pratica : E 2 E 1 E 0 4000 600 cm -1 4000 600 cm -1 Tra 2 livelli vibrazionali puliti Sottolivelli rotazionali 2
Assorbimenti di alcani (stretching. Corso Metodi Fisici in Chimica Organica Prof. Renzo LUISI Uniba. vietata la vendita
 Assorbimenti di alcani (stretching C-H) Corso Metodi Fisici in Chimica rganica Prof. Renzo LUISI Uniba. vietata la vendita Analisi di spettri: ALCANI (C-H) 4000 3500 3000 2500 2000 1500 1300 1000 700 500
Assorbimenti di alcani (stretching C-H) Corso Metodi Fisici in Chimica rganica Prof. Renzo LUISI Uniba. vietata la vendita Analisi di spettri: ALCANI (C-H) 4000 3500 3000 2500 2000 1500 1300 1000 700 500
L ONDA ELETTROMAGNETICA UNITA DI MISURA E DEFINIZIONI. ν ν. λ =
 IR: Teoria Campo elettrico L ONDA ELETTROMAGNETICA Lunghezza d onda Direzione di propagazione Campo magnetico Lunghezza d onda (cm) Numero d onda (cm -1 ) UNITA DI MISURA E DEFINIZIONI c λ = ν ν ν = =
IR: Teoria Campo elettrico L ONDA ELETTROMAGNETICA Lunghezza d onda Direzione di propagazione Campo magnetico Lunghezza d onda (cm) Numero d onda (cm -1 ) UNITA DI MISURA E DEFINIZIONI c λ = ν ν ν = =
Bassa Energia Alta Energia
 L assorbimento di fotoni causa variazioni nelle vibrazioni molecolari hν Bassa Energia Alta Energia Vibrazioni Molecolari Atomi legati si muovono nello spazio Un ciclo vibrazionale ogni ~10-15 secondi
L assorbimento di fotoni causa variazioni nelle vibrazioni molecolari hν Bassa Energia Alta Energia Vibrazioni Molecolari Atomi legati si muovono nello spazio Un ciclo vibrazionale ogni ~10-15 secondi
INTERPRETAZIONE DEGLI SPETTRI IR
 INTERPRETAZIONE DEGLI SPETTRI IR Anche se non esistono gruppi di regole per la interpretazione completa degli spettri infrarossi, si è trovato che possono essere utili alcune linee-guida generali. 1. Cominciare
INTERPRETAZIONE DEGLI SPETTRI IR Anche se non esistono gruppi di regole per la interpretazione completa degli spettri infrarossi, si è trovato che possono essere utili alcune linee-guida generali. 1. Cominciare
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
Lezione n. 26. Principi generali della spettroscopia IR. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 26 Principi generali della spettroscopia IR 02/03/2008 Antonino Polimeno 1 Spettroscopia infrarossa (1) - La spettroscopia infrarossa studia
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 26 Principi generali della spettroscopia IR 02/03/2008 Antonino Polimeno 1 Spettroscopia infrarossa (1) - La spettroscopia infrarossa studia
Informazioni che si possono ricavare da uno spettro protonico
 Informazioni che si possono ricavare da uno spettro protonico Per interpretare uno spettro 1 H NMR bisogna: 1) Contare il numero di picchi che corrispondono agli idrogeni fisicamente diversi nella molecola.
Informazioni che si possono ricavare da uno spettro protonico Per interpretare uno spettro 1 H NMR bisogna: 1) Contare il numero di picchi che corrispondono agli idrogeni fisicamente diversi nella molecola.
H, banda allargata) Stretching C-OC Scarso valore diagnostico
 ALCOLI Il gruppo funzionale O-H che caratterizza gli alcoli è di rapida identificazione nello spettro IR. La banda di assorbimento associata a questa funzione risulta generalmente larga e intensa tra 3000-3700
ALCOLI Il gruppo funzionale O-H che caratterizza gli alcoli è di rapida identificazione nello spettro IR. La banda di assorbimento associata a questa funzione risulta generalmente larga e intensa tra 3000-3700
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
ACIDI CARBOSSILICI Gli acidi carbossilici presentano tre bande caratteristiche dovute al gruppo funzionale COOH
 ACIDI CABOSSILICI Gli acidi carbossilici presentano tre bande caratteristiche dovute al gruppo funzionale COOH OH C O Presenta infatti le bande di assorbimento caratteristiche dei due gruppi: C=O e OH
ACIDI CABOSSILICI Gli acidi carbossilici presentano tre bande caratteristiche dovute al gruppo funzionale COOH OH C O Presenta infatti le bande di assorbimento caratteristiche dei due gruppi: C=O e OH
L ONDA ELETTROMAGNETICA UNITA DI MISURA E DEFINIZIONI. ν ν. λ =
 IR: Teoria L ONDA ELETTROMAGNETICA Campo elettrico Lunghezza d onda Direzione di propagazione Campo magnetico Lunghezza d onda (cm) Numero d onda (cm -1 ) UNITA DI MISURA E DEFINIZIONI c λ = ν ν ν = =
IR: Teoria L ONDA ELETTROMAGNETICA Campo elettrico Lunghezza d onda Direzione di propagazione Campo magnetico Lunghezza d onda (cm) Numero d onda (cm -1 ) UNITA DI MISURA E DEFINIZIONI c λ = ν ν ν = =
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
LO SPETTRO ELETTROMAGNETICO
 LO SPETTRO ELETTROMAGNETICO cresce cresce Raggi γ Raggi X UV IR Micio onde Onde radio Medio corte medie lunghe Processo: Eccitazione dei nuclei atomici Lontano Vicino Lontano Transizione degli e-interni
LO SPETTRO ELETTROMAGNETICO cresce cresce Raggi γ Raggi X UV IR Micio onde Onde radio Medio corte medie lunghe Processo: Eccitazione dei nuclei atomici Lontano Vicino Lontano Transizione degli e-interni
Proprietà della Radiazione Elettromagnetica
 Proprietà della Radiazione Elettromagnetica La radiazione elettromagnetica è composta da un campo elettrico e un campo magnetico in fase tra di loro. Tutti i tipi di spettroscopia comportano un interazione
Proprietà della Radiazione Elettromagnetica La radiazione elettromagnetica è composta da un campo elettrico e un campo magnetico in fase tra di loro. Tutti i tipi di spettroscopia comportano un interazione
Metodi spettroscopici
 Metodi spettroscopici I metodi spettroscopici sono tecniche sperimentali basate sull interazione tra energia e materia per la determinazione di proprietà fisiche e chimiche. Metodi spettroscopici L interazione
Metodi spettroscopici I metodi spettroscopici sono tecniche sperimentali basate sull interazione tra energia e materia per la determinazione di proprietà fisiche e chimiche. Metodi spettroscopici L interazione
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
La radiazione infrarossa si trova nella parte dello spettro elettromagnetico tra le regioni del visibile e delle microonde. La porzione di maggiore
 La radiazione infrarossa si trova nella parte dello spettro elettromagnetico tra le regioni del visibile e delle microonde. La porzione di maggiore interesse per la spettroscopia IR è quella compresa tra
La radiazione infrarossa si trova nella parte dello spettro elettromagnetico tra le regioni del visibile e delle microonde. La porzione di maggiore interesse per la spettroscopia IR è quella compresa tra
MAGGIORE È LA COSTANTE DI FORZA K, MAGGIORE È LA FREQUENZA DI ASSORBIMENTO MAGGIORE È LA MASSA RIDOTTA, MINORE È LA FREQUENZA
 Spettroscopia IR Spettroscopia IR La spettroscopia infrarossa (IR) utilizza la regione dello spettro elettromagnetico compresa 0,78 µm (limite del visibile) e 100 µm di lunghezza d onda. IR vicino (NIR)
Spettroscopia IR Spettroscopia IR La spettroscopia infrarossa (IR) utilizza la regione dello spettro elettromagnetico compresa 0,78 µm (limite del visibile) e 100 µm di lunghezza d onda. IR vicino (NIR)
Spettroscopia infrarossa
 Spettroscopia infrarossa Utilizzata per studiare i livelli vibrazionali nelle molecole Energie in gioco: 5000-200 cm -1 (corrispondono a 2000-50000 nm), Il coefficiente di estinzione è circa di un ordine
Spettroscopia infrarossa Utilizzata per studiare i livelli vibrazionali nelle molecole Energie in gioco: 5000-200 cm -1 (corrispondono a 2000-50000 nm), Il coefficiente di estinzione è circa di un ordine
ESERCIZI SPETTROMETRIA DI MASSA
 ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
7.11 Assorbimento UV/visibile dei composti organici
 2 7.11 Assorbimento UV/visibile dei composti organici Alcani e cicloalcani Le molecole degli alcani contengono solo legami C-C e C-H e quindi le uniche transizioni possibili sono del tipo s s*. Queste
2 7.11 Assorbimento UV/visibile dei composti organici Alcani e cicloalcani Le molecole degli alcani contengono solo legami C-C e C-H e quindi le uniche transizioni possibili sono del tipo s s*. Queste
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
Spettroscopia. 05/06/14 SPET.doc 0
 Spettroscopia 05/06/14 SPET.doc 0 Spettroscopia Analisi del passaggio di un sistema da uno stato all altro con scambio di fotoni Spettroscopia di assorbimento Spettroscopia di emissione: In entrambi i
Spettroscopia 05/06/14 SPET.doc 0 Spettroscopia Analisi del passaggio di un sistema da uno stato all altro con scambio di fotoni Spettroscopia di assorbimento Spettroscopia di emissione: In entrambi i
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1
 CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Lezione n. 20. Visibile. La spettroscopia UV/Visibile. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 20 Principi generali delle spettroscopie ottiche La spettroscopia UV/Visibile Visibile Antonino Polimeno 1 Spettroscopie ottiche (1) - Le tecniche di misura
Chimica Fisica Biotecnologie sanitarie Lezione n. 20 Principi generali delle spettroscopie ottiche La spettroscopia UV/Visibile Visibile Antonino Polimeno 1 Spettroscopie ottiche (1) - Le tecniche di misura
SPETTROFOTOMETRIA IR
 SPETTROFOTOMETRIA IR Spettrofotometria IR La spettrofotometria IR si basa sull'assorbimento, da parte di molecole o più in generale di composti, delle radiazioni con lunghezze d'onda comprese fra 0,78
SPETTROFOTOMETRIA IR Spettrofotometria IR La spettrofotometria IR si basa sull'assorbimento, da parte di molecole o più in generale di composti, delle radiazioni con lunghezze d'onda comprese fra 0,78
I composti organici. Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H)
 I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
Identificazione di un composto organico:
 Identificazione di un composto organico: Laboratorio di Chimica Organica II? O O NO 2 Identificazione di un composto organico: Laboratorio di Chimica Organica II? Analisi elementare: formula bruta (C x
Identificazione di un composto organico: Laboratorio di Chimica Organica II? O O NO 2 Identificazione di un composto organico: Laboratorio di Chimica Organica II? Analisi elementare: formula bruta (C x
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Identificazione di un composto organico:
 Identificazione di un composto organico: Laboratorio di Chimica Organica II Analisi elementare: formula bruta (C x H y O z N x )? Analisi cromatografica: purezza, confronto con campioni noti Punto di fusione:
Identificazione di un composto organico: Laboratorio di Chimica Organica II Analisi elementare: formula bruta (C x H y O z N x )? Analisi cromatografica: purezza, confronto con campioni noti Punto di fusione:
PROPRIETA FISICHE DEI COMPOSTI ORGANICI
 PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
Composti carbonilici Acidi carbossilici
 Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
SPETTROSCOPIA UV-VIS LEZIONE 9
 SPETTROSCOPIA UV-VIS LEZIONE 9 RADIAZIONE ELETTROMAGNETICA La radiazione elettromagnetica è la propagazione nello spazio e nel tempo dell energia elettromagnetica tramite onde e corpuscoli. natura ondulatoria:
SPETTROSCOPIA UV-VIS LEZIONE 9 RADIAZIONE ELETTROMAGNETICA La radiazione elettromagnetica è la propagazione nello spazio e nel tempo dell energia elettromagnetica tramite onde e corpuscoli. natura ondulatoria:
PIANO DELLE UDA Terzo Anno
 ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Terzo Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Rappresentare una
ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Terzo Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Rappresentare una
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Aromaticità. Addizione elettrofila alcheni
 Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Teoria degli orbitali. Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale.
 Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Spettroscopia infrarossa
 La radiazione infrarossa si riferisce, in generale, a quella parte dello spettro elettromagnetico che si trova tra le regioni del visibile e delle microonde. In particolare dividiamo questa zona in: IR
La radiazione infrarossa si riferisce, in generale, a quella parte dello spettro elettromagnetico che si trova tra le regioni del visibile e delle microonde. In particolare dividiamo questa zona in: IR
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
IBRIDAZIONE DEL CARBONIO NEGLI ALCANI PREMESSA: COSA SONO GLI ORBITALI IBRIDI.
 ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Esercizi di identificazione di composti incogniti via IR Incognito n.1: formula bruta C 9 H 12
 Esercizi di identificazione di composti incogniti via IR Incognito n.1: formula bruta C 9 H 12 COMMENTATI 1 6 2 4 3 5 Dalla f. b. U=4: aromatico? 1. stiramneto Csp 2 -H (>3000 cm -1 ) 2. stiramento Csp
Esercizi di identificazione di composti incogniti via IR Incognito n.1: formula bruta C 9 H 12 COMMENTATI 1 6 2 4 3 5 Dalla f. b. U=4: aromatico? 1. stiramneto Csp 2 -H (>3000 cm -1 ) 2. stiramento Csp
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a
 Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a formare lo scheletro della molecola, mentre gli atomi di
Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a formare lo scheletro della molecola, mentre gli atomi di
Addizioni nucleofile. Addizioni a C=O
 Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA
 INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
IBRIDAZIONE. MODELLO DELL ORBITALE di LEGAME
 IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi dondi@unipv.it Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
Introduzione alla chimica organica Daniele Dondi dondi@unipv.it Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
COMPOSTI AROMATICI. Formula C 6 H 6
 COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
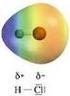 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi dondi@unipv.it 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
Introduzione alla chimica organica Daniele Dondi dondi@unipv.it 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Introduzione alla Chimica Organica V Ed.
 William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
Acidi carbossilici e derivati
 Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
ORBITA ORBIT LI ALI MOLECOLARI
 ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
Composti Carbossilici. Acidi Carbossilici
 Composti Carbossilici Acidi Carbossilici ACIDI CARBSSILICI Gli acidi carbossilici sono caratterizzati dalla presenza del gruppo carbonilico legato ad un gruppo idrossilico R C Il gruppo carbossilico viene
Composti Carbossilici Acidi Carbossilici ACIDI CARBSSILICI Gli acidi carbossilici sono caratterizzati dalla presenza del gruppo carbonilico legato ad un gruppo idrossilico R C Il gruppo carbossilico viene
ACIDI CARBOSSILICI. ac. formico ac. acetico ac. benzoico
 ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche I primi termini della serie sono liquidi incolori
ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche I primi termini della serie sono liquidi incolori
Lezione n. 22. Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi
 LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
ACIDI e BASI: evoluzione del concetto
 ACIDI E BASI ACIDI e BASI: evoluzione del concetto Acidi e basi di Arrhenius Gli acidi sono composti che, in soluzione acquosa, si dissociano liberando ioni H +. Esempi: HCl, H 2 SO 4, HI, H 3 PO 4 Le
ACIDI E BASI ACIDI e BASI: evoluzione del concetto Acidi e basi di Arrhenius Gli acidi sono composti che, in soluzione acquosa, si dissociano liberando ioni H +. Esempi: HCl, H 2 SO 4, HI, H 3 PO 4 Le
Alcani. Es. CH 3 CH 2 CH 2 CH 3
 Alcani Gli alcani sono i composti organici più semplici costituiti solo da atomi di e di (Idrocarburi); Sono composti saturi poiché ogni atomo di carbonio è legato al numero massimo possibile (4) di altri
Alcani Gli alcani sono i composti organici più semplici costituiti solo da atomi di e di (Idrocarburi); Sono composti saturi poiché ogni atomo di carbonio è legato al numero massimo possibile (4) di altri
ACIDI E BASI ORGANICI: pka e ph
 Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
FENOLI: nomenclatura IUPAC
 FENOLI, AMMINE ed ENAMMINE FENOLI: nomenclatura IUPAC I fenoli sono composti la cui caratteristica strutturale è quella di possedere un gruppo idrossile ( OH) legato a un anello benzenico. Il sistema it
FENOLI, AMMINE ed ENAMMINE FENOLI: nomenclatura IUPAC I fenoli sono composti la cui caratteristica strutturale è quella di possedere un gruppo idrossile ( OH) legato a un anello benzenico. Il sistema it
A.A Laboratorio 3 - Esercizio
 Laboratorio 3 Studio del dimero dell acqua A.A. 2007-08 08! " 1 Laboratorio 3 - Esercizio 1) Ottimizzazione della geometria e calcolo delle frequenze vibrazionali della molecola di acqua Confronto con
Laboratorio 3 Studio del dimero dell acqua A.A. 2007-08 08! " 1 Laboratorio 3 - Esercizio 1) Ottimizzazione della geometria e calcolo delle frequenze vibrazionali della molecola di acqua Confronto con
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Cos è la chimica organica
 Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
Chimica Organica. Studio dei composti del CARBONIO
 Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
REGOLE DELLA RISONANZA
 REGOLE DELLA RISONANZA 1. Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di C con cinque valenze 2. La posizione dei nuclei DEVE
REGOLE DELLA RISONANZA 1. Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di C con cinque valenze 2. La posizione dei nuclei DEVE
Forze intermolecolari
 Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
NMR e Fenomeni Dinamici
 NMR e Fenomeni Dinamici L NMR è molto utile per lo studio di fenomeni dinamici come equilibri, scambi intere intramolecolari,, studi conformazionali,, isomerizzazioni configurazionali etc. Alla base dell
NMR e Fenomeni Dinamici L NMR è molto utile per lo studio di fenomeni dinamici come equilibri, scambi intere intramolecolari,, studi conformazionali,, isomerizzazioni configurazionali etc. Alla base dell
Legame covalente. H 1s un protone e un elettrone
 Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Capitolo 24 Dai gruppi funzionali ai polimeri
 Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
10.9 ANALISI QUALITATIVA. 10.9.1 Fattori che influenzano la posizione di l max
 2 10.9 ANALISI QUALITATIVA 26 Ovviamente le transizioni proibite dalle regole di selezione non danno luogo ad assorbimento o comunque danno bande di bassissima intensità. 27 Nella figura non compaiono
2 10.9 ANALISI QUALITATIVA 26 Ovviamente le transizioni proibite dalle regole di selezione non danno luogo ad assorbimento o comunque danno bande di bassissima intensità. 27 Nella figura non compaiono
L effetto del sostituente (induttivo e coniugativo) modifica:
 L effetto del sostituente (induttivo e coniugativo) modifica: 1 la densità elettronica del centro di reazione influenza la REATTIVITA Se da un atomo di ad un altro cambia la distribuzione degli elettroni
L effetto del sostituente (induttivo e coniugativo) modifica: 1 la densità elettronica del centro di reazione influenza la REATTIVITA Se da un atomo di ad un altro cambia la distribuzione degli elettroni
Spettroscopia IR. Spettroscopia IR
 Spettroscopia IR Spettroscopia IR Spettroscopia IR La radiazione infrarossa (e in particolar modo quella nel vicino IR) può essere assorbita dalle molecole e convertita in Energia Vibrazionale. Gli atomi
Spettroscopia IR Spettroscopia IR Spettroscopia IR La radiazione infrarossa (e in particolar modo quella nel vicino IR) può essere assorbita dalle molecole e convertita in Energia Vibrazionale. Gli atomi
Chimica Organica. In passato, i composti chimici erano suddivisi in due grandi gruppi,
 Chimica Organica In passato, i composti chimici erano suddivisi in due grandi gruppi, inorganici e organici, in base alla loro origine. La chimica organica diveniva così la chimica dei composti del carbonio.
Chimica Organica In passato, i composti chimici erano suddivisi in due grandi gruppi, inorganici e organici, in base alla loro origine. La chimica organica diveniva così la chimica dei composti del carbonio.
ETOILEPEDIA IL LEGAME CHIMICO
 IL LEGAME CHIMICO La teoria quantistica ha introdotto il concetto di valenza, cioè della capacità di un atomo di formare un determinato numero di legami a seconda della propria configurazione elettronica;
IL LEGAME CHIMICO La teoria quantistica ha introdotto il concetto di valenza, cioè della capacità di un atomo di formare un determinato numero di legami a seconda della propria configurazione elettronica;
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Pronti per l Università Liceo Scientifico de Caprariis Atripalda PON F
 Pronti per l Università Liceo Scientifico de Caprariis Atripalda PON F2 2011-14 La chimica del carbonio Il Carbonio Copyright 2008 PresentationFx.com Redistribution Prohibited Image 2008 clix@sxc.hu This
Pronti per l Università Liceo Scientifico de Caprariis Atripalda PON F2 2011-14 La chimica del carbonio Il Carbonio Copyright 2008 PresentationFx.com Redistribution Prohibited Image 2008 clix@sxc.hu This
CAPITOLO 4 STRUTTURE MOLECOLARI
 APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
Spettroscopia 13 C NMR
 L analisi degli spettri 13 C NMR non differisce molto da quella dell 1 H. La principale differenza risiede nella minore sensibilità osservata nella registrazione degli d spettri 13 C che pertanto richiedono
L analisi degli spettri 13 C NMR non differisce molto da quella dell 1 H. La principale differenza risiede nella minore sensibilità osservata nella registrazione degli d spettri 13 C che pertanto richiedono
