A cura del Progetto FARMAONCO Ultimo aggiornamento giugno 2012 TIPOLOGIE DI RIMBORSO E TEMPISTICHE DI RIVALUTAZIONE
|
|
|
- Franco Cappelli
- 8 anni fa
- Visualizzazioni
Transcript
1 TIPOLOGIE DI RIMBORSO E TEMPISTICHE DI RIVALUTAZIONE
2 1 note importanti per la richiesta di Afinitor Everolimus Carcinoma renale avanzato, in progressione durante o dopo trattamento con terapia mirata anti- VEGF risk sharing ii, pari al prezzo dei primi 3 mesi di trattamento, è dovuto in caso di interruzione definitiva della terapia per fallimento terapeutico (progressione della malattia o tossicità) rilevato dal prescrittore durante o immediatamente dopo il terzo ciclo assoluto di trattamento (3 mesi) di un paziente iscritto nel Registro e risultato eleggibile. [NB: fine trattamento deve essere entro non più di 100 giorni dalla data della prima richiesta ed entro 30 giorni dalla data dell'ultima richiesta ; non deve esserci la 4 richiesta inserita, altrimenti va annullata.] E previsto l inserimento della rivalutazione con data compresa tra quella della terza richiesta e quella della quarta richiesta. state comunicate tutte le schede rivalutazione relative al trattamento e che i trattamenti per i quali si intende chiedere i rimborsi siano stati dichiarati conclusi tramite la scheda Alimta Pemetrexed In associazione con cisplatino come prima linea di trattamento di pazienti con carcinoma polmonare non a piccole cellule localmente avanzato o metastatico ad eccezione dell'istologia a predominanza di cellule squamose. In monoterapia nel trattamento di seconda linea di pazienti con carcinoma polmonare non a piccole cellule localmente avanzato o metastatico ad eccezione dell'istologia a predominanza di cellule squamose. Arzerra Ofatumumab Trattamento della leucemia linfatica cronica (LLC) nei pazienti refrattari a fludarabina e alemtuzumab Cost-Sharing: pari al 50% dell intera terapia (12 infusioni) per tutti i pazienti, è applicabile per ogni paziente iscritto nel Registro e risultato eleggibile;nel dopo le 8 richieste caso di dispensazione di un numero di infusioni settimanali e prima di inferiore a 12, ovvero di non completamento della quelle mensili terapia, il pari al 50% sarà dovuto in relazione alle confezioni effettivamente dispensate Atriance Nelarabina Leucemia mieloide cronica (LMC), con cromosoma Philadelphia positivo in fase cronica ed in fase accelerata con resistenza o intolleranza ad una precedente terapia comprendente imatinib. Avastin Bevacizumab In combinazione con chemioterapia a base di fluoropirimidine e' indicato per il trattamento di pazienti con carcinoma metastatico del colon e del retto a 6 settimane e poi payback nell'arco di ogni anno di terapia Il è basato su una fase iniziale (cost share) pari al 50% per le prime 6 settimane di trattamento e una fase successiva di ripiano annuale (payback) per tutte le dosi somministrate eccedenti la quota di mg nell arco di ciascun anno di trattamento. a 14 settimane massimo dalla data d invio della prima richiesta. Rimborso dispensazioni effettuate entro le 6 settimane dall inizio della terapia. Per queste dispensazioni viene effettuato il controllo, SE PRESENTE, delle posologie nelle richieste. Se la posologia non è presente vengono considerate a tutte le schede nella finestra temporale di 8 settimane. Avastin Bevacizumab In aggiunta a chemioterapia a base di platino, è indicato per il trattamento in prima linea di pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in ricaduta, con istologia a predominanza non squamocellulare delle prime 2 somministrazioni e poi payback nell'arco di ogni anno di terapia Il è basato su una fase iniziale (cost share) pari al 50% della somma dei dosaggi delle prime due dispensazionile e una fase successiva di ripiano annuale (payback) per tutte le dosi somministrate eccedenti la quota di mg nell arco di ciascun anno di trattamento. Prima della 4 richiesta del [senza controllo di data]
3 2 Avastin Avastin Erbitux Erbitux Halaven Herceptin (gastro) Iressa Bevacizumab Bevacizumab Cetuximab Cetuximab Eribulina Trastuzumab Gefitinib In combinazione con interferone alfa-2a è indicato per il trattamento in prima linea di pazienti con carcinoma renale avanzato e/o metastatico In combinazione con paclitaxel è indicato per il trattamento in prima linea di pazienti con carcinoma mammario metastatico Trattamento di pazienti affetti da carcinoma metastatico del colon-retto con espressione del recettore per il fattore di crescita epidermico (EGFR) - non determinante- e con gene KRAS non mutato (wild-type)puo' essere usato: -in combinazione con chemioterapia a base di irinotecan o con FOLFOX4; -in monoterapia nei pazienti nei quali sia fallita la terapia a base di oxaliplatino e irinotecan e che siano intolleranti a irinotecan Trattamento di pazienti affetti da carcinoma a cellule squamose di testa e collo in combinazione con chemioterapia a base di platino nella malattia ricorrente e/o metastatica In monoterapia è indicato per il trattamento di pazienti con cancro della mammella localmente avanzato o metastatico, che hanno mostrato una progressione dopo almeno due regimi chemioterapici per malattia avanzata. La terapia precedente deve avere previsto l impiego di un antraciclina e di un taxano, a meno che i pazienti non siano idonei a ricevere questi trattamenti In associazione a capecitabina o 5-fluorouracile e cisplatino nel trattamento di pazienti con adenocarcinoma metastatico dello stomaco o della giunzione gastroesofagea HER2-positivo, che non siano stati precedentemente sottoposti a trattamento antitumorale per la malattia metastatica. Trattamento di pazienti adulti con carcinoma polmonare non a piccole cellule (NSCLC) localmente avanzato o metastatico con mutazione attivante l'egfr-tk. delle prime 3 somministrazio ni e poi payback nell'arco di ogni anno di terapia a 6 settimane e poi payback nell'arco di ogni anno di terapia risk sharing note importanti per la richiesta di Il è basato su una fase iniziale (cost share) pari al 50% della somma dei dosaggi delle prime tre dispensazioni e una fase successiva di ripiano annuale (payback) per tutte le dosi somministrate eccedenti la quota di mg nell arco di ciascun anno di trattamento. Il è basato su una fase iniziale (cost share) pari al 50% per le prime 6 settimane di trattamento e una fase successiva di ripiano annuale (payback) per tutte le dosi somministrate eccedenti la quota di mg nell arco di ciascun anno di trattamento. Risk-share, pari al 50% per i pazienti non responder a 8 settimane; la data di valutazione in diagnosi deve essere successiva al 26/06/2009(se non fosse presente tale data è da considerarsi valida la "data dell'esame di riferimento"); la dose massima somministrata = 4300 mg; fine trattamento entro 75 giorni da prima richiesta. Payment by Result, pari al 100% per pazienti non responder con al massimo 45 giorni di trattamento (6 settimane fra 1 e ultima richiesta ); fine trattamento entro 30 giorni da ultima richiesta Payment by, pari al 100% delle confezioni erogate nei primi 3 mesi (4 cicli) di trattamento in caso di interruzione definitiva della terapia per fallimento terapeutico (progressione o tossicità), rilevato dal prescrittore durante o subito dopo il quarto ciclo assoluto di trattamento (3 mesi). A 12 settimane dalla dalla data d'invio della prima richiesta A 12 settimane dalla data d'invio della prima richiesta A 2 mesi A 6 settimane [N.B. E necessario inserire una rivalutazione una volta raggiunti i 4300 mg] Prime 2 : ogni 2 cicli. Payment by Result: il, pari al prezzo del utilizzato nei primi 2 mesi/3 cicli di trattamento, è dovuto in caso di fallimento terapeutico a 2 mesi dalla prima e interruzione definitiva della terapia, rilevati dal richiesta (tra 3 e prescrittore entro o immediatamente dopo i primi 2 4 ciclo di trattamento). mesi/tre cicli assoluti di trattamento di un paziente iscritto nel Registro e risultato eleggibile. E' previsto l'inserimento Payment by Results per i primi 3 mesi di terapia se della scheda di fallimento terapeutico (progressione o tossicità), fine rivalutazione con data trattamento entro 110 giorni dalla prima richiesta compresa tra gli 87 e i 100. Dose rimborsabile 3 confezioni ( mg giorni dalla data della totali). prima richiesta. Dalla terza rivalutazione in poi: ogni 3 cicli, salvo nei casi in cui sia necessario anticipare la rivalutazione strumentale. Successive ogni 3 cicli. state comunicate tutte le schede rivalutazione relative al trattamento e che i trattamenti per i quali si intende chiedere i rimborsi siano stati state comunicate tutte le schede rivalutazione relative al trattamento e che i trattamenti per i quali si intende chiedere i rimborsi siano stati state comunicate tutte le schede rivalutazione relative al trattamento e che i trattamenti per i quali si intende chiedere i rimborsi siano stati
4 3 note importanti per la richiesta di Javlor Vinflunina Carcinoma a cellule transizionali del tratto uroteliale avanzato o metastatico dopo fallimento di un precedente regime contenente platino. RImborso pari al prezzo del utilizzato nei primi due mesi di trattamento (max 3 cicli), in caso di fallimento terapeutico e interruzione definitiva della terapia, rilevati dal prescrittore entro o immediatamente dopo i primi due mesi assoluti di trattamento di un paziente iscritto nel Registro e risultato eleggibile Prima rivalutazione a 49/63 giorni da prima richiesta Le ogni 3 cicli NB è condizione necessaria che siano state comunicate tutte le schede Jevtana Cabazitaxel In combinazione con prednisone o prednisolone è indicato per il trattamento di pazienti affetti da carcinoma della prostata metastatico ormonorefrattario, trattati in precedenza con un regime contenente docetaxel Mabthera Rituximab LNH: Linfoma follicolare in III-IV stadio precedentemente non trattati, in associazione a chemioterapia. La terapia di mantenimento è indicata per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza MabThera. In monoterapia nel linfoma follicolare in III-IV stadio che sono chemioresistenti o sono in seconda o successiva ricaduta dopo chemioterapia. Linfoma non-hodgkin, CD20 positivo, diffuso a grandi cellule B, in associazione a chemioterapia CHOP (ciclofosfamide, doxorubicina, vincristina, prednisolone). SECONDO 648: Linfomi non- Hodgkin a cellule B(CD20+), di qualunque istologia, in associazione con regimi vari di polichemioterapia (includenti farmaci quali antracicline, fludarabina, cisplatino, citarabina, etoposide, metotrexate) impiegati per il trattamento di prima linea o di salvataggio, inclusi i regimi di condizionamento pretrapianto di cellule staminali emopoietiche. Mepact Mifamurtide Nei bambini, negli adolescenti e nei giovani adulti per il trattamento dell osteosarcoma non metastatico ad alto grado resecabile in seguito a resezione chirurgica macroscopicamente completa. Il medicinale viene utilizzato in associazione alla chemioterapia postoperatoria con più agenti. ogni 3 mesi di trattamento
5 4 note importanti per la richiesta di Mozobil Plarixafor Iin combinazione con GCSF per incrementare la mobilizzazione delle cellule staminali ematopoietiche al sangue periferico per la raccolta e il conseguente trapianto autologo in pazienti con linfoma e mieloma multiplo con una scarsa mobilizzazione cellulare Il pari a un pay-back a carico dell azienda per l intera terapia, è dovuto in caso di fallimento terapeutico. Si considera fallimento terapeutico l interruzione della terapia per il mancato conseguimento dei parametri di efficacia. NB per usufruire del è importante che le date di richiesta delle 2 fiale siano due giorni successivi NB PARAMETRI DI EFFICACIA: raccolta di CD34+ > 2 x10 6/Kg. Ai fini della valutazione di efficacia saranno valutati solo pazienti che avranno effettuato almeno 2 somministrazioni in giorni consecutivi e nei quali il trattamento è comunque effettuato in giorni consecutivi e sia stata rispettata la finestra di raccolta tra la sesta e l undicesima ora dopo ciascuna somministrazione. Nexavar Sorafenib Carcinoma a cellule renali(rcc) in stadio avanzato (stadio IV) dopo fallimento terapeutico ad una precedente terapia a base di interferone alfa o interleuchina-2, o che sono considerati non idonei a ricevere tale terapia Cost share sconto in merce del 50% per il SSN, per i primi 3 mesi-3 cicli di trattamento. Massimo 3 confezioni. Per questa indicazione terapeutica la procedura telematica specifica, da utilizzare esclusivamente per trattamenti di pazienti iscritti per la prima volta nel Registro, a partire dal 2 Agosto 2011; per i pazienti con una data di registrazione all interno del registro anteriore a tale data, la richiesta di dovrà essere effettuata esclusivamente mediante la procedura manuale. Indifferente Nexavar Sorafenib Trattamento dell epatocarcinoma- HCC Payment by Results intero prezzo del per i primi 2 mesi di trattamento, in seguito del costo con nota di credito per i pazienti nonresponders. La data del fine trattamento deve essere entro 60 gg dalla data della prima richiesta. La data del fine trattamento deve essere entro 21 gg dalla data dell ultima richiesta. Massimo 2 confezioni.[ NB La data del fine trattamento deve essere entro 80 gg dalla data della prima richiesta se è presente piu di una richiesta. Nel caso sia presente un unica richiesta la data del fine trattamento deve essere entro 50 giorni. Massimo 2 confezioni.] a 2 mesi
6 5 note importanti per la richiesta di Revlimid Lenalidomide In associazione con desametasone è indicato per il trattamento di pazienti con mieloma multiplo sottoposti ad almeno una precedente terapia Revlimid 648 Lenalidomide Trattamento di pazienti anemici trasfusionedipendenti, con sindrome mielodisplastica a rischio basso o intermedio-1, portatori di delezione 5qassociata o meno ad altre anomalie cromosomiche. Utilizzo nei Linfomi diffusi a grandi cellule B e linfomi mantellari MCL recidivatirefrattari a precedenti trattamenti chemioterapici per i quali non si ravvisano alternative terapeutiche e non candidabili a trapianto di cellule staminali autologhe o allogeniche. Utilizzo nell Amiloidosi in pazienti già trattati con melphalan e bortezomib (o in quelli che hanno controindicazioni a essere esposti a melphalan e/o bortezomib). Dispensazione gratuita della prima confezione per ogni nuovo paziente dopo debita compilazione delle schede di monitoraggio AIFA. E però a carico dell Azienda Sanitaria l IVA relativa alla prima confezione (IVA al 10%) In alternativa in Regione Lombardia sconto del 50% sulle prime due confezioni per ciascun paziente (l ordine parte direttamente al 50%). MDS 5-q: Da novembre 2008 sconto del 50% sulle prime due confezioni per ciascun paziente (l ordine parte direttamente al 50%). Removab Catumaxomab Trattamento intraperitoneale dell'ascite maligna nei pazienti con carcinomi EpCAM-positivi quando una terapia standard non sia disponibile o non sia più attuabile. Il a carico dell azienda è pari al 50% delle confezioni erogate nei primi due cicli somministrati per ogni paziente iscritto nel Registro e risultato eleggibile Sprycel Dasatinib Trattamento di adulti con leucemia mieloide cronica (LMC), in fase cronica, accelerata o in fase blastica con resistenza o intolleranza ad una precedente terapia comprendente imatinib mesilato. Trattamento di adulti affetti da leucemia linfoblastica acuta (LLA) con cromosoma Philadelphia positivo (Ph+) ed LMC in fase blastica linfoide con resistenza o intolleranza ad una precedente terapia. risk sharing* (solo per pazienti con data di registrazione antecedente il 9 dicembre 2011) per pazienti arruolati dal 9 dicembre 2011 Risk sharing: il, pari al prezzo del primo ciclo di trattamento (4 settimane), è dovuto in caso di interruzione definitiva della terapia per fallimento terapeutico (progressione della malattia) rilevato dal prescrittore durante o immediatamente dopo il primo ciclo assoluto di trattamento (4 settimane) di un paziente iscritto nel Registro e risultato eleggibile. Cost sharing da dicembre 2011 il, pari al 50% del prezzo delle confezioni di utilizzate nell ambito dei primi 3 mesi/3cicli di trattamento, è applicabile per ogni paziente iscritto nel Registro e risultato eleggibile (Cost-Share) a 4 settimane Sprycel Dasatinib Leucemia Mieloide Cronica (LMC) con cromosoma Philadelphia positivo (Ph+) in fase cronica, di nuova diagnosi. Iil, pari al 50% del prezzo delle confezioni di utilizzate nell ambito dei primi 3 mesi/3cicli di trattamento, è applicabile per ogni paziente iscritto nel Registro e risultato eleggibile (Cost-Share)
7 6 Sutent Sunitinib Trattamento del carcinoma renale avanzato e/o metastatico (MRCC). note importanti per la richiesta di il, pari al prezzo di una confezione di utilizzato nell ambito dei primi 3 mesi assoluti di trattamento, è applicabile per ogni paziente iscritto nel Registro e risultato eleggibile a 12 settimane Tarceva Erlotinib Trattamento di pazienti affetti da carcinoma polmonare non a piccole cellule localmente avanzato o metastatico, dopo fallimento di almeno un precedente regime chemioterapico Riduzione del prezzo del 50% per il SSN, sul prezzo ex factory, per i primi due mesi (= primi due cicli di trattamento). Follow-up previsto dopo 8 settimane di trattamento a 2 mesi Aggiornamento 8 novembre 2011: e' possibile effettuare richieste di per confezioni dispensate da non più di un anno rispetto alla data della singola richiesta di ;viene confermata la rimborsabilità dei trattamenti con durata superiore ai 12 mesi. con le richieste di per le confezioni relative ai trattamenti con durata superiore ai 12 mesi. In questo caso la relativa documentazione dovrà essere inviata direttamente a Roche all indirizzo italy.customerservice@roche.com, e in copia, per conoscenza, all AIFA, indirizzo aifa-rfmrimborsi@agenzia.it. Tasigna Nilotinib Trattamento di pazienti adulti con leucemia mieloide cronica (LMC) con cromosoma Philadelphia positivo di nuova diagnosi in fase cronica da GU Tasigna 150 mg Cost sharing: 50% del prezzo delle confezioni di utilizzate nell ambito dei primi 3 mesi/3 cicli di trattamento a 3 mesi Tasigna Nilotinib Trattamento di adulti con leucemia mieloide cronica (LMC), con cromosoma Philadelphia positivo in fase cronica ed in fase accelerata con resistenza o intolleranza ad una precedente terapia comprendente imatinib. Il, pari al prezzo del primo mese di trattamento (4 settimane), è dovuto in caso di fallimento terapeutico e interruzione definitiva della terapia, rilevati dal prescrittore durante o immediatamente dopo il primo mese (4 settimane) assoluto di trattamento di un paziente iscritto nel Registro e risultato eleggibile. Viene considerata valida ai fini del anche la sospensione per tossicità. a 1 mese Thalidomide Celgene Thalidomide Celgene 648 Talidomide Talidomide In associazione a melfalan e prednisone è indicata per il trattamento di prima linea di pazienti con mieloma multiplo non trattato di età 65 anni o non idonei a chemioterapia a dosi elevate Utilizzo nella terapia di mantenimento nel trattamento dell Amiloidosi,Utilizzo nel trattamento di Mieloma Multiplo in mantenimento,utilizzo nel trattamento di Mieloma Multiplo in prima linea per VTD nel paziente candidabile a trapianto autologo
8 7 Torisel Torisel Tyverb Temsirolimus Temsirolimus Lapatinib Trattamento di prima linea in pazienti con carcinoma avanzato a cellule renali, che presentino almeno tre dei sei fattori di rischio prognostici. Trattamento di pazienti adulti con linfoma a cellule mantellari refrattario e/o recidivante (MCL) Trattamento di pazienti affetti da carcinoma mammario, il cui tumore sovraesprime l'her2 (ErB2);in associazione con capecitabina, nei pazienti con malattia avanzata o metastatica in progressione dopo che i pazienti abbiano ricevuto un trattamento che deve aver incluso antracicline e taxani ed una terapia con trastuzumab per malattia metastatica. in associazione con un inibitore dell'aromatasi, nelle donne in post-menopausa con malattia metastatica positiva per il recettore ormonale, per le quali al momento non e' indicata la chemioterapia. Le pazienti nello studio registrativo non erano state trattate in precedenza con trastuzumab o con un inibitore dell'aromatasi. Cost-sharing note importanti per la richiesta di Payment by Results con pari al prezzo del utilizzato nelle prime 8 settimane di trattamento, [vanno a massimo 8 confezioni pari a 200mg]; la scheda fine trattamento deve essere compilata con data entro i 30 gg dall ultima richiesta ; il pz deve aver fatto un massimo di 60 gg di terapia (conteggiati tra la prima e l ultima richiesta ) Cost sharing: payback equivalente a 6 fiale a carico dell azienda per ogni paziente arruolato (estensione delle indicazioni MCL) Il, pari al prezzo del utilizzato, è dovuto in caso di fallimento terapeutico e interruzione definitiva della terapia di un paziente eleggibile, rilevati dal Centro prescrittore entro i primi tre cicli di trattamento, [cioè 3 settimane ] (o immediatamente dopo, entro 30 giorni). Di conseguenza, può essere rimborsato un massimo di sei confezioni per un dosaggio totale non superiore a mg. Viene considerata valida ai fini del anche la sospensione per tossicità. Payment by con fine trattamento entro i 30 gg dall ultima richiesta a 8 settimane a 3 cicli di trattamento consigliate ogni 8 settimane Vectibix Panitumumab Monoterapia per il trattamento di pazienti con carcinoma colorettale metastatico (mcrc) esprimenti il recettore per il fattore di crescita epidermico (EGFR) dopo fallimento di regimi chemioterapici contenenti fluoropirimidine, oxaliplatino e irinotecan, nel caso in cui i tumori presentino il gene KRAS (Kristen sarcoma 2 viral oncogene homologue) non mutato (wild-type). rish sharing Entro il 2 mese Obbligatorio inserire la scheda di Rivalutazione di stato malattia (senza Risk share al 50% per pazienti in progressione entro controllo di data) dopo il due mesi dalla prima richiesta ; non devono raggiungimento della dose essere superati i 2640mg totali e la scheda di fine massima nelle prime 8 trattamento deve essere inserita entro un mese dalla settimane di terapia data dell ultima richiesta calcolabile nelle varie richieste (si ricorda che la dose massima per una richiesta è di 1320 mg). La Commissione Tecnico-Scientifica dell'aifa (verbale CTS n.18 del 12 e 13 luglio 2011), sentito il parere del Gruppo di Lavoro per le Terapie Oncologiche e la sottocommissione Sperimentazione Clinica, approva la seguente modifica inerente i criteri di eleggibilita': si considera non determinante la valutazione dell espressione dell'egfr per l'eleggibilita' dei pazienti affetti da carcinoma del colon-retto in trattamento con Cetuximab (Erbitux ) e Panitumumab (Vectibix ). Velcade Bortezomib In associazione con melfalan e prednisone è indicato per il trattamento di pazienti con mieloma multiplo precedentemente non trattato non candidabili a chemioterapia ad alte dosi con trapianto di midollo osseo. trattamento in monoterapia del mieloma multiplo in progressione in pazienti che abbiano già ricevuto almeno una precedente linea di trattamento e che siano già stati sottoposti o non siano candidabili a trapianto di midollo osseo. [max 4 confezioni] Cost Sharing al 50% del prezzo delle confezioni di utilizzate nell ambito del primo ciclo di trattamento (6 settimane + 15 giorni = 60 giorni). Vanno a, sempre nell ambito dei 60 giorni di trattamento dalla prima richiesta, massimo 8 richieste e massimo 28 mg dispensati. Indifferente dopo 4 mesi
9 8 note importanti per la richiesta di Velcade 648 Bortezomib Utilizzo in prima linea dell Amiloidosi. VELCADE in associazione con desametasone è indicato per il trattamento dei pazienti affetti da mieloma multiplo refrattario/recidivato (secondo Legge 648/96). Vidaza Azacitidina Trattamento di pazienti adulti non eleggibili al trapianto di cellule staminali emopoietiche con: sindromi mielodisplastiche (SMD) a rischio intermedio-2 e alto secondo l International Prognostic Scoring System (IPSS), leucemia mielomonocitica cronica (LMMC) con il 10-29% di blasti midollari senza disordine mieloproliferativo, leucemia mieloide acuta (LMA) con 20-30% di blasti e displasia multilineare, secondo la classificazione dell Organizzazione mondiale della sanità (OMS). Cost-Sharing: pari all' 11% del prezzo delle confezioni di utilizzate fino al terzo ciclo di trattamento, è applicabile per ogni paziente iscritto nel Registro e risultato eleggibile; due possibilità per chiedere : on-line su sito AIFA dopo fine trattamento oppure richiesta con modulo cartaceo alla Ditta entro 60 giorni dalla fine del sesto ciclo o dalla fine del trattamento (qualora il paziente vada in progressione prima del sesto ciclo); è preferibile on-line perchè non ha limite temporale. E' previsto l'inserimento della scheda di rivalutazione precedentemente al 7 ciclo di trattamento (dopo il 6 ciclo); se presenti è necessario conteggiare anche i cicli di trattamento indicati nella scheda di diagnosi; se paziente termina prima del sesto ciclo occorre inserire direttamente scheda fine trattamento NB è condizione necessaria che siano state comunicate tutte le schede Votrient Pazopanib Trattamento di prima linea del carcinoma renale (RCC) avanzato e nei pazienti che hanno ricevuto in precedenza una terapia a base di citochine per malattia avanzata Il, pari al prezzo del utilizzato nelle prime 24 settimane di trattamento (max mg), è dovuto in caso di fallimento terapeutico e interruzione definitiva della terapia, rilevati dal prescrittore entro o immediatamente dopo le prime 24 settimane di terapia. a 12 settimane ( giorni) dalla prima richiesta NB è condizione necessaria che siano state comunicate tutte le schede Yondelis Trabectedina In associazione con doxorubicina liposomiale pegilata (PDL), e' indicato per il trattamento di pazienti con recidiva di cancro ovarico platinosensibile. risk sharing Il, pari al prezzo dei primi tre cicli di trattamento), è dovuto in caso di interruzione definitiva (paziente non-responder) della terapia per fallimento terapeutico rilevato dal prescrittore entro o immediatamente dopo il terzo ciclo (2 mesi di trattamento), da ripianare con nota di accredito sulla base delle schede compilate per singolo paziente. Eventuali sospensioni per fallimento terapeutico occorse nei cicli successivi al primo non danno luogo a. Si considera fallimento terapeutico la progressione, o ricaduta di malattia, e/o un eventuale tossicità ritenuta dal prescrittore intollerabile ai fini di una continuazione del trattamento. tra 2 e 3 richiesta. NB è condizione necessaria che siano state comunicate tutte le schede
10 A cura del Progetto FARMAONCO Ultimo aggiornamento giugno Yondelis Trabectedina Trattamento dei pazienti con sarcoma dei tessuti molli in stato avanzato dopo il fallimento della terapia con antracicline e ifosfamide o che non sono idonei a ricevere tali agenti. I dati sull'efficacia si basano soprattutto su pazienti con liposarcoma e leiomiosarcoma. risk sharing note importanti per la richiesta di Il, pari al prezzo dei primi due cicli di trattamento (6 settimane) è dovuto in caso di interruzione definitiva (paziente nonresponder) della terapia per fallimento terapeutico rilevato dal prescrittore entro o immediatamente dopo il secondo ciclo (6 settimane di trattamento), da ripianare con nota di accredito sulla base delle schede compilate Entro le prime 6 settimane per singolo paziente. Eventuali sospensioni per di trattamento fallimento terapeutico occorse nei cicli successivi al secondo non danno luogo a. Si considera fallimento terapeutico la progressione, o ricaduta di malattia, e/o un eventuale tossicità ritenuta dal prescrittore intollerabile ai fini di una continuazione del trattamento NB è condizione necessaria che siano state comunicate tutte le schede Zevalin Ibritumomab tiuxetano Trattamento di pazienti adulti affetti da linfoma non Hodgkin (NHL) follicolare a cellule B CD20+, ricaduti o refrattari a rituximab.
Principi attivi e indicazioni terapeutiche autorizzate sottoposte a payment by results, cost sharing e risk sharing. Data di inizio 24/07/2006
 ALLEGATO A Principi attivi e indicazioni terapeutiche autorizzate sottoposte a payment by results, cost sharing e risk sharing Principio attivo ERLOTINIB (Tarceva ) SUNITINIB (Sutent ) SORAFENIB (Nexavar
ALLEGATO A Principi attivi e indicazioni terapeutiche autorizzate sottoposte a payment by results, cost sharing e risk sharing Principio attivo ERLOTINIB (Tarceva ) SUNITINIB (Sutent ) SORAFENIB (Nexavar
ALLEGATOA alla Dgr n. 95 del 31 gennaio 2012 pag. 1/5
 giunta regionale 9^ legislatura ALLEGATOA alla Dgr n. 95 del 31 gennaio 2012 pag. 1/5 ALEMTUZUMAB L01XC04 Alemtuzumab è indicato per il trattamento di pazienti affetti da leucemia linfocitica cronica a
giunta regionale 9^ legislatura ALLEGATOA alla Dgr n. 95 del 31 gennaio 2012 pag. 1/5 ALEMTUZUMAB L01XC04 Alemtuzumab è indicato per il trattamento di pazienti affetti da leucemia linfocitica cronica a
Allegato B al Decreto n. 48 del 17 maggio 2016 pag. 1/6
 giunta regionale Allegato B al Decreto n. 48 del 17 maggio 2016 pag. 1/6 ELENCO FARMACI ONCO-EMATOLOGICI SOGGETTI A REGISTRO AIFA E DEI RELATIVI CENTRI AUTORIZZATI ALLA PRESCRIZIONE NOME FARMACO PRINCIPIO
giunta regionale Allegato B al Decreto n. 48 del 17 maggio 2016 pag. 1/6 ELENCO FARMACI ONCO-EMATOLOGICI SOGGETTI A REGISTRO AIFA E DEI RELATIVI CENTRI AUTORIZZATI ALLA PRESCRIZIONE NOME FARMACO PRINCIPIO
Ricerca, innovazione e Competitività
 Ricerca, innovazione e Competitività Roma 15 novembre 2012 dott.ssa Nadia Storti Farmaci innovativi ed innovazioni terapeutiche: quali vantaggi per il paziente - Possibili vantaggi terapeutici - Controllo
Ricerca, innovazione e Competitività Roma 15 novembre 2012 dott.ssa Nadia Storti Farmaci innovativi ed innovazioni terapeutiche: quali vantaggi per il paziente - Possibili vantaggi terapeutici - Controllo
Allegato B al Decreto n. 65 del 7 giugno 2017 pag. 1/6
 giunta regionale Allegato B al Decreto n. 65 del 7 giugno 2017 pag. 1/6 ELENCO FARMACI ONCO-EMATOLOGICI* PRINCIPIO ATTIVO Adcetris (Brentuximab vedotin) Indicazione Per il trattamento di pazienti adulti
giunta regionale Allegato B al Decreto n. 65 del 7 giugno 2017 pag. 1/6 ELENCO FARMACI ONCO-EMATOLOGICI* PRINCIPIO ATTIVO Adcetris (Brentuximab vedotin) Indicazione Per il trattamento di pazienti adulti
Allegato A al Decreto n. 107 del 8 agosto 2017 pag. 1/6
 giunta regionale Allegato A al Decreto n. 107 del 8 agosto 2017 pag. 1/6 ELENCO FARMACI ONCO-EMATOLOGICI* PRINCIPIO ATTIVO Adcetris (Brentuximab vedotin) Atriance (Nelarabina) Arzerra (Ofatumumab) Arzerra
giunta regionale Allegato A al Decreto n. 107 del 8 agosto 2017 pag. 1/6 ELENCO FARMACI ONCO-EMATOLOGICI* PRINCIPIO ATTIVO Adcetris (Brentuximab vedotin) Atriance (Nelarabina) Arzerra (Ofatumumab) Arzerra
Allegato A al Decreto n. 14 del 2 FEB pag. 1/7
 giunta regionale Allegato A al Decreto n. 14 del 2 FEB. 2018 pag. 1/7 ELENCO FARMACI ONCO-EMATOLOGICI* PRINCIPIO ATTIVO Adcetris (Brentuximab vedotin) Atriance (Nelarabina) Arzerra (Ofatumumab) Arzerra
giunta regionale Allegato A al Decreto n. 14 del 2 FEB. 2018 pag. 1/7 ELENCO FARMACI ONCO-EMATOLOGICI* PRINCIPIO ATTIVO Adcetris (Brentuximab vedotin) Atriance (Nelarabina) Arzerra (Ofatumumab) Arzerra
Allegato A al Decreto n. 82 del 9 luglio 2018 pag. 1/8
 giunta regionale Allegato A al Decreto n. 82 del 9 luglio 2018 pag. 1/8 ELENCO FARMACI ONCO-EMATOLOGICI* PRINCIPIO ATTIVO Indicazione Centri autorizzati (con decreti Direttore Generale Area Sanità e Sociale)
giunta regionale Allegato A al Decreto n. 82 del 9 luglio 2018 pag. 1/8 ELENCO FARMACI ONCO-EMATOLOGICI* PRINCIPIO ATTIVO Indicazione Centri autorizzati (con decreti Direttore Generale Area Sanità e Sociale)
Le politiche di compartecipazione alle spesa farmaceutica
 Le politiche di compartecipazione alle spesa farmaceutica Valentina Orlando CIRFF - Dipartimento di Farmacia Università degli Studi di Napoli Federico II Il mercato farmaceutico Medico Assistito Domanda
Le politiche di compartecipazione alle spesa farmaceutica Valentina Orlando CIRFF - Dipartimento di Farmacia Università degli Studi di Napoli Federico II Il mercato farmaceutico Medico Assistito Domanda
Allegato A al Decreto n. 48 del 17 maggio 2016 pag. 1/3
 giunta regionale Allegato A al Decreto n. 48 del 17 maggio 2016 pag. 1/3 INDIVIDUAZIONE DELLA RETE DEI CENTRI PRESCRITTORI DI FARMACI ONCOEMATOLOGICI SOGGETTI A REGISTRO AIFA L area oncoematologica rappresenta
giunta regionale Allegato A al Decreto n. 48 del 17 maggio 2016 pag. 1/3 INDIVIDUAZIONE DELLA RETE DEI CENTRI PRESCRITTORI DI FARMACI ONCOEMATOLOGICI SOGGETTI A REGISTRO AIFA L area oncoematologica rappresenta
I DOCUMENTI DI HEALTH INDUSTRY REGIONE VENETO. Decreto n 48 del 17 maggio 2016
 I DOCUMENTI DI HEALTH INDUSTRY REGIONE VENETO Decreto n 48 del 17 maggio 2016 Attivazione ed individuazione della rete dei Centri Regionali autorizzati alla prescrizione di farmaci soggetti a Registro
I DOCUMENTI DI HEALTH INDUSTRY REGIONE VENETO Decreto n 48 del 17 maggio 2016 Attivazione ed individuazione della rete dei Centri Regionali autorizzati alla prescrizione di farmaci soggetti a Registro
Leucemie acute e sindromi mielodisplastiche
 Leucemie acute e sindromi mielodisplastiche Gli strumenti di governo clinico e la vigilanza da parte della Farmacia 23/02/2012 Paola Fiacchi Strumenti di governo Individuare per ogni molecola ad alto costo
Leucemie acute e sindromi mielodisplastiche Gli strumenti di governo clinico e la vigilanza da parte della Farmacia 23/02/2012 Paola Fiacchi Strumenti di governo Individuare per ogni molecola ad alto costo
Indicazioni della Direzione Generale Sanità Regione Lombardia in ambito Oncoematologico per un uso appropriato di farmaci e procedure.
 Allegato n.1 Indicazioni della Direzione Generale Sanità Regione Lombardia in ambito Oncoematologico per un uso appropriato di farmaci e procedure. La Direzione Generale Sanità di Regione Lombardia ha
Allegato n.1 Indicazioni della Direzione Generale Sanità Regione Lombardia in ambito Oncoematologico per un uso appropriato di farmaci e procedure. La Direzione Generale Sanità di Regione Lombardia ha
Esperienza dell USL 2 dell Umbria
 Perugia, 15 settembre 2015 DIPARTIMENTO ASSISTENZA FARMACEUTICA DIRETTORE: DR. FAUSTO BARTOLINI Esperienza dell USL 2 dell Umbria Dott.ssa Vittoria Blandini REGISTRO DI MONITORAGGIO AIFA.. Strumento Clinico
Perugia, 15 settembre 2015 DIPARTIMENTO ASSISTENZA FARMACEUTICA DIRETTORE: DR. FAUSTO BARTOLINI Esperienza dell USL 2 dell Umbria Dott.ssa Vittoria Blandini REGISTRO DI MONITORAGGIO AIFA.. Strumento Clinico
ALLEGATO B ELENCO FARMACI ONCOLOGICI. Scheda monitoraggio AIFA (*) Note aggiuntive. Regime di rimborsabilita /Modalità di prescrizione
 ALLEGATO B ELENCO FARMACI ONCOLOGICI CODICE PRINCIPI ATTIVI OS VIA DI SOMMINISTRAZIONE FORMA FARMACEUTICA INIETTABILE ALTRE Regime di rimborsabilita /Modalità di prescrizione Scheda monitoraggio AIFA (*)
ALLEGATO B ELENCO FARMACI ONCOLOGICI CODICE PRINCIPI ATTIVI OS VIA DI SOMMINISTRAZIONE FORMA FARMACEUTICA INIETTABILE ALTRE Regime di rimborsabilita /Modalità di prescrizione Scheda monitoraggio AIFA (*)
NUOVI FARMACI ONCOLOGICI: EVIDENZE E SOSTENIBILTA DEL SSN
 IfF n. 2018 NUOVI FARMACI ONCOLOGICI: EVIDENZE E SOSTENIBILTA DEL SSN TABELLA SUPPLEMENTARE: ACCORDI NEGOZIALI CONDIZIONATI E RELATIVI VALORI ESMO-MCBS Farmaco Specialità Indicazioni rimborsate Tipo accordo
IfF n. 2018 NUOVI FARMACI ONCOLOGICI: EVIDENZE E SOSTENIBILTA DEL SSN TABELLA SUPPLEMENTARE: ACCORDI NEGOZIALI CONDIZIONATI E RELATIVI VALORI ESMO-MCBS Farmaco Specialità Indicazioni rimborsate Tipo accordo
Allegato A al Decreto n. 65 del 7 giugno 2017 pag. 1/3
 giunta regionale Allegato A al Decreto n. 65 del 7 giugno 2017 pag. 1/3 INDIVIDUAZIONE DELLA RETE DEI CENTRI PRESCRITTORI DI FARMACI ONCOEMATOLOGICI L area oncoematologica rappresenta uno dei settori nei
giunta regionale Allegato A al Decreto n. 65 del 7 giugno 2017 pag. 1/3 INDIVIDUAZIONE DELLA RETE DEI CENTRI PRESCRITTORI DI FARMACI ONCOEMATOLOGICI L area oncoematologica rappresenta uno dei settori nei
RUOLO DEL TRAPIANTO NEL PAZIENTE CON MIELOMA MULTIPLO
 RUOLO DEL TRAPIANTO NEL PAZIENTE CON MIELOMA MULTIPLO Nicola Giuliani U. O. Ematologia e CTMO, Azienda Ospedaliero-Universitaria di Parma MM-EPIDEMIOLOGIA 10% di tutti i tumori del sangue Malattia dell
RUOLO DEL TRAPIANTO NEL PAZIENTE CON MIELOMA MULTIPLO Nicola Giuliani U. O. Ematologia e CTMO, Azienda Ospedaliero-Universitaria di Parma MM-EPIDEMIOLOGIA 10% di tutti i tumori del sangue Malattia dell
D.G. Sanità D.d.g. 13 settembre 2012 - n. 7837
 6 Bollettino Ufficiale D.G. Sanità D.d.g. 13 settembre 2012 - n. 7837 Indicazioni della direzione generale Sanità in ambito oncoematologico per un uso appropriato di alcuni farmaci e procedure Premesso
6 Bollettino Ufficiale D.G. Sanità D.d.g. 13 settembre 2012 - n. 7837 Indicazioni della direzione generale Sanità in ambito oncoematologico per un uso appropriato di alcuni farmaci e procedure Premesso
FARMACI CON USO CONSOLIDATO NEL TRATTAMENTO DELLE NEOPLASIE E PATOLOGIE EMATOLOGICHE PER INDICAZIONI
 ALLEGATO 3 Aprile 2011 FARMACI CON USO CONSOLIDATO NEL TRATTAMENTO DELLE NEOPLASIE E PATOLOGIE EMATOLOGICHE PER INDICAZIONI ANCHE DIFFERENTI DA QUELLE PREVISTE DAL PROVVEDIMENTO DI AUTORIZZAZIONE ALL IMMISSIONE
ALLEGATO 3 Aprile 2011 FARMACI CON USO CONSOLIDATO NEL TRATTAMENTO DELLE NEOPLASIE E PATOLOGIE EMATOLOGICHE PER INDICAZIONI ANCHE DIFFERENTI DA QUELLE PREVISTE DAL PROVVEDIMENTO DI AUTORIZZAZIONE ALL IMMISSIONE
A l l eg ato 2. del 31 gennaio 2012 Monitoraggio dei farmaci oncologici ad alto costo: de-
 114 Ambiente familiare problematico Valutazione del livello di cura riabilitativo Presenza condizioni psicosociali che permettono di passare bilitativa Day hospital Ricovero Recupero o mantenimento del
114 Ambiente familiare problematico Valutazione del livello di cura riabilitativo Presenza condizioni psicosociali che permettono di passare bilitativa Day hospital Ricovero Recupero o mantenimento del
UO Qualità, Ricerca Organizzativa e Innovazione Pagina 1 di 5
 Contenuto ER MITO Epidemiologia e diagnosi biomolecolare le malattie mitocondriali in Emilia PUMANER1301 Studio comparativo tra neratinib più capecitabina in pazienti con carcinoma mammario metastatico
Contenuto ER MITO Epidemiologia e diagnosi biomolecolare le malattie mitocondriali in Emilia PUMANER1301 Studio comparativo tra neratinib più capecitabina in pazienti con carcinoma mammario metastatico
Terapia medica oncologica e radioterapia adiuvante
 RETTO TRATTAMENTO MEDICO 01 Terapia medica oncologica e radioterapia adiuvante DESCRIZIONE: Stima la proporzione di pazienti che effettuano una terapia medica oncologica e radioterapia post-intervento
RETTO TRATTAMENTO MEDICO 01 Terapia medica oncologica e radioterapia adiuvante DESCRIZIONE: Stima la proporzione di pazienti che effettuano una terapia medica oncologica e radioterapia post-intervento
PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI CLOPIDOGREL
 20-3-2009 GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale - n. 66 ALLEGATO 1 PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI CLOPIDOGREL Centro prescrittore Nome cognome del clinico prescrittore
20-3-2009 GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale - n. 66 ALLEGATO 1 PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI CLOPIDOGREL Centro prescrittore Nome cognome del clinico prescrittore
Gli strumenti di governo clinico e la vigilanza da parte della Farmacia
 Gli strumenti di governo clinico e la vigilanza da parte della Farmacia Dott.ssa Stella Sferra Laboratorio di allestimento farmaci oncologici U.O. Farmacia Ospedale S. Anna AOSP-U di Ferrara Governo Clinico
Gli strumenti di governo clinico e la vigilanza da parte della Farmacia Dott.ssa Stella Sferra Laboratorio di allestimento farmaci oncologici U.O. Farmacia Ospedale S. Anna AOSP-U di Ferrara Governo Clinico
Presentazione: AFI CRS: Sistemi Terapeutici Innovativi. Relatore: Dr. Mario Bruzzone
 Presentazione: AFI CRS: Sistemi Terapeutici Innovativi Relatore: Dr. Mario Bruzzone Data 9 Giugno 20 Sala Fellini AFI CRS: Sistemi Terapeutici Innovativi La posizione di AIFA riguardo alle nuove formulazioni
Presentazione: AFI CRS: Sistemi Terapeutici Innovativi Relatore: Dr. Mario Bruzzone Data 9 Giugno 20 Sala Fellini AFI CRS: Sistemi Terapeutici Innovativi La posizione di AIFA riguardo alle nuove formulazioni
U.O. FARMACIA LFA.P 13
 . Pag. 1 / 5 Viene definito File F il tracciato record per la gestione, attivazione e rendicontazione dei farmaci somministrati e forniti dalle strutture ospedaliere, per l utilizzo ambulatoriale e domiciliare,
. Pag. 1 / 5 Viene definito File F il tracciato record per la gestione, attivazione e rendicontazione dei farmaci somministrati e forniti dalle strutture ospedaliere, per l utilizzo ambulatoriale e domiciliare,
IL PUNTO DI VISTA DEL FARMACISTA. La vecchia e nuova piattaforma: pro e contro;
 Genova, 4 Dicembre 2014, 15 Gennaio e 13 Febbraio 2015 Corso di formazione sul campo I REGISTRI AIFA IL PUNTO DI VISTA DEL FARMACISTA. La vecchia e nuova piattaforma: pro e contro; le risultanze degli
Genova, 4 Dicembre 2014, 15 Gennaio e 13 Febbraio 2015 Corso di formazione sul campo I REGISTRI AIFA IL PUNTO DI VISTA DEL FARMACISTA. La vecchia e nuova piattaforma: pro e contro; le risultanze degli
O GG E TTO : Individuazione Centri prescrittori medicinali sottoposti a registro AIFA: "Stivarga" - "Cyramza" e altri. LA GIUNTA REGIONALE
 O GG E TTO : Individuazione Centri prescrittori medicinali sottoposti a registro AIFA: "Stivarga" - "Cyramza" e altri. N. 1313 IN 30/11/2015 LA GIUNTA REGIONALE del REGISTRO ATTI DELLA GIUNTA DATA VISTI
O GG E TTO : Individuazione Centri prescrittori medicinali sottoposti a registro AIFA: "Stivarga" - "Cyramza" e altri. N. 1313 IN 30/11/2015 LA GIUNTA REGIONALE del REGISTRO ATTI DELLA GIUNTA DATA VISTI
Domande relative alla specializzazione in: Oncologia medica
 Domande relative alla specializzazione in: Oncologia medica Domanda #1 (codice domanda: n.541) : Cosa caratterizza il grado T2 del colangiocarcinoma? A: Interessamento del connettivo periduttale B: Coinvolgimento
Domande relative alla specializzazione in: Oncologia medica Domanda #1 (codice domanda: n.541) : Cosa caratterizza il grado T2 del colangiocarcinoma? A: Interessamento del connettivo periduttale B: Coinvolgimento
 Allegato n.1 Indicazioni della Direzione Generale Sanità Regione Lombardia in ambito Oncoematologico per un uso appropriato di farmaci e procedure. La Direzione Generale Sanità di Regione Lombardia ha
Allegato n.1 Indicazioni della Direzione Generale Sanità Regione Lombardia in ambito Oncoematologico per un uso appropriato di farmaci e procedure. La Direzione Generale Sanità di Regione Lombardia ha
LAZIOSANITÀ AGENZIA DI SANITÀ PUBBLICA
 LAZIOSANITÀ AGENZIA DI SANITÀ PUBBLICA Progetto Analisi e valutazione dell erogazione dei farmaci nell ambito dell assistenza ambulatoriale e della distribuzione diretta nella Regione Lazio Aprile 2013
LAZIOSANITÀ AGENZIA DI SANITÀ PUBBLICA Progetto Analisi e valutazione dell erogazione dei farmaci nell ambito dell assistenza ambulatoriale e della distribuzione diretta nella Regione Lazio Aprile 2013
Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto. Carmelo Lupo
 Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto Carmelo Lupo RAS-RAF signaling Activation of the RAS-RAF signaling cascade occurs via the following sequential steps 1 : Activation
Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto Carmelo Lupo RAS-RAF signaling Activation of the RAS-RAF signaling cascade occurs via the following sequential steps 1 : Activation
SEBASTIANO FILETTI. Dipartimento di Medicina Interna e Specialità Mediche. Università di Roma Sapienza, Roma
 SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
IL REGISTRO ONCOLOGICO COME STRUMENTO DI IMPLEMENTAZIONE DELLE DECISIONI: QUALE RUOLO NELL HTA
 IL REGISTRO ONCOLOGICO COME STRUMENTO DI IMPLEMENTAZIONE DELLE DECISIONI: QUALE RUOLO NELL HTA Francesca Caprari Direttore Affari Istituzionali e Relazioni Esterne Celgene srl L inizio Il Registro AIFA
IL REGISTRO ONCOLOGICO COME STRUMENTO DI IMPLEMENTAZIONE DELLE DECISIONI: QUALE RUOLO NELL HTA Francesca Caprari Direttore Affari Istituzionali e Relazioni Esterne Celgene srl L inizio Il Registro AIFA
ATTO. REGIONE LIGURIA - Giunta Regionale LA GIUNTA REGIONALE SCHEMA N... NP/7675. O GG E TTO : Aggiornamento prontuario terapeutico regionale
 SCHEMA N.... NP/7675 DEL PROT. ANNO...2009 Dipartimen t o Sa lu te e Servizi Sociali O GG E TTO : Aggiornamento prontuario terapeutico regionale DELIBERAZIONE N. 565 IN 12/05/2009 LA GIUNTA REGIONALE del
SCHEMA N.... NP/7675 DEL PROT. ANNO...2009 Dipartimen t o Sa lu te e Servizi Sociali O GG E TTO : Aggiornamento prontuario terapeutico regionale DELIBERAZIONE N. 565 IN 12/05/2009 LA GIUNTA REGIONALE del
Sinossi di studio clinico Codice: GECP06/01 Pag. 1 di 5
 Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Master in FARMACOVIGILANZA
 MAFV Master in FARMACOVIGILANZA anno accademico 2011-2012 Piano di allineamento delle segnalazioni di reazioni avverse da nexavar fra il registro di monitoraggio intensivo oncologico e la rete nazionale
MAFV Master in FARMACOVIGILANZA anno accademico 2011-2012 Piano di allineamento delle segnalazioni di reazioni avverse da nexavar fra il registro di monitoraggio intensivo oncologico e la rete nazionale
ALLEGATO 3. Nome composto. consolidati sulla base di evidenze scientifiche presenti in letteratura
 ALLEGATO 3 FARMACI CON USO CONSOLIDATO NEL TRATTAMENTO DELLE NEOPLASIE EMATOLOGICHE PER INDICAZIONI ANCHE DIFFERENTI DA QUELLE PREVISTE DAL PROVVEDIMENTO DI AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO Nome
ALLEGATO 3 FARMACI CON USO CONSOLIDATO NEL TRATTAMENTO DELLE NEOPLASIE EMATOLOGICHE PER INDICAZIONI ANCHE DIFFERENTI DA QUELLE PREVISTE DAL PROVVEDIMENTO DI AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO Nome
Espressione di geni specifici per un determinato tumore
 Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
Allegato n 5. Studi clinici controllati condotti dalla Struttura Complessa di Oncologia Medica ed Ematologia nel quinquennio 2003-2007
 Allegato n 5 Studi clinici controllati condotti dalla Struttura Complessa di Oncologia Medica ed Ematologia nel quinquennio 2003-2007 Anno 2003 1. XRP6976/F/2501 Studio randomizzato di fase II che valuta
Allegato n 5 Studi clinici controllati condotti dalla Struttura Complessa di Oncologia Medica ed Ematologia nel quinquennio 2003-2007 Anno 2003 1. XRP6976/F/2501 Studio randomizzato di fase II che valuta
Scritto da RyderItalia Mercoledì 12 Maggio 2010 11:19 - Ultimo aggiornamento Mercoledì 03 Novembre 2010 15:57
 LA TERAPIA METRONOMICA Per oltre mezzo secolo, la terapia sistemica per i tumori è stata caratterizzata dalla somministrazione dei farmaci chemioterapici. La maggior parte di questi farmaci ha lo scopo
LA TERAPIA METRONOMICA Per oltre mezzo secolo, la terapia sistemica per i tumori è stata caratterizzata dalla somministrazione dei farmaci chemioterapici. La maggior parte di questi farmaci ha lo scopo
Regione Lazio. Decreti del Commissario ad Acta 31/05/ BOLLETTINO UFFICIALE DELLA REGIONE LAZIO - N. 43
 Regione Lazio Decreti del Commissario ad Acta Decreto del Commissario ad Acta 24 maggio 2016, n. U00185 Aggiornamento elenco dei farmaci oncologici ad alto costo ai fini dell'addebito in mobilità sanitaria
Regione Lazio Decreti del Commissario ad Acta Decreto del Commissario ad Acta 24 maggio 2016, n. U00185 Aggiornamento elenco dei farmaci oncologici ad alto costo ai fini dell'addebito in mobilità sanitaria
Neoplasie della mammella - 2
 Neoplasie della mammella - 2 Fattori prognostici Numero di N+ : >3 Età e stato menopausale Diametro di T Invasione linfatica e vascolare Tipo istologico Grading Recettore per Estrogeni/Progesterone Amplificazione
Neoplasie della mammella - 2 Fattori prognostici Numero di N+ : >3 Età e stato menopausale Diametro di T Invasione linfatica e vascolare Tipo istologico Grading Recettore per Estrogeni/Progesterone Amplificazione
LEUCEMIE ACUTE LINFOIDI DELL'ADULTO
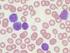 LEUCEMIE ACUTE LINFOIDI DELL'ADULTO La leucemia acuta linfoide è una malattia non frequente (15% delle forme leucemiche) in cui vi è una proliferazione maligna di cellule linfoidi nel midollo, nel sangue
LEUCEMIE ACUTE LINFOIDI DELL'ADULTO La leucemia acuta linfoide è una malattia non frequente (15% delle forme leucemiche) in cui vi è una proliferazione maligna di cellule linfoidi nel midollo, nel sangue
GLI EFFETTI DEGLI INTERVENTI CENTRALI E DEI PROVVEDIMENTI REGIONALI
 L uso dei farmaci in Italia dal 2000 ad oggi: tra sostenibilità e innovazione possibile Istituto Superiore di Sanità - 4 luglio 2013 GLI EFFETTI DEGLI INTERVENTI CENTRALI E DEI PROVVEDIMENTI REGIONALI
L uso dei farmaci in Italia dal 2000 ad oggi: tra sostenibilità e innovazione possibile Istituto Superiore di Sanità - 4 luglio 2013 GLI EFFETTI DEGLI INTERVENTI CENTRALI E DEI PROVVEDIMENTI REGIONALI
ATTO. REGIONE LIGURIA - Giunta Regionale LA GIUNTA REGIONALE SCHEMA N... NP/22876
 O GG E TTO : Individuazione Centri prescrittori medicinali sottoposti a registro AIFA: "Nivolumab BMS", "Imnovid" e altri. N. 1208 IN 03/11/2015 LA GIUNTA REGIONALE del REGISTRO ATTI DELLA GIUNTA DATA
O GG E TTO : Individuazione Centri prescrittori medicinali sottoposti a registro AIFA: "Nivolumab BMS", "Imnovid" e altri. N. 1208 IN 03/11/2015 LA GIUNTA REGIONALE del REGISTRO ATTI DELLA GIUNTA DATA
Avastin è utilizzato con altri medicinali antitumorali per il trattamento dei seguenti tipi di tumore negli adulti:
 EMA/175824/2015 EMEA/H/C/000582 Riassunto destinato al pubblico bevacizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/175824/2015 EMEA/H/C/000582 Riassunto destinato al pubblico bevacizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel.
 BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel. (09-09-2008) Specialità: Avastin(Roche spa) Forma farmaceutica:
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel. (09-09-2008) Specialità: Avastin(Roche spa) Forma farmaceutica:
L accesso ai nuovi farmaci antitumorali nelle Regioni. Angelo C. Palozzo Direttore Farmacia Istituto Oncologico Veneto IRCCS Padova
 L accesso ai nuovi farmaci antitumorali nelle Regioni Angelo C. Palozzo Direttore Farmacia Istituto Oncologico Veneto IRCCS Padova IL CONTESTO 1947 Costituzione della Repubblica Italiana Art. 32 La Repubblica
L accesso ai nuovi farmaci antitumorali nelle Regioni Angelo C. Palozzo Direttore Farmacia Istituto Oncologico Veneto IRCCS Padova IL CONTESTO 1947 Costituzione della Repubblica Italiana Art. 32 La Repubblica
ONCOVIEW 2012. Istruzioni per la compilazione delle schede pazienti
 ONCOVIEW 2012 Istruzioni per la compilazione delle schede pazienti ONCOVIEW - COME SI COLLABORA Lo studio ONCOVIEW ha l obiettivo di fornire un quadro esaustivo ed approfondito delle terapie farmacologiche
ONCOVIEW 2012 Istruzioni per la compilazione delle schede pazienti ONCOVIEW - COME SI COLLABORA Lo studio ONCOVIEW ha l obiettivo di fornire un quadro esaustivo ed approfondito delle terapie farmacologiche
LE RETI ONCOLOGICHE REGIONALI
 LE RETI ONCOLOGICHE REGIONALI Presente, Problematiche e Prospettive future Giampietro Gasparini Direttore Struttura Complessa di Oncologia A.C.O. San Filippo Neri Roma, Camera dei Deputati, 29 Settembre
LE RETI ONCOLOGICHE REGIONALI Presente, Problematiche e Prospettive future Giampietro Gasparini Direttore Struttura Complessa di Oncologia A.C.O. San Filippo Neri Roma, Camera dei Deputati, 29 Settembre
Breast Units / Centri di Senologia: verso gli standard europei
 Breast Units / Centri di Senologia: verso gli standard europei Approccio multidisciplinare e medicina personalizzata Roberto Labianca Direttore Cancer Center AO Papa Giovanni XXIII Direttore DIPO Bergamo
Breast Units / Centri di Senologia: verso gli standard europei Approccio multidisciplinare e medicina personalizzata Roberto Labianca Direttore Cancer Center AO Papa Giovanni XXIII Direttore DIPO Bergamo
16th World Conference on Lung Cancer (WCLC): highlights
 16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
SCHEDA FARMACO. Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE CONSIDERATO ETICO
 COME E QUANDO GLI ASPETTI TECNICI DEI PROTOCOLLI POSSONO-DEVONO ESSERE OGGETTO-ARGOMENTO DI DECISIONI ETICHE? Fausto Roila Oncologia Medica, Terni NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE
COME E QUANDO GLI ASPETTI TECNICI DEI PROTOCOLLI POSSONO-DEVONO ESSERE OGGETTO-ARGOMENTO DI DECISIONI ETICHE? Fausto Roila Oncologia Medica, Terni NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE
La rilevanza clinica della Neutropenia in Oncologia. Lorenzo Belluomini Oncologia Medica Negrar, 15/05/2019
 La rilevanza clinica della Neutropenia in Oncologia Lorenzo Belluomini Oncologia Medica Negrar, 15/05/2019 Neutropenia Evento comune nei pz trattati con chemioterapia: 20-40% dei pz con neoplasie solide
La rilevanza clinica della Neutropenia in Oncologia Lorenzo Belluomini Oncologia Medica Negrar, 15/05/2019 Neutropenia Evento comune nei pz trattati con chemioterapia: 20-40% dei pz con neoplasie solide
LA COMMISSIONE UNICA DEL FARMACO. Viste le proprie deliberazioni assunte nelle sedute del 25 gennaio 2000 e 7 giugno 2000; Dispone: Art. l.
 PROVVEDIMENTO 20 luglio 2000. Istituzione dell'elenco delle specialità medicinali erogabili a totale carico del Servizio sanitario nazionale ai sensi della legge 648/96. LA COMMISSIONE UNICA DEL FARMACO
PROVVEDIMENTO 20 luglio 2000. Istituzione dell'elenco delle specialità medicinali erogabili a totale carico del Servizio sanitario nazionale ai sensi della legge 648/96. LA COMMISSIONE UNICA DEL FARMACO
 Agenzia Italiana del Farmaco Bando di assegnazione di finanziamento per la Ricerca indipendente sui farmaci Area 2 - Studi comparativi fra farmaci e strategie farmacologiche Art. 48, commi 5 lett. g) e
Agenzia Italiana del Farmaco Bando di assegnazione di finanziamento per la Ricerca indipendente sui farmaci Area 2 - Studi comparativi fra farmaci e strategie farmacologiche Art. 48, commi 5 lett. g) e
Dott. Alessandro Fabbri U.O. Pneumologia ASL 3 PT Direttore ff Dott. Franco Vannucci
 Dott. Alessandro Fabbri U.O. Pneumologia ASL 3 PT Direttore ff Dott. Franco Vannucci Negli ultimi anni c è stato un notevole cambiamento nella gestione diagnosticoterapeutica dei soggetti affetti da neoplasia
Dott. Alessandro Fabbri U.O. Pneumologia ASL 3 PT Direttore ff Dott. Franco Vannucci Negli ultimi anni c è stato un notevole cambiamento nella gestione diagnosticoterapeutica dei soggetti affetti da neoplasia
T.E.V. E CHEMIOTERAPIA. Dott. Pietro Masullo
 T.E.V. E CHEMIOTERAPIA Dott. Pietro Masullo I MECCANISMI SONO MOLTEPLICI, SPESSO PRESENTI CONTEMPORANEAMENTE E NON ANCORA DEL TUTTO CHIARI LA CHEMIOTERAPIA PU0 AUMENTARE IL RISCHIO TEV ATTRAVERSO
T.E.V. E CHEMIOTERAPIA Dott. Pietro Masullo I MECCANISMI SONO MOLTEPLICI, SPESSO PRESENTI CONTEMPORANEAMENTE E NON ANCORA DEL TUTTO CHIARI LA CHEMIOTERAPIA PU0 AUMENTARE IL RISCHIO TEV ATTRAVERSO
Diritto alla salute e sostenibilità in una sanità federale. La SIFO interroga e propone
 Diritto alla salute e sostenibilità in una sanità federale. La SIFO interroga e propone XXXI Congresso Nazionale SIFO Cagliari 6-8 ottobre 2010 Tavola rotonda Regole e strumenti di sistema e di indirizzo.
Diritto alla salute e sostenibilità in una sanità federale. La SIFO interroga e propone XXXI Congresso Nazionale SIFO Cagliari 6-8 ottobre 2010 Tavola rotonda Regole e strumenti di sistema e di indirizzo.
LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO
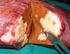 LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO Cetuximab può ridurre la massa tumorale per permettere la resezione delle metastasi, anche, in pazienti inizialmente non resecabili,
LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO Cetuximab può ridurre la massa tumorale per permettere la resezione delle metastasi, anche, in pazienti inizialmente non resecabili,
Anticorpi monoclonali Anti-EGFR. -Ruolo Biologico -Evidenze terapeutiche -Problemi -Sviluppi futuri. Valentina Anrò
 Anticorpi monoclonali Anti-EGFR -Ruolo Biologico -Evidenze terapeutiche -Problemi -Sviluppi futuri Valentina Anrò Ruolo Biologico Epidermal Growth Factor Receptor Extracellular Domain Transmembrane Domain
Anticorpi monoclonali Anti-EGFR -Ruolo Biologico -Evidenze terapeutiche -Problemi -Sviluppi futuri Valentina Anrò Ruolo Biologico Epidermal Growth Factor Receptor Extracellular Domain Transmembrane Domain
Terapia in fase Avanzata
 IL CARCINOMA DEL COLON-RETTO 14 OTTOBRE 2011, ROMA Terapia in fase Avanzata Maria Sofia Rosati Oncologia A Policlinico Umberto I Roma Numeri.. e persone!! ***Solo il 56% *50% dei pz con CRC è over 70 degli
IL CARCINOMA DEL COLON-RETTO 14 OTTOBRE 2011, ROMA Terapia in fase Avanzata Maria Sofia Rosati Oncologia A Policlinico Umberto I Roma Numeri.. e persone!! ***Solo il 56% *50% dei pz con CRC è over 70 degli
LINEE GUIDA TERAPEUTICHE TUMORI DEL COLON
 LINEE GUIDA TERAPEUTICHE TUMORI DEL COLON DATA DI AGGIORNAMENTO: MARZO 2012 Adenoma con displasia alto grado o severa (1) Escissione locale completa endoscopica in unica escissione (non piecemeal) Resezione
LINEE GUIDA TERAPEUTICHE TUMORI DEL COLON DATA DI AGGIORNAMENTO: MARZO 2012 Adenoma con displasia alto grado o severa (1) Escissione locale completa endoscopica in unica escissione (non piecemeal) Resezione
LE SINDROMI MIELODISPLASTICHE. Sono disordini acquisiti clonali delle cellule staminali emopoietiche
 LE SINDROMI MIELODISPLASTICHE Sono disordini acquisiti clonali delle cellule staminali emopoietiche EMOPOIESI INEFFICACE (midollo ipercellulare) ANEMIA e/o NEUTROPENIA e/o PIASTRINOPENIA EVOLUZIONE IN
LE SINDROMI MIELODISPLASTICHE Sono disordini acquisiti clonali delle cellule staminali emopoietiche EMOPOIESI INEFFICACE (midollo ipercellulare) ANEMIA e/o NEUTROPENIA e/o PIASTRINOPENIA EVOLUZIONE IN
Accesso ai farmaci innovativi: alternative all AIC
 Accesso ai farmaci innovativi: alternative all AIC Maria Lebboroni Servizio di Farmacia Ospedaliera ULSS 9 Treviso Premessa Sperimentazione clinica Immissione in commercio (AIC) normativa farmacovigilanza
Accesso ai farmaci innovativi: alternative all AIC Maria Lebboroni Servizio di Farmacia Ospedaliera ULSS 9 Treviso Premessa Sperimentazione clinica Immissione in commercio (AIC) normativa farmacovigilanza
Algoritmi e percorsi terapeutici dei Carcinomi del Polmone
 Algoritmi e percorsi terapeutici dei Carcinomi del Polmone Standard Individualizzata Sperimentale Stadio Ia/Ib T1-2a N0 M0 radicale) CHIR con resezione sub-lobare, solo stadio Ib CHIR con VATS campionamento
Algoritmi e percorsi terapeutici dei Carcinomi del Polmone Standard Individualizzata Sperimentale Stadio Ia/Ib T1-2a N0 M0 radicale) CHIR con resezione sub-lobare, solo stadio Ib CHIR con VATS campionamento
Allegato A al Decreto n. 136 del 15 novembre 2017 pag. 1/7
 giunta regionale Allegato A al Decreto n. 136 del 15 novembre 2017 pag. 1/7 Elenco dei Centri regionali autorizzati alla prescrizione dei farmaci oncologici, oggetto di specifiche determine AIFA*. PRINCIPIO
giunta regionale Allegato A al Decreto n. 136 del 15 novembre 2017 pag. 1/7 Elenco dei Centri regionali autorizzati alla prescrizione dei farmaci oncologici, oggetto di specifiche determine AIFA*. PRINCIPIO
sintesi dei risultati
 sintesi dei risultati In questo primo rapporto collaborativo tra i registri tumori delle province emiliane di Parma, Reggio Emilia e Modena vengono presentati i dati di incidenza, mortalità e sopravvivenza
sintesi dei risultati In questo primo rapporto collaborativo tra i registri tumori delle province emiliane di Parma, Reggio Emilia e Modena vengono presentati i dati di incidenza, mortalità e sopravvivenza
LA CHEMIOTERAPIA NEL TUMORE DEL POLMONE
 LA CHEMIOTERAPIA NEL TUMORE DEL POLMONE Gianna Regis qualche informazione Il tumore del polmone rappresenta la prima tra le cause di morte tumorale in termini di frequenza tra i maschi e la seconda tra
LA CHEMIOTERAPIA NEL TUMORE DEL POLMONE Gianna Regis qualche informazione Il tumore del polmone rappresenta la prima tra le cause di morte tumorale in termini di frequenza tra i maschi e la seconda tra
La terapia medica primaria e adiuvante e il follow-up: le principali novità. a cura di Claudio Zamagni (Bologna) e Antonio Frassoldati (Ferrara)
 Protocollo diagnostico-terapeutico per le Pazienti con carcinoma mammario La terapia medica primaria e adiuvante e il follow-up: le principali novità a cura di Claudio Zamagni (Bologna) e Antonio Frassoldati
Protocollo diagnostico-terapeutico per le Pazienti con carcinoma mammario La terapia medica primaria e adiuvante e il follow-up: le principali novità a cura di Claudio Zamagni (Bologna) e Antonio Frassoldati
Sarcomi delle parti molli
 Sarcomi delle parti molli Sarcomi dei tessuti molli ad alto rischio in fase localizzata degli arti e del tronco: approccio integrato con chemioterapia standard vs chemioterapia orientata per istotipo in
Sarcomi delle parti molli Sarcomi dei tessuti molli ad alto rischio in fase localizzata degli arti e del tronco: approccio integrato con chemioterapia standard vs chemioterapia orientata per istotipo in
Rassegna Stampa. Comunicato stampa. Intermedia s.r.l. per la comunicazione integrata
 Rassegna Stampa Comunicato stampa TUMORE DEL SENO: FUNZIONA LA TERAPIA "ACCELERATA" "IL 94% DEI PAZIENTI GUARISCE CON I TEMPI DI CURA PIU' BREVI" Intermedia s.r.l. per la comunicazione integrata Via Malta,
Rassegna Stampa Comunicato stampa TUMORE DEL SENO: FUNZIONA LA TERAPIA "ACCELERATA" "IL 94% DEI PAZIENTI GUARISCE CON I TEMPI DI CURA PIU' BREVI" Intermedia s.r.l. per la comunicazione integrata Via Malta,
Allegato B al Decreto n. 37 del 28 marzo 2017 pag. 1/7
 giunta regionale Allegato B al Decreto n. 37 del 28 marzo 2017 pag. 1/7 Elenco dei Centri regionali autorizzati alla prescrizione dei farmaci oncologici, oggetto di specifiche determine AIFA. PRINCIPIO
giunta regionale Allegato B al Decreto n. 37 del 28 marzo 2017 pag. 1/7 Elenco dei Centri regionali autorizzati alla prescrizione dei farmaci oncologici, oggetto di specifiche determine AIFA. PRINCIPIO
METASTASI POLMONARI. Terapia Oncologica. Dott. Marcello Tiseo Unità Operativa di Oncologia Medica Azienda Ospedaliero-Universitaria di Parma
 METASTASI POLMONARI Terapia Oncologica Dott. Marcello Tiseo Unità Operativa di Oncologia Medica Azienda Ospedaliero-Universitaria di Parma Metastasi polmonari: EPIDEMIOLOGIA Prevalenza nelle autopsie di
METASTASI POLMONARI Terapia Oncologica Dott. Marcello Tiseo Unità Operativa di Oncologia Medica Azienda Ospedaliero-Universitaria di Parma Metastasi polmonari: EPIDEMIOLOGIA Prevalenza nelle autopsie di
Il mieloma multiplo La terapia
 MIELOMA MULTIPLO Il mieloma multiplo è una malattia neoplastica caratterizzata dalla proliferazione e accumulo nel midollo osseo di linfociti e di plasmacellule che, direttamente o indirettamente, possono
MIELOMA MULTIPLO Il mieloma multiplo è una malattia neoplastica caratterizzata dalla proliferazione e accumulo nel midollo osseo di linfociti e di plasmacellule che, direttamente o indirettamente, possono
I contributi all A.L.C. - ONLUS - possono essere detratti dalla dichiarazione dei redditi in base all art. 13 D.LGS. n. 460 del 4/12/97.
 L Associazione Laura Coviello è nata nel 1996, indipendente e senza fini di lucro, con lo scopo di aiutare i malati leucemici con informazioni mirate e specifiche e sostenere il Centro Trapianti di Midollo
L Associazione Laura Coviello è nata nel 1996, indipendente e senza fini di lucro, con lo scopo di aiutare i malati leucemici con informazioni mirate e specifiche e sostenere il Centro Trapianti di Midollo
I Registri dei farmaci sottoposti a monitoraggio
 I Registri dei farmaci sottoposti a monitoraggio Introdotti dall Agenzia Italiana del Farmaco AIFA - nel 2006 allo scopo di: verificare l appropriatezza prescrittiva di un medicinale dopo la sua autorizzazione
I Registri dei farmaci sottoposti a monitoraggio Introdotti dall Agenzia Italiana del Farmaco AIFA - nel 2006 allo scopo di: verificare l appropriatezza prescrittiva di un medicinale dopo la sua autorizzazione
Sofosbuvir: Up to date in regione Veneto
 Sofosbuvir: Up to date in regione Veneto Il caso Sofosbuvir è considerato il paradigma attuale e futuro di riferimento su cui basare la politica nazionale del farmaco per i farmaci ad alto costo. AIFA
Sofosbuvir: Up to date in regione Veneto Il caso Sofosbuvir è considerato il paradigma attuale e futuro di riferimento su cui basare la politica nazionale del farmaco per i farmaci ad alto costo. AIFA
Metodologia di calcolo del pay-back 5% - 2013
 Metodologia di calcolo del pay-back 5% - 2013 Vista la proroga al 31 dicembre 2013 emanata ai sensi del D.P.C.M. 26 giugno 2013, dei termini previsti all art.9, comma 1, del D.L. 31 dicembre 2007, n.248,
Metodologia di calcolo del pay-back 5% - 2013 Vista la proroga al 31 dicembre 2013 emanata ai sensi del D.P.C.M. 26 giugno 2013, dei termini previsti all art.9, comma 1, del D.L. 31 dicembre 2007, n.248,
Report dei Registri Farmaci sottoposti a monitoraggio AIFA Annualità Assessorato alla Sanità Regione Campania UOD 08-DG 04
 Report dei Registri Farmaci sottoposti a monitoraggio AIFA Annualità 2013-2014-2015-2016 Assessorato alla Sanità Regione Campania UOD 08-DG 04 Elaborazione: Dott. Crescenzo Ilardi (Referente Registri AIFA)
Report dei Registri Farmaci sottoposti a monitoraggio AIFA Annualità 2013-2014-2015-2016 Assessorato alla Sanità Regione Campania UOD 08-DG 04 Elaborazione: Dott. Crescenzo Ilardi (Referente Registri AIFA)
INFORMATIVA PROFESSIONALE n. 25 del 29.05.2009. Informazioni di sicurezza relative all uso di thalidomide celgene (principio attivo: talidomide)
 Brescia, 3 giugno 2009 Circ. n. 169 INFORMATIVA PROFESSIONALE n. 25 del 29.05.2009 Informazioni di sicurezza relative all uso di thalidomide celgene (principio attivo: talidomide) La Regione Lombardia,
Brescia, 3 giugno 2009 Circ. n. 169 INFORMATIVA PROFESSIONALE n. 25 del 29.05.2009 Informazioni di sicurezza relative all uso di thalidomide celgene (principio attivo: talidomide) La Regione Lombardia,
Elenco dei test di patologia cromosomica e molecolare
 Elenco dei test di patologia cromosomica e molecolare Test Metodo utilizzato Osservazioni, indicazioni Amplificazione genica Her2/neu nei carcinoma mammari e gastrici L amplificazione genica di Her2/neu
Elenco dei test di patologia cromosomica e molecolare Test Metodo utilizzato Osservazioni, indicazioni Amplificazione genica Her2/neu nei carcinoma mammari e gastrici L amplificazione genica di Her2/neu
Documento PTR n.212 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Specialità: Avastin(Roche spa)
 BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in ricaduta in aggiunta a chemioterapia a base
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in ricaduta in aggiunta a chemioterapia a base
I FARMACI ONCOLOGICI INNOVATIVI ED I PROTOCOLLI CONDIVISI
 I FARMACI ONCOLOGICI INNOVATIVI ED I PROTOCOLLI CONDIVISI Dr. Tullio Testa U.O. Farmacia A.O.H.Maggiore di Crema Gruppo di Lavoro S.I.F.O.in Oncologia Regione Lombardia L esperienza del Farmacista delle
I FARMACI ONCOLOGICI INNOVATIVI ED I PROTOCOLLI CONDIVISI Dr. Tullio Testa U.O. Farmacia A.O.H.Maggiore di Crema Gruppo di Lavoro S.I.F.O.in Oncologia Regione Lombardia L esperienza del Farmacista delle
APPROCCIO RADIOTERAPICO
 Unità operativa di Radioterapia Azienda Ospedaliera di Parma APPROCCIO RADIOTERAPICO Dott.ssa Dell Anna Cristina TUMORI PRIMITIVI DELLA PARETE TORACICA Sono tumori eterogenei che possono prendere origine
Unità operativa di Radioterapia Azienda Ospedaliera di Parma APPROCCIO RADIOTERAPICO Dott.ssa Dell Anna Cristina TUMORI PRIMITIVI DELLA PARETE TORACICA Sono tumori eterogenei che possono prendere origine
Trattamento di seconda linea dei carcinomi. Trattamento di tumori neuroendocrini in fase. avanzati del tratto gastroenterico (colon, retto,
 Irinotecan Carcinoma colonretto avanzato: In combinazione con 5FU/FA in pazienti non precedentemente trattati con CT per malattia avanzata. Come monochemioterapia in pazienti già trattati con regime convenzionale
Irinotecan Carcinoma colonretto avanzato: In combinazione con 5FU/FA in pazienti non precedentemente trattati con CT per malattia avanzata. Come monochemioterapia in pazienti già trattati con regime convenzionale
Allegato A al Decreto n. 42 del 13 aprile 2017 pag. 1/8
 giunta regionale Allegato A al Decreto n. 42 del 13 aprile 2017 pag. 1/8 Elenco dei Centri regionali autorizzati alla prescrizione dei farmaci oncologici, oggetto di specifiche determine AIFA*. PRINCIPIO
giunta regionale Allegato A al Decreto n. 42 del 13 aprile 2017 pag. 1/8 Elenco dei Centri regionali autorizzati alla prescrizione dei farmaci oncologici, oggetto di specifiche determine AIFA*. PRINCIPIO
E.Molfese, P.Matteucci, A.Iurato, M. Fiore, L.E. Trodella, L. Poggesi, R.M. D Angelillo, E. Iannacone, L.Trodella!
 Il trattamento stereotassico delle lesioni surrenaliche in pazienti oligometastatici affetti da NSCLC: una promettente arma per il controllo locale di malattia?! E.Molfese, P.Matteucci, A.Iurato, M. Fiore,
Il trattamento stereotassico delle lesioni surrenaliche in pazienti oligometastatici affetti da NSCLC: una promettente arma per il controllo locale di malattia?! E.Molfese, P.Matteucci, A.Iurato, M. Fiore,
Allegato A al Decreto n. 102 del 8 agosto 2017 pag. 1/6
 giunta regionale Allegato A al Decreto n. 102 del 8 agosto 2017 pag. 1/6 Elenco dei Centri regionali autorizzati alla prescrizione dei farmaci oncologici, oggetto di specifiche determine AIFA*. PRINCIPIO
giunta regionale Allegato A al Decreto n. 102 del 8 agosto 2017 pag. 1/6 Elenco dei Centri regionali autorizzati alla prescrizione dei farmaci oncologici, oggetto di specifiche determine AIFA*. PRINCIPIO
NSCLC - stadio iiib/iv
 I TUMORI POLMONARI linee guida per la pratica clinica NSCLC - stadio iiib/iv quale trattamento per i pazienti anziani con malattia avanzata? Il carcinoma polmonare è un tumore frequente nell età avanzata.
I TUMORI POLMONARI linee guida per la pratica clinica NSCLC - stadio iiib/iv quale trattamento per i pazienti anziani con malattia avanzata? Il carcinoma polmonare è un tumore frequente nell età avanzata.
consolidati sulla base di evidenze scientifiche Utilizzo nel melanoma maligno. Via di Estensione di indicazione relativa ad usi
 ALLEGATO 1 - Aprile 2011 FARMACI CON USO CONSOLIDATO NEL TRATTAMENTO DEI TUMORI SOLIDI NELL ADULTO PER INDICAZIONI ANCHE DIFFERENTI DA QUELLE PREVISTE DAL PROVVEDIMENTO DI AUTORIZZAZIONE ALL IMMISSIONE
ALLEGATO 1 - Aprile 2011 FARMACI CON USO CONSOLIDATO NEL TRATTAMENTO DEI TUMORI SOLIDI NELL ADULTO PER INDICAZIONI ANCHE DIFFERENTI DA QUELLE PREVISTE DAL PROVVEDIMENTO DI AUTORIZZAZIONE ALL IMMISSIONE
Focus su epatite C e terapie di nuova generazione Place in Therapy: documento ARS
 Focus su epatite C e terapie di nuova generazione Place in Therapy: documento ARS Genova, 9 aprile 2014 Dott.ssa M.S. Rivetti Normativa Determinazioni AIFA 26.11.2012 (G.U. n. 287 del 10.12.2012) Regime
Focus su epatite C e terapie di nuova generazione Place in Therapy: documento ARS Genova, 9 aprile 2014 Dott.ssa M.S. Rivetti Normativa Determinazioni AIFA 26.11.2012 (G.U. n. 287 del 10.12.2012) Regime
DECRETI E DELIBERE DI ALTRE AUTORITÀ
 DECRETI E DELIBERE DI ALTRE AUTORITÀ AGENZIA ITALIANA DEL FARMACO DETERMINA 17 giugno 2013. Classificazione del medicinale per uso umano «Kristexxa», secondo procedura centralizzata. (Determina n. 583/2013).
DECRETI E DELIBERE DI ALTRE AUTORITÀ AGENZIA ITALIANA DEL FARMACO DETERMINA 17 giugno 2013. Classificazione del medicinale per uso umano «Kristexxa», secondo procedura centralizzata. (Determina n. 583/2013).
Le norme tributarie disciplinanti la liquidazione
 Le norme tributarie disciplinanti la liquidazione Art. 182 Tuir: regole di determinazione del reddito d impresa durante la fase di liquidazione; Art. 17 e 21 Tuir: condizioni e modalità per la tassazione
Le norme tributarie disciplinanti la liquidazione Art. 182 Tuir: regole di determinazione del reddito d impresa durante la fase di liquidazione; Art. 17 e 21 Tuir: condizioni e modalità per la tassazione
PASQUALE FREGA Assobiotec
 ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
I tumori rari in oncologia: fondamenti scientifici e aspetti legislativi
 I tumori rari in oncologia: fondamenti scientifici e aspetti legislativi DEFINIZIONE DI TUMORE RARO Dott. Luciano Stumbo UOC Oncologia ACO S. Filippo Neri - Roma Roma, 19 settembre 2013 Quando un tumore
I tumori rari in oncologia: fondamenti scientifici e aspetti legislativi DEFINIZIONE DI TUMORE RARO Dott. Luciano Stumbo UOC Oncologia ACO S. Filippo Neri - Roma Roma, 19 settembre 2013 Quando un tumore
