Chimica e chimica della vita
|
|
|
- Gianpaolo Fiorini
- 7 anni fa
- Visualizzazioni
Transcript
1 Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono del tungsteno diceva zio Dave. Non esiste nulla di simile. Non sapevo se fosse vero, ma non lo misi mai in dubbio. Da: Oliver Sacks Zio Tungsteno Ed. Adelphi Per chiunque tema che la chimica (o la fisica) siano materie impossibili : un percorso di riconciliazione: Sacks, Zio Tungsteno, Adelphi; Feynman, Sei pezzi facili, Adelphi. (in modo particolare il capitolo 1) Chimica della vita: elementi da ripassare Materia ed elementi Atomi e molecole Legami chimici Reazioni chimiche Chimica della vita: argomento della lezione Chimica organica Macromolecole organiche: Carboidrati Fosfolipidi Amminoacidi e proteine Acidi nucleici Materia ed elementi Materia: tutto ciò che occupa spazio e ha una massa - può essere in tre stati: solido,liquido e gassoso Elementi - Singole forme della materia che non possono essere divise in forme più semplici con delle reazioni chimiche ordinarie. Dei 115 elementi conosciuti 4 (C, O, N, ) costituiscono il 96% della massa degli organismi viventi. Ognuno dei 115 elementi presenta distinte categorie chimiche. Elementi ed atomi Atomi Atomi - Particelle più piccole che possiedono le caratteristiche degli elementi.sono costituiti da: Nucleo Protoni (carica elettrica positiva unitaria) Neutroni (carica neutra) Elettroni (carica elettrica negativa unitaria) Numero atomico: n di protoni per atomo; Massa atomica: somma di protoni e neutroni in un singolo atomo (massa elettrone = 1/1800 della massa di un protone e/o neutrone). Unità di misura = uma (unità di massa atomica) o dalton. 1 uma massa di un protone o neutrone Isotopo - Forme di un elemento che variano per differenze di massa atomica (differiscono per il numero di neutroni). Ciascun elemento ha nel nucleo un numero fisso di protoni. Tale numero è detto numero atomico. Nella tavola periodica gli elementi sono sistemati in un ordine che dipende (anche) dal loro numero atomico. 1
2 Tavola periodica degli elementi Da Figura 2-1 Solomon, Berg, Martin Elettroni ed orbitali Gli elettroni si muovono in particolari regioni dello spazio dette orbitali (rappresentati come nuvole elettroniche ). Ogni orbitale contiene al massimo due elettroni. L energia di un elettrone dipende dall orbitale che esso occupa. Elettroni posti in orbitali con energie simili hanno lo stesso livello energetico principale e costituiscono un guscio elettronico (modello di Bohr) Elettroni ed orbitali Modello di Bohr: configurazione elettronica dei primi 18 elementi Da Figura 2-4 Solomon, Berg, Martin Da Figura 2-9 Campbell - Reece Da Figura 2-10 Campbell - Reece Elettroni ed orbitali Gli elettroni di maggiore energia vengono detti elettroni di valenza e occupano il guscio di valenza che costituisce il cerchio più esterno del modello proposto da Bohr Da Figura 2-4 Solomon, Berg, Martin Da Figura 2-11 Campbell - Reece 2
3 Formule chimiche Una formula chimica è il modo più abbreviato per descrivere la composizione chimica di una sostanza. I simboli chimici identificano gli atomi presenti, e i numeri a pedice il rapporto tra gli atomi. Formula semplice o formula empirica: i.e. N 2 (rapporto 1:2 azoto e idrogeno). Formula molecolare: i.e. N 2 4 (ogni molecola di idrazina è in realtà composta da 2 atomi di azoto e quattro di idrogeno); 2 O (ogni molecola di acqua è in realtà composta da 2 atomi di idrogeno e uno di ossigeno). Formula di struttura: i.e. -O- (riporta non solo il tipo e il numero di atomi, ma anche la loro organizzazione reciproca). Molecole e composti Composto chimico. Atomi di due o più elementi differenti combinati in un rapporto fisso: i.e. NaCl (cloruro da sodio sale da cucina). Molecola. Due o più atomi che si combinano chimicamente e formano unità dette molecole 2 O (ogni molecola di acqua è in realtà composta da 2 atomi di idrogeno e uno di ossigeno). Molecole e composti Massa molecolare. La massa molecolare di un composto è la somma delle masse atomiche degli atomi che compongono ogni molecola. Acqua 2 O = (: 2 X 1uma) + (O: 1 X 16 uma) = 18 uma Glucosio C 6 12 O 6 = (C: 6 X 12 uma) + (: 12 X 1uma) + (O: 6 X 16 uma) = 180 uma Molecole e composti : moli Mole. La mole è la quantità di un composto la cui massa in grammi è equivalente alla sua massa atomica o molecolare. 1 mole di acqua corrisponde è 18 grammi (g), una mole di glucosio ha una massa di 180 g. Permette paragoni tra atomi e molecole di massa diversa perché una mole di ciascuna sostanza contiene sempre lo stesso numero di unità (sia che si tratti di piccoli atomi che di grandi molecole). In una mole ci sono 6,02 X unità (numero di Avogadro). 1 mole di 2 0 = 18 g = 6,02 X molecole 1 mole di 2 = 2 g = 6,02 X molecole 5 moli di C 6 12 O 6 = 900 g [5X180] = 30,1 [5X 6,02] X molecole Non si possono contare singolarmente gli atomi e le molecole, grazie al numero di Avogadro è possibile calcolarne il numero attraverso una pesatura. Molecole e composti: moli Il concetto di mole permette anche di paragonare tra loro le soluzioni. Una soluzione 1 molare si indica come 1M, contiene una mole di una data sostanza sciolta in un litro di soluzione. 1 litro di soluzione 1M glucosio [C 6 12 O 6 ] 1 litro di soluzione 1M saccarosio [C O 11 ] differiscono per la massa di zucchero disciolto (180 e 340 g) ma entrambe contengono 6,02 X molecole di zucchero Reazioni chimiche Il comportamento chimico di un atomo è determinato dal numero e dalla posizione degli elettroni di valenza. Il guscio di valenza di e e è completo (e cioè stabile) quando contiene 2 elettroni. Quando il guscio di valenza non è completo l atomo tende ad acquisire, cedere o condividere elettroni per completare il guscio esterno. Le reazioni chimiche possono essere descritte attraverso delle equazioni: C 6 12 O 6 + 6O 2 6CO O + Energia reagenti prodotti 3
4 Legami chimici Legami chimici - Forze (energia chimica) che uniscono gli atomi in molecole. L energia di legame è l energia necessaria per rompere il legame chimico. Covalenti - condivisione di elettroni tra due atomi adiacenti Ionici - Cationi (caricati positivamente) ed anioni (caricati negativamente) Idrogeno - Ineguale attrazione degli elettroni condivisi (nell acqua l atomo di ossigeno attrae gli elettroni condivisi molto di più di quanto non facciano gli atomi di idrogeno e questo fa si che gli atomi di idrogeno siano parzialmente positivi, mentre quello di ossigeno sia parzialmente negativo; ne consegue che gli atomi di idrogeno sono debolmente attratti dagli atomi di ossigeno delle molecole circostanti Legami covalenti Comportano la condivisione di elettroni tra due atomi adiacenti in modo tale che ogni atomo un guscio di valenza completo. I.e. Ogni atomo di idrogeno ha un solo elettrone di valenza e per completare il guscio di valenza ne sono necessari due. I due atomi hanno la stessa capacità di attrarre elettroni, quindi nessuno dona un elettrone all altro, ma condividono gli unici elettroni che vengono attratti dai due protoni. Di conseguenza gli elettroni ruotano attorno ad entrambi i nuclei, tenendo uniti gli atomi Da Figura 2-5 Solomon, Berg, Martin Legami covalenti I legami covalenti possono essere rappresentati mediante la formula di struttura o la forma di Lewis Formula di struttura Acqua ( 2 0): -O- Idrogeno molecolare ( 2 ): - Ammoniaca (N 3 ) Metano (C 4 ) N C Formula di Lewis Acqua ( 2 0): : O: Idrogeno molecolare ( 2 ): : Ammoniaca (N 3 ) Metano (C 4 ) : : : : : N: : : C: : Legami covalenti Singolo legame covalente: un doppietto di elettroni condiviso da due atomi Doppio legame covalente: due doppietti di elettroni condivisi da due atomi Triplo legame covalente: tre doppietti di elettroni condivisi da due atomi Da Figura 2-5 Solomon, Berg, Martin Legami covalenti Ogni molecola ha forma e caratteristiche ben precise. La forma geometrica di una molecola permette di mantenere la distanza ottimale tra gli elettroni per controbilanciare la repulsione dei doppietti elettronici. Un atomo legato covalentemente con altri atomi può presentare un riarrangiamento degli orbitali del guscio di valenza, in un processo detto ibridazione degli orbitali. Da Figura 2-6 Solomon, Berg, Martin Legami covalenti Gli atomi di ogni elemento differiscono per l affinità per gli elettroni. L elettronegatività è la misura dell attrazione esercitata da un atomo sulla coppia di elettroni di un legame covalente. Tra due atomi dello stesso elemento l attrazione è in equilibrio (legame covalente non polare). Tra due atomi con diversa elettronegatività gli elettroni sono attratti dal nucleo con maggior affinità (nell acqua dall ossigeno). Si parla in questo caso di legame covalente polare. Tale legame ha due estremità (o poli) diverse, una con carica negativa e una con carica positiva. Da Figura 2-7 Solomon, Berg, Martin 4
5 Legami ionici Ioni - Atomi che contengono un numero maggiore o minore di elettroni rispetto a protoni (sono quindi carichi elettricamente). Se un atomo ha 1,2,3 elettroni nel guscio di valenza tende a cederli, mentre se un atomo ha 5,6,7, elettroni nel guscio di valenza tende ad accettare elettroni da altri atomi. Cationi: caricati positivamente Anioni: caricati negativamente Legami ionici Legame ionico: conseguenza dell attrazione tra la carica positiva di un catione e la carica negativa di un anione. Esempio è il sale da cucina (cloruro di sodio NaCl) Da Figura 2-7 Solomon, Berg, Martin Da Figura 2-9 Solomon, Berg, Martin Legami ionici Un composto ionico tende ad essere i legami molto forti quando si trova allo stato solido (i.e. NaCl), ma posto in un solvente, come l acqua (anche grazie alla sua polarità) il solido si scioglie. Nella soluzione ogni catione e anione è circondato da estremità di molecole di acqua con la carica opposta Da Figura 2-10 Solomon, Berg, Martin Legami idrogeno Da Figura 2-11 Solomon, Berg, Martin L idrogeno può combinarsi con atomi elettronegativi, e questo conferisce una parziale carica positiva all idrogeno, che si lega anche ad altri atomi elettronegativi. Sono legami deboli (si formano e si rompono facilmente) ma se numerosi l insieme è molto forte Acqua Buona parte degli organismi è costituita da acqua 70% del nostro peso corporeo è costituito da acqua Nelle cellule umane il 20% delle ossa è costituito da acqua e il 85% delle cellule cerebrali è costituito da acqua. L acqua ha un ruolo fondamentale nel permettere la vita sulla terra Sostanze possono essere idrofile/idrofobe Acqua Da Figura 2-12 Solomon, Berg, Martin 5
6 Ioni, Acidi, e Basi Ioni - Atomi che contengono un numero maggiore o minore di elettroni rispetto a protoni (sono quindi carichi elettricamente). Acidi - sostanze che rilasciano ioni idorgeno. Basi - sostanze che legano ioni idrogeno. Scala p : 0-14 (usata per descrivere il numero di ioni idrogeno in una soluzione acquosa) < 7 Acidi > 7 Basi I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio. Quattro categorie principali: Carboidrati: in genere formula (C 2 O) n dove n rappresenta una serie di unità ripetitive che si organizzano in catene od anelli i.e. glucosio - C 6 12 O 6 Lipidi: i.e. grassi ed oli, - i lipidi costituiscono le pareti delle membrane cellulari Proteine: costituiscono la maggioranza dei componenti strutturali e funzionali delle cellule, sono composte da subunità -amminoacidi- e danno origine a catene e forme tridimensionali; gli enzimi sono esempi di proteine Acidi nucleici: sono le molecole contenti le informazioni genetiche che governano i processi vitali; sono costituiti da nucleotidi: combinazioni di molecole di zuccheri, strutture circolari contenenti azoto e ponti di fosforo che legano i nucleotidi Atomi e molecole di carbonio Atomi e molecole di carbonio Il carbonio possiede alcune proprietà, grazie alle quali può formare grandi molecole: possiede 4 elettroni di valenza e completa il suo guscio di valenza formando 4 legami covalenti; i legami carboniocarbonio sono forti e non vengono rotti facilmente (si possono avere 1, 2, 3 legami indicati rispettivamente C-C, C=C, C=C); le (macro)molecole organiche composte da C e possono formare catene ed anelli; Le molecole hanno una forma tridimensionale, anche se spesso vengono rappresentate su base bidimensionale; Da Figura 3-2 Solomon, Berg, Martin 6
7 Gruppi funzionali Gruppi funzionali Quando una o più atomi di idrogeno legati allo scheletro carbonioso di un idrocarburo vengono sostituiti da altri gruppi di atomi, detti gruppi funzionali si possono modificare le proprietà delle molecole organiche. Negli idrocarburi i legami covalenti C- sono apolari e non ci sono regioni cariche, quindi sono insolubili in acqua e tendono a raggrupparsi attraverso reazioni idrofobiche Gruppo ossidrilico R-O Polare Gruppo carbonilico Polare Aldeidi R-C- Chetoni R-C-R Carbossilico R-C-O Debolmente acido, può rilasciare uno ione + =O =O =O Amminico R-N Debolmente basico, può accettare uno o due ioni + Fosfato Debolmente acido, può rilasciare uno o due ioni + =O R-P-O - O Polimeri e monomeri Carboidrati Monosaccaridi, disaccaridi e polisaccaridi Carboidrati: in genere formula (C2O)n dove n rappresenta una serie di unità ripetitive che si organizzano in catene od anelli i.e. glucosio - C 6 12 O 6 Monosaccaridi Contengono in genere da tre a sette atomi di carbonio. Nei monosaccaridi tutti gli atomi di carbonio sono legati a un gruppo ossidrilico (-O), eccetto uno, che è legato con doppio legame a un ossigeno (=O) e forma un gruppo carbonilico. Disaccaridi Sono due monosaccaridi legati tra loro da mediante un legame glicosidico (un ossigeno centrale legato covalentemente a due atomi di carbonio, uno per anello. Polisaccaridi Sono costituiti da unità ripetute di uno zucchero semplice (generalmente il glucosio) Da Figura 3-6 Solomon, Berg, Martin 7
8 Glucosio: è il monoscaccaride più abbondante. Viene utilizzato come fonte di energia da quasi tutti gli organismi. Durante le fasi di respirazione cellulare le cellule ossidano il glucosio e rilasciano energia che può essere utilizzata per compiere il lavoro cellulare. Il glucosio serve anche per la sintesi di altri composti (i.e. amminoacidi e acidi grassi). Disaccaridi: Saccarosio e maltosio Maltosio + Acqua Glucosio + Glucosio Saccarosio + Acqua Glucosio + fruttosio Da Figura 3-7 Solomon, Berg, Martin Da Figura 3-8 Solomon, Berg, Martin Polisaccaridi - unità ripetute di uno zucchero semplice - Amido: (carboidrato di riserva delle piante) Cellulosa: rappresenta il 50% del carbonio vegetale. Per essere idrolizzato richiede enzimi specifici che non tutti gli animali hanno (i.e. l uomo ne è privo, e quindi la cellulosa non è un nutrimento, ovini, bovini e termiti ospitano dei batteri che sono in grado di digerire la cellulosa). Chitina: carboidrato con cui gli insetti costruiscono il loro esoscheletro I lipidi sono un gruppo eterogeneo di composti, generalmente solubili in solventi apolari e insolubili in solventi polari come l acqua. I lipidi più abbondanti negli organismi sono i trigliceridi, detti comunemente grassi. Sono una riserva di energia importante perché quando vengono metabolizzati forniscono più del doppio dell energia per grammo rispetto ai carboidrati. I fosfolipidi sono caratterizzati da avere una estremità polare e una apolare. Lipidi Da Figura 5-7 Campbell & Reece Da Figura 5-8 Campbell & Reece 8
9 Proteine Le proteine sono macromolecole costituite da amminoacidi. Sono coinvolte in tutti gli aspetti del metabolismo di un organismo Amminoacidi Gli amminoacidi hanno un gruppo amminico (-N 2 ) e uno carbossilico (-COO) legati allo stesso atomo di carbonio, detto carbonio α (carbonio alfa). Gli amminoacidi più comuni sono 20 Tutte le piante e i batteri sono in grado di sintetizzare a partire da sostanze semplici gli amminoacidi Gli animali no, e devono assumere attraverso la dieta alcuni amminoacidi, detti amminoacidi essenziali (variano da specie a specie) Da Figura 3-16 Solomon, Berg, Martin Gli amminoacidi si combinano tra loro legando il carbonio del gruppo carbossilico di una molecola all azoto del gruppo amminico di un altra molecola. Il legame covalente che tiene insieme due amminoacidi è detto legame peptidico. Da Figura 3-18 Solomon, Berg, Martin Proteine: livelli di organizzazione Le proteine hanno quattro livelli di organizzazione: struttura primaria (catena polipeptidica); struttura secondaria (legami idrogeno dello scheletro amminoacidico); struttura terziaria (interazioni tra gruppi laterali); struttura quaternaria (interazioni tra polipeptidi). struttura primaria: sequenza degli amminoacidi, Es. lisozima è una proteina costituita da 129 unità amminoacidi Nb una proteina composta da 129 unità di amminoacidi produrrebbe modi diversi di disporre tali amminoacidi. La struttura primaria di una proteina è determinata dall informazione genetica ereditaria presente in ogni organismo. Da Figura 3-19 Solomon, Berg, Martin Da Figura 5-18 Campbell & Reece 9
10 Piccole variazioni nella struttura primaria di una proteina possono influenzare la conformazione e la possibilità di funzionamento della proteina: i.e. anemia falciforme è un disordine ereditario del sangue dovuto alla sostituzione di un amminoacido con un altro in una singola posizione della struttura primaria dell emoglobina struttura secondaria (legami idrogeno dello scheletro amminoacidico); Due forme: α elica β foglietto Da Figura 3-20 Solomon, Berg, Martin Da Figura 5-19 Campbell & Reece Struttura terziaria è la forma complessiva assunta da ciascuna catena polipeptidica legami a idrogeno che si formano tra i gruppi R di alcune subunità amminoacidiche; Legami ionici tra i gruppi R carichi positivamente e quelli carichi negativamente interazioni idrofobiche (i gruppi R tendono a disporsi all interno della struttura globulare, lontano dall acqua circostante; legami covalenti che legano atomi di zolfo di due unità di cisteina detti ponti disolfuro S-S- Molte proteine sono costituite da più catene polipeptidiche, che interagiscono tra loro in modo specifico. La struttura quaternaria deriva dall interazione delle diverse catene polipeptidiche Da Figura 3-22 Solomon, Berg, Martin Da Figura 3-21 Solomon, Berg, Martin Acidi nucleici: Acidi nucleici: sono le molecole contenti le informazioni genetiche che governano i processi vitali; sono costituiti da nucleotidi: combinazioni di molecole di zuccheri, strutture circolari contenenti azoto e ponti di fosforo che legano i nucleotidi Nelle cellule ci sono due tipi di acidi nucleici: RNA (acido ribonucleico) DNA (acido desossiribonucleico) Acidi nucleici: Polimeri di nucleotidi zucchero a 5 atomi di carbonio (ribosio e desossiribosio) uno o più gruppi fosfati; basi azotate (purine e pirimidine) DNA contine le purine A (adenina), G (guanina) e le pirimidine C (citosina) e T (timina). RNA contine le purine A (adenina), G (guanina) e le pirimidine C (citosina) e U (uracile). 10
11 11
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Le molecole biologiche. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
 http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
Organizzazione della materia
 Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
LA CHIMICA DELLA VITA
 LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Indagine biologica: elevato livello di organizzazione delle strutture coinvolte.
 Indagine biologica: elevato livello di organizzazione delle strutture coinvolte. L organizzazione biologica si basa su una gerarchia di livelli strutturali Si parte dall atomo tessuti organi molecola organismo
Indagine biologica: elevato livello di organizzazione delle strutture coinvolte. L organizzazione biologica si basa su una gerarchia di livelli strutturali Si parte dall atomo tessuti organi molecola organismo
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Gerard Tortora, Brian Derrickson. Conosciamo
 1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
I composti organici. Il carbonio e i composti organici
 I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
LE MOLECOLE DELLA VITA
 LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Di cosa è fatta una cellula?
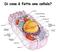 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Come si costruiscono le molecole in natura ed in laboratorio. Giuseppe Macino
 Come si costruiscono le molecole in natura ed in laboratorio Giuseppe Macino E Dio creo la luce Cosa tiene insieme tutta la materia che forma la terra? Tutto questo e costituito da ELEMENTI Gli elementi
Come si costruiscono le molecole in natura ed in laboratorio Giuseppe Macino E Dio creo la luce Cosa tiene insieme tutta la materia che forma la terra? Tutto questo e costituito da ELEMENTI Gli elementi
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
LE MOLECOLE BIOLOGICHE
 LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
Idrogeno (H) Azoto (N) La materia è costituita da elementi chimici. In natura sono presenti 92 elementi
 Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
LA CLASSIFICAZIONE DEI COMPOSTI CHIMICI
 LA LASSIFIAZIONE DEI OMPOSTI IMII Inorganici Acqua Sali minerali omposti chimici Idrocarburi arboidrati Organici Alcoli, aldeidi Molecole biologiche o biomolecole Lipidi Proteine Acidi nucleici Vitamine
LA LASSIFIAZIONE DEI OMPOSTI IMII Inorganici Acqua Sali minerali omposti chimici Idrocarburi arboidrati Organici Alcoli, aldeidi Molecole biologiche o biomolecole Lipidi Proteine Acidi nucleici Vitamine
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
La chimica della vita. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 La chimica della vita 1 Tutta la materia è composta da elementi chimici È materia qualsiasi cosa, vivente e non vivente, che occupi dello spazio e che abbia una massa. La materia è composta da elementi
La chimica della vita 1 Tutta la materia è composta da elementi chimici È materia qualsiasi cosa, vivente e non vivente, che occupi dello spazio e che abbia una massa. La materia è composta da elementi
CARBOIDRATI SEMPLICI
 CARBOIDRATI Dal greco glucos =dolce Glucidi Zuccheri Sostanze formate acqua e carbonio Hanno forma molecolare (CH₂O)n 1 CARBOIDRATI SEMPLICI Monosaccaridi, una sola unità di poliidrossi aldeide o di poliidrossi
CARBOIDRATI Dal greco glucos =dolce Glucidi Zuccheri Sostanze formate acqua e carbonio Hanno forma molecolare (CH₂O)n 1 CARBOIDRATI SEMPLICI Monosaccaridi, una sola unità di poliidrossi aldeide o di poliidrossi
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
I composti organici e i loro polimeri
 I ARBIDRATI I composti organici e i loro polimeri La diversità molecolare della vita è basata sulle proprietà del ARBNI. Un atomo di carbonio può formare quattro legami covalenti. Questi legami gli permettono
I ARBIDRATI I composti organici e i loro polimeri La diversità molecolare della vita è basata sulle proprietà del ARBNI. Un atomo di carbonio può formare quattro legami covalenti. Questi legami gli permettono
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
SOLUZIONI DEGLI ESERCIZI
 Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Liceo Scientifico Statale" A.ROMITA" CLASSE: 2C PROGRAMMA DI CHIMICA. ARGOMENTI: LA MOLE. La mole:unità di quantità e di sostanza.
 Liceo Scientifico Statale" A.ROMITA" CLASSE: 2C PROGRAMMA DI CHIMICA. ARGOMENTI: LA MOLE. La mole:unità di quantità e di sostanza. La costante di Avogadro. La massa molare. Relazione tra massa di una sostanza
Liceo Scientifico Statale" A.ROMITA" CLASSE: 2C PROGRAMMA DI CHIMICA. ARGOMENTI: LA MOLE. La mole:unità di quantità e di sostanza. La costante di Avogadro. La massa molare. Relazione tra massa di una sostanza
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
BIOMOLECOLE LE BASI DELLA BIOCHIMICA. Capitolo 1 Dal Carbonio agli OGM PLUS
 BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Lezione 1 ELEMENTI, COMPOSTI E LEGAMI
 Lezione 1 ELEMENTI, COMPOSTI E LEGAMI 1 1.4 Le particolari proprietà dell acqua favoriscono la vita esplorando Nell acqua, l ossigeno acquista una parziale carica negativa, mentre gli atomi di idrogeno
Lezione 1 ELEMENTI, COMPOSTI E LEGAMI 1 1.4 Le particolari proprietà dell acqua favoriscono la vita esplorando Nell acqua, l ossigeno acquista una parziale carica negativa, mentre gli atomi di idrogeno
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
F. Fogolari Milano, Marzo
 Biomolecole - 1 Federico Fogolari Dipartimento Scientifico e Tecnologico Universita di Verona Ca Vignal 1, Strada Le Grazie 15 37134 Verona, Italy tel. ++39-045-8027906 fax. ++39-045-8027929 email: fogolari@sci.univr.it
Biomolecole - 1 Federico Fogolari Dipartimento Scientifico e Tecnologico Universita di Verona Ca Vignal 1, Strada Le Grazie 15 37134 Verona, Italy tel. ++39-045-8027906 fax. ++39-045-8027929 email: fogolari@sci.univr.it
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
Unità 1. Le molecole della vita
 Unità 1 Le molecole della vita In apertura: Lattosio, sì o no? Latte e latticini sono cibi nutrienti, ricchi di proteine e minerali Per milioni di persone, però, i benefici di questi alimenti sono accompagnati
Unità 1 Le molecole della vita In apertura: Lattosio, sì o no? Latte e latticini sono cibi nutrienti, ricchi di proteine e minerali Per milioni di persone, però, i benefici di questi alimenti sono accompagnati
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
CPIA 1 FOGGIA punto di erogazione San Severo. Prof.ssa ANNA LUCIA L. CANCELLIERE
 CPIA 1 FOGGIA punto di erogazione San Severo Prof.ssa ANNA LUCIA L. CANCELLIERE Sono delle grandi molecole che troviamo nel mondo dei viventi sia come molecole costituenti gli organismi viventi che come
CPIA 1 FOGGIA punto di erogazione San Severo Prof.ssa ANNA LUCIA L. CANCELLIERE Sono delle grandi molecole che troviamo nel mondo dei viventi sia come molecole costituenti gli organismi viventi che come
Atomi e molecole. Gli atomi degli elementi si trovano in natura generalmente combinati tra loro in molecole o composti ionici
 IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
2. La chimica della vita Tutta la MATERIA è soggetta alle leggi della CHIMICA e della FISICA
 Tutta la MATERIA è soggetta alle leggi della CHIMICA e della FISICA Simbolo Numero atomico % in organismi viventi Elementi che costituiscono circa il 96% del peso degli organismi viventi O 8 65.0 C 6 18.5
Tutta la MATERIA è soggetta alle leggi della CHIMICA e della FISICA Simbolo Numero atomico % in organismi viventi Elementi che costituiscono circa il 96% del peso degli organismi viventi O 8 65.0 C 6 18.5
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
ACIDI GRASSI INSATURI
 LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) POLIMERI Le cellule sintetizzano un enorme numero di grosse molecole a partire da una ristretta serie di
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) POLIMERI Le cellule sintetizzano un enorme numero di grosse molecole a partire da una ristretta serie di
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Lezione 1: Atomi e molecole:
 Lezione 1: Atomi e molecole: La materia è costituita da elementi chimici in forma pura o in combinazioni dette composti. La vita richiede circa 25 elementi chimici. La struttura atomica determina il comportamento
Lezione 1: Atomi e molecole: La materia è costituita da elementi chimici in forma pura o in combinazioni dette composti. La vita richiede circa 25 elementi chimici. La struttura atomica determina il comportamento
ACIDI NUCLEICI ESPERIMENTI
 ACIDI NUCLEICI ESPERIMENTI 1869 FRIEDRICK MIESCHER Isolò per la prima volta una sostanza zuccherina leggermente acida contenente fosforo Questa sostanza venne chiamata: acido nucleico perché scoperta nel
ACIDI NUCLEICI ESPERIMENTI 1869 FRIEDRICK MIESCHER Isolò per la prima volta una sostanza zuccherina leggermente acida contenente fosforo Questa sostanza venne chiamata: acido nucleico perché scoperta nel
Costituenti chimici della materia vivente
 Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
CARBOIDRATI Sono aldeidi o chetoni con diversi gruppi ossidrilici (formula molecolare di base (CH2O)n, con n =>3) Funzioni riserva energetica
 CARBOIDRATI Sono aldeidi o chetoni con diversi gruppi ossidrilici (formula molecolare di base (CH2O)n, con n =>3) Funzioni riserva energetica combustibili intermedi metabolici Impalcatura del DNA e RNA
CARBOIDRATI Sono aldeidi o chetoni con diversi gruppi ossidrilici (formula molecolare di base (CH2O)n, con n =>3) Funzioni riserva energetica combustibili intermedi metabolici Impalcatura del DNA e RNA
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
BIOMOLECOLE. I mattoni delle cellule.
 BIMLECLE I mattoni delle cellule PRINCIPALI GRUPPI FUNZINALI I gruppi funzionali sono gruppi di atomi, uniti da legami covalenti, che conferiscono alla molecola di cui fanno parte un comportamento chimico
BIMLECLE I mattoni delle cellule PRINCIPALI GRUPPI FUNZINALI I gruppi funzionali sono gruppi di atomi, uniti da legami covalenti, che conferiscono alla molecola di cui fanno parte un comportamento chimico
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
CHIMICA ORGANICA. 2 a D. Novembre Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14. Ponte Felcino Perugia.
 CHIMICA ORGANICA 2 a D Novembre 2014 Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14 Ponte Felcino Perugia Manuela Casasoli IL CARBONIO La chimica organica studia i composti organici in cui il
CHIMICA ORGANICA 2 a D Novembre 2014 Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14 Ponte Felcino Perugia Manuela Casasoli IL CARBONIO La chimica organica studia i composti organici in cui il
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
02/12/2014. Tutti gli esseri viventi sono composti da cellule LA CELLULA E L UNITA STRUTTURALE E FUNZIONALE DEGLI ORGANISMI VIVENTI
 Tutti gli esseri viventi sono composti da cellule Eubatteri Procarioti unicellulari Archebatteri LA CELLULA E L UNITA STRUTTURALE E FUNZIONALE DEGLI ORGANISMI VIVENTI -Autoconservazione mantenimento della
Tutti gli esseri viventi sono composti da cellule Eubatteri Procarioti unicellulari Archebatteri LA CELLULA E L UNITA STRUTTURALE E FUNZIONALE DEGLI ORGANISMI VIVENTI -Autoconservazione mantenimento della
Corso di CHIMICA LEZIONE 1
 Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
H N H R N H R N R R N R H H H
 AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
Nucleotidi e Acidi Nucleici. Struttura di DNA e RNA
 Nucleotidi e Acidi Nucleici Nucleosidi Nucleotidi Funzioni biologiche dei nucleotidi Struttura di DNA e RNA Concatenazione e appaiamento dei nucleotidi Lo scheletro degli acidi nucleici Componenti degli
Nucleotidi e Acidi Nucleici Nucleosidi Nucleotidi Funzioni biologiche dei nucleotidi Struttura di DNA e RNA Concatenazione e appaiamento dei nucleotidi Lo scheletro degli acidi nucleici Componenti degli
Corso di chimica generale
 Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
COMPOSTI ORGANICI. b) il carbonio può formare lunghe catene di legami carbonio-carbonio secondo una varietà di combinazioni quasi infinita;
 COMPOSTI ORGANICI Si definiscono composti organici, tutti i composti del carbonio escluso il monossido e il biossido di carbonio (anidride carbonica) e i carbonati. Attualmente si conoscono più di 2 milioni
COMPOSTI ORGANICI Si definiscono composti organici, tutti i composti del carbonio escluso il monossido e il biossido di carbonio (anidride carbonica) e i carbonati. Attualmente si conoscono più di 2 milioni
20/10/2015. Importanza dei legami non covalenti in Biologia. Legami covalenti
 Legami covalenti Gli atomi che costituiscono le molecole sono tenuti insieme da legami covalenti in cui coppie di elettroni sono condivise tra coppie di atomi. La formazione del legame covalente si basa
Legami covalenti Gli atomi che costituiscono le molecole sono tenuti insieme da legami covalenti in cui coppie di elettroni sono condivise tra coppie di atomi. La formazione del legame covalente si basa
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Anno scolastico Programma svolto. Testo: Scopriamo la Chimica di F. Bagatti, E. Corradi, A. Desco, C. Ropa Ed.
 Ministero dell Istruzione, dell Università e della Ricerca Istituto d Istruzione Secondaria Superiore di II^ Grado LICEO ARTISTICO A. FRATTINI Via Valverde, 2-21100 Varese tel: 0332820670 fax: 0332820470
Ministero dell Istruzione, dell Università e della Ricerca Istituto d Istruzione Secondaria Superiore di II^ Grado LICEO ARTISTICO A. FRATTINI Via Valverde, 2-21100 Varese tel: 0332820670 fax: 0332820470
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Il DNA: istruzioni per la vita Bibliografia I colori della Biologia Gatti- Giusti- Anelli Ed. Pearson
 Il DNA: istruzioni per la vita Bibliografia I colori della Biologia Gatti- Giusti- Anelli Ed. Pearson Una divisione equa Quando una cellula si divide, si formano due nuove cellule che contengono esattamente
Il DNA: istruzioni per la vita Bibliografia I colori della Biologia Gatti- Giusti- Anelli Ed. Pearson Una divisione equa Quando una cellula si divide, si formano due nuove cellule che contengono esattamente
La cellula, la vita, è formata da molecole. Le molecole non sono organismi viventi. La Cellula è un organismo vivente.
 biomolecole La cellula, la vita, è formata da molecole. Le molecole non sono organismi viventi. La ellula è un organismo vivente. rganizzazione Le strutture biologiche hanno un organizzazione gerarchica
biomolecole La cellula, la vita, è formata da molecole. Le molecole non sono organismi viventi. La ellula è un organismo vivente. rganizzazione Le strutture biologiche hanno un organizzazione gerarchica
I Composti Organici. Le Biomolecole
 I Composti Organici I composti organici sono molecole tutte contenenti carbonio. Essi comprendono. 1. composti di interesse energetico che sono gli Idrocarburi ( i derivati del petrolio), 2. composti a
I Composti Organici I composti organici sono molecole tutte contenenti carbonio. Essi comprendono. 1. composti di interesse energetico che sono gli Idrocarburi ( i derivati del petrolio), 2. composti a
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
I composti organici. Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi.
 I composti organici Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi. I composti organici possono essere costituiti da lunghe catene grazie alla capacità
I composti organici Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi. I composti organici possono essere costituiti da lunghe catene grazie alla capacità
Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH
 Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
