Chimica Fisica Biologica
|
|
|
- Battista Napoli
- 6 anni fa
- Visualizzazioni
Transcript
1 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle varie specie chimiche [A], [B] etc. si possono seguire nel tempo misurando una o più proprietà che dipendono dalla concentrazione (e.g. intensità di assorbimento della luce, pressione, conducibilità). [A] + [B] k [C] + [D] November 27, 2002 [A] = concentrazione della specie chimica A al tempo t 1
2 Variazione della concentrazione [2] La velocità di una reazione chimica è la velocità di scomparsa di un reagente o la velocità di produzione di un prodotto. 2NOBr(g) 2NO(g) + Br 2 (g) Variazione nel tempo della concentrazione delle specie chimiche all interno di un reattore Qual è la velocità della reazione? Calcoliamo la velocità di scomparsa del NOBr o la velocità di formazione del monossido di azoto NO v = 1 d[nobr] = 1 d[no] = d[br 2] 2 2 L unità di misura della velocità di reazione è mol l 1 s
3 Velocità di reazione Per una reazione chimica generica la velocità di reazione è c 1 C 1 + c 2 C c l C l = 0 v = 1 c i [C i ] La legge cinetica di una reazione è la reazione empirica che lega v e le concentrazioni dei componenti chimici Esempi Sintesi dell acido iodidrico H 2 + I 2 2HI v = 1 d[hi] definizione 2 v = k[h 2 ][I 2 ] legge v = f([c 1 ], [C 2 ],..., [C l ]) Per molte (ma non tutte) reazioni chimiche la legge cinetica ha la forma v = kf[c 1 ] a 1 [C 2 ] a 2... la somma dei coefficienti a 1 + a = a si dice ordine della reazione. Sintesi dell acido bromidrico H 2 + Br 2 2HBr v = 1 d[hbr] definizione 2 v = k [H 2][br 2 ] 1/2 legge [Br 2 ] + k [HBr] la costante di proporzionalità k si dice costante di reazione. 4 5
4 Reazioni del primo ordine [2] Reazioni del primo ordine [1] A Prodotti Una reazione del primo ordine obbedisce alla legge cinetica v = k[a] d[a] = k[a] La legge cinetica integrata, cioè la funzione che specifica come [A] cambia nel tempo, è data da [A] t = [A] 0 exp( kt) Es. CH 3 N 2 CH 3 (g) CH 3 CH 3 (g) + N 2 (g) Rappresentazione di [A] t primo ordine contro t per una reazione al 6 7
5 Reazioni del primo ordine [3] Il tempo di dimezzamento di una reazione chimica è il tempo necessario perchè sia consumata la metà del reagente presente al tempo iniziale. Per una reazione al primo ordine il tempo di dimezzamento si calcola dalla legge cinetica integrata come [A] 0 t 1/2 = ln 2 k Reazioni del secondo ordine [1] A Prodotti Una reazione del secondo ordine obbedisce alla legge cinetica v = k[a] 2 d[a] = k[a] 2 La legge cinetica integrata, cioè la funzione che specifica come [A] cambia nel tempo, è data da [A] 0 /2 [A] t = 1 kt + 1 [A] 0 Es. 2I(g) I 2 (g) t 1/2 t Tempo di dimezzamento 8 9
6 Meccanismi di reazione [2] La molecolarità di una reazione chimica elementare è il numero di molecole che intervengono come reagenti Meccanismi di reazione [1] Reazioni elementari: sono i singoli passaggi di una reazione nella reazione. 1. Reazioni unimolecolari: interviene una sola molecola chimica, cioè linsieme di singoli eventi molecolari che formano il meccanismo di una reazione chimica. A Prodotti Esempio: decomposizione dell ozono k O 1 3 O 2 + O k 2 O 3 O2 + O d[a] = k[a] k O + O 3 3 2O2 2. Reazioni bimolecolari: intervengono due molecole A + B Prodotti d[a] = k[a][b] 10 11
7 Meccanismi di reazione [3] Una reazione unimolecolare ha una legge cinetica del primo ordine; una reazione bimolecolare ha una legge cinetica del secondo ordine etc. Per una reazione elementare: MOLECOLARITÀ ORDINE DELLA REAZIONE La legge cinetica di un meccanismo di reazione si ottiene combinando le leggi cinetiche delle varie reazioni elementari che lo compongono. Reazioni consecutive [1] In una serie di reazione consecutive si ha la temporanea formazione di INTERMEDI CHIMICI A k AB B k AB C Il meccanismo di reazione è descritto dalle equazioni d[a] = k AB [A] d[b] = k AB [A] k BC [B] [A] + [B] + [C] = [A]
8 Soluzione: Reazioni consecutive [2] [A] = [A] 0 exp( k AB t) [B] = k AB[A] 0 k BC k AB [exp( k AB t) exp( k BC t)] [C] = [A] 0 [A] [B] Equilibrio semplice Due reazioni elementari opposte costituiscono un semplice modello di equilibrio chimico k AB A B k BA Legge cinetica: d[a] = k AB [A] + k BA [B] d[b] = k AB [A] k BA [B] All equilibrio la velocità di variazione delle concentrazioni diventa zero (le specie chimiche raggiungono concentrazione costante): Reazione consecutiva A B C k AB [A] eq k BA [B] eq = 0 [B] eq [A] eq = k AB k BA = K La costante di equilibrio, per un sistema descritto da due reazioni chimiche elementari unimolecolari, si ottiene come il rapporto delle costanti di velocità
9 Intepretazione molecolare [1] Costanti cinetiche e temperatura La costante cinetica di una reazione (elementare) dipende dalla temperatura A + B k P k = A exp( E a /RT ) La legge di Arrhenius descrive la dipendenza dalla temperatura della costante cinetica di una reazione elementare, definita in funzione dell energia di attivazione E a e del fattore pre-exponenziale A. Una reazione chimica avviene a livello molecolare come 1. Collisione tra molecole di reagenti 2. Formazione di un complesso attivato 3. Trasformazione del complesso attivato nei prodotti L interpretazione della dipendenza dalla temperatura della costante cinetica di una reazione richiede l applicazione di concetti molecolari: la velocità di una reazione dipende dal contenuto energetico delle molecole reagenti e dalla loro disposizione nello spazio. Complesso attivato e reazione chimica 16 17
10 Interpretazione molecolare [3] Interpretazione molecolare [2] Solo se le molecole hanno un energia sufficientemente elevata quando si incontrano può avvenire la trasformazione del complesso attivato in prodotti: esiste una barriera energetica tra i reagenti ed i prodotti. La coordinata di reazione descrive il cammino che le molecole dei reagenti devono seguire per trasformarsi in prodotti. L energia di attivazione è l energia necessaria per superare la barriera che impedisce la formazione dei prodotti. Superamento della barriera energetica di attivazione Cammino di reazione ed energia di attivazione 18 19
11 Interpretazione molecolare [4] Sostituzione nucleofila S N 2 Esempio L energia necessaria a superare la barriera tra reagenti e prodotti deriva dall energia cinetica delle molecole che entrano in collisione. L energia termica cinetica delle molecole è tanto maggiore quanto maggiore è la temperatura: l aumento di temperatura favorisce la formazione dei prodotti Cammino di reazione per una reazione S N 2 Energia termica e reazione chimica 20 21
12 Interpretazione molecolare [5] Il fattore pre-esponenziale A tiene conto della possibilità statistica che anche molecole con E > E a non reagiscano. Interpretazione molecolare [6] La teoria del complesso attivato parte dal presupposto che il complesso attivato sia in equilibrio termodinamico con i reagenti A + B AB K = [AB ] [A][B] e che la velocità di formazione sia proporzionale alla concentrazione del complesso attivato v = k BT h [AB ] = k BT h K [A][B] Secondo la teoria del complesso attivato, la costante di velocità è perciò k = k BT h K dove k B = J K 1 è la costante di Boltzmann, h = Js è la costante di Planck; K è la costante di equilibrio per la formazione del complesso attivato dai reagenti. Eventi non reattivi vs. eventi reattivi 22 23
13 Interpretazione molecolare [7] È noto dalla termodinamica che la costante di equilibrio di una reazione si può scrivere in funzione dell energia libera di reazione K = exp( G/RT ) G = H T S Si può scrivere quindi la costante di velocità come k = k BT h exp( S) exp( H/RT ) A exp( E a /RT ) H = entalpia di attivazione energia di attivazione S = entropia di attivazione fattore pre-esponenziale Catalisi enzimatiche [1] Gli enzimi sono proteine con strutture tridimensionali (conformazioni) e caratteristiche chimiche che si esplicano in una attività di catalisi di specifiche reazioni chimiche. L attività catalitica è selettiva, si applica cioè solo ad una particolare reazione chimica. Gli enzimi sono molecole di dimensioni relativamente grandi rispetto alle molecole coinvolte nelle reazioni catalizzate, e presentano di solita una specifica zona reattiva detta centro di reazione dove la reazione chimica catalizzata ha luogo
14 Catalisi enzimatiche [2] Un esempio di meccanismo di reazione che coinvolge un enzima viene fornito dal meccanismo di Michaelis- Menten k 1 E + S ES k 3 P + E k2 E = enzima S = substrato ES = complesso enzima-substrato P = prodotto Il meccanismo MM è un pre-equilibrio di formazione del complesso substrato-enzima, che poi decade ad enzima e prodotti. Catalisi enzimatiche [3] La concentrazione approssimata del complesso si ottiene applicando l approssimazione dello STATO STAZIONARIO, che pone circa a zero la velocità di formazione del complesso stesso d[es] = k 1 [E][S] k 2 [ES] k 3 [ES] 0 [ES] k 1[E][S] k 2 + k 3 La concentrazione dell enzima in totale si indica con [E] 0 ; vale un bilancio di massa: [E] + [ES] = [E] 0 Combinando le due equazioni precedenti si ottiene la concentrazione del complesso in funzione della concentrazione del substrato e della concentrazione totale di enzima [ES] = k 1[E] 0 [S] k 2 + k 3 + k 1 [S] 26 27
15 Catalisi enzimatiche [5] La velocità della reazione di enzimolisi è lineare con la concentrazione di enzima mentre ha una dipendenza più Catalisi enzimatiche [4] complessa dalla concentrazione di substrato. La velocità di formazione del prodotto si scrive quindi come d[p] = k 3 [ES] = k[e] 0 k = k 3 [S] K M + [S] K M = k 2 + k 3 k 1 K M è detta costante di Michaelis. Dipendenza di v dalla concentrazione di substrato 28 29
16 Catalisi enzimatiche [6] Quando la concentrazione del substrato è grande, la reazione è di ordine zero rispetto al substrato [S] K M [P] k 3[E] 0 Quando la concentrazione del substrato è piccola, la reazione è di primo ordine rispetto al substrato. [S] K M [P] k 3 K M [E] 0 [S] Misurando la costante di velocità k a varie concentrazioni di substrato, si possono ottenere informazioni dirette sulle costanti k 3 e K M, impiegando il grafico di Lineweaver- Burk: 1 k = 1 + K m 1 k 3 k 3 [S] La velocità massima di enzimolisi è v max = k 3 [E] 0. 30
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA
 REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica Chimica. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Cinetica Chimica Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Cinetica Chimica Termodinamica la reaction avrà luogo? Cinetica quanto sarà veloce la reazione?
Cinetica Chimica Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Cinetica Chimica Termodinamica la reaction avrà luogo? Cinetica quanto sarà veloce la reazione?
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Legge dell azione di massa. Misura sperimentale della costante di equilibrio. Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Velocità di reazione Una trasformazione chimica modifica completamente la natura delle sostanze iniziali ( i reagenti), formando altre specie (i prodo
 Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Cine%ca enzima%ca. Copyright 2013 Zanichelli editore S.p.A.
 Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Principi di cinetica chimica per il corso di Chimica Fisica I
 Principi di cinetica chimica per il corso di Chimica Fisica I. Definizione di velocità di reazione Consideriamo una reazione generica: a A + b B c C + d D Come misura della velocità di reazione si assume
Principi di cinetica chimica per il corso di Chimica Fisica I. Definizione di velocità di reazione Consideriamo una reazione generica: a A + b B c C + d D Come misura della velocità di reazione si assume
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
ESERCITAZIONI CHIMICA-FISICA I. Equazioni cinetiche. Reazione generica
 ESERCITAZIONI CHIMICA-FISICA I Equazioni cinetiche Reazione generica A P Ordine Equazione cinetica Equazione cinetica integrata Tempo di semitrasformazione 0 d [ A] =k [ A] 0 =k dt [ A]=[ A] 0 kt d [ A]
ESERCITAZIONI CHIMICA-FISICA I Equazioni cinetiche Reazione generica A P Ordine Equazione cinetica Equazione cinetica integrata Tempo di semitrasformazione 0 d [ A] =k [ A] 0 =k dt [ A]=[ A] 0 kt d [ A]
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Combustione. Energia chimica. Energia termica Calore. Combustibili fossili
 Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
PROGRAMMA DISCIPLINARE SVOLTO a. s / N.B. il programma è pubblico ad uso degli studenti e delle famiglie.
 Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Cinetica chimica CONTENUTI: (1) Concetti generali (2) Reazioni di combustione (3) Ossidazione del metano (4) Analisi dei meccanismi
 1 Cinetica chimica CONTENUTI: (1) Concetti generali (2) Reazioni di combustione (3) Ossidazione del metano (4) Analisi dei meccanismi 2 Concetti generali La termochimica prevede che assegnate: a) 2 variabili
1 Cinetica chimica CONTENUTI: (1) Concetti generali (2) Reazioni di combustione (3) Ossidazione del metano (4) Analisi dei meccanismi 2 Concetti generali La termochimica prevede che assegnate: a) 2 variabili
Leggi dei gas. PV = n RT SISTEMI DI PARTICELLE NON INTERAGENTI. perché le forze tra le molecole sono differenti. Gas perfetti o gas ideali
 Perché nelle stesse condizioni di temperatura e pressione sostanze differenti possono trovarsi in stati di aggregazione differenti? perché le forze tra le molecole sono differenti Da che cosa hanno origine
Perché nelle stesse condizioni di temperatura e pressione sostanze differenti possono trovarsi in stati di aggregazione differenti? perché le forze tra le molecole sono differenti Da che cosa hanno origine
2. Indicare l'affermazione che descrive più accuratamente il comportamento di un catalizzatore:
 1. "L'energia di attivazione, cioè l'energia necessaria a formare un composto ad alta energia potenziale, intermedio della reazione (il cosiddetto complesso attivato), è una grandezza caratteristica di
1. "L'energia di attivazione, cioè l'energia necessaria a formare un composto ad alta energia potenziale, intermedio della reazione (il cosiddetto complesso attivato), è una grandezza caratteristica di
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico
 Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico 43. A 723 K in un reattore dal volume di 5,000 L sono presenti all'equilibrio 3,356 mol di azoto, 4,070 mol di idrogeno
Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico 43. A 723 K in un reattore dal volume di 5,000 L sono presenti all'equilibrio 3,356 mol di azoto, 4,070 mol di idrogeno
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA.
 CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA FACOLTA DI MEDICINA E CHIRURGIA. IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA. Un enzima è una proteina capace di catalizzare una specifica reazione
CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA FACOLTA DI MEDICINA E CHIRURGIA. IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA. Un enzima è una proteina capace di catalizzare una specifica reazione
TERMODINAMICA E TERMOCHIMICA
 TERMODINAMICA E TERMOCHIMICA La TERMODINAMICA è una scienza chimico-fisica che studia le trasformazioni dell energia. La TERMOCHIMICA è una particolare branca della termodinamica che valuta quantitativamente
TERMODINAMICA E TERMOCHIMICA La TERMODINAMICA è una scienza chimico-fisica che studia le trasformazioni dell energia. La TERMOCHIMICA è una particolare branca della termodinamica che valuta quantitativamente
La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa.
 La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa. ChimicaGenerale_lezione17 1 L'Equilibrio Chimico Nella chimica
La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa. ChimicaGenerale_lezione17 1 L'Equilibrio Chimico Nella chimica
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
CORSO DI CHIMICA. Esercitazione del 7 Giugno 2016
 CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
5.1 RUOLO DELLA TERMODINAMICA E DELLA CINETICA 3 5.3 LEGGE DI VELOCITÀ, COSTANTE DI VELOCITÀ E ORDINE DI REAZIONE 7
 Cap. 5 CINETICA E MECCANISMO DELLE REAZIONI DISCONTINUE I N D I C E pag. PREMESSA 3 5.1 RUOLO DELLA TERMODINAMICA E DELLA CINETICA 3 5.2 VELOCITÀ DI REAZIONE E SUA MISURA 4 5.3 LEGGE DI VELOCITÀ, COSTANTE
Cap. 5 CINETICA E MECCANISMO DELLE REAZIONI DISCONTINUE I N D I C E pag. PREMESSA 3 5.1 RUOLO DELLA TERMODINAMICA E DELLA CINETICA 3 5.2 VELOCITÀ DI REAZIONE E SUA MISURA 4 5.3 LEGGE DI VELOCITÀ, COSTANTE
Proprietà elettriche della materia
 Proprietà elettriche della materia Conduttori Materiali in cui le cariche elettriche scorrono con facilità. In un metallo gli elettroni più esterni di ciascun atomo formano una specie di gas all interno
Proprietà elettriche della materia Conduttori Materiali in cui le cariche elettriche scorrono con facilità. In un metallo gli elettroni più esterni di ciascun atomo formano una specie di gas all interno
LA VELOCITA DELLE REAZIONI
 LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
Bilancio di energia: il Primo Principio della Termodinamica. Termodinamica dell Ingegneria Chimica
 Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Dipendenza dell'energia libera dalla T e P
 Dipendenza dell'energia libera dalla T e P G = H - TS essendo H = U + PV G = U + PV - TS Una variazione infinitesima di una o più variabili che definiscono lo stato del sistema determina una variazione
Dipendenza dell'energia libera dalla T e P G = H - TS essendo H = U + PV G = U + PV - TS Una variazione infinitesima di una o più variabili che definiscono lo stato del sistema determina una variazione
Fondamenti di Meteorologia e Climatologia
 Università degli studi di Trento Facoltà di Ingegneria Corso di Laurea in Ingegneria per l Ambiente e il Territorio Prof. Dino Zardi Dipartimento di Ingegneria Civile ed Ambientale Fondamenti di Meteorologia
Università degli studi di Trento Facoltà di Ingegneria Corso di Laurea in Ingegneria per l Ambiente e il Territorio Prof. Dino Zardi Dipartimento di Ingegneria Civile ed Ambientale Fondamenti di Meteorologia
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
Temperatura [ºC] Per realizzare questo scopo si utilizza la regola della leva data secondo l equazione (1.
![Temperatura [ºC] Per realizzare questo scopo si utilizza la regola della leva data secondo l equazione (1. Temperatura [ºC] Per realizzare questo scopo si utilizza la regola della leva data secondo l equazione (1.](/thumbs/50/26948478.jpg) 1. Diagramma di fase Cu-Sn Si desidera calcolare la frazione in peso della fase liquida e la frazione in peso della frazione solida per una lega di rame con un 12% di stagno come è indicato nella Figura
1. Diagramma di fase Cu-Sn Si desidera calcolare la frazione in peso della fase liquida e la frazione in peso della frazione solida per una lega di rame con un 12% di stagno come è indicato nella Figura
FORZA DI ACIDI E BASI HA + :B HB + + A
 FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
ASPETTI CINETICI DI UNA REAZIONE CHIMICA
 ASPETTI CINETICI DI UNA REAZIONE CHIMICA Alcune delle reazioni che avvengono attorno a noi sono istantanee, come l'esplosione di una mina; altre richiedono tempi superiori al minuto e sono dette veloci,
ASPETTI CINETICI DI UNA REAZIONE CHIMICA Alcune delle reazioni che avvengono attorno a noi sono istantanee, come l'esplosione di una mina; altre richiedono tempi superiori al minuto e sono dette veloci,
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
ESERCITAZIONI CHIMICA-FISICA I a.a. 2012/2013. Metodo differenziale. Problema
 ESERCITAZIONI CHIMICA-FISICA I a.a. 0/03 Metodo differenziale Problema Per la reazione: A + B P sono stati condotti tre esperimenti cinetici a diverse concentrazioni iniziali dei reagenti. I valori iniziali
ESERCITAZIONI CHIMICA-FISICA I a.a. 0/03 Metodo differenziale Problema Per la reazione: A + B P sono stati condotti tre esperimenti cinetici a diverse concentrazioni iniziali dei reagenti. I valori iniziali
Stampa Preventivo. A.S Pagina 1 di 11
 Stampa Preventivo A.S. 2009-2010 Pagina 1 di 11 Insegnante BADALINI RENZO Classe 2BT Materia elementi di chimica e fisica preventivo consuntivo 99 84 titolo modulo 1. STRUTTURA E TRASFORM. DELL 2. L'ATOMO
Stampa Preventivo A.S. 2009-2010 Pagina 1 di 11 Insegnante BADALINI RENZO Classe 2BT Materia elementi di chimica e fisica preventivo consuntivo 99 84 titolo modulo 1. STRUTTURA E TRASFORM. DELL 2. L'ATOMO
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Determinazione di parametri cinetici di una reazione di dissociazione mediante spettroscopia UV-visibile
 Determinazione di parametri cinetici di una reazione di dissociazione mediante spettroscopia UV-visibile Obiettivo dell'esperienza è la determinazione di parametri cinetici per la reazione di decomposizione
Determinazione di parametri cinetici di una reazione di dissociazione mediante spettroscopia UV-visibile Obiettivo dell'esperienza è la determinazione di parametri cinetici per la reazione di decomposizione
Al Prof. Mario Beccari, professore ordinario di Impianti Chimici, va il mio ringraziamento per aver elaborato gli argomenti riportati qui.
 Al Prof. Mario Beccari, professore ordinario di Impianti Chimici, va il mio ringraziamento per aver elaborato gli argomenti riportati qui. Nota per gli studenti. Sono stati usati simboli diversi da quelli
Al Prof. Mario Beccari, professore ordinario di Impianti Chimici, va il mio ringraziamento per aver elaborato gli argomenti riportati qui. Nota per gli studenti. Sono stati usati simboli diversi da quelli
di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
 Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
INTRODUZIONE ALLA TERMODINAMICA. Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta
 INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
5.4 Larghezza naturale di una riga
 5.4 Larghezza naturale di una riga Un modello classico più soddisfacente del processo di emissione è il seguente. Si considera una carica elettrica puntiforme in moto armonico di pulsazione ω 0 ; la carica,
5.4 Larghezza naturale di una riga Un modello classico più soddisfacente del processo di emissione è il seguente. Si considera una carica elettrica puntiforme in moto armonico di pulsazione ω 0 ; la carica,
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Lezione di Combustione
 Lezione di Combustione Introduzione Da un punto di vista chimico-fisico la combustione è un processo reattivo fortemente esotermico Generalmente le temperature in gioco sono particolarmente elevate e dipendono
Lezione di Combustione Introduzione Da un punto di vista chimico-fisico la combustione è un processo reattivo fortemente esotermico Generalmente le temperature in gioco sono particolarmente elevate e dipendono
L equilibrio chimico
 L equilibrio chimico Vi sono molte reazioni chimiche che non procedono fino a completezza, cioè fino a che uno dei reagenti non si esaurisca, ad esempio la reazione di dimerizzazione del diossido di azoto:
L equilibrio chimico Vi sono molte reazioni chimiche che non procedono fino a completezza, cioè fino a che uno dei reagenti non si esaurisca, ad esempio la reazione di dimerizzazione del diossido di azoto:
Sapienza, Università di Roma. Antonella Goggiamani
 Sapienza, Università di Roma CHIMICA ORGANICA Antonella Goggiamani antonella.goggiamani@uniroma1.it Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea in Scienze Naturali, canale M Z LEZIONI
Sapienza, Università di Roma CHIMICA ORGANICA Antonella Goggiamani antonella.goggiamani@uniroma1.it Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea in Scienze Naturali, canale M Z LEZIONI
dq = C P (T ) dt dq = T 1 C P (T ) dt q = [16.10T ] K K (JK 1 ) + 2 K 1 ( K)2 = 18.6 kj
![dq = C P (T ) dt dq = T 1 C P (T ) dt q = [16.10T ] K K (JK 1 ) + 2 K 1 ( K)2 = 18.6 kj dq = C P (T ) dt dq = T 1 C P (T ) dt q = [16.10T ] K K (JK 1 ) + 2 K 1 ( K)2 = 18.6 kj](/thumbs/52/30664943.jpg) Esercizio 1 Calcolo q, w, U e H per riscaldamento gas ideale Calcolare q, w, U e H per un gas ideale in seguito all'aumento della sua temperatura da 25 C a 120 C in condizioni di pressione costante, sapendo
Esercizio 1 Calcolo q, w, U e H per riscaldamento gas ideale Calcolare q, w, U e H per un gas ideale in seguito all'aumento della sua temperatura da 25 C a 120 C in condizioni di pressione costante, sapendo
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Università di Roma Tor Vergata
 Università di Roma Tor Vergata Facoltà di Ingegneria Dipartimento di Ingegneria Industriale Corso di: TERMOTECNICA TRASMISSIONE DEL CALORE: RESISTENZA DI CONTATTO Ing. G. Bovesecchi gianluigi.bovesecchi@gmail.com
Università di Roma Tor Vergata Facoltà di Ingegneria Dipartimento di Ingegneria Industriale Corso di: TERMOTECNICA TRASMISSIONE DEL CALORE: RESISTENZA DI CONTATTO Ing. G. Bovesecchi gianluigi.bovesecchi@gmail.com
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Equilibri Acido Base e ph
 Equilibri Acido Base e ph Definizioni di Acido e Base Secondo la teoria di Arrhenius, un acido è una sostanza che dissociandosi in acqua libera ioni H +, una base è invece una sostanza che dissociandosi
Equilibri Acido Base e ph Definizioni di Acido e Base Secondo la teoria di Arrhenius, un acido è una sostanza che dissociandosi in acqua libera ioni H +, una base è invece una sostanza che dissociandosi
Termodinamica dei sistemi biologici
 Bioenergetica Termodinamica dei sistemi biologici La bioenergetica è lo studio quantitativo delle trasduzioni energetiche, cioè dei cambiamenti di energia da una forma ad un altra Le trasformazioni biologiche
Bioenergetica Termodinamica dei sistemi biologici La bioenergetica è lo studio quantitativo delle trasduzioni energetiche, cioè dei cambiamenti di energia da una forma ad un altra Le trasformazioni biologiche
Chimica e laboratorio
 ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
Chimica. La Chimica è la scienza che cerca di comprendere il comportamento della materia studiando il comportamento di atomi e molecole
 Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Termodinamica. Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico
 Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
ENZIMI. A + B AB (100 Kcal= E. Attiv.) A + B AB (50 Kcal) SUBSTRATO ENZIMA E N E R G I A
 ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
Selezione test GIOCHI DELLA CHIMICA
 Selezione test GIOCHI DELLA CHIMICA CLASSE A Velocità - Equilibrio - Energia Regionali 2010 36. Se il valore della costante di equilibrio di una reazione chimica diminuisce al crescere della temperatura,
Selezione test GIOCHI DELLA CHIMICA CLASSE A Velocità - Equilibrio - Energia Regionali 2010 36. Se il valore della costante di equilibrio di una reazione chimica diminuisce al crescere della temperatura,
TECNICHE SPETTROSCOPICHE
 TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
Stati di aggregazione della materia
 Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
TERMODINAMICA. Il sistema è il corpo o l insieme dei corpi sotto esame.
 TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
Programma svolto a.s. 2015/2016. Materia: fisica
 Programma svolto a.s. 2015/2016 Classe: 4A Docente: Daniela Fadda Materia: fisica Dettagli programma Cinematica e dinamica: moto circolare uniforme (ripasso); moto armonico (ripasso); moto parabolico (ripasso);
Programma svolto a.s. 2015/2016 Classe: 4A Docente: Daniela Fadda Materia: fisica Dettagli programma Cinematica e dinamica: moto circolare uniforme (ripasso); moto armonico (ripasso); moto parabolico (ripasso);
Capitolo n 5 ELEMENTI DI TERMODINAMICA E DI CINETICA
 Capitolo n 5 ELEMENTI DI TERMODINAMICA E DI CINETICA 5.1 Elementi di Termodinamica chimica 5.1.1 Introduzione alla Termodinamica La Termodinamica è una parte della Fisica che studia i sistemi e le loro
Capitolo n 5 ELEMENTI DI TERMODINAMICA E DI CINETICA 5.1 Elementi di Termodinamica chimica 5.1.1 Introduzione alla Termodinamica La Termodinamica è una parte della Fisica che studia i sistemi e le loro
U.D. CHIMICA classe 2 a TECN. (CAT) CHIMICA TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO
 CHIMICA Classe 2 a TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D. Periodo Ore lezione 1. Nomenclatura molecole inorganiche (ripasso) settembre 6 2. Struttura atomica e tavola periodica
CHIMICA Classe 2 a TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D. Periodo Ore lezione 1. Nomenclatura molecole inorganiche (ripasso) settembre 6 2. Struttura atomica e tavola periodica
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
LASER. Light Amplification by Stimulated Emission of Radiation. Introduzione. Assorbimento, emissione spontanea, emissione stimolata
 LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
Appendice cap. 29: applicazioni
 2 Analisi chimica strumentale Appendice cap. 29: applicazioni Per una reazione del 1 ordine, l equazione differenziale, ovvero la forma differenziale della legge cinetica, assume la forma d[a]/dt = k [A]
2 Analisi chimica strumentale Appendice cap. 29: applicazioni Per una reazione del 1 ordine, l equazione differenziale, ovvero la forma differenziale della legge cinetica, assume la forma d[a]/dt = k [A]
Capitolo 12. Moto oscillatorio
 Moto oscillatorio INTRODUZIONE Quando la forza che agisce su un corpo è proporzionale al suo spostamento dalla posizione di equilibrio ne risulta un particolare tipo di moto. Se la forza agisce sempre
Moto oscillatorio INTRODUZIONE Quando la forza che agisce su un corpo è proporzionale al suo spostamento dalla posizione di equilibrio ne risulta un particolare tipo di moto. Se la forza agisce sempre
Stabilità dei complessi
 Stabilità dei complessi v stabilità o instabilità termodinamica di un complesso è una misura del grado in cui un complesso è presente all equilibrio insieme alle sue specie costituenti, ossia allo ione
Stabilità dei complessi v stabilità o instabilità termodinamica di un complesso è una misura del grado in cui un complesso è presente all equilibrio insieme alle sue specie costituenti, ossia allo ione
REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI. Dr. Francesco Musiani
 REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI Dr. Francesco Musiani Versione aggiornata al 20.12.2011 Zn (s) + NO 3 - Zn 2+ + NH 4 + Zn (s) Ý Zn 2+ (1) NO - + 3 Ý NH 4 (2) - Bilanciamento di (1): In questa
REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI Dr. Francesco Musiani Versione aggiornata al 20.12.2011 Zn (s) + NO 3 - Zn 2+ + NH 4 + Zn (s) Ý Zn 2+ (1) NO - + 3 Ý NH 4 (2) - Bilanciamento di (1): In questa
Indice generale. Prefazione XIII
 Indice generale Prefazione XIII 1 Introduzione. Leggi fondamentali della chimica 1 1.1 Il metodo scientifico 1 1.2 Esecuzione di un esperimento e presentazione dei risultati: interpolazione ed estrapolazione
Indice generale Prefazione XIII 1 Introduzione. Leggi fondamentali della chimica 1 1.1 Il metodo scientifico 1 1.2 Esecuzione di un esperimento e presentazione dei risultati: interpolazione ed estrapolazione
Capitolo 10. Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni 1
 Capitolo 10 N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni
Capitolo 10 N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Corrente ele)rica. Cariche in movimento e legge di Ohm
 Corrente ele)rica Cariche in movimento e legge di Ohm Corrente ele)rica Nei metalli si possono avere elettroni che si muovono anche velocemente fra un estremo e l altro del metallo, ma la risultante istante
Corrente ele)rica Cariche in movimento e legge di Ohm Corrente ele)rica Nei metalli si possono avere elettroni che si muovono anche velocemente fra un estremo e l altro del metallo, ma la risultante istante
La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione.
 Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Radioattività. 1. Massa dei nuclei. 2. Decadimenti nucleari. 3. Legge del decadimento XVI - 0. A. Contin - Fisica Generale Avanzata
 Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Unità didattica 10. Decima unità didattica (Fisica) 1. Corso integrato di Matematica e Fisica per il Corso di Farmacia
 Unità didattica 10 Radioattività... 2 L atomo... 3 Emissione di raggi x... 4 Decadimenti nucleari. 6 Il decadimento alfa.... 7 Il decadimento beta... 8 Il decadimento gamma...... 9 Interazione dei fotoni
Unità didattica 10 Radioattività... 2 L atomo... 3 Emissione di raggi x... 4 Decadimenti nucleari. 6 Il decadimento alfa.... 7 Il decadimento beta... 8 Il decadimento gamma...... 9 Interazione dei fotoni
La macchina termica. Marina Cobal - Dipt.di Fisica - Universita' di Udine 1
 La macchina termica Universita' di Udine 1 La macchina termica Un insieme di trasformazioni che parta da uno stato e vi ritorni costituisce una macchina termica un ciclo termodinamico Universita' di Udine
La macchina termica Universita' di Udine 1 La macchina termica Un insieme di trasformazioni che parta da uno stato e vi ritorni costituisce una macchina termica un ciclo termodinamico Universita' di Udine
CINETICA CHIMICA. Velocità= - Δ(tempo)
 CINETICA CHIMICA La cinetica chimica studia la velocità delle reazioni chimiche. Tale studio ha un utilità pratica, in quanto consente di sapere quanto velocemente un sistema raggiunge l equilibrio chimico.
CINETICA CHIMICA La cinetica chimica studia la velocità delle reazioni chimiche. Tale studio ha un utilità pratica, in quanto consente di sapere quanto velocemente un sistema raggiunge l equilibrio chimico.
STUDIO SPERIMENTALE DELLA CINETICA DI UNA REAZIONE CHIMICA PER VIA CONDUTTOMETRICA
 STUDIO SPERIMENTALE DELLA CINETICA DI UNA REAZIONE CHIMICA PER VIA CONDUTTOMETRICA Lo scopo di questa esperienza è quello di vedere come sia possibile studiare, da un punto di vista cinetico, l'evolversi
STUDIO SPERIMENTALE DELLA CINETICA DI UNA REAZIONE CHIMICA PER VIA CONDUTTOMETRICA Lo scopo di questa esperienza è quello di vedere come sia possibile studiare, da un punto di vista cinetico, l'evolversi
Sistemi Gassosi. GAS = specie che occupa tutto lo spazio disponibile. VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 )
 Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Testo di riferimento: Millman-Grabel MICROELECTRONICS McGraw Hill Cap. 1: 1,2,3,4 Cap. 2: 1,2,3,4,6,7,8,(9,10). Cap. 3: 1,2,4,5,6,8,9,10.
 Esperimentazioni di Fisica 3 AA 20122013 Semiconduttori Conduzione nei semiconduttori Semiconduttori intrinseci ed estrinseci (drogati) La giunzione pn Il diodo a semiconduttore Semplici circuiti con diodi
Esperimentazioni di Fisica 3 AA 20122013 Semiconduttori Conduzione nei semiconduttori Semiconduttori intrinseci ed estrinseci (drogati) La giunzione pn Il diodo a semiconduttore Semplici circuiti con diodi
Diffrazione di Raggi-X da Monocristalli A.A Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Diffrazione di Raggi-X da Monocristalli A.A. 2009-2010 Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Raccolta Dati di Diffrazione: Diffrazione di Raggi X Raccolta
Diffrazione di Raggi-X da Monocristalli A.A. 2009-2010 Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Raccolta Dati di Diffrazione: Diffrazione di Raggi X Raccolta
La fisica di Feynmann Termodinamica
 La fisica di Feynmann Termodinamica 3.1 TEORIA CINETICA Teoria cinetica dei gas Pressione Lavoro per comprimere un gas Compressione adiabatica Compressione della radiazione Temperatura Energia cinetica
La fisica di Feynmann Termodinamica 3.1 TEORIA CINETICA Teoria cinetica dei gas Pressione Lavoro per comprimere un gas Compressione adiabatica Compressione della radiazione Temperatura Energia cinetica
Attività elettrica dei neuroni. Neuroni piramidali del SNC che stanno crescendo su una matrice di glia/fibroblasti
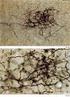 Attività elettrica dei neuroni Neuroni piramidali del SNC che stanno crescendo su una matrice di glia/fibroblasti Un esperimento in current-clamp Si inietta una corrente I di intensità nota nella cellula
Attività elettrica dei neuroni Neuroni piramidali del SNC che stanno crescendo su una matrice di glia/fibroblasti Un esperimento in current-clamp Si inietta una corrente I di intensità nota nella cellula
La reazione da bilanciare è quindi: Cu + HNO 3 CuNO 3 + NO. Le due semireazioni da bilanciare saranno: HNO 3 NO (1) Cu CuNO 3 (2)
 Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Capitolo 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino
 Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
Reazioni chimiche reversibili
 Reazioni chimiche reversibili In accordo all esperienza, la maggior parte delle reazioni chimiche possono procedere sia nel verso dai reagenti ai prodotti che nel verso opposto, cioè dai prodotti ai reagenti,
Reazioni chimiche reversibili In accordo all esperienza, la maggior parte delle reazioni chimiche possono procedere sia nel verso dai reagenti ai prodotti che nel verso opposto, cioè dai prodotti ai reagenti,
TEORIA DEI SISTEMI SISTEMI LINEARI
 TEORIA DEI SISTEMI Laurea Specialistica in Ingegneria Meccatronica Laurea Specialistica in Ingegneria Gestionale Indirizzo Gestione Industriale TEORIA DEI SISTEMI SISTEMI LINEARI Ing. Cristian Secchi Tel.
TEORIA DEI SISTEMI Laurea Specialistica in Ingegneria Meccatronica Laurea Specialistica in Ingegneria Gestionale Indirizzo Gestione Industriale TEORIA DEI SISTEMI SISTEMI LINEARI Ing. Cristian Secchi Tel.
Introduzione al Metabolismo
 Chimica Biologica A.A. 2010-2011 Introduzione al Metabolismo Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Metabolismo Metabolismo l insieme dei processi attraverso
Chimica Biologica A.A. 2010-2011 Introduzione al Metabolismo Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Metabolismo Metabolismo l insieme dei processi attraverso
Le proteine III. Corso di Biochimica 1. Prof. Giuseppina Pitari
 Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
TERMOLOGIA & TERMODINAMICA I
 TERMOLOGIA & TERMODINAMICA I 1 Meccanica: studia il moto dei corpi e le cause che lo genera Grandezze meccaniche: massa, velocità, accelerazione, forza, energia Struttura atomica dei gas: particelle tutte
TERMOLOGIA & TERMODINAMICA I 1 Meccanica: studia il moto dei corpi e le cause che lo genera Grandezze meccaniche: massa, velocità, accelerazione, forza, energia Struttura atomica dei gas: particelle tutte
1.1 Coordinate sulla retta e nel piano; rette nel piano
 1 Sistemi lineari 11 Coordinate sulla retta e nel piano; rette nel piano Coordinate sulla retta Scelti su una retta un primo punto O (origine) ed un diverso secondo punto U (unita ), l identificazione
1 Sistemi lineari 11 Coordinate sulla retta e nel piano; rette nel piano Coordinate sulla retta Scelti su una retta un primo punto O (origine) ed un diverso secondo punto U (unita ), l identificazione
FISICA per SCIENZE BIOLOGICHE A.A. 2012/2013 APPELLO 18 Luglio 2013
 FISICA per SCIENZE BIOLOGICHE A.A. 2012/2013 APPELLO 18 Luglio 2013 1) Un corpo di massa m = 500 g scende lungo un piano scabro, inclinato di un angolo θ = 45. Prosegue poi lungo un tratto orizzontale
FISICA per SCIENZE BIOLOGICHE A.A. 2012/2013 APPELLO 18 Luglio 2013 1) Un corpo di massa m = 500 g scende lungo un piano scabro, inclinato di un angolo θ = 45. Prosegue poi lungo un tratto orizzontale
CHIMICA (versione 14 giugno 2016)
 Syllabus delle conoscenze per il modulo CHIMICA (versione 14 giugno 2016) SYLLABUS 1. Proprietà macroscopiche della materia Per proprietà macroscopiche della materia si intendono le proprietà osservabili
Syllabus delle conoscenze per il modulo CHIMICA (versione 14 giugno 2016) SYLLABUS 1. Proprietà macroscopiche della materia Per proprietà macroscopiche della materia si intendono le proprietà osservabili
PERCORSI ABILITANTI SPECIALI CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA
 PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
Chimica Fisica I. a.a. 2012/2013 S. Casassa
 a.a. 2012/2013 S. Casassa 1 Note Tecniche 2 Testi consigliati: G.K. Vemulapalli, Chimica Fisica", EdiSES, Napoli (1995). D.A. Mc Quarrie e J.D. Simon, Chimica Fisica: un approccio molecolare", Zanichelli,
a.a. 2012/2013 S. Casassa 1 Note Tecniche 2 Testi consigliati: G.K. Vemulapalli, Chimica Fisica", EdiSES, Napoli (1995). D.A. Mc Quarrie e J.D. Simon, Chimica Fisica: un approccio molecolare", Zanichelli,
