I RADICALI. o L'atomo B può prendere tutti e due gli elettroni. o Ognuno dei due atomi prende un elettrone A B A + B
|
|
|
- Fabriciano Santi
- 6 anni fa
- Visualizzazioni
Transcript
1 I ADIALI Per riuscire a comprendere bene che cos'è un radicale dobbiamo partire dalla descrizione della natura dei legami chimici Abbiamo visto come si forma un legame covalente ed abbiamo visto che la formazione di un legame è dovuta al fatto che i due atomi che si legano fra di loro ottengono uno stato di energia potenziale minore rispetto allo stato in cui si trovano separati Se quindi forniamo energia ad una molecola biatomica possiamo fare in modo che i due atomi legati tra di loro si separino e che quindi la molecola si dissoci in due atomi L'energia che dobbiamo fornire viene chiamata energia di dissociazione del legame (bond dissociation energy: BDE) e si indica con BDE(-) dove "" rappresenta l'atomo legato ome conseguenza se due atomi si uniscono a formare tale legame, l'energia che viene emessa è esattamente uguale a questa quantità Nel caso in cui si ha la formazione di un legame covalente la formazione del legame e quindi il guadagno di energia è dovuto alla messa in comune di due elettroni (uno per ogni atomo) in quanto l'energia dei due elettroni associati insieme ai due nuclei è minore dell'energia dei due elettroni associati separatamente ognuno ad un nucleo Un legame di questo tipo che si formi tra due atomi diversi A e B si può rompere in tre diversi modi: o L'atomo A può prendere tutti e due gli elettroni e poiché gli elettroni sono cariche negative avremo: AB A + B o L'atomo B può prendere tutti e due gli elettroni AB A + B o Ognuno dei due atomi prende un elettrone AB A + B Le specie cariche che si formano nei primi due casi vengono dette ioni e la rottura del legame si dice eterolisi, mentre le specie che si formano nel terzo caso vengono dette radicali e la rottura del legame si dice omolisi I radicali sono le specie che si formano dalla rottura emolitica di un legame covalente e sono quindi specie caratterizzate dalla presenza di un elettrone spaiato (numero dispari di elettroni) Il modo energeticamente più favorevole di rompere un legame è sempre l'omolisi Anche il cloruro di sodio, che è un tipico composto ionico, se venisse riscaldato in fase gassosa si dissocerebbe in maniera emolitica; in soluzione però, specialmente se il sovente è polare, esso si dissocia in ioni Na e ioni l in quanto gi ioni vengono stabilizzati dalla presenza delle molecole di solvente che li circondano formano una sorta di gabbia di solvente L'interazione tra gli ioni e le molecole di solvente, detta solvatazione, abbassa l'energia potenziale ed è il fattore che controlla le reazioni in soluzione La solvatazione può essere importante anche se non si formano specie cariche ma gli intermedi di reazione sono fortemente polarizzati Nel caso del cloruro di sodio gli ioni ioni Na e gli ioni l rimangono separati in quanto l'energia potenziale si abbassa di più con la solvatazione che con il riformarsi del legame tra ioni Na e ioni l I radicali non vengono solvatati nello stesso modo degli ioni La tipica solvatazione avviene infatti per interazione elettrostatica tra cariche elettriche Per solvatare i radicali, servirebbe un solvente contenente elettroni spaiati (singoli elettroni in un orbitale) e di norma i solventi hanno tutti gli elettroni accoppiati così che l'interazione tra un radicale e 1-1
2 un solvente è molto piccola Questo comporta che non si può formare una robusta gabbia di molecole di solvente intorno ad un radicale e quindi essi possono ricombinarsi facilmente tra di loro per riformare una molecola Questo è il motivo per cui è possibile avere alte concentrazioni di ioni in solventi polari come l acqua, mentre non possiamo ottenere alte concentrazioni di radicali in soluzione In generale i radicali sono quindi specie transienti con un tempo di vita molto corto; esistono però alcuni radicali, chiamati radicali persistenti che possono esistere puri allo stato liquido o solido in virtù delle loro caratteristiche elettroniche e di struttura I radicali sono quindi sostanze che possiedono un elettrone spaiato e che contengono quindi un numero dispari di elettroni Due esempi di questo tipo sono l ossido di azoto (monossido di azoto) e il biossido di azoto (diossido di azoto) L ossido di azoto ha una scarsa tendenza a dimerizzare in fase gassosa, ma il biossido di azoto è in equilibrio con il suo dimero, il tetrossido di diazoto N O N O O Stabilità dei radicali al carbonio La stabilità di un radicale è una proprietà termodinamica che misura la sua energia: tanto più bassa è l energia di un composto e tanto più esso è stabile Vista l impossibilità di misurare in modo assoluto l energia di un composto essa viene però misurata in termini di forza del legame - del radicale ( ) in questione con un atomo di idrogeno: tanto maggiore sarà la forza del legame - e tanto minore sarà la stabilità del radicale in quanto evidentemente esso viene notevolmente stabilizzato (abbassa la sua energia) dalla formazione del legame con un atomo di idrogeno Il confronto delle BDE(-) dei diversi radicali ci può quindi dare un idea della stabilità di ognuno di essi rispetto ad un altro Tipo Legame BDE (kcal mol -1 ) 76 Bis-allilico 85 Allilico Benzilico 2 88 Perossidico OO 88 Tiilico 3 S Terziario Secondario 96 Primario Metilico Fenilico Idrossilico O
3 Nella figura riportata sotto vengono descritti i tipi più comuni di radicali in ordine di stabilità: partiamo dal radicale trifenilmetile, per proseguire con il radicale benzile e l allile e per arrivare ai radicali alchilici (terziario, secondario primario, metilico); infine troviamo i radicali vinilici e fenilici 2 > 2 2 > > > Trifenilmetilico Benzilico Allilico Terziario 3 3 > 3 2 > 3 > Secondario Primario Metilico Vinilico Fenilico 2 I primi tre radicali devono la loro stabilità al fenomeno della risonanza: tante più forme di risonanza possiede una certa struttura e tanto più essa è stabile Per il radicale trifenilmetilico si possono scrivere molte forme in cui l elettrone spaiato sia delocalizzato dal carbonio centrale a quelli orto e para degli anelli benzenici: l alto grado di delocalizzazione rende il prodotto molto stabile (10 forme di risonanza); meno stabili saranno di conseguenza il radicale benzilico (4 forme di risonanza) e quello allilico (2 forme di risonanza identiche) I radicali alchilici non possiedono forme di risonanza e sono quindi di conseguenza meno stabili; il loro ordine di stabilità (radicale terziario > radicale secondario > radicale primario, radicale metilico) è dovuto al fenomeno dell'iperconiugazione che consiste in una delocalizzazione degli elettroni attraverso legami σ anziché π (le forme iperconiugative possono portare al trasferimento dell elettrone solamente su atomi di idrogeno) Paramagnetismo e spin elettronico 1-3
4 Una delle caratteristiche dei radicali e che sono paramagnetici Vediamo in che cosa consiste tale caratteristica Gli elettroni che si muovono intorno al nucleo, formano delle correnti elettriche e quindi dei campi magnetici Nel caso in cui una specie venga sottoposta ad un campo magnetico esterno l energia dei due stati di spin, che possono assumere gli elettroni in ogni orbitale, che in condizioni normali sono degeneri, viene modificata a causa dell interazione del campo magnetico esterno con quello generato dall elettrone Elettroni che abbiano spin opposto generano campi magnetici di polarità invertita, per cui, se il numero di elettroni con spin ½ è uguale a quello degli elettroni con spin -½ non si avrà alcun effetto mentre se uno dei due spin prevale sull altro si avrà un campo magnetico risultante La presenza di elettroni spaiati può essere quindi rilevata tramite l interazione con un campo magnetico Nel caso in cui si verifichi la prima ipotesi (tutti gli elettroni accoppiati) la sostanza si dice diamagnetica, mentre nel secondo caso (uno o più elettroni spaiati) si dice paramagnetica Lo stato di tripletto i sono inoltre sostanze che nonostante abbiano un numero pari di elettroni, come ad esempio l ossigeno, sono ugualmente paramagnetiche Per capire il paramagnetismo dell ossigeno dobbiamo andare a vedere come si dispongono gli elettroni negli orbitali all interno di una molecola e quindi analizzare il caso particolare dell ossigeno Gli atomi sono costituiti da nuclei carichi positivamente circondati da elettroni carichi negativamente Gli elettroni occupano gli orbitali atomici ad ognuno dei quali è associata una determinata energia Un atomo neutro contiene tanti elettroni quanti ne occorrono per bilanciare la carica del nucleo osì il nucleo del carbonio contiene 6 protoni ed è circondato da 6 elettroni che occupano 4 orbitali atomici Gli elettroni occupano gli orbitali a più bassa energia disponibili e si accoppiano con spin antiparallelo Quando ci sono disponibili due o più orbitali alla stessa energia (degeneri) gli elettroni preferiscono disporsi con spin parallelo uno per orbitale piuttosto che accoppiarsi (regola di und) Quando due atomi si legano tra loro gli orbitali atomici si combinano, si mescolano, per formare orbitali molecolari e gli elettroni si dispongono su questi ultimi rispettando le stesse regole Gli orbitali molecolari di legame possono essere di tipo σ o di tipo π e per ogni orbitale molecolare di legame che si forma si forma un orbitale molecolare di antilegame (si combinano due orbitali atomici, si devono formare due orbitali molecolari) che si trova ad alta energia e rappresenta uno stato repulsivo e viene contraddistinto da un asterisco L'ordine delle energia per gli orbitali molecolari che si formano quando si legano due atomi uguali del secondo periodo è quello mostrato in figura Per semplificare le cose non teniamo conto del fenomeno dell'ibridazione 1-4
5 Nel caso dell ossigeno gli atomi che si vanno a legare fra di loro hanno ognuno 8 elettroni (stiamo considerando anche gli elettroni del guscio interno) e la situazione che si viene a creare è la seguente: gli elettroni che erano negli orbitali 1s (2 + 2) riempiono l orbitale molecolari di legame 1σ s e l orbitale molecolare di antilegame 1σ s *; gli elettroni che erano negli orbitali 2s (2 + 2) riempiono l orbitale molecolari di legame 2σ s e l orbitale molecolare di antilegame 2σ s *; gli elettroni che erano negli orbitali 2p (4 + 4) riempiono completamente l orbitale molecolare di legame 2σ p e i due orbitali molecolari di legame 2π p e parzialmente i due orbitali molecolari di antilegame 2π p * con due elettroni a spin parallelo E la presenza di questi due elettroni spaiati che causa il paramagnetismo dell ossigeno Inoltre i due elettroni spaiati controllano anche il comportamento chimico dell ossigeno che si comporta come un biradicale stabile Le molecole che hanno due elettroni spaiati con spin parallelo vengono detti tripletti Le molecole come l ossigeno che sono dei tripletti allo stato fondamentale sono rare ma spesso molecole in uno stato eccitato sono tripletti 1-5
6 LA STOIA Nella storia della chimica i radicali sono una realtà abbastanza recente Il primo vero radicale libero è stato preparato solamente all inizio del 20 secolo, e il fatto che i radicali giocassero un ruolo importante nelle reazioni chimiche è stato riconosciuto solo trent anni dopo Essendo delle specie che portano degli elettroni spaiati, i radicali sono specie molto reattive ed in generale capaci di esistere solamente come specie transienti osì non ci si deve meravigliare se, nonostante ci sia stato un grande interesse a produrre ed isolare dei radicali, non ci si sia riusciti fino al 1900 quando Moses Gomberg generò per la prima volta il suo famoso trifenilmetil radicale, e produsse evidenze sperimentali, per confermare le sue affermazioni Passarono circa 28 anni prima che i semplici metil ed etil radicale venissero preparati Questi radicali, venne dimostrato che esistono solo per una frazione di secondo Il riconoscimento che i radicali partecipassero come entità reagenti nelle reazioni chimiche avvenne però solamente nel 1937 da parte di Kharasch e Flory negli Stati Uniti e ey e Waters in Inghilterra; si aprì quindi una nuova era nella quale si cominciò a tenere conto della possibile partecipazione dei radicali come specie reagenti nelle reazioni chimiche Questo portò ad interpretare delle reazioni che finora erano state viste come processi degradativi come delle vere e proprie reazioni chimiche, come la pirolisi dei composti organici che veniva usata solamente per distruggere i composti naturali e determinarne la loro composizione chimica, o i processi ossidativi di deterioramento dei composti Inoltre, diverse reazioni che era stato dimostrato che avvenissero con dei meccanismi ionici, ma che mostravano dei comportamenti anormali in determinate condizioni, venne dimostrato che in tali condizioni seguivano un meccanismo di tipo radicalico che poteva spiegare il comportamento altrimenti considerato anomalo Un esempio di questo tipo è la reazione di addizione di acido bromidrico agli alcheni Questo riconoscimento dei radicali liberi quali partecipanti nelle reazioni chimiche ha avuto notevoli conseguenze nella chimica organica Da un verso, si scoprì un nuovo campo di investigazione, e la ricerca di nuove reazioni che coinvolgessero radicali liberi ne fu l'immediata conseguenza Dall'altro, e questo fu forse di maggiore fondamentale importanza, si aprì un nuovo modo di interpretare dal punto di vista teorico i fenomeni chimici I radicali derivano da uno dei due modi fondamentali nei quali si può rompere un legame covalente, e così, poiché finora i chimici avevano considerato esclusivamente dei reagenti ionici nello studio del comportamento dei composti chimici, i loro studi erano per metà incompleti non avendo preso in esame anche l'effetto di reagenti radicalici Lo sviluppo della chimica dei radicali portò ad un grande sviluppo della chimica del petrolio Fino al 19simo secolo per i chimici gli idrocarburi saturi sembravano essere privi di reattività chimica così che vennero chiamati paraffine che significa di poca affinità Questi studiosi, d'altra parte usarono solo reagenti ionici (acidi, basi ed affini) su questi composti, mentre al contrario, questi idrocarburi reagiscono con grande avidità se vengono attaccati da reagenti radicalici, dando origine a reazioni a catena caratteristiche delle reazioni dei radicali in generale La maggior parte delle reazioni caratteristiche di questi composti inoltre sono applicabili a tutti i composti organici, e lo studio del meccanismo di tali reazioni portò ad una nuova prospettiva nella teoria delle reazioni 1-6
7 organiche Per fare alcuni esempi di queste reazioni radicaliche, specialmente quelle che hanno utili applicazioni nella vita di tutti i giorni, si può menzionare lo studio dei processi chimici denominati combustione e il conseguente sviluppo degli antidetonanti e di altri additivi che aiutano il processo di combustione Dallo studio del processo denominato autossidazione abbiamo capito come i grassi e gli oli, ed altri generi alimentari si deteriorano e si sono sviluppati gli antiossidanti e gli inibitori che ritardano questi processi chimici e che vengono usati come conservanti nei cibi Inoltre, lo stesso tipo di reazione è responsabile della decomposizione di alcuni reagenti chimici ed anche dell'invecchiamento delle gomme Nonostante l'autossidazione sia spesso un problema e devono essere prese misure speciali per bloccarlo, in alcune occasioni esso può essere usato positivamente Per esempio l'ossidazione aerobica del cumene, fatta su scala industriale produce il fenolo e l'acetone usati come antisettici L'asciugatura delle vernici e delle pitture è anch'esso un processo che coinvolge i radicali liberi e le ricerche in questo campo hanno portato alla scoperta di nuovi materiali che perseguono specifiche richieste Ancora il cosiddetto processo di cracking cioè la pirolisi sotto condizioni controllate, rompe le molecole degli idrocarburi del petrolio per produrre carburanti per motori Al contrario il processo della polimerizzazione, attraverso il quale piccole molecole vengono legate insieme per formare molecole ordinate giganti viene usato per numerosi scopi Un cenno va anche fatto ad un gruppo di reazioni radicaliche, che avvengono in fase liquida o di vapore, che vengono iniziate per irraggiamento con la luce del sole o ultravioletta o con i raggi γ, che provoca la rottura di legami covalenti per generare radicali Questo riassunto di reazioni radicaliche non sarebbe completo senza un richiamo al ruolo dei radicali nelle reazioni che avvengono nei sistemi biologici Questo è stato il soggetto di lunghe speculazioni per molto tempo ma tale studio non ha ottenuto grandi successi fino ad un passato più recente, e specialmente fino allo sviluppo della tecnica della risonanza elettronica di spin L'importanza del problema risulta evidente dalla lista dei processi biologici nei quali i radicali liberi si sono dimostrati attivi partecipanti attraverso questa nuova tecnica Questi includono l'ossidazione e la riduzione enzimatica, l'invecchiamento cellulare, la fotosintesi, la chemiluminescenza, il danno alle cellule per irraggiamento e l'inizio di crescite maligne 1-7
I RADICALI. Caratteristiche
 I RADIALI aratteristiche os è un radicale Un radicale è una specie che possiede un elettrone spaiato Per rappresentare l elettrone spaiato del composto radicalico si usa un punto R R R R N R O R S R ome
I RADIALI aratteristiche os è un radicale Un radicale è una specie che possiede un elettrone spaiato Per rappresentare l elettrone spaiato del composto radicalico si usa un punto R R R R N R O R S R ome
Reazioni di radicali. Reazioni di propagazione Reazioni di terminazione
 Reazioni di radicali Reazioni di propagazione Reazioni di terminazione Reazioni di propagazione Processi di trasferimento di radicali coinvolgono un radicale ed una molecola di substrato e portano alla
Reazioni di radicali Reazioni di propagazione Reazioni di terminazione Reazioni di propagazione Processi di trasferimento di radicali coinvolgono un radicale ed una molecola di substrato e portano alla
Idrocarburi Saturi. Reazioni
 Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI
 LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI Il legame covalente e la geometria delle molecole possono essere descritti dalla teoria del legame di valenza: i legami risultano dalla condivisione di
LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI Il legame covalente e la geometria delle molecole possono essere descritti dalla teoria del legame di valenza: i legami risultano dalla condivisione di
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
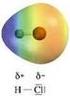
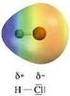
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
IBRIDAZIONE DEL CARBONIO NEGLI ALCANI PREMESSA: COSA SONO GLI ORBITALI IBRIDI.
 ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
LA STRUTTURA DELLE MOLECOLE. Le Molecole Poliatomiche
 LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio.
 La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
Combustione. Energia chimica. Energia termica Calore. Combustibili fossili
 Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Gli elettroni della molecola sono quindi descritti da
 IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
ATOMO POLIELETTRONICO. Numero quantico di spin m s
 ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
Lezione 20: Atomi e molecole
 Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI
 ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
Aromaticità Un composto si definisce aromatico se possiede un anello di elettroni chiuso.
 Aromaticità Un composto si definisce aromatico se possiede un anello di elettroni chiuso. E anche detto aromatico, quando tramite i seguenti criteri soddisfa la regola di ückel: 1. I composti aromatici
Aromaticità Un composto si definisce aromatico se possiede un anello di elettroni chiuso. E anche detto aromatico, quando tramite i seguenti criteri soddisfa la regola di ückel: 1. I composti aromatici
Chimica e chimica della vita. Chimica della vita. Atomi. Materia ed elementi. Tavola periodica degli elementi. Elementi ed atomi
 Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Lezione 3. Legame Chimico. Teoria degli Orbitali Molecolari
 Lezione 3 Legame Chimico Teoria degli Orbitali Molecolari 1 Perchè si formano i legami? Un diagramma di energia mostra che un legame fra due atomi si forma se l energia del sistema diminuisce quando i
Lezione 3 Legame Chimico Teoria degli Orbitali Molecolari 1 Perchè si formano i legami? Un diagramma di energia mostra che un legame fra due atomi si forma se l energia del sistema diminuisce quando i
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
Capitolo 4 Reazioni degli alcheni
 himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
Configurazione elettronica e Tavola periodica. Lezioni 13-16
 Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
VERIFICA La struttura della materia: atomi e molecole
 ERIICA La struttura della materia: atomi e molecole Cognome Nome Classe Data I/1 ero o falso? La massa atomica indica quanti neutroni sono presenti nel nucleo La massa atomica indica la massa in grammi
ERIICA La struttura della materia: atomi e molecole Cognome Nome Classe Data I/1 ero o falso? La massa atomica indica quanti neutroni sono presenti nel nucleo La massa atomica indica la massa in grammi
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
(2) cubico a facce centrate (3) esagonale compatto
 IL LEGAME METALLICO La maggior parte dei metalli cristallizza in strutture a massimo impacchettamento, ovvero in solidi in cui si può considerare che gli ioni metallici che occupano le posizioni reticolari,
IL LEGAME METALLICO La maggior parte dei metalli cristallizza in strutture a massimo impacchettamento, ovvero in solidi in cui si può considerare che gli ioni metallici che occupano le posizioni reticolari,
TEORIA DEGLI ORBITALI MOLECOLARI
 TEORIA DEGLI ORBITALI MOLECOLARI La teoria VB è la teoria più semplice basata sulla meccanica quantistica. Essa riesce a descrivere correttamente la geometria di moltissime molecole ma non permette di
TEORIA DEGLI ORBITALI MOLECOLARI La teoria VB è la teoria più semplice basata sulla meccanica quantistica. Essa riesce a descrivere correttamente la geometria di moltissime molecole ma non permette di
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
IBRIDAZIONE e GEOMETRIA MOLECOLARE
 IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Atomi e molecole. Gli atomi degli elementi si trovano in natura generalmente combinati tra loro in molecole o composti ionici
 IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
Teorie del legame chimico. Teorie del legame chimico
 Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Reazioni degli alcani
 Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1
 REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
IL LEGAME METALLICO 1
 IL LEGAME METALLICO 1 Non metalli Metalli Metalloidi Proprietà dei metalli Elevata conducibilità elettrica; Elevata conducibilità termica; Effetto fotoelettrico; Elevata duttilità e malleabilità; Lucentezza;
IL LEGAME METALLICO 1 Non metalli Metalli Metalloidi Proprietà dei metalli Elevata conducibilità elettrica; Elevata conducibilità termica; Effetto fotoelettrico; Elevata duttilità e malleabilità; Lucentezza;
GLI ALCANI. Michele Kodrič
 GLI ALCANI Michee Kodrič DEGLI ALCANI VEDREMO: (CARATTERISTICE (NOMENCLATURA (FORMULAZIONE (COMPOSTI PRINCIPALI (REATTIVITA (OTTENIMENTO (ISOMERIA DI CATENA (GRUPPI ALCILICI 1 CARATTERISTICE DEGLI ALCANI
GLI ALCANI Michee Kodrič DEGLI ALCANI VEDREMO: (CARATTERISTICE (NOMENCLATURA (FORMULAZIONE (COMPOSTI PRINCIPALI (REATTIVITA (OTTENIMENTO (ISOMERIA DI CATENA (GRUPPI ALCILICI 1 CARATTERISTICE DEGLI ALCANI
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Prof.ssa Stacca Prof.ssa Stacca
 La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Le sostanze chimiche
 Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
LA STRUTTURA DELLA MATERIA
 LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Teoria dell Orbitale Molecolare
 Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
REAZIONI E LORO MECCANISMI
 REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
Esercitazioni di Elementi di Chimica. Modulo 2 Struttura della Materia
 Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
un legame covalente due legami covalenti? tre legami covalenti due legami covalenti un legame covalente
 e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 1: mole, bilanciamento di equazioni chimiche non redox, formule minime e
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 1: mole, bilanciamento di equazioni chimiche non redox, formule minime e
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
A_Test di valutazione di CHIMICA:
 COGNOME NOME... C.I./Patente n... MATRICOLA NO SI, n:... Prova di accertamento per la determinazione di eventuali debiti formativi A_Test di valutazione di CHIMICA: Cosa studia in generale la chimica A)
COGNOME NOME... C.I./Patente n... MATRICOLA NO SI, n:... Prova di accertamento per la determinazione di eventuali debiti formativi A_Test di valutazione di CHIMICA: Cosa studia in generale la chimica A)
Prova in itinere di Chimica Generale 9 Gennaio 2013
 Prova in itinere di Chimica Generale 9 Gennaio 2013 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 9 Gennaio 2013 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
ph di Acidi e Basi Forti Molto Diluiti
 ph di Acidi e Basi Forti Molto Diluiti Come si calcola il ph di acidi e basi forti molto diluiti Proviamo a determinare il ph di una soluzione di HCl avente una concentrazione 10-7 mol/l. Applicando il
ph di Acidi e Basi Forti Molto Diluiti Come si calcola il ph di acidi e basi forti molto diluiti Proviamo a determinare il ph di una soluzione di HCl avente una concentrazione 10-7 mol/l. Applicando il
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
CHIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO. energia superiore. energia inferiore. orbitale s
 CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
ESERCIZI ESERCIZI. il basso d. aumenta lungo un periodo da sinistra verso
 ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
L Atomo e le Molecole
 L Atomo e le Molecole L atomo L'atomo, la particella che come un mattone costituisce tutta la materia, non è un corpicciolo semplice. Esso è a sua volta composto da particelle elementari piccolissime:
L Atomo e le Molecole L atomo L'atomo, la particella che come un mattone costituisce tutta la materia, non è un corpicciolo semplice. Esso è a sua volta composto da particelle elementari piccolissime:
LE MOLECOLE DELLA VITA
 LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
ORBITA ORBIT LI ALI MOLECOLARI
 ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
Come si costruiscono le molecole in natura ed in laboratorio. Giuseppe Macino
 Come si costruiscono le molecole in natura ed in laboratorio Giuseppe Macino E Dio creo la luce Cosa tiene insieme tutta la materia che forma la terra? Tutto questo e costituito da ELEMENTI Gli elementi
Come si costruiscono le molecole in natura ed in laboratorio Giuseppe Macino E Dio creo la luce Cosa tiene insieme tutta la materia che forma la terra? Tutto questo e costituito da ELEMENTI Gli elementi
VERIFICA Dalla tavola periodica al modello atomico
 VERIFICA Dalla tavola periodica al modello atomico Cognome Nome Classe Data I/1 Vero o Falso? Scegli per ciascuna risposta l'alternativa corretta V F Nella tavola periodica ogni elemento è contrassegnato
VERIFICA Dalla tavola periodica al modello atomico Cognome Nome Classe Data I/1 Vero o Falso? Scegli per ciascuna risposta l'alternativa corretta V F Nella tavola periodica ogni elemento è contrassegnato
H 2 O 2 (aq) 2e - + O 2 (g) H + (aq) MnO 2 (s) +2e H + (aq Mn 2+ (aq) +2 H 2 O (l).
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
LA CHIMICA DELLA VITA
 LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
PROVA 1. Dati i composti con formula KBr e HClO 2 :
 PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
Gruppi funzionali Un gruppo funzionale è un atomo o un gruppo di atomi con proprietà chimiche e fisiche tipiche. E
 Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
PERCHE STUDIARE LA CHIMICA ORGANICA?
 CIMICA ORGANICA CE COSA E LA CIMICA ORGANICA? La chimica organica è dedicata alla descrizione della struttura, delle proprietà e delle funzioni dei composti del carbonio (C). PERCE STUDIARE LA CIMICA ORGANICA?
CIMICA ORGANICA CE COSA E LA CIMICA ORGANICA? La chimica organica è dedicata alla descrizione della struttura, delle proprietà e delle funzioni dei composti del carbonio (C). PERCE STUDIARE LA CIMICA ORGANICA?
Teoria degli orbitali ibridi
 Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
L Atomo e le Molecole
 L Atomo e le Molecole L atomo L'atomo, la particella che come un mattone costituisce tutta la materia, non è un corpicciolo semplice. Esso è a sua volta composto da particelle elementari piccolissime:
L Atomo e le Molecole L atomo L'atomo, la particella che come un mattone costituisce tutta la materia, non è un corpicciolo semplice. Esso è a sua volta composto da particelle elementari piccolissime:
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA
 INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
Chimica. La scienza che studia le trasformazioni della materia. Acqua (ghiaccio) Acqua (Liquido) Trasformazione Fisica
 Nozioni di Base Chimica La scienza che studia le trasformazioni della materia Acqua (ghiaccio) ----- Acqua (Liquido) Trasformazione Fisica Metano + Ossigeno -- Anidride Carbonica + Acqua Trasformazione
Nozioni di Base Chimica La scienza che studia le trasformazioni della materia Acqua (ghiaccio) ----- Acqua (Liquido) Trasformazione Fisica Metano + Ossigeno -- Anidride Carbonica + Acqua Trasformazione
La Chimica Organica idrogeno carbonio azoto ossigeno composti covalenti catene di atomi di carbonio strutture covalenti e debolmente polarizzate
 LA IMIA ORGANIA La himica Organica I quattro elementi idrogeno, carbonio, azoto e ossigeno rappresentano più del 95% dei costituenti della materia vivente. I composti organici sono composti covalenti che
LA IMIA ORGANIA La himica Organica I quattro elementi idrogeno, carbonio, azoto e ossigeno rappresentano più del 95% dei costituenti della materia vivente. I composti organici sono composti covalenti che
Le sostanze chimiche prof. Matteo Scapellato
 1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Corso di CHIMICA LEZIONE 1
 Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
Struttura dell atomo atomo particelle sub-atomiche - protoni positiva - neutroni } nucleoni - elettroni negativa elemento
 Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 2 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 3 Numerazione gruppi
Le proprietà periodiche degli elementi 1 2 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 3 Numerazione gruppi
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A Prova scritta del corso di Fondamenti di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
