La via per accelerare i processi biologici
|
|
|
- Aureliano Riccardi
- 6 anni fa
- Visualizzazioni
Transcript
1 La via per accelerare i processi biologici
2 ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. La loro struttura, come quella delle proteine, è molto complessa e caratterizzata da una ben precisa configurazione tridimensionale con ripiegamenti, rientranze e sporgenze. Il sito attivo dell enzima è un regione (estremamente piccola della molecola) a forma di fessura o di tasca che istaura legami con il substrato. E costituito da pochi residui di amminoacidi con una configurazione spaziale ben definita, complementare a quella del substrato con cui interagisce. Per l interazione enzima substrato è stato suggerito il modello chiave serratura:
3 La maggior parte degli enzimi portano nella loro molecola una parte non proteica. In questo caso l enzima intero prende il nome di oloenzima, la componente proteica di apoenzima, la non proteica di gruppo prostetico Se il gruppo prostetico è facilmente dissociabile dall apoenzima esso prende il nome di coenzima. La nomenclatura e la classificazione degli enzimi si basa sul tipo di reazione catalizzata, si hanno così 6 classi di enzimi: All interno delle classi gli enzimi vengono generalmente classificati in base al nome del substrato specifico
4 DIFFERENZE TRA ENZIMI E CATALIZZATORI INORGANICI Gli enzimi si distinguono dai comuni catalizzatori inorganici per le seguenti significative caratteristiche: Peso molecolare A differenza dei catalizzatori della chimica inorganica che sono composti molto semplici spesso anche semplici atomi, gli enzimi sono molecole proteiche e, pertanto, espressione dei geni. Sono caratterizzati da un peso molecolare molto alto e da una configurazione tridimensionale piuttosto complessa, articolata nelle quattro strutture proprie delle proteine. Specificità Potere catalitico Diversamente dai catalizzatori inorganici che molto spesso si comportano da pas-partout e catalizzano numerose reazioni anche molto diverse tra loro, gli enzimi sono altamente specifici sia verso il substrato sul quale agiscono, sia verso il tipo di reazione che catalizzano. La maggior parte di enzimi agisce su di un unico substrato o su un numero molto limitato di composti. Gli enzimi accelerano le reazioni almeno di un milione di volte.
5 ENERGIA DI ATTIVAZIONE Perché una reazione chimica possa avvenire, si devono rompere i legami preesistenti e si devono eventualmente formare nuovi legami. Consideriamo una popolazione di molecole R-X che devono reagire per formare il prodotto R + X -. Affinché una reazione chimica avvenga è necessario: le molecole si urtino urto efficace, nel senso che le molecole che si urtano devono avere un contenuto energetico tale da permettere loro di formare il complesso attivato (R δ+ --- X δ- ) ad alto contenuto energetico e bassa stabilità. Il livello energetico a cui è localizzato il complesso attivato si chiama stato di transizione. La differenza di energia tra i reagenti e lo stato di transizione viene detta energia di attivazione (Ea). Ea rappresenta quindi una barriera energetica che i reagenti devono superare per trasformarsi nei prodotti.
6 Il tutto può essere simpaticamente rappresentato come un sasso (reagente) che per arrivare a valle (prodotto) deve superare la montagna (Ea) Maggiore è il numero di molecole R-X capaci di formare, nell unità di tempo, il complesso attivato maggiore sarà la velocità di reazione. La velocità di reazione è definita come la quantità di sostanza consumata o prodotta nell unità di tempo: v = dc/dt Una reazione chimica può essere accelerata aumentando la temperatura. Infatti aumentando la T aumenta l energia cinetica delle particelle aumenta il numero degli urti efficaci tra le molecole un maggior numero di particelle, nell unità di tempo, formerà il complesso attivato.
7 CATALISI ENZIMATICA Un altro modo per accelerare una reazione è quello di aggiungere un enzima (E). E si lega alle molecole R-X per formare il complesso attivato (E-R δ + ---X δ- ) il cui stato di transizione è più basso rispetto a quello della reazione non catalizzata. Così alcune molecole di R-X che prima non erano in grado di reagire, adesso legandosi a E entrano nello stato di transizione (più basso) per formare i prodotti. Gli Enzimi catalizzano tutte le reazioni che avvengono nell ambiente cellulare dove le condizioni di temperatura e concentrazione esistenti comporterebbero tempi di reazione molto lunghi.
8 Come si misura la velocità di una reazione catalizzata La velocità di reazione è definita come la quantità di sostanza consumata o prodotta nell unità di tempo. Un altro modo per esprimere la velocità di una reazione catalizzata è il numero di turnover. Esso indica il numero di molecole di substrato che reagiscono con una sola molecola di enzima nell unità di tempo. La velocità di reazione cambia da enzima ad enzima ed è caratteristica di ognuno di essi. Concentrazione v o [P] [S] Andamento nel tempo di una reazione enzimatica misurata come comparsa del prodotto (P) o scomparsa del substrato (S). La linea tratteggiata tangente alla curva rappresenta la velocità iniziale v 0 Tempo All inizio quando è praticamente presente tutto il substrato la velocità segue un andamento rettilineo (v 0 ), a mano a mano che il substrato viene consumato la velocità rallenta fino a raggiungere un plateau quando tutto il substrato è stato convertito in prodotto.
9 La velocità di una reazione catalizzata è influenzata dai seguenti fattori Concentrazione del substrato Concentrazione dell enzima Temperatura ph Inibitori
10 CONCENTRAZIONE DEL SUBSTRATO A parità di altre condizioni (temperatura, concentrazione di enzima, ph, ecc.) riportando in grafico la concentrazione di substrato in funzione della v 0 si ottiene una curva iperbolica. Si osserva che, nel primo tratto della curva (rettilineo) la v 0 è direttamente proporzionale alla concentrazione di substrato (aumentando la concentrazione di S aumenta proporzionalmente il numero di molecole che formano il complesso ES). Una volta raggiunta una certa concentrazione di S la v 0 cresce più lentamente fino a raggiungere un valore massimo quando tutto l enzima è saturato dal substrato e pur continuando ad aumentare la concentrazione di S la v 0 rimane costante (Vmax). E possibile risalire alla velocità di una reazione enzimatica dall equazione v 0 = Vmax [S] / [S] + Km proposta dai due studiosi Michaelis e Menten. Nell equazione, v è la velocità di reazione, Vmax la velocità massima, [S] la concentrazione del substrato e Km è la costante di Michaelis-Menten. Km corrisponde alla concentrazione di S alla quale la velocità è = Vmax/2
11 Equazione di Michaelis-Menten v 0 = Vmax [S] Km + [S] A basse concentrazioni di substrato, quando [S] è molto più piccola di Km e quindi trascurabile, si ha v 0 = Vmax [S] / Km cioè, la velocità è direttamente proporzionale alla concentrazione del substrato. Ad alte concentrazioni di substrato, quando [S] è molto più grande di Km, Km diventa trascurabile e si ha v 0 = Vmax, cioè, la velocità è la massima, indipendentemente dalla concentrazione del substrato. I valori di Km variano moltissimo da enzima ad enzima ed esprimono l affinità che l enzima ha per il substrato. Osservando la posizione di Km sul grafico velocità contro concentrazione di substrato, si può notare che se Km è bassa, in ogni istante è necessaria una bassa concentrazione di substrato per saturare metà delle molecole di enzima e questo è segno di alta affinità dell enzima per il substrato, mentre se Km è alta, occorre una più alta concentrazione di substrato per saturare metà delle molecole di enzima in ogni istante e questo vuol dire che l enzima presenta bassa affinità per il substrato. Il valore di Km è indipendente dalla concentrazione dell'enzima e dalla concentrazione del substrato.
12 Per un calcolo più accurato della Vmax e della Km è opportuno trasformare matematicamente l equazione di Michealis-Menten facendo il reciproco di entrambi i lati dell equazione v 0 = Vmax [S] Km + [S] 1 K M 1 = v 0 Vmax [S] + 1 Vmax Si ottiene il grafico dei doppi reciproci (o grafico di Lineweaver-Burk) mediante il quale la curva iperbolica viene convertita in una retta
13 CONCENTRAZIONE DELL ENZIMA La velocità iniziale v 0 di una reazione enzimatica è direttamente proporzionale alla concentrazione dell enzima. Km è indipendente dalla concentrazione dell enzima v 0 5 Unità enzimatica: quantità di enzima capace di trasformare una µmole di S in 1 minuto a 25 C nelle condizioni ottimali del saggio. È quindi possibile misurare l attività di un enzima (cioè la sua concentrazione espressa come unità per volume o per g di peso fresco o secco) mediante una misura della Vo ed in particolare della Vmax. Tali misure si effettuano utilizzando una concentrazione saturante di substrato ( 5 volte la Km quando la v o =Vmax) e monitorando la reazione nei primi minuti, quando tutto il substrato è praticamente disponibile.
14 TEMPERATURA La velocità delle reazioni enzimatiche varia col crescere della temperatura secondo il grafico a campana riportato. Si può osservare che, inizialmente, la velocità cresce al crescere della temperatura, raggiunge un massimo in corrispondenza di una certa temperatura definita ottimale, si riduce, in seguito, per effetto della denaturazione dell enzima. ph Come la variazione della temperatura, in modo un poco più complesso, anche la variazione del ph influenza la velocità delle reazioni enzimatiche. Anche in questo caso, la curva presenta un andamento a campana e l attività enzimatica manifesta un massimo in corrispondenza di un valore definito ph ottimale legato alla natura del substrato.
15 Inibitori In molti casi, molecole specifiche o ioni possono competere con le molecole di substrato nel legarsi con l enzima ed inibire l attività dell enzima. L inibizione può essere irreversibile e reversibile. IRREVERSIBILE E irreversibile quando l inibitore si va a legare al sito catalitico dell enzima con un legame molto forte, impedendo l accesso del substrato. Ki I + E EI inattivo Un esempio di inibizione irreversibile è dato dall azione dei gas nervini che bloccano l azione dell enzima acetilcolinesterasi, un enzima che ha un ruolo importantissimo nella trasmissione degli impulsi nervosi.
16 REVERSIBILE L inibizione reversibile può essere competitiva, quando gli inibitori sono, da un punto di vista chimico, molto simili alle molecole di substrato e si legano agli stessi siti attivi, e non competitiva, quando gli inibitori si legano a siti dell enzima diversi da quelli che legano il substrato e, pertanto, possono legarsi sia all enzima che al complesso ES. COMPETITIVA NON COMPETITIVA L inibitore possiede una struttura molto simile a quella del substrato la similitudine porta il substrato e l inibitore a competere per lo stesso sito attivo dell enzima. L esito della competizione dipende dalla concentrazione delle due molecole che si contendono il sito attivo Può essere completamente rimossa aumentando notevolmente la concentrazione di substrato L inibitore si lega all enzima in una zona diversa da quella del sito attivo dando luogo al complesso EI inattivo. Il legame dell inibitore deforma la conformazione spaziale dell enzima ed il suo sito catalitico pur potendosi legare al substrato risulta inattivo.
17 E possibile distinguere la inibizione competitiva da quella non competitiva 1/Vmax 1/Vmax In presenza di inibitore per ottenere la stessa velocità di reazione che in sua assenza, è necessario aumentare la concentrazione di substrato. La Vmax rimane invariata (infatti a concentrazione elevata di substrato tutta l inibizione viene rimossa) mentre la Km aumenta - 1/Km diminuisce. A qualsiasi concentrazione di substrato la velocità di reazione in presenza di inibitore è sempre minore che in sua assenza. Quindi la Vmax diminuisce 1/Vmax aumenta, mentre la Km rimane costante.
18 STUDIO DELLE INTERAZIONI PROTEINA-LIGANDO Queste interazioni sono alla base del riconoscimento molecolare e quindi rappresentano la chiave della maggior parte dei processi biologici: Specificità degli enzimi ed allosterismo Trasporto attraverso i compartimenti cellulari Trasduzione del segnale Regolazione della trascrizione e della traduzione Riconoscimento degli antigeni da parte degli anticorpi ed altro Come si analizzano tali interazioni e come si determinano le costanti di dissociazione o di legame?
19 Concetti basilari per lo studio del binding recettoriale I recettori sono presenti in concentrazioni molto piccole nei tessuti. Incubando il tessuto contenente i recettori R ed il ligando radiomarcato D in opportune condizioni sperimentali si formerà il complesso RD secondo l equazione R + D RD Quando il sistema raggiunge l equilibrio in ogni provetta avremo:
20 Radioligando Tessuto Tampone di incubazione Incubazione Equilibrio Ligando radiomarcato D Recettore RD Recettore libero R Il recettore libero R non potrà essere misurata ma possiamo misurare la quantità di complesso ligando-recettore RD.
21 Per poter calcolare la quantità del complesso RD è necessaria un operazione di separazione del legato (Bound) dalla quantità di ligando radiomarcato D libero in soluzione non legato al tessuto (Free). Equilibrio Separazione
22 Metodi di separazione del RD dal mezzo di reazione Filtrazione Il metodo più semplice e classico è quello della filtrazione su membrane in fibra di vetro Whatman GF/A, GF/B, GF/C dove varia la porosità 0.7 µm-2.7 µm Il tessuto contenente il recettore legato al radioligando aderisce al filtro mentre il radioligando libero passa attraverso la membrana.
23 Limiti e precauzioni della filtrazione Le proteine ostruiscono il filtro Il ligando radiomarcato tende a legarsi alle fibre del filtro. Elevata velocità di filtrazione (deve essere completata in 4-5 secondi per evitare che il ligando radiomarcato si stacchi dal recettore. In genere si perde il 5% di RD)
24 Centrifugazione Limiti e precauzioni della centrifugazione Una certa quantità di ligando radiomarcato (Free) potrebbe restare intrappolato nel pellet. Numero limitato degli alloggi nel rotore
25 Dialisi Viene impiegata quando il recettore ha bassa affinità per il ligando radiomarcato (micromolare). Una piccola membrana simile alla cellulosa da dialisi separa due camere L L R R R L L L L L
26 La membrana è scelta in modo tale che il ligando possa passare mentre il recettore viene trattenuto. Il ligando diffonde fino a raggiungere l equilibrio. Nella camera azzurra [L] sarà Ligando libero Nella camera gialla [L]= ligando libero +ligando legato La differenza fra questi valori è la concentrazione di ligando legato. Quella che viene misurata è la deplezione di ligando libero
27 Analisi di saturazione Recettore + Ligando K on K off Recettore-Ligando Il binding avviene quando ligando e recettore collidono mediante diffusione e quando la collisione ha un corretto orientamento e sufficiente energia. La velocità di associazione è data dal numero di eventi di binding per unità di tempo V on = [Ligando] [Recettore] k on
28 Una volta avvenuto il binding, ligando e recettore restano legati per un certo periodo di tempo. La velocità di dissociazione del complesso è data dal numero di eventi per unità di tempo V off = [ligando-recettore] k off Dopo la dissociazione il ligando e il recettore non devono aver subito modifiche. All equilibrio avremo: V on = V off
29 [Ligando] [Recettore] k on = [Ligando-Recettore] k off Riarrangiando l equazione avremo: [Ligando] [Recettore] [Ligando-Recettore] = K off = K d K on Per meglio comprendere il significato della K d poniamo [Ligando] = K d L equazione pertanto diviene: [Recettore] [Ligando-Recettore] = 1 da cui si evince che:
30 [Recettore] = [Ligando- Recettore] Quando [Ligando] = K d la quantità di recettore libero è esattamente uguale alla quantità di recettore occupato. I recettori totali sono la somma di quelli liberi più quelli legati al ligando, e quando [Ligando] = K d avremo che metà della popolazione recettoriale sarà occupata all equilibrio. Se il ligando ha elevata affinità per il recettore, la K d sarà piccola perché basterà una piccola concentrazione di ligando per legare la metà dei recettori.
31 Non bisogna confondere la K d (costante di dissociazione all equilibrio) con K off (costante di dissociazione). Non sono la stessa cosa ed hanno dimensioni differenti. K on = costante di associazione (molare -1 min -1 ) K off = costante di dissociazione (min -1 ) K d = costante di dissociazione all equilibrio (molare) La legge di azione di massa permette di definire la frazione di recettore occupata all equilibrio in funzione della concentrazione di ligando.
32 Frazione recettoriale occupata [RL] [R tot ] = [RL] [R] + [RL] Questa equazione non è utile perché non conosciamo la concentrazione di recettore libero. Poiché [R] = [Rtot] - [RL] e sapendo che: K d = [R] [L] [RL]
33 [RL] = [R] [L] K K d = ([R tot ] - [RL]) [L] d [RL] K d = [R tot ] [L] - [RL] [L] [RL] K d + [RL] [L] = [R tot ] [L] [RL] (K d + [L] ) = [R tot ] [L] [RL] = [R tot ] [L] Kd + [L]
34 Bound (pmol/mg protein) Binding totale Binding non specifico Binding specifico [ 3 H]spiroperidolo, (nm) Le tre curve corrispondenti sono riportate in figura Visualizzando solo la curva del binding specifico possiamo individuare la K d e la Bound (pmol/mg protein) K d Bmax B max [ 3 H]spiroperidolo, (nm)
35 da cui la frazione recettoriale occupata [RL]/ [R tot ] sarà: [RL] [R tot ] = [Ligando] Ligando + K d [Ligando] Frazione recettoriale occupata 0 0% 1Kd 50% 4Kd 80% 9Kd 90% 99Kd 99%
36 Informazioni provenienti dall analisi di saturazione K D Indica la concentrazione di radioligando che all equilibrio occupa il 50% dei recettori presenti nel preparato biologico B max Indica la densità recettoriale nel tessuto studiato. Si esprime in moli/mg di proteina.
37 Approccio sperimentale all analisi di saturazione L esperimento di saturazione viene effettuato determinando il Binding Totale e il Binding Non-Specifico a differenti concentrazioni di ligando radiomarcato. Binding Totale Viene definito aggiungendo al tessuto concentrazioni crescenti di radioligando Binding Non-Specifico Viene definito in presenza di ligando non marcato ad elevata concentrazione alla quale tutto il radioattivo viene spiazzato dai siti specifici di legame
38 Esempio: Vogliamo determinare il binding specifico all equilibrio per un determinato radioligando alla concentrazione di 0.5 nm Provetta 1 (Binding totale) Tessuto + Rx (0.5 nm) Lettura radioattività =2500 cpm Provetta 2 (Binding non specifico) Tessuto + Rx (0.5 nm) + Ligando non marcato (10 µm) Lettura radioattività= 500 cpm Alla concentrazione 0.5 nm di RX il complesso RD (Binding Specifico, Bound) sarà : = 2000 cpm.
39 Il valore 500 cpm rappresenta la quantità di RX che si è legato a siti non specifici di legame. Infatti l impiego del ligando non marcato ad levata concentrazione spiazza RX solo da tutti i siti specifici ma non da quelli non specifici. Realizzando differenti concentrazioni di RX e definendo per ciascuna il Binding Totale e il binding Non-Specifico si calcola il Binding Specifico.
40 Bound (pmol/mg protein) Binding totale Binding non specifico Binding specifico [ 3 H]spiroperidolo, (nm) Le tre curve corrispondenti sono riportate in figura Visualizzando solo la curva del binding specifico possiamo individuare la K d e la Bound (pmol/mg protein) K d Bmax B max [ 3 H]spiroperidolo, (nm)
41 Come trasformare i cpm in concentrazione Esempio:Un campione dal volume totale di un 1 ml fornisce 5000 cpm per un Rx di attività specifica 27 Ci/mmole cpm dpm = efficienza (%) Conoscendo l efficienza strumentale (es 55%) 5000 cpm corrispondono a 9090 dpm Sapendo che 2.22 x 10 6 dpm corrispondono a 1 µci Avremo che 9090 dpm corrispondono a 4.1 x 10-3 µci
42 Dall attività specifica del radioligando sappiamo che 27 Ci corrispondono ad 1 mmole. Cioè 27 x 10 6 µci ad 1 mmole Avremo che 4.1 x 10-3 µci corrispondono a 1.52 x10-10 mmoli Il campione in esame ha un volume totale di 1 ml La concentrazione sarà: 1.52x10-10 M (0.152 nm).
43 Analisi di Scatchard Partendo dall equazione: [RL] = [R tot ] [L] Kd + [L] [RL] ([L] + K d ) = [L] [R tot ] [RL] [L] + [RL] K d = [L] [R tot ] dividendo tutto per [L] K d avremo: [RL] [L] [RL]K d [R tot ] [L] + = [L] K d [L] K d [L] K d
44 quindi: [RL] [L] = [R tot ] K d - [RL] K d Se indichiamo con B la concentrazione di ligando legato [RL]; con B max la quantità massima di ligando legato [R tot ]; con F la quantità di ligando libero [L] avremo: B F = _ B + K d B max Riportando in grafico il rapporto tra la quantità di ligando legato e ligando libero (B/F) rispetto alla quantità di ligando legato (B) avremo: K d
45 B/F B max Bound Si ottiene una retta con Slope = - 1 K d L intercetta sull asse delle ascisse (B/F = 0) permette di ricavare B max che rappresenta la densità recettoriale.
46 Se è presente un solo tipo di recettore lo Scatchard sarà lineare. Se sono presenti invece due tipi di recettore in uguale concentrazione ma con differenze in K d per il radioligando avremo: A B 1.00 Binding specifico [radioligando] B/F Bound Le curve dei singoli recettori sono riportate in rosso e azzurro mentre in nero la curva somma del binding totale.
47 Nel grafico di Scatchard (B) la linea nera del binding totale (inteso come somma del binding specifico delle popolazioni recettoriali esistenti) evidenzia una curvatura e le due linee tratteggiate rappresentano il binding specifico di ciascun recettore. Dall analisi di Scatchard si può determinare l omogeneità di una popolazione recettoriale (sempre che vi siano differenze evidenti tra i valori di K d del radioligando per ciascun recettore). In caso contrario avremo un informazione apparente (di un unica popolazione recettoriale). La soluzione del problema è realizzata ovviamente da radioligandi selettivi per ciascun tipo di recettore presente.
48 Analisi di Hill Considerando l equazione: [RL] = [R tot ] [L] Kd + [L] che può essere scritta: [RL] [L] + [RL] K d = [R tot ] [L] [RL] K d = [R tot ] [L] - [RL] [L] [RL] = [L] ([R tot ] - [RL]) K d
49 da cui: [RL] [R tot ] - [RL] = [L] K d se il ligando L interagisce con n siti secondo l equazione nl + R RL n avremo: [RL] [R tot ] - [RL] = [L] n K d B B max - B = [L] n K d
50 passando ai logaritmi: dove n è il coefficiente di Hill (n H ) log log B B max - B B B max - B = n log [L] - log K d Se esiste un solo sito di interazione per recettore (n =1) si ha una retta con pendenza = 1 Per calcolare la K d bisogna porre 0 pendenza = n H log B B max - B = 0 log [L]
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Analisi quantitativa dell interazione proteina-proteina
 Analisi quantitativa dell interazione proteina-proteina Legame recettore-ligando (proteina-proteina) Il legame per il ligando deve essere: reversibile ad alta affinità saturabile deve portare ad una risposta
Analisi quantitativa dell interazione proteina-proteina Legame recettore-ligando (proteina-proteina) Il legame per il ligando deve essere: reversibile ad alta affinità saturabile deve portare ad una risposta
Fondamenti di Chimica Farmaceutica. Inibizione enzimatica
 Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
IL BINDING RECETTORIALE VIENE EFFETTUATO ATTRAVERSO L UTILIZZO DI LIGANDI SELETTIVI MARCATI CON UN RADIOISOTOPO E CI PERMETTE:
 IL BINDING RECETTORIALE VIENE EFFETTUATO ATTRAVERSO L UTILIZZO DI LIGANDI SELETTIVI MARCATI CON UN RADIOISOTOPO E CI PERMETTE: Ø VALUTAZIONE DELLA PRESENZA DI SITI DI RICONOSCIMENTO SPECIFICI PER UN LIGANDO
IL BINDING RECETTORIALE VIENE EFFETTUATO ATTRAVERSO L UTILIZZO DI LIGANDI SELETTIVI MARCATI CON UN RADIOISOTOPO E CI PERMETTE: Ø VALUTAZIONE DELLA PRESENZA DI SITI DI RICONOSCIMENTO SPECIFICI PER UN LIGANDO
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe. Substrato
 Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Fondamenti di Chimica Farmaceutica. Recettori come bersagli dei farmaci
 Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
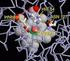 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio
 Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
CINETICA CHIMICA. Ogni reazione chimica però impiega un certo tempo per raggiungere le condizioni di equilibrio.
 Facendo reagire delle sostanze si arriva ad uno stato di equilibrio in cui le concentrazioni di reagenti e prodotto rispettano la legge di equilibrio chimico, definita da una costante di equilibrio. Ogni
Facendo reagire delle sostanze si arriva ad uno stato di equilibrio in cui le concentrazioni di reagenti e prodotto rispettano la legge di equilibrio chimico, definita da una costante di equilibrio. Ogni
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
2) La presenza di gruppi funzionali specifici che partecipano alla catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o quelli
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Analisi quantitativa dell interazione proteina-ligando
 Analisi quantitativa dell interazione proteina-ligando INTERAZIONI PROTEINA-LIGANDO Queste interazioni sono alla base del riconoscimento molecolare e quindi rappresentano la chiave della maggior parte
Analisi quantitativa dell interazione proteina-ligando INTERAZIONI PROTEINA-LIGANDO Queste interazioni sono alla base del riconoscimento molecolare e quindi rappresentano la chiave della maggior parte
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Cinetica Chimica. Cinetica chimica
 Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Affinità ed efficacia
 Affinità ed efficacia Effetto massimo (percentuale) EC50 Parametri delle curve doseeffetto POTENZA: Sensibilità di un organo o di un tessuto al farmaco EFFICACIA: Effetto massimo raggiungibile con quel
Affinità ed efficacia Effetto massimo (percentuale) EC50 Parametri delle curve doseeffetto POTENZA: Sensibilità di un organo o di un tessuto al farmaco EFFICACIA: Effetto massimo raggiungibile con quel
ENZIMI. A + B AB (100 Kcal= E. Attiv.) A + B AB (50 Kcal) SUBSTRATO ENZIMA E N E R G I A
 ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
FARMACODINAMICA. La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci.
 FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Le reazioni chimiche
 Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
La cinetica chimica. Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento)
 La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Appendice cap. 29: applicazioni
 2 Analisi chimica strumentale Appendice cap. 29: applicazioni Per una reazione del 1 ordine, l equazione differenziale, ovvero la forma differenziale della legge cinetica, assume la forma d[a]/dt = k [A]
2 Analisi chimica strumentale Appendice cap. 29: applicazioni Per una reazione del 1 ordine, l equazione differenziale, ovvero la forma differenziale della legge cinetica, assume la forma d[a]/dt = k [A]
Cine%ca enzima%ca. Copyright 2013 Zanichelli editore S.p.A.
 Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Velocità di reazione Una trasformazione chimica modifica completamente la natura delle sostanze iniziali ( i reagenti), formando altre specie (i prodo
 Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
CARATTERIZZAZIONE DELLE INTERAZIONI
 CARATTERIZZAZIONE DELLE INTERAZIONI Costante di legame Concentrazione delle due specie Interazione Competizione con altre proteine Cofattori Compartimentazione cellulare Fattori che influenzano l interazione
CARATTERIZZAZIONE DELLE INTERAZIONI Costante di legame Concentrazione delle due specie Interazione Competizione con altre proteine Cofattori Compartimentazione cellulare Fattori che influenzano l interazione
Reazione di Briggs Rauscher
 Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Case study. viene espressa in unità µmol per ora per grammo di peso secco.
 Vengono studiate due specie diverse (ma dello stesso genere) di piante di interesse agronomico. In particolare, i ricercatori vogliono misurare la capacità dell'apparato radicale di tali piante di assorbire
Vengono studiate due specie diverse (ma dello stesso genere) di piante di interesse agronomico. In particolare, i ricercatori vogliono misurare la capacità dell'apparato radicale di tali piante di assorbire
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Per la stessa reazione possono essere utilizzati catalizzatori diversi. es. HCOOH H 2 + CO 2 viene catalizzata da Ni, Cd, Pt, Cu.
 CATALISI L'uso di un catalizzatore, sostanza capace di accelerare una reazione senza intervenire sulla T, è di enorme importanza in alcuni tipi di reazione. Ad esempio le proteine reagiscono velocemente
CATALISI L'uso di un catalizzatore, sostanza capace di accelerare una reazione senza intervenire sulla T, è di enorme importanza in alcuni tipi di reazione. Ad esempio le proteine reagiscono velocemente
Velocità di reazione
 1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA
 TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. a.a
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia a.a. 2016-17 Cinetica Chimica studia i fenomeni connessi con la VELOCITA di una REAZIONE Reazioni
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia a.a. 2016-17 Cinetica Chimica studia i fenomeni connessi con la VELOCITA di una REAZIONE Reazioni
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
In questo caso parliamo di un processo entalpico. Si tratta di un processo entalpico.
 LEZIONE DEL 10/04/2017 ENZIMOLOGIA - APPLICAZIONI DELLA CINETICA ENZIMATICA Essa trova applicazioni nel processamento dei rifiuti, nelle materie organiche. Si tratta dell'ingegnerizzazione dei processi
LEZIONE DEL 10/04/2017 ENZIMOLOGIA - APPLICAZIONI DELLA CINETICA ENZIMATICA Essa trova applicazioni nel processamento dei rifiuti, nelle materie organiche. Si tratta dell'ingegnerizzazione dei processi
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
Esistono reazioni energeticamente favorite (ΔH<0) che non avvengono.es. C(diamante) à C(grafite)
 CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
frazionamento). Per ciascuna frazione è determinata la quantità di proteine totali e le unità di attività enzimatica della proteina di interesse.
 Ogni passaggio della procedura di purificazione determina la separazione delle proteine totali presenti nel campione in una serie di frazioni (frazionamento( frazionamento). Per ciascuna frazione è determinata
Ogni passaggio della procedura di purificazione determina la separazione delle proteine totali presenti nel campione in una serie di frazioni (frazionamento( frazionamento). Per ciascuna frazione è determinata
metodi poco sensibili, laboriosi, costosi, e indaginosi
 dosaggi ormonali L ANALISI CHIMICA fasi di isolamento, purificazione e concentrazione elaborate non sufficientemente sensibile per il dosaggio di tutti gli ormoni nel sangue metodi poco sensibili, laboriosi,
dosaggi ormonali L ANALISI CHIMICA fasi di isolamento, purificazione e concentrazione elaborate non sufficientemente sensibile per il dosaggio di tutti gli ormoni nel sangue metodi poco sensibili, laboriosi,
VELOCITA DI REAZIONE
 VELOCITA DI REAZIONE Analogamente alla velocità di un corpo (velocità = distanza percorsa / tempo impiegato) la velocità di reazione è definita come la variazione di concentrazione dei prodotti o dei reagenti
VELOCITA DI REAZIONE Analogamente alla velocità di un corpo (velocità = distanza percorsa / tempo impiegato) la velocità di reazione è definita come la variazione di concentrazione dei prodotti o dei reagenti
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
La Farmacogenetica studia:
 La Farmacogenetica studia: a) Gli effetti dei farmaci sull espressione genica b) La sintesi di farmaci da parte di organismi geneticamente modificati c) Nessuna delle risposte è esatta d) La terapia genica
La Farmacogenetica studia: a) Gli effetti dei farmaci sull espressione genica b) La sintesi di farmaci da parte di organismi geneticamente modificati c) Nessuna delle risposte è esatta d) La terapia genica
ESERCIZI ESERCIZI. 3) Data la reazione chimica: H 2
 ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
LA VELOCITA DELLE REAZIONI
 LA VELOCITA DELLE REAZIONI Classe 3 Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
LA VELOCITA DELLE REAZIONI Classe 3 Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
RADIOIMMUNOLOGIA COMPONENTI REAZIONI ESECUZIONE DOSAGGI R.I.A.
 RADIOIMMUNOLOGIA COMPONENTI REAZIONI ESECUZIONE DOSAGGI R.I.A. Radioimmunologia Inserita nel contesto della Medicina Nucleare La storia Il RIA nasce dalla combinazione di tecniche mutuate dall immunochimica
RADIOIMMUNOLOGIA COMPONENTI REAZIONI ESECUZIONE DOSAGGI R.I.A. Radioimmunologia Inserita nel contesto della Medicina Nucleare La storia Il RIA nasce dalla combinazione di tecniche mutuate dall immunochimica
FARMACODINAMICA. E CIO CHE IL FARMACO FA ALL ORGANISMO Si occupa degli effetti dei farmaci e dei loro meccanismi d azione.
 FARMACODINAMICA E CIO CHE IL FARMACO FA ALL ORGANISMO Si occupa degli effetti dei farmaci e dei loro meccanismi d azione. La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci
FARMACODINAMICA E CIO CHE IL FARMACO FA ALL ORGANISMO Si occupa degli effetti dei farmaci e dei loro meccanismi d azione. La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci
Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica
 Brevetti Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Committente:
Brevetti Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Committente:
VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.V VERIFICA SE HAI CAPITO 10.B PRE-TEST ESERCIZI 10.
 VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.B PRE-TEST 10.C OBIETTIVI 10.3.2 CATALISI ETEROGENEA 10.3.3 CATALISI ENZIMATICA 10.V VERIFICA SE HAI CAPITO ESERCIZI 10.1 LA VELOCITA
VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.B PRE-TEST 10.C OBIETTIVI 10.3.2 CATALISI ETEROGENEA 10.3.3 CATALISI ENZIMATICA 10.V VERIFICA SE HAI CAPITO ESERCIZI 10.1 LA VELOCITA
ECONOMIA APPLICATA ALL INGEGNERIA (Docente: Prof. Ing. Donato Morea)
 ESERCIZIO n. 1 - Scelte di consumo (scelta ottimale, variazione di prezzo, variazione di reddito) Un consumatore ha preferenze rappresentate dalla seguente funzione di utilità: a) Determinare la scelta
ESERCIZIO n. 1 - Scelte di consumo (scelta ottimale, variazione di prezzo, variazione di reddito) Un consumatore ha preferenze rappresentate dalla seguente funzione di utilità: a) Determinare la scelta
Laboratorio 29.1 CINETICA DI IDROLISI ALCALINA DELL ACETATO DI ETILE
 2 Analisi chimica strumentale Laboratorio 29.1 CINETICA DI IDROLISI ALCALINA DELL ACETATO DI ETILE SCOPO Determinazione della costante di velocità, dell energia di attivazione e del fattore di frequenza
2 Analisi chimica strumentale Laboratorio 29.1 CINETICA DI IDROLISI ALCALINA DELL ACETATO DI ETILE SCOPO Determinazione della costante di velocità, dell energia di attivazione e del fattore di frequenza
PRINCIPI DI FARMACODINAMICA
 PRINCIPI DI FARMACODINAMICA FARMACODINAMICA La farmacodinamica è la branca della farmacologia che studia i meccanismi con cui i farmaci sono in grado di modificare le funzioni dell organismo. In particolare,
PRINCIPI DI FARMACODINAMICA FARMACODINAMICA La farmacodinamica è la branca della farmacologia che studia i meccanismi con cui i farmaci sono in grado di modificare le funzioni dell organismo. In particolare,
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A
 1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
Transizioni liquido-solido: Aspetti cinetici
 Transizioni liquido-solido: Aspetti cinetici Prof.G.Marletta Chimica Fisica dei Materiali II e Laboratorio Laurea Magistrale in Chimica dei Materiali Università di Catania A.A. 2011/2012 1- Caratteri generali
Transizioni liquido-solido: Aspetti cinetici Prof.G.Marletta Chimica Fisica dei Materiali II e Laboratorio Laurea Magistrale in Chimica dei Materiali Università di Catania A.A. 2011/2012 1- Caratteri generali
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine:
 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
Brady Senese Pignocchino Chimica.blu Zanichelli 2014 Soluzione degli esercizi Capitolo 19
 Brady Senese Pignocchino Chimica.blu Zanichelli 2014 Soluzione degli esercizi Capitolo 19 Esercizio Risposta PAG 435 ES 1 È la velocità con cui si formano i prodotti e scompaiono i reagenti. PAG 435 ES
Brady Senese Pignocchino Chimica.blu Zanichelli 2014 Soluzione degli esercizi Capitolo 19 Esercizio Risposta PAG 435 ES 1 È la velocità con cui si formano i prodotti e scompaiono i reagenti. PAG 435 ES
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
LA VELOCITA DELLE REAZIONI
 LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
5. Trasporto di membrana
 5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
Tra nm Nucleotidi mono-fosfato
 Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Limiti del criterio della variazione entropia
 Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
CINETICA CHIMICA. ChimicaGenerale_lezione21 1
 CINETICA CHIMICA La cinetica chimica è lo studio della velocità delle reazioni chimiche, cioè della variazione delle concentrazione dei reagenti (o dei prodotti) in funzione del tempo. ChimicaGenerale_lezione21
CINETICA CHIMICA La cinetica chimica è lo studio della velocità delle reazioni chimiche, cioè della variazione delle concentrazione dei reagenti (o dei prodotti) in funzione del tempo. ChimicaGenerale_lezione21
Esistono reazioni energeticamente favorite ( H<0) che non avvengono.es. C(diamante) C(grafite)
 CINETICA CHIMICA Esistono reazioni energeticamente favorite ( H
CINETICA CHIMICA Esistono reazioni energeticamente favorite ( H
di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
 Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Legge dell azione di massa. Misura sperimentale della costante di equilibrio. Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Determinazione dell attività enzimatica
 Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
CORSO DI CHIMICA. Esercitazione del 7 Giugno 2016
 CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
Cinetica chimica. 2 H 2 (g) + O 2 (g) 2 H 2 O (g)
 Cinetica chimica 2 H 2 (g) + O 2 (g) 2 H 2 O (g) Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione La cinetica chimica A differenza della termodinamica
Cinetica chimica 2 H 2 (g) + O 2 (g) 2 H 2 O (g) Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione La cinetica chimica A differenza della termodinamica
Elementi di matematica - dott. I. GRASSI
 Gli assi cartesiani e la retta. Il concetto di derivata. È ormai d uso comune nei libri, in televisione, nei quotidiani descrivere fenomeni di varia natura per mezzo di rappresentazioni grafiche. Tali
Gli assi cartesiani e la retta. Il concetto di derivata. È ormai d uso comune nei libri, in televisione, nei quotidiani descrivere fenomeni di varia natura per mezzo di rappresentazioni grafiche. Tali
ISIS A PONTI Gallarate
 4 A TCB 1 IL CROMATOGRAMMA: E il tracciato che descrive l andamento del segnale del rivelatore in funzione del tempo o del volume di eluente a partire dall istante in cui la miscela viene introdotta nella
4 A TCB 1 IL CROMATOGRAMMA: E il tracciato che descrive l andamento del segnale del rivelatore in funzione del tempo o del volume di eluente a partire dall istante in cui la miscela viene introdotta nella
1.Pressione di un Gas
 1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1. LA VELOCITA. Si chiama traiettoria la linea che unisce le posizioni successive occupate da un punto materiale in movimento.
 1. LA VELOCITA La traiettoria. Si chiama traiettoria la linea che unisce le posizioni successive occupate da un punto materiale in movimento Il moto rettilineo: si definisce moto rettilineo quello di un
1. LA VELOCITA La traiettoria. Si chiama traiettoria la linea che unisce le posizioni successive occupate da un punto materiale in movimento Il moto rettilineo: si definisce moto rettilineo quello di un
