Corso di Laurea Magistrale in Medicina e Chirurgia. Biofisica e Fisiologia I A.A ESERCITAZIONE. Prof. Clara Iannuzzi
|
|
|
- Chiara Pappalardo
- 6 anni fa
- Visualizzazioni
Transcript
1 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
2 Trasporti di membrana
3 Forze agenti sugli ioni Gradiente di Concentrazione Campo Elettrico Energia chimica è l energia contenuta in un gradiente di concentrazione Energia elettrica è l energia dovuta alle cariche in un campo elettrico
4 Cosa accade quando la membrana è permeabile solo ad uno ione? elettroneutralità nessuna differenza di potenziale elettroneutralità
5 Cosa accade quando la membrana è permeabile solo ad uno ione? un catione si muove dalla zona ad alta a quella a bassa concentrazione elettroneutralità nessuna differenza di potenziale elettroneutralità
6 Cosa accade quando la membrana è permeabile solo ad uno ione? Su entrambi i lati le cariche non sono più bilanciate - voltaggio eccesso di carica - eccesso di carica
7 Cosa accade quando la membrana è permeabile solo ad uno ione? l eccesso di cariche tende a respingere i cationi da questo lato - voltaggio eccesso di carica - eccesso di carica
8 Cosa accade quando la membrana è permeabile solo ad uno ione? viene raggiunto un equilibrio: la forza dovuta al gradiente di concentrazione uguaglia la forza dovuta al gradiente elettrico - voltaggio eccesso di carica - eccesso di carica
9 GENESI DI UN POTENZIALE D EQUILIBRIO Membrana permeabile solo al potassio Na Cl mm K K K Cl mm K K K - - Δ E Δ C Δ E Δ C Δ E Δ C All equilibrio: flusso dovuto al gradiente di concentrazione = flusso dovuto al potenziale elettrico
10 Il potenziale di equilibrio può essere calcolato dall Equazione di Nernst E RT zf [ C] ln [ C ] K K 1 2 R= 8.3 J/mol R= 8.3 J/mol o o K =1.98 cal/mol =1.98 cal/mol o o K (cost. dei gas) (cost. dei gas) T = o o K (20 (20 o o C) C) z = 1 (per Na 1 (per Na, K, H etc) etc) z = -1 (per Cl -1 (per Cl - - ) z = 2 (per Ca 2 (per Ca 2 2 etc) etc) F = 96,500 coulomb (costante di Faraday) 96,500 coulomb (costante di Faraday)
11 z
12 Membrana permeabile solo al Potassio
13 Quesito n.1 [Ca 2 ] e =0.004 mm; [Ca 2 ] i = mm Calcolare il potenziale di equilibrio del calcio E Ca E Ca = 58 mv log [Ca2 ] e z [Ca 2 ] i E Ca = 58 log Equazione di Nerst per il calcio = 32.5 mv
14 Quesito n.2 E k =-90mV quando [K ] e =12mM E k =? se [K ] e =24mM E K = 58 mv log [K ] e z [K ] i -90= 58 log 12 1 [K ] i Equazione di Nerst per il potassio 90 [K 58 ] i = 12x10 = 425 mm E K = 58 log = -72,5 mv
15 GENESI DI UN POTENZIALE DI DIFFUSIONE Si genera quando la membrana è permeabile in misura diversa alle varie specie ioniche Na Cl mm K Cl mm - - K K t 1 Na t 2 Na p K >p Na f K >f Na p K >p Na f K =f Na Il suo raggiungimento comporta: Equilibrio elettrico ma squilibrio elettrochimico Flusso netto non nullo delle varie specie ioniche Un potenziale di diffusione non si mantiene indefinitivamente
16 Confronto tra potenziale d equilibrio e di diffusione Potenziale di equilibrio: Le specie ioniche diffusibili sono all equilibrio elettrochimico (vale l equazione di Nernst) Il potenziale di membrana coincide con il potenziale di equilibrio di ciascuna specie ionica diffusibile (V m =E i ) Il potenziale di equilibrio si mantiene indefinitamente Potenziale di diffusione: Le specie ioniche diffusibili non sono all equilibrio elettrochimico (non vale l equazione di Nernst) Il potenziale di membrana non coincide con il potenziale di equilibrio di alcuna delle specie ioniche diffusibili (V m E i ) Il potenziale di diffusione non si mantiene indefinitamente
17
18 Sostituendo i valori delle costanti e trasformando in log 10 per una membrana permeabile solo al Na e K, l equazione di Goldman si può riscrivere:
19
20
21 Equazione di Goldman 1)Supponendo che le concentrazioni intra- ed extra-cellulari del Na e del K siano: [K ] 1 = 120 mm; [Na ] 1 = 10 mm; [K ] 2 = 5 mm; [Na ] 2 = 100 mm, rappresentate graficamente l'andamento del potenziale di membrana in funzione del rapporto p Na /p K. 2) Il rapporto P Na /P K in una cellula eccitabile varia tra 0.02 e 25. Le concentrazioni intra- ed extracellulari del sodio e del potassio sono: [Na ] 1 = 12 mm; [Na ] 2 = 120 mm; [K ] 1 = 125 mm e [K ] 2 = 5 mm. Calcolare entro quali limiti può variare il potenziale di membrana. 3) Un assone gigante di calamaro ha un potenziale di membrana E m = -58 mv in presenza delle seguenti concentrazioni di sodio e potassio: [Na ] 1 = 10 mm; [Na ] 2 = 100 mm; [K ] 1 = 150 mm e [K ] 2 = 7.5 mm Cosa accade se la concentrazione extracellulare del sodio passa da 100 a 130mM e quella del potassio da 7.5 a 15 mm?
22 1)Supponendo che le concentrazioni intra- ed extra-cellulari del Na e del K siano: [K ] 1 = 120 mm; [Na ] 1 = 10 mm; [K ] 2 = 5 mm; [Na ] 2 = 100 mm, rappresentate graficamente l'andamento del potenziale di membrana in funzione del rapporto p Na /p K Em Em E Na = 58 mv p Na /p K = E K = -81 mv -100 p Na /p K gna/gk
23 2) Il rapporto P Na /P K in una cellula eccitabile varia tra 0.02 e 25. Le concentrazioni intra- ed extracellulari del sodio e del potassio sono: [Na ] 1 = 12 mm; [Na ] 2 = 120 mm; [K ] 1 = 125 mm e [K ] 2 = 5 mm. Calcolare entro quali limiti può variare il potenziale di membrana. P Na Int Est (mm) E m = 58 mv log [K ] e [Na ] e P K [K ] [K ] i [Na ] i P Na P K [Na ] Se P Na /P K =0.02 E m = 58 log 50,02x ,02x12 = -71 mv Se P Na /P K =25 E m = 58 log 525x x12 = 49mV
24 3) Un assone gigante di calamaro ha un potenziale di membrana E m = -58 mv in presenza delle seguenti concentrazioni di sodio e potassio: [Na ] 1 = 10 mm; [Na ] 2 = 100 mm; [K ] 1 = 150 mm e [K ] 2 = 7.5 mm Cosa accade se la concentrazione extracellulare del sodio passa da 100 a 130mM e quella del potassio da 7.5 a 15 mm? E m = 58 mv log [K ] e [Na ] e P Na P K [K ] i [Na ] i P Na P K b [K ] [Na ] Int 150 7, Est (mm) 58= 58 log E m = 58 log 7,5100 b b 150,076x ,076x10 b= 0,076 = - 45 mv
25 Osmosi
26 questo recipiente è diviso in due da un filtro e contiene, nel comparto di sinistra, un alta concentrazione di una sostanza in grado di attraversare il filtro. questa è la diffusione semplice l equilibrio di concentrazione viene ristabilito dal rapido passaggio di tale sostanza attraverso la membrana.
27 Il filtro che divide questo recipiente, invece, non consente il passaggio di detta sostanza. questa è l osmosi l equilibrio di concentrazione viene ristabilito grazie al passaggio di acqua (solvente) dal compartimento di destra a quello di sinistra.
28 -Due compartimenti di uguale volume sono separati da una membrana che è permeabile solo all acqua (membrana semipermeabile) e che non permette il passaggio di soluto. Il compartimento A è riempito con una soluzione concentrata di soluto mentre il compartimento B contiene un volume uguale di soluzione più diluita. L acqua si muove per la legge di Fick verso il compartimento dove il soluto è più concentrato. P, contropressione, che bilancia il potenziale osmotico, π A B J H20 -Se viene inserito un pistone nel compartimento A, la pressione esercitata sul pistone genera una forza che si oppone al movimento osmotico dell acqua verso A. L entità della forza che deve essere applicata per bloccare l osmosi viene definita pressione osmotica. -Se non controbilanciato da una forza opposta, il flusso d acqua si ferma quando la concentrazione del soluto nei due compartimenti diventa uguale. Il compartimento A ha guadagnato volume mentre il compartimento B lo ha perso.
29 La pressione osmotica (π) dipende da: - concentrazione delle particelle osmoticamente attive - diffusibilità del soluto La pressione osmotica viene calcolata con l equazione di van t Hoff, che converte la concentrazione delle particelle in pressione considerando la diffusibilità del soluto: Π = σ R TΔC σ è il coefficiente osmotico o di riflessione (varia da 0 a 1), indica la facilità con cui un soluto attraversa la membrana σ=1, il soluto non è diffusibile, esercita il suo massimo effetto osmotico, la pressione osmotica effettiva sarà massima, così come il flusso d acqua. σ=0, il soluto è completamente diffusibile, la pressione osmotica è nulla
30 OSMOLARITA Osmolarità = Molarità X numero di particelle Il fattore importante nell osmosi è il numero di particelle in un dato volume di soluzione. Per es. una molecola di glucosio si scioglie in acqua dando una particella una molecola di NaCl si scioglie dando due particelle 1 Molare Glucosio= 1 Osmolare Glucosio 1 Molare NaCl= 2 Osmolare NaCl
31 Osmosi 1) Determinare la pressione osmotica (π ) a 35 C di una soluzione del volume di 1 L contenente 12,0 grammi di glucosio (PM = 180 g/mol). 2) In un adulto, il volume del liquido intra-cellulare (LIC) è 28L e la sua osmolarità è 300mOsm. Nel compartimento extra-cellulare sono iniettati 2L di soluto ND 350mOsm. All equilibrio, il volume del LIC diventa 27,8L. Calcolare il volume iniziale del compartimento extra-cellulare. 3) In un adulto, il volume del liquido intra-cellulare (LIC) è 22L e quello del liquido extra-cellulare (LEC) è 15L. la sua osmolarità è 260mOsm. Come si modificheranno i suddetti volumi se nel LEC vengono iniettati 1500mL di una soluzione di glicerolo 500mM? Quale sarà l osmolarità dei due compartimenti dopo il raggiungimento del nuovo stato di equilibrio?
32 1) Determinare la pressione osmotica (π ) a 35 C di una soluzione del volume di 1 L contenente 12,0 grammi di glucosio (Mm = 180 g/mol). Equazione di van t Hoff π = M x R x T Determiniamo il numero delle moli di glucosio: n glucosio = g glucosio / PM = 12,0 / 180 = 0,0667 mol quindi la molarità: M = n glucosio / V soluzione = 0,0667 / 1,00 = 0,0667 mol/l Convertiamo la temperatura in kelvin: T = = 308 K Calcoliamo il valore della pressione osmotica: π = M R T = 0,0667 0, = 1,686 atm
33 2) In un adulto, il volume del liquido intra-cellulare (LIC) è 28L e la sua osmolarità è 300mOsm. Nel compartimento extra-cellulare sono iniettati 2L di soluto ND 350mOsm. All equilibrio, il volume del LIC diventa 27,8L. Calcolare il volume iniziale del compartimento extra-cellulare. LIC 300mOsm 28L LEC 300mOsm 2L ND 350mOsm c i v i =c f v f V f =27,8L LIC c f =c i v i /v f = 300x28/27,8= 302 mosm all equilibrio LEC In equilibrio osmotico c f LIC=c f LEC= 302 mosm c f =(c i v i c ND v ND )/v f = (300v i 3502)/v i 20,2= 302 mosm v i = 17,8L
34 3) In un adulto, il volume del liquido intra-cellulare (LIC) è 22L e quello del liquido extra-cellulare (LEC) è 15L. la sua osmolarità è 260mOsm. Come si modificheranno i suddetti volumi se nel LEC vengono iniettati 1500mL di una soluzione di glicerolo 500mM? Quale sarà l osmolarità dei due compartimenti dopo il raggiungimento del nuovo stato di equilibrio? LIC 260mOsm ND 22L LEC 260mOsmND 15L 1,5L glicerolo 500mOsm Calcoliamo il numero di osmoli vxc= 37x260= 9620 mosmoli 1,5x500= 750 Osmoli aggiunte = mosmoli totali Osmolarità=Osmoli totali/v tot =10370/38,5= 269,3mOsM
35 LIC 260mOsm ND 22L LEC 260mOsmND 15L 1,5L glicerolo 500mOsm Osmolarità=Osmoli totali/v tot =10370/38,5= 269,3mOsM c i v i =c f v f LIC v f =c i v i /c f = 260x22/269,3= 21,24L all equilibrio -0,76L LEC V f -V perso dal LIC = 151,50,76= 17,26L all equilibrio
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
POTENZIALE DI MEMBRANA
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 POTENZIALE DI MEMBRANA Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 POTENZIALE DI MEMBRANA Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
La pompa sodio-potassio
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
Il binomio di van t Hoff Le proprietà colligative dipendono dal numero di particelle effettivamente presenti nella soluzione. Nel caso in cui il solut
 Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana
 Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
POTENZIALE DI MEMBRANA
 POTENZIALE DI MEMBRANA 1 POTENZIALE DI RIPOSO Tutte le cellule (non solo le cellule eccitabili) hanno un potenziale di riposo (resting): una carica elettrica attraverso la membrana plasmatica, con l interno
POTENZIALE DI MEMBRANA 1 POTENZIALE DI RIPOSO Tutte le cellule (non solo le cellule eccitabili) hanno un potenziale di riposo (resting): una carica elettrica attraverso la membrana plasmatica, con l interno
Capitolo 14 Le proprietà delle soluzioni
 Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
pressione esercitata dalle molecole di gas in equilibrio con Si consideri una soluzione di B in A. Per una soluzione ideale
 PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
1. Perché le sostanze si sciolgono?
 1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Che ruolo ha la membrana plasmatica nei potenziali di diffusione?
 Le cellule nervose e muscolari generano segnali elettrici principalmente mediante cambiamenti della permeabilità di membrana verso gli ioni sodio e potassio. Gli aumenti di permeabilità sono dovuti alla
Le cellule nervose e muscolari generano segnali elettrici principalmente mediante cambiamenti della permeabilità di membrana verso gli ioni sodio e potassio. Gli aumenti di permeabilità sono dovuti alla
Ioni fosfato e proteine (anioni) sono prevalenti nella cellula
 Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
I nostri compartimenti idrici sono in Equilibrio osmotico ma non chimico
 I nostri compartimenti idrici sono in Equilibrio osmotico ma non chimico Concentrazione dei principali ioni I compartimenti del nostro corpo non sono in equilibrio elettrico ELETTRICITA Atomi: entità elettricamente
I nostri compartimenti idrici sono in Equilibrio osmotico ma non chimico Concentrazione dei principali ioni I compartimenti del nostro corpo non sono in equilibrio elettrico ELETTRICITA Atomi: entità elettricamente
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Compito A-7 BIOFISICA E FISIOLOGIA I Anno Accademico
 Compito A-7 1) L ampiezza del potenziale d azione che circola lungo un assone mielinico è 115 mv. Sapendo che, a riposo, il rapporto p Na /p K è 0,015, calcolare di quanto varia p Na nel corso di un potenziale
Compito A-7 1) L ampiezza del potenziale d azione che circola lungo un assone mielinico è 115 mv. Sapendo che, a riposo, il rapporto p Na /p K è 0,015, calcolare di quanto varia p Na nel corso di un potenziale
Il potenziale di membrana a riposo
 Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
3. Fisiologia Cellulare Potenziale transmembranario, potenziale d azione
 3. Fisiologia Cellulare Potenziale transmembranario, potenziale d azione Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Genesi e mantenimento
3. Fisiologia Cellulare Potenziale transmembranario, potenziale d azione Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Genesi e mantenimento
STATO LIQUIDO. Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso
 STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA
 FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
Sistema Termodinamico
 Sistema Termodinamico Un insieme di elementi con un certo grado di correlazione. Esempio: un organismo; un organo; un organello; una macromolecola biologica; una reazione chimica. Ambiente Sistema Q, W
Sistema Termodinamico Un insieme di elementi con un certo grado di correlazione. Esempio: un organismo; un organo; un organello; una macromolecola biologica; una reazione chimica. Ambiente Sistema Q, W
-PROPRIETA COLLIGATIVE-
 -PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
-PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
Attivi (non equilibranti) Passivi (equilibranti) Migrazione attraverso canali membran. Diffusione semplice. Tasporto attivo secondario
 TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati
 Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
LE SOLUZIONI. Una soluzione è un sistema omogeneo costituito da almeno due componenti
 LE SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti Il componente maggioritario e solitamente chiamato solvente mentre i componenti in quantita minore sono chiamati soluti
LE SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti Il componente maggioritario e solitamente chiamato solvente mentre i componenti in quantita minore sono chiamati soluti
Si è ipotizzato che il potenziale di membrana fosse un potenziale di Equilibrio del K descritto dall eq. di Nerst : Em= -RT/ZF 2.
 Si è ipotizzato che il potenziale di membrana fosse un potenziale di Equilibrio del K descritto dall eq. di Nerst : Em= -RT/ZF 2.3log [K]i / [K]o Registrazione del potenziale di membrana Potenziale di
Si è ipotizzato che il potenziale di membrana fosse un potenziale di Equilibrio del K descritto dall eq. di Nerst : Em= -RT/ZF 2.3log [K]i / [K]o Registrazione del potenziale di membrana Potenziale di
I compartimenti liquidi corporei
 I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
Le soluzioni e il loro comportamento
 A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le
 Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: H 2 S (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 (aq) + N 3 (aq) + + (aq) (s) + N (g) + 2 (l). Calcolare i grammi di (s) ed il volume di N (g) a 25 C ed 1
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 (aq) + N 3 (aq) + + (aq) (s) + N (g) + 2 (l). Calcolare i grammi di (s) ed il volume di N (g) a 25 C ed 1
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
GLI STATI DELLA MATERIA
 GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
Trasporto di membrana
 Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
Lezione n. 12. Proprietà colligative Variazione del punto crioscopico. Pressione osmotica. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Le soluzioni possono esistere in ognuno dei tre stati della materia: gas, liquido o solido.
 SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
 positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
Le proprietà colligative delle soluzioni
 Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 9. L unità di misura dei chimici: la mole SEGUI LA MAPPA La concentrazione delle
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 9. L unità di misura dei chimici: la mole SEGUI LA MAPPA La concentrazione delle
Miscela di gas 1, 2 e 3. P 1 = n1 R T P 2 = n2 R T P 3 = n3 R T V V V. Pressioni parziali dei gas P 1 P 2 P 3
 Miscele di gas Pressione parziale di un gas in una miscela gassosa: pressione esercitata da un componente della miscela se occupasse da solo l intero volume a disposizione della miscela.(legge di DALTON)
Miscele di gas Pressione parziale di un gas in una miscela gassosa: pressione esercitata da un componente della miscela se occupasse da solo l intero volume a disposizione della miscela.(legge di DALTON)
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
BIOFISICA DELLE MEMBRANE
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 BIOFISICA DELLE MEMBRANE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 BIOFISICA DELLE MEMBRANE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
struttura e composizione della membrana cellulare Prof. Davide Cervia - Fisiologia Fisiologia della cellula: trasporti di membrana
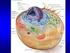 struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
Bioingegneria Elettronica I
 Bioingegneria Elettronica I Cenni alla fisiologia delle cellule e dei sistemi biologici A. Bonfiglio La cellula struttura generale La cellula Struttura generale della cellula Composizione dei liquidi intracellulare
Bioingegneria Elettronica I Cenni alla fisiologia delle cellule e dei sistemi biologici A. Bonfiglio La cellula struttura generale La cellula Struttura generale della cellula Composizione dei liquidi intracellulare
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
COMPITO A DI CHIMICA DEL 15-09-09
 COMPITO A DI CHIMICA DEL 15-09-09 1A) 3,447 g di anidride arsenica (As 2 O 5 ) solida e 6,278 g di zinco metallico vengono fatti reagire con un eccesso di acido solforico. Si calcoli il volume di arsina
COMPITO A DI CHIMICA DEL 15-09-09 1A) 3,447 g di anidride arsenica (As 2 O 5 ) solida e 6,278 g di zinco metallico vengono fatti reagire con un eccesso di acido solforico. Si calcoli il volume di arsina
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Modalità di trasporto di membrana (DIFFUSIONE FACILITATA)
 Modalità di trasporto di membrana (DIFFUSIONE FACILITATA) Classi di proteine di trasporto presenti nella membrana plasmatica (o CARRIER) Porta girevole Porta aperta I canali ionici Sezione trasversale
Modalità di trasporto di membrana (DIFFUSIONE FACILITATA) Classi di proteine di trasporto presenti nella membrana plasmatica (o CARRIER) Porta girevole Porta aperta I canali ionici Sezione trasversale
LEZIONE 4. Le soluzioni
 LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
Per una mole di AB 1 - α α α. Per n moli di AB n (1 α) n α n α. Il numero totale delle particelle, all'equilibrio, sono:
 Elettroliti AB A + + B - Grado di dissociazione α è la frazione di mole che all equilibrio ha subito dissociazione α : 1 = n mol dissociate : n mol iniziali AB A + + B - Per una mole di AB 1 - α α α Per
Elettroliti AB A + + B - Grado di dissociazione α è la frazione di mole che all equilibrio ha subito dissociazione α : 1 = n mol dissociate : n mol iniziali AB A + + B - Per una mole di AB 1 - α α α Per
Segnali Bioelettrici. Bioingegneria. Docente Prof. Francesco Amato. Versione 1.3 AA 2014/15.
 Segnali Bioelettrici Docente Prof. Francesco Amato Versione 1.3 AA 2014/15 amato@unicz.it 1 Interazione: Misurare, elaborare, analizzare, presentare un biosegnale Controllo e Feedback Sensore Alimentazione
Segnali Bioelettrici Docente Prof. Francesco Amato Versione 1.3 AA 2014/15 amato@unicz.it 1 Interazione: Misurare, elaborare, analizzare, presentare un biosegnale Controllo e Feedback Sensore Alimentazione
Fisiologia cellulare e Laboratorio di colture cellulari
 Corso di laurea in Biotecnologie UNIVERSITA DEGLI STUDI DI TERAMO Fisiologia cellulare e Laboratorio di colture cellulari Prof.ssa Luisa Gioia possibili sistemi di trasporto della cellula TRASPORTO TRANS-MEMBRANA
Corso di laurea in Biotecnologie UNIVERSITA DEGLI STUDI DI TERAMO Fisiologia cellulare e Laboratorio di colture cellulari Prof.ssa Luisa Gioia possibili sistemi di trasporto della cellula TRASPORTO TRANS-MEMBRANA
Lo stato liquido. i liquidi molecolari con legami a idrogeno: le interazioni tra le molecole si stabiliscono soprattutto attraverso legami a idrogeno
 Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA
 Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA Fisiologia cellulare: Membrana cellulare. Trasporto di ioni e molecole attraverso la membrana cellulare. Canali ionici, pompe e proteine vettrici.
Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA Fisiologia cellulare: Membrana cellulare. Trasporto di ioni e molecole attraverso la membrana cellulare. Canali ionici, pompe e proteine vettrici.
2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi
 2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Diffusione semplice e mediata da
2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Diffusione semplice e mediata da
-SOLUZIONE- In una soluzione liquida si possono distinguere un solvente (il componente liquido più abbondante) e uno o più soluti.
 -SOLUZIONE- Una soluzione è una miscela omogenea di due o più componenti. In generale una soluzione può essere in fase solida (leghe metalliche), liquida (gas + liquido, liquido + liquido, solido + liquido),
-SOLUZIONE- Una soluzione è una miscela omogenea di due o più componenti. In generale una soluzione può essere in fase solida (leghe metalliche), liquida (gas + liquido, liquido + liquido, solido + liquido),
Lezione 11 Soluzioni. Diffusione ed osmosi.
 Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Proprietà di permeabilità della membrana
 Proprietà di permeabilità della membrana Il Trasporto attraverso le membrane La fase lipidica delle membrane le rende impermeabili alla maggior parte degli ioni e delle sostanze polari. Questi composti
Proprietà di permeabilità della membrana Il Trasporto attraverso le membrane La fase lipidica delle membrane le rende impermeabili alla maggior parte degli ioni e delle sostanze polari. Questi composti
Elettricità cellulare
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Elettricità cellulare 30/3/2006 Sistemi biologici Essenzialmente costituiti da acqua (solvente) e da differenti soluti (molti dei
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Elettricità cellulare 30/3/2006 Sistemi biologici Essenzialmente costituiti da acqua (solvente) e da differenti soluti (molti dei
Le proprietà colligative
 Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Carica e massa di particelle atomiche
 Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
- Equilibri omogenei: tutte le sostanze che partecipano alla reazione fanno parte della stessa fase:
 ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
EQUILIBRI DI SOLUBILITA
 EQUILIBRI DI SOLUBILITA Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con
EQUILIBRI DI SOLUBILITA Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con
5. Trasporto di membrana
 5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
LA FORMAZIONE DELLE SOLUZIONI.
 LA FORMAZIONE DELLE SOLUZIONI. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore
LA FORMAZIONE DELLE SOLUZIONI. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore
Fisiologia Renale 6. Bilancio idro-elettrolitico I. Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona
 Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Programma di fisiologia infermieristica
 Programma di fisiologia infermieristica 2011-2012 Omeostasi:ambiente interno ed esterno- compartimenti liquidi-meccanismi omeostatici (feedback positivo e negativo) Biofisica della membrana: la membrana
Programma di fisiologia infermieristica 2011-2012 Omeostasi:ambiente interno ed esterno- compartimenti liquidi-meccanismi omeostatici (feedback positivo e negativo) Biofisica della membrana: la membrana
FUNZIONE, REGOLAZIONE, NATURA CHIMICA, TIPO DI RECETTORE
 Elena, Serena, Francesca, Valentina, Elisa, Lucrezia, Elisa Lezione 7 1. Asse Ipotalamo-ipofisi-surrene: CRH ACTH - Cortisolo 2. Asse Ipotalamo-ipofisi-ghiandole sessuali: GdRH e gonadotropine ipofisarie:
Elena, Serena, Francesca, Valentina, Elisa, Lucrezia, Elisa Lezione 7 1. Asse Ipotalamo-ipofisi-surrene: CRH ACTH - Cortisolo 2. Asse Ipotalamo-ipofisi-ghiandole sessuali: GdRH e gonadotropine ipofisarie:
Permeabilità Di Membrana Cellulare
 Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
Stimolazione artificiale del cuore
 Stimolazione artificiale del cuore Il ciclo del cuore: Impulso elettrico di stimolazione da parte di un gruppo di fibre nervose il nodo sinoatriale, Stimolatori artificiali Pacemaker impiantati chirurgicamente
Stimolazione artificiale del cuore Il ciclo del cuore: Impulso elettrico di stimolazione da parte di un gruppo di fibre nervose il nodo sinoatriale, Stimolatori artificiali Pacemaker impiantati chirurgicamente
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
Le membrane cellulari
 Le membrane cellulari La struttura delle membrane biologiche Le membrane cellulari sono formate da un doppio strato fosfolipidico dove si trovano varie proteine, che possono essere: periferiche: si trovano
Le membrane cellulari La struttura delle membrane biologiche Le membrane cellulari sono formate da un doppio strato fosfolipidico dove si trovano varie proteine, che possono essere: periferiche: si trovano
SOLUZIONI. Soluzioni gassose, liquide e solide
 LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
Fenomeni elettrici che interessano la cellula
 Fenomeni elettrici che interessano la cellula In quasi tutte le cellule dell organism o si generano potenziali elettrici a livello della m em brana cellulare Alcune cellule, come quelle nervose e muscolari
Fenomeni elettrici che interessano la cellula In quasi tutte le cellule dell organism o si generano potenziali elettrici a livello della m em brana cellulare Alcune cellule, come quelle nervose e muscolari
MEMBRANE MEMBRANE. elio giroletti. Elio GIROLETTI - Università degli Studi di Pavia, Dip. Fisica nucleare e teorica
 1 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy tel. 038/98.7905 - girolett@unipv.it - www.unipv.it/webgiro MEMBRANE diffusione e filtrazione
1 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy tel. 038/98.7905 - girolett@unipv.it - www.unipv.it/webgiro MEMBRANE diffusione e filtrazione
Sistemi Gassosi. GAS = specie che occupa tutto lo spazio disponibile. VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 )
 Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
L ACQUA E LE CELLULE VEGETALI
 L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
+ 4e - + 16H 3 O + 3S 2- + 36H 2 O 3SO 2-4 + 24e - + 24H 3 O +
 SOLUZIONI COMPITO A DI CHIMICA DEL 22-06-11 1A) 258 g di un minerale contenente il 91% di solfuro di arsenico (III), vengono immessi in 4,0 L di una soluzione acquosa di acido manganico al 10% in peso
SOLUZIONI COMPITO A DI CHIMICA DEL 22-06-11 1A) 258 g di un minerale contenente il 91% di solfuro di arsenico (III), vengono immessi in 4,0 L di una soluzione acquosa di acido manganico al 10% in peso
TARGETS DEI FARMACI ATTUALMENTE IN USO
 TARGETS DEI FARMACI ATTUALMENTE IN USO NEURONI Il corpo umano contiene circa 100 miliardi di neuroni. Sono cellule specializzate nel trasmettere e ricevere informazioni. Possono variare forma e dimensione
TARGETS DEI FARMACI ATTUALMENTE IN USO NEURONI Il corpo umano contiene circa 100 miliardi di neuroni. Sono cellule specializzate nel trasmettere e ricevere informazioni. Possono variare forma e dimensione
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: H 2 O 2(aq) + MnO 4
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 2(aq) + Mn 4 -(aq) 2(g) + Mn 2(s) + - (aq) + 2 (l). Calcolare il volume di 2 (g), misurato a 1.0 atm e 25
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 2(aq) + Mn 4 -(aq) 2(g) + Mn 2(s) + - (aq) + 2 (l). Calcolare il volume di 2 (g), misurato a 1.0 atm e 25
GAS. H 2 N 2 O 2 F 2 Cl 2 CO CO 2 NO 2 SO 2 CH 4
 GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
PROPRIETÀ TIPICHE DEI LIQUIDI
 STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
otenziali graduati (elettrotonici) potenziale d azione
 I segnali elettrici che si generano nei neuroni: potenziali graduati (elettrotonici) potenziale d azione sono modificazioni del potenziale di riposo determinate dall apertura o chiusura di canali ionici.
I segnali elettrici che si generano nei neuroni: potenziali graduati (elettrotonici) potenziale d azione sono modificazioni del potenziale di riposo determinate dall apertura o chiusura di canali ionici.
FENOMENI DI TRASPORTO DELLA MATERIA
 FENOMENI DI TRASPORTO DELLA MATERIA MOTI BROWNIANI Gli atomi e le molecole che costituiscono la materia non sono mai fermi, se non alla temperatura dello zero assoluto (T 0 K -273 C) In particolare, mentre
FENOMENI DI TRASPORTO DELLA MATERIA MOTI BROWNIANI Gli atomi e le molecole che costituiscono la materia non sono mai fermi, se non alla temperatura dello zero assoluto (T 0 K -273 C) In particolare, mentre
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
solvente soluto concentrazione
 Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
CORSO DI CHIMICA. Esercitazione del 7 Giugno 2016
 CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
Base. Acido. Acido. Base
 ACIDI E BASI Un acido è un donatore di protoni, una base è un accettore di protoni. La base coniugata di un acido è quella che si forma quando l acido si è privato del protone. L acido coniugato di una
ACIDI E BASI Un acido è un donatore di protoni, una base è un accettore di protoni. La base coniugata di un acido è quella che si forma quando l acido si è privato del protone. L acido coniugato di una
SOLUZIONI. solide (es. leghe)
 SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
Lo stato gassoso e le sue proprietà
 Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
