GEOMETRIA MOLECOLARE
|
|
|
- Federigo Bianchini
- 6 anni fa
- Visualizzazioni
Transcript
1 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche semplici. H H C H H H H C H H H-C-H = 90 C 2s 1 2p 1 x 2p 1 y 2p 1 z H 1s 1 3 legami equivalenti 2p C con 1s H; 1 legame 2s C con 1s H Sperimentalmente si evidenziano 4 legami C-H uguali con angoli di legame di HCHHH109.5 Orbitali ibridi 2 1
2 Orbitali atomici IBRIDI Orbitali atomici risultanti dalla combinazione lineare di orbitali atomici puri Solo orbitali atomici di energia confrontabile si possono combinare Si ottiene un numero di orbitali atomici ibridi pari al numero di orbitali atomici puri che sono stati combinati Il livello energetico degli orbitali ibridi è intermedio tra quelli degli orbitali atomici puri. 3 Ibridazione sp 3 del CARBONIO Dalla combinazione di 1 orbitale atomico 2s e 3 orbitali atomici 2p si ottengono 4 orbitali ibridi sp 3, fortemente direzionali, orientati verso i vertici di un tetraedro al cui centro si trova l atomo di C 4 2
3 Orbitali atomici ibridi sp 3 (tetraedrici) - Geometria di CH 4 5 Orbitali atomici ibridi sp 3 (tetraedrici) - Geometria di CH 4 6 3
4 Ibridazione sp 3 del CARBONIO E 2p 2s 2(sp 3 ) Stato fondamentale Stato di tetravalenza Stato di ibridazione sp 3 7 NH 3 H 2 O Le coppie solitarie occupano i vertici del tetraedro 8 4
5 Repulsione delle coppie solitarie La presenza di coppie di legame e/o di distribuzione non simmetrica di carica elettronica implica la formazione di geometrie non regolari. 9 Altri orbitali atomici ibridi comprendenti orbitali s e p Ibridi sp 2 Ibridi trigonali piani Angoli 120 Ibridi sp Ibridi digonali Angolo
6 sp sp 2 11 Geometria molecolare sp sp 2 sp 3 dsp 3 d 2 sp
7 sp 3 d sp 3 d 2 13 Energia degli orbitali ibridi E p p p sp 3 s sp 2 sp Stato fondamentale Stato di ibridazione sp 3 Stato di ibridazione sp 2 Stato di ibridazione sp s< sp < sp 2 < sp 3 < p 14 7
8 Geometria molecolare- Etene o etilene (C 2 H 4 ) sp 2 15 Geometria molecolare- Etino o acetilene (C 2 H 2 ) sp 16 8
9 Geometria molecolare - La teoria VSEPR La teoria VSEPR (Valence Shell Electron Pair Repulsion o teoria della repulsione delle coppie elettroniche del guscio di valenza) Le coppie elettroniche del guscio di valenza presenti sull ATOMO CENTRALE della molecola o dello ione, che possono essere localizzate fra due atomi (coppie di legame) o su un solo atomo (coppia solitaria), tendono a disporsi il più lontano possibile le une dalle altre AB x E y Per ogni legame multiplo si considera una sola coppia elettronica 17 Geometria molecolare - La teoria VSEPR Gruppo I: solo composti ionici Gruppo II: Be 2s 2 2s 1 2p 1 2(sp) 2 BeX 2 AB
10 Geometria molecolare - La teoria VSEPR Gruppo III: MX 3 M = B, Al, Ga, In ns 2 np 1 ns 1 np 2 n(sp 2 ) 3 AB 3 19 Geometria molecolare - La teoria VSEPR Gruppo IV: C 2s 2 2p 2 2s 1 2p 3 2(sp 3 ) 4 CH 4, C 2 H
11 Geometria molecolare - La teoria VSEPR Gruppo IV: C 2s 2 2p 2 2s 1 2p 3 2(sp 2 ) 3 2p 1 C 2 H 4 21 Geometria molecolare - La teoria VSEPR Gruppo IV: C 2s 2 2p 2 2s 1 2p 3 2(sp) 2 2p 2 C 2 H 2, CO
12 Geometria molecolare - La teoria VSEPR AB 3 E Gruppo V: N 2s 2 2p 3 2(sp 3 ) 5 NH 3 Piramide a base triangolare Gruppo V: N NH 3 + H + NH Geometria molecolare - La teoria VSEPR AB 2 E 2 Angolare Gruppo VI: O 2s 2 2p 4 2(sp 3 ) 6 H 2 O AB 3 E 24 12
13 Geometria molecolare - La teoria VSEPR Gruppo VI: S 3s 2 3p 4 3s 1 3p 3 3d 2 SO 3 3s 2 3p 4 3s 2 3p 3 3d 1 SO 2 AB 3 AB 2 E 25 Geometria molecolare - La teoria VSEPR Gruppo VI: S 3s 2 3p 4 3(sp 3 ) 6 H 2 S AB 2 E 2 Angolare 26 13
14 Delocalizzazione degli elettroni (teoria VB) - La risonanza Ione CO 3 2- Geometria trigonale piana Ibridazione sp 2 27 Delocalizzazione degli elettroni (teoria VB) - La risonanza Doppio legame C=O delocalizzato " = a" I + b" II + c" III a = b = c 28 14
15 Delocalizzazione degli elettroni (teoria VB) - La risonanza Benzene C 6 H 6 Geometria trigonale piana Ibridazione sp 2 29 Delocalizzazione degli elettroni (teoria VB) - La risonanza! = a(! I +! II ) + b(! III +! IV +! V ) a > b 30 15
16 Delocalizzazione degli elettroni (teoria VB) - La risonanza E III IV V VI I II VI ΔE! VI = a(! I +! II ) + b(! III +! IV +! V ) 31 Riassumendo La TEORIA DEL LEGAME DI VALENZA (VB) interpreta il legame chimico nelle molecole e nei composti covalenti a struttura infinita; i punti fondamentali sono: si considerano solo gli elettroni più esterni (quelli di valenza) ogni legame si forma dalla messa in comune di una coppia di elettroni da parte dei due atomi (gli elettroni possono anche provenire entrambi dallo stesso atomo, nel caso del legame covalente dativo) le coppie di elettroni di legame sono localizzate tra i due atomi interessati dal legame esistono legami di tipo σ e legami di tipo π la geometria delle molecole si può prevedere con il modello VSEPR o mediante l introduzione degli orbitali atomici ibridi La teoria VB si trova però in difficoltà: nel descrivere molecole in cui le coppie di elettroni non si comportano come se fossero localizzate fra i vari atomi (artificio della risonanza) nello spiegare le proprietà magnetiche di molte molecole semplici nel descrivere gli stati eccitati delle molecole, quindi nell interpretare le proprietà spettroscopiche 32 16
IBRIDAZIONE. MODELLO DELL ORBITALE di LEGAME
 IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
Teorie del legame chimico. Teorie del legame chimico
 Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
GEOMETRIA MOLECOLARE. La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in
 GEOMETRIA MOLECOLARE La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in quanto dipende dagli ANGOLI DI LEGAME cioè gli angoli tra le linee che congiungono i nuclei degli
GEOMETRIA MOLECOLARE La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in quanto dipende dagli ANGOLI DI LEGAME cioè gli angoli tra le linee che congiungono i nuclei degli
un legame covalente due legami covalenti? tre legami covalenti due legami covalenti un legame covalente
 e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
Lezione n. 22. Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Legame e struttura molecolare
 2016 2017 CCS Biologia CCS-Scienze Geologiche 1 Legame e struttura molecolare Orbitali atomici Molecole Cap 9. 1-3, 15-16, 18, 21-23, 40 CONSIDERAZIONI PRELIMINARI 2 Le strutture di Lewis e la teoria VSEPR
2016 2017 CCS Biologia CCS-Scienze Geologiche 1 Legame e struttura molecolare Orbitali atomici Molecole Cap 9. 1-3, 15-16, 18, 21-23, 40 CONSIDERAZIONI PRELIMINARI 2 Le strutture di Lewis e la teoria VSEPR
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
La forma delle molecole
 La forma delle molecole Geometria molecolare: disposizione relativa nello spazio degli atomi costituenti una molecola o un composto covalente a struttura infinita La geometria delle molecole si esprime
La forma delle molecole Geometria molecolare: disposizione relativa nello spazio degli atomi costituenti una molecola o un composto covalente a struttura infinita La geometria delle molecole si esprime
Legame covalente. H 1s un protone e un elettrone
 Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
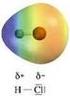
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
Formule di Lewis e regola dell ottetto
 Formule di Lewis e regola dell ottetto 1916-1919 Lewis si accorse che: Qualcosa di unico nelle configurazioni elettroniche dei gas nobili è responsabile della loro inerzia; gli atomi degli altri elementi
Formule di Lewis e regola dell ottetto 1916-1919 Lewis si accorse che: Qualcosa di unico nelle configurazioni elettroniche dei gas nobili è responsabile della loro inerzia; gli atomi degli altri elementi
IBRIDAZIONE e GEOMETRIA MOLECOLARE
 IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di energia.
 LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
LEGAMI CHIMICI e GEOMETRIA MOLECOLARE
 DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
Il legame covalente , P 4 , O 3 , N 2
 Il legame covalente Nel legame covalente gli elettroni responsabili del legame sono condivisi tra i due atomi legati: essi percorrono nel tempo lo spazio intorno a entrambi gli atomi, nonché la regione
Il legame covalente Nel legame covalente gli elettroni responsabili del legame sono condivisi tra i due atomi legati: essi percorrono nel tempo lo spazio intorno a entrambi gli atomi, nonché la regione
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
GEOMETRIE MOLECOLARI: TEORIE VSEPR
 GEOMETRIE MOLECOLARI: TEORIE VSEPR (Valence shell Electron Pair Repulsion: repulsione delle coppie di elettroni di valenza) e VB (Valence Bond: legame di valenza) Rappresentazione delle molecole con le
GEOMETRIE MOLECOLARI: TEORIE VSEPR (Valence shell Electron Pair Repulsion: repulsione delle coppie di elettroni di valenza) e VB (Valence Bond: legame di valenza) Rappresentazione delle molecole con le
Metodi basati sulla meccanica quantistica
 Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali
Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CHIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO. energia superiore. energia inferiore. orbitale s
 CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
Introduzione alla chimica organica. 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole
 Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi
 LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
Legame chimico unità 1, modulo D del libro
 Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
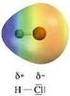
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Teoria degli orbitali ibridi
 Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
CAPITOLO 4 STRUTTURE MOLECOLARI
 APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
Esercizi sulle Geometrie Molecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Geometrie Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Geometrie Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
CHIMICA ORGANICA PER BIOTECNOLOGIE con esercitazioni di LABORATORIO D. Savoia
 CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
CORSO DI LAUREA IN BIOTECNOLOGIE CHIMICA ORGANICA. - Brown, Poon, INTRODUZIONE ALLA CHIMICA ORGANICA, EdiSES
 CORSO DI LAUREA IN BIOTECNOLOGIE CHIMICA ORGANICA TESTI: - John McMurry, CHIMICA ORGANICA, PICCIN - Brown, Poon, INTRODUZIONE ALLA CHIMICA ORGANICA, EdiSES - Janice Gorzynski Smith, FONDAMENTI DI CHIMICA
CORSO DI LAUREA IN BIOTECNOLOGIE CHIMICA ORGANICA TESTI: - John McMurry, CHIMICA ORGANICA, PICCIN - Brown, Poon, INTRODUZIONE ALLA CHIMICA ORGANICA, EdiSES - Janice Gorzynski Smith, FONDAMENTI DI CHIMICA
Struttura molecolare
 Struttura molecolare Nella discussione sulle teorie del legame covalente dobbiamo ternere in considerazione che le teorie che abbiamo discusso rappresentano un tentativo di spiegare e organizzare quello
Struttura molecolare Nella discussione sulle teorie del legame covalente dobbiamo ternere in considerazione che le teorie che abbiamo discusso rappresentano un tentativo di spiegare e organizzare quello
Formule di Lewis e geometria molecolare
 Formule di Lewis e geometria molecolare Formalismo simbolico di Lewis Rappresentazione degli elettroni di valenza; permette di seguire gli elettroni di valenza durante la formazione di un legame Consiste
Formule di Lewis e geometria molecolare Formalismo simbolico di Lewis Rappresentazione degli elettroni di valenza; permette di seguire gli elettroni di valenza durante la formazione di un legame Consiste
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
TEORIA DEL LEGAME DI VALENZA
 TERIA DEL LEGAME DI VALENZA ( Strutture di LEWIS ) Tutti gli atomi tendono ad acquisire la struttura elettronica dei gas nobili Il tipo di legame è correlato alla elettronegatività degli atomi che si legano
TERIA DEL LEGAME DI VALENZA ( Strutture di LEWIS ) Tutti gli atomi tendono ad acquisire la struttura elettronica dei gas nobili Il tipo di legame è correlato alla elettronegatività degli atomi che si legano
Il legame chimico. Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici
 Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
06/03/2012. Elementi in chimica organica
 CORSO DI LAUREA IN BIOINFORMATICA CHIMICA ORGANICA E DELLE MACROMOLECOLE BIOLOGICHE MICHAEL ASSFALG Lezione: 6 CFU = 48 ORE Lun 14:30-16:30, 16:30, Mer 8:30-10:30 PROVA FINALE: SCRITTO (+ ORALE) TESTI:
CORSO DI LAUREA IN BIOINFORMATICA CHIMICA ORGANICA E DELLE MACROMOLECOLE BIOLOGICHE MICHAEL ASSFALG Lezione: 6 CFU = 48 ORE Lun 14:30-16:30, 16:30, Mer 8:30-10:30 PROVA FINALE: SCRITTO (+ ORALE) TESTI:
Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
 LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 13-14 2010 Configurazioni elettroniche Descrizioni diverse Sistema periodico Configurazioni elettroniche Il modello
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 13-14 2010 Configurazioni elettroniche Descrizioni diverse Sistema periodico Configurazioni elettroniche Il modello
Tutti gli atomi (tranne i gas nobili) interagiscono tra di loro per formare molecole
 Il legame chimico 1 Tutti gli atomi (tranne i gas nobili) interagiscono tra di loro per formare molecole Teorie del legame chimico 2 1. Teoria di Lewis (o dell ottetto) + metodo VSEPR per determinazione
Il legame chimico 1 Tutti gli atomi (tranne i gas nobili) interagiscono tra di loro per formare molecole Teorie del legame chimico 2 1. Teoria di Lewis (o dell ottetto) + metodo VSEPR per determinazione
Elementi di Chimica Organica
 CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio (mariapina.donofrio@univr.it) Orario ricevimento: mar e giov 11:30-13:30 Corso: 6 CFU = 48 ORE Lezioni: Mar 8:30-10:30,
CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio (mariapina.donofrio@univr.it) Orario ricevimento: mar e giov 11:30-13:30 Corso: 6 CFU = 48 ORE Lezioni: Mar 8:30-10:30,
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
ORBITA ORBIT LI ALI MOLECOLARI
 ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
STRUTTURA E FORMA DELLE MOLECOLE
 Ricapitolando Z numero atomico = n. di protoni A numero di massa = n. di protoni n. di neutroni 1 UMA = 1/12 x1.99 10 23 g = 1.66 10 24g = 1/12 massa 12C PA peso atomico massa media degli atomi contenuti
Ricapitolando Z numero atomico = n. di protoni A numero di massa = n. di protoni n. di neutroni 1 UMA = 1/12 x1.99 10 23 g = 1.66 10 24g = 1/12 massa 12C PA peso atomico massa media degli atomi contenuti
Lezione 3 - Legame chimico
 Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I legami chimici. (parte seconda) Lezioni d'autore
 I legami chimici (parte seconda) Lezioni d'autore Introduzione (I) La teoria del legame di Lewis considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente dal fatto che
I legami chimici (parte seconda) Lezioni d'autore Introduzione (I) La teoria del legame di Lewis considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente dal fatto che
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
Energia potenziale. d l. E p
 IL LEGAME COVALENTE Legame covalente Si riscontra in composti molecolari i cui atomi costituenti sono uguali o per i quali non si può avere trasferimento elettronico. H 2 N 2 Cl 2 HCl CO in un legame covalente
IL LEGAME COVALENTE Legame covalente Si riscontra in composti molecolari i cui atomi costituenti sono uguali o per i quali non si può avere trasferimento elettronico. H 2 N 2 Cl 2 HCl CO in un legame covalente
FORMULE DI STRUTTURA E GEOMETRIE MOLECOLARI
 FORMULE DI TRUTTUR E GEOMETRIE MOLEOLRI FORMULE DI TRUTTUR GEOMETRIE MOLEOLRI IMI OVLENTE DI ELEMENTI DEL II E III PERIODO LEGME DTIVO IDI E BI DI LEWI TRUTTURE DI OMPOTI ORGNII FORMULE DI TRUTTUR La tavola
FORMULE DI TRUTTUR E GEOMETRIE MOLEOLRI FORMULE DI TRUTTUR GEOMETRIE MOLEOLRI IMI OVLENTE DI ELEMENTI DEL II E III PERIODO LEGME DTIVO IDI E BI DI LEWI TRUTTURE DI OMPOTI ORGNII FORMULE DI TRUTTUR La tavola
Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi
 Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi Gli elementi sono ordinati secondo numero atomico Z ( numero dei protoni ) crescente Il numero
Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi Gli elementi sono ordinati secondo numero atomico Z ( numero dei protoni ) crescente Il numero
Cap. 3 L ARCHITETTURA DELLE MOLECOLE: MODELLO DEGLI ORBITALI IBRIDI
 Cap. 3 L ARCHITETTURA DELLE MOLECOLE: MODELLO DEGLI ORBITALI IBRIDI In questo Capitolo sono sviluppati i concetti fondamentali delle architetture molecolari, utilizzando la teoria quantomeccanica del legame
Cap. 3 L ARCHITETTURA DELLE MOLECOLE: MODELLO DEGLI ORBITALI IBRIDI In questo Capitolo sono sviluppati i concetti fondamentali delle architetture molecolari, utilizzando la teoria quantomeccanica del legame
Chimica (A.A. 2010/2011)
 Chimica (A.A. 2010/2011) Il legame chimico. Tipi di legame e proprietà generali. Il legame ionico (cenni). Il legame covalente. Teoria del legame di valenza (Ibridazione. Formule di struttura e rappresentazioni
Chimica (A.A. 2010/2011) Il legame chimico. Tipi di legame e proprietà generali. Il legame ionico (cenni). Il legame covalente. Teoria del legame di valenza (Ibridazione. Formule di struttura e rappresentazioni
Descrivere come dedurre la polarità delle molecole dalla geometria molecolare STRUTTURA ELETTRONICA DEGLI ATOMI
 Descrivere come dedurre la polarità delle molecole dalla geometria molecolare STRUTTURA ELETTRONICA DEGLI ATOMI Ogni atomo contiene un piccolo denso nucleo,formato da neutroni e protoni carichi positivamente.
Descrivere come dedurre la polarità delle molecole dalla geometria molecolare STRUTTURA ELETTRONICA DEGLI ATOMI Ogni atomo contiene un piccolo denso nucleo,formato da neutroni e protoni carichi positivamente.
H 2 O 2 (aq) 2e - + O 2 (g) H + (aq) MnO 2 (s) +2e H + (aq Mn 2+ (aq) +2 H 2 O (l).
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
LEGAME CHIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici.
 LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
VSEPR Polarità Ibridizzazione
 VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
La chimica organica. Corso di Chimica Organica. I composti organici contengono carbonio Struttura elettronica e legame chimico
 2 nm Corso di Chimica Organica Synthesis of Anthropomorphic Molecules: The NanoPutians Di Stephanie H. Chanteau and James M. Tour J. Org. Chem., 68 (23), 8750-8766, 2003. Argomenti e materiale del corso:
2 nm Corso di Chimica Organica Synthesis of Anthropomorphic Molecules: The NanoPutians Di Stephanie H. Chanteau and James M. Tour J. Org. Chem., 68 (23), 8750-8766, 2003. Argomenti e materiale del corso:
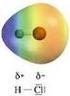
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
LA STRUTTURA DELLE MOLECOLE. Le Molecole Poliatomiche
 LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
Il legame Chimico II. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Il legame Chimico II Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Rappresentazione di Lewis per gli Elementi del Gruppo Principale ed i Gas Nobili 2 Un legame
Il legame Chimico II Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Rappresentazione di Lewis per gli Elementi del Gruppo Principale ed i Gas Nobili 2 Un legame
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno
 Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
.. O. I LEGAMI CHIMICI
 I LEGAMI CHIMICI Gli atomi isolati, tranne i gas nobili, avendo livelli energetici esterni incompleti, sono instabili e di conseguenza hanno un elevata energia Per aumentare la stabilità modificano la
I LEGAMI CHIMICI Gli atomi isolati, tranne i gas nobili, avendo livelli energetici esterni incompleti, sono instabili e di conseguenza hanno un elevata energia Per aumentare la stabilità modificano la
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
Chimica Fisica Biologica
 Molecola di Idrogeno [1] Rappresentazione semplificata di Lewis (doppietto di legame) H H H H Chimica Fisica Biologica Rappresentazione realistica: due elettroni attorno ai due protoni (nuclei) a distanza
Molecola di Idrogeno [1] Rappresentazione semplificata di Lewis (doppietto di legame) H H H H Chimica Fisica Biologica Rappresentazione realistica: due elettroni attorno ai due protoni (nuclei) a distanza
Formule e Strutture. Chimica Generale ed Inorganica. Chimica Inorganica 1. prof. Dario Duca
 Formule e Strutture Chimica Generale ed Inorganica Chimica Inorganica 1 prof. Dario Duca richiami su strutture molecolari, risonanza, cariche formali elettronegatività l elettronegatività origina da un
Formule e Strutture Chimica Generale ed Inorganica Chimica Inorganica 1 prof. Dario Duca richiami su strutture molecolari, risonanza, cariche formali elettronegatività l elettronegatività origina da un
LEGAME COVALENTE. ( Elettronegatività tra gli atomi < 2)
 LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
LEGAMI INTRAMOLECOLARI
 LEGAMI INTRAMOLECOLARI Introduzione La maggior parte degli elementi in natura non esistono allo stato atomico. Per legarsi tra loro a formare delle molecole, gli atomi modificano la distribuzione degli
LEGAMI INTRAMOLECOLARI Introduzione La maggior parte degli elementi in natura non esistono allo stato atomico. Per legarsi tra loro a formare delle molecole, gli atomi modificano la distribuzione degli
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA
 INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
Le molecole ed il legame chimico
 La meccanica quantistica è in grado di determinare esattamente i livelli energetici dell atomo di idrogeno e con tecniche matematiche più complesse è anche in grado di descrivere l atomo di elio trovando
La meccanica quantistica è in grado di determinare esattamente i livelli energetici dell atomo di idrogeno e con tecniche matematiche più complesse è anche in grado di descrivere l atomo di elio trovando
a.a CHIMICA ORGANICA 1 Prof. Giuliana Pitacco lab 337; tel Orario: L M M Aula A1
 a.a. 2006-2007 CIMICA ORGANICA 1 Prof. Giuliana Pitacco gpitacco@units.it lab 337; tel. 040 558 3923 Orario: L M M 11-13 11-13 11-13 Aula A1 ricevimento: appuntamento in qualsiasi momento 1 FEBBRAIO MARZO
a.a. 2006-2007 CIMICA ORGANICA 1 Prof. Giuliana Pitacco gpitacco@units.it lab 337; tel. 040 558 3923 Orario: L M M 11-13 11-13 11-13 Aula A1 ricevimento: appuntamento in qualsiasi momento 1 FEBBRAIO MARZO
I legami chimici e le molecole inorganiche
 Le molecole biatomiche con legami covalenti omopolari La molecola biatomica dell idrogeno, H 2 L atomo di idrogeno (H) ha numero atomico Z = 1. La sua configurazione elettronica è 1s 2. Appartenendo al
Le molecole biatomiche con legami covalenti omopolari La molecola biatomica dell idrogeno, H 2 L atomo di idrogeno (H) ha numero atomico Z = 1. La sua configurazione elettronica è 1s 2. Appartenendo al
Tutti gli atomi (tranne i gas nobili) interagiscono tra di loro per formare molecole
 Il legame chimico 1 Tutti gli atomi (tranne i gas nobili) interagiscono tra di loro per formare molecole Teorie del legame chimico 2 1. Teoria di Lewis (o dell ottetto) + metodo VSEPR per determinazione
Il legame chimico 1 Tutti gli atomi (tranne i gas nobili) interagiscono tra di loro per formare molecole Teorie del legame chimico 2 1. Teoria di Lewis (o dell ottetto) + metodo VSEPR per determinazione
Immagini e testi tratti dai website di: genome.wellcome.ac.uk, dnaftb.org, unipv.it, unimi.it, wikipedia.it, unibs.it, unisi.it, unina.
 Immagini e testi tratti dai website di: genome.wellcome.ac.uk, dnaftb.org, unipv.it, unimi.it, wikipedia.it, unibs.it, unisi.it, unina.it, uniroma.it, nih.gov, zanichelli.it, sciencemag.org, ncbi.gov Gruppo
Immagini e testi tratti dai website di: genome.wellcome.ac.uk, dnaftb.org, unipv.it, unimi.it, wikipedia.it, unibs.it, unisi.it, unina.it, uniroma.it, nih.gov, zanichelli.it, sciencemag.org, ncbi.gov Gruppo
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
Trasformazioni chimiche:
 Il legame chimico 1 Trasformazioni chimiche Trasformazioni chimiche: Le sostanze si trasformano in altre sostanze aventi proprietà differenti (livello macroscopico). Le trasformazioni chimiche avvengono
Il legame chimico 1 Trasformazioni chimiche Trasformazioni chimiche: Le sostanze si trasformano in altre sostanze aventi proprietà differenti (livello macroscopico). Le trasformazioni chimiche avvengono
Anche tra le molecole si instaurano forze di attrazione, meno intense dei legami chimici, che vengono chiamate legami secondari o legami deboli.
 I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
Molecole: Forma e Polarità Orbitali Molecolari
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Molecole: Forma e Polarità Orbitali Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Molecole: Forma e Polarità Orbitali Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
Metodi spettroscopici per le Biotecnologie
 AA 013014 Metodi spettroscopici per le Biotecnologie Il legame chimico Dott. Alfonso Zoleo Strutture di Lewis Lewis (1916): un legame chimico implica la compartecipazione di elettroni H HH H struttura
AA 013014 Metodi spettroscopici per le Biotecnologie Il legame chimico Dott. Alfonso Zoleo Strutture di Lewis Lewis (1916): un legame chimico implica la compartecipazione di elettroni H HH H struttura
Aromaticità Un composto si definisce aromatico se possiede un anello di elettroni chiuso.
 Aromaticità Un composto si definisce aromatico se possiede un anello di elettroni chiuso. E anche detto aromatico, quando tramite i seguenti criteri soddisfa la regola di ückel: 1. I composti aromatici
Aromaticità Un composto si definisce aromatico se possiede un anello di elettroni chiuso. E anche detto aromatico, quando tramite i seguenti criteri soddisfa la regola di ückel: 1. I composti aromatici
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
Teoria degli orbitali. Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale.
 Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Teoria VB. ChimicaGenerale_lezione9
 Teoria VB La teoria del legame di valenza è una descrizione del legame chimico basata sulla meccanica quantistica che supera il modello VSEPR, consentendo di calcolare il valore numerico della lunghezza
Teoria VB La teoria del legame di valenza è una descrizione del legame chimico basata sulla meccanica quantistica che supera il modello VSEPR, consentendo di calcolare il valore numerico della lunghezza
La teoria del legame di valenza
 La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
