GP2013. Sinossi del protocollo dello studio CIGG013A2301J
|
|
|
- Samuele Damiano Colonna
- 8 anni fa
- Visualizzazioni
Transcript
1 GP2013 dello studio CIGG013A2301J Studio randomizzato, controllato, in doppio cieco, di Fase III, per confrontare l efficacia, la sicurezza d impiego e la farmacocinetica di GP2013 in associazione a ciclofosfamide, vincristina, prednisone in confronto a MabThera in associazione a ciclofosfamide, vincristina, prednisone, seguiti da terapia di mantenimento con GP2013 o MabThera in pazienti con linfoma follicolare in stadio avanzato precedentemente non trattato Tipo di documento: Basato su: Protocollo emendato, Versione 1.1 datata Rilasciato il: data di rilascio
2 Novartis Pag. 2 di 13 Numero del protocollo Titolo CIGG013A2301J Studio randomizzato, controllato, in doppio cieco, di Fase III, per confrontare l efficacia, la sicurezza d impiego e la farmacocinetica di GP2013 in associazione a ciclofosfamide, vincristina, prednisone in confronto a MabThera in associazione a ciclofosfamide, vincristina, prednisone, seguiti da terapia di mantenimento con GP2013 o MabThera in pazienti con linfoma follicolare in stadio avanzato precedentemente non trattato Sponsor e fase di sviluppo clinico Scopo e razionale Novartis Fase III Nonostante il positivo rapporto di costo-efficacia nella maggior parte degli studi farmacoeconomici condotti fino ad oggi, MabThera rimane un farmaco costoso e l accesso ai pazienti viene spesso limitato dal costo (vedi valutazione NICE). L introduzione di prodotti medicinali biosimilari è considerata auspicabile per diversi motivi. I prodotti biologici similari aumenteranno l accessibilità al paziente espandendo il settore dei trattamenti biotecnologici concorrenti. Inoltre, prodotti medicinali biosimilari possono aumentare la disponibilità di forniture sufficienti di prodotti biotecnologici, ovviare alla carenza di scorte se dovessero verificarsi e diminuire la dipendenza da un singolo produttore. Infine, i prodotti medicinali biosimilari hanno la potenzialità di consentire l accesso ai pazienti e ai medici mediante, ad esempio, la conduzione di ricerche cliniche con prodotti conosciuti. Il linfoma follicolare (FL) CD-20 positivo è il più comune dei linfomi indolenti e lo scopo del trattamento è il controllo della malattia. Pertanto, è possibile che i pazienti e gli sperimentatori acconsentano a partecipare a uno studio clinico con un anticorpo biosimilare nel linfoma follicolare. Il programma di sviluppo di GP2013 ha lo scopo di ottenere l autorizzazione alla commercializzazione di GP2013 come Prodotto Medicinale biologico Similare a MabThera nell Unione Europea, in conformità alle linee-guida e al quadro giuridico dell European Medicines Agency (EMA). Il farmaco GP2013 è stato sviluppato utilizzando i principi dell approccio quality by design (QbD). La dimostrazione che GP2013 e MabThera sono altamente confrontabili in termini di proprietà fisico chimiche e farmaceutiche, legame in vitro, attività biologica e farmacocinetica e capacità farmacodinamica negli animali, costituisce la base per il confronto clinico tra GP2013 e MabThera.
3 Novartis Pag. 3 di 13 GP2013 è stato sviluppato come prodotto medicinale proteico biosimilare a MabThera (rituximab; in alcuni Paesi, commercializzato anche con il nome di Rituxan ). Come per MabThera, il principio attivo di GP2013 è rituximab, un anticorpo monoclonale chimerico murino/umano (mab) IgG1 kappa, con regioni variabili per le catene pesanti e leggere murine (dominio Fab) e regioni costanti delle catene kappa e gamma-1 umane (dominio Fc). Rituximab si lega a CD20, una proteina transmembrana non glicosilata, idrofobica che è presente sulla superficie cellulare dei pre-linfociti B e dei linfociti B maturi, ma non sulle cellule staminali emopoietiche, nelle plasmacellule differenziate terminali e in altri tessuti. Di conseguenza, si prevede che l efficacia e la sicurezza d impiego di GP2013 in pazienti con linfoma follicolare sia altamente comparabile a quella di MabThera, che possiede un rapporto rischio-beneficio favorevole, stabilito in un ampio numero di studi clinici e da una sostanziale esperienza con il farmaco in commercio. Per ulteriori informazioni sulle proprietà fisiche, precliniche, cliniche e farmaceutiche di GP2013 (compresi i dettagli dei test di confronto tra GP2013 e MabThera ), consultare l ultima edizione dell Investigator Brochure di GP2013. Obiettivo primario Obiettivo primario: Dimostrare la comparabilità del tasso di risposta complessiva (ORR) in pazienti con linfoma follicolare (FL) in stadio avanzato precedentemente non trattato che ricevono il trattamento con l associazione GP2013-CVP in confronto al trattamento con l associazione MabThera -CVP. La ORR sarà determinata durante il periodo di trattamento con l associazione utilizzando i Criteri di Risposta Modificati per il Linfoma Maligno (vedi Appendice 1). Obiettivi secondari Altri obiettivi di efficacia: Valutare il tasso di risposta completa (CR) durante il periodo di trattamento con l associazione. Valutare il tasso di risposta parziale (PR) durante il periodo di trattamento con l associazione. Valutare la sopravvivenza libera da progressione (PFS), definita come il periodo dalla data della randomizzazione alla data della prima progressione documentata della malattia o del decesso dovuto a qualsiasi causa, con un periodo di follow up fino a 3 anni dopo la randomizzazione. Valutare la sopravvivenza complessiva (OS), definita come il periodo dalla data della randomizzazione alla data del decesso
4 Novartis Pag. 4 di 13 dovuto a qualsiasi causa, con un periodo di follow up fino a 3 anni dopo la randomizzazione. Obiettivi di sicurezza: Descrivere la sicurezza d impiego di GP2013 in confronto a MabThera in monoterapia o in associazione a CVP. Valutare l incidenza di immunogenicità (formazione di anticorpi contro il farmaco ADA) nei confronti di GP2013 e MabThera. Obiettivi farmacocinetici/ farmacodinamici Valutare la farmacocinetica di GP2013 e MabThera. Valutare la conta delle cellule B CD19+ periferiche come indicatore biologico farmacodinamico dopo il trattamento con GP2013-CVP e MabThera -CVP. Obiettivi esploratori Esplorare la farmacocinetica di popolazione di GP2013 e MabThera. Disegno dello studio Studio randomizzato, con controllo attivo, in doppio cieco, multicentrico, a gruppi paralleli, di Fase III, per confrontare l efficacia e la sicurezza d impiego, la farmacocinetica e la farmacodinamica di GP2013 in associazione a ciclofosfamide, vincristina, prednisone in confronto a MabThera in associazione a ciclofosfamide, vincristina, prednisone, seguiti da terapia di mantenimento con GP2013 o MabThera in pazienti con linfoma follicolare in stadio avanzato precedentemente non trattato. Approssimativamente 618 pazienti con linfoma follicolare in stadio avanzato (stadio Ann Arbor III/IV), CD20 positivo con grado istologico 1-3a (WHO) saranno randomizzati, in un rapporto 1:1, stratificati in base al punteggio del gruppo di rischio FLIPI (Solal-Celigny et al 2004) e alla regione geografica, al trattamento con GP2013 in associazione a CVP o MabThera in associazione a CVP per 8 cicli. La stratificazione per gruppo di rischio FLIPI consiste in: rischio basso/intermedio (punteggio FLIPI 0-2) in confronto a rischio elevato (punteggio FLIPI 3-5). La stratificazione per regione viene definita approssimativamente in base alla localizzazione geografica dei Paesi partecipanti e sarà categorizzata in una delle 3 regioni seguenti: Asia Pacifica, America Latina ed Europa. Una coorte di circa 100 pazienti per gruppo di trattamento (Coorte 1), dal totale dei 618 pazienti, sarà sottoposta a prelievi per la valutazione farmacocinetica. Un ulteriore sottogruppo di approssimativamente 20 pazienti per braccio (Coorte 2), ossia 40 dei pazienti compresi nella Coorte 1, sarà sottoposta in aggiunta a valutazioni farmacocinetiche
5 Novartis Pag. 5 di 13 estensive durante il Ciclo 4 e a valutazioni farmacodinamiche durante il Ciclo 1. In tutti i pazienti saranno raccolti campioni per la valutazione dell immunogenicità. I pazienti che ottengono una Risposta Completa (CR) o una Risposta Parziale (PR) alla fine del periodo di trattamento con l associazione saranno eleggibili al trattamento di mantenimento con GP2013/MabThera in monoterapia, in base al trattamento inizialmente assegnato, per un periodo di 2 anni. Tutti i pazienti saranno seguiti per un periodo di tre anni a partire dalla randomizzazione. Un Data Monitoring Committee (DMC) indipendente garantirà la supervisione dello studio, sulla base di uno statuto concordato tra lo Sponsor e il DMC. Lo studio sarà condotto in approssimativamente 140 centri e 20 Paesi. L arruolamento in questo studio sarà competitivo e si prevede che il periodo di reclutamento duri approssimativamente 18 mesi. Lo studio comprende quattro periodi: Screening, Trattamento di associazione, Trattamento di Mantenimento e Follow up. Il disegno dello studio è illustrato nella Figura 4-2 e nella Figura 4-3 del protocollo. Periodo di Screening (fino a 28 giorni prima della randomizzazione) Il periodo di screening inizia il giorno in cui viene eseguita la prima procedura dello studio (Giorno -28) dopo che il paziente ha fornito il proprio consenso informato scritto alla partecipazione allo studio e termina il giorno della randomizzazione. Tutte le valutazioni di screening saranno eseguite durante una o più visite cliniche per determinare l eleggibilità allo studio. Campioni freschi o archiviati di un linfonodo tumorale o blocchi di paraffina o vetrini devono essere inviati al laboratorio patologico centralizzato designato e i risultati che confermano l istologia di linfoma follicolare, il grado istologico WHO e la positività CD20 devono essere disponibili prima della randomizzazione. Dopo la firma del consenso e prima della randomizzazione, il centro compilerà un modulo di prerandomizzazione che include i principali criteri di eleggibilità. Questo modulo sarà inviato allo sponsor per la conferma dell eleggibilità del paziente allo studio. Periodo di trattamento con l associazione (8 cicli; approssimativamente 6 mesi) Tutti i pazienti saranno randomizzati in un rapporto 1:1 a 8 cicli di trattamento con GP2013-CVP o MabThera -CVP. Il trattamento in doppio cieco con l associazione inizia il Giorno 1 del ciclo 1. I cicli si ripetono ogni 21 giorni per 8 cicli (approssimativamente 6 mesi) o fino alla progressione della malattia, alla comparsa di tossicità intollerabile, alla sospensione del trattamento o al ritiro del consenso al trattamento o allo studio. Nel caso in cui qualsiasi componente del regime di
6 Novartis Pag. 6 di 13 trattamento dell associazione (qualsiasi componente della chemioterapia o il farmaco biologico) debba essere sospeso (ad es: a causa di tossicità intollerabile) i pazienti possono ancora continuare a ricevere altri componenti del regime di trattamento dell associazione. Braccio 1 Braccio di trattamento in studio GP2013 (375 mg/m² e.v. il Giorno 1) Ciclofosfamide a (750 mg/m 2 e.v. il Giorno 1) Vincristina a [1,4 mg/m 2 (dose massima 2 mg) e.v. il Giorno 1] Prednisone b (100 mg per os nei giorni 1-5) Braccio 2 Braccio di controllo MabThera (375 mg/m² e.v. il Giorno 1) Ciclofosfamide a (750 mg/m 2 e.v. il Giorno 1) Vincristina a [1,4 mg/m 2 (dose massima 2 mg) e.v. il Giorno 1] Prednisone b (100 mg per os nei giorni 1-5) a Ciclofosfamide e vincristina possono essere somministrate il Giorno 2 se non fattibile dal punto di vista logistico il Giorno 1. b In un Paese in cui il prednisone non è disponibile in commercio possono essere utilizzate dosi equivalenti (100 mg) di prednisolone al posto di prednisone. Periodo di Terapia di Mantenimento (2 anni) Il periodo di trattamento di mantenimento con GP2013/MabThera segue il completamento del periodo di trattamento con l associazione. Ai pazienti che alla fine del Ciclo 8 rispondono al trattamento con l associazione, come evidenziato dalla dimostrazione di una CR o PR, utilizzando i criteri di risposta modificati per il linfoma maligno (vedi Appendice 1) sarà offerta la possibilità di essere trattati in doppio cieco con la terapia di mantenimento con GP2013/MabThera in monoterapia, in base all assegnazione del trattamento in origine, che sarà somministrata ogni 3 mesi per ulteriori 2 anni o fino alla progressione della malattia, alla comparsa di tossicità intollerabile, alla sospensione del trattamento o al ritiro del consenso al trattamento o allo studio. Periodo di Follow-up Tutti i pazienti saranno seguiti per la progressione della malattia e la sopravvivenza complessiva per un periodo totale di 3 anni dalla data della randomizzazione. I pazienti nei quali alla fine della fase di trattamento con l associazione la risposta al trattamento in studio è la malattia stabile (SD) (e quindi non sono eleggibili alla terapia di mantenimento) o i pazienti che sospendono il trattamento prima della progressione della malattia documentata/confermata saranno seguiti per la comparsa di progressione della malattia e per la sopravvivenza per un periodo totale di tre anni dalla data della randomizzazione. I pazienti, nei quali viene documentata la progressione della malattia in qualsiasi momento, sospenderanno il trattamento in studio ma
7 Novartis Pag. 7 di 13 continueranno a essere seguiti per la sopravvivenza per 3 anni dalla data della randomizzazione. Inoltre, tutti i pazienti saranno seguiti per la valutazione della sicurezza d impiego per almeno 30 giorni dopo la somministrazione dell ultima dose del trattamento in studio (sia per quanto riguarda la terapia in associazione sia per quanto riguarda la terapia di mantenimento). I pazienti che sospendono il trattamento anticipatamente per la comparsa di eventi avversi devono essere monitorati fino alla risoluzione o alla stabilizzazione dell'evento. Popolazione La popolazione in studio consiste di pazienti adulti (>= 18 anni) con linfoma follicolare in stadio avanzato non precedentemente trattato (stadio Ann Arbor III/IV) con grado istologico 1-3a (WHO). Numero di pazienti Si prevede che approssimativamente 618 pazienti siano randomizzati al trattamento con GP2013-CVP e MabThera -CVP, secondo un rapporto 1:1. Criteri d inclusione I pazienti eleggibili all inclusione nel presente studio devono soddisfare tutti i criteri seguenti: 1) Pazienti con linfoma follicolare in stadio avanzato, CD20 positivo non precedentemente trattato: a. Stadio III/IV della classificazione Ann Arbor; b. Grado istologico 1, 2 o 3a (WHO), confermato dalla valutazione patologica centralizzata e c. Necessità di trattamento per il linfoma follicolare, secondo le linee-guida locali o secondo l opinione del medico che segue il paziente. 2) Pazienti di età >= 18 anni. 3) Pazienti con almeno una lesione misurabile (misurabile con precisione in almeno 2 dimensioni perpendicolari): a. almeno 1 lesione linfonodale misurabile con asse maggiore > 20 mm OPPURE b. almeno 1 lesione extra-linfonodale misurabile con entrambi gli assi, maggiore e minore >= 10 mm. 4) Pazienti con ECOG performance status 0, 1 o 2. 5) Pazienti con funzionalità cardiaca adeguata, definita da frazione di eiezione >= 45%, misurata mediante ecocardiografia o MUGA scan, senza alterazioni cliniche rilevanti.
8 Novartis Pag. 8 di 13 6) Pazienti con i seguenti valori di laboratorio ottenuti durante lo screening (fino a 28 giorni prima della randomizzazione): a. Emoglobina >= 10 g/dl (a meno che le alterazioni non siano dovute a coinvolgimento midollare del linfoma, confermato dall istologia); b. Conta dei neutrofili assoluta (ANC) >= 1,5 x 10 9 /L (a meno che le alterazioni non siano dovute a coinvolgimento midollare del linfoma, confermato dall istologia); c. Conta piastrinica >= 100 x 10 9 /L (a meno che le alterazioni non siano dovute a coinvolgimento midollare del linfoma, confermato dall istologia); d. Bilirubina totale < 1,5 x ULN (limite superiore della norma) (se presente sindrome di Gilbert-Meulengracht sono consentiti valori fino a 2,0 x ULN); e. Transaminasi < 2,5 x ULN; f. Livello di creatinina sierica < 2 x ULN o clearance della creatinina calcolata > 50 ml/min; g. Marcatori sierologici o virologici negativi per infezioni da virus dell epatite B e C in fase attiva o latente. 7) pazienti di sesso maschile che acconsentono a utilizzare un preservativo durante i rapporti sessuali durante il periodo di assunzione del trattamento in studio e per 12 mesi dopo la sospensione del trattamento poiché devono astenersi dal concepire un figlio in questo periodo di tempo. E richiesto l utilizzo del preservativo anche nei pazienti vasectomizzati (così come durante il rapporto sessuale con partner di sesso maschile) per prevenire il passaggio del farmaco attraverso il liquido seminale. 8) Donne potenzialmente fertili, definite come tutte le donne fisiologicamente capaci di iniziare una gravidanza, comprese le donne la cui carriera, stile di vita, orientamento sessuale preclude i rapporti sessuali con partner maschili e donne il cui partner è stato sterilizzato mediante vasectomia o altri metodi che accettano di utilizzare un metodo contraccettivo di efficacia elevata (definito nella Sezione ) durante la somministrazione del trattamento in studio e per 12 mesi dopo la sospensione del trattamento OPPURE Donne considerate in post-menopausa e quindi non potenzialmente capaci di iniziare una gravidanza, ossia quelle donne che hanno avuto 6 mesi di amenorrea fisiologica (spontanea), con un profilo clinico adeguato (ad esempio, età appropriata, storia di sintomi vasomotori) o sono state sottoposte a ovariectomia bilaterale (con o
9 Novartis Pag. 9 di 13 Criteri d esclusione senza isterectomia) o legatura delle tube almeno nelle sei settimane precedenti (nel caso della sola ovariectomia solo se lo stato riproduttivo della donna viene confermato dalla valutazione dei livelli ormonali). 9) Pazienti che hanno firmato e datato i documenti di consenso informato in base alle linee-guida locali. I pazienti eleggibili al presente studio non devono presentare alcuno dei seguenti criteri: 1) Pazienti con linfoma follicolare di Grado 3b (aggressivo) o qualsiasi diagnosi istologica diversa da linfoma follicolare di grado 1, 2 o 3a. 2) Pazienti con evidenza istologica di trasformazione a linfoma di grado alto o linfoma diffuso a grandi cellule B. 3) Pazienti precedentemente sottoposti a qualsiasi terapia per il linfoma (ad es: farmaci citostatici o citotossici, radioterapia, anticorpi, vaccino anti-linfoma, trattamenti sperimentali). 4) Evidenza di malattia leucemica rilevante, definita da cellule di linfoma CD20+ circolanti > 10 x 10 9 /L. 5) Pazienti con evidenza clinica di interessamento del sistema nervoso centrale (SNC) da parte del linfoma o qualsiasi evidenza di compressione midollare da parte del linfoma. 6) Pazienti con evidenza di qualsiasi infezione, acuta o cronica attiva, non controllata (virale, batterica o micotica). 7) Pazienti in trattamento con dosi croniche (> 3 mesi) elevate (> 20 mg di prednisone o > approssimativamente 3 mg di desametasone al giorno o dosaggio equivalente di altro corticosteroide) di corticosteroide sistemico. 8) Pazienti con qualsiasi neoplasia maligna nei 5 anni precedenti la data della randomizzazione, a eccezione di carcinoma in situ della cervice uterina adeguatamente trattato, carcinoma a cellule basali o a cellule squamose o carcinoma cutaneo non melanomatoso. 9) Pazienti con un ipersensibilità nota a uno qualsiasi dei componenti del trattamento, ad es. anticorpi umani ricombinanti. 10) Pazienti con patologie concomitanti serie, condizioni mediche non controllate o altre patologie presenti in anamnesi comprese alterazioni clinicamente rilevanti dei risultati degli esami di laboratorio che, secondo l opinione dello sperimentatore, possano interferire con la partecipazione del paziente allo studio o con l interpretazione dei risultati: a. Malattie neurologiche non controllate (ad es: crisi epilettiche ricorrenti nonostante il trattamento anticomiziale);
10 Novartis Pag. 10 di 13 b. Neuropatia >= grado 1, malattia neuromuscolare; c. Alterazione grave della funzionalità epatica; d. Stipsi grave; e. Cistite o altre infezioni in corso; f. Disturbi della minzione; g. Broncopneumopatia ostruttiva cronica grave con ipossiemia clinicamente evidente; h. Ipertensione non controllata (definita da pressione sistolica > 160 mmhg o pressione diastolica > 100 mmhg); i. Anamnesi positiva per ictus o ischemia cerebrale (nei 6 mesi precedenti lo screening); j. Anamnesi positiva per infarto miocardico o altre miocardiopatie clinicamente rilevanti (nei 6 mesi precedenti lo screening) o angina instabile (>= NYHA di grado II); k. Infezione nota da HIV o qualsiasi altro stato di immunocompromissione grave, in base all anamnesi del paziente (se richiesto dalle legislazioni locali o dalle linee-guida della pratica clinica locale, il paziente dovrebbe essere valutato durate il periodo di screening per confermare lo stato HIV); l. Evidenza di abuso di alcool o sostanze stupefacenti non legali (droghe) nei 6 mesi precedenti lo screening; m. Infezione tubercolare in fase attiva. I pazienti con evidenza di tubercolosi latente, in base al risultato del test per lo screening della tubercolosi e durante il follow up successivo possono entrare nello studio dopo valutazione da parte di uno specialista e dopo l inizio di un trattamento sufficiente in base alla pratica clinica locale. 11) Pazienti sottoposti a intervento chirurgico maggiore, biopsia aperta o trauma, nelle 4 settimane precedenti la data dello screening (la biopsia linfonodale non viene considerata un intervento chirurgico maggiore) o che prevedono la necessità di intervento chirurgico maggiore durante il corso del trattamento in studio. 12) Pazienti in allattamento (al seno o mediante tiralatte ), in gravidanza o che hanno programmato una gravidanza entro 12 mesi dall ultima infusione del trattamento in studio; la gravidanza viene definita dallo stato di una donna dopo il concepimento e fino al termine della gestazione, confermata da un test di laboratorio hcg positivo (> 5 mlu/ml). 13) Pazienti in trattamento con qualsiasi altro farmaco sperimentale
11 Novartis Pag. 11 di 13 entro 30 giorni o 5 emivite, qualunque accada prima, precedenti lo screening. 14) Pazienti che intendono sottoporsi a vaccinazioni con vaccini vivi durante lo studio o hanno ricevuto vaccini vivi nelle 4 settimane precedenti la data dello screening. Esempi di vaccini vivi comprendono: antiinfluenzale per via nasale, morbillo, parotite, rosolia, antipolio per via orale, BCG, febbre gialla, varicella e vaccino antitifico TY21a. 15) Pazienti che utilizzano fattori di crescita o trasfusioni per soddisfare i requisiti di eleggibilità durante il periodo di screening. Terapia sperimentale e di riferimento Il periodo di trattamento consiste di 2 parti: Periodo del trattamento in associazione Consiste di 8 cicli di trattamento di GP2013/MabThera -CVP somministrati ogni 21 giorni (+/- 3 giorni), ossia circa un periodo di 6 mesi. I pazienti che presentano PR o CR al completamento degli 8 cicli di trattamento in associazione continueranno a ricevere il trattamento di mantenimento in base all assegnazione originale del trattamento con GP2013/MabThera. Periodo di mantenimento del trattamento Consiste di 8 cicli di trattamento con GP2013/MabThera (+/- 3 giorni), in monoterapia somministrato ogni 3 mesi (+/- 14 giorni), per ulteriori 2 anni. Trattamenti non consentiti Valutazioni di Durante il trattamento in studio non è consentito l uso dei seguenti farmaci e delle seguenti terapie: Fattori di crescita o trasfusioni per consentire l eleggibilità del paziente allo screening. Impiego per la profilassi primaria di fattori di crescita prima del Giorno 1 del ciclo 1. Farmaci immunosoppressori. Vaccini vivi, ad es: anti-influenzale per via nasale, morbillo, parotite, rosolia, antipolio per via orale, BCG, febbre gialla, varicella e vaccino antitifico TY21a. Altri trattamenti che sono o possono essere attivi nei confronti del linfoma, compresi farmaci sperimentali. Radioterapia.
12 Novartis Pag. 12 di 13 efficacia Gli endpoint di efficacia comprendono il tasso di risposta, la sopravvivenza libera da progressione e la sopravvivenza complessiva (definite nella Sezione 10 del protocollo). L efficacia sarà valutata utilizzando i criteri di risposta modificati per il linfoma maligno (vedi Appendice 1) basati sulle valutazioni TAC con mezzo di contrasto o RMN e del midollo osseo. Al momento delle valutazioni tumorali saranno anche determinati i Sintomi B. Le valutazioni tumorali (TAC/RMN) devono essere eseguite fino alla progressione della malattia nei seguenti tempi: Screening Fino a -28 giorni dalla data della randomizzazione. Periodo del trattamento in associazione: Ciclo 4 e 8, Giorno 21 (+/- 7 giorni). Periodo del trattamento di mantenimento: Ogni 6 mesi: cicli 2, 4, 6 e 8, Giorno 21 (+/- 14 giorni). Follow-up post-trattamento: Ogni 6 mesi dalla data dell ultima valutazione tumorale completata (+/- 14 giorni rispetto alla data in cui è stata pianificata la valutazione). Nei pazienti che sospendono anticipatamente il trattamento in studio senza progressione della malattia documentata è necessario eseguire una valutazione tumorale di fine trattamento, se sono trascorse > 4 settimane dall ultima valutazione. Scansioni aggiuntive possono essere eseguite se clinicamente indicato. Valutazioni di sicurezza Analisi dei dati La sicurezza d impiego e la tollerabilità comprenderanno il monitoraggio degli eventi avversi e le variazioni rispetto al basale dei valori degli esami di laboratorio e dei segni vitali. La tollerabilità sarà valutata mediante l incidenza degli eventi avversi che comportano ritardo della somministrazione del trattamento in studio o interruzione del trattamento (vedi Sezione 8 per le informazioni sulla raccolta dei dati e sulla segnalazione). I riscontri rilevanti presenti prima della firma del modulo di consenso informato devono essere inclusi nell anamnesi/condizioni cliniche attuali della ecrf. I riscontri rilevanti di nuova insorgenza che iniziano o peggiorano dopo la consegna del consenso informato, che soddisfano la definizione di evento avverso devono essere registrati nella pagina AE della ecrf. Gli eventi avversi saranno raccolti a partire dalla data del consenso informato fino al completamento dello studio. In questo studio saranno eseguite due analisi dei dati clinici. L analisi primaria ha lo scopo di dimostrare la similarità del trattamento con l associazione GP2013-CVP nei confronti del trattamento con l'associazione MabThera -CVP in riferimento all endpoint primario: ORR.
13 Novartis Pag. 13 di 13 Questa analisi primaria sarà eseguita quando tutti i pazienti randomizzati avranno completato il periodo di trattamento con l associazione (GP2013/ MabThera -CVP). La seconda analisi dei dati clinici sarà eseguita quando tutti i pazienti avranno completato il periodo di mantenimento e il periodo di followup, come descritto nel protocollo. La valutazione primaria dell equivalenza di GP2013 al farmaco di riferimento sarà basata sull intervallo di confidenza a due code del 95% per la differenza del tasso di OR. L ipotesi nulla (H0) rispetto all ipotesi alternativa (HA) sarà: H0: pt - ps > δ versus HA: pt - ps δ dove pt = tasso di risposta per GP2013, ps = tasso di risposta per MabThera e δ = margine di equivalenza pre-specificato di 0.12 (vedi Sezione 10.7 del protocollo per la giustificazione del margine selezionato). L equivalenza sarà eseguita se l intero intervallo di confidenza al 95% si situa all interno dell intervallo (-δ,+δ), ossia (-0.12, +0.12).
Studio di ricerca clinica sul dolore da endometriosi. Il dolore che Lei sente è reale... anche se gli altri non possono vederlo.
 Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
Trials clinici. Disegni di studio
 Trials Clinici Dott.ssa Pamela Di Giovanni Studi descrittivi Disegni di studio Popolazioni Individui Studi analitici Osservazionali Sperimentali Studi di correlazione o ecologici Case report - Case series
Trials Clinici Dott.ssa Pamela Di Giovanni Studi descrittivi Disegni di studio Popolazioni Individui Studi analitici Osservazionali Sperimentali Studi di correlazione o ecologici Case report - Case series
Sinossi di studio clinico Codice: GECP06/01 Pag. 1 di 5
 Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
SINOSSI. Studio di Fase II: Obiettivo primario Determinare l attività antitumorale della combinazione in termini di tempo alla progressione
 SINOSSI TITOLO Studio di fase I-II con Lapatinib in combinazione con capecitabina e vinorelbina come seconda linea di trattamento in pazienti con carcinoma mammario con iperespressione di ErbB2 localmente
SINOSSI TITOLO Studio di fase I-II con Lapatinib in combinazione con capecitabina e vinorelbina come seconda linea di trattamento in pazienti con carcinoma mammario con iperespressione di ErbB2 localmente
HIV-AIDS e Benessere Riproduttivo
 HIV-AIDS e Benessere Riproduttivo HIV-AIDS Un emergenza da non dimenticare A livello globale, l epidemia di HIV-AIDS pare essersi stabilizzata. Il tasso di nuove infezioni è in costante diminuzione dalla
HIV-AIDS e Benessere Riproduttivo HIV-AIDS Un emergenza da non dimenticare A livello globale, l epidemia di HIV-AIDS pare essersi stabilizzata. Il tasso di nuove infezioni è in costante diminuzione dalla
L uso della Lofexidina nei contesti clinici italiani: lo studio DETOX
 L uso della Lofexidina nei contesti clinici italiani: lo studio DETOX dott. Marco Riglietta direttore Dipartimento delle Dipendenze Roma -5 ottobre 03 FEDERSERD V congresso nazionale Il protocollo Obiettivo(i)
L uso della Lofexidina nei contesti clinici italiani: lo studio DETOX dott. Marco Riglietta direttore Dipartimento delle Dipendenze Roma -5 ottobre 03 FEDERSERD V congresso nazionale Il protocollo Obiettivo(i)
STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? 2. Come nasce la sperimentazione clinica e che tipi di studi esistono?
 STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica, o studio clinico controllato, (in inglese: clinical trial), un esperimento scientifico che genera dati
STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica, o studio clinico controllato, (in inglese: clinical trial), un esperimento scientifico che genera dati
L Investigator s Brochure. Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari. Maglie 25 novembre 2004
 L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI CLOPIDOGREL
 20-3-2009 GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale - n. 66 ALLEGATO 1 PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI CLOPIDOGREL Centro prescrittore Nome cognome del clinico prescrittore
20-3-2009 GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale - n. 66 ALLEGATO 1 PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI CLOPIDOGREL Centro prescrittore Nome cognome del clinico prescrittore
-Sinossi del Protocollo-
 -Sinossi del Protocollo- CHEMIO-IMMUNOTERAPIA INTENSIVA PER IL TRATTAMENTO IN PRIMA LINEA DI PAZIENTI ADULTI CON LINFOMA NON HODGKIN A CELLULE T PERIFERICHE (PTCL) Studio Clinico A Tipo di studio Scopo
-Sinossi del Protocollo- CHEMIO-IMMUNOTERAPIA INTENSIVA PER IL TRATTAMENTO IN PRIMA LINEA DI PAZIENTI ADULTI CON LINFOMA NON HODGKIN A CELLULE T PERIFERICHE (PTCL) Studio Clinico A Tipo di studio Scopo
16th World Conference on Lung Cancer (WCLC): highlights
 16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
Allegato I. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Sperimentazione Clinica: ruolo e responsabilità dell Infermiere
 Sperimentazione Clinica: ruolo e responsabilità dell Infermiere Fasi dello studio Disegni di ricerca sperimentale Barbara Gorini, Investigator Site Development Lead, Development Operations- Pfizer ITALIA
Sperimentazione Clinica: ruolo e responsabilità dell Infermiere Fasi dello studio Disegni di ricerca sperimentale Barbara Gorini, Investigator Site Development Lead, Development Operations- Pfizer ITALIA
Le malattie cardiovascolari (MCV) sono la principale causa di morte nelle donne, responsabili del 54% dei decessi femminili in Europa
 Red Alert for Women s Heart Compendio DONNE E RICERCA CARDIOVASCOLARE Le malattie cardiovascolari (MCV) sono la principale causa di morte nelle donne, responsabili del 54% dei decessi femminili in Europa
Red Alert for Women s Heart Compendio DONNE E RICERCA CARDIOVASCOLARE Le malattie cardiovascolari (MCV) sono la principale causa di morte nelle donne, responsabili del 54% dei decessi femminili in Europa
Raccolta prospettica di dati di rilevanza prognostica in pazienti con Leucemia Linfatica Cronica a cellule B.
 O-CLL1 CHRONIC LYMPHOCYTIC LEUKEMIA PROGNOSTIC FACTOR PROJECT Raccolta prospettica di dati di rilevanza prognostica in pazienti con Leucemia Linfatica Cronica a cellule B. O-CLL1-PROTOCOL Sinossi O-CLL1-sinossi,
O-CLL1 CHRONIC LYMPHOCYTIC LEUKEMIA PROGNOSTIC FACTOR PROJECT Raccolta prospettica di dati di rilevanza prognostica in pazienti con Leucemia Linfatica Cronica a cellule B. O-CLL1-PROTOCOL Sinossi O-CLL1-sinossi,
STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI
 STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI ( 65 E
STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI ( 65 E
CARTA INTESTATA DEL CENTRO CLINICO
 CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
SINOSSI DEL PROTOCOLLO
 SINOSSI DEL PROTOCOLLO Titolo Numero di protocollo Studio multicentrico, in aperto, randomizzato e adattivo di palifosfamide-tris, un nuovo DNA crosslinker, in combinazione con chemioterapia con carboplatino
SINOSSI DEL PROTOCOLLO Titolo Numero di protocollo Studio multicentrico, in aperto, randomizzato e adattivo di palifosfamide-tris, un nuovo DNA crosslinker, in combinazione con chemioterapia con carboplatino
Espressione di geni specifici per un determinato tumore
 Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
PAPILLOMA VIRUS UMANO E CARCINOMA DELLA CERVICE
 PAPILLOMA VIRUS UMANO E CARCINOMA DELLA CERVICE Lo screening come forma di prevenzione LE INFEZIONI DA HPV (PAPILLOMA VIRUS UMANO) Cos è l HPV? L HPV è una categoria di virus molto diffusa. La trasmissione
PAPILLOMA VIRUS UMANO E CARCINOMA DELLA CERVICE Lo screening come forma di prevenzione LE INFEZIONI DA HPV (PAPILLOMA VIRUS UMANO) Cos è l HPV? L HPV è una categoria di virus molto diffusa. La trasmissione
SEBASTIANO FILETTI. Dipartimento di Medicina Interna e Specialità Mediche. Università di Roma Sapienza, Roma
 SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
ONCOVIEW 2012. Istruzioni per la compilazione delle schede pazienti
 ONCOVIEW 2012 Istruzioni per la compilazione delle schede pazienti ONCOVIEW - COME SI COLLABORA Lo studio ONCOVIEW ha l obiettivo di fornire un quadro esaustivo ed approfondito delle terapie farmacologiche
ONCOVIEW 2012 Istruzioni per la compilazione delle schede pazienti ONCOVIEW - COME SI COLLABORA Lo studio ONCOVIEW ha l obiettivo di fornire un quadro esaustivo ed approfondito delle terapie farmacologiche
RIASSUNTO DEL PROTOCOLLO
 RIASSUNTO DEL PROTOCOLLO Titolo dello studio Studio di Fase 3b, randomizzato con Revlimid (Lenalidomide) somministrato come terapia di mantenimento verso placebo dopo il trattamento di induzione con Melfalan,
RIASSUNTO DEL PROTOCOLLO Titolo dello studio Studio di Fase 3b, randomizzato con Revlimid (Lenalidomide) somministrato come terapia di mantenimento verso placebo dopo il trattamento di induzione con Melfalan,
Protocollo di studio clinico o epidemiologico
 Protocollo di studio clinico o epidemiologico Esempi e struttura Esempio 1 (1) Titolo: gli eventi trombo-embolici nei pazienti con tumori a cellule germinali e trattati con chemioterapia Background: all
Protocollo di studio clinico o epidemiologico Esempi e struttura Esempio 1 (1) Titolo: gli eventi trombo-embolici nei pazienti con tumori a cellule germinali e trattati con chemioterapia Background: all
Risultati del triage e del follow-up post-trattamento con HPV-DNA test
 Lo screening per la prevenzione dei tumori della cervice uterina in Emilia Romagna Risultati del triage e del follow-up post-trattamento con HPV-DNA test Bologna, 29 marzo 2011 HPV TEST NEL TRIAGE DI ASC-US
Lo screening per la prevenzione dei tumori della cervice uterina in Emilia Romagna Risultati del triage e del follow-up post-trattamento con HPV-DNA test Bologna, 29 marzo 2011 HPV TEST NEL TRIAGE DI ASC-US
Il Test HPV come test di screening primario: la scelta della Regione Toscana Prof. Gianni Amunni
 Il Test HPV come test di screening primario: la scelta della Regione Toscana Prof. Gianni Amunni Direttore Istituto per lo studio e la prevenzione oncologica ISPO Direttore Istituto Toscani Tumori (ITT)
Il Test HPV come test di screening primario: la scelta della Regione Toscana Prof. Gianni Amunni Direttore Istituto per lo studio e la prevenzione oncologica ISPO Direttore Istituto Toscani Tumori (ITT)
FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
Prevenzione: abitudine. la nostra buona. Call Center 800.318.318 www.sanita.regione.lombardia.it
 Call Center 800.318.318 www.sanita.regione.lombardia.it Prevenzione: la nostra buona abitudine Carcinoma della cervice uterina: attacchiamolo da più fronti Il carcinoma della cervice uterina: una conseguenza
Call Center 800.318.318 www.sanita.regione.lombardia.it Prevenzione: la nostra buona abitudine Carcinoma della cervice uterina: attacchiamolo da più fronti Il carcinoma della cervice uterina: una conseguenza
Ricerca farmacologica priclinica e clinica
 Ricerca farmacologica priclinica e clinica SPERIMENTAZIONE PRECLINICA DURATA MEDIA?? ANNI Consente di isolare, dalle migliaia di sostanze sottoposte al primo screening di base farmacologico e biochimico,
Ricerca farmacologica priclinica e clinica SPERIMENTAZIONE PRECLINICA DURATA MEDIA?? ANNI Consente di isolare, dalle migliaia di sostanze sottoposte al primo screening di base farmacologico e biochimico,
SINOSSI DEL PROTOCOLLO
 SINOSSI DEL PROTOCOLLO TITOLO DELLO STUDIO: CODICE DEL PROTOCOLLO: SPONSOR: FASE DELLO STUDIO: CENTRI PARTECIPANTI ALLO STUDIO: PERIODO DI STUDIO PIANIFICATO (PRIMO ARRUOLAMENTO ULTIMO PAZIENTE USCITO
SINOSSI DEL PROTOCOLLO TITOLO DELLO STUDIO: CODICE DEL PROTOCOLLO: SPONSOR: FASE DELLO STUDIO: CENTRI PARTECIPANTI ALLO STUDIO: PERIODO DI STUDIO PIANIFICATO (PRIMO ARRUOLAMENTO ULTIMO PAZIENTE USCITO
Potenza dello studio e dimensione campionaria. Laurea in Medicina e Chirurgia - Statistica medica 1
 Potenza dello studio e dimensione campionaria Laurea in Medicina e Chirurgia - Statistica medica 1 Introduzione Nella pianificazione di uno studio clinico randomizzato è fondamentale determinare in modo
Potenza dello studio e dimensione campionaria Laurea in Medicina e Chirurgia - Statistica medica 1 Introduzione Nella pianificazione di uno studio clinico randomizzato è fondamentale determinare in modo
Che cos è l AIDS. Il virus H.I.V. è la causa dell immunodeficienza acquisita
 HIV e AIDS Che cos è l AIDS L A.I.D.S. o S.I.D.A. è una sindrome da immunodeficienza acquisita. E una malattia del sistema immunitario che ne limita e riduce le funzioni. Le persone colpite sono più suscettibili
HIV e AIDS Che cos è l AIDS L A.I.D.S. o S.I.D.A. è una sindrome da immunodeficienza acquisita. E una malattia del sistema immunitario che ne limita e riduce le funzioni. Le persone colpite sono più suscettibili
Titolo, oggetto e obiettivo del Progetto: Obiettivo Primario
 Titolo, oggetto e obiettivo del Progetto: Studio clinico randomizzato, con gruppo di controllo, sull Agopuntura Tradizionale Cinese come Terapia di Supporto in pazienti sottoposti a trattamento Chemioterapico
Titolo, oggetto e obiettivo del Progetto: Studio clinico randomizzato, con gruppo di controllo, sull Agopuntura Tradizionale Cinese come Terapia di Supporto in pazienti sottoposti a trattamento Chemioterapico
SINOSSI DELLO STUDIO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO
 SINOSSI DELLO STUDIO TITOLO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO SPONSOR Sequenza ottimale di ormonoterapia in pazienti con carcinoma mammario metastatico ricadute dopo terapia
SINOSSI DELLO STUDIO TITOLO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO SPONSOR Sequenza ottimale di ormonoterapia in pazienti con carcinoma mammario metastatico ricadute dopo terapia
coin lesion polmonare
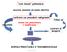 coin lesion polmonare accurata anamnesi ed esame obiettivo impossibile confronto con precedenti radiogrammi lesione non preesistente o modificatasi TC Follow-up caratteri di benignità lesione sospetta
coin lesion polmonare accurata anamnesi ed esame obiettivo impossibile confronto con precedenti radiogrammi lesione non preesistente o modificatasi TC Follow-up caratteri di benignità lesione sospetta
Versione aggiornata al 1 agosto 2003
 Versione aggiornata al 1 agosto 2003 PROTOCOLLO PER L UTILIZZO DI DONATORI POSITIVI PER GLI ANTICORPI DIRETTI CONTRO L ANTIGENE CORE (HBcAb-IgG) DEL VIRUS B DELL EPATITE (HBV) NEL TRAPIANTO DI FEGATO.
Versione aggiornata al 1 agosto 2003 PROTOCOLLO PER L UTILIZZO DI DONATORI POSITIVI PER GLI ANTICORPI DIRETTI CONTRO L ANTIGENE CORE (HBcAb-IgG) DEL VIRUS B DELL EPATITE (HBV) NEL TRAPIANTO DI FEGATO.
ABRAXANE (nab-paclitaxel) - Carcinoma pancreas esocrino
 Campo obbligatorio ai fini dell'eleggibilità Campo obbligatorio ABRAXAN (nab-paclitaxel) - Carcinoma pancreas esocrino Abraxane in associazione con gemcitabina è indicato per il trattamento di prima linea
Campo obbligatorio ai fini dell'eleggibilità Campo obbligatorio ABRAXAN (nab-paclitaxel) - Carcinoma pancreas esocrino Abraxane in associazione con gemcitabina è indicato per il trattamento di prima linea
Call Center 840.000.006 www.sanita.regione.lombardia.it
 Call Center 840.000.006 www.sanita.regione.lombardia.it Carcinoma della cervice uterina: attacchiamolo da più fronti Il carcinoma della cervice uterina: una conseguenza rara di una infezione comune Il
Call Center 840.000.006 www.sanita.regione.lombardia.it Carcinoma della cervice uterina: attacchiamolo da più fronti Il carcinoma della cervice uterina: una conseguenza rara di una infezione comune Il
Il Pap test di triage
 La Citologia negli screening oncologici Roma, 19 novembre 2014 Il Pap test di triage nello screening con test HPV Maria Luisa Schiboni UOC Anatomia Patologica, Osp S.Giovanni - Roma Il Pap test di triage
La Citologia negli screening oncologici Roma, 19 novembre 2014 Il Pap test di triage nello screening con test HPV Maria Luisa Schiboni UOC Anatomia Patologica, Osp S.Giovanni - Roma Il Pap test di triage
Domande relative alla specializzazione in: Oncologia medica
 Domande relative alla specializzazione in: Oncologia medica Domanda #1 (codice domanda: n.541) : Cosa caratterizza il grado T2 del colangiocarcinoma? A: Interessamento del connettivo periduttale B: Coinvolgimento
Domande relative alla specializzazione in: Oncologia medica Domanda #1 (codice domanda: n.541) : Cosa caratterizza il grado T2 del colangiocarcinoma? A: Interessamento del connettivo periduttale B: Coinvolgimento
Call Center 840.000.006 www.sanita.regione.lombardia.it. Prevenzione: la nostra buona. abitudine
 Call Center 840.000.006 www.sanita.regione.lombardia.it Prevenzione: la nostra buona abitudine Carcinoma della cervice uterina: attacchiamolo da più fronti Il carcinoma della cervice uterina: una conseguenza
Call Center 840.000.006 www.sanita.regione.lombardia.it Prevenzione: la nostra buona abitudine Carcinoma della cervice uterina: attacchiamolo da più fronti Il carcinoma della cervice uterina: una conseguenza
E.Molfese, P.Matteucci, A.Iurato, M. Fiore, L.E. Trodella, L. Poggesi, R.M. D Angelillo, E. Iannacone, L.Trodella!
 Il trattamento stereotassico delle lesioni surrenaliche in pazienti oligometastatici affetti da NSCLC: una promettente arma per il controllo locale di malattia?! E.Molfese, P.Matteucci, A.Iurato, M. Fiore,
Il trattamento stereotassico delle lesioni surrenaliche in pazienti oligometastatici affetti da NSCLC: una promettente arma per il controllo locale di malattia?! E.Molfese, P.Matteucci, A.Iurato, M. Fiore,
SINOSSI PROTOCOLLO STUDIO OSSERVAZIONALE
 SINOSSI PROTOCOLLO STUDIO OSSERVAZIONALE Studio prospettico, non interventistico, di coorte, sul rischio di tromboembolismo venoso (TEV) in pazienti sottoposti a un nuovo trattamento chemioterapico per
SINOSSI PROTOCOLLO STUDIO OSSERVAZIONALE Studio prospettico, non interventistico, di coorte, sul rischio di tromboembolismo venoso (TEV) in pazienti sottoposti a un nuovo trattamento chemioterapico per
STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO
 STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO FAX: 0916552413 SITO WEB: www.gstu.it E-MAIL: gstu@gstu.it CRITERI
STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO FAX: 0916552413 SITO WEB: www.gstu.it E-MAIL: gstu@gstu.it CRITERI
Sabato 17 ottobre 2015 S. Beux, S. Monticone, G. Innocenzi, M. Zaffaroni, G. Bona
 Sabato 17 ottobre 2015 S. Beux, S. Monticone, G. Innocenzi, M. Zaffaroni, G. Bona Clinica Pediatrica Università degli Studi di Novara A.O.U. Maggiore della Carità di Novara Nel Mondo: 130-150 milioni di
Sabato 17 ottobre 2015 S. Beux, S. Monticone, G. Innocenzi, M. Zaffaroni, G. Bona Clinica Pediatrica Università degli Studi di Novara A.O.U. Maggiore della Carità di Novara Nel Mondo: 130-150 milioni di
PASQUALE FREGA Assobiotec
 ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
Il ragionamento diagnostico TEST DIAGNOSTICO. Dott.ssa Marta Di Nicola. L accertamento della condizione patologica viene eseguito TEST DIAGNOSTICO
 Il ragionamento diagnostico http://www.biostatistica biostatistica.unich unich.itit 2 L accertamento della condizione patologica viene eseguito All'inizio del decorso clinico, per una prima diagnosi In
Il ragionamento diagnostico http://www.biostatistica biostatistica.unich unich.itit 2 L accertamento della condizione patologica viene eseguito All'inizio del decorso clinico, per una prima diagnosi In
Parte I (punti 3-9): Misure sanitarie obbligatorie per il controllo della Paratubercolosi bovina
 LINEE GUIDA PER L ADOZIONE DI PIANI DI CONTROLLO E PER L ASSEGNAZIONE DELLA QUALIFICA SANITARIA DEGLI ALLEVAMENTI NEI CONFRONTI DELLA PARATUBERCOLOSI BOVINA 1. Definizioni Ai sensi delle presenti linee
LINEE GUIDA PER L ADOZIONE DI PIANI DI CONTROLLO E PER L ASSEGNAZIONE DELLA QUALIFICA SANITARIA DEGLI ALLEVAMENTI NEI CONFRONTI DELLA PARATUBERCOLOSI BOVINA 1. Definizioni Ai sensi delle presenti linee
Questionario del progetto SHARE per i genitori
 Questionario del progetto SHARE per i genitori Informazioni personali del paziente e diagnosi Paese di nascita: Sesso: (Maschio) (Femmina) Età: Età alla diagnosi: Persona che compila il questionario: Madre
Questionario del progetto SHARE per i genitori Informazioni personali del paziente e diagnosi Paese di nascita: Sesso: (Maschio) (Femmina) Età: Età alla diagnosi: Persona che compila il questionario: Madre
La rosolia nella donna in gravidanza
 La rosolia nella donna in gravidanza ROSOLIA Trasmissione materno-fetale Trasmissione transplacentare Nel corso della fase viremica con o senza manifestazioni cliniche L infezione fetale dopo reinfezione
La rosolia nella donna in gravidanza ROSOLIA Trasmissione materno-fetale Trasmissione transplacentare Nel corso della fase viremica con o senza manifestazioni cliniche L infezione fetale dopo reinfezione
LA VACCINAZIONE CONTRO IL PAPILLOMAVIRUS UMANO (HPV) S.S. Pediatria Territoriale Servizio di Medicina Scolastica
 LA VACCINAZIONE CONTRO IL PAPILLOMAVIRUS UMANO (HPV) S.S. Pediatria Territoriale Servizio di Medicina Scolastica LO SCREENING Uno dei principali obiettivi della medicina è diagnosticare una malattia il
LA VACCINAZIONE CONTRO IL PAPILLOMAVIRUS UMANO (HPV) S.S. Pediatria Territoriale Servizio di Medicina Scolastica LO SCREENING Uno dei principali obiettivi della medicina è diagnosticare una malattia il
Informazioni per potenziali partecipanti. Possiamo sciogliere l'amiloidosi AL?
 Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Verranno inoltre effettuati: - HCV Ab - CMV IgG, - Toxoplasma IgG - EBV VCA-IgG, EBNA - HSV IgG - VZV IgG
 Versione approvata al 1marzo 2005 PROTOCOLLO PER L UTILIZZO DI DONATORI POSITIVI PER GLI ANTICORPI DIRETTI CONTRO L ANTIGENE CORE (HBcAb-IgG) DEL VIRUS B DELL EPATITE (HBV) NEL TRAPIANTO DI CUORE E/O POLMONE
Versione approvata al 1marzo 2005 PROTOCOLLO PER L UTILIZZO DI DONATORI POSITIVI PER GLI ANTICORPI DIRETTI CONTRO L ANTIGENE CORE (HBcAb-IgG) DEL VIRUS B DELL EPATITE (HBV) NEL TRAPIANTO DI CUORE E/O POLMONE
Segnaliamo le sospette reazioni avverse! Come fare?
 La Farmacovigilanza. Perché, quando e come segnalare le Reazioni Avverse da Farmaci Segnaliamo le sospette reazioni avverse! Come fare? Dr. Michele Conti Regione Lazio Farmacista collaboratore di Farmacovigilanza
La Farmacovigilanza. Perché, quando e come segnalare le Reazioni Avverse da Farmaci Segnaliamo le sospette reazioni avverse! Come fare? Dr. Michele Conti Regione Lazio Farmacista collaboratore di Farmacovigilanza
SCHEDA FARMACO. Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
COSTITUZIONE DELL ARCHIVIO BIOLOGICO NAZIONALE PER LA SICUREZZA DELLA RETE TRAPIANTOLOGICA ED ALLEGATO TECNICO.
 COSTITUZIONE DELL ARCHIVIO BIOLOGICO NAZIONALE PER LA SICUREZZA DELLA RETE TRAPIANTOLOGICA ED ALLEGATO TECNICO. (Consulta Nazionale per i Trapianti - 31 agosto 2004) 1. E costituito l Archivio Biologico
COSTITUZIONE DELL ARCHIVIO BIOLOGICO NAZIONALE PER LA SICUREZZA DELLA RETE TRAPIANTOLOGICA ED ALLEGATO TECNICO. (Consulta Nazionale per i Trapianti - 31 agosto 2004) 1. E costituito l Archivio Biologico
Titolo. Background. Obiettivi. Metodi Tipo di studio (disegno) Centro/i partecipante/i Popolazione
 La SIFC promuove la ricerca clini ca nel campo della Fibrosi Cistica in Italia mediante la valutazione di progetti scientifici multicentrici e m ultidisciplinari. La Commissione Permanente Ricerca e Sviluppo
La SIFC promuove la ricerca clini ca nel campo della Fibrosi Cistica in Italia mediante la valutazione di progetti scientifici multicentrici e m ultidisciplinari. La Commissione Permanente Ricerca e Sviluppo
PARTE III LA VALUTAZIONE DELLA CAPACITà DI PERSEGUIMENTO
 PARTE III LA VALUTAZIONE DELLA CAPACITà DI PERSEGUIMENTO Delle strategie REGIONALI (B) a cura di Sara Barsanti Introduzione L area di valutazione del conseguimento delle strategie regionali (area B) ha
PARTE III LA VALUTAZIONE DELLA CAPACITà DI PERSEGUIMENTO Delle strategie REGIONALI (B) a cura di Sara Barsanti Introduzione L area di valutazione del conseguimento delle strategie regionali (area B) ha
MabThera. rituximab. Che cos è MabThera? Per che cosa si usa MabThera? Riassunto destinato al pubblico
 EMA/614203/2010 EMEA/H/C/000165 Riassunto destinato al pubblico rituximab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/614203/2010 EMEA/H/C/000165 Riassunto destinato al pubblico rituximab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
La programmazione di uno studio clinico: dalla domanda al disegno
 Metodo epidemiologici per la clinica _efficacia / 1 La programmazione di uno studio clinico: dalla domanda al disegno La buona ricerca clinica Non è etico ciò che non è rilevante scientificamente Non è
Metodo epidemiologici per la clinica _efficacia / 1 La programmazione di uno studio clinico: dalla domanda al disegno La buona ricerca clinica Non è etico ciò che non è rilevante scientificamente Non è
Metodi in vivo e in vitro per : il riconoscimento dei farmaci lo studio delle loro proprietà farmacologiche lo studio del loro meccanismo d azione
 Metodi in vivo e in vitro per : il riconoscimento dei farmaci lo studio delle loro proprietà farmacologiche lo studio del loro meccanismo d azione Metodi generali Metodi mirati Scoperta e sviluppo di nuovi
Metodi in vivo e in vitro per : il riconoscimento dei farmaci lo studio delle loro proprietà farmacologiche lo studio del loro meccanismo d azione Metodi generali Metodi mirati Scoperta e sviluppo di nuovi
Comparabilità fra le somministrazioni successive effetto di trascinamento ( carry-over ) effetto di periodo
 Metodo epidemiologici per la clinica _efficacia / 2 Gli studi crossover Periodo 1 Periodo 2 R A N D O M A B A B Valutazione Tempo 1 0 1 1 2 0 2 1 Gli studi crossover Metodo epidemiologici per la clinica
Metodo epidemiologici per la clinica _efficacia / 2 Gli studi crossover Periodo 1 Periodo 2 R A N D O M A B A B Valutazione Tempo 1 0 1 1 2 0 2 1 Gli studi crossover Metodo epidemiologici per la clinica
CARCINOMA DELLA CERVICE UTERINA:
 HPV-test Pap-test 71% CARCINOMA DELLA CERVICE UTERINA: FALSI MITI & REALTÀ DA CONOSCERE 1 Il carcinoma della cervice uterina colpisce solo donne in età avanzata 1 Studi recenti hanno evidenziato che il
HPV-test Pap-test 71% CARCINOMA DELLA CERVICE UTERINA: FALSI MITI & REALTÀ DA CONOSCERE 1 Il carcinoma della cervice uterina colpisce solo donne in età avanzata 1 Studi recenti hanno evidenziato che il
Quando il dolore è ancora un problema. XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013
 Quando il dolore è ancora un problema XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013 Marta Gentili vivere senza dolore onlus In Italia, nel 2012, si stimano circa 364 mila nuove diagnosi per tumore
Quando il dolore è ancora un problema XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013 Marta Gentili vivere senza dolore onlus In Italia, nel 2012, si stimano circa 364 mila nuove diagnosi per tumore
A.I.E.O.P. Gruppo Immunodeficienze primitive
 A.I.E.O.P. Gruppo Immunodeficienze primitive Mod.1.01 SCHEDA DI REGISTRAZIONE Questa scheda deve essere compilata ed inviata al più presto per ogni paziente affetto da XLA, CGD, CVID, THI, WAS, AAR. Centro
A.I.E.O.P. Gruppo Immunodeficienze primitive Mod.1.01 SCHEDA DI REGISTRAZIONE Questa scheda deve essere compilata ed inviata al più presto per ogni paziente affetto da XLA, CGD, CVID, THI, WAS, AAR. Centro
Sviluppo di un tumore
 TUMORI I tumori Si tratta di diversi tipi di malattie, che hanno cause diverse e che colpiscono organi e tessuti differenti Caratteristica di tutti i tumori è la proliferazione incontrollata di cellule
TUMORI I tumori Si tratta di diversi tipi di malattie, che hanno cause diverse e che colpiscono organi e tessuti differenti Caratteristica di tutti i tumori è la proliferazione incontrollata di cellule
Biosimilari Infliximab in gastroenterologia
 Promozione d uso dei farmaci a brevetto scaduto in particolare nel campo dei farmaci biotecnologici Biosimilari Infliximab in gastroenterologia Guido Basilisco Stefania Orlando, Flavio Caprioli UO di Gastroenterologia
Promozione d uso dei farmaci a brevetto scaduto in particolare nel campo dei farmaci biotecnologici Biosimilari Infliximab in gastroenterologia Guido Basilisco Stefania Orlando, Flavio Caprioli UO di Gastroenterologia
GLI ACCERTAMENTI SANITARI DI SECONDO LIVELLO
 GLI ACCERTAMENTI SANITARI DI SECONDO LIVELLO Dott. Giuliano Giucastro Sert. Langhirano Parma 19/11/2010 AMBULATORIO PER GLI ACCERTAMENTI DI SECONDO LIVELLO E un articolazione dell Area Dipendenze Patologiche
GLI ACCERTAMENTI SANITARI DI SECONDO LIVELLO Dott. Giuliano Giucastro Sert. Langhirano Parma 19/11/2010 AMBULATORIO PER GLI ACCERTAMENTI DI SECONDO LIVELLO E un articolazione dell Area Dipendenze Patologiche
DECISION MAKING. E un termine generale che si applica ad azioni che le persone svolgono quotidianamente:
 DECISION MAKING E un termine generale che si applica ad azioni che le persone svolgono quotidianamente: Cosa indosserò questa mattina? Dove e cosa mangerò a pranzo? Dove parcheggerò l auto? Decisioni assunte
DECISION MAKING E un termine generale che si applica ad azioni che le persone svolgono quotidianamente: Cosa indosserò questa mattina? Dove e cosa mangerò a pranzo? Dove parcheggerò l auto? Decisioni assunte
MALATTIE INFIAMMATORIE CRONICHE INTESTINALI (IBD) E GRAVIDANZA
 MALATTIE INFIAMMATORIE CRONICHE INTESTINALI (IBD) E GRAVIDANZA Di cosa parleremo? Potrò concepire e avere figli come tutte le altre persone? Influenza della gravidanza sul decorso della malattia e influenza
MALATTIE INFIAMMATORIE CRONICHE INTESTINALI (IBD) E GRAVIDANZA Di cosa parleremo? Potrò concepire e avere figli come tutte le altre persone? Influenza della gravidanza sul decorso della malattia e influenza
POLITERAPIE NEL PAZIENTE ANZIANO. Dipartimento Farmaceutico Azienda USL di Reggio Emilia
 POLITERAPIE NEL PAZIENTE ANZIANO Dipartimento Farmaceutico Azienda USL di Reggio Emilia PAZIENTI ANZIANI Maggiori utilizzatori di farmaci per la presenza di polipatologie spesso croniche Ridotte funzionalità
POLITERAPIE NEL PAZIENTE ANZIANO Dipartimento Farmaceutico Azienda USL di Reggio Emilia PAZIENTI ANZIANI Maggiori utilizzatori di farmaci per la presenza di polipatologie spesso croniche Ridotte funzionalità
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio
 Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Scheda Valutativa Tirocinio. Formativo
 Scheda Valutativa Tirocinio Formativo PER STUDENTI ISCRITTI AL 5 ANNO CdL in MEDICINA E CHIRURGIA Data inizio tirocinio: Data conclusione tirocinio:.. Studente Tutor clinico (nome e cognome) (qualifica
Scheda Valutativa Tirocinio Formativo PER STUDENTI ISCRITTI AL 5 ANNO CdL in MEDICINA E CHIRURGIA Data inizio tirocinio: Data conclusione tirocinio:.. Studente Tutor clinico (nome e cognome) (qualifica
SCHEDA REQUISITI PER LA QUALIFICAZIONE DEL CORSO PER ESPERTI IN MARKETING & COMUNICAZIONE
 Viale di Val Fiorita, 90-00144 Roma Tel. 065915373 - Fax: 065915374 E-mail: corsi@cepas.it Sito internet: www.cepas.it Pag. 1 di 5 SCHEDA REQUISITI PER LA QUALIFICAZIONE DEL 1 22.03.2002 Rev. Generale
Viale di Val Fiorita, 90-00144 Roma Tel. 065915373 - Fax: 065915374 E-mail: corsi@cepas.it Sito internet: www.cepas.it Pag. 1 di 5 SCHEDA REQUISITI PER LA QUALIFICAZIONE DEL 1 22.03.2002 Rev. Generale
APPROCCIO RADIOTERAPICO
 Unità operativa di Radioterapia Azienda Ospedaliera di Parma APPROCCIO RADIOTERAPICO Dott.ssa Dell Anna Cristina TUMORI PRIMITIVI DELLA PARETE TORACICA Sono tumori eterogenei che possono prendere origine
Unità operativa di Radioterapia Azienda Ospedaliera di Parma APPROCCIO RADIOTERAPICO Dott.ssa Dell Anna Cristina TUMORI PRIMITIVI DELLA PARETE TORACICA Sono tumori eterogenei che possono prendere origine
Interventi di prevenzione del tumore della cervice uterina
 Interventi di prevenzione del tumore della cervice uterina http:// Iechyd Cyhoeddus Cymru Public Health Wales Questo opuscolo fornisce informazioni che potrebbero contribuire alla prevenzione del tumore
Interventi di prevenzione del tumore della cervice uterina http:// Iechyd Cyhoeddus Cymru Public Health Wales Questo opuscolo fornisce informazioni che potrebbero contribuire alla prevenzione del tumore
BAY 43-9006/13266 - SINOSSI DEL PROTOCOLLO
 BAY 43-9006/13266 - SINOSSI DEL PROTOCOLLO Nome dello sponsor Nome del prodotto finito Nome del principio attivo Titolo dello studio Sperimentatore Principale Centri dello studio pianificati Periodo di
BAY 43-9006/13266 - SINOSSI DEL PROTOCOLLO Nome dello sponsor Nome del prodotto finito Nome del principio attivo Titolo dello studio Sperimentatore Principale Centri dello studio pianificati Periodo di
 Indicatori di qualità nei carcinomi genitali femminili: ovaio e utero Serata di presentazione progetto Zonta Club Locarno 13.04.2010 Registro Tumori Canton Ticino Istituto Cantonale di Patologia Via in
Indicatori di qualità nei carcinomi genitali femminili: ovaio e utero Serata di presentazione progetto Zonta Club Locarno 13.04.2010 Registro Tumori Canton Ticino Istituto Cantonale di Patologia Via in
I risultati dello studio pilota del HPV DNA test come test di screening nella Provincia di Reggio Emilia
 I risultati dello studio pilota del HPV DNA test come test di screening nella Provincia di Reggio Emilia SONIA PRANDI - CINZIA CAMPARI LUISA PATERLINI - TERESA RUBINO TITOLO DEL PROGETTO MINISTERIALE Progetto
I risultati dello studio pilota del HPV DNA test come test di screening nella Provincia di Reggio Emilia SONIA PRANDI - CINZIA CAMPARI LUISA PATERLINI - TERESA RUBINO TITOLO DEL PROGETTO MINISTERIALE Progetto
BS OHSAS 18001: 2007. Occupational. Health. Safety. Assesments. Series
 BS OHSAS 18001: 2007 Occupational Health Safety Assesments Series Prefazione La Norma è stata sviluppata per essere compatibile con le Norme: ISO 9001:2000 (Qualità) ISO 14001:2004 (Ambiente) Dr.ssa Carlotta
BS OHSAS 18001: 2007 Occupational Health Safety Assesments Series Prefazione La Norma è stata sviluppata per essere compatibile con le Norme: ISO 9001:2000 (Qualità) ISO 14001:2004 (Ambiente) Dr.ssa Carlotta
Screening. Definizione
 Screening Dott.ssa Pamela Di Giovanni Definizione Applicazione di un test, esame o di un altra procedura su soggetti asintomatici finalizzata all identificazione presuntiva di una potenziale patologia
Screening Dott.ssa Pamela Di Giovanni Definizione Applicazione di un test, esame o di un altra procedura su soggetti asintomatici finalizzata all identificazione presuntiva di una potenziale patologia
La conferma di laboratorio della rosolia
 La conferma di laboratorio della rosolia La risposta anticorpale all infezione post-natale da rosolia IgG Rash IgM Prodromi INCUBAZIONE 0 7 14 15 16 17 18 19 20 21 22 23 24 27 35 42 VIREMIA ESCREZIONE
La conferma di laboratorio della rosolia La risposta anticorpale all infezione post-natale da rosolia IgG Rash IgM Prodromi INCUBAZIONE 0 7 14 15 16 17 18 19 20 21 22 23 24 27 35 42 VIREMIA ESCREZIONE
I dati morfo-fenotipici, genotipici e clinici hanno permesso di suddividere il linfoma di Hodgkin in quattro gruppi istologici.
 LINFOMA DI HODGKIN Il linfoma di Hodgkin (LH) è una neoplasia di derivazione linfoide che rappresenta circa l 1% dei tumori che annualmente insorgono de novo nel mondo. La sede di esordio del linfoma di
LINFOMA DI HODGKIN Il linfoma di Hodgkin (LH) è una neoplasia di derivazione linfoide che rappresenta circa l 1% dei tumori che annualmente insorgono de novo nel mondo. La sede di esordio del linfoma di
Conoscere per Vincere Il Rotary per la prevenzione Sanitaria. Giuseppe Failla R.C.Ct & Giovanni Urso R.C. Ct Nord
 Conoscere per Vincere Il Rotary per la prevenzione Sanitaria Giuseppe Failla R.C.Ct & Giovanni Urso R.C. Ct Nord Qualche numero Sul territorio nazionale: Incidenza CRC: 52.000 nuovi casi diagnosticati
Conoscere per Vincere Il Rotary per la prevenzione Sanitaria Giuseppe Failla R.C.Ct & Giovanni Urso R.C. Ct Nord Qualche numero Sul territorio nazionale: Incidenza CRC: 52.000 nuovi casi diagnosticati
Studio FARM6KWTCT Emendamento 3 Protocollo Versione 3 del 26/05/2009 Versione finale del 18/10/2010 STUDIO CLINICO FARM6KWTCT
 STUDIO CLINICO FARM6KWTCT Efficacia di dosaggi elevati di acido folico nel prevenire l occorrenza delle malformazioni congenite. Trial clinico randomizzato nelle donne in età fertile che programmano la
STUDIO CLINICO FARM6KWTCT Efficacia di dosaggi elevati di acido folico nel prevenire l occorrenza delle malformazioni congenite. Trial clinico randomizzato nelle donne in età fertile che programmano la
1 Accesso. 2 Accesso. Note 1-2. Nota 3. (dopo 15-30 giorni) STOP. Nota 4
 1 Accesso Note 1-2 1. Individua i pazienti affetti da Sindrome Metabolica utilizzando l algoritmo per la diagnosi secondo l ATP III fra tutti i pazienti con BMI > 27 o affetti da uno dei disordini che
1 Accesso Note 1-2 1. Individua i pazienti affetti da Sindrome Metabolica utilizzando l algoritmo per la diagnosi secondo l ATP III fra tutti i pazienti con BMI > 27 o affetti da uno dei disordini che
Sinossi dell studio GIMEMA AML 1310
 Terapia adattata al rischio genetico/citogenetico e basata sulla determinazione della malattia minima residua per pazienti giovani ( 60 anni) affetti da leucemia acuta mieloide di nuova diagnosi EudraCT
Terapia adattata al rischio genetico/citogenetico e basata sulla determinazione della malattia minima residua per pazienti giovani ( 60 anni) affetti da leucemia acuta mieloide di nuova diagnosi EudraCT
Aree di impatto per considerazioni da parte del cliente Tratte dalle Regole per ottenere il riconoscimento IATF
 Regole 3 Edizione Aree di impatto per considerazioni da parte del cliente Aree di impatto per considerazioni da parte del cliente Tratte dalle Regole per ottenere il riconoscimento IATF 3 Edizione per
Regole 3 Edizione Aree di impatto per considerazioni da parte del cliente Aree di impatto per considerazioni da parte del cliente Tratte dalle Regole per ottenere il riconoscimento IATF 3 Edizione per
Corso di Medicina del Lavoro
 Corso di Medicina del Lavoro Malattie da cancerogeni, mutageni e genotossici Valutazione del rischio per la riproduzione in ambiente di lavoro 1 of 28 A quali agenti è esposto il lavoratore o la lavoratrice?
Corso di Medicina del Lavoro Malattie da cancerogeni, mutageni e genotossici Valutazione del rischio per la riproduzione in ambiente di lavoro 1 of 28 A quali agenti è esposto il lavoratore o la lavoratrice?
Documento PTR n.212 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Effetti sull opinione di pazienti riguardo all utilizzo di un computer in uno studio medico nell assistenza ordinaria
 Effetti sull opinione di pazienti riguardo all utilizzo di un computer in uno studio medico nell assistenza ordinaria Christopher N. Sciamanna, Scott P. Novak, Bess H. Marcus. International Journal of
Effetti sull opinione di pazienti riguardo all utilizzo di un computer in uno studio medico nell assistenza ordinaria Christopher N. Sciamanna, Scott P. Novak, Bess H. Marcus. International Journal of
Sarcomi delle Parti Molli
 Congresso Nazionale di Chirurgia Pediatrica LA MALATTIA NEOPLASTICA NELL ADOLESCENTE E NEL GIOVANE ADULTO STRATEGIE A CONFRONTO Ferrara, 9 OTTOBRE 2013 Sarcomi delle Parti Molli Gianni Bisogno Clinica
Congresso Nazionale di Chirurgia Pediatrica LA MALATTIA NEOPLASTICA NELL ADOLESCENTE E NEL GIOVANE ADULTO STRATEGIE A CONFRONTO Ferrara, 9 OTTOBRE 2013 Sarcomi delle Parti Molli Gianni Bisogno Clinica
PROGETTAZIONE E ORGANIZZAZIONE DI UN PROGRAMMA DI SCREENING. Relatore: Brunella Spadafora
 PROGETTAZIONE E ORGANIZZAZIONE DI UN PROGRAMMA DI SCREENING Relatore: Brunella Spadafora Epidemiologia e prevenzione dei tumori maligni I tumori nel loro insieme, costituiscono la seconda causa di morte,
PROGETTAZIONE E ORGANIZZAZIONE DI UN PROGRAMMA DI SCREENING Relatore: Brunella Spadafora Epidemiologia e prevenzione dei tumori maligni I tumori nel loro insieme, costituiscono la seconda causa di morte,
Dalla Diagnostica per Immagini all Imaging Molecolare
 Dalla Diagnostica per Immagini all Imaging Molecolare L imaging Molecolare è l insieme di metodiche che consentono di ottenere contemporaneamente informazioni morfologiche e funzionali per la caratterizzazione
Dalla Diagnostica per Immagini all Imaging Molecolare L imaging Molecolare è l insieme di metodiche che consentono di ottenere contemporaneamente informazioni morfologiche e funzionali per la caratterizzazione
NUOVI SCREENING: UNA RIVOLUZIONE?
 NUOVI SCREENING: UNA RIVOLUZIONE? Nuovi programmi di screening Montale, 18 Ottobre 2014 Villa Castello Smilea HPV E CARCINOMA CERVICALE L infezione da HPV è un passaggio essenziale per lo sviluppo delle
NUOVI SCREENING: UNA RIVOLUZIONE? Nuovi programmi di screening Montale, 18 Ottobre 2014 Villa Castello Smilea HPV E CARCINOMA CERVICALE L infezione da HPV è un passaggio essenziale per lo sviluppo delle
MANUALE DELLA QUALITÀ SIF CAPITOLO 08 (ED. 01) MISURAZIONI, ANALISI E MIGLIORAMENTO
 INDICE 8.1 Generalità 8.2 Monitoraggi e Misurazione 8.2.1 Soddisfazione del cliente 8.2.2 Verifiche Ispettive Interne 8.2.3 Monitoraggio e misurazione dei processi 8.2.4 Monitoraggio e misurazione dei
INDICE 8.1 Generalità 8.2 Monitoraggi e Misurazione 8.2.1 Soddisfazione del cliente 8.2.2 Verifiche Ispettive Interne 8.2.3 Monitoraggio e misurazione dei processi 8.2.4 Monitoraggio e misurazione dei
RUOLO DEL TRAPIANTO NEL PAZIENTE CON MIELOMA MULTIPLO
 RUOLO DEL TRAPIANTO NEL PAZIENTE CON MIELOMA MULTIPLO Nicola Giuliani U. O. Ematologia e CTMO, Azienda Ospedaliero-Universitaria di Parma MM-EPIDEMIOLOGIA 10% di tutti i tumori del sangue Malattia dell
RUOLO DEL TRAPIANTO NEL PAZIENTE CON MIELOMA MULTIPLO Nicola Giuliani U. O. Ematologia e CTMO, Azienda Ospedaliero-Universitaria di Parma MM-EPIDEMIOLOGIA 10% di tutti i tumori del sangue Malattia dell
UNITÁ OPERATIVA DI PSICOLOGIA OSPEDALIERA DIPARTIMENTO ONCOLOGICO
 UNITÁ OPERATIVA DI PSICOLOGIA OSPEDALIERA DIPARTIMENTO ONCOLOGICO 1/7 Attività L unità operativa di Psicologia Ospedaliera assicura interventi psicologici per: 1. Garantire, quando richiesto, il supporto
UNITÁ OPERATIVA DI PSICOLOGIA OSPEDALIERA DIPARTIMENTO ONCOLOGICO 1/7 Attività L unità operativa di Psicologia Ospedaliera assicura interventi psicologici per: 1. Garantire, quando richiesto, il supporto
Dal 2000, con la perdita dei brevetti di importanti principi attivi, abbiamo assistito ad un controllo della spesa territoriale italiana.
 Dal 2000, con la perdita dei brevetti di importanti principi attivi, abbiamo assistito ad un controllo della spesa territoriale italiana. Le scadenze brevettuali sono aumentate dal 2000 ad 2008 ma dopo
Dal 2000, con la perdita dei brevetti di importanti principi attivi, abbiamo assistito ad un controllo della spesa territoriale italiana. Le scadenze brevettuali sono aumentate dal 2000 ad 2008 ma dopo
Il paziente e la ricerca: cosa sapere
 Il paziente e la ricerca: cosa sapere 1 Perché è importante la ricerca? Negli ultimi decenni la ricerca scientifica ha conseguito importanti risultati nella lotta contro i tumori. La qualità e l eccellenza
Il paziente e la ricerca: cosa sapere 1 Perché è importante la ricerca? Negli ultimi decenni la ricerca scientifica ha conseguito importanti risultati nella lotta contro i tumori. La qualità e l eccellenza
