Termodinamica. Studia il bilancio energetico di sistemi fisici nel modo più generale, compresi scambi di energia non meccanici (calore).
|
|
|
- Faustino Berardino
- 6 anni fa
- Visualizzazioni
Transcript
1 ermodinamia Studia il bilanio energetio di sistemi fisii nel modo iù generale, omresi sambi di energia non meanii (alore). NC In meania E M E K E P L energia meania si onserva se le forze sono onservative L eserienza quotidiana mostra forze non onservative. Le forze fondamentali sono onservative. Com è ossibile? Esemio: urto fra due ontenitori ontenenti diverse artielle. PRIM DOPO isione mirosoia isione marosoia. In un oro marosoio il numero di atomi/moleole è dell ordine del numero di vogadro: N Effetto di risoluzione: inaaità/imossibilità di osservare a livello mirosoio. Ma la D si è sviluata indiendentemente da onsiderazioni mirosoihe.
2 Definizioni Sistema termodinamio Porzione del mondo oggetto di osservazione. Formato da una o iù arti. mbiente utto iò on ui interagise il sistema. Contribuise alla evoluzione del sistema. Sistema + mbiente = Universo ermodinamio sistema aerto sambia massa ed energia sistema hiuso sambia solo energia sistema isolato nessuno sambio L Universo ermodinamio si onsidera un sistema isolato. In ermodinamia interessano sorattutto gli sambi di energia
3 Desrizione di un sistema ermodinamio Lo stato di un sistema è desritto da un iolo numero di grandezze fisihe misurabili, marosoihe, dette ariabili ermodinamihe ariabili estensive:, m, U, S... additive. d es. SIS k k ariabili intensive:, r,,... definite loalmente, unto er unto io e numero di variabili diendono dal sistema gas ideale due gas ideali se il setto he seara i due gas è mobile senza attrito, in equilibrio 1 Uno Stato ermodinamio (marostato) orrisonde a molti stati mirosoii (mirostati)
4 Desrizione di un sistema ermodinamio Equilibrio ermodinamio: equilibrio meanio equilibrio termio, (equilibrio himio) Equilibrio fra le arti del sistema Equilibrio fra sistema e ambiente equilibrio di forze e momenti (tutte le arti in quiete) non è sambio di alore ll equilibrio le variabili D sono legate da una equazione di stato er gas ideale f (,, ) 0 eriò una variabile si uò eliminare Lo stato di un sistema termodinamio si uò raresentare ome un unto in un oortuno sazio delle variabili D nel aso di un gas ideale bastano variabili Se lo stato del sistema ambia, è una trasformazione termodinamia
5 Pressione (grandezza salare, intensiva) S 678 N S mg S 678 S N S' mg S F mg Preisazioni mg S F mg N S mg F sin S mg mg F N S Comonente Normale Suerfiie della Forza F N S N m kg ms Pa ltre unità omuni: 1bar=10 5 Pa, mb Pressione atmosferia standard: Pa (er noi sarà semre 0 )
6 ltra rorietà è l isotroia. La ressione non diende dall orientazione Pressione in un fluido in equilibrio Un fluido in equilibrio eserita forze soltanto normali sulle suerfii on ui è a ontatto (ressione). Si uò rendere ome definizione di fluido. F S vuoto In assenza di forze di volume (es. gravità) la ressione di un fluido in equilibrio è omogenea. In resenza di gravità la ressione diende dalla quota. In un fluido omogeneo: 0 r g y Legge di Stevino y è la quota: oordinata lungo un asse vertiale orientato in su Se la densità r è iola (ad es. in un gas), in un reiiente di dimensioni ordinarie rgy << 0. Si assumerà semre ressione uniforme in tutto il volume del gas. Es. aria a s.t.. e y=1m 1Pa iola risetto a 0 ~ 10 5 Pa
7 Equilibrio termio e emeratura Priniio dell equilibrio termio (o Priniio zero della D): se i sistemi e sono in equilibrio termio on il sistema C, allora e sono in equilibrio termio fra loro. definizione in aarenza banale, he onsente di definire la temeratura (giustifia l uso del termometro) C C Due sistemi (o arti di un sistema) in equilibrio D hanno la stessa temeratura arete a meno he non siano searati da una arete «imenetrabile al alore», he imedise il raggiungimento dell equilibrio (si ensi al thermos). in tal aso e sono termiamente isolati e la arete si die adiabatia (dal greo adiàbatos: imenetrabile) una arete he ermette sambi di alore si die diatermia
8 emeratura. Definizione oerativa Si sfruttano le rorietà termometrihe di aluni ori (variazioni di volume, di resistenza elettria, di ressione e.) se una grandezza fisia X diende dalla temeratura (aratteristia termometria), è ossibile utilizzarla er misurare la temeratura seondo la funzione termometria (X) si seglie una sostanza he sia faile ortare in uno stato di temeratura ben definito: Punto rilo dell aqua: P 73,16 P 611 Pa K valore fissato er definizione se la rorietà termometria al unto trilo vale X P e alla temeratura «inognita» vale X, si assume he P X X P quindi P X X P è la temeratura emiria ermometri (emirii) diversi ossono dare temerature diverse. ltre sale: Celsius t( C) ( K) t = 0 C è la temeratura di fusione del ghiaio a ressione atmosferia standard.
9 Sambi di energia Un sistema termodinamio hiuso uò ortarsi in equilibrio on l ambiente mediante sambi di energia gas sotto forma di lavoro gas sotto forma di alore (forma disordinata) Definizione: alore è l energia sambiata da un sistema D hiuso in forma diversa dal lavoro
10 Sistemi diabatii. Eserienza di Joule Si uò omiere lavoro su un sistema in molti modi. on un sistema di alette rotanti omrimendo un volume di gas ontenuto nel reiiente sfregando ori fra i quali si eserita attrito lavoro er mantenere una orrente elettria (resistenza) e. Se EX >0 si osserva un risaldamento del sistema ( a on > ) diende uniamente dal lavoro omiuto, EX, non dal modo EX reiiente adiabatio iù esattamente, diende solo dallo stato iniziale e dallo stato finale, non da ome i si arriva. Ciò onsente di definire una «funzione dello stato termodinamio»: U EX SIS U U SIS U è l energia interna del sistema, ioè l energia mirosoia non onsidereremo arti marosoihe in movimento negli stati iniziale e finale.
11 Sistemi diabatii. Eserienza di Joule Meania ermodinamia y 1 1 il lavoro non diende dal erorso ma solo dalla osizione iniziale e finale si uò definire una funzione della osizione E P (x,y) tale he E P E P, EX E P definita a meno di una ostante additiva x il lavoro non diende dalla trasformazione D ma solo dallo stato D iniziale e finale si uò definire una funzione dello stato termodinamio U(,,...) tale he U, EX se E K =0 U definita a meno di una ostante additiva
12 Sistemi non adiabatii. Primo Priniio. se il sistema D subise una trasformazione adiabatia a U U U se si uò ortare il sistema da a senza lavoro, mettendolo a ontatto on una sorgente a temeratura diversa, U vale semre U U U si die he il sistema ha sambiato alore U [U]=[]=[]=J E questa la definizione di alore sambiato e della «equivalenza alore-lavoro». In generale, quando il sistema sambia sia lavoro meanio he alore, si trova he: non diende dalla trasformazione ma solo dallo stato iniziale e finale U 1 Priniio della ermodinamia
13 1 Priniio della ermodinamia Preisazioni Energia sambiata on l ambiente sotto forma di lavoro Diende dalla trasformazione Energia sambiata on l ambiente in forma mirosoia, disordinata Diende dalla trasformazione U E funzione dello stato termodinamio del sistema. Nello stato U=U() Se il sistema assa dallo stato allo stato, non imorta ome, U ha semre lo stesso valore U=U -U L energia fornita al sistema ome o è immagazzinata ome U e uò essere riutilizzata (in riniio, ma entro erti limiti, v. Priniio) E definita a meno di una ostante additiva In una trasformazione D ( a ) U = U -U erhé U non diende dal roesso Invee e diendono dal roesso (non si srive,!)
14 1 Priniio della ermodinamia Preisazioni Convenzione sui segni. Sistema >0 >0 U Entrante Usente : alore assorbito dal sistema (>0 se il sistema assorbe alore, <0 se lo ede) : lavoro omiuto dal sistema ( ha il segno del lavoro omiuto dal sistema. Ha segno oosto al lavoro omiuto dall ambiente sul sistema) U EX in una trasformazione a U U U non si uò arlare di ontenuto di alore o lavoro Il 1 Priniio della D esrime la onservazione dell energia nel modo iù generale
15 rasformazioni ermodinamihe Generalità dal 1 Priniio. e diendono dal roesso (1) (1) () () (3) (3) 1 U diende solo dagli stati iniziale e finale U (1) U () U (3) U U 3 ovvero: (1) (1) () () (3) (3) U non diende dalla artiolare trasformazione da a, ma solo dallo stato iniziale e finale e invee diendono dalla seifia trasformazione rasformazione infinitesima. du d d du du è differenziale esatto: du U U basta onosere gli stati estremi, rasf, rasf Non si srive mai!
16 rasformazioni ermodinamihe Preisazione degli obiettivi Si tratteranno solo stati di equilibrio iniziale e finale: la trasformazione ollega stati di equilibrio. Il temo non omare ( è tutto il temo he serve) Dal unto di vista dell equilibrio D le trasformazioni si dividono in 1. rasformazioni di quasi equilibrio o quasi statihe. roedono er stati di (quasi) equilibrio Si raresentano on linee ontinue nello sazio delle oordinate termodinamihe 1 1. rasformazioni reversibili. 3 sono rasformazioni uasi-statihe in ui non agisono forze dissiative ossono essere erorse in senso inverso, attraversando esattamente gli stessi stati intermedi.. rasformazioni non quasi-statihe. Gli stadi intermedi non sono di equilibrio. Non è ossibile raresentarle on una linea nello sazio delle oordinate termodinamihe (le variabili D non sono definite nelle fasi intermedie) In un grafio si raresenta on una linea tratteggiata
17 rasformazioni ermodinamihe rasformazioni Cilihe. U U U U 0 0 = In artiolare, se: >0 (alore assorbito) >0 (lavoro fatto: mahina termia) <0 (alore eduto) <0 (lavoro subito: mahina frigorifera) Nota: le mahine sono semre ilihe. rasformazioni diabatihe. Non è sambio di alore on l ambiente (Pareti adiabatihe, ovvero termiamente isolanti) U 0
18 Esemi 1. In una trasformazione termodinamia, =kj e =1.5kJ. Calolare la variazione di U.. Un gas si esande adiabatiamente, eseguento un lavoro =8MJ. Calolare la variazione di energia interna. 3. Un sistema subise una trasformazione (1) da a, on 1 =15kJ e 1 =13kJ. ale sistema viene riortato allo stato (trasf. ), edendo 18kJ sotto forma di alore. Calolare il lavoro del sistema nel ilo. [ 1-1 =-( - ) a = = -16kJ] 4. In un gas ideale l energia interna diende solo dalla temeratura: U=U(). In una tasformazione isoterma =50 J, quanto vale?
19 Calorimetria. Definizioni Un sistema è osto a ontatto termio on oggetti a temeratura diversa; si orta in equilibrio termio sambiando alore i f Caaità termia C: C C J K C In rima arossimazione C si uò onsiderare ostante ( è roorzionale a ) se C diende dalla temeratura: C d d f i C d
20 Calorimetria. Definizioni La aaità termia diende dalle dimensioni del sistema (un bloo di ferro di kg ha aaità doia di uno da 1kg. Caaità termia er unità di massa o alore seifio: i f 1 m C m m J kgk se = (): 1 m d d f m ( ) d i Poihé diende dal roesso iò vale anhe er. In artiolare: (distinzione imortante er i gas) 1 m d d ostante P 1 m d d ostante P P In generale, a ausa del lavoro di esansione termia (ma i sono eezioni) P er solidi e liquidi. I valori tabulati sono P (= M ).
21 Calorimetria Calori seifii di aluni solidi e liquidi aqua 15 C J/kgK ghiaio 0 C J/kgK alool etilio 0 C 40.0 J/kgK ferro 0 C J/kgK Sesso, sorattutto on i gas, si utilizza il alore (seifio) molare: 1 n n J mol K se diende dalla temeratura: 1 n d d f n ( ) d i nhe qui si distinguono: 1 n d d P 1 n d d P
22 m m m m m m 0 Calorimetro. =0 =0 Reiiente adiabatio e rigido liazione del 1 Priniio: U U U U 0 U 0 F Sistema + Sistema Sistema Se,, solido o liquido iiamente uno dei ori è il liquido alorimetrio. termometro
23 13 Cambiamenti di stato. Calori latenti Proessi isotermi e isobari. Sono aratterizzati da un alore latente l ml [l]=j/kg l è «grande»: un ambiamento di stato rihiede (o libera) molta energia. Per l aqua: l l FUS P J J kg kg a a 73K 373K l P >> l FUS anhe sublimazione l P raresenta l energia neessaria er romere i legami fra le moleole. Diende debolmente dalla temeratura. Sorgente di alore: Oggetto in grado di sambiare alore senza variare la sua temeratura. In ratia: serbatoio di aaità termia infinita sostanza in transizione di fase. basta he sia ostante durante la trasformazione
24 Diagrammi di fase P, P Isoterme S S L L PC G Solido Liquido PC Gas L - L S - P aore Punto trilo Punto ritio Per l aqua: K Pa g/m 3 (L) mg/m 3 () K.604 MPa 3 kg/m 3
25 Un ezzo di ferro di 0.5 kg, on temeratura iniziale 400 C è messo in un alorimetro ideale,ontenente kg di aqua a 0 C. Calolare la temeratura di equilibrio (C Fe = 448 J/kg/K) [9.9 C] Un amione di 0.5kg di un erto materiale, inizialmente a 400 C è osto in un alorimetro ideale ontenente kg di aqua a 0 C. Se la temeratura finale è di 3 C, quanto vale il alore seifio del materiale? [546 J/kg/K] In 1.0 kg di aqua a 5 C si mettono 50g di ghiaio alla temeratura di fusione. Calolare la temeratura finale (doo he si è siolto tutto il ghiaio). [0.0 C] In 1.0 kg di aqua a 5 C si mettono 400g di ghiaio alla temeratura di fusione. Calolare lo stato di equilibrio finale se il sistema è isolato. [0 C, restano 87g di ghiaio] (se si siogliesse tutto si troverebbe = C)
26 Lavoro in una trasformazione termodinamia in U è il lavoro omiuto dal sistema ontro l esterno. (nel senso del segno) Calolo del lavoro si suonga he il tratto di suerfiie d si sosti di ds F ds F d F ds ds os d suorremo he il lavoro sia semre legato ad una variazione di volume Estendendo a tutta la suerfiie: d d se la ressione è uniforme su tutta la suerfiie d d 0 0 d d 0 0 esansione omressione ressione del sistema d variaz. di volume del sistema
27 1. Caso di rasformazione quasi-statia Lavoro in una trasformazione termodinamia rasformazione di quasi equilibrio: la ressione è definita ovunque, quindi ha senso integrare g,g SIS d rasformazione ilia 1 Signifiato nel iano - o di Claeyron in questo aso > 0; <0 se la trasformazione fosse da ad. Il lavoro è raresentato dall area del ilo nel iano 0 0, 1 verso orario: > 0 verso antiorario: < 0, on, 1,
28 Lavoro in una trasformazione quasistatia. Esemi rasf., di quasi equilibrio seondo la legge k C on k=8.1 bar. m -3/ C=50l Saendo he: =1l, =30K, =30l alolare il lavoro d k 3 3/ C 506J
29 Lavoro in una trasformazione. Lavoro esterno e lavoro del sistema. il lavoro omiuto dal sistema è oosto a quello omiuto dall esterno sul sistema, ome è evidente in una trasformazione quasi-statia, SIS SISd EXd, EX, g, g. Caso di rasformazione NON quasi-statia d, SIS SIS non è alolabile ( SIS non è nemmeno definita)...,g tuttavia uò essere alolabile,ex :, SIS, EX EX,g P d SIS In altri asi SIS si uò riavare dal 1 Priniio della D, se onosiamo U e
30 Lavoro in una trasformazione termodinamia Un gas è ontenuto in un ilindro di volume iniziale 0.056m 3, alla ressione di,0bar. ll imrovviso il gas è lasiato libero di esandersi ontro una ressione esterna P EX =1,0bar. Calolare il lavoro omiuto dal gas nell esansione, saendo he il volume finale è di 0.11m kj EX d EX 6, g
31 P in C P0 (1 t) P ostante L. olta-gay Lussa (1 t) 0 P ostante L. olta -Gay Lussa 0 Gas Ideale (Gas erfetto) 1 t C 1 t 0 0 t 0 0 P ost ostante Legge di oyle t 0 temeratura in Kelvin n M numero di moli Legge di vogadro: olume di una mole di gas ideale (stessa, ) olumi uguali di gas (ideali) diversi, alla stessa ressione e temeratura, ontengono lo stesso numero di moleole. mole: unità fondamentale (quantità di materia) numero di atomi ontenuti in 1g di 1 C Numero di massa: unità di massa atomia: m U = kg massa moleolare: m=m U n M g g N moleole / mole m U numero di moli
32 Equazione di stato del gas ideale in alternativa: P nr P r R R = P 0 0m / 0 = J/K mole è la ostante dei gas. k=r/n = J/K è la ostante di oltzmann il gas erfetto è una sostanza termometria ideale. Es. ermometro a gas ideale a olume ostante: gas ideale h P=0 0 0 Il gas reale non è erfettamente ideale, eriò si deve estraolare er P a 0. lim P0 P P P P r Hg gh La temeratura del gas ideale oinide on la emeratura ermodinamia assoluta.
33 Eserienza di Joule-homson: Esansione libera di un gas ideale Reiiente adiabatio e rigido (sistema isolato) Energia interna di un gas ideale Gas vuoto termometro liquido del alorimetro L G L L L G G G 0 0 erhé U Liquido + Gas Liquido alorimetrio G L 0 m L L L gas ideale Osservazione serimentale: 0 U(, ) se il gas è ideale L =0 liazione del 1 Priniio alla trasformazione. U(, ) U U non diende da né da ma solo da Risultato valido er un gas ideale. Non aliabile in genere ad altri sistemi. Controesemio: misela liquido vaore (ambiamento di fase).
34 Energia interna di un gas Ideale Conseguenze dell eserienza di J- C isoora rasformazione generia suddivisa in C + C isoterma U U U C C uindi er ogni trasformazione di un gas ideale U 0 n C U U C n C (U è funzione di stato) (olume ostante) (eserimento J-) du n d nessun limite sul tio di trasformazione limite sul sistema in una trasformazione isobara: Relazione di Mayer er i alori molari d du d P R n P d n d d n d nrd g P 1
35 Dal riniio di equiartizione dell energia (eoria inetia lassia dei gas) si riava: gas monoatomii gas biatomii Calori molari dei gas ideali 3 5 R R 1.5 J/mol/K 0.8 J/mol/K uesti alori molari non diendono dalla temeratura. uttavia si tratta di un risultato arossimativo (ignora la natura quantistia del fenomeno). In ratia: P P 5 7 R R 5 g g C gas monoatomii (0 C) He 1.8 J/mol/K r 1.7 J/mol/K C gas biatomii (0 C) H N O 0.4 J/mol/K 0.8 J/mol/K 1.0 J/mol/K H H C gas triatomii (0 C) CO O O 8.5 J/mol/K 5.4 J/mol/K 6.3 J/mol/K 40 C 100 C In genere = (), in artiolare er i gas oliatomii uando non è seifiato, si assumeranno i valori dati sora er gas ideali mono- e bi-atomii. Problema. Per l aria sea si ha: =0.717J/g/K P =1.005J/g/K. Mostrare he è un gas biatomio e riavarne la massa molare (media). g =1.40: biatomio. M =.5R a M=9.0 (vero: 8.96)
36 rasformazioni di un Gas Ideale rasformazione a olume ostante o Isoora linea ontinua se trasf. quasi statia 0 U n he si tratti di una trasformazione quasi-statia o meno dall equazione di stato: nr nr nr
37 rasformazioni di un Gas Ideale rasformazione a ressione ostante, o Isobara linea ontinua se quasi statia np U n nr er definizione di P er ogni trasf. di un gas ideale dal 1 Priniio della D U n P n nr ome nel aso quasi-statio nr nr il risultato non diende dalla ondizione di quasi-equilibrio
38 rasformazioni di un Gas Ideale rasformazione a temeratura ostante, o Isoterma U n 0 er ogni trasf. di un gas ideale il lavoro del sistema è ari al alore assorbito Se l isoterma è quasi statia P è nota in ogni stadio intermedio: si uò integrare usando l equazione di stato d nr d nr ln nr ln se la trasformazione non è quasi-statia servono altre informazioni, ad es. il lavoro delle forze esterne. Il lavoro omiuto è massimo in ondizioni quasi-statihe.
39 rasformazione diabatia rasformazioni di un Gas Ideale 0 U n iù riida delle isoterme Esansione: >0 U<0 <0 omressione <0 U>0 >0 diabatia reversibile du n d d nr d d P R g 1 d g ost g 1 ost (1 g ) / g ost
40 rasformazioni ilihe U 0 >0 mahina termia (ilo orario) <0 mahina frigorifera (ilo antiorario) Lo stesso ilo uò aratterizzare sia una mahina termia he una frigorifera seondo il verso di erorrenza (urhé il ilo sia REERSIILE) Searando i tratti in ui d > 0 (d > 0) dagli altri si uò alolare il alore assorbito omlessivo ( ) e il alore totale eduto ( C ). C e C C 1 1 >0 <0 C Definizione: rendimento di una Mahina ermina (0<<1) (v.)
41 rasformazioni ilihe reversibili (gas ideale) Risultati validi er ogni sistema termodinamio (v. P.) Calolo esliito er un gas ideale Cilo di Carnot Mahina termia 1 C = + C >0 > 1 D C 1 : esansione isoterma. C: esansione adiabatia. CD: omressione isoterma. D: omressione adiabatia. C CD U CD U C D nr nr n n 1 ln ln 1 / D 1 / C (=0) C (=0) alla tem. alla tem. 1
42 lavoro nel ilo: nr rasformazioni ilihe reversibili (gas ideale) Cilo di Carnot C CD / n nr ln n D ln 1 1 D / C 1 C: D: g 1 g 1 1 C g 1 g 1 1 D faendo il raorto: D C rendimento: C 1 1 D C 1 ln( ln( / / ) ) Diende solo dalle temerature on ui la mahina sambia alore questo risultato diende soltanto dall iotesi he il ilo sia reversibile (v. Priniio)
43 rasformazioni ilihe reversibili (gas ideale) 1 D C : esansione isoterma. C: raffreddamento isooro. CD: omressione isoterma. D: risaldamento isooro. C CD D 0 0 CD Cilo di Stirling C D nr nr n 1 n ln ln 1 D C 1 C e questi? 1 1 D C 1 ln( ln( / / ) ) 1 ome il ilo di Carnot. Non è un aso vedremo he questo è il rendimento di ogni mahina termia reversibile he lavora fra le stesse temerature 1 e (eorema di Carnot, v. Priniio)
44 Mahina Frigorifera Cilo di Carnot (reversibile) on gas ideale. C 1 1 D C : omressione isoterma. D: esansione adiabatia. DC: esansione isoterma. C: omressione adiabatia. D DC C U DC U D C nr nr n n 1 1 ln ln / C 1 / D C alla tem. alla tem. 1 effiienza: (Nota: uò essere > 1) C 1 1
Applicazione del principio di conservazione dell energia a sistemi aventi un gran numero di particelle.
 PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
Termometria e calorimetria
 ermometria e alorimetria Priniio zero della termodinamia: 2 ori, e, a temerature differenti ( < ) osti a ontatto raggiungono l equilibrio termio. Se e sono in equilibrio termio on un terzo oro C allora
ermometria e alorimetria Priniio zero della termodinamia: 2 ori, e, a temerature differenti ( < ) osti a ontatto raggiungono l equilibrio termio. Se e sono in equilibrio termio on un terzo oro C allora
Impianti di Propulsione Navale
 A/A 2011/12 orso di: Imianti di Proulsione Naale rihiami di termodinamia e mahine Sistema hiuso a) sistema isolato b) sistema rigido ) sistema adiabatio IPN027 Sistema aerto IPN028 I rinii termodinamia
A/A 2011/12 orso di: Imianti di Proulsione Naale rihiami di termodinamia e mahine Sistema hiuso a) sistema isolato b) sistema rigido ) sistema adiabatio IPN027 Sistema aerto IPN028 I rinii termodinamia
Primo principio della termodinamica
 Primo riniio della termodinamia Priniio di equivalenza Due ori a temeratura diversa, in ontatto, raggiungono l'equilibrio termio Durante il ontatto, il "alore" si trasferise dal oro iù aldo al oro iù freddo
Primo riniio della termodinamia Priniio di equivalenza Due ori a temeratura diversa, in ontatto, raggiungono l'equilibrio termio Durante il ontatto, il "alore" si trasferise dal oro iù aldo al oro iù freddo
Lezione 10 Termodinamica
 rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
pdv + p ponendo v T v p
 Nel aso artiolare in i δl sia esresso in fnzione delle oordinate e, è er trasformazione internamente reersibile ari a : δl d laoro di ariazione di olme, essendo d d d esso si ò osì esrimere δl d d onendo
Nel aso artiolare in i δl sia esresso in fnzione delle oordinate e, è er trasformazione internamente reersibile ari a : δl d laoro di ariazione di olme, essendo d d d esso si ò osì esrimere δl d d onendo
ESERCIZI SUL BILANCIO TERMICO DEI GENERATORI E DEGLI ACCUMULI
 ESERCIZI SUL BILANCIO TERMICO DEI GENERATORI E DEGLI ACCUMULI FORMULARIO DI RIEPILOGO Tabella 0.1 Poteri alorifii di aluni ombustibili. PCI [MJ/kg] PCS [MJ/kg] Petrolio greggio 41,9 44,8 Benzina er auto
ESERCIZI SUL BILANCIO TERMICO DEI GENERATORI E DEGLI ACCUMULI FORMULARIO DI RIEPILOGO Tabella 0.1 Poteri alorifii di aluni ombustibili. PCI [MJ/kg] PCS [MJ/kg] Petrolio greggio 41,9 44,8 Benzina er auto
Esercizi svolti di termodinamica applicata
 0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
Legge del gas perfetto e termodinamica
 Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Termologia. Paolo Bagnaia - CTF Esercizi di termologia e termodinamica 1
 ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
CHIMICA FISICA I. Le leggi dei gas
 A.A. 2014-2015 Corso di Laurea in CHIMICA INDUSTRIALE CHIMICA FISICA I Le leggi dei gas Lezioni di Chimia Fisia I A.A. 2014-2015 Leggi dei gas - Pagina 1 Un sistema ostituito da un gas puro si omporta
A.A. 2014-2015 Corso di Laurea in CHIMICA INDUSTRIALE CHIMICA FISICA I Le leggi dei gas Lezioni di Chimia Fisia I A.A. 2014-2015 Leggi dei gas - Pagina 1 Un sistema ostituito da un gas puro si omporta
GRANDEZZE OPERATIVE DELLE MACCHINE OPERANTI CON FLUIDI COMPRIMIBILI
 CAPITOLO 6 GRANDEZZE OPERATIVE DELLE MACCHINE OPERANTI CON FLUIDI COMPRIMIBILI 6.) Lavori, rendimenti e otenze. Sviluando i termini ontenuti nell'equazione dell'energia (3.) e indiando on i edii "" e ""
CAPITOLO 6 GRANDEZZE OPERATIVE DELLE MACCHINE OPERANTI CON FLUIDI COMPRIMIBILI 6.) Lavori, rendimenti e otenze. Sviluando i termini ontenuti nell'equazione dell'energia (3.) e indiando on i edii "" e ""
CALDAIA A CONDENSAZIONE. Il rendimento termico di una caldaia, con riferimento al potere calorifico inferiore LHV, può essere espresso come:
 CALDAIA A CONDENSAZIONE Il rendimento termio di una aldaia, on riferimento al otere alorifio inferiore, uò essere esresso ome: i d dove i, e d raresentano le otenze erse er unità di otenza messa a disosizione
CALDAIA A CONDENSAZIONE Il rendimento termio di una aldaia, on riferimento al otere alorifio inferiore, uò essere esresso ome: i d dove i, e d raresentano le otenze erse er unità di otenza messa a disosizione
Processi irreversibili
 Proessi irreversibili a nostra esperienza quotidiana è segnata da una moltitudine di proessi irreversibili, he ioè avvengono spontaneamente in una sola direzione e non possono essere riprodotti uguali
Proessi irreversibili a nostra esperienza quotidiana è segnata da una moltitudine di proessi irreversibili, he ioè avvengono spontaneamente in una sola direzione e non possono essere riprodotti uguali
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: dv dp. dv dt. nrt dt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
LAVORO DI UN GAS. Espansione di un gas a pressione costante V A V B
 LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
D.E.TE.C. Corso di Termofluidodinamica Prof. Luigi de Luca TERMODINAMICA
 ERMODINAMICA La termodinamia è una arte della fisia he rientra nello studio della meania: studia il omortamento della materia, sia essa allo stato solido, liquido o gassoso. Noi i oueremo dei fluidi, ossia
ERMODINAMICA La termodinamia è una arte della fisia he rientra nello studio della meania: studia il omortamento della materia, sia essa allo stato solido, liquido o gassoso. Noi i oueremo dei fluidi, ossia
CALORE E TERMODI NAMI CA - PRI MO PRI NCI PI O
 CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
TERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la
 ERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la circonda e può influenzarne il comportamento ( ambiente
ERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la circonda e può influenzarne il comportamento ( ambiente
Esercizi sugli stati ed il diagramma entalpico dell'aria umida
 Esercizi sugli stati ed il diagramma entalico dell'aria umida CESARE MARIA JOPPOLO, STEFANO DE ANTONELLIS, LUCA MOLINAROLI DIPARTIMENTO DI ENERGIA POLITECNICO DI MILANO C. M. Joolo, S. De Antonellis, L.
Esercizi sugli stati ed il diagramma entalico dell'aria umida CESARE MARIA JOPPOLO, STEFANO DE ANTONELLIS, LUCA MOLINAROLI DIPARTIMENTO DI ENERGIA POLITECNICO DI MILANO C. M. Joolo, S. De Antonellis, L.
Dal modellino dei Gas perfetti alla Tecnologia del vuoto
 Dal modellino dei Gas erfetti alla ecnologia del vuoto Il gas erfetto è un modellino teorico che ermette di rogettare e dimensionare i sistemi da vuoto, arte tutto da P= Nk () (*) P ressione del gas, olume
Dal modellino dei Gas erfetti alla ecnologia del vuoto Il gas erfetto è un modellino teorico che ermette di rogettare e dimensionare i sistemi da vuoto, arte tutto da P= Nk () (*) P ressione del gas, olume
Consideriamo un gas ideale in equilibrio termodinamico alla pressione p 1. , contenuto in un volume V
 LEGGI DEI GS Per gas si intende un fluido rivo di forma o volume rorio e facilmente comrimibile in modo da conseguire notevoli variazioni di ressione e densità. Le variabili termodinamiche iù aroriate
LEGGI DEI GS Per gas si intende un fluido rivo di forma o volume rorio e facilmente comrimibile in modo da conseguire notevoli variazioni di ressione e densità. Le variabili termodinamiche iù aroriate
FISICA. V [10 3 m 3 ]
![FISICA. V [10 3 m 3 ] FISICA. V [10 3 m 3 ]](/thumbs/24/2838543.jpg) Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Fisica dell Atmosfera e del Clima
 Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
Il I principio della termodinamica. Calore, lavoro ed energia interna
 Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
SISTEMI E STATI TERMODINAMICI
 ittorio Mussino: vittorio.mussino@olito.it SISEMI E SI ERMODINMICI Nel corso di Fisica I (meccanica), si sono determinate le leggi che governano il moto dei sistemi di articelle (discreti e continui) e
ittorio Mussino: vittorio.mussino@olito.it SISEMI E SI ERMODINMICI Nel corso di Fisica I (meccanica), si sono determinate le leggi che governano il moto dei sistemi di articelle (discreti e continui) e
Peso atomico (meglio massa atomica)
 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Dilatazione termica. Effetti della T sui materiali e l ambiente. l=α l o t. A = 2 α A o t. α = coefficiente di dilatazione termica lineare
 Acroolis Atene Eretteo: sostituzione di armature in acciaio con strutture in itanio. Esemi di restauro negativo acciaio contro ferro sigillato in iombo. Recuero di restauri inoortuni con sostituzione mediante
Acroolis Atene Eretteo: sostituzione di armature in acciaio con strutture in itanio. Esemi di restauro negativo acciaio contro ferro sigillato in iombo. Recuero di restauri inoortuni con sostituzione mediante
Il primo principio della termodinamica
 Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Fondamenti di Meteorologia e Climatologia
 Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Formulario di Termodinamica
 Formulario di Termodinamica Punto triplo dell acqua: T triplo = 273.16 K. Conversione tra gradi Celsius e gradi Kelvin (temperatura assoluta): t( C) = T (K) 273.15 Conversione tra Caloria e Joule: 1 cal
Formulario di Termodinamica Punto triplo dell acqua: T triplo = 273.16 K. Conversione tra gradi Celsius e gradi Kelvin (temperatura assoluta): t( C) = T (K) 273.15 Conversione tra Caloria e Joule: 1 cal
Scrivere una relazione
 Srivere una relazione La relazione sull eserienza fatta in laboratorio deve essere sritta suonendo he hi la legge non saia osa avete fatto, non ensate he sarà il doente he vi ha seguito a orreggerla. Quindi
Srivere una relazione La relazione sull eserienza fatta in laboratorio deve essere sritta suonendo he hi la legge non saia osa avete fatto, non ensate he sarà il doente he vi ha seguito a orreggerla. Quindi
Laboratorio di Misure Fisiche per Scienze Biologiche
 Laboratorio di Misure Fisihe per Sienze Biologihe Nozioni di alorimetria e misura del alore speiio di una sostanza Rihiami di teoria (Ragozzino et al Fondamenti di Fisia) - Il onetto di temperatura. -
Laboratorio di Misure Fisihe per Sienze Biologihe Nozioni di alorimetria e misura del alore speiio di una sostanza Rihiami di teoria (Ragozzino et al Fondamenti di Fisia) - Il onetto di temperatura. -
Programma svolto a.s. 2015/2016. Materia: fisica
 Programma svolto a.s. 2015/2016 Classe: 4A Docente: Daniela Fadda Materia: fisica Dettagli programma Cinematica e dinamica: moto circolare uniforme (ripasso); moto armonico (ripasso); moto parabolico (ripasso);
Programma svolto a.s. 2015/2016 Classe: 4A Docente: Daniela Fadda Materia: fisica Dettagli programma Cinematica e dinamica: moto circolare uniforme (ripasso); moto armonico (ripasso); moto parabolico (ripasso);
TERMODINAMICA. Studia le trasformazioni dei sistemi in relazione agli scambi di calore e lavoro. GENERALITÀ SUI SISTEMI TERMODINAMICI
 TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
Enunciato di Kelvin-Plank
 ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
3. Le Trasformazioni Termodinamiche
 3. Le Trasformazioni Termodinamiche Lo stato termodinamico di un gas (perfetto) è determinato dalle sue variabili di stato: ressione, olume, Temperatura, n moli ffinché esse siano determinate è necessario
3. Le Trasformazioni Termodinamiche Lo stato termodinamico di un gas (perfetto) è determinato dalle sue variabili di stato: ressione, olume, Temperatura, n moli ffinché esse siano determinate è necessario
Impianto di pressurizzazione e condizionamento
 IMPIANTI E SISTEMI Disense del orso, versione 2014 Caitolo 9 Imianto di ressurizzazione e ondizionamento Caitolo 9 Imianto di ressurizzazione e ondizionamento Queste disense ossono essere liberamente sariate
IMPIANTI E SISTEMI Disense del orso, versione 2014 Caitolo 9 Imianto di ressurizzazione e ondizionamento Caitolo 9 Imianto di ressurizzazione e ondizionamento Queste disense ossono essere liberamente sariate
Scambiatori di calore
 Fisia enia G. Grazzini UNIVERSIA DI FIRENZE Sambiatori di alore Con il termine sambiatori di alore indihiamo una apparehiatura in ui si ha trasmissione di alore da un luido ad un altro. In ampo termotenio
Fisia enia G. Grazzini UNIVERSIA DI FIRENZE Sambiatori di alore Con il termine sambiatori di alore indihiamo una apparehiatura in ui si ha trasmissione di alore da un luido ad un altro. In ampo termotenio
Primo principio della Termodinamica
 rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
5. Energia libera e potenziale chimico
 5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
A1. Soluzione. Ilcalore Q per unita di massa e negativo (ceduto all esterno) e vale:
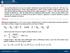 A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
6. I GAS IDEALI. 6.1 Il Gas perfetto
 6. I GAS IDEALI 6. Il Gas erfetto Il gas erfetto o ideale costituisce un modello astratto del comortamento dei gas cui tendono molti gas reali a ressioni rossime a quella atmosferica. Questo modello di
6. I GAS IDEALI 6. Il Gas erfetto Il gas erfetto o ideale costituisce un modello astratto del comortamento dei gas cui tendono molti gas reali a ressioni rossime a quella atmosferica. Questo modello di
Tonzig La fisica del calore
 0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
TEORIA CINETICA DEI GAS
 TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
L Q = 1. e nel ciclo di Carnot questo rendimento assume valore massimo pari a : η =
 CICLI ERMODINAMICI DIREI: Maccine termice Le maccine ce anno come scoo uello di trasformare ciclicamente in lavoro il calore disonibile da una sorgente termica sono dette maccine termice o motrici e il
CICLI ERMODINAMICI DIREI: Maccine termice Le maccine ce anno come scoo uello di trasformare ciclicamente in lavoro il calore disonibile da una sorgente termica sono dette maccine termice o motrici e il
Q Q. Energia scambiata per ciclo legata alle differenze di pressione ed al valore della pressione stessa. I Principio macchina CICLICA L = Q 12 -Q 34
 Fisia enia G. Grazzini UNIVERSIA DI FIRENZE Diagramma Indiatore Energia sambiata per ilo legata alle differenze di pressione ed al alore della pressione stessa. I Prinipio maina CICLICA L 2-34 L ε 2 Reersibilità
Fisia enia G. Grazzini UNIVERSIA DI FIRENZE Diagramma Indiatore Energia sambiata per ilo legata alle differenze di pressione ed al alore della pressione stessa. I Prinipio maina CICLICA L 2-34 L ε 2 Reersibilità
MOMENTI E CENTRAGGIO DEL VELIVOLO
 x 1 x ISTITUZIONI DI INGEGNERIA AEROSAZIALE OENTI E CENTRAGGIO VELIVOLO OENTI E CENTRAGGIO DEL VELIVOLO er il alolo delle prestazioni in volo orizzontale rettilineo ed uniforme, il velivolo può essere
x 1 x ISTITUZIONI DI INGEGNERIA AEROSAZIALE OENTI E CENTRAGGIO VELIVOLO OENTI E CENTRAGGIO DEL VELIVOLO er il alolo delle prestazioni in volo orizzontale rettilineo ed uniforme, il velivolo può essere
Appunti di Meccanica dei Fluidi M. Tregnaghi
 Aunti di Meccanica dei Fluidi 3. STATICA: PRESSIONE E LEE IDROSTATICA PRESSIONE IN UN PUNTO La ressione è il modulo della forza esercitata da un fluido er unità di suerficie che agisce in direzione normale
Aunti di Meccanica dei Fluidi 3. STATICA: PRESSIONE E LEE IDROSTATICA PRESSIONE IN UN PUNTO La ressione è il modulo della forza esercitata da un fluido er unità di suerficie che agisce in direzione normale
QUESITI DI FISICA RISOLTI A LEZIONE TERMODINAMICA
 QUESITI DI FISICA RISOLTI A LEZIONE TERMODINAMICA Un recipiente contiene gas perfetto a 27 o C, che si espande raggiungendo il doppio del suo volume iniziale a pressione costante. La temperatura finale
QUESITI DI FISICA RISOLTI A LEZIONE TERMODINAMICA Un recipiente contiene gas perfetto a 27 o C, che si espande raggiungendo il doppio del suo volume iniziale a pressione costante. La temperatura finale
Lezione 24 IL TEOREMA DI BERNOULLI
 unti dei corsi di Idraulica e Idrodinamica Lezione 4 IL TEOREM DI ERNOULLI Nella LEZIONE 3 abbiamo dedotto il teorema di ernoulli er le correnti fluide, artendo dall equazione del moto valida in tali circostanze.
unti dei corsi di Idraulica e Idrodinamica Lezione 4 IL TEOREM DI ERNOULLI Nella LEZIONE 3 abbiamo dedotto il teorema di ernoulli er le correnti fluide, artendo dall equazione del moto valida in tali circostanze.
Tre tipi di Sistema Un richiamo
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
Introduzione alla Chimica. Paolo Mazza
 Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
Idraulica e Idrologia: Lezione 12 Agenda del giorno
 Idraulica e Idrologia: Lezione genda del giorno Idrostatica: fluidi in quiete - Unità di misura er la ressione di un fluido - Pressione e rofondità - Princiio di rchimede: cori in un fluido Pg Fluido Cosa
Idraulica e Idrologia: Lezione genda del giorno Idrostatica: fluidi in quiete - Unità di misura er la ressione di un fluido - Pressione e rofondità - Princiio di rchimede: cori in un fluido Pg Fluido Cosa
9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI
 9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI 9. Introduzione I rocessi termodinamici che vengono realizzati nella ratica devono consentire la realizzazione di uno scambio di energia termica o di energia
9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI 9. Introduzione I rocessi termodinamici che vengono realizzati nella ratica devono consentire la realizzazione di uno scambio di energia termica o di energia
CAPITOLO 4 EQUAZIONI di CONSERVAZIONE
 CAPIOLO 4 EQUAZIONI di CONSERVAZIONE 4. Cassifiazione dee ahine Chiamasi mahina a sede di una trasformazione energetia oerante mediante uno o iù fuidi in azione dinamia o inematia; detti fuidi sono i ettori
CAPIOLO 4 EQUAZIONI di CONSERVAZIONE 4. Cassifiazione dee ahine Chiamasi mahina a sede di una trasformazione energetia oerante mediante uno o iù fuidi in azione dinamia o inematia; detti fuidi sono i ettori
FACOLTÀ DI INGEGNERIA. ESAME DI MECCANICA RAZIONALE Corso di Laurea in Ingegneria Meccanica PROF. A. PRÁSTARO 21/01/2013
 FACOLTÀ DI INGEGNERIA ESAME DI MECCANICA RAZIONALE Corso di Laurea in Ingegneria Meania PROF A PRÁSTARO /0/03 Fig Diso D, ruotante, on rihiamo elastio radiale in un piano vertiale π, e portatore di aria
FACOLTÀ DI INGEGNERIA ESAME DI MECCANICA RAZIONALE Corso di Laurea in Ingegneria Meania PROF A PRÁSTARO /0/03 Fig Diso D, ruotante, on rihiamo elastio radiale in un piano vertiale π, e portatore di aria
ESAME DI AMMISSIONE ALLA TERZA LICEO SCIENZE SPERIMENTALI: FISICA
 LICO CANTONAL DI LUGANO 2 SAM DI AMMISSION ALLA TRZA LICO SCINZ SRIMNTALI: FISICA COGNOM: NOM:...... RONINZA SCOLASTICA:. unti esercizi 1 2 3 TOT 18 4 3 25 unti fatti Nota SRCIZIO 1 Annerire o crociare
LICO CANTONAL DI LUGANO 2 SAM DI AMMISSION ALLA TRZA LICO SCINZ SRIMNTALI: FISICA COGNOM: NOM:...... RONINZA SCOLASTICA:. unti esercizi 1 2 3 TOT 18 4 3 25 unti fatti Nota SRCIZIO 1 Annerire o crociare
Fluido in movimento. Linee di flusso.
 Fluido in moimento. Linee di flusso. Raresentazione del moto di un fluido. Linea di flusso: linea in ogni unto tangente alla elocità del fluido; indica la direzione del flusso isualizzabili mediante filetti
Fluido in moimento. Linee di flusso. Raresentazione del moto di un fluido. Linea di flusso: linea in ogni unto tangente alla elocità del fluido; indica la direzione del flusso isualizzabili mediante filetti
1 bar = 10 Pa = 10 barie PRESSIONE PRESSIONE. N 10 dyn dyn. m 10 cm cm. Solido. Liquido. Gassoso. (pascal) m. kg 1000.
 STATI DI AGGREGAZIONE DELLA MATERIA Solido Liquido Gassoso Il coro ha volume e forma ben definiti Il coro ha volume ben definito, ma assume la forma del reciiente che lo contiene Il coro occua tutto lo
STATI DI AGGREGAZIONE DELLA MATERIA Solido Liquido Gassoso Il coro ha volume e forma ben definiti Il coro ha volume ben definito, ma assume la forma del reciiente che lo contiene Il coro occua tutto lo
ESERCIZI ESERCIZI. Macchine termiche Motori a combustione interna QUANTO?
 Mahine termihe Motori a ombustione interna QUANO? Una mahina termia produe 40 J a ilo, assorbendo 0 J di alore. Quanto alore viene disperso nell ambiente? 680 J@ QUANO? Una mahina termia ha un rendimento
Mahine termihe Motori a ombustione interna QUANO? Una mahina termia produe 40 J a ilo, assorbendo 0 J di alore. Quanto alore viene disperso nell ambiente? 680 J@ QUANO? Una mahina termia ha un rendimento
SCHEDA PER LO STUDENTE DETERMINAZIONE DELLA DENSITÀ DI UN LIQUIDO TRAMITE LA LEGGE DI STEVINO
 SCHEDA PER LO STUDENTE DETERMINAZIONE DELLA DENSITÀ DI UN LIQUIDO TRAMITE LA LEGGE DI STEVINO I Titolo dell eserienza N 3 DETERMINAZIONE DELLA DENSITÀ DI UN LIQUIDO ATTRAVERSO L APPLICAZIONE DELLA LEGGE
SCHEDA PER LO STUDENTE DETERMINAZIONE DELLA DENSITÀ DI UN LIQUIDO TRAMITE LA LEGGE DI STEVINO I Titolo dell eserienza N 3 DETERMINAZIONE DELLA DENSITÀ DI UN LIQUIDO ATTRAVERSO L APPLICAZIONE DELLA LEGGE
Fisica dei mezzi trasmissivi Prof. G. Macchiarella Prova del 28 Febbraio 2013
 Fisia dei mezzi trasmissivi Prof. G. Mahiarella Prova del 8 Febbraio 013 1 3 4 non srivere nella zona soprastante COGNOME E NOME MTRICO FIRM Eserizio 1 Un generatore, la ui tensione varia nel tempo ome
Fisia dei mezzi trasmissivi Prof. G. Mahiarella Prova del 8 Febbraio 013 1 3 4 non srivere nella zona soprastante COGNOME E NOME MTRICO FIRM Eserizio 1 Un generatore, la ui tensione varia nel tempo ome
Il calcolo vettoriale: ripasso della somma e delle differenza tra vettori; prodotto scalare; prodotto vettoriale.
 Anno scolastico: 2012-2013 Docente: Paola Carcano FISICA 2D Il calcolo vettoriale: ripasso della somma e delle differenza tra vettori; prodotto scalare; prodotto vettoriale. Le forze: le interazioni fondamentali;
Anno scolastico: 2012-2013 Docente: Paola Carcano FISICA 2D Il calcolo vettoriale: ripasso della somma e delle differenza tra vettori; prodotto scalare; prodotto vettoriale. Le forze: le interazioni fondamentali;
PRIMI ELEMENTI DI TERMODINAMICA. La termodinamica studia le leggi con cui i sistemi scambiano (cedono e ricevono) energia con l ambiente.
 PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
ESERCIZI ELEMENTARI DI FLUIDODINAMICA
 ISTITUZIONI I INGEGNERI EROSPZILE ESERCIZI ELEMENTRI I FLUIOINMIC ESERCIZI ELEMENTRI I FLUIOINMIC RICHIMI INTROUTTII Il fluido viene onsiderato ome un ontinuo, ossia vengono identifiate alune grandezze
ISTITUZIONI I INGEGNERI EROSPZILE ESERCIZI ELEMENTRI I FLUIOINMIC ESERCIZI ELEMENTRI I FLUIOINMIC RICHIMI INTROUTTII Il fluido viene onsiderato ome un ontinuo, ossia vengono identifiate alune grandezze
Esercitazione di Fisica Tecnica
 Anno Accademico 2016-2017 Prof. Ing. L. Maffei 1 Anno Accademico 2016-2017 - PARTE 1 Grandezze e unità di misura Consumi energetici 2 Grandezze e unità di misura 3 Convertire le seguenti misure usando
Anno Accademico 2016-2017 Prof. Ing. L. Maffei 1 Anno Accademico 2016-2017 - PARTE 1 Grandezze e unità di misura Consumi energetici 2 Grandezze e unità di misura 3 Convertire le seguenti misure usando
Termodinamica. Ireneo Kikic. DICAMP - SFLAB - University of Trieste
 ermodinamica Ireneo Kikic DIAM - FLAB - University of rieste IRENEO.KIKI@DIAM.UNI.I rimo principio della termodinamica alore e lavoro solo quando sono trasferiti tra i corpi Energia uò essere convertita
ermodinamica Ireneo Kikic DIAM - FLAB - University of rieste IRENEO.KIKI@DIAM.UNI.I rimo principio della termodinamica alore e lavoro solo quando sono trasferiti tra i corpi Energia uò essere convertita
Per quanto detto prima il fenomeno di svuotamento termina quando la pressione di ristagno è pari a:
 Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Problemi e domande d esame tratte dalle prove di accertamento in itinere degli anni precedenti
 Problemi e domande d esame tratte dalle prove di accertamento in itinere degli anni precedenti Problema 1 Un disco omogeneo di massa m=2 kg e raggio R= 0.3 m ruota in un piano orizzontale intorno all asse
Problemi e domande d esame tratte dalle prove di accertamento in itinere degli anni precedenti Problema 1 Un disco omogeneo di massa m=2 kg e raggio R= 0.3 m ruota in un piano orizzontale intorno all asse
È quella parte della termologia che studia le trasformazioni di calore in lavoro e viceversa.
 EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
Andrea Scozzari a.a Analisi di sensibilità
 Andrea Sozzari a.a. 2012-2013 Analisi di sensibilità 1 Problema di Massimo in forma generale ma 130 100 1,5 0,3 0,5, 27 21 15 16 0 regione ammissibile 2 Problema di Massimo in forma generale ma 130 100
Andrea Sozzari a.a. 2012-2013 Analisi di sensibilità 1 Problema di Massimo in forma generale ma 130 100 1,5 0,3 0,5, 27 21 15 16 0 regione ammissibile 2 Problema di Massimo in forma generale ma 130 100
INTRODUZIONE ALLA TERMODINAMICA. Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta
 INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
A.A Corso di GESTIONE DELLE RISORSE IDRICHE APPENDICE F LAMINAZIONE DELLE PIENE AD OPERA DEI SERBATOI
 A.A. 2000-2001 Corso di GESTIONE DELLE RISORSE IDRICHE APPENDICE F LAMINAZIONE DELLE PIENE AD OPERA DEI SERBATOI 1 LA LAMINAZIONE DELLE PIENE NEI SERBATOI Esistono essenzialmente tre tiologie di oere er
A.A. 2000-2001 Corso di GESTIONE DELLE RISORSE IDRICHE APPENDICE F LAMINAZIONE DELLE PIENE AD OPERA DEI SERBATOI 1 LA LAMINAZIONE DELLE PIENE NEI SERBATOI Esistono essenzialmente tre tiologie di oere er
Bilancio di energia: il Primo Principio della Termodinamica. Termodinamica dell Ingegneria Chimica
 Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Esercitazione 7. Soluzione. Il sistema è isolato, quindi l energia totale si conserva. Applicando il primo principio della termodinamica si ottiene:
 Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
b) Essendo p A V A = p C V C ne risulta T C = T A = 300 K.
 2.00 moli di un gas perfetto di volume V 1 = 3.50 m 3 e T 1 = 300 K possono espandersi fino a V 2 = 7.00 m 3 e T 2 = 300 K. Il processo è compiuto isotermicamente. Determinare: a) Il lavoro fatto dal gas;
2.00 moli di un gas perfetto di volume V 1 = 3.50 m 3 e T 1 = 300 K possono espandersi fino a V 2 = 7.00 m 3 e T 2 = 300 K. Il processo è compiuto isotermicamente. Determinare: a) Il lavoro fatto dal gas;
Corso di Laurea: INGEGNERIA INFORMATICA (classe 09) Insegnamento: n Lezione: Titolo: V M. Fig. 5.1 Schematizzazione di una macchina a fluido
 Corso di Laurea: INGEGNERIA INFORMATICA (lasse 09) Le equazioni del moto dei fluidi L equazione di onservazione dell energia in forma termodinamia V M Ω Ω Fig. 5. Shematizzazione di una mahina a fluido
Corso di Laurea: INGEGNERIA INFORMATICA (lasse 09) Le equazioni del moto dei fluidi L equazione di onservazione dell energia in forma termodinamia V M Ω Ω Fig. 5. Shematizzazione di una mahina a fluido
IL CICLO DI CARNOT. Scambi di energia durante il ciclo
 IL CICLO DI CNO Consideriamo un gas ideale, contenuto nel solito cilindro, che compie un ciclo di 4 trasformazioni reversibili (2 isoterme + 2 adiabatiche) rappresentate nel piano -p come in figura. cambi
IL CICLO DI CNO Consideriamo un gas ideale, contenuto nel solito cilindro, che compie un ciclo di 4 trasformazioni reversibili (2 isoterme + 2 adiabatiche) rappresentate nel piano -p come in figura. cambi
Equilibri in fase gassosa
 Equilibri in fase gassosa 1) Le seguenti reazioni hanno luogo in fase gassosa; srivere la ostante di equilibrio ed indiare: - se sono spontanee o no a ondizioni standard; - se sono favorite o sfavorite
Equilibri in fase gassosa 1) Le seguenti reazioni hanno luogo in fase gassosa; srivere la ostante di equilibrio ed indiare: - se sono spontanee o no a ondizioni standard; - se sono favorite o sfavorite
LA MATERIA ED I SUOI STATI
 LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
Moto Monodimensionale in Condotti
 Diartimento di Ingegneria Industriale Moto Monodimensionale in Condotti Fluido Comrimibile - eoria Fig a Fig B Fig. A Moti D Comrimibili- ermodinamica Scuola di Ingegneria Corso di e Macchine A.A. 3 4
Diartimento di Ingegneria Industriale Moto Monodimensionale in Condotti Fluido Comrimibile - eoria Fig a Fig B Fig. A Moti D Comrimibili- ermodinamica Scuola di Ingegneria Corso di e Macchine A.A. 3 4
Lezione n. 5. Entalpia. a volume costante a pressione costante Calorimetria differenziale Reazione esotermiche ed endotermiche Legge di Hess
 himica Fisica - himica e Tecnologia Farmaceutiche Lezione n. 5 Entalpia alorimetria a volume costante alorimetria a pressione costante alorimetria differenziale Reazione esotermiche ed endotermiche Legge
himica Fisica - himica e Tecnologia Farmaceutiche Lezione n. 5 Entalpia alorimetria a volume costante alorimetria a pressione costante alorimetria differenziale Reazione esotermiche ed endotermiche Legge
Corso di Termofluidodinamica
 Corso di Termofluidodinamica Modulo di Termodinamica Tecnica A.A. 2014-2015 - Esercizi di preparazione alla prima prova intermedia Problema N. 1 Un serbatoio deve essere dimensionato per contenere 200
Corso di Termofluidodinamica Modulo di Termodinamica Tecnica A.A. 2014-2015 - Esercizi di preparazione alla prima prova intermedia Problema N. 1 Un serbatoio deve essere dimensionato per contenere 200
Termodinamica classica
 Termodinamica classica sistema termodinamico: insieme di corpi di cui si studiano le proprieta fisiche macroscopiche e le loro variazioni nel tempo ambiente termodinamico: insieme dei corpi con cui il
Termodinamica classica sistema termodinamico: insieme di corpi di cui si studiano le proprieta fisiche macroscopiche e le loro variazioni nel tempo ambiente termodinamico: insieme dei corpi con cui il
FORMULARIO DI TERMODINAMICA
 Formularo d ermodnama e eora neta Pagna d 5 FORMURIO DI ERMODINMIC Denzone d alora: la CORI e' la quanttà d alore eduta da un grammo d aqua nel rareddars da 5.5 C a 4.5 C alla ressone d una atmosera alora
Formularo d ermodnama e eora neta Pagna d 5 FORMURIO DI ERMODINMIC Denzone d alora: la CORI e' la quanttà d alore eduta da un grammo d aqua nel rareddars da 5.5 C a 4.5 C alla ressone d una atmosera alora
Compito di Fisica Generale I mod. B, Corsi di Laurea in Fisica e in Astronomia, AA 2010/11. Cognome... Nome... Matricola n...
 22.06.2011 Compito di Fisica Generale I mod. B, Corsi di Laurea in Fisica e in Astronomia, AA 2010/11 Cognome... Nome... Matricola n... Esercizio 1. Si abbia un recipiente a pareti adiabatiche contenente
22.06.2011 Compito di Fisica Generale I mod. B, Corsi di Laurea in Fisica e in Astronomia, AA 2010/11 Cognome... Nome... Matricola n... Esercizio 1. Si abbia un recipiente a pareti adiabatiche contenente
Esercizi e Problemi di Termodinamica.
 Esercizi e Problemi di Termodinamica. Dr. Yves Gaspar March 18, 2009 1 Problemi sulla termologia e sull equilibrio termico. Problema 1. Un pezzetto di ghiaccio di massa m e alla temperatura di = 250K viene
Esercizi e Problemi di Termodinamica. Dr. Yves Gaspar March 18, 2009 1 Problemi sulla termologia e sull equilibrio termico. Problema 1. Un pezzetto di ghiaccio di massa m e alla temperatura di = 250K viene
UGELLO CONVERGENTE. Dai valori noti si ricava: = = e quindi il rapporto: p a
 UGELLO CONVERGENE. Si consideri un ugello convergente che scarica in ambiente ( a atm). Sono noti la temeratura di ristagno K, il diametro di uscita dell ugello D.m e la differenza di ressione tra monte
UGELLO CONVERGENE. Si consideri un ugello convergente che scarica in ambiente ( a atm). Sono noti la temeratura di ristagno K, il diametro di uscita dell ugello D.m e la differenza di ressione tra monte
Dipartimento di Scienze Chimiche. Ambiente. Sistema
 Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
COMPITO A. 4) Primo principio della termodinamica per sistemi chiusi ed aperti. 5)Teoremi di Carnot: enunciati ed esempi
 COMPITO A 1)In un vaso di alluminio, di massa m1, è contenuta la massa m2 di acqua di cui non si conosce la temperatura. Nell acqua si immerge un pezzo di rame di massa m3, riscaldato a t1 C e con ciò
COMPITO A 1)In un vaso di alluminio, di massa m1, è contenuta la massa m2 di acqua di cui non si conosce la temperatura. Nell acqua si immerge un pezzo di rame di massa m3, riscaldato a t1 C e con ciò
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Lo stato liquido: il modello
 Lo stato liquido: il modello lemolecolesonoin moto perpetuo e casuale(moto Browniano) l'energia del moto: è dello stesso ordine di grandezza dell'energia di interazione tra le molecole dipende dalla temperatura(agitazione
Lo stato liquido: il modello lemolecolesonoin moto perpetuo e casuale(moto Browniano) l'energia del moto: è dello stesso ordine di grandezza dell'energia di interazione tra le molecole dipende dalla temperatura(agitazione
Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire.
 Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire. Molte reazioni procedono in modo incompleto; è importante quindi determinare
Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire. Molte reazioni procedono in modo incompleto; è importante quindi determinare
i tre stati di aggregazione
 Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Termodinamica. Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico
 Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
LEGGI DEI GAS / CALORI SPECIFICI. Introduzione 1
 LEGGI DEI GAS / CALORI SPECIFICI Introduzione 1 1 - TRASFORMAZIONE ISOBARA (p = costante) LA PRESSIONE RIMANE COSTANTE DURANTE TUTTA LA TRASFORMAZIONE V/T = costante (m, p costanti) Q = m c p (Tf - Ti)
LEGGI DEI GAS / CALORI SPECIFICI Introduzione 1 1 - TRASFORMAZIONE ISOBARA (p = costante) LA PRESSIONE RIMANE COSTANTE DURANTE TUTTA LA TRASFORMAZIONE V/T = costante (m, p costanti) Q = m c p (Tf - Ti)
Dalla legge dei gas perfetti si ha il rapporto tra il numero di moli dei due gas R T 1 V 2 P V 1. =n 1. RT 2 =V 2 qundi: n 1 = T 2. =n 2.
 Compito intercorso Fisica II ICI 1 giugno 2006 1 Due recipienti uguali, isolati termicamente dall'ambiente esterno, sono connessi da un condotto con un rubinetto, inizialmente chiuso. Uno dei recipienti
Compito intercorso Fisica II ICI 1 giugno 2006 1 Due recipienti uguali, isolati termicamente dall'ambiente esterno, sono connessi da un condotto con un rubinetto, inizialmente chiuso. Uno dei recipienti
