H 3 N CH C OH + H N CH COO : R 1 H R H 3 N CH C N CH COO O H O. IL LEGAME PEPTIDICO (è un legame carboammidico)
|
|
|
- Gaetana Greco
- 6 anni fa
- Visualizzazioni
Transcript
1 IL LEGAME PEPTIDI (è un egame carboammidico) ondensazione fra i gruppo α-arbossiico di un amminoacido e i α-amminico di un atro amminoacido R 1 R : È riasciata una moecoa di acqua Estremità -terminae R 1 R Estremità -terminae I gruppi α-amminico e α-carbossiico coinvoti ne egame peptidico non sono carichi
2 PETAPEPTIDE 5 residui amminoacidici egati da 4 egami peptidici ome sarà ionizzato i peptide a p 7.0? Quae sarà a sua carica netta? I QUALE ITERVALL DI p ADE IL SU pi? arica netta a p 7.0 = 0 I peptide è nea sua forma zwitterionica. Quindi i suo pi avrà vaori vicini a 7.0
3 Le proprietà ioniche di un peptide dipendono dao stato di ionizzazione, ad un dato p, dee catene aterai degi amminoacidi che o compongono. Es.: scrivere a struttura de tripeptide Ser-ys-Gu, indicando i suo stato di ionizzazione a p pka pka R1 8.2 S pka R2 4.2 In souzione a p 7.0: carica netta de peptide -1 Significa che i peptide avrà un punto isoeettrico acido -1 pka 1 2.0
4 arica netta de peptide in souzione a p 1.0? +1 p 1 è inferiore a tutti i pka de peptide: i gruppi saranno prevaentemente protonati +1 pka arica netta de peptide in souzione a p 12.0? -3 p 12 è superiore a tutti i pka de peptide: i gruppi saranno prevaentemente deprotonati pka R2 4.2 pka R1 8.2 S pka S
5 PEPTIDI DI IMPRTAZA BILGIA, esempio de gutatione Moti ormoni sono peptidi: (ossitocina, vasopressina) Encefaine: pentapeptidi anagesici naturai Moti peptidi sono tossine: veeni di serpenti, funghi o prodotte da batteri. Diversi antibiotici sono peptidi. Gutatione (GS): tripeptide, sequestra agenti ossidanti, protegge e ceue da danni causati da eevate concentrazioni di perossidi, ha un importantissima azione intra- e extra-ceuare di difesa dao stress ossidativo Legame isopeptido fra i γ- de gutammato e α- 2 dea cisteina α β γ GLUTATIE (GS) ridotto
6 Dimerizza per ossidazione 2e, 2 + GLUTATIE (GSSG) SSIDAT
7 IL REDX DEL GLUTATIE anione superossido Enzimi che partecipano a cico: SD = superossido dismutasi AT = cataasi GPx = gutatione perossidasi GR = gutatione reduttasi G6PD = gucosio 6-fosfato deidrogenasi 2x La gutatione perossidasi utiizza i gutatione per rimuovere i perossidi, come 2 2, > 2 2 è ridotta ad 2 a spese de GS che si ossida a GSSG > i GSSG viene riportato nea forma ridotta GS daa gutatione reduttasi che utiizza come agente ossidoriduttivo i ADP prodotto daa gucosio 6- fosfato-deidrogenasi
8 IMIA DEL LEGAME PEPTIDI α1.. α2 I egame peptidico: >> è un ibrido di risonanza >> ha parziae carattere di doppio egame, >> è impedita a ibera rotazione α1 -.. α1 + α2 δδ - δδ + α2 Densità eettronica intorno a egame peptidico I gruppo peptidico è poare giace su un piano chiamato PIA AMMIDI
9 LA FIGURAZIE DEL GRUPP PEPTIDI PU ESSERE TRAS IS Le due configurazioni non sono interconvertibii R α1 α2 R α1 α2 Più favorita Meno favorita a causa de ingombro sterico dee catene R attaccate ai due α In acuni casi (~6%), quando ne egame peptidico è coinvoto azoto in afa dea proina a configurazione de egame peptidico può essere cis In questo caso ingombro sterico è di poco superiore aa configurazione trans
10 Lo scheetro poipeptidico di una proteina è data da susseguirsi di gruppi peptidici, ognuno dei quai giace su un piano ammidico, tenuti insieme ai vertici dagi atomi di arbonio α. La rotazione è impedita intorno a egame peptidico È invece possibie intorno ai egami : α La rotazione può variare secondo un ampiezza massima di 180 in senso orario o antiorario e a catena poipeptidica può assumere un diverso tipo di avvogimento dipendentemente da grado di rotazione di questi 2 egami.
11 Ψ (psi) =Angoo di rotazione intorno a egame α. Φ (phi) = Angoo di rotazione intorno a egame α arbonio α R Le rotazioni Ψ e Φ sono imitate: Interferenza sterica fra gi atomi de gruppo peptidico Interferenza sterica fra gi atomi dee catene aterai (es.: proina, triptofano)
12 Struttura primaria: sequenza amminoacidica dea proteina Struttura terziaria: descrive i ripiegamento dea catena poipeptidica in una conformazione tridimensionae compatta e gobuare Struttura secondaria: organizzazione spaziae dea catena poipeptidica in strutture ocai e ripetitive Struttura quaternaria: descrive assembamento di 2 o + catene poipeptidiche in una proteina oigomerica
13 Strutture secondarie Le più comuni: α-eiche e β-fogietti α-elia La catena poipeptidica si avvoge, in modo regoare e ripetitivo, intorno ad un asse immaginario Estremità -terminae aratteristiche: Soitamente destrogire Passo (avanzamento per curva): 0,54 nm Per un giro competo de eica sono necessari da 3,5 >3,7 residui amminoacidici (3 unità - α - e 1 di un 4 residuo) Spazio occupato da ogni residuo: 0,15 nm Lunghezza: da 5 a 40 residui Estremità -terminae
14 atene aterai a esterno de ciindro de eica
15 LEGAMI IDRGE PERIDII: gni ossigeno carboniico (n) deo scheetro poipeptidico forma un egame con idrogeno ammidico de 4 residuo successivo in direzione -terminae (n + 4), in un α-eica tutti i gruppi e deo scheetro peptidico sono coinvoti in egami gni egame chiude un ansa contenente 13 atomi: ossigeno carboniico, 11 atomi deo scheetro e idrogeno ammidico >>>> ELIA
16 L afa-eica è stabiizzata da effetto UMULATIV di moti egami idrogeno ITRAATEA δ+ I gruppi = sono rivoti tutti verso estremità -terminae e i gruppi - verso estremità -terminae de eica. L intera eica è un dipoo: Tutti i gruppi peptidici mantengono a stessa poarità ungo eica e i egami sono tutti paraei a asse de eica. δ
17 La stabiità de afa-eica è infuenzata dae catene aterai dei residui amminoacidici che a costituiscono ALAIA (Aa) : catena R piccoa e neutra, residuo più comune. TIRSIA (Tyr), TRIPTFA (Trp), ARGIIA (Arg): catena R ingombrante, meno comuni. GLIIA (Gy): a catena R è un idrogeno, destabiizzante, nessun impedimento aa rotazione intorno a α. Si trovano aa fine o a inizio de eica. PRLIA (Pro): distrugge a conformazione destrorsa de eica, non può partecipare competamente ai egami idrogeno intracatena. on è consentita acuna rotazione intorno a egame α poiché fa parte di un aneo rigido. AMMIAIDI ARII: Gu, Asp, Lys, Arg. AA con a stessa carica sua catena aterae creano una distensione de eica per effetto di repusione. Stabiizzano i dipoo de eica quando presenti a estremità con carica opposta.
18 STRUTTURE β Fiamento β : catena poipeptidica distesa e disposta a fisarmonica (6 residui aa in media) α α α α α Fogietto β : più fiamenti β affiancati, stabiizzati da egami (da 2 a 15 fiamenti β), che possono appartenere a: 1) segmenti differenti dea stessa catena poipeptidica, spesso anche ocaizzati in regioni ontane dea sequenza proteica 2) catene poipeptidiche diverse. Si uniscono insieme quando a proteina assume a sua struttura terziaria definitiva.
19 Fogietto β paraeo: Legami distorti (Meno stabii) Fogietto β antiparaeo: più stabie
20 Strutture secondarie non ripetute ASE (LPS) e URVE (TURS) -ausano cambiamenti direzionai nea catena poipeptidica, connettendo e α-eiche o i fogietti β. - anno conformazioni imitate dagi angoi di egame Φ e Ψ - Permettono aa catena poipeptidica di ripiegarsi su stessa sino ad assumere una struttura tridimensionae più compessa. - Sono stabiizzate da egami idrogeno interni
21 ASE Residui idrofiici Presenti sua Superficie dea proteina, dove formano egami con 2 5 α-eiche unite da anse e curve 2 α-eiche e 4 fiamenti β uniti da anse e curve
22 URVE Piccoe anse contenenti sino a 5 residui amminoacidici Brusco cambiamento nea direzione dea catena urve più comuni: curve inverse o ripiegamenti β (β-turns) onnettono i fiamenti β in un fogietto β Tipo I e tipo II 4 residui aa Legami tra ossigeno carboniico de 1 residuo e idrogeno ammidico de 4 residuo ambiamento di direzione di 180 nea catena poipeptidica
23 2 residuo è spesso Pro in entrambi i tipi, soprattutto ne tipo I 3 residuo è Gy (favorisce un brusco cambiamento di direzione) Gicina α α Proina α ripiegamento β di TIP I ripiegamento β di TIP II
COOH. Sono tutti α-amminoacidi possiedono un gruppo amminico e un carbossilico entrambi legati allo stesso atomo di carbonio (il carbonio α)
 AMMINOACIDI Gi amminoacidi comuni o standard che tutti gi organismi viventi utiizzano per assembaggio dee PROTEINE sono 20 e sono codificati da codice genetico. Sono tutti α-amminoacidi possiedono un gruppo
AMMINOACIDI Gi amminoacidi comuni o standard che tutti gi organismi viventi utiizzano per assembaggio dee PROTEINE sono 20 e sono codificati da codice genetico. Sono tutti α-amminoacidi possiedono un gruppo
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 5
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Chaperonina. Emoglobina
 STRUTTURA QUATERNARIA Presente in proteine costituite da 2 o più subunità, quindi da 2 o + catene poipetidiche. Le subunità (o monomeri) possono essere identiche o diverse I monomeri si associano nee superfici
STRUTTURA QUATERNARIA Presente in proteine costituite da 2 o più subunità, quindi da 2 o + catene poipetidiche. Le subunità (o monomeri) possono essere identiche o diverse I monomeri si associano nee superfici
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Diagramma di Ramachandran
 Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
La struttura delle proteine e e descritta da quattro livelli di organizzazione
 La struttura delle proteine e e descritta da quattro livelli di organizzazione Struttura Primaria- - la sequenza di aminoacidi Struttura Secondaria - strutture locali stabilizzate da legami H che coinvolgono
La struttura delle proteine e e descritta da quattro livelli di organizzazione Struttura Primaria- - la sequenza di aminoacidi Struttura Secondaria - strutture locali stabilizzate da legami H che coinvolgono
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 6
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
30/10/2015 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE
 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
COMPORTAMENTO ANFOTERO DEGLI AA
 Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Gli amminoacidi ( 20) hanno proprietà strutturali comuni
 Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
CENNI SUL TIPO DI FORZE
 CENNI SUL TIPO DI FORZE Forze deboli che influenzano la struttura delle proteine: le interazioni di van der Waals repulsione attrazione Forze attrattive dovute a interazioni istantanee che si generano
CENNI SUL TIPO DI FORZE Forze deboli che influenzano la struttura delle proteine: le interazioni di van der Waals repulsione attrazione Forze attrattive dovute a interazioni istantanee che si generano
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Il legame peptidico è polare
 Scaricato da Il legame peptidico è polare SONO FAVORITE QUELLE CONFIGURAZIONI CHE CONSENTONO IL MAGGIOR NUMERO DI INTERAZIONI TRA LE PARTI DELLA CATENA POLIPEPTIDICA. A CAUSA DELLA POLARITA' DEL LEGAME
Scaricato da Il legame peptidico è polare SONO FAVORITE QUELLE CONFIGURAZIONI CHE CONSENTONO IL MAGGIOR NUMERO DI INTERAZIONI TRA LE PARTI DELLA CATENA POLIPEPTIDICA. A CAUSA DELLA POLARITA' DEL LEGAME
Equilibrio del corpo rigido
 Equiibrio de corpo rigido Probema1 Due sbarrette omogenee AB e BC aventi a stessa unghezza e a stessa massa di 6 kg, vengono sadate ne punto B in modo da formare un angoo di 90. Le due sbarrette così unite
Equiibrio de corpo rigido Probema1 Due sbarrette omogenee AB e BC aventi a stessa unghezza e a stessa massa di 6 kg, vengono sadate ne punto B in modo da formare un angoo di 90. Le due sbarrette così unite
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico
 gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
ADP + HPO 3, NAD +, NADP +, FAD ATP, NADH, NADPH, FADH 2 ENERGIA CHIMICA
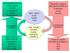 MACROMOLECOLE CELLULARI Proteine Polisaccaridi Lipidi Acidi nucleici ADP + HPO 3 2-, NAD +, NADP +, FAD Metaboliti complessi RICCHI DI ENERGIA Carboidrati Lipidi Proteine ANABOLISMO (biosintesi) MOLECOLE
MACROMOLECOLE CELLULARI Proteine Polisaccaridi Lipidi Acidi nucleici ADP + HPO 3 2-, NAD +, NADP +, FAD Metaboliti complessi RICCHI DI ENERGIA Carboidrati Lipidi Proteine ANABOLISMO (biosintesi) MOLECOLE
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
FOSFORILAZIONE OSSIDATIVA
 FOSFORILAZIONE OSSIDATIVA Lo scopo ultimo dei processi metabolici ossidativi è quello di canalizzare l energia contenuta nello scheletro carbonioso di zuccheri, ac. grassi e amminoacidi nella sintesi di
FOSFORILAZIONE OSSIDATIVA Lo scopo ultimo dei processi metabolici ossidativi è quello di canalizzare l energia contenuta nello scheletro carbonioso di zuccheri, ac. grassi e amminoacidi nella sintesi di
Macromolecole Biologiche. La struttura secondaria (I)
 La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
STRUTTURAZIONE DELLE PROTEINE
 STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
La struttura delle proteine viene suddivisa in quattro livelli di organizzazione:
 Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
lati esterni altamente Idrofilici
 I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE
 STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
FUNZIONI DELLE PROTEINE
 FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
H N H R N H R N R R N R H H H
 AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH
 Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Le proteine. Sintetizzate nei ribosomi come una sequenza lineare di amminoacidi assumono in seguito una struttura tridimensionale
 Le proteine Elementi funzionali e strutturali di fondamentale importanza per lo svolgimento di funzioni metaboliche, di trasporto, di trasmissione nervosa o contrattile, ormonale o immunitaria Sintetizzate
Le proteine Elementi funzionali e strutturali di fondamentale importanza per lo svolgimento di funzioni metaboliche, di trasporto, di trasmissione nervosa o contrattile, ormonale o immunitaria Sintetizzate
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine:
 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
Meccanica dei Manipolatori. Corso di Robotica Prof. Davide Brugali Università degli Studi di Bergamo
 Meccanica dei Manipoatori Corso di Robotica Prof. Davide Brugai Università degi Studi di Bergamo Definizione di robot industriae Un robot industriae è un manipoatore mutifunzionae riprogrammabie, comandato
Meccanica dei Manipoatori Corso di Robotica Prof. Davide Brugai Università degi Studi di Bergamo Definizione di robot industriae Un robot industriae è un manipoatore mutifunzionae riprogrammabie, comandato
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
Proteine. Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana)
 Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Macromolecole Biologiche. La struttura secondaria (II)
 La struttura secondaria (II) Nello stesso anno (1951) in cui proposero l α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo l α elica,
La struttura secondaria (II) Nello stesso anno (1951) in cui proposero l α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo l α elica,
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
Lunghezza della circonferenza e area del cerchio
 3 GEMETRI Lunghezza dea circonferenza e area de cerchio Esercizi suppementari di verifica Esercizio 1 Metti una crocetta su vero (V) o faso (F) accanto ad ogni formua reativa aa unghezza dea circonferenza
3 GEMETRI Lunghezza dea circonferenza e area de cerchio Esercizi suppementari di verifica Esercizio 1 Metti una crocetta su vero (V) o faso (F) accanto ad ogni formua reativa aa unghezza dea circonferenza
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Principali vie di utilizzo del Glucosio
 Principali vie di utilizzo del Glucosio GLICOGENO (Polimero di riserva) Polimero lineare e ramificato di glucosio che si accumula nel fegato e nel muscolo. Nella catena lineare le molecole di glucosio
Principali vie di utilizzo del Glucosio GLICOGENO (Polimero di riserva) Polimero lineare e ramificato di glucosio che si accumula nel fegato e nel muscolo. Nella catena lineare le molecole di glucosio
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
CONOSCENZE 1. il concetto di parallelismo e. e perpendicolari. 2. la proiezione di un segmento
 GEOMETRIA PREREQUISITI conoscere e caratteristiche de sistema decimae conoscere e proprietaá dee quattro operazioni e operare con esse operare con e misure angoari conoscere gi enti dea geometria e e oro
GEOMETRIA PREREQUISITI conoscere e caratteristiche de sistema decimae conoscere e proprietaá dee quattro operazioni e operare con esse operare con e misure angoari conoscere gi enti dea geometria e e oro
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Parametri dell α-elica. residui/giro 3.6. passo dell elica
 GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Esercitazione n. 6 - Esercitazione sulla stereoisomeria ottica.
 Esercitazione n. 6 Esercitazione sua stereoisomeria ottica.. Dare una definizione dei seguenti termini: a) enantiomero Immagine specuare non sovrapponibie b) Proiezione di Fischer Proiezione su piano di
Esercitazione n. 6 Esercitazione sua stereoisomeria ottica.. Dare una definizione dei seguenti termini: a) enantiomero Immagine specuare non sovrapponibie b) Proiezione di Fischer Proiezione su piano di
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
CLASSIFICAZIONE ENZIMI
 CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
Modello Watson-Crick del DNA
 Modello Watson-Crick del DNA Diffrazione raggi X (Wilkins & Franklin) Modello atomico a doppia elica (B-DNA, Watson & Crick) VMD 1 Modello Watson-Crick del DNA B-DNA: doppia elica destrorsa Doppia elica
Modello Watson-Crick del DNA Diffrazione raggi X (Wilkins & Franklin) Modello atomico a doppia elica (B-DNA, Watson & Crick) VMD 1 Modello Watson-Crick del DNA B-DNA: doppia elica destrorsa Doppia elica
Cap. 1 Interazioni delle molecole con l acqua
 Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Macromolecole Biologiche Interazioni non covalenti
 Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
ACIDI CARBOSSILICI. ac. formico ac. acetico ac. benzoico
 ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche I primi termini della serie sono liquidi incolori
ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche I primi termini della serie sono liquidi incolori
