Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
|
|
|
- Gloria Guidi
- 6 anni fa
- Visualizzazioni
Transcript
1 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1
2 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano attorno al nucleo grazie al bilancio tra forza centrifuga e forza di attrazione elettrostatica. Secondo le leggi dell elettromagnetismo (Maxwell) una particella carica in moto non rettilineo emette energia sotto forma di radiazione elettromagnetica. 2
3 Modello di Rutherford: limiti Conclusione: l elettrone dovrebbe perdere velocità e collassare sul nucleo in s. Sperimentalmente ciò non si verifica, dato che la maggior parte degli atomi è stabile. 3
4 Modello di Rutherford: limiti La radiazione elettromagnetica emessa o assorbita da un elettrone in movimento a velocità variabile dovrebbe essere pertanto continua, a tutte le lunghezze d onda, ma sperimentalmente ciò non si verifica. L atomo emette solo alcune radiazioni, a lunghezze d onda caratteristiche di ciascun elemento. LIMITI: Non spiega gli spettri di assorbimento ed emissione. Non spiega la stabilità degli atomi. 4
5 Gas rarefatti: idrogeno 6
6 Sodio 7
7 Spettri di emissione: gas rarefatti 8
8 Modello di Bohr Bohr tentò di risolvere le incongruenze del modello di Rutherford, abbandonando la fisica classica, ed utilizzando l emergente teoria quantistica di Planck- Einstein. Analisi dei dati sperimentali: Gli spettri a righe degli atomi indicano che l elettrone all interno dell atomo può assumere solo particolari energie. Ogni riga corrisponde ad una transizione dell elettrone tra due livelli ad energia permessa. 9
9 Quantizzazione dell energia (Planck 1900) Planck ipotizzò che la radiazione elettromagnetica sia costituita da una successione di quantità minime non ulteriormente frazionabili, che chiamò quanti, successivamente ribattezzato fotoni da Einstein. La radiazione elettromagnetica manifesta natura ondulatoria (fisica classica) o particellare (fisica quantistica) a seconda del tipo di esperimento effettuato. La sua natura è duale: onda-particella. Propagazione della radiazione elettromagnetica 10
10 Relazione tra energia e frequenza della radiazione elettromagnetica L energia di ogni quanto è proporzionale alla frequenza, ν (pr. nù), della radiazione elettromagnetica. In generale: E = n h ν con n = 1, 2, 3, 4, (n = numero intero) h = costante di Planck = J s La frequenza della radiazione è legata alla sua lunghezza d onda, λ, dalla relazione: c = λ ν c = m/s (velocità della luce nel vuoto) 11
11 Quantizzazione dell energia (Planck 1900) Nell interazione tra radiazione elettromagnetica e materia l energia può essere ceduta o assorbita solo per multipli interi di quanti. Anche gli elettroni, come la radiazione, possono essere considerati contemporaneamente particelle o onde. I dati spettrali indicano che l energia dell elettrone in un atomo è quantizzata. 12
12 Quantizzazione dell energia L energia di un elettrone in un atomo può essere paragonata all energia della tartaruga. A) Energia continua: l energia potenziale della tartaruga (e quindi dell elettrone) può assumere tutti i valori. B) Energia quantizzata: l energia potenziale della tartaruga (e per analogia dell elettrone) può assumere solo alcuni valori. 13
13 Modello di Bohr (1913) Bohr elaborò un modello che potesse dare una spiegazione teorica ai dati sperimentali. Nel modello di Rutherford ogni elettrone ha una definita orbita. Bohr propose, per lo stesso elettrone, l esistenza di più orbite consentite. Il suo modello si basa su tre postulati. 14
14 Modello di Bohr: I postulato Gli elettroni si muovono intorno al nucleo su un numero discreto di orbite situate ad una distanza ben precisa dal nucleo, dette orbite quantiche o stati stazionari. Ogni orbita è caratterizzata da un numero intero, n (n = 1, 2, 3, ) detto numero quantico principale. Ad ogni orbita è associata una energia, che dipende dal numero quantico principale, n: E = - b / n 2, b = J 15
15 Modello di Bohr: I postulato Normalmente l elettrone occupa l orbita più vicina al nucleo (primo livello energetico), cui è associata anche la minor energia. Quando ciò accade l atomo si trova nello stato fondamentale. 16
16 Modello di Bohr: II postulato Quando l elettrone occupa una qualsiasi di queste orbite non emette né assorbe energia. I livelli energetici vengono riempiti dagli elettroni a partire da quello cui è associata la minor energia. I livelli energetici sono teoricamente infiniti, sperimentalmente, tuttavia, gli elettroni degli atomi finora noti occupano soltanto i primi 7 livelli. In ogni livello energetico possono essere collocati al massimo 2n 2 elettroni. 17
17 Modello di Bohr: III postulato L elettrone può saltare tra le orbite, assorbendo od emettendo radiazione elettromagnetica. La quantità di energia liberata o assorbita da un atomo non può assumere valori qualsiasi ma è quantizzata. L elettrone emette o assorbe energia solo se passa da un livello ad un altro: ΔE = E finale E iniziale = hν. L atomo eccitato tende a tornare nel suo stato fondamentale, come evidenziato dagli spettri di emissione atomica. 19
18 Modello di Bohr: emissione atomica 20
19 Modello di Bohr: spettri di emissione 21
20 Modello di Bohr: spettri di emissione I possibili valori delle energie nei vari livelli sono rappresentati come linee orizzontali in un diagramma dei livelli energetici. Se l elettrone salta oltre il livello 7 si ha ionizzazione, cioè l elettrone si separa dall atomo, generando un CATIONE (ione carico +). 22
21 Spettro di emissione dell atomo di H 23
22 Modello di Bohr: limiti Non riesce ad attribuire un significato fisico al numero quantico principale n. Non spiega la struttura fine degli spettri atomici: con il perfezionarsi degli strumenti si scoprì che le righe dello spettro dell atomo di idrogeno erano formate in realtà da clusters di altre righe molto vicine tra loro. Non spiega gli spettri di assorbimento ed emissione degli atomi polielettronici. 24
23 Spettro di emissione dell atomo di H Per migliorare l interpretazione dello spettro di emissione dell atomo di idrogeno Sommerfeld (1916) propose l introduzione di altri numeri quantici: l (numero quantico azimutale), m (numero quantico magnetico). Successivamente, per interpretare nuovi dati sperimentali, Uhlenbeck e Goudsmit (1926) introdussero anche s (numero quantico di spin, si trova anche indicato con m s ). 25
24 Modello quantomeccanico: atomi polielettronici Il nucleo, piccolissimo e carico positivamente, è circondato da una nube di elettroni in movimento continuo. Ogni elettrone, ad un dato istante, ha energia definita, ma traiettoria non definita, (Principio di indeterminazione - Heisemberg, 1927). Pertanto l esatta posizione di un elettrone all interno di un atomo è ignota e non conoscibile. 26
25 Modello quantomeccanico Scompare il concetto di orbita elettronica definita (modello di Bohr) e si comincia ad utilizzare il concetto probabilistico di orbitale (modello quantomeccanico). Orbitale: regione dello spazio intorno al nucleo in cui è massima la probabilità di trovare un elettrone (95%). 27
26 Numeri quantici Principio di esclusione di Pauli (1925): In un atomo polielettronico ogni elettrone è identificato da un set di 4 numeri quantici diverso dagli altri. Ogni elettrone appartenente ad un atomo, pertanto, è identificato da n, l, m, s. 28
27 Numeri quantici n (numero quantico principale): è associato all energia dell orbitale occupato. Può assumere solo valori interi (n = 1, 2,, ) l (numero quantico azimutale): è associato alla forma dell orbitale occupato. Può assumere solo valori interi compresi tra: l = 0, n-1. Può essere paragonato ad un sottolivello energetico. I sottolivelli energetici vengono identificati anche con le lettere s (l = 0), p (l = 1), d (l = 2), f (l = 3). Esempio: se n = 2, l può essere l = 0, oppure l = 1, cioè ci sono due sottolivelli energetici nel livello 2. 29
28 Numeri quantici m (numero quantico magnetico): è associato all orientamento nello spazio dell orbitale occupato. Può assumere solo valori interi compresi tra m = 0, ± l. Orbitali che possiedono identici n, l, m si dicono degeneri, cioè possiedono la stessa energia, ma possono avere diversa forma e diverso orientamento nello spazio. s (numero quantico di spin): è associato al senso di rotazione dell elettrone. Può assumere solo due valori: + ½, - ½. 30
29 Forma e orientamento orbitali s p d f 31
30 Riempimento degli orbitali Dal principio di Pauli e dalla definizione di numeri quantici deriva che ogni orbitale di ciascun livello energetico, può alloggiare solo due elettroni, aventi spin opposto (simbologia: ). Il numero totale di elettroni per ogni livello energetico è dato dalla somma di tutti gli elettroni contenuti negli orbitali appartenenti a quel livello: 2n 2. 32
31 Configurazione elettronica Principio di Aufbau (costruzione): gli elettroni di un atomo occupano gli orbitali appartenenti a ciascun livello energetico, a partire da quello ad energia minore. Regola di Hund: la configurazione più stabile è quella caratterizzata dal maggior numero possibile di elettroni spaiati. Es. : Configurazione dell atomo di N: 33
32 Configurazione elettronica L ordine di riempimento degli orbitali, nel caso di atomi con più di 18 elettroni, può variare leggermente per effetto delle interazioni tra elettroni. Le interazioni nell atomo sono di natura elettrostatica (legge di Coulomb): attrattiva (nucleo elettroni) e repulsiva (elettrone elettrone). Gli elettroni più lontani dal nucleo, risentono di una forza attrattiva minore (effetto della distanza), inoltre ogni elettrone risente di una carica nucleare effettiva minore di quella reale, dal momento che essa viene schermata dalla presenza degli elettroni più interni. 34
33 Ordine di riempimento orbitalico 35
34 Conclusioni : atomo Un atomo è formato da due zone distinte: Nucleo : è formato da neutroni e protoni, è carico positivamente, molto piccolo, ma molto denso (rappresenta la quasi totalità della massa atomica). Nuvola elettronica: carica negativamente, determina il volume atomico. Gli elettroni hanno energie definite, ma orbite non definite (orbitale = probabilità). 36
35 Conclusioni: atomo Il numero di protoni ed elettroni, nell atomo neutro, è uguale. Il livello energetico a maggior energia (e più lontano dal nucleo) occupato dagli elettroni viene denominato valence shell (guscio di valenza), mentre i livelli più interni (più vicini al nucleo) vengono complessivamente indicati con core (nocciolo). Al chimico interessano gli elettroni appartenenti al valence shell (che sono quelli coinvolti nella formazione dei legami). 37
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Modelli atomici. Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle.
 Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Dispense CHIMICA GENERALE E ORGANICA (STAL) 2012/13 Prof. P. Carloni GLI ATOMI
 GLI ATOMI L'atomo e le particelle che lo compongono, il nucleo e gli elettroni, numero atomico e numero di massa, isotopi, la struttura dell'atomo, gli orbitali s, p e d, la configurazione fondamentale
GLI ATOMI L'atomo e le particelle che lo compongono, il nucleo e gli elettroni, numero atomico e numero di massa, isotopi, la struttura dell'atomo, gli orbitali s, p e d, la configurazione fondamentale
Numero atomico Z : numero di protoni presenti nell atomo di quell elemento. Numero di massa A : somma dei protoni e dei neutroni in un atomo
 ATOMI E TAVOLA PERIODICA ATOMO: è il più piccolo costituente di un elemento che ne conservi le proprietà chimiche ELEMENTO: sostanza che non può essere scissa in una sostanza più semplice mediante reazione
ATOMI E TAVOLA PERIODICA ATOMO: è il più piccolo costituente di un elemento che ne conservi le proprietà chimiche ELEMENTO: sostanza che non può essere scissa in una sostanza più semplice mediante reazione
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA
 pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
CHIMICAMENTE. Lezioni del prof. Puletti Classe II B
 CHIMICAMENTE Lezioni del prof. Puletti Classe II B Scuola Media PIO X Artigianelli A.S. 2011-2012 PERCORSO - cos è la materia e da cosa è costituita - le particelle atomiche fondamentali: protoni, neutroni
CHIMICAMENTE Lezioni del prof. Puletti Classe II B Scuola Media PIO X Artigianelli A.S. 2011-2012 PERCORSO - cos è la materia e da cosa è costituita - le particelle atomiche fondamentali: protoni, neutroni
Le particelle dell atomo
 La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
Principio dell Aufbau (riempimento)
 LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
Chimica. Lezione 2 Il legame chimico Parte I
 Chimica Lezione 2 Il legame chimico Parte I GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUALVOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA CONDIZIONE
Chimica Lezione 2 Il legame chimico Parte I GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUALVOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA CONDIZIONE
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro
 Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
La tavola periodica. 1- Introduzione
 La tavola periodica 1- Introduzione La legge periodica (1869, Mendeleiev in Russia e Meyer in Germania) stabilisce che gli elementi, quando vengono disposti in ordine di massa atomica, mostrano una periodicità
La tavola periodica 1- Introduzione La legge periodica (1869, Mendeleiev in Russia e Meyer in Germania) stabilisce che gli elementi, quando vengono disposti in ordine di massa atomica, mostrano una periodicità
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
IL MODELLO ATOMICO DI BOHR
 IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
Bohr e la struttura dell atomo. Lezioni 11-12
 Bohr e la struttura dell atomo Lezioni 11-12 Onde elettromagnetiche Radiazione Elettromagnetica raggi X e raggi > 10 3 Hz
Bohr e la struttura dell atomo Lezioni 11-12 Onde elettromagnetiche Radiazione Elettromagnetica raggi X e raggi > 10 3 Hz
I modelli atomici da Dalton a Bohr
 1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
Configurazione elettronica e Tavola periodica. Lezioni 13-16
 Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
TEORIA QUANTISTICA E STRUTTURA ATOMICA
 TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
Chimica. Lezione 1 La materia
 Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
LE PARTICELLE ELEMENTARI: loro scoperta
 LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
La Fisica Quasi Moderna La Meccanica Quantistica Classica. Particelle a velocità Molto inferiore alla luce
 La Fisica Quasi Moderna La Meccanica Quantistica Classica Particelle a velocità Molto inferiore alla luce Sommario Il Macinino di Newton Ma perché esiste il Mondo? Una deviazione: fisica e matematica La
La Fisica Quasi Moderna La Meccanica Quantistica Classica Particelle a velocità Molto inferiore alla luce Sommario Il Macinino di Newton Ma perché esiste il Mondo? Una deviazione: fisica e matematica La
Struttura dell'atomo a cura di Petr Ushakov
 Struttura dell'atomo a cura di Petr Ushakov Struttura dell'atomo Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: protone, neutrone e elettrone. particelle elementari
Struttura dell'atomo a cura di Petr Ushakov Struttura dell'atomo Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: protone, neutrone e elettrone. particelle elementari
Dai primi modelli alla teoria moderna
 MODELLI ATOMICI Dai primi modelli alla teoria moderna I modelli atomici nacquero, dall'intuizione di alcuni scienziati di fronte all'impossibilità di interpretare in modo semplice i fenomeni complessi.
MODELLI ATOMICI Dai primi modelli alla teoria moderna I modelli atomici nacquero, dall'intuizione di alcuni scienziati di fronte all'impossibilità di interpretare in modo semplice i fenomeni complessi.
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro
 Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
26/10/2012. Onde elettromagnetiche. b) proprietà periodiche C) configurazione elettronica. f(x,t)=a sin(kx+ωt+φ) k=2π/λ; ω=2π/t= 2πν
 Onde elettromagnetiche Struttura atomica: a) riempimento orbitali b) proprietà periodiche C) configurazione elettronica ONDE onde armoniche f(x,t)=a sin(kx+ωt+φ) k=2π/λ; ω=2π/t= 2πν Energia di un fotone
Onde elettromagnetiche Struttura atomica: a) riempimento orbitali b) proprietà periodiche C) configurazione elettronica ONDE onde armoniche f(x,t)=a sin(kx+ωt+φ) k=2π/λ; ω=2π/t= 2πν Energia di un fotone
Chimica. Lezione 1. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Chimica Lezione 1 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Prof. Roberto Paolesse Dip. Scienze e Tecnologie Chimiche Università di Roma "Tor Vergata" Via
Chimica Lezione 1 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Prof. Roberto Paolesse Dip. Scienze e Tecnologie Chimiche Università di Roma "Tor Vergata" Via
RIASSUNTI DI CHIMICA
 Tecla Spelgatti RIASSUNTI DI CHIMICA per il liceo scientifico 2 - LA TAVOLA PERIODICA Questo testo è distribuito con licenza Common Creative: http://creativecommons.org/licenses/ CC BY-NC-ND Attribuzione
Tecla Spelgatti RIASSUNTI DI CHIMICA per il liceo scientifico 2 - LA TAVOLA PERIODICA Questo testo è distribuito con licenza Common Creative: http://creativecommons.org/licenses/ CC BY-NC-ND Attribuzione
Chimica. Lezione 2 La materia Il legame chimico (Parte I)
 Chimica Lezione 2 La materia Il legame chimico (Parte I) Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido,
Chimica Lezione 2 La materia Il legame chimico (Parte I) Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido,
C.I. CHIMICA-TECNOLOGIA DEI MATERIALI Modulo di Chimica. Lezione del 7 Marzo 2016
 C.I. CHIMICA-TECNOLOGIA DEI MATERIALI Modulo di Chimica Lezione del 7 Marzo 2016 Particelle Elementari Carica Massa SI (C) Atom. SI (kg) Atom. Protone 1.602x10-19 +1 1.673x10-27 1.0073 Neutrone 0 0 1.675x10-27
C.I. CHIMICA-TECNOLOGIA DEI MATERIALI Modulo di Chimica Lezione del 7 Marzo 2016 Particelle Elementari Carica Massa SI (C) Atom. SI (kg) Atom. Protone 1.602x10-19 +1 1.673x10-27 1.0073 Neutrone 0 0 1.675x10-27
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Il metodo scientifico
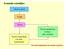 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
Tracce di energia. viaggio dentro l atomo
 Tracce di energia viaggio dentro l atomo Di cosa è fatta la torre Eiffel? di 10.000 tonnellate di ferro ovvero 10.000.000.000 di grammi di ferro miliardi Ogni grammo di ferro, a sua volta, è composto da
Tracce di energia viaggio dentro l atomo Di cosa è fatta la torre Eiffel? di 10.000 tonnellate di ferro ovvero 10.000.000.000 di grammi di ferro miliardi Ogni grammo di ferro, a sua volta, è composto da
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Atomi, molecole e ioni
 Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.6 ENERGIE DI IONIZZAZIONE E DISTRIBUZIONE DEGLI ELETTRONI 4.C OBIETTIVI
 LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
AA 2013-2014: Corso di Orientamento Elementi di Chimica Domenico Ciavardelli - Ph.D. email: domenico.ciavardelli@unikore.it
 Università degli Studi Kore di Enna Facoltà di Scienze dell Uomo e della Società CdL in Scienze delle attività motorie e sportive AA 2013-2014: Corso di Orientamento - Ph.D. email: domenico.ciavardelli@unikore.it
Università degli Studi Kore di Enna Facoltà di Scienze dell Uomo e della Società CdL in Scienze delle attività motorie e sportive AA 2013-2014: Corso di Orientamento - Ph.D. email: domenico.ciavardelli@unikore.it
La struttura degli atomi. Chimica Generale - Prof. R. Polini
 La struttura degli atomi 1 PARTICELLE FONDAMENTALI Gli atomi, e quindi tutta la materia, sono principalmente costituiti da tre particelle fondamentali : elettroni, protoni e neutroni Particella Massa Carica
La struttura degli atomi 1 PARTICELLE FONDAMENTALI Gli atomi, e quindi tutta la materia, sono principalmente costituiti da tre particelle fondamentali : elettroni, protoni e neutroni Particella Massa Carica
La tavola periodica. Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici
 La tavola periodica Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici Si possono classificare gli elementi secondo la loro configurazione elettronica: Gas nobili. Elementi
La tavola periodica Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici Si possono classificare gli elementi secondo la loro configurazione elettronica: Gas nobili. Elementi
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Organizzazione gerarchica della materia
 Meccanica Quantistica 900 problemi di Hilbert a seguire Gödel (non completezza), teoria della relatività e meccanica quantistica Meccanica Quantistica (curiosità e rivoluzione) Dualismo onda particella
Meccanica Quantistica 900 problemi di Hilbert a seguire Gödel (non completezza), teoria della relatività e meccanica quantistica Meccanica Quantistica (curiosità e rivoluzione) Dualismo onda particella
Struttura Elettronica degli Atomi
 Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Natura ondulatoria della luce. Natura corpuscolare della luce
 Natura ondulatoria della luce Data 1803 Autore Thomas Young Esperimento Un fascio di luce solare viene fatto passare da un foro e davanti a questo foro vi è un pannello con due fenditure verticali (coperte
Natura ondulatoria della luce Data 1803 Autore Thomas Young Esperimento Un fascio di luce solare viene fatto passare da un foro e davanti a questo foro vi è un pannello con due fenditure verticali (coperte
Le reazioni di ossido-riduzione
 Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
PROGETTO AMICI DI SCIASCIA. Fisica delle particelle
 PROGETTO AMICI DI SCIASCIA Fisica delle particelle TEMI TRATTATI NELLA PRESENTAZIONE 1. STORIA DELLA FISICA DELLE PARTICELLE 2. COME E FATTO L ATOMO? IPOTESI SULLA STRUTTURA DELL ATOMO 3. LA FISICA DELLE
PROGETTO AMICI DI SCIASCIA Fisica delle particelle TEMI TRATTATI NELLA PRESENTAZIONE 1. STORIA DELLA FISICA DELLE PARTICELLE 2. COME E FATTO L ATOMO? IPOTESI SULLA STRUTTURA DELL ATOMO 3. LA FISICA DELLE
LEZIONE 008 Struttura atomica TITOLO: STRUTTURA ATOMICA
 TITOLO: STRUTTURA ATOMICA 1898 Scoperta dell'elettrone (Thomson) 1900 Scoperta del protone (Goldstein) 1900 Teoria dei quanti di Planck 1904 Modello atomico di Thomson modello sferico 1911 modello atomico
TITOLO: STRUTTURA ATOMICA 1898 Scoperta dell'elettrone (Thomson) 1900 Scoperta del protone (Goldstein) 1900 Teoria dei quanti di Planck 1904 Modello atomico di Thomson modello sferico 1911 modello atomico
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Capitolo 4 Le teorie della materia
 Atomo: Prime Teorie Capitolo 4 Le teorie della materia 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria atomica spiega le leggi ponderali 4. La teoria atomica e le
Atomo: Prime Teorie Capitolo 4 Le teorie della materia 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria atomica spiega le leggi ponderali 4. La teoria atomica e le
Natura della luce. Qualsiasi tipo di onda è caratterizzato da:
 Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Orbitali e numeri quantici
 Orbitali e numeri quantici Un orbitale atomico viene approssimato con quella regione di spazio attorno al nucleo atomico in cui la probabilità di trovare un elettrone è massima (massima densità di probabilità)
Orbitali e numeri quantici Un orbitale atomico viene approssimato con quella regione di spazio attorno al nucleo atomico in cui la probabilità di trovare un elettrone è massima (massima densità di probabilità)
LICEO STATALE G. GALILEI - DOLO Anno scolastico 2014/15
 nella classe III E Geni, alleli; il DNA e la sua struttura. I cromosomi procarioti ed eucarioti. Le mutazioni geniche. Le leggi di Mendel. Il codice genetico e la sintesi proteica. Il cariotipo umano e
nella classe III E Geni, alleli; il DNA e la sua struttura. I cromosomi procarioti ed eucarioti. Le mutazioni geniche. Le leggi di Mendel. Il codice genetico e la sintesi proteica. Il cariotipo umano e
UNITA DIDATTICA P A1.01
 Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
May 5, 2013. Fisica Quantistica. Monica Sambo. Sommario
 May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
PARTICELLE SUBATOMICHE
 MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti;
MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti;
Da Newton a Planck. La struttura dell atomo. Da Newton a Planck. Da Newton a Planck. Meccanica classica (Newton): insieme
 Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
LA LEGGE DI COULOMB PER I MAGNETI
 1 LA LEGGE DI COULOMB PER I MAGNETI Lo scopo di questo esperimento è quello di riprodurre quello storico e importante ormai scomparso dai testi scolastici perché ritenuto non attinente alla realtà. È noto,
1 LA LEGGE DI COULOMB PER I MAGNETI Lo scopo di questo esperimento è quello di riprodurre quello storico e importante ormai scomparso dai testi scolastici perché ritenuto non attinente alla realtà. È noto,
Relatività Ristretta e Meccanica Quantistica: alcuni esperimenti cruciali. Lezione 1. Genova, 12,13,19,20 Gennaio 2016
 Relatività Ristretta e Meccanica Quantistica: alcuni esperimenti cruciali Lezione 1 Genova, 12,13,19,20 Gennaio 2016 Prof. Marco Pallavicini Università di Genova Dipartimento di Fisica Istituto Nazionale
Relatività Ristretta e Meccanica Quantistica: alcuni esperimenti cruciali Lezione 1 Genova, 12,13,19,20 Gennaio 2016 Prof. Marco Pallavicini Università di Genova Dipartimento di Fisica Istituto Nazionale
Dalla radiazione elettromagnetica alle celle fotovoltaiche TECHNOTOU R
 Dalla radiazione elettromagnetica alle celle fotovoltaiche TECHNOTOU R Elettromagnetismo: storia http://it.wikipedia.org http://it.wikipedia.org http://it.wikipedia.org http://www.destudiishumanitatis.it
Dalla radiazione elettromagnetica alle celle fotovoltaiche TECHNOTOU R Elettromagnetismo: storia http://it.wikipedia.org http://it.wikipedia.org http://it.wikipedia.org http://www.destudiishumanitatis.it
Dipartimento di Chimica
 UNIVERSITA' DEGLI STUDI DI SASSARI Dipartimento di Chimica Mauro Rustici Dipartimento di chimica, Via Vienna 2, 07100 SASSARI email rustici@uniss.it Elementi di Chimica Generale e Inorganica Anno Accademico
UNIVERSITA' DEGLI STUDI DI SASSARI Dipartimento di Chimica Mauro Rustici Dipartimento di chimica, Via Vienna 2, 07100 SASSARI email rustici@uniss.it Elementi di Chimica Generale e Inorganica Anno Accademico
Amministrazione, finanza e marketing - Turismo Ministero dell Istruzione, dell Università e della Ricerca PROGRAMMAZIONE DISCIPLINARE PER U. di A.
 MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR
 LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR LIMITI DEL MODELLO ATOMICO DI RUTHERFORD Il modello atomico planetario di Ernest Rutherford, seppure rappresentava un grande passo avanti rispetto al modello
LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR LIMITI DEL MODELLO ATOMICO DI RUTHERFORD Il modello atomico planetario di Ernest Rutherford, seppure rappresentava un grande passo avanti rispetto al modello
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
Programma svolto nell a.s
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
Il sistema periodico degli elementi
 Il sistema periodico degli elementi Cos è il sistema periodico? Che informazioni ne possiamo ricavare? Che predizioni possiamo trarne? 15/10/2012 Meyer: periodicità delle variazioni del volume molare atomico
Il sistema periodico degli elementi Cos è il sistema periodico? Che informazioni ne possiamo ricavare? Che predizioni possiamo trarne? 15/10/2012 Meyer: periodicità delle variazioni del volume molare atomico
Cenni di Fisica del Nucleo
 Capitolo 8 Cenni di Fisica del Nucleo 8.1 Proprietà generali dei nuclei In questo capitolo affrontiamo lo studio dei nuclei. Un nucleo è un insieme di neutroni e protoni legati insieme ( incollati ) dalla
Capitolo 8 Cenni di Fisica del Nucleo 8.1 Proprietà generali dei nuclei In questo capitolo affrontiamo lo studio dei nuclei. Un nucleo è un insieme di neutroni e protoni legati insieme ( incollati ) dalla
Chimica. 1) Il simbolo del Carbonio è: A) C B) Ca. C) Ce D) Cu. 2) Secondo il principio della conservazione della materia:
 Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
LICEO ARTISTICO STATALE Giacomo e Pio Manzù BERGAMO DOCENTE: FRANCA CUTILLO CLASSE 3H A.S. 2015 /_2016
 ML 119- PIAN DI LAVR CNSUNTIV LICE ARTISTIC STATALE BERGAM DCENTE: FRANCA CUTILL CLASSE 3H A.S. 2015 /_2016 CRS: X RDINAMENTALE DIURN SERALE SPERIMENTALE MICHELANGEL INDIRIZZ (SL TRIENNI): FINALITA _ l
ML 119- PIAN DI LAVR CNSUNTIV LICE ARTISTIC STATALE BERGAM DCENTE: FRANCA CUTILL CLASSE 3H A.S. 2015 /_2016 CRS: X RDINAMENTALE DIURN SERALE SPERIMENTALE MICHELANGEL INDIRIZZ (SL TRIENNI): FINALITA _ l
LICEO SCIENTIFICO STATALE R. CACCIOPPOLI ANNO SCOLASTICO 2012/13 CLASSE III G PROGRAMMA DI SCIENZE PROF.SSA ANGELOZZI ROBERTA CHIMICA
 LICEO SCIENTIFICO STATALE R. CACCIOPPOLI ANNO SCOLASTICO 2012/13 CLASSE III G PROGRAMMA DI SCIENZE PROF.SSA ANGELOZZI ROBERTA CHIMICA Misure e grandezze: Il Sistema Internazionale di unità di misura Grandezze
LICEO SCIENTIFICO STATALE R. CACCIOPPOLI ANNO SCOLASTICO 2012/13 CLASSE III G PROGRAMMA DI SCIENZE PROF.SSA ANGELOZZI ROBERTA CHIMICA Misure e grandezze: Il Sistema Internazionale di unità di misura Grandezze
La Risonanza Magnetica Funzionale
 La Risonanza Magnetica Funzionale Facoltà di Farmacia Corso di Laurea in Chimica e Tecnologie Farmaceutiche Attività a scelta dello studente AA 2004-2005 Cosimo Del Gratta Dipartimento di Scienze Cliniche
La Risonanza Magnetica Funzionale Facoltà di Farmacia Corso di Laurea in Chimica e Tecnologie Farmaceutiche Attività a scelta dello studente AA 2004-2005 Cosimo Del Gratta Dipartimento di Scienze Cliniche
LA LUCE. Perché vediamo gli oggetti Che cos è la luce La propagazione della luce La riflessione La rifrazione
 LA LUCE Perché vediamo gli oggetti Che cos è la luce La propagazione della luce La riflessione La rifrazione Perché vediamo gli oggetti? Perché vediamo gli oggetti? Noi vediamo gli oggetti perché da essi
LA LUCE Perché vediamo gli oggetti Che cos è la luce La propagazione della luce La riflessione La rifrazione Perché vediamo gli oggetti? Perché vediamo gli oggetti? Noi vediamo gli oggetti perché da essi
MODELLI ATOMICI. Dai primi modelli alla teoria moderna
 MODELLI ATOMICI Dai primi modelli alla teoria moderna Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole,
MODELLI ATOMICI Dai primi modelli alla teoria moderna Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole,
LEZIONE 2. Configurazioni elettroniche e tavola periodica
 LEZIONE 2 Configurazioni elettroniche e tavola periodica COSTRUZIONE DELLA CONFIGURAZIONE ELETTRONICA 1. Principio di Aufbau: gli elettroni occupano gli orbitali in ordine crescente di energia. dipende
LEZIONE 2 Configurazioni elettroniche e tavola periodica COSTRUZIONE DELLA CONFIGURAZIONE ELETTRONICA 1. Principio di Aufbau: gli elettroni occupano gli orbitali in ordine crescente di energia. dipende
Richiami. Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza
 Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
La Struttura degli atomi. ChimicaGenerale_lezione5 1
 La Struttura degli atomi ChimicaGenerale_lezione5 1 Modello atomico di Thomson Massa e carica dell'atomo sono distribuiti in modo uniforme nell'atomo La repulsione reciproca tiene gli elettroni lontani,
La Struttura degli atomi ChimicaGenerale_lezione5 1 Modello atomico di Thomson Massa e carica dell'atomo sono distribuiti in modo uniforme nell'atomo La repulsione reciproca tiene gli elettroni lontani,
Oltre il Sistema Solare
 Corso di astronomia pratica Oltre il Sistema Solare Gruppo Astrofili Astigiani Andromedae LE STELLE Nascita di una stella Una nube di gas (soprattutto idrogeno) Inizia a collassare sotto l azione della
Corso di astronomia pratica Oltre il Sistema Solare Gruppo Astrofili Astigiani Andromedae LE STELLE Nascita di una stella Una nube di gas (soprattutto idrogeno) Inizia a collassare sotto l azione della
SCUOLA PRIMARIA DI MAGGIATE Classe terza
 SCUOLA PRIMARIA DI MAGGIATE Classe terza Anno scolastico 2012-2013 TERRE ACQUE Osservando il nostro pianeta possiamo notare che la maggior parte della superficie è occupata dalle acque. Infatti esse occupano
SCUOLA PRIMARIA DI MAGGIATE Classe terza Anno scolastico 2012-2013 TERRE ACQUE Osservando il nostro pianeta possiamo notare che la maggior parte della superficie è occupata dalle acque. Infatti esse occupano
La Terra nello spazio
 La Terra nello spazio L'Universo è sempre esistito? L'ipotesi più accreditata fino ad ora è quella del Big Bang. Circa 20 miliardi di anni fa, una massa di piccolo volume, in cui vi era racchiusa tutta
La Terra nello spazio L'Universo è sempre esistito? L'ipotesi più accreditata fino ad ora è quella del Big Bang. Circa 20 miliardi di anni fa, una massa di piccolo volume, in cui vi era racchiusa tutta
LA FORZA...SIA CON TE!
 LA FORZA...SIA CON TE! CHE COS'E' LA FORZA? E' UNA GRANDEZZA FISICA VETTORIALE. L'UNITA' DI MISURA NEL S.I. E' IL "NEWTON" ( N ), DAL CELEBRE SCIENZIATO INGLESE ISAAC NEWTON, CHE NE HA STUDIATO LE LEGGI,
LA FORZA...SIA CON TE! CHE COS'E' LA FORZA? E' UNA GRANDEZZA FISICA VETTORIALE. L'UNITA' DI MISURA NEL S.I. E' IL "NEWTON" ( N ), DAL CELEBRE SCIENZIATO INGLESE ISAAC NEWTON, CHE NE HA STUDIATO LE LEGGI,
INTERAZIONI DELLE RADIAZIONI CON LA MATERIA
 M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
LICEO SCIENTIFICO STATALE G. MARCONI FOGGIA
 LICEO SCIENTIFICO STATALE G. MARCONI FOGGIA PROGRAMMA DI Fisica Classe VB Anno Scolastico 2014-2015 Insegnante: Prof.ssa La Salandra Incoronata 1 FORZA E CAMPI ELETTRICI (Richiami) Teoria sui vettori I
LICEO SCIENTIFICO STATALE G. MARCONI FOGGIA PROGRAMMA DI Fisica Classe VB Anno Scolastico 2014-2015 Insegnante: Prof.ssa La Salandra Incoronata 1 FORZA E CAMPI ELETTRICI (Richiami) Teoria sui vettori I
Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici.
 I blocchi s, p, d ed f della Tavola Periodica 1 La tavola periodica La tavola periodica La tavola periodica Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici. Si possono
I blocchi s, p, d ed f della Tavola Periodica 1 La tavola periodica La tavola periodica La tavola periodica Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici. Si possono
Stampa Preventivo. A.S Pagina 1 di 11
 Stampa Preventivo A.S. 2009-2010 Pagina 1 di 11 Insegnante BADALINI RENZO Classe 2BT Materia elementi di chimica e fisica preventivo consuntivo 99 84 titolo modulo 1. STRUTTURA E TRASFORM. DELL 2. L'ATOMO
Stampa Preventivo A.S. 2009-2010 Pagina 1 di 11 Insegnante BADALINI RENZO Classe 2BT Materia elementi di chimica e fisica preventivo consuntivo 99 84 titolo modulo 1. STRUTTURA E TRASFORM. DELL 2. L'ATOMO
Atomo: Meccanica Quantistica
 Atomo: Meccanica Quantistica Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica
Atomo: Meccanica Quantistica Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica
1.11.3 Distribuzione di carica piana ed uniforme... 32
 Indice 1 Campo elettrico nel vuoto 1 1.1 Forza elettromagnetica............ 2 1.2 Carica elettrica................ 3 1.3 Fenomeni elettrostatici............ 6 1.4 Legge di Coulomb.............. 9 1.5 Campo
Indice 1 Campo elettrico nel vuoto 1 1.1 Forza elettromagnetica............ 2 1.2 Carica elettrica................ 3 1.3 Fenomeni elettrostatici............ 6 1.4 Legge di Coulomb.............. 9 1.5 Campo
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
La strana storia del neutrino
 La strana storia del neutrino Antonio Ereditato Università di Berna con la collaborazione di Federico Scampoli Scuola Media Carducci-Purgotti, Perugia A.Ereditato - Perugia - 2011 1 Zoo delle particelle
La strana storia del neutrino Antonio Ereditato Università di Berna con la collaborazione di Federico Scampoli Scuola Media Carducci-Purgotti, Perugia A.Ereditato - Perugia - 2011 1 Zoo delle particelle
Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia. Francesco Nobili
 Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia Francesco Nobili TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tecniche analitiche basate sull interazione tra
Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia Francesco Nobili TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tecniche analitiche basate sull interazione tra
Recenti Scoperte Scientifiche in Ottica
 Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
SPETTROSCOPIA DI ASSORBIMENTO ATOMICO
 SPETTROSCOPIA DI ASSORBIMENTO ATOMICO L applicazione della spettroscopia UV-Vis ai singoli atomi piuttosto che alle molecole complesse è detta Spettroscopia di Assorbimento Atomico. L assorbimento di un
SPETTROSCOPIA DI ASSORBIMENTO ATOMICO L applicazione della spettroscopia UV-Vis ai singoli atomi piuttosto che alle molecole complesse è detta Spettroscopia di Assorbimento Atomico. L assorbimento di un
Lo spin dell elettrone
 Lo spin dell elettrone Abbiamo visto che un elettrone che ruota intorno al nucleo possiede un momento angolare orbitale, con il quale è associato anche un momento magnetico. Ci sono evidenze sperimentali
Lo spin dell elettrone Abbiamo visto che un elettrone che ruota intorno al nucleo possiede un momento angolare orbitale, con il quale è associato anche un momento magnetico. Ci sono evidenze sperimentali
Una vita per la meccanica quantistica. Alice Salvadori Liceo Scientifico G. Ulivi 5G
 Una vita per la meccanica quantistica Alice Salvadori Liceo Scientifico G. Ulivi 5G Introduzione Vita Quali meriti? Meccanica quantistica Il principio di indeterminazione Implicazioni filosofiche Nuovo
Una vita per la meccanica quantistica Alice Salvadori Liceo Scientifico G. Ulivi 5G Introduzione Vita Quali meriti? Meccanica quantistica Il principio di indeterminazione Implicazioni filosofiche Nuovo
Elettronica II Legame covalente e bande di energia nei solidi p. 2
 Elettronica II Legame covalente e bande di energia nei solidi Valentino Liberali Dipartimento di Tecnologie dell Informaione Università di Milano, 26013 Crema e-mail: liberali@dti.unimi.it http://www.dti.unimi.it/
Elettronica II Legame covalente e bande di energia nei solidi Valentino Liberali Dipartimento di Tecnologie dell Informaione Università di Milano, 26013 Crema e-mail: liberali@dti.unimi.it http://www.dti.unimi.it/
