SOMMARIO XIII BASI BIOLOGICHE 1 ASPETTI BIOMECCANICI 157 ISTOPISIOPATOLOGIA DELTESSUTO OSSEO 3 ASPETTI MORFOSTRUTTURALI DELL'OSSO PERIMPLANTARE 159
|
|
|
- Annalisa Carella
- 6 anni fa
- Visualizzazioni
Transcript
1
2 SOMMARIO BASI BIOLOGICHE 1 ISTOPISIOPATOLOGIA DELTESSUTO OSSEO 3 Istogenesi causale del tessuto osseo 4 Ossificazione intramembranosa 8 Ossificazione encondrale 9 Accrescimento in lunghezza delle ossa 12 Accrescimento diametrale delle ossa 16 Riorganizzazione interna dell'osso 19 Livelli organizzativi dei tessuto osseo 22 Matrice dell'osso 26 Matrice inorganica 27 Matrice organica: la componente fibrillare 28 Motrice organica: la componente non fibrillare 24 Cellule dell'osso 36 Linea di derivazione degli osteoblasti 40 Linea di derivazione degli osteoclasti 42 Osteoblasti 44 Osteociti 53 Processo di trasformazione dell'osteoblasta in osteocita 58 Funzioni dell'osteocita 62 Cellule di rivestimento 64 Osteoclasti 70 Organizzazione funzionale delle cellule ossee 76 Tessuti ossei 81 Osso primario o di addizione 82 Osso secondano o di sostituzione 84 Osso o fibre intrecciate 86 Osso a fibre parallele 90 Osso lamellare 92 Architetture dall'osso 99 Architettura spongiosa 102 Architettura compatta 104 Supporto vascolare 106 Circolazione microcavitaria 110 Funzioni delle cellule ossee 113 Considerazioni clinico-biologiche sull'adattamento osseo 116 Adattamento osseo e influenze biofisiche 121 Agenti mitogeni 123 Aspetti dinamici dell'architettura e della struttura dell'osso 124 Relazioni tra sollecitazioni deformanti e risposta cellulare 128 Deformazioni e adattamento osseo 129 Meccanocettori e chemocettori ossei 131 Sequenze di coordinazione cellulare nel rimaneggiamento osseo 134 Modulazione dell'attività di rimaneggiamento osseo 135 Controllo traiettoriale dell'attività cellulare 136 Biologia dello riparazione delle lesioni traumatiche 138 Emostasi e danno anossico 139 Flogosi. invasione e induzione cellulare 140 Rimozione dell'ematoma e dei tessuti necrotici 141 Blastema fibrocellulare 142 Osteogenesi e rimodellamento 144 Riparazione della ferita chirurgica attorno agli impianti Dentali 145 Incorporazione degli impianti: protocolli line-to-line versus protocolli press-fit 146 Presupposti perla valutazione della riparazione dello ferita chirurgica attorno agi impianti bioinerti di titanio 148 Stadiazione della riparazione nella ferita implantare 150 Indagini istologiche comparate per l'analisi del substrato osseo perimplantare 154 ASPETTI BIOMECCANICI 157 ASPETTI MORFOSTRUTTURALI DELL'OSSO PERIMPLANTARE 159 I biomateriali 160 Interfaccia osso-titanio 162 Reperimento di campioni bioptici umani 164 Organizzazione architetturale e tissutale dell'osso perimplantare 166 Morfologia della superficie ossea all'interfaccia 176 Competenza biomeccanica del substrato di sostegno e stabilità tissutale 178 Propagazione delle sollecitazioni dall'impianto al substrato 184 Adattamento morfostrutturale nel caso di morfotipi implantari peculiari 192 Adattamento strutturale in relazione alla geometria impiantare 198 Perdita dell'anchilosi funzionale 204 Rapporti funzionali tra osso e impianto 208 Unità osso impianto 212 Ampiezza biologica 216 Analogie tra impianti ortopedici e dentali 220 Caratteristiche dei biomateriali e rapporti di superficie 221 Dinamica della riparazione della ferita chirurgica 222 Periodo iniziale postchirurgico 223 Periodo intermedio postchirurgico 227 Periodo postchirurgico tardivo 228 XIII
3 Rapporti morfostrutturali tra osso e impianti a distanza di tempo 230 Potenzialità rigenerative del tessuto osseo attorno a impianti ortopedici 234 Considerazioni sull'organizzazione ossea perimplantare 238 APPLICAZIONI CLINICHE 241 CHIRURGIA SPECIALE IMPLANTOLOGICA 243 Evoluzione delle ossa mascellari in seguito all'edentulia 244 Zona interforaminale 246 Zone periforaminale 248 Zona posteriore 250 Zona frontale 252 Zona del pilastro canino 253 Zona subantrale 254 Zona del tuber e pilastro pterigoideo 256 Limiti d'età 258 Osteoporosi 260 Diagnostica tridimensionale mediante TC in associazione a placche di guida 262 Aspetti decisionali chirurgici 264 Placche di guida chirurgiche 266 Intervento chirurgico 269 Aspetti decisionali biologici 273 Importanza della gengiva cheratinizzata 274 Management dei tessuti molli perimplantari 276 Aumento della gengiva aderente 278 Incesto libero epitelio-connettivale 280 Innesto libero connettivale 281 Formazione di pseudopapille interimplantari 282 Condizioni determinanti il protocollo impiantare 284 Impianti nello zona posteriore dello mandibola 288 Mandibola gravemente atrofica 290 Connessione degli abutment di guarigione 292 TRATTAMENTO PROTESICO CON IMPIANTI 295 Protesi provvisoria: aspetti biomeccanici 296 Protesi provvisoria: funzionalizzazione graduale 297 Protesi provvisoria: aspetti estetici 298 Sistemo biomeccanico e carico funzionale 300 Adeguato numero di impianti 301 Momento flettente e sovraccarico 302 Sistemi geometrici autoprotettivi 303 Tripodi planari multipli 304 Protesi cementata versus protesi avvitata 307 Connettri rigidi 310 Protesi su corone doppie 312 Edentulia parziale 314 Carenza di spazio protesico posteriore 315 Stati parafunzionali 316 Dismorfosi scheletriche e dentali 318 Traumi 320 Connessione denti-impianti 324 Carico ritardato versus carico immediato 326 Edentulia totale della mandibola 332 Overdenture della mandibola edentula 333 Ancoraggio con barra a possibilità rotazionale 334 Ancoraggio mediante attacchi a bottone 336 Ancoraggio a barra con patrici o matrici 338 Ancoraggio con barre a connessione rigida 340 Ancoraggio con barre a possibilità rotazionale 341 Ancoraggio telescopico 342 Ancoraggio ibrido 344 Protesi mobili sospese o ferule amovibili 345 Condizione di edentulia del mascellare 346 Overdenture nel mascellare edentulo 347 Utilizzo di due impianti 348 Utilizzo di quattro impianti 349 Utilizzo da tre o cinque impianti in posizione Asimmetrica 350 Ancoraggio ibrido resiliente 352 Considerazioni sul trattamento protesico con impianti 353 RIGENERAZIONE OSSEA GUIDATA 355 Osteopromozione 356 Classificazione dei difetti ossei perimplantari 357 Membrane non riassorbili 360 Membrane riassorbibili 361 Linee guida con membrane in e-ptfe 362 Cavità residue e membrane non riassorbibili 364 Cavità residue e membrane riassorbibili 365 Split crestale e impianti immediati 366 Spit crestale preparatorio alla chirurgia implantare 368 Associazione di membrane in e-ptfe e membrane in collagene 370 Tecniche di supporto addizionale 372 Esposizione delle membrane in e-ptfe 373 Rigenerazione perimplantare in distrazione 374 Correzione dei profilo crestale 376 Gestione delle protesi provvisorie in GBR 378 Difetti residui e innesti alloplastici 380 INNESTI OSSEI AUTOLOGHI 303 Integrazione dell'innesto 384 Indicazione agli innesti ossei 388 Osteoconduzione 390 Osteoconduzione senza utilizzo di membrane 392 XIV
4 Osteoconduzione con membrane riassorbibili 394 Osteocenduzione con membrane non riassorbibili 396 Innesti d osso prelevati dallo teca cranica 398 Innesti d osso prelevati dalla cresta iliaca 399 Inserimento immediato o differito degli impianti 400 Innesti moscellari combinati 402 Riabilitazione del mascellare atrofico 406 COMPLICANZE 437 Complicaze chirurgiche immediate 438 Complicanze postchirurgiche precoci 441 Complicanze postchirurgirche tardive 444 Complicanze protesiche 446 ALTERAZIONI PATOLOGICHE TRATTAMENTO INTEGRATO ORTODONTICO-IMPLANTARE 409 Ancoraggio ortodontico 410 Considerazioni sui piano di trattamento integrato Ortodontico-implantare 412 Agenesie 414 Agenesia dentale multipla 418 Reintegro dei primi molari inferiori perduti precocemente 420 Chirurgia ortognatica e implantologica 422 ESITI DI LABIO-PALATO-SCHISI 425 Classificazione degli esiti di LPS 426 Inadeguatezza dei sito impiantare in esiti di LPS 428 Innesti di osso autologo in esiti di LPS 430 Approccio simultaneo implantare e di osteoplastica Terziaria in esiiti di LPS 432 Evidenze radiografiche della maturazione degli innesti di osso autologo 434 DEI TESSUTI PERIMPLANTARI 451 Plaque theory 452 Loading theory 452 Diagnosi delle alterazioni patologiche dei tessuti perimplantari 454 Trattamento delle alterazioni patologiche dei tessuti perimplantari 455 Linee guida nel trattamento delle perimplantiti 456 Terapia delle perimplantiti 457 Chirurgia resettiva versus rigenerativa 458 Rimozione dell'impianto 461 Igiene, profilassi, mantenimento 462 Igiene professionale 463 BIBLIOGRAFIA 464 INDICE ANAUTICO 482 FONTI ICONOGRAFICHE 488 XV
5 ISTOGENESI CAUSALE DEL TESSUTO OSSEO Risale al secolo scorso la concezione secondo la quale ogni tessuto adibito a funzioni di sostegno è sottoposto, anche durante la sua differenziazione, al controllo esercitato dalle forze meccaniche (Roux, 1895). Si deve però a Pauwels (1965; 1973a) l introduzione del concetto che il mesenchima può essere stimolato ed indirizzato verso la differenziazione da condizioni meccaniche quali la tensione e la pressione idrostatica. L istogenesi causale, proposta da Pawels, ha il pregio di considerare la maggior parte dei fenomeni differenziativi del mesenchima secondo una visione unitaria. Le sollecitazioni, in base a come agiscono, producono effetti deformanti differenti sul corpo al quale sono applicate. Nel caso del mesenchima sono in grado di modificare la forma ed il metabolismo delle sue cellule e nel contempo ne influenzano la differenziazione verso il fenotipo più idoneo a far fronte alle specifiche sollecitazioni. Le cellule mesenchimali sono, infatti, estremamente sensibili alle sollecitazioni meccaniche e non sono in grado d'opporre resistenza alla deformazione, ma hanno la capacità di sopportare forze di intensità elevata Mesenchima. Il mesenchima, in quanto costituito prevalentemente da liquido intercellulare, si comporta meccanicamente come un fluido, che sotto l azione delle sollecitazioni deformanti si sposta nella direzione di maggior tensione. Alla deformazione segue una differenziazione verso il fenotipo cellulare più idoneo a contrastare e convivere con la sollecitazione deformante. 4
6 In particolare, nel caso di forze pressorie di tipo idrostatico, gli elementi del mesenchima ritirano le estroflessioni citoplasmatiche ed assumono una forma sferoidale. E verosimile ipotizzare che in queste circostanze si producono modificazioni delle proprietà della membrana citoplasmatica e del metabolismo cellulare a cui consegue un evoluzione verso un tessuto, relativamente braditrofico quale la cartilagine. La pressione idrostatica può però essere prodotta non solo da forze esterne, ma anche da forze espansive in volumi limitatamente estensibili; circostanze che si verificano normalmente nel mesenchima che costituisce gli abbozzi embrionali delle estremità. Nel caso invece di forze tensili, gli elementi cellulari del mesenchima assumono una forma più allungata e una disposizione in accordo con il vettore della forza deformante. Immerse nel fluido intercellulare, le macromolecole di struttura precursori del collagene si allineano passivamente, secondo la direzione della forza traente e grazie a progressive apposizioni, si accrescono in aggregati fibrillari sempre più spessi costituendo, sin dall inizio, una struttura direzionale. In seguito, la loro stabilizzazione intermolecolare ne limita l estensibilità favorendo l opposizione ad ulteriori scorrimenti interni. E questo il caso dei tessuti connettivi fibrosi, che costituiscono i tendini (Pawels, 1965) Istogenesi causalea. Lo schema raffigura le trasformazioni dei tessuti di sostegno in seguito al tipo e all intensità di sollecitazione. 5
7 Il tessuto osseo, che è l espressione più evoluta dei tessuti connettivi, si forma sempre per sostituzione di un tessuto di sostegno preesistente. La condizione necessaria perchè questo tessuto si realizzi è che il primitivo sostegno, fibroso o cartilagineo, venga stimolato meccanicamente e nel contempo rimanga immobile (Pauwels 1965; 1973a; Lozupone et al 1992). Si riconoscono due differenti processi osteogenetici: l ossificazione intramembranosa, quando l'osso si forma direttamente in seno al tessuto connettivo, e l ossificazione encondrale, quando l'osso si sviluppa a partire da un modello cartilagineo. In quest'ultimo schema formativo la maggior parte della cartilagine che calcifica viene rimossa mentre sulla restante inizia la deposizione di tessuto osseo; i fenomeni di riassorbimento della cartilagine, almeno nello stadio iniziale, predominano quantitativamente su quelli formativi del nuovo tessuto osseo. In entrambi i tipi di ossificazione, tuttavia, la deposizione dell osso si svolge essenzialmente nello stesso modo, con differenze sulla qualità del supporto scheletrico iniziale ed interferenzesulle caratteristiche strutturali dell articolazione che unirà i segmenti scheletrici. L'osso può sporadicamente formarsi anche in seno a tessuti connettivi che non appartengono all apparato locomotore; questo fenomeno viene denominato formazione osteogenesi ectopica Osteogenesi. Lo schema raffigura i principali processi dei due differenti tipi di ossificazione: a mesenchima; b - mesenchima addensato; c - abbozzo di tessuto fibroso; d - osteogenesi; e - abbozzo di cartilagine ialina; f - cartilagine ipertrofica; g - cartilagine calcificata; h - condrolisi; i osteogenesi. 6
8 Generalmente, in condizioni normali si forma dapprima osso spongioso le cui strutture sono rappresentate da esili trabecole che vengono successivamente ispessite. L osso compatto fa la sua comparsa solo in un secondo tempo per restringimento degli interstizi compresi fra le trabecole, con confinamento degli spazi vascolari all interno di sottili canali per il mantenimento del trofismo cellulare (Marotti 1988). Nella costituzione dei segmenti scheletrici si assiste solitamente ad un progressivo irrobustimento periferico che esita nella formazione di un astuccio di osso compatto, denominato anche osso corticale. All interno di questo guscio rimane ospitato l osso spongioso, tra le cui strutture trabecolari si instaura un ampia rete di sinusoidi vascolari ed il tessuto midollare. Durante lo sviluppo le strutture ossee continuano a mantenere rapporti con le impalcature connettivali e cartilaginee di origine che ne garantiscono il progressivo accrescimento. L osso, come del resto la cartilagine e il connettivo fibroso, è una struttura di sostegno organizzata sin dalla sua origine secondo un orientamento direzionale in accordo con le sollecitazioni meccaniche. La differenza sostanziale tra il tessuto osseo e gli altri tessuti di sostegno risiede nella rigidità della sua struttura, garantita dalla presenza di sali minerali, di cui la sostanza fondamentale è particolarmente ricca. 4. Osso di nuova formazione. La microscopia ottica evidenzia nella parte superiore osso compatto e al centro trabecole di osso spugnoso. Perone (Homo). 7
9 OSSIFICAZIONE INTRAMEMBRANOSA Alcune ossa piatte del cranio, come il frontale, il parietale, l'occipitale, il temporale e parte della mandibola, si formano per ossificazione intramembranosa (Fig. 3) e vengono denominate ossa membranose. In questo tipo di ossificazione il mesenchima si condensa a formare uno strato di tessuto connettivo riccamente vascolarizzato. Cellule mesenchimali differenziate, osteoprogenitrici, si addensano attorno ai capillari; delicati fasci di fibre collagene, orientati a caso e inclusi in una sostanza fondamentale più densa, occupano gli spazi intercellulari. Dopo trasformazione ipertrofica delle cellule osteoprogenitrici compare una formazione sottile, costituita da una matrice eosinofila più densa, avente forma di tralci o strisce approssimativamente equidistanti dai vasi sanguigni. Allo stesso tempo, le circostanti cellule osteogeniche aumentano di volume, si radunano alla superficie di questo tessuto primitivo e assumono forma cubica o cilindrica. Le cellule divengono intensamente basofile e il nucleo si dispone verso il mesenchima circostante, assumendo una polarizzate che permette di identificarle come osteoblasti. Questi secernono molecole di tropocollagene che, aggregandosi al di fuori delle cellule, formano la componente fibrillare della matrice. Nella neoformata matrice preossea, detta osteoide, compaiono i primi cristalli di sali di calcio, associati a vescicole denominate matrix vesicles, che producono la mineralizzazione dell osso. Il seguente accrescimento porta alla formazione di trabecole ossee calcificate, che si dispongono a formare delle maglie intrecciate e ramificate tra i vasi sanguigni. Le trabecole primitive vengono progressivamente ispessite a spese del tessuto connettivo interposto e gli spazi che circondano i vasi sanguigni vengono per la maggior parte colmati. Nelle regioni in cui l'osso è destinato a rimanere spugnoso, le trabecole cessano di ispessirsi ed il connettivo vascolarizzato, interposto fra di esse, si trasforma gradualmente in tessuto emopoietico. A questo punto il connettivo che circonda esternamente il segmento scheletrico in accrescimento si condensa per formare il periostio. 5. Ossificazione intramembranosa. Fase iniziale di deposizione dell osso trabecolare nell abbozzo mesenchimale. Abbozzo di mascellare di feto (Homo). 8
10 OSSIFICAZIONE ENCONDRALE Le ossa della base del cranio, della colonna vertebrale, del bacino e degli arti sono denominate ossa di sostituzione, perché in un primo tempo sono costituite da cartilagine ialina; questa viene successivamente sostituita da tessuto osseo grazie ad un processo denominato ossificazione encondrale. I segmenti scheletrici dove meglio è apprezzabile questo processo sono rappresentati dalle ossa lunghe degli arti. In essi, comunque, è distinguere gli eventi che portano alla costituzione delle formazioni di accrescimento metafisarie o epifisarie da quelli che si susseguono durante tutto il periodo di accrescimento longitudinale delle ossa. Nell abbozzo cartilagineo, che ricalca le forme e le dimensioni del futuro osso lungo in formazione, i condrociti subiscono notevoli modificazioni; ciò costituisce il primo segno tangibile della comparsa del centro di ossificazione primario. I condrociti situati nella parte centrale della diafisi dell abbozzo cartilagineo diventano ipertrofici, si arricchiscono di glicogeno e assumono un aspetto molto vacuolizzato. Le lacune in cui sono contenuti s'ingrandiscono a spese della circostante matrice cartilaginea che, gradualmente, si riduce a sottili setti fenestrati ed a spicole di forma irregolare Ossificazione encondrale. Lo schema raffigura i principali eventi della formazione di un osso lungo: a - abbozzo cartilagineo; b - modifiche dell abbozzo formato da condrociti normali (I), ipertrofici (II), mentre, nel connettivo che circonda la diafisi, osteoblasti (III) formano il manicotto osseo periostale per ossificazione membranosa; c - calcificazione della cartilagine; d - erosione della cartilagine calcificata con deposizione ossea sui setti residui della stessa e comparsa di un centro di ossificazione secondario in una delle epifisi. 9
11 La matrice ialina che circonda i condrociti ipertrofici si calcifica; quando nel plasma sanguigno e nel liquido interstiziale del tessuto è presente un'adeguata concentrazione di calcio e di fosfato, si depositano in essa piccoli accumuli di cristalli di fosfato di calcio. Le cellule cartilaginee ipertrofiche vanno quindi incontro a modificazioni regressive, che consistono nell'ingrossamento del nucleo e nella perdita della cromatina, muoiono e degenerano mentre la matrice extracellulare mineralizza. Parallelamente alle modificazioni citologiche a carico dei condrociti presenti all'interno dell'abbozzo cartilagineo si attivano le potenzialità osteogeniche delle cellule mesenchimali del connettivo pericondrale, che, trasformandosi in osteoblasti depositano attorno alla parte centrale della diafisi un sottile strato di tessuto osseo, denominato manicotto o collare periostale. 7. Ossificazione encondrale: stadio iniziale. In origine le ossa lunghe risultano costituite esclusivamente da cartilagine ialina, all interno della quale i condrociti appaiono morfologicamente uniformi. In questa fase non è presente citomorfosi condrocitaria. Abbozzo cartilagineo di una falange di feto (Homo). 8. Ossificazione encondrale: stadio avanzato. Il preparato evidenzia come i condrociti appaiano ipertrofici al centro della diafisi con, al di sotto, la zona di calcificazione della cartilagine; questa viene erosa per produrre una cavità (parte inferiore dell immagine). Abbozzo cartilagineo di una falange di feto (Homo) 10
12 Al tempo stesso, dal connettivo periostale che circonda questo collare osseo, grazie all attività macrofagica di cellule portate dai vasi, vengono prodotte per erosione aperture nel manicotto che permettono ai vasi sanguigni in accrescimento di penetrare nella diafisi. L attività macrofagica si estende poi all interno della matrice cartilaginea calcificata sino a trasformare la porzione interna dell abbozzo scheletrico in una cavità. All interno della primitiva cavità diafisaria i vasi perforanti crescono verso le epifisi, formando anse capillari che raggiungono le pareti della cavità stessa,; quest ultima è delimitata internamente da cartilagine calcificata che si continua con la cartilagine ialina epifisaria ed esternamente è rivestita da osso. Nelle due epifisi compaiono successivamente uno o più centri di ossificazione secondari. Cellule mesenchimali indifferenziate sono trasportate all'interno della cartilagine dal tessuto connettivo perivascolare che accompagna i vasi sanguigni; alcune di esse si differenziano in elementi emopoietici del midollo ed altre, giunte a contatto della cartilagine calcificata, si differenziano in osteoblasti. Queste cellule si radunano a formare uno strato simil-epiteliale a ridosso della superficie delle spicole di matrice cartilaginea calcificata e depositano su di esse matrice ossea. Le prime trabecole che si formano nei centri di ossificazione encondrale sono quindi costituite da una parte centrale di cartilagine calcificata, rivestita da uno strato di osso di variabile spessore. Le trabecole sono facilmente distinguibili da quelle più omogenee che si formano nell'ossificazione intramembranosa, perché la cartilagine calcificata e l'osso posseggono radiopacità e affinità tintoriali diverse. 9. Ossificazione encondrale: stadio terminale. Nella porzione centrale di queste trabecole la cartilagine calcificata (in viola scuro) è ben distiguibile dall osso (in arancio). All interno del segmento scheletrico le trabecole verranno successivamente erose per costituire la futura cavità midollare della diafisi. Alla periferia, per continua deposizione, le trabecole assumono in seguito un aspetto compatto per costituire la corticale diafisaria. La cartilagine calcificata, assieme all osso primario ad essa adeso, verrà successivamente sostituita con il processo di rimaneggiamento strutturale dell osso. Metafisi di un osso lungo decalcificato (Homo). 11
13 ACCRESCIMENTO IN LUNGHEZZA DELLE OSSA A seguito della comparsa del centro primario di ossificazione nella diafisi, i condrociti delle metafisi, invece di essere raccolti in modo casuale a piccoli gruppi, come avviene di solito nella cartilagine ialina, assumono una disposizione ordinata in colonne longitudinali. Tale configurazione consente il continuo accrescimento in lunghezza dell'abbozzo cartilagineo, mentre nello stesso tempo nella diafisi il processo di ossificazione può progredire in direzione delle estremità. Nell'ambito di ciascuna colonna le cellule risultano divise fra loro da sottili setti trasversali, mentre colonne adiacenti sono separate da lamine più ampie di matrice ialina, dirette longitudinalmente. I condrociti vanno incontro alla stessa serie di modificazioni strutturali che precedono la calcificazione della cartilagine nella porzione centrale della diafisi, ma nel piatto di accrescimento metafisario il processo risulta notevolmente più ordinato. Lungo le colonne della metafisi, infatti, le cellule cartilaginee si succedono l'una all'altra delineando caratteristiche zone evolutive che corrispondono ai diversi stadi della loro citomorfosi. 10. Ossificazione encondrale. L immagine evidenzia come i condrociti risultano disposti in modo molto ordinato a colonne. Metafisi di osso lungo decalcificato (Homo). 12
14 A partire dall'epifisi, dove è presente la cartilagine di riserva o zona di quiescenza, nella quale le cellule sono poco attive, procedendo verso la cavità diafisaria, si riscontra la zona di proliferazione, sede di piccoli condrociti appiattiti spesso in mitosi che assicurano il continuo accrescimento delle colonne. Segue la zona di ipertrofia, in cui le cellule non si dividono più, ma gradualmente aumentano di volume e depongono una matrice con caratteristiche diverse da quella preesistente. Le cellule divengono poi molto grandi, vacuolizzate, quindi degenerano e muoiono; questa regione, o zona di calcificazione, è sede di deposizione di sali di calcio nella matrice. All'estremità diafisaria del piatto di accrescimento, o zona di condrolisi, si riscontrano condroclasti che rimuovono i setti cartilaginei trasversali ed i condrociti in degenerazione. Queste cellule allargano le lacune cartilaginee calcificate ed erodono anche i setti intercolonnari; si producono così cavità longitudinali che vengono popolate da anse capillari e dal connettivo lasso, provenienti dagli spazi midollari della diafisi. Osteoblasti, differenziati dalle cellule mesenchimali che hanno invaso le cavità comprese tra le colonne calcificate dell'estremità diafisaria o zona di osteogenesi, depongono un sottile strato di matrice ossea sulla superficie delle irregolari lamine longitudinali di cartilagine, risparmiate dai condroclasti. 11. Ossificazione encondrale. Lo schema raffigura le sei zone che caratterizzano le diverse fasi dell attività cellulare, che conduce all evoluzione della cartilagine in tessuto osseo in un piatto di accrescimento metafisario. 13
15 I centri primari di ossificazione compaiono in tutte le principali ossa dello scheletro prima della fine del terzo mese di vita intrauterina. Nelle epifisi, la caratteristica ipertrofia dei condrociti che prelude all'inizio dell'ossificazione è evidenziabile molto più tardi, di solito dopo la nascita. In seguito, in queste zone si avrà l invasione delle cavità prodotte dai condroclasti da parte di vasi sanguigni e di tessuto osteogenico, provenienti dal pericondrio, con la formazione dei centri di ossificazione secondari. L'espansione dei centri secondari produce la sostituzione della cartilagine epifisaria con osso; alla periferia, tuttavia, permane uno strato che costituisce la cartilagine articolare, mentre verso la diafisi si formerà un disco disposto trasversalmente denominato cartilagine di accrescimento o di coniugazione. Questocorrisponde alla parte cartilaginea del piatto di accrescimento metafisario, posto tra epifisi e diafisi, dove la continua moltiplicazione dei condrociti e la successiva produzione di matrice, in particolare nella zona proliferativa, saranno responsabili dell accrescimento longitudinale delle ossa lunghe. 12. Ossificazione encondrale. Colorazione istochimica per la fosfatasi alcalina totale (TALP): si noti come la fosfatasi alcalina (in blu) che evidenzia le cellule impegnate in attività depositiva, sia elevata attorno ai condrociti della zona di ipertrofia e agli osteoblasti della zona di osteogenesi. Osso coxale non decalcificato incluso in PMMA (Oryctolagus cuniculus). 14
16 In condizioni normali, all'estremità epifisaria della zona proliferativa della cartilagine di coniugazione, i condrociti si moltiplicano con una velocità che eguaglia quella delle cellule che degenerano: lo spessore della cartilagine di coniugazione si mantiene pertanto approssimativamente costante per un ampio periodo della vita di un osso lungo. L'accrescimento dell'osso è possibile perché le cellule cartilaginee della zona di quiescenza proliferano gradualmente e continuamente, allontanandosi sempre più dal centro della diafisi. Queste producono una matrice, cioè un nuovo tessuto cartilagineo che è progressivamente sostituito dal tessuto osseo, realizzando come risultato finale un aumento in lunghezza della diafisi stessa. Alla fine del periodo di accrescimento, l'attività proliferativa dei condrociti rallenta, determinando la scomparsa della cartilagine di coniugazione che viene quindi sostituita da osso spugnoso e da midollo: il processo e denominato fusione o saldatura delle epifisi. A partire da questo momento, l epifisi e la diafisi, entrambe costituite da tessuto osseo, si continuano l'una con l'altra e non è più possibile un ulteriore aumento in lunghezza del segmento scheletrico. 13. Ossificazione encondrale. Colorazione istochimica per la fosfatasi acida tartrato resistente (TRAP). La reazione mette in evidenza i lisosomi ricchi di fosfatasi contenuti nei condroclasti (in rosso) della zona di condrolisi. La cartilagine calcificata appare in blu scuro e l osso neoformato in grigio. Osso coxale non decalcificato incluso in PMMA (Oryctolagus cuniculus). 15
17 ACCRESCIMENTO DIAMETRALE DELLE OSSA Le ossa lunghe degli arti sono classificate come ossa di sostituzione, perché si formano da un modello cartilagineo preesistente. Il loro aumento in lunghezza dipende da un processo di ossificazione encondrale secondo uno schema evolutivo determinato dalla presenza dei piatti metafisari. L accrescimento diametrale, invece, è dovuto alla deposizione di nuovo osso sulla superficie periostale e alla contemporanea erosione sul lato endostale. Al termine dello sviluppo, l'osso compatto che costituisce la diafisi delle ossa lunghe si è quasi completamente formato per espansione diametrale, dovuta all ossificazione periostale. Dopo la comparsa del centro di ossificazione primario, le estremità dell'abbozzo cartilagineo continuano ad allungarsi e a espandersi per proliferazione dei condrociti e formazione di nuova matrice. Questo accrescimento interstiziale, invece, non è più possibile nella diafisi poiché l iniziale cartilagine presente nella sua porzione interna è stata completamente eliminata. La cartilagine presente alla periferia viene sostituita dal tessuto osseo derivato dal periostio; quest ultimo è originato dal primitivo connettivo pericondrale. 14. Accrescimento diametrale dell osso. Si noti come la fosfatasi alcalina totale (TALP) sia elevata all esterno della corticale, cioè nella zona di deposizione subperiostale (A); la fosfastasi acida tartrato resistente (TRAP) mette in risalto gli osteoclasti (in rosso) che erodono l osso endostale prodotto precedentemente (B). Corticale di osso lungo non decalcificato incluso in PMMA (Oryctolagus cuniculus). 16
18 Per questo motivo l'osso di origine encondrale, che si forma all estremità metafisaria della diafisi nel suo accrescimento non può assumere un diametro maggiore di quello che possiede il modello cartilagineo da cui origina. Inizialmente questo diametro corrisponde esattamente a quello che diafisi possedeva al momento della comparsa del centro primario di ossificazione encondrale. In seguito, per accrescimento periferico subpericondrale, del piatto di coniugazione, la cartilagine metafisaria aumenta di dimensione seguendo l incremento diametrale delle epifisi, dovuto ad un rapido accrescimento interstiziale della cartilagine. Pertanto, se in un preciso momento si ha produzione di osso metafisario, questo sarà caratterizzato da un ben definito diametro, derivato da quello che il piatto metafisario ha in quell istante; quest osso diviene, per compattazione, l estremità metafisaria della parete della diafisi. Il restante osso diafisario, prodotto precedentemente a quello dell estremità metafisaria, possedeva nel momento della sua formazione un diametro tanto minore quanto più risulta distante dalla metafisi; ciò determina la necessità di una deposizione periostale, per avere la stessa dimensione di quello ora prodotto dal piatto di accrescimento metafisario in progressiva espansione diametrale. 15. Accrescimento diametrale dell osso. La marcatura con oxitetraciclina evidenzia come il fronte di deposizione sia lineare. Corticale di osso lungo non decalcificato incluso in PMMA (Oryctolagus cuniculus). 17
19 Per il mantenimento dimensionale si rende quindi necessaria una deposizione apposizionale in grado di produrre un progressivo ispessimento del manicotto osseo periostale. Tale ispessimento si realizza in modo ordinato e genera i cosiddetti sistemi o lamelle circonferenziali esterne, formati da osso primario a struttura lamellare. Nell'accrescimento diametrale delle ossa il riassorbimento è tanto attivo quanto la formazione di nuovo tessuto. Contemporaneamente alla neodeposizione periostale della diafisi avviene un progressivo riassorbimento della corticale interna da parte di osteoclasti che risultano presenti nelle superfici endostali. Queste cellule sono responsabili dell erosione della parete ossea endostale, che, parallelamente all assottigliamento dello spessore della parete diafisaria, conduce all'ampliamento della cavità midollare. La velocità con cui viene apposto nuovo osso sulla superficie periostale e quella con cui procede il riassorbimento della superficie endostale sono regolate in modo tale che il cilindro diafisario si accresca più rapidamente di quanto non aumenti lo spessore della sua parete. In altre parole, l attività coordinata degli osteoblasti dal lato periostale e degli osteoclasti da quello endostale consente al cilindro osseo in formazione di accrescere diametralmente, senza subire un ispessimento. In questo modo il segmento scheletrico è soggetto a un aumento dimensionale che prosegue fino al completamento dell accrescimento corporeo, consentendo nel contempo un espansione della cavità midollare, all interno della quale il tessuto emopoietico ha modo di svilupparsi. Nell ambito di questo tessuto prendono origine e maturano gli elementi cellulari del sangue. 16. Accrescimento diametrale dell osso. Si noti come l osso apposizionale formi i sistemi circonferenziali esterni (parte superiore dell immagine) che subiscono successivamente un rimodellamento (parte inferiore dell immagine). Corticale di tibia non decalcificata e non inclusa (Homo). 18
20 RIORGANIZZAZIONE INTERNA DELL'OSSO La trasformazione dell'osso spongioso primario in osso compatto è dovuta all'ispessimento delle trabecole con progressiva invasione degli spazi midollari da parte del tessuto mineralizzato, che causa una riduzione dimensionale delle cavità preesistenti (Marotti 1988). L osso che riempie le areole midcollari può avere la stessa morfologia strutturale del primitivo osso a fibre intrecciate o, se deposto più lentamente, possedere una struttura più ordinata; questo è il caso dell osso a fibre parallele, dove i fasci di collagene sono orientati tutti parallelamente tra loro, e dell osso lamellare, in cui la deposizione si realizza a strati (Marotti 1990, 1993). Si costituiscono in tal modo formazioni, cilindroidi, denominate osteoni o sistemi haversiani primitivi o primari, per distinguerli dagli osteoni tipici dell'osso adulto o secondari, in genere esclusivamente lamellari e con struttura più regolare (Marotti e Muglia 1992). L osso lamellare secondario viene deposto, infatti, solo nel corso del rimaneggiamento strutturale, che si attua per erosione osteoclastica dell'osso primario, con formazione di cavità di riassorbimento, che in un secondo tempo vengono colmate dall attività depositiva osteoblastica (Frost 1963a, 1963b, 1969). Nello specifico del rimaneggiamento strutturale osteonico gli osteoclasti producono cavità, in forma di lunghi canali cilindrici, sulle pareti delle quali segue la deposizione osteoblastica di lamelle concentriche che ne determinano un restringimento; al centro residua un canale che ospita le strutture vascolari per il trofismo dell osteone neocostituito (Lacroix 1971). 17. Erosione osteoclastica dell osso primario. Si noti come fosfastasi acida tartrato resistente (TRAP) evidenzi gli osteoclasti multinucleati (in rosso) adesi a cavità di erosione prodotte nell osso endostale. Corticale di osso lungo non decalcificato incluso in PMMA (Oryctolagus cuniculus). 19
21 Nel rimaneggiamento strutturale la superficie, dove ha avuto termine l attività erosiva degli osteoclasti e dove è cominciata la nuova deposizione ossea, si identifica in sezione per la presenza delle linee cementanti, contenenti poco collagene, ricche in glicoproteine e proteoglicani e dovute alla calcificazione di materiale deposto per primo sulla parete della cavità di riassorbimento (Weidenreich 1930, Frasca 1981). L'osso secondario può gradualmente rimpiazzare tutti i sistemi haversiani primitivi; di conseguenza, più ci si allontana dalla nascita, maggiore è la difficoltà di reperire osso primario. Le linee cementanti separano, quindi, formazioni secondarie dal tessuto circostante che solo all inizio è costituito interamente da osso primario, ma alla fine dell accrescimento è sostituito da osso secondario. L erosione dell'osso e la sua ricostruzione non terminano con la sostituzione dell'osso primario da parte di quello secondario, ma proseguono attivamente per tutta la vita; continuano infatti a comparire cavità di riassorbimento, che vengono successivamente colmate da osteoni di terzo, di quarto o di ordine ancora superiore. Le formazioni lamellari poste tra gli interstizi nell'osso adulto rappresentano frammenti residui di precedenti generazioni di sistemi haversiani o circonferenziali e prendono il nome di breccia interosteonica. Nell adulto, l osso risulta quindi costituito da: osteoni maturi, che formano la maggior parte dell'osso della funzione di sostegno; osteoni in formazione, nei quali si depositano e progressivamente calcificano strati concentrici di tessuto preosseo definito osteoide; cavità di riassorbimento, destinate ad essere riempite da nuovi osteoni. 18. Sistemi haversiani dell osso compatto. In luce ordinaria l immagine evidenzia gli osteoni e la breccia interosteonica. Corticale di tibia non decalcificata e non inclusa (Homo). 20
22 La velocità di formazione dell'osso lamellare può essere determinata somministrando tetraciclina, consecutivamente per due volte a una certa distanza di tempo l'una dall'altra, e misurando lo spessore del tessuto compreso fra due bande di osso che si sono marcate. Con questi studi si è dimostrato che nell'uomo si forma in media 1 µm di osso lamellare al giorno e che la velocità di deposizione rallenta in ciascun osteone quando il suo sviluppo si avvicina al termine, cioè quando le lamelle sono più prossime al centro dell osteone (Marshall et al 1959). In riferimento alle osservazioni di Simmons e Nichols (1966), che con indagini microradiografiche e morfologiche avevano già dimostrato nell'animale variazioni di intensità dell'attività ossea, erosiva e depositiva, nel corso delle 24 ore, uno studio sperimentale, condotto con marcature fluorocromiche di tetraciclina somministrata nell'animale, per via endovenosa ogni 12 e 24 ore, ha evidenziato come, nella dentina e nel tessuto osseo, i fenomeni di deposizione e di erosione non avvengono con costanza durante l'arco della giornata, ma seguono un ritmo circadiano, con un massimo di attività durante il giorno e un minimo durante la notte (Miani et al 1966). È interessante osservare come il bioritmo seguito dall'attività delle cellule ossee ripercorre in modo simile l'andamento delle variazioni giornaliere dell'attività corticosurrenale e dei livelli di escrezione urinaria del calcio e del fosforo (Solberger 1965); dal momento, inoltre, che queste cellule sono influenzate nella loro attività anche dal tasso ematico di diversi ormoni, tra i quali gli estrogeni, il verificarsi di un andamento ciclico può indicare l'esistenza di una correlazione tra i due fenomeni (Miani et al 1966). Il tessuto osseo, infatti, oltre a svolgere la funzione di sostegno scheletrico, che ne determina continue modificazioni strutturali in relazione alle necessità meccaniche, è coinvolto anche nella regolazione del tasso ematico dei minerali, fungendo da sede di deposito di calcio e fosfati e quindi risulta sotto il controllo ormonale. 19. Sistemi haversiani dell osso compatto. Si microradiografia si apprezza il grado di radiopacità degli osteoni e della breccia interosteonica. Corticale di tibia non decalcificata e non in clusa (Homo). 21
23 LIVELLI ORGANIZZATIVI DEL TESSUTO OSSEO Il termine osso è utilizzato per indicare sia il tessuto osseo che l organo rappresentato dal segmento scheletrico. L osso, come del resto tutti gli organi, è organizzato secondo diversi livelli che partono dai componenti elementari, riferibili alle cellule e alla sostanza intercellulare, fino a giungere a formazioni complesse che nel caso specifico sono rappresentate dai segmenti scheletrici veri e propri (Marotti 1989). Ciascun livello organizzativo è caratterizzato da formazioni che dipendono gerarchicamente dalle strutture del livello precedente- Tuttavia, in ciascun livello, le formazioni sono raggruppate secondo le diverse caratteristiche intrinseche macroscopiche, semi-microscopiche, microscopiche o sub-microscopiche possedute. 20. Osso lungo. Faccia anteriore di omero di sinistra (Homo). 22
24 21. Segmento scheletrico. Livelli di organizzazione. Il primo livello di organizzazione dell osso è quello rappresentato matrice ossea. Poiché questo tessuto biologico è riccamente mineralizzato, la matrice ossea risulta costituita da due componenti: una organica ed una inorganica. A sua volta la componente organica è scindibile in due parti: una amorfa (il materiale organico disciolto nel fluido interstiziale) e una fibrillare (il collagene). La componente inorganica, anche se comprende altri sali di calcio, è prevalentemente costituita da un particolare fosfato: l idrossiapatite, Ca 10 (OH) 2 (PO 4 ) 6. Il secondo livello organizzativo è rappresentato dalle cellule. Le cellule ossee vere e proprie sono gli osteoblasti, che producono la matrice ossea e ne condizionano la mineralizzazione, gli osteociti e le cellule di rivestimento o lining bone cells, che risiedono rispettivamente all interno della matrice o sulle superfici periostali, vascolari ed endostali dell osso, ed infine gli osteoclasti, deputati al riassorbimento dell osso. È da sottolineare che gli osteoblasti e gli osteoclasti sono presenti solo quando le condizioni meccaniche o metaboliche lo richiedono, mentre gli osteociti e le cellule di rivestimento rappresentano la popolazione stabile del tessuto osseo. Le cellule ossee lavorano sempre in gruppi costituendo unità operative che possono essere considerate come un livello organizzativo intermedio, ma solo da un punto di vista funzionale Matrice ossea. Composizione. 23. Cellule dell osso. Composizione. 23
25 Il terzo livello prevede l organizzazione del tessuto osseo la cui struttura dipende soprattutto dal modo in cui avviene il reclutamento delle cellule osteoformatrici, ma anche dalle esigenze meccaniche. Il tessuto osseo può assumere una struttura con le fibre collagene disposte disordinatamente (tessuto osseo a fibre intrecciate), oppure disposte parallelamente tra loro, (tessuto osseo a fibre parallele, tipico delle ossa sottoposte a trazione e quindi poco rappresentato nell uomo), o ancora disposte a lamelle (tessuto osseo lamellare, il principale tessuto costituente l osso nell adulto). 24. Tessuti ossei. Composizione. Le varietà tessutali possono essere inoltre differenziate anche in funzione alla loro successiva comparsa nell ontogenesi ossea in osso primario, o di addizione, e osso secondario, o di sostituzione. L osso primario modella la forma macroscopica delle strutture scheletriche mentre l osso secondario rimpiazza porzioni di tessuto esistenti rinnovando la microstruttura, senza modificarne la forma; per questo motivo è definito anche osso di rimodellamento. 25. Osteoni primari (A) e secondari (B) dell osso. Si osservi in A come non esista alcuna soluzione di continuità sia tra gli osteoni primari, che tra essi e il tessuto osseo circostante. In B una netta linea cementante separa l osteone secondario dalla breccia interosteonica. Immagini al SEM di sezioni trasversali non decalcificate della corticale di tibia di adolescente (Homo). 24
26 Il quarto livello di organizzazione delle os sa definisce le configurazioni macroscopiche che determinano la forma e la struttura del singolo segmento scheletrico e possono essere costituite da tutte le varietà tissutali del terzo livello: l architettura compatta e l architettura spongiosa. La differenza sostanziale tra due architetture risiede esclusivamente nella densità tissutale, cioè nel diverso rapporto esistente tra la superficie dell osso rispetto al suo volume (R = S/V). Questa diversità comporta necessariamente anche un differente rapporto di vascolarizzazione, che si riflette quindi in una diversa velocità di turnover osseo. 26. Architetture ossee. Composizione. L architettura spongiosa risulta notevolmente più vascolarizzata di quella compatta: ciò determina una possibilità di adattamento strutturale maggiore, oltre ad essere anche la prima struttura coinvolta quando le esigenze metaboliche lo richiedono. Le due architetture si localizzano topograficamente in sedi diverse, dando origine ai singoli di segmenti scheletrico che rappresentano il livello superiore dell organizzazione ossea. Le modalità di vascolarizzazione dei segmenti scheletrici non è in funzione della loro morfologia, ma solo della loro architettura. 27. Sezione di omero al collo chirurgico. Disposizione delle diverse architetture. Nelle ossa la compatta delimita e racchiude all interno la spongiosa. (Homo). 25
27 MATRICE DELL OSSO Il tessuto osseo deve le sue caratteristiche di durezza e resistenza alla particolare composizione della sostanza extracellulare, definita matrice ossea, che a differenza degli altri tessuti di sostegno, risulta ricca di Sali minerali. La matrice ossea è un materiale moderatamente idratato nel vivente; circa il 10% del contenuto è rappresentato da acqua. Il restante 90%, che esprime il peso secco, è composto per il 70% dalla matrice inorganica, cioè da sali minerali prevalentemente aggregati in forma di cristalli. Il rimanente 30% è invece formato dalla matrice organica, costituita a sua volta per il 95% dalla componente fibrillare, rappresentata dalle macromolecole di struttura del collagene, e per il rimanente 5% dalla componente non fibrillare, che comprende diverse biomolecole regolatorie e carboidrati. Le proporzioni dei singoli elementi costituenti non sono comunque assolute, ma variano con l età, sede ossea, stato metabolico e, chiaramente, anche nelle condizioni di alterazione patologica. 28. Composizione della matrice dell osso. L osso disidratato è costituito dalla matrice inorganica e da quella organica. Quest ultima risulta principalmente formata dalla componente fibrillare, mentre la percentuale rappresentata dalla componente non fibrillare è sostanzialmente piccola. 26
28 MATRICE INORGANICA La matrice inorganica dell osso è formata da cristalli molto piccoli e piatti, di lunghezza di 64 nm circa, con asse maggiore parallelo alle fibre collagene, che possono essere disposti all esterno oppure all interno delle stesse. Negli esilissimi spazi tra i cristalli è presente acqua e macromolecole organiche. Il principale componente dei cristalli minerali è l idrossiapatite Ca 10 (OH) 2 (PO 4 ) 6, che non è quasi mai pura ma associata a quantitativi variabili di carbonato. Inoltre, si riscontrano anche piccoli quantitativi di fosfati di calcio non apatitici. Nella matrice inorganica, oltre a calcio, fosfati, idrossili e carbonati sono presenti pure tracce di altri composti come gli anioni citrato, fluoruro, il cloruro, i cationi magnesio, il sodio, il potassio, lo stronzio, il ferro, lo zinco ecc. Alcuni di essi possono sostituire il calcio nella mineralizzazione e perciò denominati cationi osteotropi. 29. Cristalli di idrossiapatite dello smalto interprismatico al SEM. Le formazioni orizzontali corrispondono ai prismi, più resistenti, che non si sfaldano per frattura. I cristalli nello smalto sono di dimensioni maggiori, ma hanno identica composizione chimica di quelli dell osso (Homo). 30. Idrossiapatite. Lo schema raffigura la disposizione dei cristalli. 27
29 MATRICE ORGANICA La matrice organica dell osso è costituita principalmente da due componenti: la componente fibrillare e la componente non fibrillare. 31. Fibre collagene al microscopio ottico. I fasci di fibre collagene (in blu intenso) sono organizzatii in modo intrecciato e con i fibroblasti (in rosso) tra essi interposti. Derma, colorazione Azan-Mallory (Homo). 32. Fibre collagene al SEM. I fasci di fibre collagene sono disposti in modo ordinato (paralleli). Tendine del capo lungo del tricipite (Homo). 28
30 La componente fibrillare costituisce circa il 95% della matrice organica ed è rappresentata quasi esclusivamente dal collagene di tipo I. Il rimanente 5 % è formato invece da proteine non collagene specifiche, quali l'osteocalcina, l'osteonectina, le fosfoproteine, i proteoglicani, le sialoproteine e le sieroproteine. Quest ultimo gruppo di biomolecole non prende parte direttamente alla costituzione strutturale dell osso, ma svolge un ruolo di regolazione. 33. Fibre collagene al microscopio ottico. Sla disposizione dei tenociti (in rosso) ricalca l andamento dei fasci di fibre collagene (verde/blu intenso). Colorazione tricromica di Gomori. Tendine del quadricipite (Oryctolagus cuniculus). 34. Fibre collagene al SEM. A maggior ingrandimento si può apprezzare il parallelismo dei fasci di fibre collagene. Tendine del capo lungo del tricipite (Homo). 29
31 Il collagene, uno dei principali costituenti extracellulari della maggior parte dei tessuti connettivi, è una proteina fibrosa dalla caratteristica bandeggiatura in microscopia elettronica, che rappresenta circa il 25% delle proteine contenute nell'organismo umano. L'unità fondamentale del collagene è rappresentata dalla molecola di collagene o tropocollagene, costituita da tre catene polipeptidiche avvolte tra loro elicoidalmente, che misura circa 300 nm in lunghezza e 1,5 nm di diametro. Le molecole di collagene si uniscono tra loro lungo il loro asse maggiore con legami trasversali e formano polimeri ordinati costituenti le fibrille collagene, strutture filamentose di calibro da 10 a 300 nm, che provvedono a dare adeguato supporto ad ogni tessuto connettivo (Piez e Reddi 1984). All'interno dei tessuti le fibrille collagene sono riunite in grande numero, per dar origine ai grossi fasci di fibre collagene, o rimanere isolate intrecciandosi tra di loro, per costituire il tessuto reticolare. Nel tessuto osseo il collagene è completamente immerso nella matrice minerale con funzione principale di impartire alla struttura caratteristiche di resistenza meccanica. La fibra collagene, infatti, è flessibile ma non estensibile e offre una notevole resistenza alla trazione. La matrice minerale da sola, per quanto estremamente dura, è rigida e quindi non è in grado di resistere alle sollecitazioni incurvanti. La trama di collagene funzionando come un'impalcatura per la matrice minerale, permette invece alla struttura ossea, entro certi limiti, di venire sollecitata senza che si verifichino fratture. La precipitazione dei cristalli di idrossiapatite sembra cominciare in corrispondenza di particolari siti delle fibrille collagene, definiti buchi (Montgomery et al 1981), e si perpetua seguendo lo schema organizzativo delle fibre. 35. Fibrille collagene al TEM. Le fibrille collagene dell orletto osteoide, non essendo perfettamente parallele come quelle del tendine, appaiono sezionate sia longitudinalmente che trasversalmente. In sezione longitudinale le fibrille mostrano la caratteristica bandeggiatura trasversale (Homo). 30
32 Il collagene predominante nei tessuti connettivi (circa il 90%) è quello formato dalla molecola di tipo I, presente nelle ossa, nei tendini e nella pelle. Il collagene di tipo I è un eteropolimero composto da due catene polipeptidiche α1 e α2, ed è praticamente l'unico tipo di collagene rappresentato nel tessuto osseo (Montgomery et al 1981). Le caratteristiche delle fibre collagene sono strettamente legate alla loro composizione chimica che segue precisi schemi organizzativi molecolari. Come per tutte le proteine la struttura primaria è dovuta alla composizione in aminoacidi e alla disposizione degli stessi nella catena polipeptidica: in altre parole la sequenza dei singoli amminoacidi può cambiare nelle catene polipeptidiche e quindi avere, in ciascuna, una differente struttura primaria. Il collagene ha una composizione in aminoacidi particolare: la glicina, l aminoacido più semplice, rappresenta da sola la molecola principale (oltre il 30%); la prolina e idrossiprolina sono contenute nella misura del 20% circa, i rimanenti aminoacidi sono invece presenti in scarse quantità 36. Fibrille collagene. Lo schema raffigura la disposizione delle fi-bre collagene nel contesto dell osso. oppure sono del tutto assenti nella catena (per esempio il triptofano e la cisteina). La struttura primaria del collagene è caratterizzata dalla peculiare sequenza amminoacida in cui la glicina compare nella catena sempre dopo altri due aminoacidi. Si verifica di conseguenza il ripetersi di trimeri di glicina-x-y, dove X e Y rappresentano molecole diverse dalla glicina. La presenza di questo aminoacido è fondamentale nella sequenza del polipeptide, in quanto la glicina è in assoluto la molecola meno ingombrante e quindi la meno influente dal punto di vista dell assetto strutturale e geometrico della catena finale. Tra gli gli aminoacidi che occupano le posizioni indicate con X e Y compaiono spesso la prolina e idrossiprolina. A differenza di tutti gli altri amminoacidi, queste molecole sono particolari, in quanto possiedono una struttura ciclica planare che impedisce ai singoli elementi strutturali della molecola di poter ruotare attorno al carbonio centrale. Quando la prolina o il suo derivato idrossilato compaiono nella catena, quest ultima è soggetta a una distensione, poiché queste molecole generano zone rigide che impediscono al polipeptide di aggrovigliarsi su se stesso e nel contempono impartiscono alla molecola un caratteristico andamento a spirale levogira allungata. 31
33 37. Molecole di prolina. La prolina e il suo derivato idrossiprolina sono in realtà amminoacidi aventi struttura ciclica planare e, comparendo in maniera ripetitiva nella sequenza della catena polipeptidica, ne determinano un particolare andamento strutturale secondario. La conformazione a elica, che ruota in senso orario rappresenta la struttura secondaria del polipeptide e a ogni giro dell elica sono contenuti tre aminoacidi. La stessa catena mostra anche una spirale secondaria nella direzione opposta, denominata struttura supersecondaria, con passo sufficiente a ospitare a ogni suo giro altre due catene α. Nella maggior parte dei tessuti dei mammiferi esistono diverse catene α che, pur essendo della medesima grandezza (peso molecolare di ), differiscono tra loro per la composizione in aminoacidi. Se ne cooscono almeno venti tipi che costituiscono più di dieci varietà di collagene; tuttavia nelle principali molecole di collagene (I-IV) ne sono presenti solo due, denominate α1 e α2. Le singole catene α vengono sintetizzate nei ribosomi adesi alla membrana del reticolo endoplasmatico sotto forma di pro-catene α, precursori di dimensione maggiore per l aggiunta alle due estremità, carbossi- e amino-terminale, di pro-peptidi. Tre catene pro-α si uniscono tra loro attraverso legami a idrogeno (tra i residui idrossilisinici e idrossiprolinici) e covalenti (mediante ponti di bisolfuro fra i pro-peptidi carbossi-terminali della molecola di procollagene) dando luogo alla struttura terziaria conformata a tripla elica, cioè la molecola di procollagene. Dopo scissione dei propeptidi dal procollagene si forma la molecola di collagene o tropocollagene, strutturata a tripla elica, con dimensioni di 300 nm di lunghezza e di 1,5 nm di diametro e peso molecolare triplo rispetto alla sola catena α. Le catene α contenute nel tropocollagene sono impossibilitate nello scorrimento a causa degli innumerevoli legami che si vengono a creare dopo l'attorcigliamento elicoidale. Il tropocollagene è la macromolecola collagene fondamentale e nel caso specifico del tessuto osseo è costituito da due catene α1 e da una catena α2. 32
34 37. Fibre, fibrille e molecole di collagene. a - Piccola fibra collagene costituita dall unione di 14 fibrille; b - Ingrandimento di una porzione di una fibrilla per evidenziare la caratteristica bandeggiatura; c - schema della disposizione delle singole molecole di collagene che presentano il caratteristico sfasamento, con periodo di 67 nm, respon-sabile della bandeggiatura; d - ingrandimento della singola molecola di collagene o tropocollagene; e - ingrandimento di una delle tre catene polipeptidiche disposte a spirale levogira. L'aggregazione di più molecole di tropocollagene porta alla formazione della fibrilla collagene. Le molecole si dispongono parallelamente l'una accanto all'altra, ma ogni molecola è sfasata rispetto a quelle vicine di 67 nm, l'equivalente di circa un quinto della lunghezza tra l inizio di una molecola e quello di una successiva. Al microscopio elettronico queste strutture appaiono come una serie di bande più dense e meno dense alternate regolarmente. Le strie che presentano sono probabilmente l'espressione morfologica del punto in cui le molecole si uniscono vicino al buco. Si ipotizza inoltre che questa zona sia il luogo di formazione dei cristalli di idrossiapatite, da cui ha inizio la formazione del tessuto osseo calcificato. La fibrilla, una volta formata, viene stabilizzata dalla formazione di legami sia intermolecolari, tra le catene di tropocollagene definiti cross-links o legami trasversali sia intramolecolari, tra i residui lisinici. I cross-links sono legami covalenti che vengono a formare per condensazione di residui idrossilici e aldeidici di aminoacidi di catene adiacenti. 33
35 MATRICE ORGANICA: LA COMPONENTE NON FIBRILLARE La componente non fibrillare, definita anche componente amorfa, è costituita da un ampio spettro di molecole proteiche e glucidiche, prevalentemente coniugate in forma di glicoproteine, che sono inglobate nella matrice mineralizzata. La maggior parte di queste molecole glicoproteiche sono sintetizzate e secrete dagli osteoblasti durante la deposizione, altre invece giungono dal torrente ematico, filtrano attraverso l'endotelio dei capillari ed entrano a far parte della miriade di sostanze extracellularì. Con la mineralizzazione dell'osteide tutte queste molecole rimangono intrappolate nel tessuto osseo. Le sostanze contenute nella componente non fibrillare della matrice sono state per lungo tempo oggetto di interesse da parte dei ricercatori, ma solo negli ultimi ventanni alcune di queste sono state isolate, rendendo possibile, almeno in via teorica, l'identificazione del ruolo. A oggi vengono riconosciuti i proteoglicani, l'osteocalcina, l'osteonectina, le sialoproteine e alcune sieroproteine. L'eterogeneo insieme di queste molecole rappresenta circa il 63% della componente non fibrillare; il rimanente 37%, invece, deve essere ancora determinato. Assodato che queste glicoproteine non entrano a far parte dell'organizzazione strutturale del tessuto osseo, compito esclusivo della componente fibrillare, ma ne! contempo accertato che alcune di esse hanno affinità per il collagene, per i sali minerali o per entrambi, sono state proposte possibili funzioni regolatorie. L'organizzazione e l'estensione delle fibre di collagene, per esempio, sono processi extracellulan e possono necessitare l'intervento di alcune di queste biomolecole per il periodico ripetersi nell'allineamento delle fibre. Anche l'inizio della precipitazione de! fosfato di calcio con formazione di idrossiapatite, nei siti intermolecolari del collagene che si vengono a creare per lo sfasamento delle catene, sembra essere controllato dalla presenza dì specifiche molecole, capaci di dare inizio alla precipitazione dei cristalli a partire dalla soluzione satura di sali minerali, presente nel contesto dell'orietta» osteoide. 39. Matrice amorfa dell osso. Lo schema raffigura la composizione. 34
36 Proteoglicani Iproteoglicani rappresentano circa il 10% delle proteine non collagene dell'osso. Sono costituiti da un nucleo proteico allungato, o agglomerato, al quale sono unite da numerose catene, fino a un migliaio di polisaccaridi acidi, chiamate glicosaminoglicani. I glicosaminoglicani, denominati in passato mucopolisaccaridi, sono molecole costituite da catene di carboidrati carbossilati e solforati, e quindi particolarmente acide, responsabili del legame della matrice con la maggior parte dei coloranti acidofili come l'alcian blu, il rosso rutenio e la safranina. È stato osservato che proteoglicani di piccole dimensioni interagiscono in maniera perio-dica con le fibrille collagene (Scott et al 1981, Scott e Orford 1981). Recenti ricerche condotte sia in vitro (Vogel e Heinegard 1983) che in vivo (Palumbo et al. 1995) hanno permesso di ipotizzare che i proteoglicani possono essere coinvolti nel controllo della formazione e dell'estensione delle fibrille collagene. Osteocalcina L osteocalcina è la meglio caratterizzata tra le proteine non collagene dell'osso e sembra giocare un ruolo fondamentale nei vertebrati. Questa glicoproteina è sintetizzata dagli osteoblasti come una proteina acida di 99 aminoacidi, coniugata con i carboidrati. Prima di essere secreta, l acido glutammico della molecola di osteocalcina nativa viene carbossilato in corrispondenza del carbonio γ. L'osteocalcina rappresenta il 10-20% delle proteine non collagene dell'osso e completamente γ-carbossilata, è in grado di legare sia l'idrossiapatite sia gli ioni calcio (Price 1983). Inoltre blocca la trasmissione della fase minerale che anticipa la formazione di idrossiapatite (Herring 1972) e ne inibisce la precipitazione in caso di soluzioni sature di ioni calcio e fosfato (Price et al 1976). Osteonectina L osteonectina è una glicoproteina fosforilata che rappresenta circa il 15% delle proteine non fibrillari e la sua quantità è in relazione alla quantità di osso lamellare (Conn e Termine 1985). L'osteonectina mostra legami saturabili e scambiabili sia col collagene sia con l'idrossiapatite; questa proteina possiede domini di legame separati per il collagene e per i minerali e può promuovere la deposizione di minerali in presenza di collagene di tipo I (Termine et al 1981). È possibile quindi che la molecola, dopo essersi legata alle fibrille collagene, possa presentare un costante orientamento dei siti che legano il calcio, al fine di addensare i cristalli di idrossiapatite in maniera molto precisa. Sialoproteine Il compartimento osseo minerale è ricco di sialoproteine (7,5-10% delle proteine non collagene). L'acido sialico (acido N-acetil-neuramminico) forma catene oligosaccaridiche attaccate alle proteine non collagene. Nessuna delle sialoproteine è stata osservata in tessuti diversi da quello osseo (Franzen e Heinegard 1985). Sembra che siano glicoproteine in grado di legare il calcio e di regolare la dimensione dei cristalli, ma la loro esatta funzione non è attualmente conosciuta. Sieroroteine Le proteine sieriche sono tra le proteine non collagene maggiormente rappresentate nell'osso con una percentuale del 13%. Nella matrice calcificata sono state riconosciute proteine sieriche quali la sieroalbumina (Owen et al 1973), l'α 3 2Hs glicoproteina (Triffit et al 1978), la transferrina ed alcune classi di immunoglobuline (Ashton et al 1974). Altre glicoproteine Il rimanente 37% del contenuto della matrice amorfa risulta costituito da proteine glicosilate non ancora identificate. 35
37 CELLULE DELL OSSO Se si considera l osso come un organo, formato quindi da più tessuti, in esso sono presenti, oltre alle cellule proprie, numerosi altri tipi di cellule come: elementi del midollo a vari stadi maturativi, adipociti, fibroblasti, cellule endoteliali, cellule muscolari lisce. La maggior parte di queste cellule, tuttavia, esplica attività che esulano da quelle dell osso. I soli elementi cellulari in grado di regolare l omeostasi fosfocalcica del segmento scheletrico sono le cellule ossee propriamente dette, rappresentate dagli osteoblasti, dagli osteoclasti, dagli osteociti e dalle cellule di rivestimento dell osso. Le singole cellule ossee hanno funzioni distinte e rapporti diversi con l osso a seconda dello specifico stato funzionale del tessuto. A questi riguardo, una determinata porzione o superficie ossea può infatti trovarsi, in relazione alle specifiche necessità meccaniche o metaboliche, in uno stato di attività o in uno stato di quiescenza. Nella situazione di attività funzionale si verifica la presenza o di osteoblasti, in grado di produrre la matrice preossea e di condizionarne la sua mineralizzazione, oppure è possibile riconoscere gli osteoclasti che provvedono all erosione della stessa.questi due tipi di cellule non lavorano singolarmente, ma si organizzano in gruppi funzionali che operano spesso in modo coordinato e provvedono a modificare la forma dei segmenti scheletrici oppure a rinnovarne la struttura interna. Una superficie ossea attiva può essere quindi soggetta a cambiamenti derivanti da due diversi processi: il modellamento della forma, distinto nella fase appositiva, attuata esclusivamente dagli osteoblasti e finalizzata all incremento dimensionale del frammento osseo, e dalla fase erosiva attuata esclusivamente dagli osteoclasti e finalizzata alla sua demolizione. Nel modellamento le due fasi possono avvenire sia in tempi diversi sia contemporaneamente, ma sempre su superfici ossee differenti e comportare modificazioni della quantità di osso o, quanto meno, una dislocazione dello stesso. 40. Cellule dell osso. Lo schema raffigura i diversi elementi cellulari propri di questo tessuto. 36
38 il rimodellamento della struttura o rimaneggiamento, attuato dall attività coordinata e temporalmente differenziata inizialmente dagli osteoclasti, che riducono la parete ossea e, successivamente, dagli osteoblasti che la ricostruiscono. Non si ha pertanto una modificazione della quantità di tessuto, ma un rinnovamento della sua struttura. Nel rimodellamento le attività cellulari sono necessariamente sequenziali poiché avvengono sulle stesse superfici ossee; a eccezione che alla fase erosiva non faccia seguito, per motivi metabolici o meccanici la fase depositiva, l intero processo non comporta variazioni della massa ossea. 37
39 Lo stato di attività di una superficie ossea è determinato da necessità di ordine meccanico e metabolico ed è regolato da molteplici fattori: l attività che si verifica si di una superficie ossea è sempre opera di gruppi di cellule che operano in modo coordinato, definiti da Frost (1963a, 1963b) Unità Multicellulari di Base o BMU. Nel rimodellamento osseo le BMU sono costituite sia da osteoclasti sia da osteoblasti, con una attività cronologicamente sequenziale: dapprima gli osteoclasti demoliscono e poi gli osteoblasti ricostruiscono. L azione coordinata e sequenziale degli elementi operativi di questi sistemi viene indicata con il termine coupling o accoppiamento. Nel modellamento della forma si verifica, invece, una situazione di disaccopiamento delle attività cellulari, con il prevalere dell una o dell altra. Tale disgiunzione in condizioni normali ha comunque un significato di adattamento funzionale delle strutture scheletriche, ma può verificarsi anche in condizioni patologiche come ad esempio nell osteoporosi, dove prevalgono fenomeni erosivi, oppure nell osteopetrosi, dove si ha un prevalere dei fenomeni osteoformativi. Quando il tessuto osseo si trova in un teorico stato di equilibrio funzionale, e cioè quando non sussistono né fenomeni formativi né demolitivi, gli unici elementi cellulari in esso osservabili sono rappresentati da osteoblasti al termine della loro attività depositiva, che hanno perso quindi le capacità di sintesi della matrice. Tali cellule a seconda che si trovino comprese all'interno della matrice mineralizzata o lungo le sue superfici vascolari, endostali, periostali o canali haversiani, prendono il nome rispettivamente di osteociti e cellule di rivestimento dell osso o bone lining cells. Durante la deposizione della matrice, un certo numero di osteoblasti modifica e rallenta l attività osteoidosintetica e viene incorporato nel tessuto trasformandosi in osteociti. Al termine dell attività osteogenetica gli osteoblasti che non sono diventati osteociti modificano la loro forma, appiattendosi e formando uno strato di rivestimento. Sono questi gli elementi definiti cellule di rivestimento dell osso. 42. Modellamento appositivo. L immagine in microscopia ottica evidenzia alcune lamine di osteoblasti (intensamente colorati dal blu di toluidina) impegnati nella deposizione di nuovo osso, in apposizione sulla superficie periostale della corticale preesistente. Metatarso (Equus caballus). 38
40 Questi due gruppi di cellule, sebbene derivino dallo stesso pool di precursori blastici, presentano, per la differente modalità di formazione, caratteristiche morfologiche peculiari in relazione alla loro posizione, all interno o in superficie della matrice mineralizzata. Gli osteociti appaiono come cellule dendritiche, costituite da un corpo cellulare dal quale si dipartono sottili propaggini ramificate, che prendono il nome di prolungamenti citoplasmatici. Il corpo cellulare è ospitato all'interno di piccole cavità dell osso, che ne riproducono la forma, definite lacune osteocitiarie. I processi citoplasmatici invece sono contenuti all'interno di sottili escavazioni tubolari, i canalicoli, che connettono tra loro le lacune. Gli osteociti sono avvolti completamente dalla matrice mineralizzata e rimangono in connessione tra loro e le cellule di rivestimento, esclusivamente per mezzo della fitta rete di canalicoli che si sviluppa all interno della stessa. Le cellule di rivestimento hanno forma prismatica appiattita e formano uno strato lungo le superficie vascolari dell osso. Sebbene siano di chiara origine mesenchimale. l'aspetto di questo strato di cellule ricorda quello degli epiteli di rivestimento monostratificati. Al termine dell attività osteoformativa la matrice mineralizzata dell'osso risulta essere compenetrata da un sistema cavitario, il compartimento fluido dell osso, contenente gli osteociti internamente e delimitato dalle cellule di rivestimento all'esterno. Ciò fa supporre che qualsiasi tipo di relazione tra la matrice mineralizzata e gli spazi che circondano il tessuto osseo e che costituiscono il compartimento vascolare dell osso, come le cavità haversiane, gli spazi periostali, endostali e midollari, non può prescindere da questi due tipi di cellule. Pertanto al fine di avere una visione più completa della popolazione cellulare e delle sue relazioni all'interno del tessuto osseo, non soggetto a modificazioni di tipo formativo o erosivo, sarà necessario riferirsi, per quanto riguarda le cellule, al complesso osteociti-cellule di rivestimento e per quanto riguarda le loro relazioni, alla rete-lacuno-canalicolare. 43. Modellamento sottrattivo. L immagine in microscopia ottica evidenzia un gruppo di osteoclasti (marcati dal colorante solocromo cianina-congo rosso) impegnati nel riassorbimento osseo. Inoltre, è possibile apprezzare le notevoli dimensioni di queste cellule rispetto agli altri elementi adiacenti. Osso dell anca (Oryctolagus cuniculus). 39
41 LINEA DI DERIVAZIONE DEGLI OSTEOBLASTI La genesi delle cellule dell osso è stata a lungo oggetto di controversie. Nonostante si ammetta che le cellule ossee abbiano una comune origine mesenchimale, esse generano da elementi progenitori differenti capostipiti di linee di differenziazione completamente diverse. Gli osteoblasti derivano da cellule del mesenchima intraembrionario che nel feto riveste gli abbozzi scheletrici. Questo tessuto, durante i processi di ossificazione si addentra negli abbozzi scheletrici per formare la trama di sostegno del midollo osseo. Le cellule osteoblasto progenitrici sono elementi sessili, di tipo fibroblastico, che derivano da cellule staminali stromali; queste trovano sede nel connettivo lasso che dà sostegno al sistema dei sinusoidi del midollo e dello strato profondo del periostio. Le cellule staminali stromali sono precursori comuni di altre cellule come i fibroblasti, i condroblasti e gli adipociti (Owen 1985). Dal momento comunque che tali elementi non entrano in circolo, i precursori degli osteoblasti derivano necessariamente da un pool autopertetuantesi di cellule staminali stromali, ma non è possibile escludere una possibile differenziazione di elementi precedentemente orientati verso un altro tipo cellulare. Allo stato delle conoscenze attuali si ritiene che gli osteoblasti si specializzino per modulazione, cioè in modo non mitotico, dai loro immediati precursori, i preosteoblasti, che derivano per mitosi da cellule competenti staminali stromali (Owen 1978, Rodan e Rodan 1984). Di conseguenza, la disponibilità di osteoblasti è funzione dell'insieme delle cellule staminali stromali e dell attività di mitosi delle stesse. 44. Linea osteogenica. Lo schema raffigura gli elementi cellulari derivanti dal comune precursore mesenchimale. 40
42 Una volta differenziato, l osteoblasta si dispone assieme ad altre cellule formando aggregazioni similepiteliali, veri e propri fronti di deposizione che prendono il nome di lamine osteogeniche. Ogni osteoblasta assume un aspetto cuboidale o poliedrico, si polarizza disponendo il proprio nucleo verso lo stroma di sostegno e raccoglie i granuli di secrezione in direzione della superficie di deposizione. In una lamina osteogenica gli osteoblasti lavorano affiancati, connessi tra loro per mezzo di numerose giunzioni e ogni cellula occupa un territorio di circa 15 µm 2 (Jaworski e Hooper 1980). Durante la deposizione del tessuto osseo alcuni elementi della lamina osteogenica rallentano e modificano la polarità della loro attività depositiva per venire incorporati nella matrice preossea, diventando prima preosteociti e poi, con la mineralizzazione della matrice, osteociti (Marotti 1988). Durante il processo di trasformazione queste cellule mantengono rapporti con le cellule adiacenti e con gli elementi della lamina osteogenica, emettendo numerosi processi citoplasmatici. Al termine dell attività depositiva, gli elementi cellulari che non sono stati incorporati nella matrice, pur mantenendo l aspetto epitelioide, si appiattiscono trasformandosi in cellule di rivestimento (Menton et al 1984). Mentre è assodato che tutti gli osteociti hanno origine da osteoblasti della lamina osteogenica, per le cellule di rivestimento non si può asserire altrettanto. Allo stato attuale delle conoscenze, infatti, non è possibile escludere che una parte di queste cellule derivino direttamente da elementi staminali stromali con potenzialità osteoblasto progenitrici e che, in seguito ad opportuni stimoli, possano riacquistare attività osteogenica (Volpi et al 1981). L aspetto più interessante circa il complesso delle cellule della linea osteogenica riguarda l evidenza morfologica di come tutti gli elementi appartenenti a questo gruppo siano sempre in contatto tra loro a costituire un imponente rete di collegamento, che si estende dalle zone più profonde del tessuto osseo sino ai capillari. L organizzazione di questa rete cellulare sembra essere alla base del sistema di controllo di ogni attività del tessuto osseo (Marotti 1996). 45. Linea osteogenica. Fronti di deposizione osteoblasti in piena attività (intensamente colorati dal blu di toluidina) aumentano lo spessore di due nuove trabecole. Numerosi capillari (in nero di china) garantiscono il trofismo alle cellule. Nel connettivo lasso che accompagna i vasi sono presenti gli elementi precursiori dei nuovi osteoblasti (colorati in modo più tenue). Osso dell anca (Oryctolagus cuniculus). 41
43 LINEA DI DERIVAZIONE DEGLI OSTEOCLASTI Gli osteoclasti sono grandi cellule polinucleate con capacità di degradazione e riassorbimento della matrice. Pur essendo di derivazione mesenchimale, non hanno niente a che vedere con le altre cellule ossee (Hall 1975). La linea di discendenza degli osteoclasti, infatti è quella del tessuto emopoietico, al pari di altre cellule del sangue (Bonucci 1981). Il precursore è quindi la cellula staminale totipotente che si è differenziata nel mesenchima extraembrionale del sacco vitellino. Gli osteoclasti derivano da elementi mononucleati, i monoblasti, che traggono origine nel contesto del tessuto emopoietico del fegato, della milza, del timo e del midollo osseo. Per richiamo chemiotattico raggiungono le superfici del tessuto osseo attraverso il torrente ematico. Sebbene gli osteoclasti siano cellule polinucleate, non sono mai state osservate divisioni mitotiche o amitotiche nel contesto dei loro precursori mononucleati. Ad oggi, quindi, è generalmente ammesso che essi originano per fusione sinciziale di più elementi mononucleati del sistema emopoietico, i quali possiedono capacità di degradazione di sostanze organiche al pari dei macrofagi (Bonucci 1981). Le conoscenze attuali comunque non forniscono elementi sufficienti per comprendere se queste cellule derivino esclusivamente da monociti, da cellule osteoclastoprogenitrici circolanti o da altri fagociti, che confluiscono nello stesso sincizio. Mancano inoltre elementi circa il fatto che i precursori entrino a fare parte della cellula come tali, oppure subiscano modificazioni strutturali da poterli riconoscere come preosteoclasti o cellule osteoclastoprogenitrici tissutali. Numerose ricerche sembrano avvallare l ipotesi che i precursori degli osteoclasti siano elementi mononucleati del sistema emopoietico, ma che non siano in realtà dei monociti maturi. 44. Linea osteoclastica. Lo schema raffigura gli elementi cellulari derivanti dal comune precursore emopoietico. 42
44 Le differenze sostanziali tra gli osteoclasti e i monociti maturi risiedono nella mancanza di espressioni fenotipiche caratteristiche di tali elementi (Jones et al 1981; Burger et al 1982; Horton et al 1984, 1985). Di fatto gli osteoclasti si vengono a costituire in prossimità delle superfici ossee da riassorbire. Il sincizio, una volta formatosi assume un aspetto tipico per la funzione che deve svolgere. La cellula che normalmente possiede dimensioni di circa 100 µm si polarizza attaccandosi, come una ventosa, sulla superficie ossea da degradare. La membrana si specializza presentando numerose estroflessioni verso la superficie ossea, mentre la parte rivolta verso gli spazi extracellulari, stroma di sostegno e vasi, si presenta convessa e priva di propaggini (Baron 1989). I nuclei, di norma in numero di tre o più, sono disposti alla periferia, mentre la maggior parte del sistema microtubulare, deputato alla sintesi di enzimi di degradazione della matrice, è ospitato al centro della cellula (Miller 1977, Zambonin Zallone e Teti 1981). Al termine della loro attività di degradazione e riassorbimento gli osteoclasti scompaiono dalla superficie ossea. Anche in questo caso non esistono dati certi che attestino il loro destino. Non è ancora chiaro se si scindano nei loro elementi precursori per rientrare nel torrente ematico o se invece degenerino e vengono eliminati (Baron et al 1984). 47. Linea osteoclastica. A) Un gruppo di osteoclasti (intensamente marcati di rosso dalla colorazione istochimica per la fosfatasi acida tartrato resistente) è impegnato a demolire una grossa trabecola. B) Un altro gruppo di osteoclasti in piena attività riassorbe un frammento di osso preesistente attaccato a trabecole di osso neoformato. Nel connettivo lasso che accompagna i vasi sono presenti gli elementi precursori che appaiono colorato in modo più tenue. Osso dell anca (Oryctolagus cuniculus). 43
45 OSTEOBLASTI Gli osteoblasti sono le cellule dell osso deputate alla deposizione della matrice (Rodan e Rodan 1984). Sono elementi mononucleati di derivazione mesenchimale che originano da precursori comuni ai fibroblasti e condroblasti. Si presentano con forme variabili, dipendenti dalla loro attività sintetica: quelli in attiva deposizione hanno forma poliedrica o cuboidale, e le loro dimensioni si aggirano solitamente intorno ai µm; quelli alla fine della deposizione hanno invece forma appiattita in seguito a una consistente riduzione della quantità di organuli citoplasmatici (Holtrop 1975, Javorski e Hooper 1980) 48. Osteoblasti in attiva deposizione al microscopio ottico. Gli osteoblasti, di forma poliedrica, sono allineati a formare una lamina osteogenica. Sezione di osso di femore non decacificato e incluso in PMMA. Colorazione blu di toluidina (Homo). 48. Osteoblasti alla fine della deposizione al microscopio ottico. Gli osteoblasti, di forma appiattita, sono adesi a un orletto osteoide. Sezione di osso di femore non decacificato e incluso in PMMA. Colorazione blu di toluidina (Homo). 44
46 Gli osteoblasti sono elementi cellulari fortemente impegnati nella sintesi proteica e hanno una struttura che ne ricalca la funzione, sviluppandosi in modo polarizzato. Si riconoscono un polo rivolto verso il fronte di deposizione ed un altro rivolto invece verso gli spazi extracellulari, dove sono presenti le strutture vascolari (Roberts et al 1987). Durante la deposizione si dispongono appaiati, a formare fronti monostratificati di cellule contigue, definiti lamine osteogeniche, che abbisognano, per il loro sviluppo, sostentamento e ricambio cellulare, di un continuo apporto di risorse nutritive e un pool di elementi staminali stromali pronti a differenziarsi in cellule osteoformative. Affinchè questo possa realizzarsi, i fronti di deposizione presentano sempre alle loro spalle un adeguato sostegno connettivale lasso, ricco di cellule reticolari stromali e capillari ematici (Roberts et al 1982, 1987). Nel procedere della deposizione, infatti, diversi osteoblasti vengono inglobati nel tessuto osseo osseo in formazione e si trasformano in osteociti; affinchè la lamina osteogenica mantenga un uniformità strutturale è necessaria una reintegrazione degli stessi con nuove cellule. Dal momento però che gli osteoblasti non hanno capacità mitotiche il rimpiazzamento avviene solo per differenziazione di nuovi elementi, a partire dalle cellule staminali stromali perivascolari. Con il crescere della deposizione le lamine osteogeniche si spostano progressivamente verso il territorio vascolare, che, in particolare negli spazi haversiani, si riduce fortemente di dimensione, ma viene mantenuto attivo in modo che permangano un adeguato sostentamento e un apporto nutrizione degli osteoblasti. Gli osteoblasti, dal punto di vista strutturale, si presentano come cellule asimmetriche. 50. Osteoblasti in deposizione attiva al TEM. Si noti la polarizzazione del nucleo, verso lo stroma connettivale di sostegno, e la ricchezza di organuli cellulari. Sezione di osso di femore (Homo). 45
47 51. Osteoblasti. Lo schema raffigura la disposizione polarizzata degli organuli cellulari durante la deposizione. Il nucleo, spostato verso lo stroma connettivale, cioè l estremità vascolare della cellula, appare ricco di eucromatina, quindi pallido nelle colorazioni sia al microscopio ottico che elettronico, ed è dotato di un grosso nucleolo. Il citoplasma risulta fortemente basofilo e presenta un apparato di sintesi molto sviluppato, con vescicole di secrezione verso il fronte di deposizione. In microscopia elettronica a trasmissione si riconoscono numerosi mitocondri, centrioli ben evidenti, un grande apparato di Golgi ed un reticolo endoplasmico granulare esteso. In grande quantità sono anche le vescicole di trasposto, che si distaccano dal sistema microtubulare per portarsi in direzione della membrama citoplasmatica rivolta verso il fronte di deposizione o estremità minerale. Metodi istochimici rivelano la presenza dell enzina di membrana fosfatasi alcalina, indice dello stato di attività delle cellule, ed una PAS-positività delle vescicole di trasporto che evidenzia il contenuto glicoproteico. Le vescicole contengono i precursori delle proteine di struttura della matrice e di numerose altre glicoproteine. La superfice plasmatica rivolta verso il fronte di deposizione presenta un aspetto villoso per l effetto di estroflessioni della membrana cellulare. Le estroflessioni assumono un significato di aumento della superficie di scambio per il trasporto; alcune di esse servono a mantenere il contatto con osteoblasti adiacenti e altre con gli osteociti, siti profondamente nello spessore della matrice. Gli osteoblasti di una lamina osteogenica lavorano strettamente appaiati durante la deposizione; risultano tra loro uniti medianti sistemi giunzionali del tipo gap junction, che permettono di coordinare l attività di tutti gli elementi cellulari di una lamina osteogenica impegnata nella deposizione (Jeansonne et al 1979, Doty 1981). Negli osteoblasti sono cellule impegnate nella formazione di nuovo tessuto osseo. A tal fine essi svolgono le funzioni riportate nella figura
48 52. Immagini al microscopio ottico di sezioni colorate (a sinistra) istologicamente con blu di toluidina e (a destra) isto-chimicamente con una reazione per la fosfatasi alcalina totale (TALP). Gli osteoblasti, il cui citoplasma appare intensamente colorato col blu di toluidina (A), mostrano invece solo la loro superficie intensamente positiva (in blu) alla fosfatasi alcalina (B). Sezioni seriate di osso dell anca non decalcificato e incluso in PMMA (Oryctolagus cuniculus). 53. Osteoblasti. Lo schema raffigura le funzioni delle cellule osteoformative. 47
49 Gli osteoblasti, cellule impegnate nella produzione della matrice organica dell osso, sintetizzano tutte sostanze necessarie alla deposizione dello stesso. Le macromolecole prodotte per secrezione sono rappresentate da: proteine strutturali: collagene, prevalentemente di tipo I e piccole quantità di tipo IV (Von Der Mark et al 1976); molecole regolatorie: osteonectina (Otsuka et al 1984), osteocalcina (Skjodt et al 1985), prostaglandina E2 (Yeh e Rodan 1984), sialoproteine, glicosaminoglicani, proteoglicani, fosfoproteine; enzimi proteolitici: collagenasi (Heath et al 1984), attivatori del plasminogeno (Hamilton et al 1985). 54. Osteoblasti. Lo schema raffigura le macromolecole prodotte per secrezione. Le sostanze sintetizzate dagli osteoblasti vengono prodotte in forma di precursori che dopo estrusione dalla cellula vengono trasformati nelle loro forme attive. Nella sintesi della principale proteina prodotta dagli osteoblasti, il collagene, si possono riconoscere due fasi: la prima è la fase intracellulare, durante la quale viene prodotto il procollagene, precursore del tropocollagene; la seconda extracellulare, in cui si ha l'aggregazione del tropocollagene in fibrille. La sintesi prevede una fase nucleare e una fase citoplasmatica. La fase nucleare della sintesi proteica, e in particolare del collagene, consiste nell iniziale trascrizione dei geni necessari a codificare la proteina. All'interno del genoma cellulare sono stati riconosciuti almeno 18 differenti geni che codificano le diverse catene α del collagene (Cheah 1985). I geni sono considerevolmente più lunghi rispetto alla sequenza di coppie di basi che servono realmente a codificare la sequenza aminoacidica della catena α finale. 48
50 Le sequenze di basi realmente utili, o esoni, e quelle invece che non servono nella codificazione delle catene α, o introni, sono intercalate tra loro all'interno del gene e vengono trascritte per intero sul filamento di RNA nucleare eterogeneo hnrna o precursore del RNA messaggero (Martin et al 1985). Questo primo filamento di hnrna subisce un processo di maturazione prima di essere trasportato all'esterno del nucleo sotto forma di RNA messaggero, mrna. Durante il processo di maturazione (splicing) gli introni formano alcune anse consentendo l'avvicinamento degli esoni. Gli introni vengono poi degradati nel nucleo, mentre gli esoni vengono uniti tra loro per formare il filamento di mrna maturo che avrà quindi una lunghezza inferiore rispetto al precedente. Una volta trasportato nel citoplasma l mrna maturo, ha termine la fase nucleare 55. Lo schema raffigura la fase nucleare con la formazione di RNA messaggero per trascrizione del DNA. a - piccolo cromosoma costituito da circa 3000 geni; b - frammento ingrandito del cromosoma costituito, per esempio, da 16 geni; c - frammento di DNA costituente un gene formato da due introni (in) e tre esoni (es); d - RNA trascritto (nucleare eterogenero hnrna); e avvicinamento degli esoni ed eliminazione degli introni dopo la formazione del lasso; f - RNA messaggero (mrna) maturo con esoni saldati che potrà uscire dal nucleo attraverso i pori della membrana nucleare Nella fase citoplasmatica l mrna maturro viene accoppiato ai ribosomi del reticolo endoplasmatico, che traducono il codice di basi nella sequenza aminoacidica delle catene pro-α. Al momento della loro formazione, le catene pro-α hanno una lunghezza maggiore rispetto alle catene α della molecola di collagene; dovuta alla presenza di terminazioni in corrispondenza delle loro estremità o regioni telopeptidiche. All'interno del reticolo endoplasmico le catene pro-α vengono idrossilate e glicosilate in corrispondenza degli aminoacidi prolina e lisina. 49
51 L'idrossilazione di questi due aminoacidi è un momento fondamentale affinché le catene pro-α possano essere legate assieme (Prockop e Williams 1982). Tre molecole di pro-α vengono quindi assemblate e formano la macromolecola di procollagene. In essa si possono riconoscere tre zone o domini proteici: una centrale rappresentata dalla tripla elica e due periferiche costituite dalle regioni telopeptidiche delle catene pro-α che si embricano tra loro senza però assumere l'aspetto a tripla elica. Le regioni telopeptidiche rappresentano una caratteristica importante della molecola di procollagene, in quanto la loro ingombrante presenza ne impedisce l'aggregazione e la formazione delle fibrille all interno della cellula. 56. Fase citoplasmatica con formazione della molecola di procollagene. Lo schema raffigura la sintesi del collagene. a - mrna esce dal nucleo attraverso i pori della sua membrana; b - si porta ai ribosomi adesi alle cisterne del reticolo endoplasmatico rugoso (RER) per essere letto tra l unità piccola e quella grande del ribosoma; c - viene sintetizzata la proteina pro-α; d la proteina pro-α percorre il sistema cavitario del RER dove subisce l idrossilazione della lisina e della prolina; e - abbandona il RER con una vescicola di trasporto; f -viene convogliata all apparato del Golgi dove subisce la glicosilazione dell idrossilisina e dove tre catene pro-α si assemblano per formare la molecola di procollagene (forma intracellulare della molecola di collagene). Una volta formato, il procollagene viene convogliato, per mezzo di vescicole di trasporto, dalle cisterne del reticolo endoplasmatico rugoso (RER) al complesso di Golgi. Qui il procollagene viene glicosilato e successivamente trasportato, tramite vescicole di secrezione, verso la superficie cellulare. La deposizione della matrice, infatti, si realizza mediante estrusione di vescicole di secrezione, contenenti procollagene e altre proteine, dall estremità minerale della membrana plasmatica, dove le vescicole si fondono con essa e con meccanismo di esocitosi riversano il loro contenuto nello spazio extracellulare. 50
52 Dopo la sua secrezione nel liquido extracellulare, il procollagene viene trasformato in molecola di collagene o tropocollagene per mezzo di enzimi specifici, denominati peptidasi procollagene, che distaccano dalla molecola le estremità che non possiedono struttura elicoidale, lasciando solo la molecola di collagene a tripla α-elica della lunghezza di 300 nm (Ehrlich e Borstein 1972). Sembra sia proprio la peptidasi procollagene a stabilire in quali zone dello spazio extracellulare debbano formarsi le fibre collagene (Lapière et al 1971). Le singole molecole di tropocollagene si allineano in una sequenza, in cui ciascuna molecola è sfasata di quasi un quinto della propria lunghezza rispetto alle altre, costituendo, alla microscopia elettronica, una tipica immagine dotata di una periodicità di 67 nm. Una volta formate nel tessuto, le fibre collagene vengono stabilizzate per mezzo della formazione di legami covalenti sia a livello intramolecolare che intermolecolare definiti cross-links (Eyre et al 1984). Il processo di formazione dei cross-links comincia con la conversione dei residui lisilici e idrossilisilici della molecola di tropocollagene in derivati aldeidici, per mezzo dell'azione dell'enzima lisil-ossidasi. Questi due aminoacidi modificati condensano con i residui lisilici e idrossilisilici di altri aminoacidi, formando legami covalenti. La presenza di questi legami impedisce lo scorrimento relativo delle molecole di tropocollagene, impartendo così una maggior stabilità alla fibra e rendendola praticamente inestensibile. Di contro, questo processo non diminuisce il carattere di flessibilità della molecola. 57. Superficie di deposizione dell osteoide in fase di mineralizzazione al SEM. Il basso ingrandimento evidenzia la re-golarità della superficie prodotta da una lamina osteoblastica. Su-perficie endostale di femore (Homo). Una volta costituita la trama di fibre collagene, definita osteoide, gli osteoblasti provvedono alla sua mineralizzazione, fornendo gli ioni minerali necessari per la formazione dei cristalli di idrossiapatite (Anderson 1985). La mineralizzazione incomincia a seguito della deposizione dell osteoide e si completa alcuni mesi dopo (Parfitt 1983), procedendo sempre dalle superfici minerali verso quelle vascolari. Il passaggio dei minerali sembra realizzarsi attraverso veicolazione microtubulare nello spazio extracellulare secondo il sistema di trasporto vescicolare (Anderson 1985). 51
53 Durante la deposizione dell osteoide circa un decimo degli osteoblasti, in base al tipo di tessuto osseo che si sta formando, viene reclutato a trasformarsi in osteociti, a seguito di segnali emessi dalle cellule inglobate nella matrice (Marotti 1992). Il processo di trasformazione richiede modificazioni strutturali che prevedono dapprima un cambiamento della polarità dell attività depositiva; questa comporta un rallentamento della velocità di deposizione, lo scavalcamento, da parte delle altre cellule, della lamina osteogenica e l emissione di processi citoplasmatici per mantenere i contatti con la lamina stessa e con gli altri osteociti (Palumbo et al 1990a, 1990b). Il processo di trasformazione degli osteoblasti in osteociti potrebbe essere interpretato come una sorta di promozione funzionale che acquisisce solo una piccola parte di essi. 58. Superficie di deposizione con formazione di una lacuna osteocitaria al SEM. L alto ingrandimento evidenzia la struttura di collagene mineralizzato e la presenza di una cavità di un preosteocita. Superficie endostale di femore (Homo). Questi osteoblasti, infatti, rallentano gradualmente la secrezione fino a perdere la loro capacità di sintesi della matrice (Marotti 1976a, Volpi et al 1981), ma acquisiscono un ruolo strategico fondamentale nel controllo dell omeostasi scheletrica e minerale (Marotti 1988). Il processo di trasformazione da osteoblasta ad osteocita prevede diversi stadi evolutivi che verranno dettagliatamente trattati in un apposito capitolo dedicato all evoluzione di questi elementi cellulari. La trattazione di tale argomento permette di comprendere quali complessi meccanismi entrino in gioco nel determinare lo sviluppo della rete cibernetica, tra gli osteociti e le cellule di rivestimento, fondamentale per il controllo dei processi omeostatici del tessuto osseo (Marotti 1996). 52
54 OSTEOCITI Gli osteociti sono cellule di aspetto dendritico e presentano un corpo cellulare dal quale si dipartono numerosi e sottili prolungamenti citoplasmatici. Originano dagli osteoblasti per trasformazioni morfologiche progressive, che si verificano durante il processo di deposizione dell orletto osteoide e della sua mineralizzazione, assumendo una morfologia specifica a se conda del tessuto osseo in formazione. Una volta completata la deposizione, i corpi cellulari di tali elementi rimangono racchiusi in piccole cavità che ne riproducono la forma, definite lacune osteocitarie, mentre i loro processi citoplasmatici si estendono all interno di sottili formazioni tubulari denominati canalicoli (Marotti et al 1990). 59. Lacune osteocitarie al microscopio ottico. I vuoti (in nero) evidenziano sia le lacune sia la rete canalicolare pervia. Sezione di femore non decalcificata e non inclusa (Homo). 60. Comparazione tra forma e dimensione degli osteociti. Si noti Si noti la loro diversa forma: globosa nel-l osso a fibre intrecciate (A); allungata, mandorliforme, nell osso la-mellare (B); allungata, ellissoidale, nell osso a fibre parallele e (C). Femore (Homo). 53
55 La forma definitiva de! corpo e dell'arborizzazione dei processi citoplasmatici degli osteociti, e di conseguenza anche della lacuna e della rete di microtubuli, risulta caratteristica a seconda del tipo di osso nel quale le cellule si trovano, Anche la dimensione del corpo cellulare varia tra gli osteociti presenti in tessuti ossei diversi. In particolare, nell'osso disordinato a fibre intrecciate il corpo si presenta di dimensioni piuttosto cospicue e di forma globosa. Nell'osso lamellare, più regolare nella sua costituzione, il corpo è invece più piccolo, allungato, schiacciato trasversalmente e assume un aspetto mandorliforme. Nell'osso a fibre parallele, ancora più ordinato rispetto agli altri tessuti ossei, il corpo risulta sempre piccolo e allungato, ma di aspetto fusiforme (Marotti et al 1985). 61. Osteocita. La cellula isolata (a), nella lacuna osteocitana (b), e la sola lacuna (c). 62. Lacune osteocitarie al SEM. I prparati evidenziano come siano morfologicamente diverse le lacune degli osteociti: globose nell osso a fibre intrecciate (A); allungate e mandorliformi nell osso lamellare (B); ellissoidali nell osso a fibre parallele (C). Dal fondo di ciascuna lacuna si dipartono le aperture dei canalicoli, che connettono tra loro le lacune e le mettono in comunicazione con i comparti vascolari. Femore (Homo). 54
56 A differenza degli osteoblasti e degli osteoclasti, che compaiono solo durante la formazione e il riassorbimento osseo, gli osteociti costituiscono invece la popolazione cellulare permanente e sono, quindi, sempre rilevabili nel tessuto. Queste cellule, una volta costituite, rimangono, infatti, definitivamente inglobate all'interno della matrice ossea, senza poter modificare ulteriormente la loro posizione, La scomparsa degli osteociti avviene solamente durante il riassorbimento da parte degli osteoclasti, che attuano la rimozione sia della matrice sia delle cellule. Di contro, se il tessuto osseo non subisce alcuna attività erosiva, gli osteociti permangono nelle lacune anche dopo il loro ciclo vitale (Marotti et al 1987). 62. Osteocita al SEM. La cellula dirama dal corpo cellulare e immette nei canalicoli i suoi prolungamenti. Femore (Homo). In microscopia ottica solamente il nucleo degli osteociti è chiaramente visibile; il citoplasma appare finemente granulare, debolmente basofìlo e alcune volte contiene goccioline lipidiche. I processi citoplasmatici sono occasionalmente evidenti e quando sono visibili, comunque, sono impregnati di colorante. Studi in microscopia elettronica a trasmissione mostrano come l'ultrastruttura degli osteociti vari in funzione dell'età evolutiva delle cellule stesse (Nefussi et al 1991). Gli osteociti appena costituiti, quindi molto vicini alle lamine osteogeniche, e ancor più i preosteociti, cioè quelle cellule che si sono staccate dalla lamina di osteoblasti ma che non sono ancora circondate dal tessuto mineralizzato, possiedono molte caratteristiche degli osteoblasti (Palumbo 1986). 55
57 64. Osteociti in osso a fibre intrecciate (A) e in osso lamellare (B). La comparazione delle sezioni dei tessuti evidenzia le diversità morfologiche nello schema di deposizione e nella forma delle cellule. Osso mandibolare. Colorazione blu di toluidina. (Homo). Gli osteociti giovani contengono un reticolo endoplasmatico rugoso abbondante, numerosi ribosomi liberi, molti mitocondri, un ampio apparato di Golgi iuxtanucleare e un nucleo ricco di eucromatina. Sono circondati da un ampio spazio pericellulare, contenente fibre collagene disposte in modo lasso; la parete mineralizzata delle loro lacune di solito mostra un bordo indentato. Gli osteociti appena formati, che non hanno colmato la loro lacuna, sono pertanto ancora osteogenicamente attivi (Palumbo 1986; Palumbo et al 1990a, 1990b). 65. Preosteocita al TEM. La cellula ha perso la polarizzazione mentre viene inclusa nell osteoide diramando brevi prolungamenti citoplasmatici. Osso dell anca (Oryctolagus cuniculus) ). 66. Osteocita maturo al TEM. La cellula, una volta inglobata nella matrice presenta un minor sviluppo dell apparato organulare. Osso dell anca (Oryctolagus cuniculus) ). 56
58 Negli osteociti maturi l'apparato organulare acquisisce minor rilievo. Il reticolo endoplasmatico rugoso e il complesso di Golgi sono assenti o estremamente ridotti. I mitocondri sono più ampi di quelli degli osteoblasti ma meno numerosi. Frequentemente si riscontra la presenza di inclusioni di goccioline lipidiche, vacuoli isolati e alcuni microcorpi densi. La membrana plasmatica è di solito in contatto con la parete lacunare, costituita di una capsula che contiene cristalli di idrossiapatite disposti a palizzata (Palumbo 1986; Palumbo et al 1990a, 1990b). In campioni di osso decalcificato, colorati con acido osmico, il collagene appare separato dalla circostante matrice ossea, quando è disposto in modo lasso, e da una lamina osmiofila dove è invece organizzato in bande più dense. La natura e il significato di questa lamina osmiofila, più densa, non sono stati ancora chiariti, ma sembra essere un indice del completamento della lacuna, in quanto essa non è osservabile nelle lacune in formazione. I processi citoplasmatici non contengono organuli, appaiono di solito costituiti da microtubuli e microfilamenti disposti a nido d'ape. Gli osteociti adiacenti possono connettersi tra loro mediante contatti di tipo end-to-end, side-to-side, finger-like. Sono presenti inoltre giunzioni tra gli osteociti e gli osteoblasti. A livello delle connessioni intercellulari è stata descritta la presenza di tight-junction e gap-juntion. Il calibro dei processi è variabile (0,01-0,1 µm), ma ovviamente risulta essere più piccolo di quello dei canalicoli (0,05-0,5 µm) (Palumbo et al 1990a). I processi citoplasmatici che originano dai due lati opposti degli osteociti, si estendono in modo asimmetrico, all'interno dei corrispondenti canalicoli. I processi diretti verso la superficie vascolare, infatti sono notevolmente più lunghi di quelli rivolti in direzione degli osteociti più vecchi (Palumbo et al 1990b). 67. Osteociti al SEM. Si noti come dall osteocita più vecchio (di dimensioni maggiori, a sinistra) lunghi prolungamenti si portino in direzione dell osteocita più giovane (di dimensioni minori) e della cavità vascolare (a destra). Femore (Homo). 57
59 PROCESSO DI TRASFORMAZIONE DELL OSTEOBLASTA IN OSTEOCITA In condizioni normali, durante il processo di deposizione la lamina osteogenica, per la continua secrezione di nuovo osteoide che, successivamente, calcifica, si allontana progressivamente da un punto iniziale di riferimento, come per esempio la linea cementante. Per la continua produzione di osteoide la maggior parte degli osteoblasti rimane alla stessa distanza dal fronte di calcificazione; ciò invece non si verifica per alcuni osteoblasti, destinati a trasformarsi in osteociti, in risposta a segnali emessi da altri osteociti, presenti nell osso deposto precedentemente (Marotti et al 1992, 1995a). Gli osteoblasti reclutati cambiano di dimensione e aumentano la loro superficie di deposizione riducendo così la velocità di progressione; di conseguenza vengono circondati dal tessuto preosseo prodotto dagli osteoblasti vicini. Con la calcificazione del tessuto osteoide che li circonda, essi sono spazialmente vincolati nel punto in cui hanno modificato la loro attività depositiva (Marotti 1976a, Volpi at al 1981). La forma dendritica dell'osteocita maturo viene raggiunta progressivamente attraverso notevoli cambiamenti morfologici. Il corpo cellulare si riduce di dimensioni e, nel contempo, si ha l emissione dei processi citoplasmatici. La quantità degli organuli del citoplasma diminuisce mentre il rapporto nucleo-citoplasma aumenta (Palumbo et al 1990a, 1990b). Marotti et al (1990) 68. Sequenza di eventi che si realizzano durante il processo di trasformazione dell'osteoblasto in osteocita. Lo schema raffigura una lamina osteogenica con l osteoblasta reclutatoal centro (a), l osteoblasta rallenta e diventa preosteocita di tipo I (PO1) (b), la trasformazione in preosteocita di tipo II (PO2) dopo lo scavalcamento da parte della lamina osteogenica e il suo rimpiazzamento con un nuovo osteoblasta (c), la trasformazione in tipo III (PO3) ancora parzialmente compreso nell osteoide non completamente mineralizzato (d). 58
60 Gli osteoblasti di un fronte di deposizione sono in contatto con i processi citoplasmatici degli osteociti, diretti verso gli spazi contenenti i vasi, denominati processi vascolari. Durante la deposizione ossea, i processi vascolari degli osteociti neoformati continuano ad allungarsi, per rimanere in contatto con la lamina osteoblastica che gradualmente si allontana da essi. Oltre una certa distanza gli osteociti non sono più in grado di produrre il protoplasma necessario per sostenere la crescita dei loro processi citoplasmatici. A questo punto i giovani osteociti emettono il segnale che induce il reclutamento di nuovi osteoblasti indirizzandone il destino verso la trasformazione in osteociti. Questo probabilmente si realizza per mezzo delle gap-junction presenti a livello dei contatti che osteociti possiedono con gli osteoblasti della lamina osteogenica (Palumbo 1986; Palumbo et al 1990a, 1990b).. Durante il processo di trasformazione degli osteoblasti in osteociti, possono essere riconosciuti tre tipi di preosteociti: preosteociti di tipo 1, 2 e 3 in base alla posizione, alla forma e all'ultrastruttura della cellula (Marotti et al 1990). L'osteoblasta candidato a diventare osteocita si trasforma dapprima in preosteocita di tipo 1 (PO1). Questa cellula è riconoscibile poichè il lato vascolare e le porzioni laterali della membrana citoplasmatica sono completamente in contatto osteoblasti, mentre per il suo appiattimento, il territorio di secrezione è 2-3 volte più esteso di quello degli osteoblasti adiacenti. Dalla superficie di secrezione, detta anche superficie minerale, il PO1 irradia dei brevi prolungamenti citoplasmatici in direzione del fronte di calcificazione del tessuto osteoide. Come per gli osteoblasti la superficie minerale dei PO1 appare in contatto con i processi citoplasmatici di osteociti maturi, sia a livello del corpo cellulare sia tramite i brevi processi citoplasmatici in formazione. Lungo la superficie osteoblastica, i PO1 appaiono in contatto con gli osteoblasti tramite gapjunction e adherens-junction. L'aumento del territorio di secrezione sembra essere il primo fenomeno che si realizza nell'osteoblasta candidato a trasformarsi in osteocita; infatti, sebbene rispetto agli osteoblasti adiacenti la cellula reclutata continui a secernere la stessa quantità di matrice ossea per unità di volume cellulare, a causa del maggior territorio di secrezione produce davanti a sé uno strato di osteoide più sottile. Ciò determina, praticamente, una diminuzione della velocità di deposizione e, di conseguenza, la cellula in trasformazione viene superata e scavalcata dagli altri osteoblasti che procedono oltre a questa. 69. Preosteocita di tipo 1 al microscopio ottico. Il PO1 è distinguibile per il notevole aumento della superficie di deposizio-ne, appena inferiormente allo stesso. Osso mascellare. Colorazione blu di toluidina. (Rattus norvegicus). 70. Preosteocita di tipo 2 al microscopio ottico. Il PO2 mantiene ancora il contatto con la lamina osteogenica mediante il versante vascolare della membrana. Osso mascellare. Colorazione blu di toluidina. (Rattus norvegicus). 59
61 Gli osteoblasti, continuando a depositare tessuto osteoide anche dietro al preosteocita, lo inglobano nella matrice preossea (Marotti 1976a, Volpi at al 1981). Il processo di trasformazione prosegue nella maturazione del PO1 nel preosteocita di tipo 2(PO2). Questa cellula è completamente localizzato all'interno dell orletto osteoide, ma con l estremità osteogenica vascolare della membrana plasmatica ancora in contatto con la lamina. Allo stadio di PO2 i prolungamenti citoplasmatici vengono emessi solamente in direzione del fronte di mineralizzazione. I contatti side-to-side ed end-to-end, localizzati nello strato osteoide tra i brevi processi minerali dei preosteociti di tipo 1 e 2, e i lunghi processi vascolari degli osteociti maturi, sono alla base della formazione della rete canalicolare, per il controllo dell attività meccanica e metabolica dell osso. L ultimo stadio di maturazione dell'osteoblasta corrisponde al preosteocita di tipo 3 (PO3). Quest'ultimo è completamente distaccato dalla lamina osteogenica ed è in parte circondato dalla matrice mineralizzata. Nel preosteocita tipo 3, i processi minerali rivolti verso gli osteociti sono corti, e le loro interrelazioni con i processi citoplasmatici degli osteociti maturi sono simili a quelle descritte nei passi precedenti. I processi citoplasmatici rivolti verso la lamina osteogenica o vascolari, diversamente da quelli minerali, sono più lunghi e più stirati e, di solito, penetrano all'interno degli osteoblasti a formare dei contatti finger-like mediati da gap-junctions. I processi citoplasmatici rivolti verso la lamina osteogenica continuano ad allungarsi per rimanere in contatto con le cellule della lamina e ciò conduce ad una progressiva e asimmetrica arborizzazione della cellula che si sta trasformando in osteocita maturo. Il processo continuerà con il reclutamento di nuovi osteoblasti candidati a differenziarsi in osteociti, fino al termine dell attività di deposizione della lamina. 71. Preosteocita di tipo 3 al microscopio ottico. Il PO3, in prossimità del fronte di mineralizzazione dell orletto, risulta compreso nell osteoide. Colorazione blu di toluidina. Osso mascellare. (Rattus norvegicus). 72. Preosteocita di tipo 3 al microscopio ottico. Il PO3, in via di trasformazione in osteociti, appare completamente distaccato dalla lamina osteogenica. Colorazione blu di toluidina. Osso mascellare. (Rattus norvegicus). 60
62 Gli osteoblasti candidati a trasformarsi in osteociti non partecipano direttamente alla loro incorporazione ma vengono murati all'interno della matrice minerale dagli osteoblasti adiacenti. I preosteociti agli stadi PO1 e PO2 appaiono, infatti, polarizzati in direzione della superficie in mineralizzazione, mentre allo stadio PO3, quando la polarizzazione morfofunzionale non è più evidente, anche la loro attività di sintesi della matrice è notevolmente ridotta. Marotti et al (1990) hanno dimostrato che la formazione dei processi citoplasmatici degli osteociti è un fenomeno asincrono e asimmetrico che precede la mineralizzazione dell osteoide; in altre parole, i processi citoplasmatici non sembrano essere in grado di crescere all'interno della matrice ossea mineralizzata e pertanto i canalicoli non si formano come conseguenza di un riassorbimento osseo prodotto dalle punte dei processi citoplasmatici degli osteociti. I brevi e spessi prolungamenti che i preosteociti irradiano in direzione della matrice mineralizzata possiedono principalmente una funzione osteoformativa: derivano infatti dall estroflessione della membrana plasmatica dell osteoblasta (Marotti et al 1990). Questa condizione si verifica solamente all'inizio della costituzione di tali processi. In un secondo tempo essi sono coinvolti nella formazione dei canalicoli allo stesso modo dei processi rivolti verso la lamina osteogenica. Al contrario, i lunghi processi citoplasmatici che i preosteociti emettono successivamente dal lato vascolare non sono iplicati nella secrezione e mineralizzazione della matrice, ma possiedono una funzione nutrizionale e agiscono come modulatori sull'attività metabolica degli osteoblasti. Le osservazioni Marotti et al (1990), indicano infatti che attraverso l'intero processo di trasformazione da osteoblasti in osteociti, le cellule che si differenziano rimangono in contatto sia con gli osteociti sia con gli osteoblasti per mezzo di relazioni morfologiche scambiabili, che permettono la modulazione dell'attività osteoblastica. 73. Fronte di calcificazione al SEM. Superficie mineralizzata del tessuto che circonda il preosteocita di tipo 3 in via di trasformazione in osteocita, Femore. (Homo). 61
63 FUNZIONI DELL OSTEOCITA L'osteocita assolve fondamentalmente a due funzioni diverse, a seconda dell'età della cellula. Si ipotizza che i preosteocititi e gli osteociti giovani prossimi alla lamina osteogenica siano coinvolti nella regolazione dei processi osteoformativi. Gli osteociti adulti invece sembrano svolgere una funzione di controllo dell omeostasi scheletrica del tessuto (Marotti et al 1990, Marotti 1996). I preosteociti e i giovani osteociti, prossimi alla lamina osteoblastica, partecipano ai processi osteogenetici; i primi nell'organizzazione spaziale della matrice ossea e i secondi nel reclutamento di osteoblasti candidati a trasformarsi in osteociti. A questo proposito, la differenza nella trama del collagene tra i diversi tessuti ossei dipende dal mmodo in cui avviene il reclutamento degli osteoblasti che si trasformano in osteociti (Marotti e Muglia 1988). Più precisamente, se gli osteoblasti vengono reclutati in modo casuale si forma osso a fibre intrecciate; se invece il reclutamento avviene secondo uno schema ordinato e gli osteoblasti vengono chiamati in gruppi successivi a distribuirsi sullo stesso piano, si forma osso lamellare (Marotti et al 1990). Gli osteociti adulti e vecchi probabilmente producono piccole molecole proteiche, glicoproteiche o a carattere idrofobo, come le prostaglandine, che possono innescare localmente nuove attività cellulari L evidenza di contatti cellulari, tra osso neodeposto e osso preesistente, attraverso le linee cementanti, dimostrano come sia verosimile l ipotesi di un possibile controllo mediato da osteociti adulti sul reclutamento di nuovi osteoblasti. Gli osteociti sembrano agire come meccanostati: essi sono in grado di rilevare le alterazioni meccaniche locali, risentendo degli stati di deformazione che si sviluppano nel tessuto, sia quando si hanno cambiamenti nelle sollecitazioni sia, patologicamente, quando vi sono importanti modifiche del metabolismo, come nella menopausa. In quest ultimo caso essi rispondono in maniera alterata alle sollecitazioni a causa dello spostamento della sensibilità degli osteociti prodotto dal crollo di estrogeni (Marotti 1996). 68. Osteocita al TEM. La giovane cellula risulta connessa con la lamina di osteoblasti nell osso neodeposto. Osso dell anca (Oryctolagus cuniculus) ). 62
64 L estesa rete-lacuno-canalicolare sembra svolgere invece un importante ruolo nell amplificazione dei segnali. Quest ipotesi si basa sui seguenti risultati: nelle regioni ossee soggette a più elevato turnover, paragonate con quelle dove i processi adattivi sono più lenti, come le epifisi rispetto alle diafisi, le lacune osteocitiche sono più ampie e più numerose e molti osteociti adulti conservano una certa attività dell'apparato granulare coinvolto nella sintesi proteica e/o glicoproteica (Marotti et al 1955b). È difficile sostenere che queste cellule siano impegnate nella sintesi e secrezione di componenti organiche della matrice ossea, considerando che si trovano all'interno di lacune ultimate; di contro, è più veritiero ipotizzare che elaborino biomolecole regolatorie; alcuni segmenti scheletrici, come ad esempio gli ossicini auricolari, che solo occasionalmente vanno incontro a fenomeni di turnover durante l'arco della vita, normalmente contengono una percentuale di osteociti degenerati molto più elevata di quella registrata in altre ossa. La carenza di osteociti vivi sembra, quindi, precludere eventuali possibilità di innesco di nuove attività cellulari (Marotti et al 1987). studi condotti in vivo su animali, trattati con uridina tritiata, hanno dimostrato un aumento significativo dell isotopo negli osteociti, in seguito ad un singolo breve periodo ciclico, di stimolazione meccanica dell'osso (Pead et al 1988). Gli autori asseriscono che questo risultato può rappresentare semplicemente un aumento dell'attività cellulare non specificatamente correlato alla deformazione. Non è tuttavia possibile escludere che esso sia espressione di un'attività di sintesi, da parte degli osteociti, di sostanze specificatamente associate all attivazione cellulare (Pead et al 1988). A questo proposito è stato ipotizzato che la demolizione del citoscheletro negli osteociti potrebbe indurre in queste cellule un meccanismo di risposta alle forze meccaniche applicate all'osso (Doty 1988). E' stato infatti dimostrato un aumento della produzione di prostaglandina E 2, biomolecola coinvolta nell attivazione osteoclastica, in cellule osteoblasto simili, in seguito alla distruzione dei microtubuli del loro citoscheletro (Yeh e Rodan 1984). 75. Processi citoplasmatici osteocitari al SEM. Nei pressi di una linea cementante (linea dentellata e incavata a sinistra) è chiaramente apprezzabile come l osteocita, nella parte inferiore dell immagine (osso più vecchio) si connetta con i suoi prolungamenti con la rete lacuno-osteocitaria presente al di là della linea cementante (ospiù recente). Si noti inoltre la diversa disposizione dei corpi cellulari che appaiono casualmente tra loro ortogonali. Femore. (Homo). 63
65 CELLULE DI RIVESTIMENTO Le cellule di rivestimento o bone lining cells, assieme agli osteociti, costituiscono la popolazione permanente di cellule ossee. Al contrario degli osteociti, che sono compresi nella matrice mineralizzata, le cellule di rivestimento formano invece uno strato che ricopre le superfici ossee sia corticali (Cooper et al 1966) sia endostali (Miller et al 1980, Miller e Jee 1987, Miller et al 1989). Le cellule di rivestimento presentano una forma appiattita che ricorda le cellule degli epiteli monostratificati e costituiscono un tappeto cellulare che separa la matricie ossea dall ambiente extracellulare propriamente detto, isolandola da quest ultimo. Formano una sorta di barriera tra il territorio osseo e l ambiente circostante e mediano gli scambi molecolari tra i due compartimenti. Le cellule di rivestimento sono bagnate, sul loro versante rivolto verso lo stroma di sostegno dei capillari, dal fluido extracellulare, mentre sul loro versante rivolto verso la matrice mineralizzata dal fluido osseo (Marotti 1988). Il fluido circola in profondità tra i corpi cellulari e i processi citoplasmatici degli osteociti e rappresenta il veicolo delle sostanze nutrizie e dei metaboliti. Le cellule di rivestimento possiedono quindi un ruolo strategico fondamentale nella mediazione del trasporto di ioni minerali (Talmage et al 1976) e di altre sostanze che devono essere veicolate in profondità nella matrice o che provengono da essa (Miller et al 1980). 76. Cellule di rivestimento. Lo schema raffigurae la disposizione monostratificata simil-epiteliale di queste cellule. In profondità, nella matrice sono inglobati gli osteociti, in contatto con le cellule di rivestimento presenti sulla superficie ossea, attraverso i processi citoplasmatici. 64
66 Per quanto riguarda la loro origine allo stato delle conoscenze attuali, sono presenti ancora diverse interpretazioni. Sebbene la linea appartenenza sia mesenchimale, circa la loro linea di discendenza esistono tuttavia ancora alcuni lati non completamente conosciuti (Volpi et al 1981, Miller e Jee 1987). 77. Cellule di rivestimento al SEM. Le cellule sono a ridosso di una superficie ossea endostale, formando un singolo strato che la tappezza. Femore (Oryctolagus cuniculus). 78. Cellule di rivestimento dell osso al TEM. Il preparato evidenzia i due compartimenti: extracellulare (in alto a destra), alle spalle delle cellule di rivestimento, e osseo (in basso a sinistra). Si osservano fibrille collagene circondate dai fluidi, tra le cellule e il tessuto calcificato. Osso coxale (Oryctolagus cuniculus). 65
67 Le teorie più accreditate sostengono che le cellule di rivestimento originano da osteoblasti della lamina osteogenica che, durante la deposizione, non sono stati incorporati come osteociti e che al termine del processo depositivo subiscono modificazioni strutturali appiattendosi e trasformandosi in elementi di rivestimento. Non è possibile, tuttavia, escludere che alcuni di questi elementi provengano invece direttamente dalle cellule reticolari stromali (Volpi et al 1981). Le cellule di rivestimento presentano forma laminare; il nucleo, anch esso appiattito, si dispone al centro della cellula e risulta evidente in microscopia ottica; il citoplasma è di solito finemente granulare e debolmente basofilo. A livello ultrastutturale si osserva come l'intero apparato organulare risulti estremamente ridotto. Brevi e tozzi prolungamenti citoplasmatici si dipartono dal versante minerale del corpo cellulare e si protendono all interno dei canalicoli della matrice, mantenendo rapporti di contatto con i processi vascolari degli osteociti siti più in profondità. Diversi sistemi giunzionali garantiscono l unione tra gli elementi contigui dello strato di rivestimento (Doty 1981). 79. Cellule di rivestimento. Lo schema raffigura la modalità di formazione. a Gli osteoblasti, al termine di una attività depositiva, subiscono modificazioni morfologiche progressive; b le cellule aumentano il territorio di secrezione e si appiattiscono; c al termine delle citomorfosi gli elementi cellulari tappezzano la superficie. Esistono pareri contrastanti circa la possibilità che le cellule di rivestimento costituiscano uno strato continuo. Secondo Miller et al (1980) esiste una discontinuità nella barriera; questa teoria non trova riscontro nelle osservazioni di Menton et al (1984) che suggeriscono invece che le discontinuità osservate tra gli elementi cellulari della barriera di rivestimento siano in realtà il risultato di artefatti dovuti al restringimento del loro citoplasma, per effetto dei fissativi e dell essicazione dei preparati. 66
68 Le funzioni svolte dalle cellule di rivestimento sono strettamente legate alla loro posizione strategica: tessuto osseo da una parte e compartimento vascolare dall altra. Grazie ad un estesa rete di contatti intercellulari con gli osteociti in profondità e con le cellule stromali del connettivo perivascolare, contribuiscono alla gestione dei rapporti tra i due compartimenti, controllando i processi diffusivi e mediando l attivazione di nuove unità funzionali. Dal momento che la matrice mineralizzata risulta separata dall ambiente vascolare, mediante la barriera delle cellule di rivestimento, il sostentamento trofico delle cellule in essa presenti può essere garantito attraverso processi diffusivi ed entro una determinata distanza da una superficie vascolare (Lozupone e Favia 1990). È acquisito che le cellule di rivestimento rpartecipano alla regolazione dei processi di scambio tra il liquido extracellulare (LEC) del connettivo delle cavità vascolari ed il compartimento fluido osseo (CFO). Le caratteristiche sostanziali che presenta il CFO rispetto al LEC risiedono nell elevato contenuto in potassio, nell ipertonicità e nel basso contenuto in calcio (Talmage 1970). Sebbene il ruolo strategico della barriera delle cellule di rivestimento sia ad oggi ben documentato, non si conoscono ancora i meccanismi biologici con i quali agiscono, per mantenere le differenze di concentrazione tra i due fluidi e più in generale per la regolazione dell omeostasi fosfocalcica (Talmage et al 1976, Norimatsu 1978, Matthews et al., 1980, Miller et al., 1980). 80. Contatti intercellulari al TEM. Il preparato evidenzia lo sviluppo di una connessione finger-like tra una cellua stromale (in alto in verticale) e una cellula di rivestimento (in mezzo in diagonale). Osso coxale (Oryctolagus cuniculus). 67
69 La situazione logistica conferisce a queste cellule un importanza strategica determinante nella mediazione e veicolazione di possibili elementi innescanti una qualsiasi attività di modellamento o rimodellamento sulle superfici ossee (Marotti 1996). Il reclutamento di nuove unità funzionali avviene solo da elementi precursori presenti nel contesto dello stroma di sostegno connettivale e, nel caso di una superficie ossea in stato di quiescenza, solo le cellule di rivestimento contraggono rapporti con quest ultima. Si è detto in precedenza che non è possibile escludere che alcune cellule di rivestimento siano in realtà cellule reticolari stromali modificate (Volpi et al 1981). L ipotesi apre un ampio capitolo sulle possibilità funzionali di questi elementi, poichè possono essere sia la via di inizio di eventuali nuove attività osteoformative, preservando ancora capacità mitotiche e differenziative verso la linea osteoblastica. Inoltre possono rappresentare gli elementi che mediano il controllo sui precursori che risiedono nel stroma di sostegno (Marotti 1996). 81. Estensione dei contatti intercellulari al SEM. L immagine evidenzia l enorme sviluppo della rete canalicolare in partenza dalla superficie vascolare del canale haversiano di un osteone. Femore (Homo). 68
70 Circa l attivazione cellulomediata degli osteoclasti sono state suggerite interessanti teorie (Rodan e Martin 1981, Rodan et al 1981, Rodan e Rodan 1984). Nello specifico, le cellule di rivestimento sono il bersaglio di vari segnali di attivazione, la cui risposta conduce alla comparsa di osteoclasti. Quest ipotesi origina dall osservazione che le cellule di rivestimento possiedono recettori per il l ormone paratiroideo (PTH) e per la forma attiva della vitamina D 3, mentre gli osteoclasti e i loro precursori ne sono invece privi. Le cellule di rivestimento sembrano rispondere a questi segnali in due modi: contraendosi in modo tale da esporre la superficie ossea e rilasciando AMP ciclico, una biomolecola responsabile della stimolazione e dell attivazione degli osteoclasti (Rodan e Martin 1981). Altre biomolecole come le prostaglandine rappresentano invece un messagero intermedio per l attivazione del modellamento e del rimodellamento, indotto da stimoli di natura meccanica. Si è discusso in precedenza sul ruolo degli osteociti e si è visto come essi svolgano una funzione di meccanostati del tessuto osseo (Marotti 1996). Alterazioni del loro citoscheletro, in seguito a deformazione meccanica del tessuto ove sono contenuti, indurrebbero il rilascio di prostaglandina. Questa molecola, a sua volta, agendo sulle cellule di rivestimento condurrebbe a un aumento del rilascio di AMP ciclico (Yeh e Rodan 1987, Doty 1988). Questa teoria si basa sull esistenza di un loop citologico, nel quale l'ultima cellula di una sequenza di adattamento funzionale, meccanico o metabolico, diviene iniziatrice del ciclo successivo. 82. Orientamento della rete lacuno-canalicolare al SEM. L immagine di uno spazio vascolare haversiano dopo parziale demineralizzazione e digestione della componente organica. Si noti l imponente rete lacunocanalicolare e la direzione prevalente dei canalicoli osteocitari che giungoin contatto con lo spazio vascolare. Calco in PMMA. Femore (Homo). 69
71 OSTEOCLASTI Gli osteoclasti sono le cellule deputate alla degradazione e riassorbimento della matrice ossea e hanno notevoli dimensioni, circa 100 µm. Sono dei sincizi polimorfi che possono contenere un gran numero di nuclei e possiedono un citoplasma debolmente acidofilo. 83. Osteoclasti al microscopio ottico. Gli osteoclasti, colorati in blu con solocromocianina, erodono un frammento d osso, colorato in marrone dalla colorazione in rosso congo. Il preparato evidenzia le notevoli dimensioni delle cellule e i numerosi nuclei del sincizio (Oryctolagus cuniculus). A seconda dello stato funzionale, sono riconoscibili due diverse forme cellulari. Quando non sono impegnati in attività di riassorbimento gli osteoclasti appaiono polimorfi, localizzati aderenti alla superficie ossea, come nello strato interno del periostio e nel sistema reticolo endoteliale endostale, o mobili nell'ambiente extracellulare (Zambonin Zallone e Teti 1981). In questa forma, si evidenziano negli osteoclasti membrane ondulanti organizzate a formare estesi pseudopodi. Il citoplasma ha un aspetto omogeneo, completamente privo di organuli ma contenente materiale filamentoso, che assomiglia al citoplasma di altre cellule mobili, come i monociti-macrofagi. Nella parte più interna dell'area citoplasmatica, i nuclei sono raggruppati al centro della cellula, circondati dall'apparato di Golgi, dal reticolo endoplasmatico granulare, da rosette di ribosomi liberi e da lisosomi. I vacuoli sono scarsi o assenti, e non sono visibili inclusioni cellulari. (Miller 1977; Zambonin Zallone e Teti 1981). La trasformazione di un osteoclasta dalla forma quiescente a quella attiva induce importanti cambiamenti all'interno della cellula, che portano ad una riconfigurazione spaziale del citoscheletro e a un riordinamento dei suoi organuli (Baron et al 1985). In tale circostanza, l'osteoclasta acquista una stretta relazione con la superficie ossea. I nuclei alla periferia della cellula r il sistema microtubulare acquista maggiore estensione. La membrana plasmatica si dispone in due distinte aree funzionali, la membrana basolaterale e la membrana apicale (Baron 1989). 70
72 La membrana basolaterale è la parte della membrana rivolta verso lo spazio vascolare; appare liscia, non presenta caratteristiche morfologiche peculiari e regola il notevole flusso di scambi con l ambiente vascolare. La membrana apicale è rivolta verso la superficie ossea ed è organizzata in un dominio esterno con funzioni di adesione, definito zona sigillante, e uno interno, deputato alla funzione di riassorbimento, che prende il nome di bordo rugoso. 84. Forma e costituzione interna degli osteoclasti e rapporti con la superficie ossea. Lo schema raffigura il sincizio nella sua forma attiva. a Versante minerale dell osteoclasta; b struttura interna della cellula: il particolare della zona sigillante (I) ed il dettaglio della configurazione di un singolo podosoma (II). Le lettere indicano: A= α-actina, F = fimbrina, G = gelsolina, V = vinculina, T = talina. c adesione della cellula alla superficie ossea e delimitazione da parte dei podosomi del compartimento di riassorbimento. La zona sigillante è Il dominio periferico della membrana apicale (King e Holtrop 1975, Holtrop e King 1977, Baron 1899). Circoscrive uno spazio extracellulare, compreso tra l osso e la cellula stessa, definito compartimento di riassorbimento. Questo spazio è separato dall'ambiente esterno per permettere che si verifichino le condizioni necessarie alla realizzazione del riassorbimento osseo. L'area citoplasmatica che sovrasta la zona sigillante viene denominata zona chiara, in quanto possiede un aspetto omogeneo ed è priva di organuli a eccezione di alcuni poliribosomi liberi. La zona sigillante è caratterizzata dalla presenza di brevi estroflessioni della membrana plasmatica, simili a microvilli, definite podosomi, che mediano l attacco delle cellule al substrato osseo (Marchisio et al 1984, Zambonin Zallone et al 1988). I podosomi sono dotati di proteine transmembrana, la talina e la viniculina, appartenenti alla famiglia delle integrine, che sono in grado di connettersi all interno della cellula con i microfilamenti del citoscheletro e all esterno col substrato osseo (Marchisio et al 1984, 1987; Burridge et al 1988). 71
73 Il sistema di connessione intracellulare si realizza nella zona centrale dei podosomi per mezzo di un complesso proteico, costituito da α-actina, fimbrina e gelsolina (Marchisio et al 1984, 1987), legante i microfilamenti del citoscheletro, che a questo livello sono organizzati in piccole bande orientate perpendicolarmente rispetto alla membrana plasmatica (Marchisio et al 1984, Zambonin Zallone et al 1988). La connessione extracellulare tra la cellula e il substrato osseo, si realizza sempre a opera del sistema viniculina-talina, proteine che agiscono come recettori per componenti specifici della matrice extracellulare (Ruoslahti e Pierschbacker 1987, Zambonin Zallone et al 1989). Il ruolo di questi recettori è il riconoscimento di componenti proteiche che contengono la sequenza aminoacidica adesiva arginina-glicina-asparagina (Arg-Gly-Asp) (Ruoslahti e Pierschbacker 1986, 1987) presenti nel collagene, nell osteopontina, nelle sialoproteine e nella trombospondina della matrice ossea (Odberg et al 1988, Robey et al 1989). 85. Osteoclasti al microscopio ottico. I granuli positivi alla reazione istochimica per la fosfatasi acida si presentano intensamente colorati in rosso. Si evidenzia la polarizzazione delle cellule e le diverse parti funzionali della membrana citoplasmatica. Femore (Oryctolagus cuniculus). Il borgo rugoso è il dominio interno della porzione apicale della membrana plasmatica e rappresenta l'apparato di riassorbimento dell'osso, formato da pieghe profonde della membrana che ne aumentano la superficie globale della stessa. Questa struttura si sviluppa all'interno del compartimento di riassorbimento e crea un microambiente idoneo affinchè si possa realizzare la funzione di erosione dell osso. Le pieghe hanno un aspetto irregolare, a microvilli, e possono essere associate ad ampie aree vacuolari contenenti bande di fibre collagene frammentate (Bonucci 1981). I meccanismi di riassorbimento che operano a livello di questo microambiente si estrinsecano attraverso sistemi localizzati nel bordo rugoso della membrana o nel citoplasma cellulare (Fig. 83). Il riassorbimento delle due componenti della matrice avviene con un asincronismo che prevede che la prima componente ad essere degradata sia l idrossiapatite e successivamente l impalcatura di collagene (Teti e Zambonin Zallone 1990). 72
74 La dissoluzione dell idrossiapatite Ca 10 (OH) 2 (PO 4 ) 6 si realizza per acidificazione, a ph inferiori 5, del compartimento di riassorbimento. L acidificazione prevede l azione coordinata di diversi sistemi enzimatici, atti a fornire una costante quantità di protoni e nel contempo garantire lo smaltimento degli ioni provenienti dalla dissoluzione dell idrossiapatite. 86. Modalità con cui l osteoclasta dissolve il minerale dell osso. Lo schema raffigura: a i sistemi enzimatici coinvolti nell acidificazione del compartimento di riassorbimento; b i sistemi enzimatici impegnati nell escrezione dei minerali prodotti dalla degradazione dell idrossiapatite. I sistemi enzimatici coinvolti negli scambi minerali prevedono: i canali di scambio che veicolano l entrata di ioni dal compartimento di riassorbimento al citoplasma e da quest ultimo all ambiente extracellulare e viceversa; l enzima anidrasi carbonica atto a garantire la disponibilità di protoni necessari per l acidificazione. L attività di riassorbimento degli osteoclasti coinvolge la partecipazione di molti canali di scambio ionici, distribuiti in maniera polarizzata lungo la membrana cellulare: il sistema di trasporto attivo con pompa dei protoni (Baron et al 1985, Blair et al 1989) e l accoppiato canale per gli ioni cloruro (Blair et 1989), localizzati nel bordo rugoso per l acidificazione del compartimento di riassorbimento; il sistema di trasporto attivo per ioni calcio e ioni fosfato e un sistema di scambio Cl - /HCO 3 - localizzati invece nella membrana basolaterale. 73
75 Il sistema di trasporto attivo dei protoni si estrinseca attraverso un sistema ATP-asico presente a livello del bordo rugoso, che direziona il flusso di ioni H + all'esterno della membrana e acidifica il compartimento di riassorbimento (Baron et al 1985, Blair et al 1989). Infatti, il ph al di sotto degli osteoclasti, misurato con diversi metodi, è approssimativamente pari al valore di 5 (Fallon 1984, Baron et al 1985, Silver et al 1988). L'acidificazione del compartimento di riassorbimento è il meccanismo base per la dissoluzione dei cristalli di idrossiapatite e a tali valori di ph ogni molecola di idrossiapatite è solubilizzata dalla presenza di 6 ioni H + (Fallon 1984). Inoltre, la continua secrezione di H + nel compartimento di riassorbimento è necessaria affinché possa venir annullato l'effetto tampone dato dai prodotti della degradazione della matrice ossea. L enzima anidrasi carbonica partecipa all attività clastica catalizzando la conversione della CO 2 metabolica in acido carbonico e viceversa. L'acido carbonico, al ph intracellulare, si dissocia in ioni bicarbonato e idrogeno, secondo la reazione: Mentre gli ioni carbonato vengono veicolati all'esterno della cellula attraverso il sistema di scambio Cl - /HCO 3 - presente a livello della membrana basolaterale (con un rapporto di 1:1 tra lo ione HCO 3 - uscente e lo ione Cl - entrante), gli ioni idrogeno vengono convogliati nel compartimento di riassorbimento, tramite il sistema di trasporto attivo presente a livello del bordo rugoso. L'anidrasi carbonica è, pertanto, un enzima fondamentale nell'attività di riassorbimento osseo, in quanto permette il continuo rifornimento di ioni idrogeno necessari per l'acidificazione del compartimento di riassorbimento (Vaes 1965, 1968). In recenti studi sull'osteopetrosi, malattia metabolica legata all'inattività degli osteoclasti, è stata dimostrata l'associazione della malattia con una deficienza genetica dell'isoenzima anidrasi carbonica (Anderson et al 1982): 87. Modalità di dissoluzione della componente organica dell osso. Lo schema raffigura l esocitosi degli enzimi lisosomiali per la digestione del collagene. Il secondo passo nella dissoluzione ossea è la degradazione enzimatica delle componenti organiche della matrice o collagenolisi. Anche tale attività si realizza a livello extracellulare, nella lacuna di riassorbimento, per mezzo della secrezione da parte degli osteoclasti di enzimi lisosomiali (Baron et al 1985, Miller 1985). Il bordo rugoso della membrana rappresenta la sede di adesione delle vescicole lisosomiali che, aderendo alla membrana, riversano gli enzimi nel compartimento di riassorbimento (Baron et al 1988, Blair et al 1988). 74
76 La secrezione enzimatica si attua per mezzo del sistema microtubulare cellulare a partire dal reticolo endoplasmatico rugoso e procede attraverso l'organo del Golgi. Il percorso degli enzimi nel sistema tubulare è guidato da specifici sistemi di captazione, i recettori mannosio 6-fosfato, che assicurano un corretto apporto di queste sostanze nel compartimento di riassorbimento (Baron et al 1988). Qui vengono formate vescicole di trasporto convogliate successivamente verso il bordo rugoso della membrana apicale, dove si fondono con la membrana plasmatica e riversano il loro contenuto nella lacuna di riassorbimento. Il percorso degli enzimi lisosomiali è completato dal loro recupero, uptake, consentito sempre dalla presenza dei recettori mannosio 6-fostato (Blair et al 1988). I meccanismi enzimatici che permettono la collagenolisi osteoclastica appartengono alla famiglia delle proteasi acide aventi un ph d'azione intorno al 4 (Bonucci 1974, Baron 1989), ottimale per l'attività collagenasica osteoclastica. Con valori di ph superiori a 5 non è possibile rilevare nessun tipo di attività collagenasica (Bonucci 1974). Tra gli enzimi lisosomiali conosciuti i principali candidati per la degradazione del collagene sono le cisteina proteasi (Delaissè et al 1980, 1984, 1985, 1987). Tali enzimi hanno la capacità di scindere il collagene in piccoli frammenti di peso molecolare inferiore ai Dalton (Blair et al 1986). Il primo evento nel processo di riassorbimento osseo osteoclastico è quindi rappresentato dalla mobilizzazione della componente minerale dell'osso. Una volta che quest ultima è stata rimossa, il collagene viene esposto all'azione delle proteasi acide lisosomiali secrete nei microambienti di riassorbimento (Bonucci 1974, Baron 1989). L'attività litica degli osteoclasti e porta alla produzione di cavità di riassorbimento dall aspetto dentellato, definite lacune di Howship, che appaiono in microscopia a scansione come aree dall aspetto irregolare. In esse si apprezzano le concavità dove si è sviluppato il compartimento di riassorbimento delle cellule, che ha prodotto la lisi dei cristalli di idrossiapatite e la digestione del collagene, le cui fibre appaiono frammentate. 88. Superficie di erosione prodotta da osteoclasti al SEM. Il basso ingrandimento evidenzia le lacune di Howship di un fronte di erosione. La superficie ossea al termine dell attività osteoclastica appare di aspetto dentellato. Superficie endostale di femore (Homo). 89. Superficie di erosione prodotta da osteoclasti al SEM. L alto ingrandimento evidenzia come le fibre collagene appaiono frammentate. Il bordo che delimita ogni singola lacuna di Howship non è eroso, in quanto al di sotto della zona sigillante. Superficie endostale di femore (Homo). 75
77 ORGANIZZAZIONE FUNZIONALE DELLE CELLULE OSSEE Le cellule ossee attuano in modo gerarchico lo svolgimento delle attività che mantengono l omeostasi scheletrica: il modellamento della forma, con le due fasi di erosione e di deposizione su superfici diverse, e di rimodellamento, con le due fasi sulla stessa superficie ma temporalmente disaccoppiate, prima l erosione e poi la deposizione. L attività di queste cellule non viene mai svolta singolarmente, ma sempre in concerto le une con le altre costituendo unità funzionali. Con questo termine si intendono gruppi omogenei o eterogenei di cellule ossee che cooperano, a seconda delle necessità funzionali, ad attività di modellamento o di rimodellamento. 90. Lo schema raffigura gli stimoli, le cellule e le attività dell omeostasi scheletrica. Le unità funzionali del tessuto osseo, per agire, necessitano di un continuo supporto trofico e di un pool di precursori clastici o blastici che ne garantiscono il ricambio cellulare. Esse sono, di conseguenza, sempre circondate da un adeguato supporto di connettivo lasso nel quale sono ospitati capillari ematici, spesso sinusoidali. Più precisamente le cellule ossee lavorano sempre con un territorio vascolare posto alle loro spalle. Le sedi vascolo connettivali dalle quali possono prendere origine nuove unità funzionali sono: lo strato profondo del periostio; l endostio; il connettivo reticolare dei canali vascolari di Havers e di Volkmann. 76
78 L organizzazione spaziale dei gruppi di cellule dipende dalla modalità con cui esplicano la loro attività, cioè a ridosso di una superficie ossea o, invece, penetrando nello spessore della matrice. 91. Modalità di progressione delle attività cellulari. Lo schema raffigura la configurazione dell avanzamento delle cellule ossee durante il riassorbimento; in superficie (a 1 ) e in profondità (a 2 ) da parte degli osteoclasti; durante la deposizione in superficie (b) da parte degli osteoblasti. Per quanto riguarda gli osteoblasti, l unità funzionale può essere identificata con la lamina osteogenica. I singoli elementi si dispongono allineati a formare uno strato di deposizione che accresce di spessore il segmento osseo. Gli osteoblasti sono cellule che mantengono la loro posizione reciproca, ma l intera lamina si sposta, con l accrescersi dello spessore del segmento osseo, muovendosi in direzione del territorio vascolare dal quale traggono sostentamento trofico (Roberts et al 1982, 1987). Per gli osteoclasti una similarità di comportamento con gli osteoblasti può essere riscontrata per quanto riguarda la disposizione allineata dei singoli elementi. In questo caso si vengono a costituire dei fronti di erosione che avanzano entro la matrice, producendo la sua scomparsa. Il territorio vascolare incrementa la sua dimensione seguendo le cellule del fronte di erosione, al fine di garantire un loro sostegno trofico con i vasi e meccanico con il connettivo lasso perivascolare. 77
79 Gli osteoclasti, riassorbendo la superficie ossea, producono cavità dai bordi irregolari e l intera superficie di erosione assume un aspetto dentellato. La modalità di avanzamento può seguire due differenti procedure: le cellule agiscono su un ampio fronte in modo coordinato, provocando la scomparsa di strati interni di osso, come per esempio nell erosione endostale del rimodellamento delle ossa durante la loro espansione diametrale; poche cellule agiscono su una superficie ristretta producendo alla fine dei canali che si addentrano nell osso, come nella creazione di spazi per la futura formazione di osteoni secondari. Durante le fasi di modellamento della forma, su ciascuna superficie ossea si può verificare solo una o l altra delle due possibili attività. Nel rimodellamento della struttura, invece, le attività cellulari si concretizzano entrambe, ma in modo asincrono: dapprima agiscono gli osteoclasti e solo successivamente gli osteoblasti. 92. Cavità di erosione al microscopio ottico (A) e in microradiografia (B). Il preparato evidenzia come il bordo della cavità si presenti dentellato, per l azione erosiva degli osteoclasti che hanno prodotto le lacune di Howship. All interno della cavità residua si sviluppano le anse dei capillari sostenute dal connettivo lasso perivascolare. Corticale di femore non decalcificata e inclusa in PMMA (Homo) Frost (1963a) fornisce una definizione esemplare di queste organizzazioni funzionali asincrone, raggruppando tutti gli elementi cellulari che intervengono nella sequenza operativa del rimodellamento osseo in Unità Multicellulari di Base (BMU). Il concetto proposto da Frost assume un significato quantistico fondamentale, poichè una BMU è in grado di rimodellare una certa quantità di tessuto osseo che può essere identificata come Unità Strutturale Ossea. 78
80 Estremamente interessante appare la configurazione spaziale che assumono le unità funzionali nel rimodellamento osteonale. In questo caso l attività di erosione e di formazione si estrinseca profondamente nella matrice. Il fronte di erosione osteoclastico assume una configurazione spaziale a forma di guscio d uovo, definita cono di taglio. In questa configurazione gli osteoclasti sono disposti allineati sulla superficie di questo guscio mentre più all interno risiedono i vasi sanguigni e lo stroma di sostegno. 93. Lo schema raffigura un cono di taglio e le cellule costituenti una BMU. Il cono di taglio procede nella matrice come una sorta di trivella, accompagnato dalle strutture vascolari che si accrescono progressivamente con il procedere dell attività erosiva. A una certa distanza dal fronte di erosione si allineano, sulle pareti erose della matrice, gli osteoblasti che richiudono progressivamente il tunnel creato dagli osteoclasti. In questo caso le lamine osteogeniche assumono una disposizione tubulare e si muovono verso il centro del tunnel riducendone il lume, ma senza obliterarlo. È interessante osservare che, mentre il fronte osteoclastico si approfonda nella matrice muovendosi secondo l asse longitudinale del tunnel, le lamine osteogeniche si spostano ortogonalmente rispetto all asse del tunnel, restringendolo centripetamente con una progressiva apposizione di nuovo osso sulla superficie interna. La configurazione delle lamine osteogeniche impegnate nel restringimento del tunnel fanno si che il canale vascolare assuma un aspetto conico allungato, che viene definito cono di riempimento. Il risultato morfostrutturale è il canale di Havers, nel quale rimangono ospitati i vasi per il trofismo locale. 79
81 94. Apice di un cono di taglio, sezionato longitudinalmente, al microscopio ottico. Due osteoclasti, uno globoso, e un secondo appiattito, erodono osso periostale a fibre intrecciate. Dietro agli osteoclasti si sviluppa il territorio vascolare, costituito da connettivo lasso, che si amplia col procedere dell attività di erosione. In esso si riconoscono elementi cellulari stromali che accompagnano i capillari. Corticale di metatarso non decalcificata e inclusa in PMMA. Colorazione blu di toluidina (Equus caballus). 95. Cono di riempimento, sezionato trasversalmente, al microscopio ottico. Al centro dell immagine gli osteoblasti, che costituiscono il cono di riempimento, appaiono disposti secondo una disposizione circolare durante la loro attività di restringimento di un cono prima di taglio e poi di riempimento, che conduce alla formazione di un canale di Havers. Anche in questo preparato si evidenzia il sostegno vascolo connettivale al centro del canale. Corticale di metatarso non decalcificata e inclusa in PMMA. Colorazione blu di toluidina (Equus caballus). 80
82 TESSUTI OSSEI Con il termine di tessuto biologico si fa riferimento a un'organizzazione morfostrutturale microscopica costituita da un insieme omogeneno di elementi cellulari e della matrice extracellulare, prodotta dagli stessi. Nei singoli tessuti le cellule hanno la medesima derivazione embriologica, presentano caratteri morfologici simili, risultano specializzate per l'espletamento di una funzione specifica e sono tra loro integrate per lo svolgimento della stessa. Nello specifico, il tessuto osseo si viene a costituire dall'attività di deposizione degli osteoblasti che progressivamente vengono inclusi, come osteociti, nella matrice; quest'ultima è inizialmente secreta come osteoide e successivamente si arricchisce di sali minerali, per acquisire la durezza e la resistenza caratteristica del tessuto maturo. Al termine dell'attività osteogenica l'osso risulta quindi formato esclusivamente dagli osteociti e dalla matrice calcificata nella quale sono rimasti inglobati. La configurazione morfostrutturale definitiva dì questo tessuto è però condizionata dal modello di reclutamento degli osteoblasti, che può avvenire in modo più o meno ordinato, in relazione alle modulazioni metaboliche sistemiche e alle inferenze meccaniche locali, che gli elementi precursori mesenchimalì ricevono durante la loro differenziazione. Si vengono così a costituire diversi tipi di tessuto osseo, ognuno dei quali assume un aspetto morfologico caratteristico, in relazione allo stato funzionale che ne ha determinato l'origine. Sebbene, quindi, le cellule e le componenti molecolari della matrice sono le medesime nelle varie espressioni tissutali, i tessuti ossei presentano proprietà meccaniche differenti in funzione della loro organizzazione strutturale. A oggi, per classificare i tessuti ossei si fa generalmente riferimento a due criteri, uno cronologico e uno morfologico. Il criterio cronologico considera il tessuto osseo in funzione della sua comparsa nell'onto-genesi e considera l'esistenza di due tipi di osso: Il criterio morfologico considera invece il tessuto osseo in funzione del suo aspetto istologico e, nell uomo, considera l esistenza di due tipi di osso:. Negli animali a rapida crescita, come ad esempio gli erbivori, esiste una quarta varietà morfologica rappresentata dall osso plessiforme (Amprino e Godina 1974). 81
83 OSS0 PRIMARIO O DI ADDIZIONE L osso primario fa la sua comparsa nell uomo intorno al terzo mese di vita intrauterina (Jaffe 1929). La sua formazione, in condizioni fisiologiche, avviene in seguito con una produzione cospicua per tutto il periodo di accrescimento longitudinale dell individuo, per poi proseguire nell adattamento dello scheletro nell adulto, modificando le ossa all accrescimento ponderale, e nell anziano, per rispondere all insorgente osteoporosi con un incremento diametrale delle ossa. La definizione di osso primario è più adatta nell organogenesi e nelle patologie, mentre quella di osso di addizione è più adatta a descrivere questa varietà nel soggetto in crescita. Il termine di addizione ribadisce infatti il ruolo che esso svolge nell accrescimento sia longitudinale sia diametrale delle ossa, durante il quale le attività cellulari innescate sono quelle interessate dal processo di modellamento osseo. 96. Osso primario al microscopio ottico a luce ordinaria (A) e a luce polarizzata (B). Il medesimo preparato, analizzato con le due diverse metodiche, evidenzia come gli osteoni primari si continuano direttamente col tessuto non osteonico. Tibia. Preparato secco non decalcificato e non incluso (Canis canis). 82
84 La formazione di osso primario si attua, in condizioni normali, per neodeposizione nell ambito di un qualsiasi tessuto di origine mesenchimale: L osso primario può essere infatti deposto: Nel caso specifico della riparazione di una ferita, sia traumatica sia chirurgica, ha origine anche a partire dal blastema fibrocellulare che sostituisce l ematoma. Durante lo sviluppo e la crescita, l osso di addizione incrementa lo spessore, e quindi la resistenza, dei segmenti scheletrici e ne modella la forma. Nel soggetto adulto, l osso primario è formato durante il ripristino dell integrità dei segmenti scheletrici fratturati o nell adegumento della massa scheletrica, in caso di rapidi aumenti di carico. Nell uomo la varietà strutturale maggiormente rappresentata nella costituzione dell osso primario o di addizione è quella dell osso a fibre intrecciate; in percentuale decrescente, segue l osso lamellare ed infine quello a fibre parallele. 97. Osso primario a fibre intrecciate al SEM. Il preparato evidenzia un sistema ha-versiano costituito esclusivamente da tessuto osseo che, in seguito alla rapida deposizione, risulta disposto in modo disordinato. Anche le lacune osteocitarie risultano disposte irregolarmente nel contesto della matrice mineralizzata. (Da: Marotti G: The structure of bone tissues and the cellular control of their deposition. It J Anat Embryol 1996). 98. Osso primario a fibre parallele al SEM. Il preparato evidenzia un sistema haversiano costituito esclusivamente da tessuto osseo che, in seguito alla lenta deposizione, risulta disposto in modo estremamente ordinato. Si rileva la presenza di una lacuna osteocitaria disposta in senzo longitudinale. (Da: Marotti G: The structure of bone tissues and the cellular control of their deposition. It J Anat Embryol 1996). 83
85 OSS0 SECONDARIO O DI SOSTITUZIONE L osso secondario compare nell uomo intorno al settimo mese di vita intrauterina e la sua formazione continua per tutto l arco della vita, inizialmente per deposizione su osso primario e, successivamente, su altro osso secondario. L osso secondario viene definito anche osso di sostituzione, perchè sostituisce con tessuto nuovo osso precedentemente deposto. La funzione è quella di rinnovare la microstruttura del tessuto, senza peraltro modificare la forma o le dimensioni del segmento scheletrico in cui viene a costituirsi (Marotti 1989). La deposizione si realizza esclusivamente su un tessuto osseo normale preesistente, a seguito dell attività erosiva degli osteoclasti e viene deposto durante l attività di rimaneggiamento. La varietà morfologica maggiormente rappresentata è quella lamellare (Marotti 1996), estremamente minima è la presenza di osso a fibre parallele e praticamente inestente è quello a fibre intrecciate. 99. Osso secondario al microscopio ottico a luce ordinaria (A) e a luce polarizzata (B). Il medesimo preparato, analizzato con le due diverse metodiche, evidenzia come le linee cementani separano dall tessuto circostante gli osteoni secondari. Tibia. Preparato secco non decalcificato e non incluso (Homo). 84
86 L elemento caratteristico che contraddistingue l osso di sostituzione da quello di addizione è rappresentato dalla presenza nel primo delle linee cementanti. La deposizione di osso secondario si realizza esclusivamente nell attività di rimodellamento dove si verifica un inversione delle attività cellulari. Sulla stessa superficie ossea, infatti, si attua una successione cellulare temporale: prima si attua l erosione osteoclastica e, solo successivamente, segue la deposizione osteoblastica. Le linee cementanti rappresentano la linea corrispondente al punto di terminazione dell erosione osteoclastica e, di conseguenza, dell inizio della deposizione osteoblastica. Da un punto di vista morfologico esse rappresentano una sorta di cicatrice del tessuto e sono caratterizzate da un elevato grado di mineralizzazione. Le linee cementanti differiscono, dal punto di vista qualitativo, dal resto del tessuto osseo probabilmente per il fatto che, all inizio dell attività osteoformativa, la prima deposizione di tessuto osteoide avviene in modo alquanto imperfetto Osteoni secondari al SEM. A) Osteone secondario a disposizione lamellare delimitato dalla linea cementante. (Da: Marotti G: The structure of bone tissues and the cellular control of their deposition. It J Anat Embryol 1996). B) Un altra immagine evidenzia i numerosi processi citoplasmatici degli osteociti di osteoni adiacenti, vecchi e nuovi che attraversano le linee cementanti permettendo la continuità metabolica e funzionale della rete lacuno-canalicolare. 85
87 OSS0 A FIBRE INTRECCIATE L osso a fibre intrecciate è caratterizzato da una matrice mineralizzata strutturata in modo disordinato attorno alle formazioni vascolari. Rispetto ad altre varietà morfologiche, l osso a fibre intrecciate risulta costituito da una trama di fibre collagene disposte in modo irregolare. La disorganizzazione del tessuto appare ancora più evidente se viene osservato in microscopia a luce polarizzata che mette in risalto l orientamento delle fibre collagene e dei cristalliti: questo sistema di osservazione permette di apprezzare la presenza di aree rifrangenti chiare ed estinte scure, mescolate irregolarmente. Il tessuto osseo a fibre intrecciate è il principale tipo di osso primario, anche se occasionalmente possono essere osservati osteoni secondari costituiti da osso a fibre intrecciate, per la Loro intera struttura (Marotti 1996). Per quanto riguarda la cellularità, gli osteociti sono solitamente di dimensioni più grandi, di forma globosa e in numero maggiore rispetto ad altre varietà morfologiche; nel contempo sono distribuiti in modo disordinato nella compagine della matrice (Marotti 1989). In alcune aree sono accostati gli uni agli altri e le loro lacune talvolta appaiono confluire, mentre in altre aree risultano rari o addirittura inesistenti Osso a fibre intrecciate al microscopio ottico a luce ordinaria (A) e a luce polarizzata (B). L osso che circonda l areola midollare appare nel medesimo preparato, di aspetto alquanto uniforme in luce ordinaria, mentre, in luce polarizzata, risulta costituito da zone chiare dense di collagene, che appaiono nettamente rifrangenti, e zone scure lasse in collagene, che appaiono estinte. Osso mandibolare neoformato incluso in PMMA (Homo). 86
88 Al microscopio a luce ordinaria o a luce polarizzata si evidenzia come le lacune osteocitarie sono presenti sempre all interno delle aree di tessuto mineralizzato che appaiono estinte, dove la trama di collagene è organizzata in modo lasso (Marotti et al 1985). La microscopia elettronica a scansione permette di evidenziare che, nell osso a fibre intrecciate, i processi citoplasmatici degli osteociti non possiedono una disposizione polarizzata, al pari degli osteociti presenti in altri tessuti ossei, come per esempio nell osso lamellare. Anche l arborizzazione dendritica è irregolare, ma l estensione della rete lacunocanalicolare è maggiore rispetto alle altre varietà ossee Osteoni secondari al SEM costituito per intero da osso a fibre intrecciate. Ben evidente appare la disposizione estremamente irregolare della trama di collagene. In prossimità della linea cementante (a sinistra) si vede una lacuna osteocitaria ampia e di formma rotondeggiante. (Da: Marotti G: The structure of bone tissues and the cellular control of their deposition. It J Anat Embryol 1996) Osteociti di osso a fibre intrecciate al microscopio ottico a luce ordinaria (A) e a luce polarizzata (B). La microfotografia, in luce ordinaria, mostra una zona particolarmente ricca di lacune osteocitarie, delle quali ben si apprezza la forma rotondeggiante e la fitta rete lacuno-canalicolare. Quest ultima, peraltro, risulta del tutto priva di un preciso orientamento nella sua arborizzazione. L immagine comparativa, in luce polarizzata, mette in evidenza come tale zona appaia completamente estinta, indice che la trama di collagene risulta organizzata in modo lasso. Omero. Preparato secco non decalcificato e non incluso (Canis canis). 87
89 L irregolarità distributiva della matrice e delle cellule ossee dipende dal fatto la formazione di nuovo osso si è realizzata in tempi estremamente rapidi. Gli osteoblasti vengono reclutati massivamente e non hanno il tempo per disporsi in modo ordinato, cosicchè la loro inclusione nella matrice mineralizzata produce aree in cui le lacune sono molto ravvicinate o addirittura confluenti (Marotti 1990). Le necessità funzionali che determinano questo tipo di reclutamento cellulare sono, di norma, sollecitazioni di intensità elevata (Carter et al 1981a, 1981b; Frost 1983). L incremento scheletrico prodotto dalla formazione di nuovo tessuto mineralizzato, necessario per irrobustire l intero segmento, o parte di esso, in modo tale da annullare lo stato di tensione generato da quella determinata sollecitazione di intensità elevata, viene realizzato in tempi così ridotti da non permettere l organizzazione di una deposizione regolare secondo le direzioni delle sollecitazioni (Carter et al 1981a, 1981b). A differenza di altre varietà tissutali, l osso a fibre intrecciate è carente di organizzazione strutturale, e quindi dal punto di vista meccanico risulta di qualità inferiore rispetto ad altri tessuti ossei (White et al 1977, Christel et al 1981). Tuttavia, può essere deposto in grande quantità e la sua mineralizzazione procede con tempi estremamente rapidi e raggiunge livelli elevati (Christel et al 1981). Proprio le caratteristiche di sufficiente resistenza e di pronta disponibilità, che costituiscono un compromesso meccanico eccellente, rendono questo tessuto molto versatile: per questo motivo il tessuto osseo a fibre intrecciate è la varietà morfologica maggiormente rappresentata nell osso primario e solo in condizioni di una minore richiesta meccanica viene sostituito con osso lamellare secondario Osteociti di osso a fibre intrecciate al microscopio ottico. Il reclutamento degli osteoblasti, massivo e disordinato, caratteristico dell osso a fibre intrecciate, conduce alla costituzione di aree ossee in cui gli osteociti possono risultare estremamente ravvicinati, con lacune talvolta confluenti, affiancate da aree in cui gli elementi cellulari sono scarsi o addirittura assenti. Osso mascellare neoformato, incluso in PMMA. Colorazione blu di toluidina (Homo). 88
90 105. Osteociti di osso a fibre intrecciate al SEM. La microscopia a scansione permette di apprezzare la forma chiaramente globosa delle cellule, la disposizione irregolare delle stesse e l enorme rete canalicolare priva di un preciso orientamento nell arborizzazione. Femore (Homo) Osteociti di osso neoformato, a ridosso in una protesi in TiAlV. L osteocita globoso, tipico dell osso a fibre intrecciate, si pone in comunicazione con l osteocita mandorliforme, tipico dell osso lamellare. L arborizzazione dei processi citoplasmatici è rispettivamente disordinata per il primo e ordinata nel secondo. Femore (Homo). 89
91 OSS0 A FIBRE PARALLELE L osso a fibre parallele è una varietà poco rappresentata nell uomo; deve la sua denominazione al particolare assetto delle fibre collagene che sono disposte con il medesimo orientamento. La deposizione di questa varietà tissutale è limitata alle zone soggette a trazione, come ad esempio le inserzioni tendinee (Portigliatti Barbos et al 1983, 1984; Boyde et al 1984; Ascenzi et al 1987a, 1987b; Portigliatti Barbos et al 1987; Boyde e Riggs 1990), dove il particolare arrangiamento del collagene dell osso a fibre parallele conferisce le migliori caratteristiche di resistenza (Ascenzi e Bonucci 1964, 1967) Osso a fibre parallele, in sezione longitudinale, al microscopio ottico a luce ordinaria (A) e a luce polarizzata (B). La microfotografia, in luce ordinaria, evidenzia una zona di osso soggetta prevalentemente a forze di trazione, in cui l osso è stato deposto secondo l organizzazione a fibre parallele. Le lacune osteocitarie, di forma ellissoidale, risultano tutte orientate secondo l asse longitudinale del segmento osseo, ma disposte su piani diversi. In luce polarizzata l intero segmento osseo, costituito da fibre collagene addensate e disposte secondo un asse prevalente, appare come un nastro uniformemente rifrangente. Piccolo trocantere femorale. Preparato secco non decalcificato e non incluso (Homo). 90
92 Il tessuto osseo risulta organizzato in fasci di fibre collagene orientate nella stessa direzione, ed in luce polarizzata appare costituito da porzioni nastriformi allargate o da formazioni osteoniche, sia primarie che secondarie, che appaiono sempre uniformemente rifrangenti all esame in microscopia ottica, a luce polarizzata. Gli osteociti nell osso a fibre parallele hanno una forma simile a quella dell osso lamellare. Presentano l asse maggiore orientato secondo l osteone o la porzione nastriforme soggetta alle forze di trazione (Marotti 1979, Marotti et al 1990) e gli altri due assi uguali: queste condizioni ne determinano l analogia con un elissoide di rotazione. Nel tessuto osseo le lacune osteocitarie appaiono distribuite regolarmente, tra loro distanziate, ma non allineat sugli stessi piani come nell osso lamellare Osteone secondario a fibre parallele, sezionato trasversalmente, al SEM. Il reclutamento degli osteoblasti, massivo e disordinato, caratteristico dell osso a fibre intrecciate, conduce alla costituzio-ne di aree ossee in cui gli osteociti possono risultare estremamente ravvicinati, con lacune talvolta confluenti, affiancate da aree in cui gli elementi cellulari sono scarsi o addirittura assenti. Osso ma-scellare neoformato, incluso in PMMA. Colorazione blu di toluidina (Homo). 91
93 OSS0 LAMELLARE L osso lamellare è il tessuto maggiormente presente nello scheletro dell individuo adulto. La matrice è organizzata in strati laminari regolari definiti lamelle ossee. Il tessuto, analizzato al microscopio ottico a luce polarizzata, dimostra la regolare alternanza di formazioni laminari, che appaiono rifrangenti, chiare, alternate ad altre estinte, scure. Nella formazione dell osso lamellare gli osteoblasti sono reclutati in modo ordinato a costituire fronti di deposizione ben organizzati, le lamine osteogeniche (Marotti 1990). In modo altrettanto ordinato alcuni osteoblasti vengono incorporati negli strati laminari della matrice, trasformandosi in osteociti. Poiché il reclutamento osteoblastico si realizza a partire da elementi staminali stromali che accompagnano il connettivo di sostegno vascolare (Roberts et al 1982, 1987), le lamine osteogeniche traggono origine sulle superfici ossee rivolte verso il periostio, l endostio e dei vasi presenti nelle cavità vascolari dei sistemi haversiani Osso lamellare al microscopio ottico a luce ordinaria (A) e a luce polarizzata (B). La microfotografia osservata in luce ordinaria permette di evidenziare l ordinata disposizione dell osso lamellare e la regolare distribuzione delle lacune osteocitarie sui singoli piani lamellari. In luce polarizzata si apprezza il regolare alternarsi di lamelle dense, chiare, e lasse, scure: queste ultime sono i piani, dove più facilmente si sviluppano le lacune osteocitarie. Femore incluso in PMMA (Homo). 92
94 Lo schema di deposizione seguito è identico in tutti i segmenti ossei; tuttavia, l aspetto delle formazioni lamellari appare morfologicamente diverso nelle varie sedi. Alla periferia di un segmento scheletrico, sulla superficie periostale, vengono costruiti strati laminari di ampio diametro, denominati sistemi circorferenziali esterni o periostali. All interno, sistemi circorferenziali interni o endostali possono essere costruiti sulle superfici endostali; in particolare, nel contesto delle trabecole mentre della spongiosa, gli strati laminari assumono un aspetto ondulato. Quando invece l attività osteoformativa si attua sulle superifici di cavità longitudinali scavate dagli osteoclasti, aventi l asse maggiore parallelo a quello longitudinale dell osso, si costituiscono gli osteoni, strutture tubulari costituite da strati di lamelle concentriche di diametro esiguo. Indipendentemente dalle diverse disposizioni lamellari, denominatore comune dell attività depositiva è rapresentato dal notevole ordine organizzativo nel reclutamento cellulare. Questo porta alla formazione di insiemi lamellari ordinati per resistere alle sollecitazioni meccaniche, che agiscono su un determinato segmento scheletrico Campione prismatico di osso lamellare al SEM. Anche in microscopia a scansione è possibile apprezzare il regolare impaccamento delle lamelle. (Da: Marotti G. The structure of bone tissues and the cellular control of their deposition. It J Anat Embryol 1996) Osteociti di osso lamellare endostale al microscopio ottico. Osso lamellare deposto sopra superfici endostali. Il reclutamento ordinato degli osteoblasti conduce alla formazione di strati laminari alternati con l assetto delle lamelle leggermente ondulato. Femore incluso in PMMA. Colorazione blu di toluidina (Homo). 93
95 Fino a qualche anno fa la struttura degli insiemi lamellari veniva interpretata utilizzando il modello morfologico di Gebhardt (1906), nel quale si considera l alternanza di strati lamellari come l espressione di un orientamento diverso delle fibre collagene in essi contenute. In particolare, l ipotesi di Gebhardt sosteneva che i fasci di collagene, all interno delle lamelle ossee, avessero le fibre orientate tra loro parallelamente e che, in una lamella, l asse longitudinale delle fibre fosse orientato in modo diverso da quello delle due lamelle contigue. Più esattamente, se in una lamelle le fibre collagene presentavano un orientamento di 45 in senso orario, nella lamella precedente e successiva le fibre dovevano essere disposte ortogonali, cioè con un angolo di 45 in senso antiorario, quindi con con una differenza angolare di circa Osteociti di osso lamellare al microscopio ottico a luce ordinaria (A) e a luce polarizzata (B). Le lacune osteocitarie dell osso lamellare risultano ordinatamente distribuite negli strati laminari. Anche il diramarsi della rete canalicolare risulta orientato. I microtubuli che si dipartono dalle lacune sono disposti prevalentemente verso il canale vascolare centrale. In particolare, le immagini bene evidenziano come i processi citoplasmatici rivolti verso quest ultimo sono più lunghi rispetto a quelli orientati verso gli altri osteociti. Femore. Preparato secco non decalcificato e non incluso (Homo). 94
96 Secondo questo modello, le lamelle che appaiono rifrangenti alla luce polarizzata sono quindi quelle in cui le fibre collagene risultano disposte con un orientamento trasversale rispetto al fascio di luce incidente; mentre in quelle estinte il collagene è invece distribuito in modo longitudinale. Questa disposizione, che esiste in natura nel derma del girino e nella cornea, cioè in due connettivi non calcificati, e che artificialmente viene riprodotta, in modo simile, nel legno compensato multistrato, secondo Gebhardt rappresenta una disposizione strutturale in grado di garantire una maggior resistenza al segmento scheletrico. La teoria di Gebhatdt (1906) ha tuttavia un grosso limite consistente nella modalità con cui dovrebbe essere costituito l osso lamellare: non è ancora noto se il collagene viene deposto con un orientamento già definito o se sia l osteoblasta a orientare le fibre successivamente, secondo una certa direzione. In quest ultimo caso non si conoscono le modalità cicliche di intervento sulle molecole di collagene e, soprattutto, quali possono essere i messaggeri e i messaggi che le stimolano la cellula a orientarsi in modo ciclicamente diverso. Se invece il collagene viene deposto con un orientamento definito, significa che gli osteoblasti hanno una loro polarizzazione spaziale all interno di una intera lamina osteodepositiva, per produrre lamelle con il collagene orientato secondo direzioni alterne; questa condizione determina che, in seguito a qualche messaggio ritmico, gli osteoblasti devono modificare la loro disposizione spaziale ruotando tutti di 90, prima di proseguire la deposizione (Ascenzi e Benvenuti 1986) Lo schema raffigura la disposizione del collagene in lamelle adiacenti secondo il modello di Gebhardt. L aspetto delle lamelle ossee è dovuto al diverso arrangiamento delle fibre collagene dll interno delle singole lamelle. L orientamento prevalente delle fibre collagene, che costituiscono le singole lamelle, cambia tra una lamella e la successiva di circa 90 e determina il caratteristico alternarsi di aree chiare e scure in luce polarizzata. incluso (Homo). 95
97 Il movimento rotatorio degli osteoblasti appare difficile da comprendere e da giustificare. Inoltre, bisogna anche considerare la modalità con cui viene completata la formazione di una fibra collagene, cioè l aggregato delle molecole di tropocollagene in fasci. Questo aggregato, infatti, si costituisce grazie all azione della peptidasi progollagene (Lapière et al 1971), un enzima proteolitico extracellulare capace di eliminare le ingombranti regioni telopeptidiche del procollagene, liberando le triple eliche (Ehrlich e Borstein 1972) che, unendosi attraverso legami trasversali (Eyre et al. 1983), possono così dar costituzione alle fibre collagene. Tale evidenza esclude la possibilità che siano gli osteoblasti a determinare l orientamento del collagene nelle lamelle, per cui una possibile influenza diretta sulle fibre è un ipotesi non accettabile. Una recente teoria sulla struttura morfologica delle lamelle, accolta ancora con qualche scetticismo perchè sconvolge il vecchio modello, ormai accreditato, di Gebhardt, è quella proposta da Marotti e Muglia (1988). Gli autori, attraverso studi comparativi tra sezioni di osso lamellare, osservate in microscopia ottica a luce polarizzata, e campioni prismatico-rettangolari, osservati al microscopio a scansione, hanno evidenziato che se il modello di Gebhardt (1906) fosse stato corretto, le lamelle avrebbero dovuto mostrare, su due facce adiacenti, un orientamento delle fibre collarene invertito. Di contro, nelle osservazioni di campioni prismatico rettangolari al microscopio a scansione, le lamelle mostravano la stessa morfologia sia sul piano orizzontale che verticale. I risultati dei lavori condotti dall équipe dell Università di Modena dimostrano, inequivocabilmente, che la differenza tra le lamelle dipende esclusivamente dall addensamento delle fibre collagene in ciascuna lamella, mentre l orientamento delle fibre collagene sarebbe simile in tutte le lamelle (Marotti e Muglia 1988, 1992; Marotti 1993; Marotti et al 1994, 1994b, 1995a, 1995b) Immagine al SEM di un campione prismatico di osso lamellare osteonico, nel quale è possibile apprezzare sia la faccia di sezione trasversale sia quella longitudinale. Le lamelle che si costituiscono per successive ondate dell attività di deposizione osteoblastica, appaiono nettamente distinte- Il preparato evidenzia, comunque, come la stessa lamella appare priva di un diverso orientamento strutturale nelle sue sezioni ortogonali. L aspetto alternato delle lamelle è da ricondursi a fasi diverse nella deposizione: Le lamelle dove l attività depositiva ha subito un rallentamento, per l incorporazione di osteociti, corrispondono agli strati più lassi della matrice.(da: Marotti G. The structure of bone tissues and the cellular control of their deposition. It J Anat Embryol 1996). 96
98 L aspetto lamellare dell osso è pertanto dovuto alla regolare alternanza di lamelle dense, in cui le fibre collagene sono più addensate, e lamelle lasse, in cui la trama collagene risulta moto più diradata. Le lamelle rifrangenti che appaiono chiare in luce polarizzata corrispondono pertanto alle lamelle dense della microscopia a scansione, mentre quelle estinte alle lamelle lasse. Anche dimensionalmente esiste una differenza tra le lamelle: al microscopio elettronico, sia a scansione sia a trasmissione, le lamelle lasse risultano più larghe delle lamelle dense Comparazione del modello di Gebhardt (1906) e di Marotti e Muglia (1988). Il medesimo campione di osso analizzato, considerando rispettivamente una sola superficie o due superfici ortogonali, permette la formulazione di ipotesi diverse Immagine al SEM di una sezione trasversale di os-so lamellare. Si noti come sia nella lamella lassa che in quella den-sa il collagene si presenta orientato secondo i tre assi dello spazio (Da: Marotti G., Muglia M.A., Palumbo C. Collagen texture and osteocyte distribution in lamellar bone. In: New trends in microanatomy, A commemorative volume in honour of Marcello Malpighi. Firenze: Editor PM Motta, Il Sedicesimo 1995) Immagine al TEM della disposizione del collagene in un osteone. Si noti come sia nella lamelle dense, contraddistinte dai cerchi bianchi, sia in quelle lasse, il collagene assume un aspetto intrecciato (Da: Marotti G., Muglia M.A., Palumbo C. Collagen texture and osteocyte distribution in lamellar bone. In: New trends in microanatomy, A commemorative volume in honour of Marcello Malpighi. Firenze: Editor PM Motta, Il Sedicesimo 1995). 97
99 Questa interpretazione tipo di struttura lamellare è molto più coerente con le attività osteodepositive degli osteoblasti, anche se rimane da comprendere il motivo di una deposizione a strati. Marotti et al (1985) hanno osservato che nell osso lamellare circa il 70% delle lacune osteocitarie sono comprese nello spessore delle lamelle lasse e presentano una polarizzazione dell arborizzazione dendritica, con processi citoplasmatici rivolti verso il territorio vascolare notevolmente più lunghi rispetto a quelli rivolti in direzione opposta. Poichè una delle funzioni degli osteociti è quella di reclutare osteoblasti dalla lamina osteogenica in modo che circa il 10% di essi si trasformi anch esso in osteociti, è stato ipotizzato che Il reclutamento di nuovi elementi avviene nel momento in cui gli osteociti non sono più in grado di estendere i loro processi citoplasmatici che garantiscono il contatto con la lamina osteogenica. Marotti et al (1990), sulla base di queste osservazioni morfostrutturali, hanno ipotizzato che, nella fase di reclutamento di nuovi elementi, la lamina osteogenica depone fibre collagene in modo meno compatto per riprendere un attivita depositiva densa non appena i preosteciti si sono addentrati nella matrice. Le osservazioni lasciano comprendere come la deposizione della matrice avvenga in modo alternato e non in modo continuo: strati poveri di fibre collagene, avvolgenti gli osteociti in lamelle lasse o cellulari, si alternano a strati ricchi di fibre collagene ma privi di osteociti in lamelle densa o acellulari. Queste ultime sono le strutture che, dal punto di vista meccanico, svolgono i compiti fondamentali di resistenza del tessuto lamellare (Marotti 1996) Immagine al SEM di osteociti di osso lamellare in sezione trasversale (A) e longitudinale (B). Si noti come le lacune siano sempre presenti nelle lamelle lasse, dove l attività di deposizione della lamina osteogenica ha subito un rallentamento nella deposizione. (Da: Marotti G, Muglia MA, Palumbo C Collagen texture and osteocyte distribution in lamellar bone. In: New trends in microanatomy, A commemorative volume in honour of Marcello Malpighi. Firenze: Editor PM Motta, Il Sedicesimo 1995). 98
100 ARCHITETTURE DELL OSSO Il tessuto osseo si organizza, nei segmenti scheletrici, in architetture macroscopiche, più o meno compatte, capaci di far fronte ad esigenze di ordine meccanico, che possono essere suddivise in due categorie: l architettura compatta e l architettura spongiosa. Queste diverse configurazioni strutturali sono altamente dinamiche e sono in grado di mutare reciprocamente l una nell altra, sia in condizioni fisiologiche sia patologiche. La prima architettura a formarsi durante l organogenesi delle ossa è quella spongiosa (Marotti 1988): Durante la formazione dei segmenti scheletrici, trabecole ossee vengono formate attorno alle strutture vascolari nell ossificazione intramembranosa, o deposte su frammenti di cartilagine calcificata, risparmiati dall erosione condroclastica, nell ossificazione encondrale. Solo in un secondo tempo si ha formazione dell architettura compatta per progressiva osteodeposizione e conseguente riduzione degli spazi vascolari (Marotti 1988). Nell uomo adulto, le ossa dello scheletro sono complessivamente costituite per l 80% da architettura compatta e per il 20% da architettura spongiosa, se considerate ponderalmente in base al peso dell osso secco. Questa percentuale varia notevolmente, incrementandosi per quanto riguarda la spongiosa, se considerata in base al volume. Da un punto di vista microscopico entrambe risultano costituite dagli stessi tessuti e l unica differenza tra le due risiede nella loro maggiore o minore densità o, più precisamente, nel diverso rapporto tra superficie e volume (S/V) espresso in cm 2 /cm 3 o meglio in cm -1 (Marshall et al 1973). Questi autori hanno prospettato di definire architettura compatta quelle porzioni di tessuto osseo che possiedono un rapporto S/V inferiore a 60 cm -1. Una porzione ossea che presenta un quoziente S/V superiore a tale valore viene definita come costituita da osso ad architettura spongiosa. Sebbene il confine numerico, propost da Marshall per definire l una e l altra architettura sia arbitrario, offre il duplice vantaggio di poter sfuggire dal luogo comune, secondo il quale l osso compatto è esclusivamente quello corticale e l osso spongioso è quello che tra le sue maglie accoglie il tessuto midollare, e nel contempo consente un criterio discriminativo tra le miriadi di possibilità intermedie Architetture ossee La porzione più esterna di un segmento è solitamente costitui-ta da architettura compatta, mentre più internamente si sviluppa l architettura spongiosa. Osso costale (Bos taurus). 99
101 120. Estremità prossimale del femore di una giovane donna adulta La radiografia consente di apprezzare, a livello della testa e del collo del femore, come l architettura ossea prevalente sia quella spongiosa, mentre più distalmente si conforma l architettura compatta della corticale diafisaria. L immagine, inoltre, ben evidenzia l as-setto traiettoriale seguito dalle trabecole nell epifisi. (Homo). La presenza dell una o dell altra architettura è comunque anche da mettere in stretta relazione con la necessitò di mantenimento dell omeostasi sia scheletrica sia minerale delle ossa. Il comportamento biologico di un determinato segmento scheletrico, cioè la capacità di adattarsi al mutare delle necessità meccaniche e metaboliche, non dipende dalla forma (piatta, breve o lunga), tantomeno dalla posizione nell assetto scheletrico, ma esclusivamente dalle architetture che lo costituiscono; inoltre le nuove attività cellulari che modellano o rimaneggiano il segmento possono essere innescate su una superficie ossea, a partire da elementi precursori reclutati dallo stroma connettivale o dal tessuto emopoietico. Queste condizioni fanno si che l architettura spongiosa, possedendo una maggiore estensione della sua superficie, abbia capacità di adattamento superiori, in quanto offre una maggiore possibilità di reclutamento cellulare sia di migliori condizioni di vascolarizzazione. A riprova di ciò le epifisi delle ossa lunghe hanno un comportamento biologico equivalente per modalità di sviluppo, metabolismo e vascolarizzazione a quello delle ossa brevi; in entrambi, infatti, prevale l architettura spongiosa, struttura tissutale più dinamica. Studi istomorfometrici condotti mediante marcature con fluorocromi (alizarina e tetraciclina) hanno consentito di stimare con precisione l entità dei processi osteogenetici nelle due architetture, dimostrando che l osso spongioso manifesta una capacità di rinnovamento strutturale da 2 a 4 volte maggiore di quella dell osso compatto (Marotti 1963, 1976b). 100
OSTEOGENESI. OSSIFICAZIONE DIRETTA (intramembranosa) Formazione di tessuto osseo su una preesistente, pericondrio, osso)
 OSSIFICAZIONE DIRETTA (intramembranosa) Formazione di tessuto osseo su una preesistente matrice connettivale (mesenchima,(, pericondrio, osso) (dove? ossa del cranio, mandibola, clavicola) OSSIFICAZIONE
OSSIFICAZIONE DIRETTA (intramembranosa) Formazione di tessuto osseo su una preesistente matrice connettivale (mesenchima,(, pericondrio, osso) (dove? ossa del cranio, mandibola, clavicola) OSSIFICAZIONE
OSTEOGENESI. intramembranosa) Formazione di tessuto osseo su una preesistente, pericondrio, osso) Formazione di tessuto osseo su una preesistente
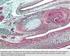 OSTEOGENESI OSSIFICAZIONE DIRETTA (intramembranosa( intramembranosa) Formazione di tessuto osseo su una preesistente matrice connettivale (mesenchima,(, pericondrio, osso) ( ossa del cranio, mandibola,
OSTEOGENESI OSSIFICAZIONE DIRETTA (intramembranosa( intramembranosa) Formazione di tessuto osseo su una preesistente matrice connettivale (mesenchima,(, pericondrio, osso) ( ossa del cranio, mandibola,
Università degli Studi di Teramo
 Università degli Studi di Teramo CORSO di LAUREA in BIOTECNOLOGIE Corso Integrato di CITOLOGIA e ISTOLOGIA Modulo LABORATORIO TECNICHE CITOLOGICHE ED ISTOLOGICHE Dr.ssa A. MAURO Tessuti connettivi specializzati
Università degli Studi di Teramo CORSO di LAUREA in BIOTECNOLOGIE Corso Integrato di CITOLOGIA e ISTOLOGIA Modulo LABORATORIO TECNICHE CITOLOGICHE ED ISTOLOGICHE Dr.ssa A. MAURO Tessuti connettivi specializzati
Tessuto osseo. L osso è al contempo resistente e leggero
 Tessuto osseo Forma specializzata di connettivo caratterizzata dalla mineralizzazione della matrice extracellulare che conferisce al tessuto una notevole resistenza e durezza L osso è al contempo resistente
Tessuto osseo Forma specializzata di connettivo caratterizzata dalla mineralizzazione della matrice extracellulare che conferisce al tessuto una notevole resistenza e durezza L osso è al contempo resistente
TESSUTO OSSEO. CARATTERISTICHE: Denso Compatto Solido Leggero Elastico Basso peso specifico
 CARATTERISTICHE: Denso Compatto Solido Leggero Elastico Basso peso specifico TESSUTO OSSEO Resistente alle azioni meccaniche (trazione, compressione, torsione e flessione) OSSO (tessuto connettivo) matrice
CARATTERISTICHE: Denso Compatto Solido Leggero Elastico Basso peso specifico TESSUTO OSSEO Resistente alle azioni meccaniche (trazione, compressione, torsione e flessione) OSSO (tessuto connettivo) matrice
TESSUTO OSSEO ELEMENTI CELLULARI: CELLULE OSTEOPROGENITRICI OSTEOBLASTI OSTEOCITI OSTEOCLASTI COMPONENTE FIBROSA: COLLAGENE
 TESSUTO OSSEO ELEMENTI CELLULARI: CELLULE OSTEOPROGENITRICI OSTEOBLASTI OSTEOCITI OSTEOCLASTI COMPONENTE FIBROSA: COLLAGENE COMPONENTE AMORFA: GAG, PROTEOGLICANI GLICOPROTEINE LEGANTI IL CALCIO SALI DI
TESSUTO OSSEO ELEMENTI CELLULARI: CELLULE OSTEOPROGENITRICI OSTEOBLASTI OSTEOCITI OSTEOCLASTI COMPONENTE FIBROSA: COLLAGENE COMPONENTE AMORFA: GAG, PROTEOGLICANI GLICOPROTEINE LEGANTI IL CALCIO SALI DI
Il tessuto cartilagineo
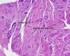 Il tessuto cartilagineo CARTILAGINE Tessuto connettivo di sostegno costituito da cellule: Condroblasti, Condrociti, Condroclasti (che derivano dai monociti del sangue) La ECM è compatta e contiene: fibre,
Il tessuto cartilagineo CARTILAGINE Tessuto connettivo di sostegno costituito da cellule: Condroblasti, Condrociti, Condroclasti (che derivano dai monociti del sangue) La ECM è compatta e contiene: fibre,
Tessuto Osseo. Tessuto osseo. Tessuto osseo Tessuto osseo. Tessuto di sostegno (ma dinamico!!!!)
 Tessuto Osseo Tessuto osseo Tessuto connettivo specializzato (Cellule + Fibre + Matrice organica e minerale) Le cellule sono immerse in una matrice mineralizzata Tessuto di sostegno (ma dinamico!!!!) Organizzato
Tessuto Osseo Tessuto osseo Tessuto connettivo specializzato (Cellule + Fibre + Matrice organica e minerale) Le cellule sono immerse in una matrice mineralizzata Tessuto di sostegno (ma dinamico!!!!) Organizzato
Ossa piatte. Ossa piatte del cranio si sviluppano con modalità diverse dalle lunghe
 Ossa piatte Ossa piatte del cranio si sviluppano con modalità diverse dalle lunghe Tavolato interno e Tavolato esterno di osso compatto, racchiudono uno strato di osso spugnoso centrale, Diploe Pericranio
Ossa piatte Ossa piatte del cranio si sviluppano con modalità diverse dalle lunghe Tavolato interno e Tavolato esterno di osso compatto, racchiudono uno strato di osso spugnoso centrale, Diploe Pericranio
Tessuto osseo. Tessuto osseo. Tessuto osseo. Tessuto di sostegno (ma dinamico!!!!) Ca ++
 Tessuto osseo Tessuto osseo Tessuto connettivo specializzato (Cellule + Fibre + Matrice organica e minerale) Protegge i visceri Le cellule sono immerse in una matrice mineralizzata Tessuto di sostegno
Tessuto osseo Tessuto osseo Tessuto connettivo specializzato (Cellule + Fibre + Matrice organica e minerale) Protegge i visceri Le cellule sono immerse in una matrice mineralizzata Tessuto di sostegno
Tessuto connettivo specializzato (Cellule + Fibre + Matrice organica e minerale) Le cellule sono immerse in una matrice mineralizzata
 Tessuto osseo Tessuto connettivo specializzato (Cellule + Fibre + Matrice organica e minerale) Le cellule sono immerse in una matrice mineralizzata Tessuto di sostegno (ma dinamico!!!!) Organizzato in
Tessuto osseo Tessuto connettivo specializzato (Cellule + Fibre + Matrice organica e minerale) Le cellule sono immerse in una matrice mineralizzata Tessuto di sostegno (ma dinamico!!!!) Organizzato in
Tessuto osseo. Costituzione del tessuto osseo
 Tessuto osseo Tessuto connettivo a prevalente funzione meccanica, di sostegno e di protezione, ma anche metabolica ( riserva di calcio) Caratteristiche generali: Durezza, resistenza meccanica a trazione
Tessuto osseo Tessuto connettivo a prevalente funzione meccanica, di sostegno e di protezione, ma anche metabolica ( riserva di calcio) Caratteristiche generali: Durezza, resistenza meccanica a trazione
Tessuto osseo. Caratteristiche generali: -Colore, leggerezza, resistenza. COMPONENTI: -Cellule e matrice extracellulare
 Tessuto osseo Varietà di tessuto connettivo a prevalente funzione meccanica, di sostegno e di protezione, ma anche metabolica ( riserva di minerali) e di movimento (dando attacco ai muscoli) Caratteristiche
Tessuto osseo Varietà di tessuto connettivo a prevalente funzione meccanica, di sostegno e di protezione, ma anche metabolica ( riserva di minerali) e di movimento (dando attacco ai muscoli) Caratteristiche
Struttura del tessuto osseo
 Struttura del tessuto osseo Classificazione in base alla forma: Ossa lunghe Zona allungata posta fra due teste globose (tibia) Ossa corte Lunghezza e larghezza uguali (carpali del polso) Ossa piatte Sottili,
Struttura del tessuto osseo Classificazione in base alla forma: Ossa lunghe Zona allungata posta fra due teste globose (tibia) Ossa corte Lunghezza e larghezza uguali (carpali del polso) Ossa piatte Sottili,
14/10 Tessuti fondamentali, struttura degli organi.
 14/10 Tessuti fondamentali, struttura degli organi. Tessuti connettivi (propriamente detti, liquidi o a funzione trofica, di sostegno) Tessuti muscolari (striato scheletrico e cardiaco, liscio) Tessuto
14/10 Tessuti fondamentali, struttura degli organi. Tessuti connettivi (propriamente detti, liquidi o a funzione trofica, di sostegno) Tessuti muscolari (striato scheletrico e cardiaco, liscio) Tessuto
1. INTRODUZIONE 1.1. Struttura del tessuto osseo
 1. INTRODUZIONE 1.1. Struttura del tessuto osseo Il tessuto osseo è costituito dagli osteociti, derivanti dagli elementi che sintetizzano la matrice ossea (osteoblasti) e da sostanza fondamentale costituita
1. INTRODUZIONE 1.1. Struttura del tessuto osseo Il tessuto osseo è costituito dagli osteociti, derivanti dagli elementi che sintetizzano la matrice ossea (osteoblasti) e da sostanza fondamentale costituita
04-07/10 Tessuti fondamentali, struttura degli organi.
 Programma settimanale 04-07/10 Tessuti fondamentali, struttura degli organi. Tessuti epiteliali (di rivestimento, ghiandolari) Tessuti connettivi (propriamente detti, liquidi o a funzione trofica, di sostegno)
Programma settimanale 04-07/10 Tessuti fondamentali, struttura degli organi. Tessuti epiteliali (di rivestimento, ghiandolari) Tessuti connettivi (propriamente detti, liquidi o a funzione trofica, di sostegno)
TESSUTI CONNETTIVI. 2) connettivi a funzione trofica (sangue, linfa) 3) T. connettivi di sostegno (cartilagine, osso) SANGUE FUNZIONI
 TESSUTI CONNETTIVI 1) T. connettivo propriamente detto (TCPD) 2) connettivi a funzione trofica (sangue, linfa) 3) T. connettivi di sostegno (cartilagine, osso) SANGUE SOSTANZA INTERCELLULARE fluida: il
TESSUTI CONNETTIVI 1) T. connettivo propriamente detto (TCPD) 2) connettivi a funzione trofica (sangue, linfa) 3) T. connettivi di sostegno (cartilagine, osso) SANGUE SOSTANZA INTERCELLULARE fluida: il
IL SISTEMA SCHELETRICO: GENERALITA
 IL SISTEMA SCHELETRICO: GENERALITA Lo scheletro è formato dalle ossa,, dalle parti cartilaginee che ne rivestono le estremità e dalle connessioni articolari che si stabiliscono tra esse Le ossa sono di
IL SISTEMA SCHELETRICO: GENERALITA Lo scheletro è formato dalle ossa,, dalle parti cartilaginee che ne rivestono le estremità e dalle connessioni articolari che si stabiliscono tra esse Le ossa sono di
SC.BIOLOGICHE I Anno - CORSO A LABORATORIO CITOLOGIA-ISTOLOGIA. Esercitazione n 4 CONNETTIVI DI SOSTEGNO
 SC.BIOLOGICHE I Anno - CORSO A LABORATORIO CITOLOGIA-ISTOLOGIA Esercitazione n 4 CONNETTIVI DI SOSTEGNO Epiteliale Di Di rivestimento rivestimento Sensoriale Sensoriale Ghiandolare Ghiandolare Connettivo
SC.BIOLOGICHE I Anno - CORSO A LABORATORIO CITOLOGIA-ISTOLOGIA Esercitazione n 4 CONNETTIVI DI SOSTEGNO Epiteliale Di Di rivestimento rivestimento Sensoriale Sensoriale Ghiandolare Ghiandolare Connettivo
SC.BIOLOGICHE I Anno - CORSO A LABORATORIO CITOLOGIA-ISTOLOGIA. Esercitazione n 4 CONNETTIVI DI SOSTEGNO
 SC.BIOLOGICHE I Anno - CORSO A LABORATORIO CITOLOGIA-ISTOLOGIA Esercitazione n 4 CONNETTIVI DI SOSTEGNO Epiteliale Di Di rivestimento rivestimento Sensoriale Sensoriale Ghiandolare Ghiandolare Connettivo
SC.BIOLOGICHE I Anno - CORSO A LABORATORIO CITOLOGIA-ISTOLOGIA Esercitazione n 4 CONNETTIVI DI SOSTEGNO Epiteliale Di Di rivestimento rivestimento Sensoriale Sensoriale Ghiandolare Ghiandolare Connettivo
Osso e cicatrizzazione ossea. Patologia chirurgica veterinaria
 Osso e cicatrizzazione ossea Patologia chirurgica veterinaria Tessuto osseo n Componente essenziale dell organismo Funzioni: 1. Impalcatura per l ancoraggio di muscoli, tendini e legamenti 2. Protezione
Osso e cicatrizzazione ossea Patologia chirurgica veterinaria Tessuto osseo n Componente essenziale dell organismo Funzioni: 1. Impalcatura per l ancoraggio di muscoli, tendini e legamenti 2. Protezione
Osteogenesi formativa diretta o intramembranosa
 Osteogenesi formativa diretta o intramembranosa Dal tessuto connettivo Cellule mesenchimali > osteoblasti Produzione di matrice mucoproteica e fibre collagene Sostanza osteoide Deposizione d idrossiapatite
Osteogenesi formativa diretta o intramembranosa Dal tessuto connettivo Cellule mesenchimali > osteoblasti Produzione di matrice mucoproteica e fibre collagene Sostanza osteoide Deposizione d idrossiapatite
Ossificazione membranosa
 Il processo fondamentale di formazione del tessuto osseo si può schematizzare in quattro momenti: differenziamento di cellule mesenchimatose indifferenziate in osteoblasti secrezione della matrice organica
Il processo fondamentale di formazione del tessuto osseo si può schematizzare in quattro momenti: differenziamento di cellule mesenchimatose indifferenziate in osteoblasti secrezione della matrice organica
Capitolo 1. Lo sviluppo dell apparato locomotore
 Capitolo 1 Lo sviluppo dell apparato locomotore L apparato locomotore inizia il suo sviluppo al 15 giorno di vita endouterina, con la comparsa della notocorda, costituita da un cordone di cellule derivanti
Capitolo 1 Lo sviluppo dell apparato locomotore L apparato locomotore inizia il suo sviluppo al 15 giorno di vita endouterina, con la comparsa della notocorda, costituita da un cordone di cellule derivanti
cartilagine connettivo a carattere solido costituisce, insieme all osso, i cosiddetti tessuti di sostegno
 cartilagine connettivo a carattere solido costituisce, insieme all osso, i cosiddetti tessuti di sostegno nell individuo adulto, la cartilagine si trova Superfici articolari Cartilagini costali Orecchio
cartilagine connettivo a carattere solido costituisce, insieme all osso, i cosiddetti tessuti di sostegno nell individuo adulto, la cartilagine si trova Superfici articolari Cartilagini costali Orecchio
IL TESSUTO OSSEO. Tessuto organizzato in strutture definite: OSSA
 Forma specializzata di tessuto connettivo caratterizzata dalla MINERALIZZAZIONE DELLA MATRICE EXTRACELLULARE durezza e resistenza Tessuto organizzato in strutture definite: OSSA - Durezza, resistenza,
Forma specializzata di tessuto connettivo caratterizzata dalla MINERALIZZAZIONE DELLA MATRICE EXTRACELLULARE durezza e resistenza Tessuto organizzato in strutture definite: OSSA - Durezza, resistenza,
L Apparato Scheletrico e Articolare
 L Apparato Scheletrico e Articolare Istologia Funzione Morfologia Modificazioni del Tessuto Osseo: accrescimento e riassorbimento Colonna Vertebrale Istologia Il tessuto osseo è costituito da una componente
L Apparato Scheletrico e Articolare Istologia Funzione Morfologia Modificazioni del Tessuto Osseo: accrescimento e riassorbimento Colonna Vertebrale Istologia Il tessuto osseo è costituito da una componente
Il tessuto cartilagineo (t. connettivo specializzato)
 Il tessuto cartilagineo (t. connettivo specializzato) -plasticità ed elasticità superficie ammortizzante per le articolazioni; levigatezza scorrimento superfici articolari -modello per la formazione del
Il tessuto cartilagineo (t. connettivo specializzato) -plasticità ed elasticità superficie ammortizzante per le articolazioni; levigatezza scorrimento superfici articolari -modello per la formazione del
composizione: 65% di cristalli di Ca sotto forma di cristalli di idrossiapatite 25% di proteine collageniche 2% di proteine non collageniche 10% di
 TESSUTO OSSEO è un tipo particolare di tessuto connettivo in quanto è mineralizzato questo gli conferisce particolari caratteristiche: è un tessuto resistente, ma presenta un certo grado di flessibilità
TESSUTO OSSEO è un tipo particolare di tessuto connettivo in quanto è mineralizzato questo gli conferisce particolari caratteristiche: è un tessuto resistente, ma presenta un certo grado di flessibilità
Forma specializzata di connettivo: la ECM è mineralizzata per cui il tessuto ha notevole resistenza e durezza
 Tessuto osseo Forma specializzata di connettivo: la ECM è mineralizzata per cui il tessuto ha notevole resistenza e durezza L osso è al contempo resistente e leggero Non è un tessuto statico; è continuamente
Tessuto osseo Forma specializzata di connettivo: la ECM è mineralizzata per cui il tessuto ha notevole resistenza e durezza L osso è al contempo resistente e leggero Non è un tessuto statico; è continuamente
I Tessuti Trofomeccanici. By A. Pirola
 I Tessuti Trofomeccanici By A. Pirola Classificazione dei tessuti trofomeccanici Sono formati prevalentemente da sostanza fondamentale Svolgono funzioni di tipo Meccanico e Trofico T. Connettivo T. Cartilagineo
I Tessuti Trofomeccanici By A. Pirola Classificazione dei tessuti trofomeccanici Sono formati prevalentemente da sostanza fondamentale Svolgono funzioni di tipo Meccanico e Trofico T. Connettivo T. Cartilagineo
Connettivi Specializzati. Cartilagine Osso Sangue
 Connettivi Specializzati Cartilagine Osso Sangue Osso Connettivo specializzato, la cui matrice extracellulare è calcificata Funzione: - Fornisce impalcatura per la protezione e il movimento - Riserva di
Connettivi Specializzati Cartilagine Osso Sangue Osso Connettivo specializzato, la cui matrice extracellulare è calcificata Funzione: - Fornisce impalcatura per la protezione e il movimento - Riserva di
Sviluppo del tessuto osseo. Osteogenesis and reparative osteogenesis muscle tissue. Giuseppe M. Peretti
 Osteogenesis and reparative osteogenesis muscle tissue Giuseppe M. Peretti I testi e le immagini che verranno presentati sono un sussidio didattico alle lezioni del corso di Morfologia Umana riguardanti
Osteogenesis and reparative osteogenesis muscle tissue Giuseppe M. Peretti I testi e le immagini che verranno presentati sono un sussidio didattico alle lezioni del corso di Morfologia Umana riguardanti
I TESSUTI CONNETTIVI connettono altri tessuti tra di loro nella formazione degli organi, danno sostegno alle parti molli, intervengono negli scambi
 I TESSUTI CONNETTIVI connettono altri tessuti tra di loro nella formazione degli organi, danno sostegno alle parti molli, intervengono negli scambi nutritizi e presentano elementi specializzati nella difesa
I TESSUTI CONNETTIVI connettono altri tessuti tra di loro nella formazione degli organi, danno sostegno alle parti molli, intervengono negli scambi nutritizi e presentano elementi specializzati nella difesa
I sistemi muscolare e scheletrico
 I sistemi muscolare e scheletrico Il sistema muscolare Esistono tre tipi di muscoli con caratteristiche strutturali e funzionali diverse: o il muscolo striato o scheletrico; o il muscolo liscio; o il muscolo
I sistemi muscolare e scheletrico Il sistema muscolare Esistono tre tipi di muscoli con caratteristiche strutturali e funzionali diverse: o il muscolo striato o scheletrico; o il muscolo liscio; o il muscolo
TESSUTO CARTILAGINEO
 TESSUTO CARTILAGINEO il tessuto cartilagineo o cartilagine è una forma specializzata di tessuto connettivo con funzione principale di sostegno è costituito da cellule denominate condrociti, che sono circondate
TESSUTO CARTILAGINEO il tessuto cartilagineo o cartilagine è una forma specializzata di tessuto connettivo con funzione principale di sostegno è costituito da cellule denominate condrociti, che sono circondate
Osso. Created by G. Papaccio
 Osso Created by G. Papaccio 1 Tessuto osseo TIPI: Non lamellare Lamellare a fibre non intrecciate a fibre intrecciate compatto spugnoso Created by G. Papaccio 2 Funzioni dell osso Sostegno meccanico Locomozione
Osso Created by G. Papaccio 1 Tessuto osseo TIPI: Non lamellare Lamellare a fibre non intrecciate a fibre intrecciate compatto spugnoso Created by G. Papaccio 2 Funzioni dell osso Sostegno meccanico Locomozione
L apparato locomotore è costituito da: segmenti ossei (che formano lo scheletro del corpo) articolazioni (giunzioni segmentarie che permettono il
 Domenica 11 Novembre 2012 CORSO DI FORMAZIONE TECNICO EDUCATORE REGIONALE LA MACCHINA DELL UOMO: CENNI DI FISIOLOGIA, ANATOMIA DELL APPARATO LOCOMOTORE APPARATO LOCOMOTORE LE OSSA Relatore: Dott.Michele
Domenica 11 Novembre 2012 CORSO DI FORMAZIONE TECNICO EDUCATORE REGIONALE LA MACCHINA DELL UOMO: CENNI DI FISIOLOGIA, ANATOMIA DELL APPARATO LOCOMOTORE APPARATO LOCOMOTORE LE OSSA Relatore: Dott.Michele
Il tessuto cartilagineo
 Il tessuto cartilagineo Tessuto connettivo di sostegno costituito da cellule condroblasti, condrociti, condroclasti e da una ECM compatta, contenente fibre, proteoglicani, glicoproteine I condrociti sono
Il tessuto cartilagineo Tessuto connettivo di sostegno costituito da cellule condroblasti, condrociti, condroclasti e da una ECM compatta, contenente fibre, proteoglicani, glicoproteine I condrociti sono
Connettivi Specializzati. Cartilagine Osso Sangue
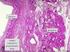 Connettivi Specializzati Cartilagine Osso Sangue Osso Connettivo specializzato, la cui matrice extracellulare è calcificata ed imprigiona le cellule che l hanno prodotta Funzione: Fornisce impalcatura
Connettivi Specializzati Cartilagine Osso Sangue Osso Connettivo specializzato, la cui matrice extracellulare è calcificata ed imprigiona le cellule che l hanno prodotta Funzione: Fornisce impalcatura
Tessuto Cartilagineo e Osseo
 Tessuti connettivi specializzati: Tessuti di sostegno Tessuto Cartilagineo Tessuti connettivi specializzati: Tessuti di sostegno Tessuto Osseo e Osseo Matrice: lastica Cellule: Condroblasti, Condrociti
Tessuti connettivi specializzati: Tessuti di sostegno Tessuto Cartilagineo Tessuti connettivi specializzati: Tessuti di sostegno Tessuto Osseo e Osseo Matrice: lastica Cellule: Condroblasti, Condrociti
Dr. Alessandro Lorusso Fisioterapista. Docente di: Patologia ortopedica
 Dr. Alessandro Lorusso Fisioterapista Docente di: Patologia ortopedica Patologia Ortopedica: Fratture Ossee Frattura e Contusione TRAUMA: Forza diretta o indiretta applicata ad un determinato segmento
Dr. Alessandro Lorusso Fisioterapista Docente di: Patologia ortopedica Patologia Ortopedica: Fratture Ossee Frattura e Contusione TRAUMA: Forza diretta o indiretta applicata ad un determinato segmento
L apparato locomotore comprende: Ossa; Articolazioni (con legamenti e capsule); I muscoli striati; I legamenti. Questo apparato ha funzione di
 L apparato locomotore comprende: Ossa; Articolazioni (con legamenti e capsule); I muscoli striati; I legamenti. Questo apparato ha funzione di sostegno e protezione degli organi interni, e permette grazie
L apparato locomotore comprende: Ossa; Articolazioni (con legamenti e capsule); I muscoli striati; I legamenti. Questo apparato ha funzione di sostegno e protezione degli organi interni, e permette grazie
Il sistema scheletrico
 Il sistema scheletrico Il sistema scheletrico è formato da ossa, articolazioni e in misura modesta da cartilagini. L'insieme delle ossa del corpo prende il nome di scheletro. In un individuo adulto lo
Il sistema scheletrico Il sistema scheletrico è formato da ossa, articolazioni e in misura modesta da cartilagini. L'insieme delle ossa del corpo prende il nome di scheletro. In un individuo adulto lo
APPARATO LOCOMOTORE. Insieme di organi che producono spostamenti in massa del corpo o di singole parti di esso
 APPARATO LOCOMOTORE APPARATO LOCOMOTORE Insieme di organi che producono spostamenti in massa del corpo o di singole parti di esso OSSA, ARTICOLAZIONI, MUSCOLI Scheletro: insieme di ossa collegate fra loro
APPARATO LOCOMOTORE APPARATO LOCOMOTORE Insieme di organi che producono spostamenti in massa del corpo o di singole parti di esso OSSA, ARTICOLAZIONI, MUSCOLI Scheletro: insieme di ossa collegate fra loro
APPARATO LOCOMOTORE. Insieme di organi che producono spostamenti in massa del corpo o di singole parti di esso OSSA, ARTICOLAZIONI, MUSCOLI
 APPARATO LOCOMOTORE APPARATO LOCOMOTORE Insieme di organi che producono spostamenti in massa del corpo o di singole parti di esso OSSA, ARTICOLAZIONI, MUSCOLI Scheletro: insieme di ossa collegate fra loro
APPARATO LOCOMOTORE APPARATO LOCOMOTORE Insieme di organi che producono spostamenti in massa del corpo o di singole parti di esso OSSA, ARTICOLAZIONI, MUSCOLI Scheletro: insieme di ossa collegate fra loro
CARTILAGINE. NON sono presenti vasi sanguigni
 CARTILAGINE Tessuto connettivo di sostegno costituito da cellule: condrociti circondati da una ECM compatta, contenente: fibre, proteoglicani, glicoproteine I condrociti sono situati in cavità dette lacune
CARTILAGINE Tessuto connettivo di sostegno costituito da cellule: condrociti circondati da una ECM compatta, contenente: fibre, proteoglicani, glicoproteine I condrociti sono situati in cavità dette lacune
APPARATO LOCOMOTORE. Insieme di organi che producono spostamenti in massa del corpo o di singole parti di esso OSSA, ARTICOLAZIONI, MUSCOLI
 APPARATO LOCOMOTORE APPARATO LOCOMOTORE Insieme di organi che producono spostamenti in massa del corpo o di singole parti di esso OSSA, ARTICOLAZIONI, MUSCOLI Scheletro: insieme di ossa collegate fra loro
APPARATO LOCOMOTORE APPARATO LOCOMOTORE Insieme di organi che producono spostamenti in massa del corpo o di singole parti di esso OSSA, ARTICOLAZIONI, MUSCOLI Scheletro: insieme di ossa collegate fra loro
Tessuto connettivo. E il più abbondante e si trova ovunque nel corpo
 Tessuto Connettivo Tessuto connettivo E il più abbondante e si trova ovunque nel corpo Mette in connessione le varie parti (tessuti e organi) Costituito da cellule e fibre immerse in una matrice o sostanza
Tessuto Connettivo Tessuto connettivo E il più abbondante e si trova ovunque nel corpo Mette in connessione le varie parti (tessuti e organi) Costituito da cellule e fibre immerse in una matrice o sostanza
L apparato locomotore è formato da: 1. sistema scheletrico 2. sistema muscolare
 APPARATO LOCOMOTORE L apparato locomotore è formato da: 1. sistema scheletrico 2. sistema muscolare Il sistema scheletrico è l insieme delle ossa, delle cartilagini e delle articolazioni del corpo Lo scheletro
APPARATO LOCOMOTORE L apparato locomotore è formato da: 1. sistema scheletrico 2. sistema muscolare Il sistema scheletrico è l insieme delle ossa, delle cartilagini e delle articolazioni del corpo Lo scheletro
 http://digilander.libero.it/glampis64 Il corpo umano è organizzato in livelli gerarchici Un organismo è costituito da un insieme di sistemi, formati a loro volta da organi, tessuti e cellule. I tessuti
http://digilander.libero.it/glampis64 Il corpo umano è organizzato in livelli gerarchici Un organismo è costituito da un insieme di sistemi, formati a loro volta da organi, tessuti e cellule. I tessuti
Tipi di TESSUTO CONNETTIVO. Tessuto connettivo propriamente detto e connettivi specializzati
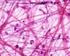 Tipi di TESSUTO CONNETTIVO Tessuto connettivo propriamente detto e connettivi specializzati Connettivi di sostegno Tessuto osseo: mineralizzato -> rigido/duro vascolarizzato Cartilagine: leggera e flessibile
Tipi di TESSUTO CONNETTIVO Tessuto connettivo propriamente detto e connettivi specializzati Connettivi di sostegno Tessuto osseo: mineralizzato -> rigido/duro vascolarizzato Cartilagine: leggera e flessibile
Il Movimento. L apparato scheletrico L apparato muscolare
 Il Movimento L apparato scheletrico L apparato muscolare Il Movimento Nell uomo il movimento si realizza grazie a: Lo scheletro o apparato scheletrico L apparato muscolare Il Movimento Lo scheletro fornisce
Il Movimento L apparato scheletrico L apparato muscolare Il Movimento Nell uomo il movimento si realizza grazie a: Lo scheletro o apparato scheletrico L apparato muscolare Il Movimento Lo scheletro fornisce
CARTILAGINE Tessuto connettivo di sostegno costituito da cellule: condroblasti; condrociti; condroclasti e da una ECM compatta, contenente:
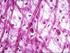 Tessuto connettivo di sostegno costituito da cellule: condroblasti; condrociti; condroclasti e da una ECM compatta, contenente: fibre, proteoglicani, glicoproteine I condrociti sono situati in cavità dette
Tessuto connettivo di sostegno costituito da cellule: condroblasti; condrociti; condroclasti e da una ECM compatta, contenente: fibre, proteoglicani, glicoproteine I condrociti sono situati in cavità dette
Connettivi Specializzati. Cartilagine Osso Sangue
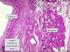 Connettivi Specializzati Cartilagine Osso Sangue Osso Connettivo specializzato, la cui matrice extracellulare è calcificata ed imprigiona le cellule che l hanno prodotta Funzione: Fornisce impalcatura
Connettivi Specializzati Cartilagine Osso Sangue Osso Connettivo specializzato, la cui matrice extracellulare è calcificata ed imprigiona le cellule che l hanno prodotta Funzione: Fornisce impalcatura
TESSUTI CONNETTIVI. Gruppo di tessuti con caratteristiche comuni: Origine embrionale (mesoderma mesenchima)
 TESSUTI CONNETTIVI Gruppo di tessuti con caratteristiche comuni: Origine embrionale (mesoderma mesenchima) Organizzazione strutturale Funzioni: connessione di altri tessuti, fz. meccanica (sostegno), fz.
TESSUTI CONNETTIVI Gruppo di tessuti con caratteristiche comuni: Origine embrionale (mesoderma mesenchima) Organizzazione strutturale Funzioni: connessione di altri tessuti, fz. meccanica (sostegno), fz.
Gerard Tortora, Brian Derrickson. Conosciamo il corpo umano
 1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 4 Il sistema scheletrico e le articolazioni 1. Le funzioni delle ossa e del sistema scheletrico 2. I quattro tipi di ossa 3. La struttura
1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 4 Il sistema scheletrico e le articolazioni 1. Le funzioni delle ossa e del sistema scheletrico 2. I quattro tipi di ossa 3. La struttura
Fondamentale è anche il sistema nervoso per il controllo funzionale. Spostamento nello spazio (contrazione muscolare) Forma del corpo
 APPARATO LOCOMOTORE Ai fini della funzione motoria è fondamentale l integrazione fra apparato scheletrico e apparato muscolare, che insieme costituiscono l apparato locomotore. Fondamentale è anche il
APPARATO LOCOMOTORE Ai fini della funzione motoria è fondamentale l integrazione fra apparato scheletrico e apparato muscolare, che insieme costituiscono l apparato locomotore. Fondamentale è anche il
SEGMENTI SCHELETRICI (o ossa)
 SEGMENTI SCHELETRICI (o ossa) Costituiti prevalentemente da tessuto osseo Cellule: osteoblasti osteociti osteoclasti Sostanza intercellulare: matrice fibrosa sostanza amorfa matrice inorganica Le cellule
SEGMENTI SCHELETRICI (o ossa) Costituiti prevalentemente da tessuto osseo Cellule: osteoblasti osteociti osteoclasti Sostanza intercellulare: matrice fibrosa sostanza amorfa matrice inorganica Le cellule
Connettivi Specializzati. Cartilagine Osso Sangue
 Connettivi Specializzati Cartilagine Osso Sangue Cartilagine Funzione di sostegno Tessuto molto elastico Resistente alle sollecitazioni meccaniche Correlato al tessuto osseo Composizione della Cartilagine
Connettivi Specializzati Cartilagine Osso Sangue Cartilagine Funzione di sostegno Tessuto molto elastico Resistente alle sollecitazioni meccaniche Correlato al tessuto osseo Composizione della Cartilagine
University of Laddington. Lo Scheletro
 University of Laddington Titolo del Libro: Lo Scheletro di: Trevor Rusemberg Indice Lo scheletro Pag 2 Disposizioni delle cartillagini Pag 3 Classificazioni delle ossa Pag 3 Struttura e aspetto Pag 3 Ossa
University of Laddington Titolo del Libro: Lo Scheletro di: Trevor Rusemberg Indice Lo scheletro Pag 2 Disposizioni delle cartillagini Pag 3 Classificazioni delle ossa Pag 3 Struttura e aspetto Pag 3 Ossa
Connettivi Specializzati. Cartilagine Osso Sangue
 Connettivi Specializzati Cartilagine Osso Sangue Cartilagine Funzione di sostegno Tessuto molto elastico Resistente alle sollecitazioni meccaniche Correlato al tessuto osseo Composizione della Cartilagine
Connettivi Specializzati Cartilagine Osso Sangue Cartilagine Funzione di sostegno Tessuto molto elastico Resistente alle sollecitazioni meccaniche Correlato al tessuto osseo Composizione della Cartilagine
Organizzazione del Corpo Umano
 Organizzazione del Corpo Umano Cellula Unità fondamentale della vita, in grado di compiere attività di base come la riproduzione Gruppi di cellule con caratteristiche uguali Tessuto Tessuto Epiteliare
Organizzazione del Corpo Umano Cellula Unità fondamentale della vita, in grado di compiere attività di base come la riproduzione Gruppi di cellule con caratteristiche uguali Tessuto Tessuto Epiteliare
L Apparato muscolo-scheletrico: scheletrico: definizione
 L Apparato muscolo-scheletrico: scheletrico: definizione E il sistema costituito dall insieme di ossa articolazioni e muscoli funzionalmente integrate tra loro Il tessuto osseo TESSUTO CONNETIVALE SPECIALIZZATO
L Apparato muscolo-scheletrico: scheletrico: definizione E il sistema costituito dall insieme di ossa articolazioni e muscoli funzionalmente integrate tra loro Il tessuto osseo TESSUTO CONNETIVALE SPECIALIZZATO
Lo scheletro umano è composto da 205 ossa, ha delle funzioni importanti per il nostro corpo,perché sostiene il nostro corpo,ci permette di muoverlo e
 Lo scheletro umano è composto da 205 ossa, ha delle funzioni importanti per il nostro corpo,perché sostiene il nostro corpo,ci permette di muoverlo e protegge i nostri organi,sopratutto quelli delicati
Lo scheletro umano è composto da 205 ossa, ha delle funzioni importanti per il nostro corpo,perché sostiene il nostro corpo,ci permette di muoverlo e protegge i nostri organi,sopratutto quelli delicati
Tessuto osseo. Forma specializzata di connettivo: la ECM è mineralizzata per cui il tessuto ha notevole resistenza e durezza
 Forma specializzata di connettivo: la ECM è mineralizzata per cui il tessuto ha notevole resistenza e durezza L osso è al contempo resistente e leggero Non è un tessuto statico; è continuamente rinnovato
Forma specializzata di connettivo: la ECM è mineralizzata per cui il tessuto ha notevole resistenza e durezza L osso è al contempo resistente e leggero Non è un tessuto statico; è continuamente rinnovato
Cartilagine. Created by G. Papaccio 1
 Cartilagine Created by G. Papaccio 1 nell individuo adulto, la cartilagine si trova Superfici articolari Cartilagini costali Orecchio esterno Cartilagini del naso Laringe Trachea e bronchi Created by G.
Cartilagine Created by G. Papaccio 1 nell individuo adulto, la cartilagine si trova Superfici articolari Cartilagini costali Orecchio esterno Cartilagini del naso Laringe Trachea e bronchi Created by G.
L inizio della vita. Capitolo 1
 Capitolo 1 L inizio della vita La vita inizia quando due cellule, incapaci di moltiplicarsi perché dotate di un corredo cromosomico incompleto, si uniscono per formare una sola cellula, lo zigote, capace
Capitolo 1 L inizio della vita La vita inizia quando due cellule, incapaci di moltiplicarsi perché dotate di un corredo cromosomico incompleto, si uniscono per formare una sola cellula, lo zigote, capace
APPARATO SCHELETRICO -INTRODUZIONE-
 APPARATO SCHELETRICO -INTRODUZIONE- Funzioni dell osso 1. Sostegno: costituisce l impalcatura del corpo 2. Protezione di molti organi (cervello, midollo spinale e tanti organi interni) 3. Leve per attacco
APPARATO SCHELETRICO -INTRODUZIONE- Funzioni dell osso 1. Sostegno: costituisce l impalcatura del corpo 2. Protezione di molti organi (cervello, midollo spinale e tanti organi interni) 3. Leve per attacco
I TESSUTI CONNETTIVI
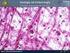 I TESSUTI CONNETTIVI 1) Tessuti connettivi propriamente detti; 2) Tessuto adiposo; 3) Sangue; 4) Tessuto cartilagineo; 5) Tessuto osseo A cura di Tiziano Baroni TESSUTO CONNETTIVO Gruppo di tessuti con
I TESSUTI CONNETTIVI 1) Tessuti connettivi propriamente detti; 2) Tessuto adiposo; 3) Sangue; 4) Tessuto cartilagineo; 5) Tessuto osseo A cura di Tiziano Baroni TESSUTO CONNETTIVO Gruppo di tessuti con
CARTILAGINE Tessuto connettivo di sostegno costituito da cellule: condroblasti; condrociti; condroclasti e da una ECM compatta, contenente:
 Tessuto connettivo di sostegno costituito da cellule: condroblasti; condrociti; condroclasti e da una ECM compatta, contenente: fibre, proteoglicani, glicoproteine I condrociti sono situati in cavità dette
Tessuto connettivo di sostegno costituito da cellule: condroblasti; condrociti; condroclasti e da una ECM compatta, contenente: fibre, proteoglicani, glicoproteine I condrociti sono situati in cavità dette
a differenza degli epiteli
 TESSUTO CONNETTIVO TESSUTO CONNETTIVO Gli spazi fra gli organi e i tessuti del corpo sono riempiti da tessuto connettivo composto principalmente da un reticolo di fibre proteiche resistenti (principalmente
TESSUTO CONNETTIVO TESSUTO CONNETTIVO Gli spazi fra gli organi e i tessuti del corpo sono riempiti da tessuto connettivo composto principalmente da un reticolo di fibre proteiche resistenti (principalmente
Regolazione endocrina della crescita
 Regolazione endocrina della crescita Determinazione genica Dieta adeguata Assenza di malattie croniche e condizioni ambientali stressanti (che inducono rilascio di cortisolo attività catabolica) Livelli
Regolazione endocrina della crescita Determinazione genica Dieta adeguata Assenza di malattie croniche e condizioni ambientali stressanti (che inducono rilascio di cortisolo attività catabolica) Livelli
FUNZIONI TIPI DI OSSA PARTI I TESSUTO OSSEO ARTICOLAZIONI
 FUNZIONI TIPI DI OSSA PARTI I TESSUTO OSSEO ARTICOLAZIONI WWW.FISIOKINESITERAPIA.BIZ Il sitema scheletrico ha tre funzioni: sostiene il corpo protegge gli organi interni più delicati consente il movimento
FUNZIONI TIPI DI OSSA PARTI I TESSUTO OSSEO ARTICOLAZIONI WWW.FISIOKINESITERAPIA.BIZ Il sitema scheletrico ha tre funzioni: sostiene il corpo protegge gli organi interni più delicati consente il movimento
Lezioni di Biomeccanica
 Università di Genova Scienze Mediche e Farmaceutiche CORSO DI LAUREA IN FISIOTERAPIA Lezioni di Biomeccanica Corso integrato di Cinesiologia, Biomeccanica Andrea Fusco Pt, SPt, OMT, SSc Lezione n 4n La
Università di Genova Scienze Mediche e Farmaceutiche CORSO DI LAUREA IN FISIOTERAPIA Lezioni di Biomeccanica Corso integrato di Cinesiologia, Biomeccanica Andrea Fusco Pt, SPt, OMT, SSc Lezione n 4n La
Tipi di TESSUTO CONNETTIVO. Tessuto connettivo propriamente detto e connettivi specializzati
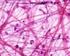 Tipi di TESSUTO CONNETTIVO Tessuto connettivo propriamente detto e connettivi specializzati Connettivi di sostegno Tessuto osseo: mineralizzato -> rigido/duro vascolarizzato Cartilagine: leggera e flessibile
Tipi di TESSUTO CONNETTIVO Tessuto connettivo propriamente detto e connettivi specializzati Connettivi di sostegno Tessuto osseo: mineralizzato -> rigido/duro vascolarizzato Cartilagine: leggera e flessibile
I TESSUTI CONNETTIVI. Tessuti connettivi propriamente detti; Tessuto adiposo; Sangue; Tessuto cartilagineo; Tessuto osseo. A cura di Tiziano Baroni
 I TESSUTI CONNETTIVI 1) 2) 3) 4) 5) Tessuti connettivi propriamente detti; Tessuto adiposo; Sangue; Tessuto cartilagineo; Tessuto osseo A cura di Tiziano Baroni TESSUTI CONNETTIVI Gruppo di tessuti con
I TESSUTI CONNETTIVI 1) 2) 3) 4) 5) Tessuti connettivi propriamente detti; Tessuto adiposo; Sangue; Tessuto cartilagineo; Tessuto osseo A cura di Tiziano Baroni TESSUTI CONNETTIVI Gruppo di tessuti con
In base alle caratteristiche delle miofibrille
 Tessuto muscolare Rende possibili sia i movimenti del corpo nell insieme che quelli delle singole parti. Il tessuto muscolare è dotato di contrattilità oltre che di eccitabilità. In base alle caratteristiche
Tessuto muscolare Rende possibili sia i movimenti del corpo nell insieme che quelli delle singole parti. Il tessuto muscolare è dotato di contrattilità oltre che di eccitabilità. In base alle caratteristiche
Sistematica e filogenesi dei Vertebrati
 Sistematica e filogenesi dei Vertebrati Lezione 5: Osteichtyes dott. Andrea Brusaferro Scuola di Scienze Ambientali Unità di Ricerca in Ecologia Animale Università di Camerino - UNICAM 0737/403226 cell.
Sistematica e filogenesi dei Vertebrati Lezione 5: Osteichtyes dott. Andrea Brusaferro Scuola di Scienze Ambientali Unità di Ricerca in Ecologia Animale Università di Camerino - UNICAM 0737/403226 cell.
Regolazione endocrina della crescita
 Regolazione endocrina della crescita Determinazione genica Dieta adeguata Assenza di malattie croniche e condizioni ambientali stressanti (che inducono rilascio di cortisolo attività catabolica) Livelli
Regolazione endocrina della crescita Determinazione genica Dieta adeguata Assenza di malattie croniche e condizioni ambientali stressanti (che inducono rilascio di cortisolo attività catabolica) Livelli
CITOSCHELETRO. Caratteristica degli epiteli: mutua adesività fra le singole cellule.
 CITOSCHELETRO Caratteristica degli epiteli: mutua adesività fra le singole cellule. Ematossilina eosina Ematossilina ferrica, fissazione in bicromato Nell epidermide l istologia rivela strutture di coesione
CITOSCHELETRO Caratteristica degli epiteli: mutua adesività fra le singole cellule. Ematossilina eosina Ematossilina ferrica, fissazione in bicromato Nell epidermide l istologia rivela strutture di coesione
Riparazione. Rigenerazione o Risoluzione
 GUARIGIONE GUARIGIONE È l insieme dei fenomeni e dei meccanismi che l organismo attua per ripristinare le condizioni di equilibrio cioè per ritornare allo stato normale. Rigenerazione o Risoluzione Ricostruzione
GUARIGIONE GUARIGIONE È l insieme dei fenomeni e dei meccanismi che l organismo attua per ripristinare le condizioni di equilibrio cioè per ritornare allo stato normale. Rigenerazione o Risoluzione Ricostruzione
INTRODUZIONE. La riabilitazione orale di tipo fisso mediante impianti osseointegrati nei
 INTRODUZIONE La riabilitazione orale di tipo fisso mediante impianti osseointegrati nei pazienti totalmente o parzialmente edentuli è una tecnica che presenta follow-up ormai soddisfacenti nell odontoiatria
INTRODUZIONE La riabilitazione orale di tipo fisso mediante impianti osseointegrati nei pazienti totalmente o parzialmente edentuli è una tecnica che presenta follow-up ormai soddisfacenti nell odontoiatria
Apparato scheletrico
 Apparato scheletrico L'apparato scheletrico ha la funzione di sostegno e di protezione degli organi interni ed è costituita dalle ossa. Le ossa sono formate dal tessuto osseo, composto da una sostanza
Apparato scheletrico L'apparato scheletrico ha la funzione di sostegno e di protezione degli organi interni ed è costituita dalle ossa. Le ossa sono formate dal tessuto osseo, composto da una sostanza
B&B DENTAL. implant company
 B&B DENTAL implant company Istologici eseguiti su un impianto di Novocor Plus inserito nell osso di pecora DIPARTIMENTO DI ANATOMIA UMANA NORMALE del UNIVERSITÀ DI MODENA e PARMA (1990) Micrografia di
B&B DENTAL implant company Istologici eseguiti su un impianto di Novocor Plus inserito nell osso di pecora DIPARTIMENTO DI ANATOMIA UMANA NORMALE del UNIVERSITÀ DI MODENA e PARMA (1990) Micrografia di
Il sostegno e il movimento
 Il sostegno e il movimento 1. Come si muovono gli animali Il movimento degli unicellulari avviene grazie a pseudopodi, ciglia o flagelli 1 1. Come si muovono gli animali 1. Come si muovono gli animali
Il sostegno e il movimento 1. Come si muovono gli animali Il movimento degli unicellulari avviene grazie a pseudopodi, ciglia o flagelli 1 1. Come si muovono gli animali 1. Come si muovono gli animali
2.6 Tessuti dello scheletro! AF
 FreeFind MedPop Web Vai MedPop 2.6 Tessuti dello scheletro! AF HOME!.php!.html!.pdf! secondo Thibodeau & Patton: Anatomia e fisiologia CEA 2005 Anatomia! Locomotore! Scheletro 2.6 Tessuti dello scheletro
FreeFind MedPop Web Vai MedPop 2.6 Tessuti dello scheletro! AF HOME!.php!.html!.pdf! secondo Thibodeau & Patton: Anatomia e fisiologia CEA 2005 Anatomia! Locomotore! Scheletro 2.6 Tessuti dello scheletro
Walter Albisetti Omar De Bartolomeo Giovanni Peretti. Problemi ortopedici nell'ambulatorio del pediatra
 Walter Albisetti Omar De Bartolomeo Giovanni Peretti Problemi ortopedici nell'ambulatorio del pediatra Copyright MMIX ARACNE editrice S.r.l. www.aracneeditrice.it info@aracneeditrice.it via Raffaele Garofalo,
Walter Albisetti Omar De Bartolomeo Giovanni Peretti Problemi ortopedici nell'ambulatorio del pediatra Copyright MMIX ARACNE editrice S.r.l. www.aracneeditrice.it info@aracneeditrice.it via Raffaele Garofalo,
Una cellula è la più piccola parte di un organismo vivente che, se isolata, può continuare a vivere e a funzionare, almeno in certe condizioni.
 I TESSUTI ANIMALI Una cellula è la più piccola parte di un organismo vivente che, se isolata, può continuare a vivere e a funzionare, almeno in certe condizioni. SCHEMA DI UNA CELLULA ANIMALE Wikipedia
I TESSUTI ANIMALI Una cellula è la più piccola parte di un organismo vivente che, se isolata, può continuare a vivere e a funzionare, almeno in certe condizioni. SCHEMA DI UNA CELLULA ANIMALE Wikipedia
TRAUMATOLOGIA. Generalità sulle fratture
 TRAUMATOLOGIA Generalità sulle fratture TRAUMATOLOGIA Frattura: soluzione di continuità completa o incompleta di un segmento osseo FATTORI CAUSALI Forza traumatica diretta: Forza isolata Schiacciamento
TRAUMATOLOGIA Generalità sulle fratture TRAUMATOLOGIA Frattura: soluzione di continuità completa o incompleta di un segmento osseo FATTORI CAUSALI Forza traumatica diretta: Forza isolata Schiacciamento
evento meccanico che provoca la lesione (danno anatomico) di uno o più tessuti o organi
 Le fratture trauma evento meccanico che provoca la lesione (danno anatomico) di uno o più tessuti o organi trauma componenti del sistema muscolo-scheletrico trauma osso articolazioni tessuti molli (cute,
Le fratture trauma evento meccanico che provoca la lesione (danno anatomico) di uno o più tessuti o organi trauma componenti del sistema muscolo-scheletrico trauma osso articolazioni tessuti molli (cute,
Cellula muscolare liscia. Cellula nervosa. Cellula staminale
 Differenziazione cellulare Cellula muscolare liscia Cellula staminale Cellula nervosa Cellule dotate di uguale genoma e di pari potenzialità danno origine ad un sistema integrato di cellule altamente differenziate
Differenziazione cellulare Cellula muscolare liscia Cellula staminale Cellula nervosa Cellule dotate di uguale genoma e di pari potenzialità danno origine ad un sistema integrato di cellule altamente differenziate
IL MOVIMENTO A.S. 2014/2015 CLASSE 2^B
 A.S. 2014/2015 CLASSE 2^B IL MOVIMENTO APPARATO SCHELETRICO: Ossa: Bosio, Franzi, Lai, Ramos Scheletro: Reynaud, Bravo, Orusa, Morglia Articolazioni: Mureddu, Fiasconaro, Mellano, Rosa APPARATO MUSCOLARE:
A.S. 2014/2015 CLASSE 2^B IL MOVIMENTO APPARATO SCHELETRICO: Ossa: Bosio, Franzi, Lai, Ramos Scheletro: Reynaud, Bravo, Orusa, Morglia Articolazioni: Mureddu, Fiasconaro, Mellano, Rosa APPARATO MUSCOLARE:
