Dal modellino dei Gas perfetti alla Tecnologia del vuoto
|
|
|
- Modesto Lombardi
- 6 anni fa
- Visualizzazioni
Transcript
1 Dal modellino dei Gas erfetti alla ecnologia del vuoto Il gas erfetto è un modellino teorico che ermette di rogettare e dimensionare i sistemi da vuoto, arte tutto da P= Nk () (*) P ressione del gas, olume che lo contiene, N numero di molecole, k costante dei Boltzmann e temeratura del gas (K) L equazione (*) contiene tutte le informazioni necessarie er qualsiasi li i tio di gas. Ed è imressionante: mette in relazione grandezze MACROSCOPICHE (P, e ) con la grandezze microscoica N ( numero di atomi, molecole) uoto e Settrometria di Massa
2 lineare Dilatazione termica l-l 0 =l 0 t-t 0 ) Macroscoico Se rendiamo t o = 0 o C, =3 0 t diventa: - 0 = 3a 0 t: = 0 +3a 0 t l=l 0 t Per fluidi (gas e liquidi) sueficiale A-A 0 =A 0 t-t 0 ) A=A 0t olumica - 0 =3a 0 t-t 0 ) =3 0 t uoto e Settrometria di Massa = t dove
3 Dilatazione dei gas Dati serimentali = 0 =m t, da = 0 + o t si ha: m = o Per tutti i gas che non condensano, a ressione costante si ha che è lo stesso. uoto e Settrometria di Massa Ad un gas rarefatto (vuoto) questo modellino si adatta molto bene º C
4 Scala termometrica dei Kelvin Riscriviamo = o t, dato che t o = 0 o C, si ha = o (+ t) Conversione della scala termometrica t k = = t c da Celsius a gradi Kelvin = o (+ t) o t 73.5 t o o o o 73.5 ª legge di Gay Lussac o (olta Gay Lussac) o o o o uoto e Settrometria di Massa
5 constante a legge di Gay Lussac = m t, Anche in questo caso si ha m = o, come er la variazione di volume si aveva m = o e vale semre Quindi allo stesso modo con la scala assoluta si ha: uoto e Settrometria di Massa 73.5 º C o ª legge di Gay Lussac o (olta Gay Lussac) 73. 5
6 costante e Legge di Boyle -Mariotte Si comrima un gas rarefatto con un sistema di termostatazione, che ermetta di mantenere costante la temeratura, si ottiene il comortamento riortato sora. Posso riscrivela quindi = costante = costante e =costante uoto e Settrometria di Massa =
7 Partiamo dalla relazione = ( ) Prendiamo la a legge di Gay Lussac: Moltilichiamo o e o membro dell equazione ( ) er questa quantità uguale: = * * (#) Prendiamo la a legge di Gay Lussac: Moltilichiamo o e o membro dell equazione (#) er una quantità uguale * * = * * uoto e Settrometria di Massa
8 Si ricava ($) Cerco di ordinare a o membro tutto con il edice ed al o membro con il edice, moltilicando o e o membro dell equazione equazione ($) er una quantità uguale * * Semlifico; Si ha quindi; uoto e Settrometria di Massa
9 Equazione di Stato dei Gas erfetti cost utti i tii di gas in condizioni rarefatte (ressioni basse alto vuoto, quello che interessa a noi) soddisfano la seguente legge: cost uoto e Settrometria di Massa
10 ediamo se questo modello va bene Se il modello va bene er isistemi da vuoto allora misuro P con la valvola aerta, doo chiudo la valvola. Svuoto il volume dei tubi, arendo la valvolina verso la oma (la ressione tubi raggiungerà il valore minimo mentre in cil non cambia (valvola chiusa). Chiudo la alvolina e riaro la valvola, avrò l esansione del gas dal volume cil a tutto il volume cil + tubi, misurerò una ressione P ovviamente minore di P P= costante P cil =P ( cil + tubi ) uoto e Settrometria di Massa
11 Questo vale er ogni successiva oerazione P P P P ( cil ( cil tubi P cil = P ( cil + tubi ) (a) P = cil 3 cil tubi ) cil P 3 ( cil + tubi ) (b) P 3... = P 4... ecc. Se dividoid il rimo membro di (a) er il rimo membro di (b), se uso la stessa P P Pi quantità (secondi membri)... l uguaglianzali non cambia. P P3 P i Il raorto tra le ressioni rimane semre lo stesso. uoto e Settrometria di Massa... )
12 Misura dei raorti tra le ressione, nel caso dell esansione Pressione misurata nel volume tubi in esansioni successive P La legge che abbiamo P P /P P 3 P /P 3 introdottodescrive bene P 4 P 3 /P 4 il sistema er l aria, P 5 P 4 /P 5 P 6 P 5 /P 6 anche in condizioni non P 7 P 6 /P 7 rarefatte. P 8 P 7 /P 8 P 9 P 8 /P 9 P 0 P 9 /P 0 media dei raorti deviazione standard errore ercentuale uoto e Settrometria di Massa
13 Misura dei raorti tra P, nel caso dli del riscaldamento dell aria Pressione misurata nel volume tubi in esansioni successive P P La legge che abbiamo P P P /P = / P 3 P 3 P 3 /P = 3 / introdottodescrive bene P 4 P 4 P 4 /P 3 = 4 / 3 il sistema er l aria, P 5 P 5 P 5 /P 4 = 5 / 4 anche in condizioni non P = 6 P 6 P 6 /P 5 6 / 5 rarefatte Si osservano che i P n- n- P n/p n- = n/ n- P n n raorti, rimangono costanti e il raorto delle ressioni è uguale al raorto delle temerature. uoto e Settrometria di Massa
14 Equazione di Stato dei Gas erfetti cost utti i tii di gas in condizioni rarefatte (ressioni basse alto vuoto, quello che interessa a noi) soddisfano la seguente legge: cost Cos è questa costante? uoto e Settrometria di Massa Continua
Dilatazione termica. Effetti della T sui materiali e l ambiente. l=α l o t. A = 2 α A o t. α = coefficiente di dilatazione termica lineare
 Acroolis Atene Eretteo: sostituzione di armature in acciaio con strutture in itanio. Esemi di restauro negativo acciaio contro ferro sigillato in iombo. Recuero di restauri inoortuni con sostituzione mediante
Acroolis Atene Eretteo: sostituzione di armature in acciaio con strutture in itanio. Esemi di restauro negativo acciaio contro ferro sigillato in iombo. Recuero di restauri inoortuni con sostituzione mediante
Peso atomico (meglio massa atomica)
 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Dilatazione termica. Δl=α l o Δt. ΔA = 2 α A o Δt. ( ) Δl=α l o Δt. α = coefficiente di dilatazione termica lineare
 Acroolis Atene Eretteo: sostituzione di armature in acciaio con strutture in itanio. Esemi di restauro negativo acciaio contro ferro sigillato in iombo. Recuero di restauri inoortuni con sostituzione mediante
Acroolis Atene Eretteo: sostituzione di armature in acciaio con strutture in itanio. Esemi di restauro negativo acciaio contro ferro sigillato in iombo. Recuero di restauri inoortuni con sostituzione mediante
Lezione 10 Termodinamica
 rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
Esercizi sugli stati ed il diagramma entalpico dell'aria umida
 Esercizi sugli stati ed il diagramma entalico dell'aria umida CESARE MARIA JOPPOLO, STEFANO DE ANTONELLIS, LUCA MOLINAROLI DIPARTIMENTO DI ENERGIA POLITECNICO DI MILANO C. M. Joolo, S. De Antonellis, L.
Esercizi sugli stati ed il diagramma entalico dell'aria umida CESARE MARIA JOPPOLO, STEFANO DE ANTONELLIS, LUCA MOLINAROLI DIPARTIMENTO DI ENERGIA POLITECNICO DI MILANO C. M. Joolo, S. De Antonellis, L.
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
UNITÀ 1 La temperatura. Test
 Test 1 Quale delle seguenti affermazioni è vera? A Il termoscopio è un termometro con una scala graduata. B Il termometro è un termoscopio con la scala graduata. C Il termoscopio visualizza variazioni
Test 1 Quale delle seguenti affermazioni è vera? A Il termoscopio è un termometro con una scala graduata. B Il termometro è un termoscopio con la scala graduata. C Il termoscopio visualizza variazioni
Esercizi svolti di termodinamica applicata
 0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
Unità 1. La temperatura
 Unità 1 La temperatura 1. Il termometro La sensazione di caldo e di freddo è soggettiva: per renderla misurabile si usa il termoscopio. È un recipiente di vetro con tappo forato e tubicino, contenente
Unità 1 La temperatura 1. Il termometro La sensazione di caldo e di freddo è soggettiva: per renderla misurabile si usa il termoscopio. È un recipiente di vetro con tappo forato e tubicino, contenente
GAS IDEALI E REALI. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche:
 GAS IDEALI E REALI Gas ideale. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche: - non ha forma, ne volume proprio; - e comprimibile.
GAS IDEALI E REALI Gas ideale. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche: - non ha forma, ne volume proprio; - e comprimibile.
La temperatura e il calore
 La temperatura e il calore Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti nel nostro laboratorio Questo simbolo significa che l esperimento si può realizzare
La temperatura e il calore Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti nel nostro laboratorio Questo simbolo significa che l esperimento si può realizzare
Le quantità chimiche un modo per contare gli atomi...
 Secondo la teoria atomica di Dalton la è un elemento distintivo tra atomi Le quantità chimiche un modo er contare gli atomi... ATOMI DIVERSI HANNO MASSA DIVERSA Ma come ossiamo determinare la di un atomo?
Secondo la teoria atomica di Dalton la è un elemento distintivo tra atomi Le quantità chimiche un modo er contare gli atomi... ATOMI DIVERSI HANNO MASSA DIVERSA Ma come ossiamo determinare la di un atomo?
termodinamico viene fatta attraverso la seguente procedura:
 Misura empirica della temperatura A.A. 214-215 l associazione di un valore della temperatura ad ogni stato di equilibrio termico di un sistema termodinamico viene fatta attraverso la seguente procedura:
Misura empirica della temperatura A.A. 214-215 l associazione di un valore della temperatura ad ogni stato di equilibrio termico di un sistema termodinamico viene fatta attraverso la seguente procedura:
TEORIA CINETICA DEI GAS
 TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
SCALA TERMOMETRICA CELSIUS
 TERMOLOGIA TEMPERATURA LA TEMPERATURA E UN INDICE DELLA SENSAZIONE FISIOLOGICA DI CALDO/FREDDO. A LIVELLO MICROSCOPICO E INDICE DELLO STATO DI AGITAZIONE TERMICA MOLECOLARE, ESSENDO PROPORZIONALE ALLA
TERMOLOGIA TEMPERATURA LA TEMPERATURA E UN INDICE DELLA SENSAZIONE FISIOLOGICA DI CALDO/FREDDO. A LIVELLO MICROSCOPICO E INDICE DELLO STATO DI AGITAZIONE TERMICA MOLECOLARE, ESSENDO PROPORZIONALE ALLA
La temperatura e il calore. Documento riadattato da MyZanichelli.it Isabella Soletta Febbraio 2012 Parte 1/3
 La temperatura e il calore Documento riadattato da MyZanichelli.it Isabella Soletta Febbraio 2012 Parte 1/3 Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti
La temperatura e il calore Documento riadattato da MyZanichelli.it Isabella Soletta Febbraio 2012 Parte 1/3 Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti
10. LA MISURA DELLA TEMPERATURA
 1. LA MISURA DELLA TEMPERATURA 1.1 L organizzazione della materia Tutte le sostanze sono composte da atomi. Quando due o più atomi si legano assieme formano molecole. Atomi o molecole sono le unità (particelle)
1. LA MISURA DELLA TEMPERATURA 1.1 L organizzazione della materia Tutte le sostanze sono composte da atomi. Quando due o più atomi si legano assieme formano molecole. Atomi o molecole sono le unità (particelle)
A1. Soluzione. Ilcalore Q per unita di massa e negativo (ceduto all esterno) e vale:
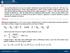 A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
i tre stati di aggregazione
 Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
temperatura ambientale massa totale d aria contenuta nella stanza temperatura raggiunta nella stanza dalla massa d aria pressione atmosferica
 Esercizio n.21 di pagina 26. L 1 = 6 m L 2 = 8 m L 3 = 10 m t 0F = 20 F M = 28.8 kg/kmol = 28.8 g/mol m =? t 1F = 75 F p a = 1.013 10 5 Pa temperatura ambientale massa molecolare media dell aria massa
Esercizio n.21 di pagina 26. L 1 = 6 m L 2 = 8 m L 3 = 10 m t 0F = 20 F M = 28.8 kg/kmol = 28.8 g/mol m =? t 1F = 75 F p a = 1.013 10 5 Pa temperatura ambientale massa molecolare media dell aria massa
Tonzig La fisica del calore
 0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
TERMOLOGIA esercizi risolti Classi quarte L.S.
 TERMOLOGIA esercizi risolti Classi quarte L.S. In questa dispensa verrà riportato lo svolgimento di alcuni esercizi inerenti la termologia e le leggi dei gas. Riprendiamo alcuni concetti utili. Temperatura
TERMOLOGIA esercizi risolti Classi quarte L.S. In questa dispensa verrà riportato lo svolgimento di alcuni esercizi inerenti la termologia e le leggi dei gas. Riprendiamo alcuni concetti utili. Temperatura
1.Pressione di un Gas
 1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: dv dp. dv dt. nrt dt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
Lezione 25: Un approccio macroscopico all equazione dei gas
 Lezione 25 - pag.1 Lezione 25: Un approccio macroscopico all equazione dei gas 25.1. Dal micro al macro Nella lezione 22 abbiamo costruito un modello microscopico che spiega bene alcune caratteristiche
Lezione 25 - pag.1 Lezione 25: Un approccio macroscopico all equazione dei gas 25.1. Dal micro al macro Nella lezione 22 abbiamo costruito un modello microscopico che spiega bene alcune caratteristiche
Leggi dei gas Equazione di stato dei gas perfetti
 Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
ATOMI E MOLECOLE. ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche.
 1 ATOMI E MOLECOLE ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche. SIMBOLO ATOMICO= 1 o 2 lettere che identificano elemento A= numero di massa (protoni+neutroni) Z=
1 ATOMI E MOLECOLE ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche. SIMBOLO ATOMICO= 1 o 2 lettere che identificano elemento A= numero di massa (protoni+neutroni) Z=
LA 1 a LEGGE DI VOLTA E GAY LUSSAC O DELLE ISOBARICHE
 1 LA 1 a LEGGE DI VOLTA E GAY LUSSAC O DELLE ISOBARICHE L energia si presenta in diverse forme e una delle più importanti è il calore. I fenomeni naturali sono quasi sempre accompagnati da sviluppo o assorbimento
1 LA 1 a LEGGE DI VOLTA E GAY LUSSAC O DELLE ISOBARICHE L energia si presenta in diverse forme e una delle più importanti è il calore. I fenomeni naturali sono quasi sempre accompagnati da sviluppo o assorbimento
TERMODINAMICA. Il sistema è il corpo o l insieme dei corpi sotto esame.
 TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
LA MATERIA ED I SUOI STATI
 LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
Lo stato gassoso e le sue proprietà
 Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Gas perfetti e sue variabili
 Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
La temperatura. La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso
 1 La temperatura La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso Qualunque sia lo stato di aggregazione, le particelle (molecole o atomi) di cui è fatta
1 La temperatura La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso Qualunque sia lo stato di aggregazione, le particelle (molecole o atomi) di cui è fatta
Primo principio della Termodinamica
 rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
Applicazione del principio di conservazione dell energia a sistemi aventi un gran numero di particelle.
 PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
Università degli Studi di Firenze Facoltà di Scienze Mat., Fis. e Nat. Corso di Laurea in Matematica
 Università degli Studi di Firenze Facoltà di Scienze Mat., Fis. e Nat. Corso di Laurea in Matematica Appunti del corso di Laboratorio di Fisica 1 Anno Accademico 2008-2009 Prof. Andrea Stefanini Appunti
Università degli Studi di Firenze Facoltà di Scienze Mat., Fis. e Nat. Corso di Laurea in Matematica Appunti del corso di Laboratorio di Fisica 1 Anno Accademico 2008-2009 Prof. Andrea Stefanini Appunti
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
ESAME DI AMMISSIONE ALLA TERZA LICEO SCIENZE SPERIMENTALI: FISICA
 LICO CANTONAL DI LUGANO 2 SAM DI AMMISSION ALLA TRZA LICO SCINZ SRIMNTALI: FISICA COGNOM: NOM:...... RONINZA SCOLASTICA:. unti esercizi 1 2 3 TOT 18 4 3 25 unti fatti Nota SRCIZIO 1 Annerire o crociare
LICO CANTONAL DI LUGANO 2 SAM DI AMMISSION ALLA TRZA LICO SCINZ SRIMNTALI: FISICA COGNOM: NOM:...... RONINZA SCOLASTICA:. unti esercizi 1 2 3 TOT 18 4 3 25 unti fatti Nota SRCIZIO 1 Annerire o crociare
UNITA DI MISURA. Le unità di misura sono molto importanti
 Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
approfondimento Fasi e cambiamenti di fase
 approfondimento Fasi e cambiamenti di fase Gas ideali e gas reali Teoria cinetica dei gas e conseguenze Cambiamenti di fase e conservazione della energia Gas ideali e gas reali In un gas ideale: l interazione
approfondimento Fasi e cambiamenti di fase Gas ideali e gas reali Teoria cinetica dei gas e conseguenze Cambiamenti di fase e conservazione della energia Gas ideali e gas reali In un gas ideale: l interazione
-GAS IDEALI- Le particelle che costituiscono un gas ideale:
 -GAS IDEALI- Le particelle che costituiscono un gas ideale: sono in movimento continuo e casuale hanno un volume trascurabile rispetto al volume totale a disposizione del gas non interagiscono fra loro
-GAS IDEALI- Le particelle che costituiscono un gas ideale: sono in movimento continuo e casuale hanno un volume trascurabile rispetto al volume totale a disposizione del gas non interagiscono fra loro
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Massa 8 giugno 2016 Gli alunni. L insegnante
 Programma di fisica classe 1^F a.s. 2015-16 Cap. 1 Paragrafo 3, le grandezze fisiche e la loro misura. Paragrafo 5, le grandezze derivate, area e volume e densità. Cap. 2 Paragrafo 1, gli strumenti di
Programma di fisica classe 1^F a.s. 2015-16 Cap. 1 Paragrafo 3, le grandezze fisiche e la loro misura. Paragrafo 5, le grandezze derivate, area e volume e densità. Cap. 2 Paragrafo 1, gli strumenti di
Termologia. Paolo Bagnaia - CTF Esercizi di termologia e termodinamica 1
 ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
Temperatura. Temperatura
 TERMOMETRIA E CALORE Che cos è la? Grandezza che misura l energia accumulata da un corpo come energia 2 La regola molti processi chimico fisici, quali ad esempio la formazione delle calotte polari, le
TERMOMETRIA E CALORE Che cos è la? Grandezza che misura l energia accumulata da un corpo come energia 2 La regola molti processi chimico fisici, quali ad esempio la formazione delle calotte polari, le
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Per quanto detto prima il fenomeno di svuotamento termina quando la pressione di ristagno è pari a:
 Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
TERMOLOGIA & TERMODINAMICA I
 TERMOLOGIA & TERMODINAMICA I 1 Meccanica: studia il moto dei corpi e le cause che lo genera Grandezze meccaniche: massa, velocità, accelerazione, forza, energia Struttura atomica dei gas: particelle tutte
TERMOLOGIA & TERMODINAMICA I 1 Meccanica: studia il moto dei corpi e le cause che lo genera Grandezze meccaniche: massa, velocità, accelerazione, forza, energia Struttura atomica dei gas: particelle tutte
Temperatura, calore e prima legge termodinamica
 Temperatura, calore e prima legge termodinamica Principio di conservazione Energia ΔE tot = ΔE i = ΔT tot = ΔT j = L +Q +... Energia Termica - Calore Temperatura Conservazione energia Forme di energia
Temperatura, calore e prima legge termodinamica Principio di conservazione Energia ΔE tot = ΔE i = ΔT tot = ΔT j = L +Q +... Energia Termica - Calore Temperatura Conservazione energia Forme di energia
Istituzione di Fisica Statistica
 Istituzione di Fisica Statistica Comito e rova arziale (December 9, 004) Mattia Donega 8 dicembre 006 Esercizio Un gas classico di N articelle di massa m in equilibrio alla temeratura T è riartito fra
Istituzione di Fisica Statistica Comito e rova arziale (December 9, 004) Mattia Donega 8 dicembre 006 Esercizio Un gas classico di N articelle di massa m in equilibrio alla temeratura T è riartito fra
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
Le proprietà delle sostanze temperatura
 la ci fornisce una misura di quanto un corpo è caldo o freddo La sensazione di caldo e di freddo che si ha toccando un corpo è soggettiva (una persona può sentire l oggetto caldo, un altra persona può
la ci fornisce una misura di quanto un corpo è caldo o freddo La sensazione di caldo e di freddo che si ha toccando un corpo è soggettiva (una persona può sentire l oggetto caldo, un altra persona può
UGELLO CONVERGENTE. Dai valori noti si ricava: = = e quindi il rapporto: p a
 UGELLO CONVERGENE. Si consideri un ugello convergente che scarica in ambiente ( a atm). Sono noti la temeratura di ristagno K, il diametro di uscita dell ugello D.m e la differenza di ressione tra monte
UGELLO CONVERGENE. Si consideri un ugello convergente che scarica in ambiente ( a atm). Sono noti la temeratura di ristagno K, il diametro di uscita dell ugello D.m e la differenza di ressione tra monte
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
Termodinamica: introduzione
 Termodinamica: introduzione La Termodinamica studia i fenomeni che avvengono nei sistemi in seguito a scambi di calore (energia termica) ed energia meccanica, a livello macroscopico. Qualche concetto rilevante
Termodinamica: introduzione La Termodinamica studia i fenomeni che avvengono nei sistemi in seguito a scambi di calore (energia termica) ed energia meccanica, a livello macroscopico. Qualche concetto rilevante
GAS IDEALI (o gas perfetti )
 GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
Lezione 10. Cenni di Termodinamica. Temperatura e calore Definizione e misura della temperatura Calore Principi della Termodinamica
 Lezione 10 Cenni di Termodinamica Temperatura e calore Definizione e misura della temperatura Calore Principi della Termodinamica Trasporto del calore Fisica Generale per Architettura - G. Cantatore 1
Lezione 10 Cenni di Termodinamica Temperatura e calore Definizione e misura della temperatura Calore Principi della Termodinamica Trasporto del calore Fisica Generale per Architettura - G. Cantatore 1
Un po di storia. Nel 1600 (Galilei muore nel 1642) si capisce che i gas non sono eterei. Si studiano nel contempo i fenomeni termici
 Temperatura 1 Un po di storia Nel 1600 (Galilei muore nel 1642) si capisce che i gas non sono eterei Torricelli (1608-1647) crea il vuoto Newton diceva che non poteva esistere in Natura Si studiano nel
Temperatura 1 Un po di storia Nel 1600 (Galilei muore nel 1642) si capisce che i gas non sono eterei Torricelli (1608-1647) crea il vuoto Newton diceva che non poteva esistere in Natura Si studiano nel
FISICA. V [10 3 m 3 ]
![FISICA. V [10 3 m 3 ] FISICA. V [10 3 m 3 ]](/thumbs/24/2838543.jpg) Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
SISTEMI E STATI TERMODINAMICI
 ittorio Mussino: vittorio.mussino@olito.it SISEMI E SI ERMODINMICI Nel corso di Fisica I (meccanica), si sono determinate le leggi che governano il moto dei sistemi di articelle (discreti e continui) e
ittorio Mussino: vittorio.mussino@olito.it SISEMI E SI ERMODINMICI Nel corso di Fisica I (meccanica), si sono determinate le leggi che governano il moto dei sistemi di articelle (discreti e continui) e
Ripasso sulla temperatura, i gas perfetti e il calore
 Ripasso sulla temperatura, i gas perfetti e il calore Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia La temperatura Fenomeni non interpretabili con le leggi della meccanica Dilatazione
Ripasso sulla temperatura, i gas perfetti e il calore Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia La temperatura Fenomeni non interpretabili con le leggi della meccanica Dilatazione
Legge del gas perfetto e termodinamica
 Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Tonzig La fisica del calore
 4 onzig La fisica del calore batiche si trova 2 / = / 4, il che vuol dire che la [F] si riduce alla [E]. Ne deriva che, nello secifico caso di un gas erfetto, il rendimento di un ciclo di Carnot è [G]
4 onzig La fisica del calore batiche si trova 2 / = / 4, il che vuol dire che la [F] si riduce alla [E]. Ne deriva che, nello secifico caso di un gas erfetto, il rendimento di un ciclo di Carnot è [G]
Calorimetria. Principio zero Trasformazioni termodinamiche Lavoro termodinamico
 Calorimetria Principio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una particella è definito quando per ogni istante siano note, la posizione (x,
Calorimetria Principio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una particella è definito quando per ogni istante siano note, la posizione (x,
Stati di aggregazione della materia. GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti
 9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
1 I gas perfetti COORDINATE TERMODINAMICHE
 Durante un viaggio può capitare di vedere i pezzi di un pneumatico esploso. Succede più spesso d estate o d inverno? Secondo te qual è la causa dell esplosione? Quando l aria contenuta in un pneumatico
Durante un viaggio può capitare di vedere i pezzi di un pneumatico esploso. Succede più spesso d estate o d inverno? Secondo te qual è la causa dell esplosione? Quando l aria contenuta in un pneumatico
Fisica dell Atmosfera e del Clima
 Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
CALORE E TEMPERATURA
 CALORE E TEMPERATURA Indice Obiettivi L agitazione termica La dilatazione termica La misura della temperatura Lo stato fisico della materia Flussi di calore ed equilibrio termico La propagazione del calore
CALORE E TEMPERATURA Indice Obiettivi L agitazione termica La dilatazione termica La misura della temperatura Lo stato fisico della materia Flussi di calore ed equilibrio termico La propagazione del calore
Termodinamica. energia associata ai componenti microscopici (atomi-molecole) del sistema.
 ermodinamica studio delle trasformazioni reciproche di energia: energia meccanica [lavoro, energia cinetica e potenziale] energia interna-termica [forma disordinata di energia, moto molecole] E int def
ermodinamica studio delle trasformazioni reciproche di energia: energia meccanica [lavoro, energia cinetica e potenziale] energia interna-termica [forma disordinata di energia, moto molecole] E int def
Università degli Studi di Milano. Facoltà di Scienze Matematiche Fisiche e Naturali
 Università degli Studi di Milano Facoltà di Scienze Matematiche Fisiche e Naturali Corsi di Laurea in: Informatica ed Informatica per le Telecomunicazioni Anno accademico 2010/11, Laurea Triennale, Edizione
Università degli Studi di Milano Facoltà di Scienze Matematiche Fisiche e Naturali Corsi di Laurea in: Informatica ed Informatica per le Telecomunicazioni Anno accademico 2010/11, Laurea Triennale, Edizione
Campioni primari e secondari di temperatura Scala ITS-90
 Campioni primari e secondari di temperatura Scala ITS-90 Unità di misura della temperatura Definizione del kelvin ( K ): Il kelvin è definito come 1/273,16 della temperatura termodinamica del punto triplo
Campioni primari e secondari di temperatura Scala ITS-90 Unità di misura della temperatura Definizione del kelvin ( K ): Il kelvin è definito come 1/273,16 della temperatura termodinamica del punto triplo
Fondamenti di Meteorologia e Climatologia
 Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Conduttanza Q Δ. m s P > P 1 P 2 Q > Vuoto e Spettrometria di Massa
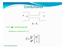 Conduttanza P P 2 Q > Se ΔP P 0 ; si ha flusso di gas (Q): P > P 2 Si definisce conduttanza ( C ): Q C= Δ P 3 m s Altre equazioni maestre Per dimensionare un sistema da vuoto, individuata la grandezza
Conduttanza P P 2 Q > Se ΔP P 0 ; si ha flusso di gas (Q): P > P 2 Si definisce conduttanza ( C ): Q C= Δ P 3 m s Altre equazioni maestre Per dimensionare un sistema da vuoto, individuata la grandezza
Enunciato di Kelvin-Plank
 ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
MISURE DI TEMPERATURA
 MISURE DI TEMPERATURA vuoto Termometro a gas a volume costante TEMPERATURA TERMODINAMICA La temperatura T R di un serbatoio è definita come segue. Sia R un serbatoio termico assegnato e sia R 0 un serbatoio
MISURE DI TEMPERATURA vuoto Termometro a gas a volume costante TEMPERATURA TERMODINAMICA La temperatura T R di un serbatoio è definita come segue. Sia R un serbatoio termico assegnato e sia R 0 un serbatoio
Descrizione macroscopica e microscopica
 Descrizione macroscopica e microscopica Per analizzare una situazione fisica si deve definire qual è il sistema e qual è l'ambiente esterno. Si studia poi come il sistema interagisce con l'ambiente esterno
Descrizione macroscopica e microscopica Per analizzare una situazione fisica si deve definire qual è il sistema e qual è l'ambiente esterno. Si studia poi come il sistema interagisce con l'ambiente esterno
Stati di aggregazione della materia
 Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
Temperatura Calore Trasformazioni termodinamiche
 I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione i del calore Termoregolazione del corpo umano pag.1
I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione i del calore Termoregolazione del corpo umano pag.1
Corso di Laurea in Ing. Gestionale ESERCIZI DI TERMODINAMICA PER IL CORSO DI FISICA TECNICA
 Corso di laurea in Ingegneria Gestionale Aggiornato a ottobre 2016 Corso di Laurea in Ing. Gestionale ESERCIZI DI TERMODINAMICA PER IL CORSO DI FISICA TECNICA 1. TERMODINAMICA DEGLI STATI 2. SISTEMI CHIUSI
Corso di laurea in Ingegneria Gestionale Aggiornato a ottobre 2016 Corso di Laurea in Ing. Gestionale ESERCIZI DI TERMODINAMICA PER IL CORSO DI FISICA TECNICA 1. TERMODINAMICA DEGLI STATI 2. SISTEMI CHIUSI
TERMODINAMICA stato gassoso. TERMODINAMICA stato gassoso. Elio GIROLETTI - Università degli Studi di Pavia, Dip. Fisica nucleare e teorica
 UNIERSITÀ DEGLI STUDI DI PAIA dip. Fisica nucleare e teorica via Bassi 6, 27100 Pavia, Italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro 1 elio giroletti TERMODINAMICA stato gassoso FISICA
UNIERSITÀ DEGLI STUDI DI PAIA dip. Fisica nucleare e teorica via Bassi 6, 27100 Pavia, Italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro 1 elio giroletti TERMODINAMICA stato gassoso FISICA
Le dimensioni rappresentano il concetto di misura fondamentali: lunghezza, tempo, massa, temperatura,
 Dimensioni e unità Le dimensioni rappresentano il concetto di misura fondamentali: lunghezza, tempo, massa, temperatura, derivate: energia, forza, velocità, pressione, Le unità sono i mezzi utilizzati
Dimensioni e unità Le dimensioni rappresentano il concetto di misura fondamentali: lunghezza, tempo, massa, temperatura, derivate: energia, forza, velocità, pressione, Le unità sono i mezzi utilizzati
Capitolo 5 La quantità chimica: la mole
 Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
[E] l energia occorrente per innalzare di 1 K la temperatura di 1 Mol di sostanza.
![[E] l energia occorrente per innalzare di 1 K la temperatura di 1 Mol di sostanza. [E] l energia occorrente per innalzare di 1 K la temperatura di 1 Mol di sostanza.](/thumbs/54/33206954.jpg) 1. Il calore specifico di una sostanza è: [A] La quantità di calore contenuta nella massa di una determinata sostanza; [B] la massima temperatura che la sostanza può raggiungere; [C] l energia occorrente
1. Il calore specifico di una sostanza è: [A] La quantità di calore contenuta nella massa di una determinata sostanza; [B] la massima temperatura che la sostanza può raggiungere; [C] l energia occorrente
Stati d aggregazione della materia
 Stati d aggregazione della materia SOLIDO: Forma e volume propri. GASSOSO: Forma e volume del recipiente in cui è contenuto. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. Parametri
Stati d aggregazione della materia SOLIDO: Forma e volume propri. GASSOSO: Forma e volume del recipiente in cui è contenuto. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. Parametri
La misura della temperatura
 Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Lezione 10 Moto dei fluidi
 Lezione 10 Moto dei fluidi Caratterizzazione del moto Consideriamo soltanto il caso di liquidi in moto nei condotti. Parametri descrittivi del moto: Portata Q di un condotto: è il volume di liquido che
Lezione 10 Moto dei fluidi Caratterizzazione del moto Consideriamo soltanto il caso di liquidi in moto nei condotti. Parametri descrittivi del moto: Portata Q di un condotto: è il volume di liquido che
PDF Compressor Pro. Temperatura e calore. Prof Giovanni Ianne
 Temperatura e calore Prof Giovanni Ianne LA TEMPERATURA La temperatura è la grandezza fisica che si misura con il termometro. La temperatura nel Sistema Internazionale si misura in gradi Kelvin (simbolo
Temperatura e calore Prof Giovanni Ianne LA TEMPERATURA La temperatura è la grandezza fisica che si misura con il termometro. La temperatura nel Sistema Internazionale si misura in gradi Kelvin (simbolo
Sistemi Gassosi. GAS = specie che occupa tutto lo spazio disponibile. VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 )
 Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Teoria e Pratica del Laboratorio Didattico di Fisica II. Corso SSIS settembre-ottobre Lezione 1
 Teoria e Pratica del Laboratorio Didattico di Fisica II. Corso SSIS settembre-ottobre 2007 Lezione 1 Scopo della Fisica Grandezza fisica Operazione di misura Misure dirette e indirette Sistema di unità
Teoria e Pratica del Laboratorio Didattico di Fisica II. Corso SSIS settembre-ottobre 2007 Lezione 1 Scopo della Fisica Grandezza fisica Operazione di misura Misure dirette e indirette Sistema di unità
PRESSIONE GAS PERFETTI
 1 PRESSIONE 1. (Da Veterinaria 2002) Il sangue che scorre nelle arterie dell uomo, come noto, ha una certa pressione. Quale tra le seguenti unità di misura (o simboli) potrebbe essere correttamente usata
1 PRESSIONE 1. (Da Veterinaria 2002) Il sangue che scorre nelle arterie dell uomo, come noto, ha una certa pressione. Quale tra le seguenti unità di misura (o simboli) potrebbe essere correttamente usata
STATO GASSOSO. parte I a. - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio
 STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
Fluido in movimento. Linee di flusso.
 Fluido in moimento. Linee di flusso. Raresentazione del moto di un fluido. Linea di flusso: linea in ogni unto tangente alla elocità del fluido; indica la direzione del flusso isualizzabili mediante filetti
Fluido in moimento. Linee di flusso. Raresentazione del moto di un fluido. Linea di flusso: linea in ogni unto tangente alla elocità del fluido; indica la direzione del flusso isualizzabili mediante filetti
L energia cinetica si conserva solo negli urti elastici, mentre la quantità di moto si conserva in ogni urto.
 Saperi minimi di Fisica prof. Angelo Vitiello T 1 Generalità, Lavoro ed Energia Il lavoro è quella grandezza che si ottiene facendo il prodotto della forza agente su un punto per lo spostamento che esso
Saperi minimi di Fisica prof. Angelo Vitiello T 1 Generalità, Lavoro ed Energia Il lavoro è quella grandezza che si ottiene facendo il prodotto della forza agente su un punto per lo spostamento che esso
PROBLEMI E QUESITI DI TERMOLOGIA (ENUNCIATI) INTRODUZIONE a cura di Nicola SANTORO
 1 PROBLEMI E QUESITI DI TERMOLOGIA (ENUNCIATI) INTRODUZIONE a cura di Nicola SANTORO I problemi ed i quesiti di Termologia che seguono sono il frutto di esperienze da me compiute principalmente nei licei
1 PROBLEMI E QUESITI DI TERMOLOGIA (ENUNCIATI) INTRODUZIONE a cura di Nicola SANTORO I problemi ed i quesiti di Termologia che seguono sono il frutto di esperienze da me compiute principalmente nei licei
SISTEMA INTERNAZIONALE (S.I.) Le grandezze che si possono misurare sono dette grandezze fisiche.
 1. GRANDEZZE FONDAMENTALI SISTEMA INTERNAZIONALE (S.I.) Le grandezze che si possono misurare sono dette grandezze fisiche. Secondo il Sistema Internazionale (SI) ci sono sette grandezze fondamentali. 2.
1. GRANDEZZE FONDAMENTALI SISTEMA INTERNAZIONALE (S.I.) Le grandezze che si possono misurare sono dette grandezze fisiche. Secondo il Sistema Internazionale (SI) ci sono sette grandezze fondamentali. 2.
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
CALORE E TERMODI NAMI CA - PRI MO PRI NCI PI O
 CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
