CINETICA CHIMICA. Ogni reazione chimica però impiega un certo tempo per raggiungere le condizioni di equilibrio.
|
|
|
- Lidia Rizzi
- 6 anni fa
- Visualizzazioni
Transcript
1 Facendo reagire delle sostanze si arriva ad uno stato di equilibrio in cui le concentrazioni di reagenti e prodotto rispettano la legge di equilibrio chimico, definita da una costante di equilibrio. Ogni reazione chimica però impiega un certo tempo per raggiungere le condizioni di equilibrio. Ad esempio: 2H 2 (g) + O 2 (g) 2H 2 O(g) K p = 1,1 x atm -1 a 25 C Il valore della costante è così alto che la reazione può essere considerata quantitativa. Questa reazione è estremamente lenta a 25 C e di fatto non avviene se non in tempi lunghissimi (dell ordine dei secoli). H 2 e O 2, in presenza l uno dell altro a 25 C rappresentano un sistema non stabile da un punto di vista termodinamico, ossia si trovano in uno stato di non equilibrio e dovrebbero reagire l un con l altro per raggiungere uno stato stabile di equilibrio. Il sistema però è stabile cineticamente, ossia la velocità di reazione è pressochè nulla.
2 Non esiste una relazione tra costante di equilibrio e il tempo necessario per raggiungerlo La Cinetica Chimica studia: la velocità delle reazioni chimiche I fattori che influenzano la velocità di una reazione i meccanismi alla base delle reazioni
3 La velocità di reazione Se si considera, ad esempio, la reazione: N 2 O 4 (g) 2NO 2 (g) Supponendo di introdurre in un recipiente chiuso solo N 2 O 4 (g), questo reagente si dissocia producendo NO 2 (g) fino a raggiungere lo stato di equilibrio, quando le concentrazioni dei due reagenti rimangono entrambi costanti. Variazione della concentrazione di N 2 O 4 (g) (curva verde) e di NO 2 (g) (curva rossa) in funzione del tempo.
4 La velocità di reazione R P Durante la reazione i reagenti diminuiscono di conseguenza R è negativa. Il segno (-) assicura che la velocità sia positiva. La velocità media di una reazione vale il cambiamento di concentrazione di una specie diviso il tempo che occorre per verificarsi. La velocità istantanea è la pendenza della tangente al grafico concentrazione tempo nell istante di interesse. Per la maggior parte delle reazioni la velocità diminuisce con il procedere della reazione.
5 Riprendiamo la reazione : N 2 O 4 (g) 2NO 2 (g) Va considerato che ogni mole di N 2 O 4 che si consuma produce due moli di NO 2 cioè la velocità con cui si forma NO 2 è il doppio di quella con cui si consuma N 2 O 4 In generale per la reazione: La velocità media/istantanea unica è data dal rapporto tra la velocità media/istantanea e il coefficiente stechiometrico della specie in esame.
6 La leggi cinetiche La legge cinetica è la relazione matematica che lega la velocità di reazione alla concentrazione dei reagenti. L andamento dei dati relativi alla velocità di reazione può spesso essere identificato usando la velocità iniziale di reazione. 2N 2 O 5 (g) 4NO 2 (g) + O 2 (g) Il grafico (b) è stato costruito riportando le 5 velocità iniziali dal grafico (a) in funzione della concentrazione iniziale di N 2 O 5. La velocità iniziale è direttamente proporzionale alla concentrazione iniziale di N 2 O 5. v = k [N 2 O 5 ] Reazione del primo ordine (a) (b)
7 La leggi cinetiche 2NO 2 (g) 2NO(g) + O 2 (g) v = k [NO 2 ] 2 Reazione del secondo ordine
8 Eccetto casi particolari, la velocità di reazione dipende, oltre che dalla temperatura, dalle concentrazioni dei reagenti e diminuisce al loro diminuire Per la reazione: In generale: v = k [A] m [B] n legge cinetica della reazione k: costante di velocità della reazione m + n : ordine di reazione In generale, l ordine di reazione non dipende dai coefficienti stechiometrici della reazione, ma deve essere determinato sperimentalmente caso per caso
9 Legge cinetica integrata del primo ordine N 2 O 5 (g) 2NO 2 (g) + 1/2 O 2 (g) v = k [N 2 O 5 ] v = - d[n 2 O 5 ] / dt - d[n 2 O 5 ] / dt = k [N 2 O 5 ] In generale, nelle reazioni del primo ordine - dc / dt = kc (C concentrazione di un generico reagente) - dc / C = k dt - dc / dt = kc è definita equazione cinetica differenziale
10 Legge cinetica integrata del primo ordine Integrando tra il tempo iniziale 0 in cui la concentrazione è C 0 e il tempo t in cui la concentrazione è C C = C 0 e -kt (equazione cinetica integrata per una reazione dei primo ordine) La concentrazione del reagente decade esponenzialmente. All inizio il cambiamento della concentrazione è rapido, ma con il trascorrere del tempo si fa più lento.
11 Legge cinetica integrata del primo ordine Nelle reazioni del primo ordine la concentrazione del reagente decade esponenzialmente con il tempo. Per accertare che una reazione sia del primo ordine si diagramma il logaritmo della concentrazione in funzione del tempo; in caso affermativo si ottiene retta la cui pendenza è k.
12 Legge cinetica integrata del primo ordine Il tempo di dimezzamento t 1/2 Il tempo di dimezzamento t 1/2 (o tempo di semi-trasformazione) è il tempo necessario perché la concentrazione si dimezzi, ossia per cui C/C 0 = 1/2 Nelle reazioni del 1 ordine t 1/2 = / k
13 Deduzione della legge cinetica aa + bb + cc + mm + nn + - d[a] dt = f([a], [B], [C], ) = k [A] [B] [C] Sperimentalmente si misura la variazione dei reagenti nel tempo e poi si cerca di integrare i dati sperimentali cioè la legge che meglio descrive l andamento della concentrazione nel tempo della specie chimica che viene seguita. Reazioni di primo ordine V = - d[a] dt = k[a] [A] t = [A] o e -kt t = ½ 0,693 k N.B. L ordine di una reazione è la somma degli esponenti delle concentrazioni nelle legge cinetica.
14 I meccanismi di reazione L ordine di reazione non è determinato dalla stechiometria della reazione, ma dal meccanismo di una reazione, che spesso può prevedere più stadi successivi (processi elementari o reazioni elementari) in ciascuno dei quali si forma un composto intermedio fino all ottenimento delle sostanze fianali. I composti intermedi non sono necessariamente rilevabili sperimentalmente ma spesso vengono suggeriti dalla legge di velocità della reazione medesima Il numero di molecole o ioni coinvolti in ciascun processo elementare determina la molecolarità del processo stesso. La molecolarità di un processo elementare non coincide in genere con l ordine della reazione globale. La molecolarità è un concetto terorico mediante il quale viene suggerito uno stadio del meccanismo della reazione, mentre l ordine di una reazione è un dato sperimentale ottenuto dalla legge di velocità
15 Molecolarità e meccanismo di una reazione La conoscenza per via sperimentale della legge cinetica di una reazione e quindi l ordine della stessa è il punto di partenza per indagarne il meccanismo. Il meccanismo di una reazione è dato da una successione di processi elementari in ciascuno dei quali si forma un composto intermedio fino all ottenimento delle sostanze finali. In ogni processo elementare possono essere coinvolte una o più molecole e questo viene indicato con il nome di molecolarità del processo elementare. La molecolarità (concetto teorico) di un processo elementare non coincide in genere con l ordine della reazione globale (dato sperimentale). A ciascuno dei processi elementari compete una caratteristica velocità espressa da una legge in cui gli esponenti delle concentrazioni dei reagenti coincidono con il relativo coefficiente stechiometrico. La velocità del processo globale è condizionata dalla velocità del processo più lento.
16 I meccanismi di reazione 2NO(g) + O 2 (g) 2NO 2 (g) v = k [NO] 2 [O 2 ] Dall ordine 3 di reazione si potrebbe dedurre che la reazione avvenga con un singolo processo elemenatre trimolecolare nel quale vengono coinvolte contemporaneamente due molecole di NO e una di O 2. Poiché i processi elementari trimolecolari sono poco probabili, si può suggerire un meccanismo che procede attraverso due processi elementari trimolecolari: NO(g) + O 2 (g) NO 3 (g) (processo elementare bimolecolare) NO 3 (g) + NO(g) 2NO 2 (g) (processo elementare bimolecolare) 2NO(g) + O 2 (g) 2NO 2 (g) (Processo globale) A ciascuno dei processi elementari compete una velocità di reazione che è espressa da una legge in cui le potenze delle concentrazioni coincidono con il relativo coefficiente stechiometrico.
17 I meccanismi di reazione 2NO(g) + O 2 (g) 2NO 2 (g) v = k [NO] 2 [O 2 ] Una condizione necessaria affinchè un meccanismo di reazione possa essere considerato valido è che rispetti la legge di velocità di reazione sperimentale. NO(g) + O 2 (g) NO 3 (g) NO 3 (g) + NO(g) 2NO 2 (g) veloce lento La velocità di una reazione è determinata dallo stadio più lento v = k 1 [NO 3 ] [NO] [NO 3 ] = K 2 [NO] [O 2 ] v = k 1 K 2 [NO] [O 2 ] [NO] = k [NO] 2 [O 2 ]
18 I meccanismi di reazione La reazione segue una cinetica del 2 ordine Il meccanismo è costituito da due processi elementari La velocità di una reazione è determinata dallo stadio più lento k = k K
19 La teoria collisionale Una reazione avviene in seguito agli urti tra ioni o molecole che partecipano alla reazione Ad esempio: v = k [CO] [NO 2 ]
20 In realtà perché la reazione avvenga occorre che: 1) Le due molecole abbiano la giusta orientazione reciproca quando collidono 2) Le molecole devono possedere un energia uguale o superiore di un energia di soglia, definita energia di attivazione E a La costante di velocità è determinata da tre contributi: k = Z x p x f Z: frequenza con cui avvengono gli urti (numero delle collisioni per unità di tempo) p: fattore sterico. Tiene conto che le collisioni sono efficaci solo per certe orientazioni delle molecole f: frazione di molecole che ha un energia sufficiente per reagire (energia maggiore di un energia di soglia definita energia di attivazione
21 Le molecole devo urtarsi secondo orientazioni opportune che rendano l urto efficace. E determinante anche la sezione d urto ( ) cioè l area che le molecole espongono come bersaglio nel corso della collisione. Maggiore è la sezione d urto e maggiore sraà la frequenza degli urti.
22 Lo stato di transizione e l energia di attivazione (Stato di transizione) Perché la reazione possa avvenire, le due molecole reagenti devono avvicinarsi a tal punto che le loro nuvole elettroniche interagiscono. L energia sale fino a un massimo, che corrisponde allo stato di transizione (complesso attivato)
23 frazione di molecole con energia E CINETICA CHIMICA (Stato di transizione) Solo le molecole reagenti con E E a hanno un energia sufficiente per poter superare la barriera energetica e dar luogo ai prodotti di reazione. Il loro numero dipende dalla temperatura ed aumenta con essa. N = numero totale di molecole di una data massa di gas N E = numero di molecole che possiedono energia cinetica E
24 La dipendenza della costante di velocità dalla temperatura è determinata dalla legge di Arrhenius: k = A e -Ea/RT A (fattore di frequenza) tiene conto della frequenza degli urti, e dell orientazione delle molecole e della sezione d urto.
25 E a E RT k A e ln k a ln A RT
26
27 Le reazioni a più stadi Le reazioni costituite da più processi elementari hanno profili cinetici più complessi, con un massimo di energia in corrispondenza di ciascun processo. La velocità della reazione è determinato dal processo più lento, caratterizzato dal massimo ad energia più alta. L energia di questo stadio definisce l energia di attivazione dell intera reazione
28 La catalisi E possibile aumentare la velocità di una reazione utilizzando un catalizzatore, cioè una sostanza che fa cambiare il percorso seguito dalla reazione facendola passare da uno caratterizzato da un energia di attivazione più bassa. I prodotti di reazione non sono alterati dall azione del catalizzatore Il catalizzatore si trova inalterato al termine della reazione
29 Si parla di catalisi in fase omogenea quando il catalizzatore è nella stessa fase dei reagenti. Il catalizzatore accelera la reazione formando generalmente un intermedio che porta a un nuovo percorso della reazione con E a più bassa. Questa reazione è molto lenta ma viene catalizzata dalla presenza di ioduro Stadio 1 Stadio 2 H 2 O + IO - 2H 2 O 2 + I - 2H 2 O 2 + O 2 + I -
30 Quando il catalizzatore non è nella stessa fase dei reagenti si parla di catalisi eterogenea Un esempio può essere il caso di alcuni metalli di transizione, che, allo stato solido, catalizzano numerose reazioni di importanza industriale che avvengono in soluzione o allo stato gassoso Ad esempio, la marmitta catalitica sfrutta l azione metalli quali Pt e Rh. Rh
La cinetica chimica. Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento)
 La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Esistono reazioni energeticamente favorite (ΔH<0) che non avvengono.es. C(diamante) à C(grafite)
 CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
Velocità di reazione Una trasformazione chimica modifica completamente la natura delle sostanze iniziali ( i reagenti), formando altre specie (i prodo
 Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Cinetica chimica. Capitolo 13
 Cinetica chimica Capitolo 13 Cinetica chimica Termodinamica si verifica la reazione? Cinetica con che velocità si verifica la reazione? Velocità di reazione è la variazione di concentrazione di un reagente
Cinetica chimica Capitolo 13 Cinetica chimica Termodinamica si verifica la reazione? Cinetica con che velocità si verifica la reazione? Velocità di reazione è la variazione di concentrazione di un reagente
Le reazioni chimiche
 Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica Chimica. Cinetica chimica
 Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A
 1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
Cinetica Chimica. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Cinetica Chimica Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Cinetica Chimica Termodinamica la reaction avrà luogo? Cinetica quanto sarà veloce la reazione?
Cinetica Chimica Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Cinetica Chimica Termodinamica la reaction avrà luogo? Cinetica quanto sarà veloce la reazione?
Legge dell azione di massa. Misura sperimentale della costante di equilibrio. Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Esistono reazioni energeticamente favorite ( H<0) che non avvengono.es. C(diamante) C(grafite)
 CINETICA CHIMICA Esistono reazioni energeticamente favorite ( H
CINETICA CHIMICA Esistono reazioni energeticamente favorite ( H
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
Reazioni opposte. Reazioni opposte o reversibili A + B 2C (k 1 e k -1 )
 Reazioni complesse Reazioni opposte o reversibili A B ( e - ) Reazioni consecutive A B C ( e ) Reazioni competitive o parallele A B ( ) A C ( ) Reazioni opposte Reazioni opposte o reversibili A + B C (
Reazioni complesse Reazioni opposte o reversibili A B ( e - ) Reazioni consecutive A B C ( e ) Reazioni competitive o parallele A B ( ) A C ( ) Reazioni opposte Reazioni opposte o reversibili A + B C (
VELOCITA DI REAZIONE
 VELOCITA DI REAZIONE Analogamente alla velocità di un corpo (velocità = distanza percorsa / tempo impiegato) la velocità di reazione è definita come la variazione di concentrazione dei prodotti o dei reagenti
VELOCITA DI REAZIONE Analogamente alla velocità di un corpo (velocità = distanza percorsa / tempo impiegato) la velocità di reazione è definita come la variazione di concentrazione dei prodotti o dei reagenti
La cinetica chimica. Velocità media di reazione
 La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA
 REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
CINETICA CHIMICA. ChimicaGenerale_lezione21 1
 CINETICA CHIMICA La cinetica chimica è lo studio della velocità delle reazioni chimiche, cioè della variazione delle concentrazione dei reagenti (o dei prodotti) in funzione del tempo. ChimicaGenerale_lezione21
CINETICA CHIMICA La cinetica chimica è lo studio della velocità delle reazioni chimiche, cioè della variazione delle concentrazione dei reagenti (o dei prodotti) in funzione del tempo. ChimicaGenerale_lezione21
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.V VERIFICA SE HAI CAPITO 10.B PRE-TEST ESERCIZI 10.
 VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.B PRE-TEST 10.C OBIETTIVI 10.3.2 CATALISI ETEROGENEA 10.3.3 CATALISI ENZIMATICA 10.V VERIFICA SE HAI CAPITO ESERCIZI 10.1 LA VELOCITA
VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.B PRE-TEST 10.C OBIETTIVI 10.3.2 CATALISI ETEROGENEA 10.3.3 CATALISI ENZIMATICA 10.V VERIFICA SE HAI CAPITO ESERCIZI 10.1 LA VELOCITA
LA VELOCITA DELLE REAZIONI
 LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
LA VELOCITA DELLE REAZIONI
 LA VELOCITA DELLE REAZIONI Classe 3 Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
LA VELOCITA DELLE REAZIONI Classe 3 Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
L equilibrio chimico dal punto di vista cinetico
 L chimico dal punto di vista cinetico L chimico dal punto di vista cinetico Ogni reazione, in un sistema chiuso, raggiunge uno stato di : Alto rendimento REAG PROD PROD REAG (Reaz. DIRETTA) (Reaz. INVERSA)
L chimico dal punto di vista cinetico L chimico dal punto di vista cinetico Ogni reazione, in un sistema chiuso, raggiunge uno stato di : Alto rendimento REAG PROD PROD REAG (Reaz. DIRETTA) (Reaz. INVERSA)
Reazione di Briggs Rauscher
 Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Modellistica dei Sistemi Biologici. Lezione 1 Introduzione alla Cinetica Chimica Fabio Mavelli
 Modellistica dei Sistemi Biologici Lezione 1 Introduzione alla Cinetica Chimica Fabio Mavelli 14 marzo 2012 Cinetica Chimica Branca della Chimica-Fisica che studia l evoluzione temporale dei Sistemi Chimici
Modellistica dei Sistemi Biologici Lezione 1 Introduzione alla Cinetica Chimica Fabio Mavelli 14 marzo 2012 Cinetica Chimica Branca della Chimica-Fisica che studia l evoluzione temporale dei Sistemi Chimici
ESERCIZI ESERCIZI. 3) Data la reazione chimica: H 2
 ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
Le reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Le reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO VIDEO Introduzione (I) La cinetica chimica è la branca della chimica che si interessa della velocità delle reazioni chimiche, cioè la variazione
Le reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO VIDEO Introduzione (I) La cinetica chimica è la branca della chimica che si interessa della velocità delle reazioni chimiche, cioè la variazione
Cinetica chimica. 2 H 2 (g) + O 2 (g) 2 H 2 O (g)
 Cinetica chimica 2 H 2 (g) + O 2 (g) 2 H 2 O (g) Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione La cinetica chimica A differenza della termodinamica
Cinetica chimica 2 H 2 (g) + O 2 (g) 2 H 2 O (g) Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione La cinetica chimica A differenza della termodinamica
Reazioni chimiche reversibili
 Reazioni chimiche reversibili In accordo all esperienza, la maggior parte delle reazioni chimiche possono procedere sia nel verso dai reagenti ai prodotti che nel verso opposto, cioè dai prodotti ai reagenti,
Reazioni chimiche reversibili In accordo all esperienza, la maggior parte delle reazioni chimiche possono procedere sia nel verso dai reagenti ai prodotti che nel verso opposto, cioè dai prodotti ai reagenti,
STUDIO SPERIMENTALE DELLA CINETICA DI UNA REAZIONE CHIMICA PER VIA CONDUTTOMETRICA
 STUDIO SPERIMENTALE DELLA CINETICA DI UNA REAZIONE CHIMICA PER VIA CONDUTTOMETRICA Lo scopo di questa esperienza è quello di vedere come sia possibile studiare, da un punto di vista cinetico, l'evolversi
STUDIO SPERIMENTALE DELLA CINETICA DI UNA REAZIONE CHIMICA PER VIA CONDUTTOMETRICA Lo scopo di questa esperienza è quello di vedere come sia possibile studiare, da un punto di vista cinetico, l'evolversi
delle curve isoterme dell anidride carbonica
 COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
Capitolo 18 L equilibrio chimico
 Capitolo 18 L equilibrio chimico 1. L equilibrio dinamico 2. L equilibrio chimico: anche i prodotti reagiscono 3. La costante di equilibrio 4. Il quoziente di reazione 5. La costante di equilibrio e la
Capitolo 18 L equilibrio chimico 1. L equilibrio dinamico 2. L equilibrio chimico: anche i prodotti reagiscono 3. La costante di equilibrio 4. Il quoziente di reazione 5. La costante di equilibrio e la
Introduzione alla cinetica chimica con esercizi
 Introduzione alla cinetica chimica con esercizi prerequisiti : conoscere la teoria particellare o cinetica della materia, sapere il significato di concentrazione, molarità, comprendere il concetto di equilibrio
Introduzione alla cinetica chimica con esercizi prerequisiti : conoscere la teoria particellare o cinetica della materia, sapere il significato di concentrazione, molarità, comprendere il concetto di equilibrio
LE REAZIONI CHIMICHE
 LE REAZIONI CHIMICHE Una reazione chimica è una trasformazione che comporta una nuova distribuzione degli atomi in una o più determinate sostanze Una reazione chimica è un processo dinamico in cui alcune
LE REAZIONI CHIMICHE Una reazione chimica è una trasformazione che comporta una nuova distribuzione degli atomi in una o più determinate sostanze Una reazione chimica è un processo dinamico in cui alcune
relazioni tra il calore e le altre forme di energia.
 Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Limiti del criterio della variazione entropia
 Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
L Equilibrio chimico
 L Equilibrio chimico 2SO 2 (g) + O 2 (g) 2SO 3 (g) EQUILIBRIO DINAMICO: un equilibrio in cui la costanza dei parametri che caratterizzano il sistema è dovuta alla uguaglianza di tendenze opposte. POSIZIONE
L Equilibrio chimico 2SO 2 (g) + O 2 (g) 2SO 3 (g) EQUILIBRIO DINAMICO: un equilibrio in cui la costanza dei parametri che caratterizzano il sistema è dovuta alla uguaglianza di tendenze opposte. POSIZIONE
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 21 L equilibrio chimico 3 Sommario 1. L equilibrio dinamico 2. L equilibrio chimico: anche i prodotti reagiscono 3. La costante
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 21 L equilibrio chimico 3 Sommario 1. L equilibrio dinamico 2. L equilibrio chimico: anche i prodotti reagiscono 3. La costante
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. a.a
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia a.a. 2016-17 Cinetica Chimica studia i fenomeni connessi con la VELOCITA di una REAZIONE Reazioni
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia a.a. 2016-17 Cinetica Chimica studia i fenomeni connessi con la VELOCITA di una REAZIONE Reazioni
- Equilibri omogenei: tutte le sostanze che partecipano alla reazione fanno parte della stessa fase:
 ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
EFFETTI DELLA NATURA DEI REAGENTI
 La Chimica studia le trasformazioni della materia attraverso lo studio delle reazioni chimiche. Le reazioni più comuni, in generale, vengono suddivise in: reazioni di sintesi reazioni che portano alla
La Chimica studia le trasformazioni della materia attraverso lo studio delle reazioni chimiche. Le reazioni più comuni, in generale, vengono suddivise in: reazioni di sintesi reazioni che portano alla
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Dipendenza dell'energia libera dalla T e P
 Dipendenza dell'energia libera dalla T e P G = H - TS essendo H = U + PV G = U + PV - TS Una variazione infinitesima di una o più variabili che definiscono lo stato del sistema determina una variazione
Dipendenza dell'energia libera dalla T e P G = H - TS essendo H = U + PV G = U + PV - TS Una variazione infinitesima di una o più variabili che definiscono lo stato del sistema determina una variazione
Per la stessa reazione possono essere utilizzati catalizzatori diversi. es. HCOOH H 2 + CO 2 viene catalizzata da Ni, Cd, Pt, Cu.
 CATALISI L'uso di un catalizzatore, sostanza capace di accelerare una reazione senza intervenire sulla T, è di enorme importanza in alcuni tipi di reazione. Ad esempio le proteine reagiscono velocemente
CATALISI L'uso di un catalizzatore, sostanza capace di accelerare una reazione senza intervenire sulla T, è di enorme importanza in alcuni tipi di reazione. Ad esempio le proteine reagiscono velocemente
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
EQUILIBRIO CHIMICO. Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2. C (g) + D (g)
 EQUILIBRIO CHIMICO Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2 C (g) + D (g) le velocità della reazione diretta e inversa sono esprimibili in funzione delle concentrazioni dei reagenti
EQUILIBRIO CHIMICO Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2 C (g) + D (g) le velocità della reazione diretta e inversa sono esprimibili in funzione delle concentrazioni dei reagenti
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa.
 La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa. ChimicaGenerale_lezione17 1 L'Equilibrio Chimico Nella chimica
La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa. ChimicaGenerale_lezione17 1 L'Equilibrio Chimico Nella chimica
v: velocità di reazione (verso destra, cioè dai reagenti ai prodotti)
 Capitolo n 2 1. Concetti fondamentali Le reazioni chimiche sono dei processi termodinamici, cioè delle trasformazioni di sistemi chimici, in cui i reagenti (stato iniziale) si trasformano nei prodotti
Capitolo n 2 1. Concetti fondamentali Le reazioni chimiche sono dei processi termodinamici, cioè delle trasformazioni di sistemi chimici, in cui i reagenti (stato iniziale) si trasformano nei prodotti
ASPETTI CINETICI DI UNA REAZIONE CHIMICA
 ASPETTI CINETICI DI UNA REAZIONE CHIMICA Alcune delle reazioni che avvengono attorno a noi sono istantanee, come l'esplosione di una mina; altre richiedono tempi superiori al minuto e sono dette veloci,
ASPETTI CINETICI DI UNA REAZIONE CHIMICA Alcune delle reazioni che avvengono attorno a noi sono istantanee, come l'esplosione di una mina; altre richiedono tempi superiori al minuto e sono dette veloci,
Il Gas Ideale. Il gas ideale é un'astrazione
 Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
2. Indicare l'affermazione che descrive più accuratamente il comportamento di un catalizzatore:
 1. "L'energia di attivazione, cioè l'energia necessaria a formare un composto ad alta energia potenziale, intermedio della reazione (il cosiddetto complesso attivato), è una grandezza caratteristica di
1. "L'energia di attivazione, cioè l'energia necessaria a formare un composto ad alta energia potenziale, intermedio della reazione (il cosiddetto complesso attivato), è una grandezza caratteristica di
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 16 L equilibrio chimico 1. L equilibrio dinamico 2. L equilibrio chimico: anche i prodotti reagiscono
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 16 L equilibrio chimico 1. L equilibrio dinamico 2. L equilibrio chimico: anche i prodotti reagiscono
Abbiamo fino ad ora considerato reazioni che vanno totalmente a compimento, come, ad esempio:
 EQUILIBRIO HIMIO Abbiamo fino ad ora considerato reazioni che vanno totalmente a compimento, come, ad esempio: H (g) + O (g) H O(g) Se mescoliamo due moli di H ed una mole di O alla fine della reazione
EQUILIBRIO HIMIO Abbiamo fino ad ora considerato reazioni che vanno totalmente a compimento, come, ad esempio: H (g) + O (g) H O(g) Se mescoliamo due moli di H ed una mole di O alla fine della reazione
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto
 Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto 1 Teoria del film (Lewis, 1924) Si assume che il trasporto di materia avvenga in uno strato
Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto 1 Teoria del film (Lewis, 1924) Si assume che il trasporto di materia avvenga in uno strato
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica: energia e velocità di reazione
 cbnd Antonio Guermani Scheda n 1 Nome Data Se forniamo al sistema 50 kj di calore e un Per trovare il catalizzatore più adatto per una La sintesi dell'acqua 2H2 + O2 2H2O è lavoro di 40 kj ΔU = 10 kj si
cbnd Antonio Guermani Scheda n 1 Nome Data Se forniamo al sistema 50 kj di calore e un Per trovare il catalizzatore più adatto per una La sintesi dell'acqua 2H2 + O2 2H2O è lavoro di 40 kj ΔU = 10 kj si
ESERCITAZIONI CHIMICA-FISICA I a.a. 2012/2013. Metodo differenziale. Problema
 ESERCITAZIONI CHIMICA-FISICA I a.a. 0/03 Metodo differenziale Problema Per la reazione: A + B P sono stati condotti tre esperimenti cinetici a diverse concentrazioni iniziali dei reagenti. I valori iniziali
ESERCITAZIONI CHIMICA-FISICA I a.a. 0/03 Metodo differenziale Problema Per la reazione: A + B P sono stati condotti tre esperimenti cinetici a diverse concentrazioni iniziali dei reagenti. I valori iniziali
Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI)
 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
Capitolo 10. Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni 1
 Capitolo 10 N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni
Capitolo 10 N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni
EQUILIBRIO CHIMICO 17/01/2014 1
 EQUILIBRIO CHIMICO Le reazioni chimiche, possono suddividersi, a seconda delle modalità con cui avvengono, in due grandi categorie: le reazioni irreversibili le reazioni reversibili le prime sono quelle
EQUILIBRIO CHIMICO Le reazioni chimiche, possono suddividersi, a seconda delle modalità con cui avvengono, in due grandi categorie: le reazioni irreversibili le reazioni reversibili le prime sono quelle
PCl5 (g) <====> PCl3(g) + Cl2(g)
 ESERCITAZIONE 10 DISSOCIAZIONE TERMICA Alcuni gas si decompongono per effetto del riscaldamento in altre sostanze, che possono essere tutte o solo in parte gassose. Ad esempio: PCl5 (g) PCl3(g)
ESERCITAZIONE 10 DISSOCIAZIONE TERMICA Alcuni gas si decompongono per effetto del riscaldamento in altre sostanze, che possono essere tutte o solo in parte gassose. Ad esempio: PCl5 (g) PCl3(g)
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
CINETICA CHIMICA. Studio della velocità di trasformazione della materia. Reazioni a velocità intermedia Reazioni organiche s in soluzione
 CINETICA CHIMICA Studio della velocità di trasformazione della materia Reazioni velocissime H + + OH - (acido/base) < 10-8 s Esplosioni (TNT, KClO 4, etc..) Reazioni veloci 10-3 s Reazioni tra ioni in
CINETICA CHIMICA Studio della velocità di trasformazione della materia Reazioni velocissime H + + OH - (acido/base) < 10-8 s Esplosioni (TNT, KClO 4, etc..) Reazioni veloci 10-3 s Reazioni tra ioni in
Cine%ca enzima%ca. Copyright 2013 Zanichelli editore S.p.A.
 Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Chimica e laboratorio
 ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
1. Le equazioni di reazione 2. I calcoli stechiometrici 3. Reagente limitante e reagente in eccesso 4. La resa di reazione 5. I vari tipi di reazione
 Unità 15 Le reazioni chimiche 1. Le equazioni di reazione 2. I calcoli stechiometrici 3. Reagente limitante e reagente in eccesso 4. La resa di reazione 5. I vari tipi di reazione 6. Le reazioni di sintesi
Unità 15 Le reazioni chimiche 1. Le equazioni di reazione 2. I calcoli stechiometrici 3. Reagente limitante e reagente in eccesso 4. La resa di reazione 5. I vari tipi di reazione 6. Le reazioni di sintesi
Equilibri chimici. Consideriamo la seg. reazione chimica in fase omogenea: aa + bb î cc + dd Definiamo, in ogni istante della reazione:
 Equilibri chimici Consideriamo la seg. reazione chimica in fase omogenea: aa + bb î cc + dd Definiamo, in ogni istante della reazione: con A, B, C, D espressi come concentrazioni molari. Il sistema si
Equilibri chimici Consideriamo la seg. reazione chimica in fase omogenea: aa + bb î cc + dd Definiamo, in ogni istante della reazione: con A, B, C, D espressi come concentrazioni molari. Il sistema si
Termodinamica classica
 Termodinamica classica sistema termodinamico: insieme di corpi di cui si studiano le proprieta fisiche macroscopiche e le loro variazioni nel tempo ambiente termodinamico: insieme dei corpi con cui il
Termodinamica classica sistema termodinamico: insieme di corpi di cui si studiano le proprieta fisiche macroscopiche e le loro variazioni nel tempo ambiente termodinamico: insieme dei corpi con cui il
Principi di cinetica chimica per il corso di Chimica Fisica I
 Principi di cinetica chimica per il corso di Chimica Fisica I. Definizione di velocità di reazione Consideriamo una reazione generica: a A + b B c C + d D Come misura della velocità di reazione si assume
Principi di cinetica chimica per il corso di Chimica Fisica I. Definizione di velocità di reazione Consideriamo una reazione generica: a A + b B c C + d D Come misura della velocità di reazione si assume
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Gas ideale: velocità delle particelle e pressione (1)
 Gas ideale: velocità delle particelle e pressione (1) In un gas ideale le particelle sono considerate puntiformi e risentono di forze solo durante gli urti (perfettamente elastici) con le pareti del recipiente.
Gas ideale: velocità delle particelle e pressione (1) In un gas ideale le particelle sono considerate puntiformi e risentono di forze solo durante gli urti (perfettamente elastici) con le pareti del recipiente.
Leggi dei gas. PV = n RT SISTEMI DI PARTICELLE NON INTERAGENTI. perché le forze tra le molecole sono differenti. Gas perfetti o gas ideali
 Perché nelle stesse condizioni di temperatura e pressione sostanze differenti possono trovarsi in stati di aggregazione differenti? perché le forze tra le molecole sono differenti Da che cosa hanno origine
Perché nelle stesse condizioni di temperatura e pressione sostanze differenti possono trovarsi in stati di aggregazione differenti? perché le forze tra le molecole sono differenti Da che cosa hanno origine
Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo
 1 Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo Limitazioni della prima legge della termodinamica 2 E = q + w E universo = E sistema + E ambiente E sistema =
1 Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo Limitazioni della prima legge della termodinamica 2 E = q + w E universo = E sistema + E ambiente E sistema =
DIFETTI PUNTUALI INTRINSECI
 DIFETTI PUNTUALI INTRINSECI Calcolo della concentrazione di difetti di equilibrio con la termodinamica statistica: La creazione di un difetto richiede energia ( H f ) ma comporta un grande aumento degli
DIFETTI PUNTUALI INTRINSECI Calcolo della concentrazione di difetti di equilibrio con la termodinamica statistica: La creazione di un difetto richiede energia ( H f ) ma comporta un grande aumento degli
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Il I principio della termodinamica. Calore, lavoro ed energia interna
 Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Organismi viventi ed energia
 Termodinamica ORGANISMI VIVENTI ED ENERGIA...2 Primo principio della termodinamica...5 Secondo principio della termodinamica...6 energia libera di Gibbs (G)...9 Variazione di energia libera in una reazione
Termodinamica ORGANISMI VIVENTI ED ENERGIA...2 Primo principio della termodinamica...5 Secondo principio della termodinamica...6 energia libera di Gibbs (G)...9 Variazione di energia libera in una reazione
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 14 Le reazioni chimiche 1. Le equazioni di reazione 2. I calcoli stechiometrici 3. Reagente
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 14 Le reazioni chimiche 1. Le equazioni di reazione 2. I calcoli stechiometrici 3. Reagente
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
v = d [C] dt d [A] dt CINETICA
![v = d [C] dt d [A] dt CINETICA v = d [C] dt d [A] dt CINETICA](/thumbs/62/47041456.jpg) CINETICA La termodinamica dà informazioni sulla possibilità che un processo avvenga in determinate condizioni, ma non dice nulla sulla velocità con cui un processo possibile avviene in realtà La cinetica
CINETICA La termodinamica dà informazioni sulla possibilità che un processo avvenga in determinate condizioni, ma non dice nulla sulla velocità con cui un processo possibile avviene in realtà La cinetica
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 18 Le reazioni chimiche 3 Sommario 1. Le equazioni di reazione 2. I calcoli stechiometrici 3. Reagente limitante e reagente in
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 18 Le reazioni chimiche 3 Sommario 1. Le equazioni di reazione 2. I calcoli stechiometrici 3. Reagente limitante e reagente in
Combustione. Energia chimica. Energia termica Calore. Combustibili fossili
 Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
La formula chimica di una sostanza nota la sua composizione %
 La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
Lo schema più semplice di intervento di un catalizzatore C nella reazione fra due composti A e B è il seguente:
 Un catalizzatore è una sostanza (un elemento o un composto) in grado di modificare la velocità di una reazione chimica senza essere consumato alla fine della reazione stessa, rendendo possibili reazioni
Un catalizzatore è una sostanza (un elemento o un composto) in grado di modificare la velocità di una reazione chimica senza essere consumato alla fine della reazione stessa, rendendo possibili reazioni
TERMODINAMICA E TERMOCHIMICA
 TERMODINAMICA E TERMOCHIMICA La TERMODINAMICA è una scienza chimico-fisica che studia le trasformazioni dell energia. La TERMOCHIMICA è una particolare branca della termodinamica che valuta quantitativamente
TERMODINAMICA E TERMOCHIMICA La TERMODINAMICA è una scienza chimico-fisica che studia le trasformazioni dell energia. La TERMOCHIMICA è una particolare branca della termodinamica che valuta quantitativamente
Capitolo 16 L energia si trasferisce
 Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Riassunto Termodinamica
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Riassunto Termodinamica Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Riassunto Termodinamica Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/
Scritto chimica generale
 Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
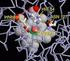 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
CONVENZIONE SUI SEGNI
 CONVENZIONE SUI SEGNI Si stabilisce una convenzione sui segni sia per gli scambi di calore che per il lavoro che il sistema compie o subisce L>0: LAVORO COMPIUTO DAL SISTEMA Q>0: CALORE ASSORBITO SISTEMA
CONVENZIONE SUI SEGNI Si stabilisce una convenzione sui segni sia per gli scambi di calore che per il lavoro che il sistema compie o subisce L>0: LAVORO COMPIUTO DAL SISTEMA Q>0: CALORE ASSORBITO SISTEMA
