Alcheni e dieni. Gli alcheni
|
|
|
- Celia Brunelli
- 6 anni fa
- Visualizzazioni
Transcript
1 Alcheni e dieni Gli alcheni Gli alcheni sono gli idrocarburi alifatici insaturi caratterizzati dalla presenza di un doppio legame, il gruppo funzionale caratteristico di questa famiglia, e hanno formula bruta generale: CnH2n dove n è un numero intero 2 In questi composti ognuno dei due atomi di carbonio coinvolti nel doppio legame ha ibridazione sp 2 e quindi una struttura trigonale planare con i tre orbitali sp 2 che si trovano sullo stesso piano diretti ai vertici di un triangolo equilatero con angoli approssimativi di 120. Il restante orbitale p, occupato da un solo elettrone, è formato da due lobi che giacciono sopra e sotto il precedente piano. Il doppio legame è costituito da: un forte legame σ, dovuto alla sovrapposizione assiale tra gli orbitali sp 2 di due atomi di carbonio adiacenti, un più debole legame π che si forma per sovrapposizione laterale dei lobi dei restanti orbitali 2 p dei due atomi di carbonio, posti perpendicolarmente agli orbitali ibridi. Nell etilene ogni atomo di carbonio forma tre forti legami σ (uno C C e due C H) che giacciono tutti sullo stesso piano e un più debole legame π (C C) le cui due nuvole elettroniche si trovano sopra e sotto al piano degli atomi. Rispetto ad un legame semplice C C, il legame doppio C = C: è più forte (163 kcal/mol contro 88 Kcal/mol); ha una lunghezza di legame minore (1,34 nm contro 1,54 nm) perché due doppietti elettronici condivisi trattengono i nuclei più di uno solo; impedisce la libera rotazione attorno al legame C C (per averla si dovrebbe rompere il legame π). La rigidità del doppio legame è all origine dell isomeria geometrica. è molto più reattivo. Tutti gli altri atomi di carbonio presenti, facendo parte di una normale catena satura, sono ibridati sp 3 e quindi hanno geometria tetraedrica con angoli di 109, 5. L alchene più semplice è l etene o etilene, C2H4. Anche gli alcheni costituiscono una serie omologa cioè sono una serie di composti nella quale ogni termine differisce da quello successivo per una quantità costante che è, come per gli alcani, il gruppo CH2.
2 Nomenclatura Le regole IUPAC per gli alcheni sono analoghe a quelle per gli alcani e si differenziano solo per le specifiche relative alla presenza del doppio legame. In particolare: 1) La desinenza caratteristica degli alcheni è ene. I primi due composti hanno, accanto ai nomi IUPAC, un nome comune molto utilizzato CH2 = CH2 etene (etilene) CH2 = CH propene (propilene) 2) Il nome base è quello della catena continua di atomi di carbonio più lunga che contiene il doppio legame H2C = C CH2 CH2 è un butene e non un pentene 3) La numerazione della catena deve iniziare dall estremità della catena base che permette di assegnare agli atomi di carbonio del doppio legame i numeri di posizione più bassi. Per indicare la posizione del doppio legame è sufficiente indicare un solo numero, quello dell atomo di carbonio di questo legame più basso H2C = C CH2 CH2 2 etil 1 butene CH CH2 C = CH 3,5 dimetil 2 esene. CH = CH CH2 CH CH2 CH 4,6 dimetil 2 ottene. 4) La nomenclatura delle ramificazioni segue le regole usuali. Due importanti gruppi hanno nomi comuni da ricordare: CH2 = CH vinile (e non etenile) CH2 = CH CH2 allile (e non 2 propenile) 5) L impedimento alla libera rotazione attorno al doppio legame comporta la formazione di isomeri geometrici che devono essere denominati in maniera diversa, utilizzando i prefissi cis e trans.
3 Isomeria di posizione e isomeria geometrica Gli idrocarburi alifatici insaturi presentano tre tipi di isomeria, per cui composti pur avendo la stessa formula grezza/molecolare, sono diversi e quindi hanno struttura e proprietà diverse. Accanto all isomeria di struttura [stesso numero di atomi di carbonio ma catene lineari o ramificate], già incontrata negli alcani, gli alcheni presentano altri due tipi di isomeria: l isomeria di posizione e l isomeria geometrica. 1) L isomeria di posizione si verifica quando due alcheni hanno la stessa formula di struttura, ma differiscono per la posizione del doppio legame CH2 = CH CH2 1 butene CH = CH 2 butene Nell 1 e nel 2 butene la catena lineare degli atomi di carbonio è la stessa e i due composti differiscono solo per la posizione del doppio legame. N.B. Non esiste il 3 butene. Con l allungarsi della catena il numero dei possibili isomeri di posizione aumenta. 2) L isomeria geometrica si verifica quando i due alcheni, identici anche per l ordine con cui gli atomi sono legati tra di loro, differiscono per il modo in cui gli atomi legati al doppio legame sono orientati nello spazio. Esistono, per esempio, due isomeri geometrici del 2 butene ( CH = CH ) che presentano la stessa sequenza con cui gli atomi sono legati fra di loro e stessa posizione del doppio legame, ma diversa disposizione nello spazio degli atomi posizionati attorno al doppio legame. Per descrivere questo tipo di isomeria, le formule di struttura devono simulare dei modelli tridimensionali e vanno scritte in maniera tale da rispettare non solo il collegamento degli atomi fra loro ma anche la relativa posizione spaziale reciproca assunta nella molecola. L isomeria geometrica che è un particolare tipo di stereoisomeria (isomeria che si realizza nello spazio tridimensionale) è dovuta alla presenza del legame π che, con le sue due nuvole elettroniche posizionate sopra e sotto il piano degli atomi coinvolti nel doppio legame, impedisce la libera rotazione attorno al doppio legame C = C. Per distinguere i due isomeri geometrici si utilizzano i prefissi cis e trans. Utilizzando i modelli a sfere: L isomero cis ha i gruppi simili (ma possono anche essere semplicemente due atomi di H) dalla stessa parte rispetto al doppio legame L isomero trans ha i gruppi simili (ma possono anche essere semplicemente due atomi di H) da parti opposte rispetto al doppio legame.
4 Utilizzando le formule di struttura: N.B. Non c è isomeria geometrica quando ad uno dei due atomi di carbonio del doppio legame sono legati due sostituenti uguali. H H C = C 2 metil 1 butene Non c è isomeria geometrica CH2 La stereochimica degli alcheni più sostituiti è relativamente complessa perché non sempre ci sono due gruppi uguali a cui fare riferimento e quindi non sono utilizzabili i prefissi cis e trans. In questi casi si è stabilito di assegnare ai vari sostituenti una priorità, basata sul numero atomico e sulla lunghezza della catena, e di anteporre al nome, tra parentesi, la lettera E (dal tedesco entgegen = opposti), se i gruppi a più alta priorità si trovano da parti opposte rispetto al doppio legame o la lettera Z (dal tedesco zusammen = insieme), quando i gruppi prioritari si trovano dalla stessa parte. Nell esempio i gruppi legati al doppio legame sono in ordine di grandezza e quindi di priorità: CH2CH2CH2 > CH2 > > H CH2 H C = C CH2CH2CH2 CH2 H C = C CH2CH2CH2 (E) 4 metil 3 - ottene (Z) 4 metil 3 ottene Dieni I dieni sono gli idrocarburi alifatici insaturi caratterizzati dalla presenza di due doppi legami e hanno formula bruta generale: CnH2n - 2 dove n è un numero intero 2 Questi idrocarburi sono denominati utilizzando il suffisso adiene e la catena è numerata al fine di dare agli atomi di carbonio dei doppi legami i numeri più bassi possibili. CH2 CH = CH CH CH = CH 2,5 ottadiene
5 Sono detti dieni coniugati quelli nei quali i legami doppi e semplici si alternano. Questi composti si distinguono dagli altri dieni per una supplementare stabilità (effetto risonanza) e per una reattività particolare. CH2 = CH CH = CH2 1,3 butadiene La maggiore stabilità dell 1,3 butadiene è legata al fatto che il legame C2 C3 è più corto (1,47 nm) di un normale legame semplice degli alcani (1,54 nm) e questo prova che il legame tra quei due atomi ha una certa % di doppio legame. Da ciò si può dedurre che i doppi legami non sono fissi fra i carboni C1 C2 e C3 C ma delocalizzati sull intera molecola: effetto risonanza. Un diene coniugato molto importante perché monomero (unità base) della gomma sintetica, una delle famiglie di polimeri industrialmente più sfruttati, è l isoprene (2 metil 1,3 butadiene). CH2 = C CH = CH2 isoprene L unità isoprenica è presente anche in molte sostanze organiche naturali come i terpeni, che costituiscono gli oli essenziali di molte piante e fiori e gli steroidi, una importante classe di lipidi. Mappa reattività alcheni
6 Reazioni di preparazioni degli alcheni (Reazione di eliminazione) Gli alcheni fino a 5 atomi di carbonio si ottengono puri dall industria petrolifera, gli altri si possono preparare mediante reazioni di eliminazione il cui meccanismo generale prevede l allontanamento di atomi o gruppi di atomi da due carboni adiacenti. C C C = C + X Y reazione di eliminazione X Y Le principali reazioni con cui si preparano gli alcheni o, ancora più importante, si introduce un doppio legame, in una qualsiasi molecola organica, sono: 1) Deidroalogenazione degli alogenuri alchilici alcool C C + KOH C = C + KX + H2O H X L eliminazione di un acido alogenidrico (HCl, HBr, HI, HF) dal corrispondente alogenuro alchilico avviene ad opera di basi forti, come KOH, in soluzione alcolica. La reattività degli alogenuri alchilici è: 3 > 2 > 1. È, con la disidratazione degli alcoli, la reazione di preparazione degli alcheni più importante. Meccanismo: lo ione ossidrile OH - strappa uno ione H + al carbonio, mentre in contemporanea l alogenione, solvatato, viene allontanato dalle molecole dell alcool con formazione del doppio legame. Se l alogeno non è in posizione terminale, viene, di preferenza, allontanato l H legato all atomo di carbonio più sostituito (cioè con più gruppi alchilici) e, di conseguenza, si forma l alchene più ramificato (Regola di Sayteff). CH2CH + KOH CH = CH + CH2CH=CH2 80 % 20 % Cl 2) Disidratazione degli alcooli acido C C C = C + H2O H OH La disidratazione avviene in ambiente acido (H2SO4 o H3PO4) ad almeno 200 C o con Al2O3 (allumina) a C. Anche in questo caso si elimina l idrogeno legato all atomo di carbonio più sostituito e quindi si forma l alchene più ramificato. La facilità di disidratazione degli alcoli è: 3 > 2 > 1
7 Meccanismo: Avviene in più stadi al contrario della precedente deidroalogenazione in cui l alogeno e l idrogeno si staccano contemporaneamente. Nel primo stadio, uno ione H + si lega (protonazione) al gruppo OH dell alcool con formazione di un buon gruppo uscente, una molecola di acqua, che si allontana mentre si forma un carbocatione cioè un atomo di carbonio ibridato sp 2 con l orbitale p perpendicolare vuoto e quindi caricato positivamente. I tre stadi della reazione: I carbocationi avendo solo 6 elettroni al posto dei soliti 8 sono molto reattivi e quindi si combinano velocemente. In questo caso si allontana uno ione H + e i due elettroni del legame C H vanno a formare il doppio legame dell alchene. Tutte e tre le reazioni sono equilibri e quindi facilmente reversibili e tali da portare alla formazione degli alcoli a partire dagli alcheni; per questo motivo i meccanismi con cui può avvenire l eliminazione (E1 ed E2) saranno approfonditi quando si studieranno gli alcool... H + H :OH H O H H + H + H2O + H + R C C R C C R C C R C = C 3) Dealogenazione di dialogenuri alchilici vicinali: acetone C C + Zn C = C + ZnX2 X X Di uso molto limitato perché di norma avviene la reazione opposta. È utilizzata soprattutto come protezione del doppio legame se si deve operare su un altra parte della molecola per poi rigenerarlo con zinco. In alternativa allo zinco si può utilizzare il magnesio. CHCH + Zn Br Br CH = CH + ZnBr2 4) Idrogenazione degli alchini: Pd C C + H2 CH = CH Questa reazione non è una eliminazione ma una addizione di idrogeno ad un triplo legame in presenza di un catalizzatore. È necessario utilizzare un catalizzatore avvelenato cioè parzialmente disattivato per evitare che il processo di idrogenazione continui fino all alcano.
8 Molto utilizzato è il catalizzatore di Lindlar, costituito da palladio su carbonato di calcio avvelenato con sali di piombo, che ha anche il grande vantaggio di formare l alchene cis. H H C C + H2 C = C cis 2 butene Reazioni degli alcheni (Reazioni di addizione) La reattività di questa classe di idrocarburi è strettamente dipendente dalla presenza del doppio legame formato da un forte legame σ assiale e da un più debole legame π laterale che costituisce il punto di attacco della molecola. Le reazioni tipiche del doppio legame sono reazioni di addizione durante le quali si verifica la rottura di questo legame π e di un legame σ del reagente con formazione di due legami σ; poiché i legami σ sono più forti (di circa kcal/mole) dei legami π, la reazione è complessivamente favorita. Si chiama reazione di addizione quella in cui due molecole si combinano per formare una sola molecola e lo schema generale è: C = C + X Y C C X Y Questo tipo di reazioni è possibile solo in presenza di atomi con due o più coppie di elettroni condivisi cioè di atomi legati con legami multipli. Gli elettroni π, che si trovano sopra e sotto il piano della molecola, esercitano un azione di attrazione minore rispetto a quelli σ nel tenere uniti i nuclei dei due atomi di carbonio e, nello stesso tempo, sono meno legati ai due atomi. Il doppio legame si comporta quindi come una fonte di elettroni (base di Lewis) e la reazione avviene grazie all attacco di reattivi elettrofili, cioè alla ricerca di elettroni (es H +, Cl +, + ); per questo motivo l addizione più tipica al doppio legame è una addizione elettrofila. Anche la geometria molecolare favorisce l attacco dei reagenti elettrofili perché la nube degli elettroni π, disposta sopra e sotto il piano, è aggredibile con relativa facilità. Esiste un altra famiglia di addizioni al doppio legame, anche se meno importante: l addizione radicalica.
9 a) Meccanismo e regola di Markovnicov Addizione elettrofila L addizione elettrofila avviene grazie all attacco di un reagente elettrofilo (E + ) e la conseguente formazione di un carbocatione (stadio lento) a cui poi si lega (stadio veloce) il nucleofilo (:Nu - ) sull orbitale vuoto sp 2 del carbocatione. L addizione avviene di preferenza in posizione trans e l elettrofilo e il nucleofilo si legano da parti opposte. Nell addizione elettrofila si forma sempre il carbocatione più stabile cioè il più ramificato. Da questa osservazione è derivata la regola di Markovnikov, secondo la quale, nell addizione ai doppi legami, l elettrofilo si lega all atomo di carbonio che presenta il maggior numero di atomi di idrogeno. Per i carbocationi alchilici l ordine di stabilità è il seguente: C + > CH + > CH2 + > + Terziario > Secondario > Primario > Metile La stabilità è dovuta ad un effetto induttivo elettrondonatore dei gruppi alchilici. Questi, essendo più elettronegativi di un atomo di idrogeno, accrescono la densità elettronica dell atomo di carbonio con la carica positiva (in un certo senso lo riforniscono di elettroni) e quindi lo stabilizzano riducendone, in parte, la carica. b) Le reazioni di addizione elettrofila
10 b1) Addizione di acidi alogenidrici (HX) Un alchene (in etere) addiziona HCl, HBr o HI per formare i corrispondenti alogenuri alchilici C = C + HX C C H X Gli acidi alogenidrici sono sostanze che contengono un idrogeno ionizzabile e l elettrofilo che provoca l attacco è lo ione H + che si lega al doppio legame con formazione del carbocatione più stabile. Il secondo passaggio è l unione del carbocatione con il nucleofilo X CH = CH2 + H : Cl CH + : Cl :.. + CH : Cl :.. CH Cl NB: lo ione H + si lega all atomo di carbonio che ha più atomi di carbonio (a chi più ha, più sarà dato) b2) Addizione di acqua (Idratazione) L acqua si somma, in ambiente acido, agli alcheni più reattivi formando gli alcoli. La reazione è relativamente semplice e quindi l idratazione degli alcheni è la principale fonte industriale degli alcoli inferiori. C = C + H2O C C H OH C = CH2 + H2O C OH L addizione, che segue la regola di Markovnikov, è una reazione reversibile. b3) Addizione di alogeni Gli alcheni sommano facilmente cloro e bromo (la reazione è quasi istantanea e avviene a temperatura ambiente) tanto che l addizione di bromo (Br2) è utilizzata come saggio qualitativo per il riconoscimento della presenza di un doppio legame CH = CH + Cl2 CH CH Cl Cl
11 b4) Addizione di idrogeno (Idrogenazione) Gli alcheni sono facilmente ridotti ad alcani con idrogeno in presenza di un catalizzatore. I catalizzatori più utilizzati sono metalli, come palladio, platino o nichel, finemente suddivisi e dispersi su una matrice di carbone. C = C + H2 C C H H L idrogenazione catalitica dei doppi legami è impiegata nell industria alimentare per trasformare gli oli vegetali in margarina o in altri grassi alimentari. La margarina, per esempio, viene ottenuta per idrogenazione dell olio di soia, di arachidi, di mais o di cotone fino ad ottenere una consistenza simile a quella del burro. Classico esempio di idrogenazione di un trigliceride Addizione radicalica L altra importante famiglia di addizioni al doppio legame segue un meccanismo completamente diverso perché la specie reattiva è un radicale libero. A questo tipo di reazioni appartengono l addizione di HBr (in presenza di perossidi) e la polimerizzazione. a) Addizione radicalica di HBr: meccanismo e prodotti L addizione di HBr agli alcheni, se avviene in presenza di perossidi e di luce, porta a prodotti che, in apparenza, non rispettano la regola di Markovnikov con l idrogeno che si lega all atomo di carbonio che ha meno idrogeni e formazione dell alogenuro meno ramificato.
12 CH = CH2 + HBr Br CH CH2 CH2Br Al buio: addizione elettrofila Luce e perossidi: addizione radicalica L anomalia è giustificata con il diverso meccanismo con cui avviene la reazione che, in queste condizioni, è di tipo radicalico. reazioni R O O R 2 R O. formazione due radicali liberi inizio catena R O. + H : Br R O H + Br. radicale che provoca l attacco al doppio legame Br. R C = C + Br. R C C Si forma il radicale più stabile reazioni R R propagazione Br H Br. Si riforma il catena R C C + H : Br R C C + Br. radicale Br. R R NB L addizione radicalica, in realtà, rispetta la regola di Markovnikov però in questo caso si forma il radicale più stabile, cioè quello più sostituito, in quanto l attacco è condotto da Br.. b) Polimerizzazione radicalica degli alcheni: meccanismo e prodotti La polimerizzazione è un processo che porta alla formazione di macromolecole, i polimeri, (dal greco molte parti ) per unione di molte piccole molecole, dette monomeri (dal greco una parte ). Dall etilene, scaldato sotto pressione e in presenza di ossigeno, si ottiene un alcano a catena molto lunga (MM circa u), noto come polietilene, la materia plastica di moltissimi recipienti flessibili; dal cloruro di vinile, in presenza di perossidi, si ottiene il PVC (cloruro di polivinile). Molti altri gruppi possono essere presenti come sostituenti nell etilene a formare materie plastiche aventi usi e proprietà molto differenti. n CH2 = CH2 etilene ~ CH2 CH2 CH2 CH2 CH2 CH2 ~ ossia ( CH2 CH2 )n polietilene n CH2 = CH ~ CH2 CH CH2 CH CH2 CH ~ ossia ( CH2 CH )n Cl Cl Cl Cl Cl cloruro di vinile polivinilcloruro
13 Il meccanismo è radicalico e la reazione richiede la presenza di piccole quantità di un iniziatore, spesso un perossido, che si decompone formando un radicale libero che dà avvio all addizione. R O O R 2 R O. formazione radicali liberi inizio catena R O. + CH2 = CH R O CH2 CH. R R catena R O CH2 CH. + CH2 = CH R O CH2 CH CH2 CH. di reazioni R R R R Questa reazione è un esempio di polimerizzazione a catena in cui in ogni passaggio si consuma una particella reattiva per produrne una simile altrettanto reattiva. Reazioni dei dieni coniugati Mentre i dieni isolati, nei quali tra i doppi legami ci sono almeno due legami semplici C C (esempio, CH2 = CH CH2 CH2 CH = CH2), danno le normali reazioni degli alcheni, i dieni coniugati, nei quali si alternano legami doppi e semplici (esempio CH2 = CH CH = CH2), oltre a dare tutte le reazioni tipiche degli alcheni (idrogenazione, addizione elettrofila e radicalica) mostrano alcune particolarità: a) reagiscono più velocemente nelle reazioni di addizione elettrofila perché si formano intermedi di reazione più stabili; b) accanto alla normale reazione di addizione 1,2 cioè l addizione sui due atomi di carbonio di un solo doppio legame, presentano l addizione coniugata 1,4 sul primo e sull ultimo dei quattro carboni del sistema dienico. Meccanismo addizione 1,4: Nel primo passaggio l elettrofilo, il protone H +, si addiziona all atomo di carbonio terminale in accordo con la regola di Markovnikov: H + + CH2 = CH CH = CH2 + CH CH = CH2 Il carbocatione che si forma è stabilizzato per risonanza, essendo un ibrido di due strutture in cui gli elettroni π sono disposti in maniera differente: + + CH CH = CH2 CH = CH CH
14 La carica positiva è delocalizzata sia sul carbonio 2, sia sul carbonio 4 e quindi, quando, nel passaggio successivo, il carbocatione somma il nucleofilo (lo ione Br - ), se questo reagisce con il carbonio 2, si ha l addizione 1,2 classica mentre se reagisce con il carbonio 4, si ha l addizione 1,4. CH2 = CH CH = CH2 + HBr 1, 3 butadiene Br CH2 = CH CH addizione 1,2 (bassa temperatura) CH = CH CH2 Br addizione 1,4 (temperatura più alta) A bassa temperatura ( 60 C) prevale l addizione 1,2 mentre a temperatura ambiente prevale il prodotto dell addizione1,4. La spiegazione è piuttosto complessa e tiene conto di un diverso controllo (cinetico o termodinamico) per cui non viene riportata [vedere: reazioni_ dieni_ alchini pdf]. L addizione 1,4 è possibile per la natura speciale del butadiene e degli alcheni coniugati che presentano le seguenti caratteristiche: a) il legame C2 C3 è più corto (1,47 nm) di un normale legame semplice degli alcani (1,54 nm) e questo prova che il legame tra quei due atomi ha una certa % di doppio legame; b) la molecola del butadiene ha una struttura planare e anche questo conferma la presenza di una piccola % di doppio legame tra C2 e C3; c) il calore di idrogenazione è più basso rispetto a quello dei corrispondenti dieni non coniugati e quindi queste molecole sono più stabili. Da ciò si può dedurre che i doppi legami non sono fissi fra gli atomi di carbonio C1 C2 e C3 C4, ma delocalizzati sull intera molecola che è meglio descritta da tre strutture in cui gli elettroni π sono disposti in maniera differente, effetto risonanza : _ + + : CH2 CH = CH CH2 CH2 = CH CH = CH2 CH2 CH = CH CH2 : Un importante esempio di addizione 1,4 è la reazione di Dies Alder: una cicloaddizione, cioè una addizione che porta alla formazione di un prodotto ciclico, in cui tre legami π sono trasformati in due legami σ e un nuovo legame π. I due reagenti sono un diene e un dienofilo e la reazione è così importante per la preparazione dei composti ciclici che i due scopritori, i chimici tedeschi Otto Diels e Kurt Alder hanno ricevuto il premio Nobel per la chimica nel Meccanismo: nuovo legame π H CH2 CH2 C CH2 CH CH2 + C CH2 CH CH2 H CH2 CH2 1, 3 butadiene etilene cicloesene nuovo legame σ nuovo legame σ
15 Proprietà fisiche degli alcheni Hanno proprietà fisiche, molto simili a quelle dei corrispondenti alcani. Essendo composti che appartengono ad una serie omologa, le proprietà variano in maniera regolare al variare della massa molecolare e della forma più o meno ramificata della molecola. In questo caso, però, le proprietà dipendono anche da: posizione del doppio legame isomeria cis/trans. 1) Temperatura di ebollizione e di fusione e stato di aggregazione A temperatura e pressione ambiente, i primi tre alcheni (da C2 a C4) sono gassosi, fino a 15 atomi di carbonio sono liquidi mentre a partire da C16 diventano solidi. Fatta eccezione per gli alcheni più piccoli, la temperatura di ebollizione aumenta di C per ogni atomo di carbonio aggiunto alla catena e la ramificazione fa abbassare la temperatura di ebollizione. Le temperature di fusione e di ebollizione sono molto simili a quelle degli alcani con ugual numero di atomi di carbonio perché anche le molecole degli alcheni, che comprendono solo legami covalenti puri sono apolari e quindi le uniche interazioni possibili sono le forze di Van der Waals tra i dipoli indotti che sono solo debolmente attrattive ed agiscono a corta distanza. A causa della maggior mobilità degli elettroni π del doppio legame, però, i momenti dipolari, pur essendo molto piccoli, sono comunque maggiori di quelli degli alcani, e questo fattore si riflette soprattutto negli isomeri cis che hanno temperatura di ebollizione più alto e temperatura di fusione più bassa del corrispondente isomero trans. 2) Solubilità Gli alcheni come i dieni sono solubili nei solventi apolari e insolubili in acqua o in solventi più o meno polari. Come solventi, gli alcheni liquidi sciolgono composti apolari o, al massimo, molto debolmente polari: per questo motivo è possibile far scoppiare un palloncino (gomma sintetica) utilizzando la buccia di un arancia che contiene il limonene. 3) Densità Sono meno densi dell acqua e la densità aumenta all aumentare delle dimensioni dell alchene, tendendo al valore limite di 0,8 g/cm 3. Fonti degli alcheni Gli alcheni si ottengono su scala industriale soprattutto nel cracking del petrolio: quelli inferiori (fino a 5 atomi di carbonio) si ottengono puri per distillazione frazionata mentre quelli superiori, che non possono essere separati facilmente si utilizzano in miscele o si preparano con le reazioni di preparazione viste in precedenza.
16 Per quantità di produzione, l etilene è forse il primo composto della chimica organica industriale, seguito dal propene. L etilene è un ormone prodotto dalle piante dove svolge il ruolo di far germinare i semi, maturare i frutti, appassire i petali dei fiori e le foglie. I chimici hanno sfruttato queste proprietà mettendo a punto composti di sintesi in grado di rilasciare in maniera controllata piccole quantità di etilene (i vegetali sono molto sensibili a questo composto che causa un aumento della respirazione e l idrolisi della cellulosa già a concentrazioni inferiori a 0,1 p.p.m.) per: indurre in alcuni prodotti agricoli (orzo, pomodori, cotone, diversi frutti) una maturazione uniforme e quindi ottenere una raccolta efficiente; accelerare artificialmente la maturazione di quei tipi di frutta che, per motivi commerciali si raccolgono sulla pianta prima che siano giunti a completa maturazione, perché in queste condizioni sono in genere più resistenti alle sollecitazioni del trasporto dal luogo di origine ai mercati di utilizzo. Le banane, che vengono generalmente raccolte in Sud America o in Africa ancora verdi per garantire la corretta distribuzione sul mercato mondiale, una volta giunte sul luogo di vendita vengono soffiate con etilene e raggiungono velocemente la maturazione. Questo processo è però possibile solo per i frutti climaterici che hanno la proprietà di poter continuare la maturazione quando sono staccati dalla pianta e quindi mele, kiwi, banane, cachi ma non arance, limoni, fragole, uva). Le mele, tra i frutti climaterici, sono forse quelle con il più alto tasso di produzione di etilene, così che fungono da stimolatore per la maturazione degli altri frutti. Caravaggio Canestro di frutta (1598) Bibliografia e sitografia essenziale: R. T. Morrison, R. N. Boyd Chimica organica Casa Editrice Ambrosiana G. Valitutti, G. Fornari, M.T. Gando Chimica organica, biochimica e laboratorio Zanichelli H. Hart, C. Hadad, L. Craine, D. Hart Chimica organica Zanichelli
CHIMICA ORGANICA. Gli alcheni
 1 2-ALENI IMIA ORGANIA ALENI Formula generale n 2n Desinenza -ene Gli alcheni La prima classe di idrocarburi insaturi è quella degli alcheni, detti anche olefine, che presentano lungo la catena uno o più
1 2-ALENI IMIA ORGANIA ALENI Formula generale n 2n Desinenza -ene Gli alcheni La prima classe di idrocarburi insaturi è quella degli alcheni, detti anche olefine, che presentano lungo la catena uno o più
CHIMICA ORGANICA. Gli alchini
 1 C3-ALCHINI CHIMICA ORGANICA ALCHINI Formula generale C n n 2 Desinenza -ino Gli alchini Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carboniocarbonio e sono anch essi classificati
1 C3-ALCHINI CHIMICA ORGANICA ALCHINI Formula generale C n n 2 Desinenza -ino Gli alchini Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carboniocarbonio e sono anch essi classificati
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Gli Alcheni : struttura e nomenclatura
 Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
CHIMICA ORGANICA. Gli esteri
 1 E8-ESTERI CHIMICA RGANICA ESTERI Formula generale R C R' Desinenza -ato Gli esteri I composti organici di questa classe presentano una struttura che deriva da quella degli acidi carbossilici in cui,
1 E8-ESTERI CHIMICA RGANICA ESTERI Formula generale R C R' Desinenza -ato Gli esteri I composti organici di questa classe presentano una struttura che deriva da quella degli acidi carbossilici in cui,
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale.
 Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
DIENI CONIUGATI. ADDIZIONE DI HCl. addotto 1,2 80% 20%
 DIENI NIUGATI wwwpianetachimicait I dieni coniugati sono diversi dai dieni isolati perché hanno lunghezze anomale dei legami e perché sono più stabili termodinamicamente dato che liberano meno energia
DIENI NIUGATI wwwpianetachimicait I dieni coniugati sono diversi dai dieni isolati perché hanno lunghezze anomale dei legami e perché sono più stabili termodinamicamente dato che liberano meno energia
I LIPIDI (GRASSI) Cosa sono
 I LIPIDI (GRASSI) Cosa sono Comunemente chiamati "grassi", i lipidi comprendono una grande varietà di molecole, accomunate dalla caratteristica di essere insolubili in acqua. I lipidi più importanti dal
I LIPIDI (GRASSI) Cosa sono Comunemente chiamati "grassi", i lipidi comprendono una grande varietà di molecole, accomunate dalla caratteristica di essere insolubili in acqua. I lipidi più importanti dal
MEMBRANE. struttura: fosfolipidi e proteine
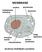 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
ITI Manciano Classe 3 A.S. 2009-10 Docente: Gianni ROMEO Test n. 3 di Chimica Organica pagina 1 di 8
 ITI Manciano lasse 3 A.S. 2009-10 Docente: Gianni ROMEO Test n. 3 di himica Organica pagina 1 di 8 Argomento: TEST N. 3 (il correttore del test è a pag. 3) Gli alcheni parte I; argomenti precedentemente
ITI Manciano lasse 3 A.S. 2009-10 Docente: Gianni ROMEO Test n. 3 di himica Organica pagina 1 di 8 Argomento: TEST N. 3 (il correttore del test è a pag. 3) Gli alcheni parte I; argomenti precedentemente
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico
 gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
CHIMICA ORGANICA Gli alcani e i cicloalcani
 1 C1-ALCANI E CICLOALCANI CHIMICA ORGANICA Gli alcani e i cicloalcani ALCANI Formula generale C n H 2n+2 Desinenza -ano Gli alcani Gli alcani, detti anche paraffine, appartengono alla classe degli idrocarburi
1 C1-ALCANI E CICLOALCANI CHIMICA ORGANICA Gli alcani e i cicloalcani ALCANI Formula generale C n H 2n+2 Desinenza -ano Gli alcani Gli alcani, detti anche paraffine, appartengono alla classe degli idrocarburi
- lipidi strutturali, costituenti fondamentali delle membrane cellulari ed intracellulari (fosfolipidi, glicolipidi e colesterolo)
 I lipidi, o grassi, costituiscono un gruppo eterogeneo di sostanze accomunate dalla proprietà fisica della insolubilità nei solventi polari (es. acqua) (idrofobicità) e dalla solubilità nei soventi organici
I lipidi, o grassi, costituiscono un gruppo eterogeneo di sostanze accomunate dalla proprietà fisica della insolubilità nei solventi polari (es. acqua) (idrofobicità) e dalla solubilità nei soventi organici
L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer
 L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer Un atomo di carbonio con almeno due sostituenti identici e la sua immagine speculare sono sovrapponibili e quindi eguali atomo1.c3d Un atomo
L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer Un atomo di carbonio con almeno due sostituenti identici e la sua immagine speculare sono sovrapponibili e quindi eguali atomo1.c3d Un atomo
Chimica Organica. Breve storia della chimica organica
 Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
ALIFATICI AROMATICI (Areni) POLIENI BENZENE e derivati CICLOALCHENI CICLOALCANI ALCHINI
 CIMICA ORGANICA IDROCARBURI Gli idrocarburi sono composti che contengono solo atomi di e C e, a seconda del tipo di legami chimici presenti nella molecola, possono essere suddivisi secondo il seguente
CIMICA ORGANICA IDROCARBURI Gli idrocarburi sono composti che contengono solo atomi di e C e, a seconda del tipo di legami chimici presenti nella molecola, possono essere suddivisi secondo il seguente
ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n
 Alcani ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n H 2n+1, m/z 43, 57, 71, 85, 99 ), con intensità massima per i cationi a
Alcani ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n H 2n+1, m/z 43, 57, 71, 85, 99 ), con intensità massima per i cationi a
4) 8 g di idrogeno reagiscono esattamente con 64 g di ossigeno secondo la seguente reazione:
 Esercizi Gli esercizi sulla legge di Lavoisier che seguono si risolvono ricordando che la massa iniziale, prima della reazione, deve equivalere a quella finale, dopo la reazione. L uguaglianza vale anche
Esercizi Gli esercizi sulla legge di Lavoisier che seguono si risolvono ricordando che la massa iniziale, prima della reazione, deve equivalere a quella finale, dopo la reazione. L uguaglianza vale anche
I differenti materiali differiscono per le caratteristiche meccaniche e fisiche.
 MATERIALI COMPOSITI I differenti materiali differiscono per le caratteristiche meccaniche e fisiche. I METALLI hanno forma cristallina e forti legami molecolari (legame metallico), che danno loro resistenza
MATERIALI COMPOSITI I differenti materiali differiscono per le caratteristiche meccaniche e fisiche. I METALLI hanno forma cristallina e forti legami molecolari (legame metallico), che danno loro resistenza
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
L'energia media V di interazione fra uno ione avente carica q e un dipolo permanente ad una distanza r Ä
 Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
Chimica organica. Biomolecole. Tessuti biologici. Polimeri proprietà funzioni
 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni 1 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni C O N 1 Chimica organica Biomolecole Tessuti biologici
Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni 1 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni C O N 1 Chimica organica Biomolecole Tessuti biologici
APPUNTI DI TECNOLOGIA
 APPUNTI DI TECNOLOGIA LA PLASTICA Classificazione e tipi Fabbricazione Riciclaggio DOWNLOAD MAPPA CONCETTUALE published by Danilo Eandi 2013 NOTA dell autore Prof. Danilo Eandi, docente di Tecnologia presso
APPUNTI DI TECNOLOGIA LA PLASTICA Classificazione e tipi Fabbricazione Riciclaggio DOWNLOAD MAPPA CONCETTUALE published by Danilo Eandi 2013 NOTA dell autore Prof. Danilo Eandi, docente di Tecnologia presso
ELASTOMERI ELASTOMERI
 ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
Problema 1 Mg + 2HCl H 2 + MgCl 2. di Mg 1 Mg 1 H 2 quindi 0,823 moli di H 2 di H 2
 REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
L idrogeno. Cennii sull comportamento chiimiico dellll iidrogeno
 Appunti di Chimica Preparazione dell idrogeno L idrogeno...1 Cenni sul comportamento chimico dell idrogeno...1 Richiami sul legame ad idrogeno...2 Preparazione dell idrogeno...3 Il problema della riduzione
Appunti di Chimica Preparazione dell idrogeno L idrogeno...1 Cenni sul comportamento chimico dell idrogeno...1 Richiami sul legame ad idrogeno...2 Preparazione dell idrogeno...3 Il problema della riduzione
CHIMICA ORGANICA II. Fabrizio Mancin
 CIMICA RGANICA II Fabrizio Mancin Dipartimento di Scienze Chimiche Edificio Chimica rganica, II Piano, Stanza 5 tel. 049 8275666, e-mail: fabrizio.mancin@unipd.it, http://www.chimica.unipd.it/fabrizio.mancin/
CIMICA RGANICA II Fabrizio Mancin Dipartimento di Scienze Chimiche Edificio Chimica rganica, II Piano, Stanza 5 tel. 049 8275666, e-mail: fabrizio.mancin@unipd.it, http://www.chimica.unipd.it/fabrizio.mancin/
Gli alcool, i composti carbonilici e gli acidi carbossilici
 Gli alcool, i composti carbonilici e gli acidi carbossilici Con questa unità didattica inizieremo a prendere in considerazione dei composti della chimica organica caratterizzati dal contenere oltre ai
Gli alcool, i composti carbonilici e gli acidi carbossilici Con questa unità didattica inizieremo a prendere in considerazione dei composti della chimica organica caratterizzati dal contenere oltre ai
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
Reazioni degli Alcheni e degli Alchini
 Reazioni degli Alcheni e degli Alchini Reazioni di addizione elettrofila La caratteristica comune a tutte le reazioni degli alcheni può essere riassunta dicendo che: gli elettroni del legame relativamente
Reazioni degli Alcheni e degli Alchini Reazioni di addizione elettrofila La caratteristica comune a tutte le reazioni degli alcheni può essere riassunta dicendo che: gli elettroni del legame relativamente
CHIMICA ORGANICA. Gli alcoli
 1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
ALCOLI ed ETERI. Glicerolo (glicerina) Mentolo Colesterolo
 ALLI ed ETEI La sostituzione formale di un idrogeno dell acqua con un radicale alchilico, oppure la sostituzione di un in un alcano con il gruppo (idrossilico), porta ad un alcol. La sostituzione di entrambi
ALLI ed ETEI La sostituzione formale di un idrogeno dell acqua con un radicale alchilico, oppure la sostituzione di un in un alcano con il gruppo (idrossilico), porta ad un alcol. La sostituzione di entrambi
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
LEZIONE 4. Le soluzioni
 LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
SERIE OMOLOGHE E GRUPPI FUNZIONALI.
 SERIE OMOLOGE E GRUPPI FUZIOALI. 1. Le serie omologhe e i gruppi funzionali I composti organici sono estremamente numerosi, ma la loro descrizione può essere semplificata se li si raggruppa in cosiddette
SERIE OMOLOGE E GRUPPI FUZIOALI. 1. Le serie omologhe e i gruppi funzionali I composti organici sono estremamente numerosi, ma la loro descrizione può essere semplificata se li si raggruppa in cosiddette
IDROCARBURI AROMATICI. Scaricato da Sunhope.it
 IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
SCUOLA PRIMARIA DI MAGGIATE Classe terza
 SCUOLA PRIMARIA DI MAGGIATE Classe terza Anno scolastico 2012-2013 TERRE ACQUE Osservando il nostro pianeta possiamo notare che la maggior parte della superficie è occupata dalle acque. Infatti esse occupano
SCUOLA PRIMARIA DI MAGGIATE Classe terza Anno scolastico 2012-2013 TERRE ACQUE Osservando il nostro pianeta possiamo notare che la maggior parte della superficie è occupata dalle acque. Infatti esse occupano
Idrocarburi aromatici. Idrocarburi. Idrocarburi
 Lezioni di himica Generale Elementi chimica organica Prof. Roberto Sebastiano Idrocarburi 1 Molecole costituite solo da atomi di carbonio e idrogeno Idrocarburi alifatici Idrocarburi saturi, solo legami
Lezioni di himica Generale Elementi chimica organica Prof. Roberto Sebastiano Idrocarburi 1 Molecole costituite solo da atomi di carbonio e idrogeno Idrocarburi alifatici Idrocarburi saturi, solo legami
Ruolo del calcio nella cellula
 Ruolo del calcio nella cellula I meccanismi evolutivi hanno attribuito agli ioni fosfato un importanza fondamentale poiché sono necessari per sintetizzare ATP. Per questo motivo la loro concentrazione
Ruolo del calcio nella cellula I meccanismi evolutivi hanno attribuito agli ioni fosfato un importanza fondamentale poiché sono necessari per sintetizzare ATP. Per questo motivo la loro concentrazione
MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA
 MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità
MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità
Degrado dei materiali non-metallici 1 materiali polimerici. Contenuto
 Contenuto o legame chimico C C - legame covalente, energia di legame - struttura tetragonale dei quattro legami del carbonio reazioni di polimerizzazione - poliaddizione, esempi - policondensazione, esempi
Contenuto o legame chimico C C - legame covalente, energia di legame - struttura tetragonale dei quattro legami del carbonio reazioni di polimerizzazione - poliaddizione, esempi - policondensazione, esempi
ARROTONDANDO FIGURE CON TRIANGOLI EQUILATERI
 ARROTONDANDO Cosa succede ad accostare figure identiche una all altra? Le figure ottenute che proprietà presentano? Posso trovare un qualche tipo di legge generale? Per rispondere a questa ed altre domande
ARROTONDANDO Cosa succede ad accostare figure identiche una all altra? Le figure ottenute che proprietà presentano? Posso trovare un qualche tipo di legge generale? Per rispondere a questa ed altre domande
Esercizi Le leggi di Lavoisier, Proust e Dalton
 Per riscaldamento, 123 g di clorato di potassio si decompongono, svolgendo ossigeno e lasciando un residuo di 75 g di cloruro di potassio. Calcola la massa dell ossigeno svolto. clorato di potassio ossigeno
Per riscaldamento, 123 g di clorato di potassio si decompongono, svolgendo ossigeno e lasciando un residuo di 75 g di cloruro di potassio. Calcola la massa dell ossigeno svolto. clorato di potassio ossigeno
Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico
 Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico 43. A 723 K in un reattore dal volume di 5,000 L sono presenti all'equilibrio 3,356 mol di azoto, 4,070 mol di idrogeno
Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico 43. A 723 K in un reattore dal volume di 5,000 L sono presenti all'equilibrio 3,356 mol di azoto, 4,070 mol di idrogeno
LAVORAZIONE DEI POLIMERI I processi per trasformare granuli e pastiglie in prodotti finiti sono numerosi.
 LAVORAZIONE DEI POLIMERI I processi per trasformare granuli e pastiglie in prodotti finiti sono numerosi. Generalmente i polimeri non vengono trasformati allo stato puro, ma miscelati con additivi che
LAVORAZIONE DEI POLIMERI I processi per trasformare granuli e pastiglie in prodotti finiti sono numerosi. Generalmente i polimeri non vengono trasformati allo stato puro, ma miscelati con additivi che
Introduzione alle macchine a stati (non definitivo)
 Introduzione alle macchine a stati (non definitivo) - Introduzione Il modo migliore per affrontare un problema di automazione industriale (anche non particolarmente complesso) consiste nel dividerlo in
Introduzione alle macchine a stati (non definitivo) - Introduzione Il modo migliore per affrontare un problema di automazione industriale (anche non particolarmente complesso) consiste nel dividerlo in
La disposizione estetica della lettera commerciale
 La disposizione estetica della lettera commerciale Gli elementi costitutivi della lettera commerciale vengono disposti sul foglio secondo stili diversi: ogni a- zienda, infatti, caratterizza la sua immagine
La disposizione estetica della lettera commerciale Gli elementi costitutivi della lettera commerciale vengono disposti sul foglio secondo stili diversi: ogni a- zienda, infatti, caratterizza la sua immagine
Programmazione Disciplinare: Chimica Organica e Biochimica Classi: III
 Istituto Tecnico Tecnologico Basilio Focaccia Salerno Programmazione Disciplinare: Chimica Organica e Biochimica Classi: III I Docenti della Disciplina Salerno, lì... settembre 2014 Finalità della Disciplina:
Istituto Tecnico Tecnologico Basilio Focaccia Salerno Programmazione Disciplinare: Chimica Organica e Biochimica Classi: III I Docenti della Disciplina Salerno, lì... settembre 2014 Finalità della Disciplina:
Prova in itinere di Chimica Generale 8 Gennaio 2016 A
 Prova in itinere di Chimica Generale 8 Gennaio 2016 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 8 Gennaio 2016 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
COMPARATORE 1/100 COMPARATORE GRADUATO
 COMPARATORE 1/100 CLASSIFICAZIONE DELLO STRUMENTO: COMPARATORE GRADUATO Avente una approssimazione di 0,01 mm ESIGENZE DI VERIFICA: E utilizzato per il controllo di errori di forma dei pezzi e per misurazioni
COMPARATORE 1/100 CLASSIFICAZIONE DELLO STRUMENTO: COMPARATORE GRADUATO Avente una approssimazione di 0,01 mm ESIGENZE DI VERIFICA: E utilizzato per il controllo di errori di forma dei pezzi e per misurazioni
Gruppi funzionali. La maggior parte delle molecole organiche oltre ai legami C-C e C-H possiedono: - Eteroatomi (O, N, Alogeni);
 --- himica rganica - SG --- --- himica rganica - SG --- Gruppi funzionali Il carbonio forma sempre 4 legami, con l eccezione di intermedi di reazione, che possono avere 3 legami, e dei carbeni, che hanno
--- himica rganica - SG --- --- himica rganica - SG --- Gruppi funzionali Il carbonio forma sempre 4 legami, con l eccezione di intermedi di reazione, che possono avere 3 legami, e dei carbeni, che hanno
L acidità del protone legato al carbonio in α compete con la. quanto accade con gli acidi carbossilici e le ammidi primarie e secondarie
 CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in a ad un gruppo carbonilico (aldeidi, chetoni, esteri) L acidità del protone legato al carbonio in α compete
CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in a ad un gruppo carbonilico (aldeidi, chetoni, esteri) L acidità del protone legato al carbonio in α compete
isomeria di struttura isomeria di posizione isomeria di catena stereoisomeria isomeria di conformazione isomeria di configurazione 'isomeria ottica
 ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
Nuclei concettuali fondamentali di chimica organica
 Nuclei concettuali fondamentali di chimica organica Istruzioni per l uso La seguente dispensa raccoglie e tratta sommariamente i principali nuclei concettuali della chimica organica, la cui conoscenza
Nuclei concettuali fondamentali di chimica organica Istruzioni per l uso La seguente dispensa raccoglie e tratta sommariamente i principali nuclei concettuali della chimica organica, la cui conoscenza
FISICA Corso di laurea in Informatica e Informatica applicata
 FISICA Corso di laurea in Informatica e Informatica applicata I semestre AA 2004-2005 G. Carapella Generalita Programma di massima Testi di riferimento Halliday Resnick Walker CEA Resnick Halliday Krane
FISICA Corso di laurea in Informatica e Informatica applicata I semestre AA 2004-2005 G. Carapella Generalita Programma di massima Testi di riferimento Halliday Resnick Walker CEA Resnick Halliday Krane
La reazione da bilanciare è quindi: Cu + HNO 3 CuNO 3 + NO. Le due semireazioni da bilanciare saranno: HNO 3 NO (1) Cu CuNO 3 (2)
 Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
REGOLE DELLA RISONANZA
 REGOLE DELLA RISONANZA 1. Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di C con cinque valenze 2. La posizione dei nuclei DEVE
REGOLE DELLA RISONANZA 1. Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di C con cinque valenze 2. La posizione dei nuclei DEVE
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
Pillole di... Chimica organica
 ISIS Calabrese-Levi as 2009/2010 Pillole di... Chimica organica dispensa elaborata dalla prof.ssa Silvia Recchia sulla base del testo Chimica interattiva di Passannanti e Sbriziolo, Ed. Tramontana Trenz
ISIS Calabrese-Levi as 2009/2010 Pillole di... Chimica organica dispensa elaborata dalla prof.ssa Silvia Recchia sulla base del testo Chimica interattiva di Passannanti e Sbriziolo, Ed. Tramontana Trenz
Gruppo 10 Nickel Ni (1751)
 Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
Serie completa di Modelli Molecolari per la Chimica Organica
 EdiSES Istruzioni per l utilizzo dei modelli molecolari Serie completa di Modelli Molecolari per la Chimica Organica allegati ai seguenti volumi: Chimica Organica - Paula Y. Bruice Elementi di Chimica
EdiSES Istruzioni per l utilizzo dei modelli molecolari Serie completa di Modelli Molecolari per la Chimica Organica allegati ai seguenti volumi: Chimica Organica - Paula Y. Bruice Elementi di Chimica
INSTALLAZIONE HARDWARE IDP106C Ver. 1.3 BLUE DIMMER INSTALLAZIONE HARDWARE
 INSTALLAZIONE HARDWARE IDP106C Ver. 1.3 BLUE DIMMER INSTALLAZIONE HARDWARE Di seguito vengono forniti gli elementi di base per l installazione e l utilizzo del modulo BLUE DIMMER (modello IDP106C). Il
INSTALLAZIONE HARDWARE IDP106C Ver. 1.3 BLUE DIMMER INSTALLAZIONE HARDWARE Di seguito vengono forniti gli elementi di base per l installazione e l utilizzo del modulo BLUE DIMMER (modello IDP106C). Il
FOCUS SU EQUILIBRI ACIDO-BASE
 1 Ci sono varie definizioni di acidi e basi, tra le quali meritano di essere ricordate quella di Bronsted e quella di Lewis. Per i nostri fini pratici, ovvero gli esercizi, ci basta però ricordare le definizioni
1 Ci sono varie definizioni di acidi e basi, tra le quali meritano di essere ricordate quella di Bronsted e quella di Lewis. Per i nostri fini pratici, ovvero gli esercizi, ci basta però ricordare le definizioni
Alimentazione ed efficienza dei sistemi alimentari
 Corso di laurea magistrale in Scienze e tecnologie animali Alimentazione ed efficienza dei sistemi alimentari Effetti delle tipologie dei consumi alimentari sui flussi della materia e dell energia, sulle
Corso di laurea magistrale in Scienze e tecnologie animali Alimentazione ed efficienza dei sistemi alimentari Effetti delle tipologie dei consumi alimentari sui flussi della materia e dell energia, sulle
Il TU 81/2008 con le modifiche del D.lgs 39/2016
 Il TU 81/2008 con le modifiche del D.lgs 39/2016 Titolo IX Il D.lgs 39/2016 entrato in vigore il 29 marzo 2016, modifica così il Testo Unico Sicurezza Riferimento TU Testo ante modifiche Testo modificato
Il TU 81/2008 con le modifiche del D.lgs 39/2016 Titolo IX Il D.lgs 39/2016 entrato in vigore il 29 marzo 2016, modifica così il Testo Unico Sicurezza Riferimento TU Testo ante modifiche Testo modificato
CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq) + H 2 O (l)
 2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
Mole e modelli atomici
 www.matematicamente.it La mole e i modelli atomici dai test di medicina 1 Mole e modelli atomici Domande tratte dai test di ammissione a medicina, odontoiatria e veterinaria 1. Quale delle seguenti affermazioni
www.matematicamente.it La mole e i modelli atomici dai test di medicina 1 Mole e modelli atomici Domande tratte dai test di ammissione a medicina, odontoiatria e veterinaria 1. Quale delle seguenti affermazioni
7 Disegni sperimentali ad un solo fattore. Giulio Vidotto Raffaele Cioffi
 7 Disegni sperimentali ad un solo fattore Giulio Vidotto Raffaele Cioffi Indice: 7.1 Veri esperimenti 7.2 Fattori livelli condizioni e trattamenti 7.3 Alcuni disegni sperimentali da evitare 7.4 Elementi
7 Disegni sperimentali ad un solo fattore Giulio Vidotto Raffaele Cioffi Indice: 7.1 Veri esperimenti 7.2 Fattori livelli condizioni e trattamenti 7.3 Alcuni disegni sperimentali da evitare 7.4 Elementi
Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno
 Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
I termini e i concetti fondamentali
 unità Elementi di chimica I termini e i concetti fondamentali 1 la materia e le sue proprietà Le caratteristiche fondamentali della materia sono tre: la massa (m) o quantità di materia di cui sono formati
unità Elementi di chimica I termini e i concetti fondamentali 1 la materia e le sue proprietà Le caratteristiche fondamentali della materia sono tre: la massa (m) o quantità di materia di cui sono formati
Nomenclatura IUPAC e struttura di alcheni e alchini
 Imparare la chimica con l aiuto del computer Nomenclatura IUPAC e struttura di alcheni e alchini Aggiornata alla nuova nomenclatura IUPAC 2009. Con questa esercitazione imparerete a disegnare semplici
Imparare la chimica con l aiuto del computer Nomenclatura IUPAC e struttura di alcheni e alchini Aggiornata alla nuova nomenclatura IUPAC 2009. Con questa esercitazione imparerete a disegnare semplici
INTERAZIONI DELLE RADIAZIONI CON LA MATERIA
 M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
LA LEGGE DI COULOMB PER I MAGNETI
 1 LA LEGGE DI COULOMB PER I MAGNETI Lo scopo di questo esperimento è quello di riprodurre quello storico e importante ormai scomparso dai testi scolastici perché ritenuto non attinente alla realtà. È noto,
1 LA LEGGE DI COULOMB PER I MAGNETI Lo scopo di questo esperimento è quello di riprodurre quello storico e importante ormai scomparso dai testi scolastici perché ritenuto non attinente alla realtà. È noto,
PENSIONI MINIME E MAGGIORAZIONI 2013: ATTENZIONE AI REDDITI
 PENSIONI MINIME E MAGGIORAZIONI 2013: ATTENZIONE AI REDDITI Già da qualche anno sono stati cambiati i parametri con i quali i pensionati possono ottenere le prestazioni pensionistiche legate al reddito.
PENSIONI MINIME E MAGGIORAZIONI 2013: ATTENZIONE AI REDDITI Già da qualche anno sono stati cambiati i parametri con i quali i pensionati possono ottenere le prestazioni pensionistiche legate al reddito.
Problemi ad alta temperatura: Creep (scorrimento viscoso a caldo) Ossidazione
 Problemi ad alta temperatura: Creep (scorrimento viscoso a caldo) Ossidazione Acciai al carbonio Possono essere impiegati fino a 450 C C 0.20% Mn 1.6% Si tra 0.15 e 0.50% S e P 0.040% Per combattere invecchiamento
Problemi ad alta temperatura: Creep (scorrimento viscoso a caldo) Ossidazione Acciai al carbonio Possono essere impiegati fino a 450 C C 0.20% Mn 1.6% Si tra 0.15 e 0.50% S e P 0.040% Per combattere invecchiamento
PROGETTO LS-OSA CORREZIONE QUESITO DI CHIMICA UNA SVISTA IN LABORATORIO COME UTILIZZARE LA RUBRIC. ( In evidenza: le abilità da valutare )
 PROGETTO LS-OSA CORREZIONE QUESITO DI CHIMICA UNA SVISTA IN LABORATORIO COME UTILIZZARE LA RUBRIC ( In evidenza: le abilità da valutare ) INDICAZIONI SEGUITE PER LA FORMULAZIONE DI UNA PROVA DI SIMULAZIONE
PROGETTO LS-OSA CORREZIONE QUESITO DI CHIMICA UNA SVISTA IN LABORATORIO COME UTILIZZARE LA RUBRIC ( In evidenza: le abilità da valutare ) INDICAZIONI SEGUITE PER LA FORMULAZIONE DI UNA PROVA DI SIMULAZIONE
Domanda individuale e domanda di mercato (Frank, Capitolo 4)
 Domanda individuale e domanda di mercato (Frank, Capitolo 4) GLI EFFETTI DELLE VARIAZIONI DI PREZZO: CURVE PREZZO CONSUMO La curva prezzo-consumo per l abitazione rappresenta i panieri ottimali corrispondenti
Domanda individuale e domanda di mercato (Frank, Capitolo 4) GLI EFFETTI DELLE VARIAZIONI DI PREZZO: CURVE PREZZO CONSUMO La curva prezzo-consumo per l abitazione rappresenta i panieri ottimali corrispondenti
CHIMICA ORGANICA. Gli acidi carbossilici
 1 E7-AIDI ARBOSSILII IMIA ORGANIA AIDI ARBOSSILII Formula generale R Desinenza -oico Gli acidi carbossilici Questi composti organici si possono ottenere dalle aldeidi, energici riducenti, che vengono facilmente
1 E7-AIDI ARBOSSILII IMIA ORGANIA AIDI ARBOSSILII Formula generale R Desinenza -oico Gli acidi carbossilici Questi composti organici si possono ottenere dalle aldeidi, energici riducenti, che vengono facilmente
PENDENZE E SISTEMI ANTICADUTA
 CRITERI PROGETTUALI Scheda: CR006 Rev: 10/06/2009 18.26.00 Pagina 1/1 PENDENZE E SISTEMI ANTICADUTA Pendenze La Uni 8088 classifica le coperture secondo la loro pendenza suddividendole in tre principali
CRITERI PROGETTUALI Scheda: CR006 Rev: 10/06/2009 18.26.00 Pagina 1/1 PENDENZE E SISTEMI ANTICADUTA Pendenze La Uni 8088 classifica le coperture secondo la loro pendenza suddividendole in tre principali
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
LICEO SCIENTIFICO STATALE "G.B.QUADRI" VICENZA DOCUMENTO DEL CONSIGLIO DI CLASSE (Regolamento, art.5; O. M. 38 art.6) Anno scolastico 2013-2014
 LICEO SCIENTIFICO STATALE "G.B.QUADRI" VICENZA DOCUMENTO DEL CONSIGLIO DI CLASSE (Regolamento, art.5; O. M. 38 art.6) Anno scolastico 2013-2014 RELAZIONE FINALE DEL DOCENTE All. A Classe: 5 DSA Indirizzo:
LICEO SCIENTIFICO STATALE "G.B.QUADRI" VICENZA DOCUMENTO DEL CONSIGLIO DI CLASSE (Regolamento, art.5; O. M. 38 art.6) Anno scolastico 2013-2014 RELAZIONE FINALE DEL DOCENTE All. A Classe: 5 DSA Indirizzo:
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Energia elettrica. L atomo nel suo complesso è neutro perché ha l equilibrio tra protoni ed elettroni presenti nello stesso numero.
 Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
26 Aprile 1915, 81 compleanno
 Reazioni di addizione-eliminazione eliminazione di composti carbonilici Ammine primarie reagiscono con composti carbonilici per dare immine, anche denominate basi di Schiff 1 Ugo Shiff (1834-1915) 1915)
Reazioni di addizione-eliminazione eliminazione di composti carbonilici Ammine primarie reagiscono con composti carbonilici per dare immine, anche denominate basi di Schiff 1 Ugo Shiff (1834-1915) 1915)
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Gli alimenti e la piramide alimentare
 Ausilioteca del Comune di Firenze - Piattaforma didattica "Facilefacile" - www.ausiliotecafirenze.org/facilefacile Gli alimenti e la piramide alimentare 1. COSA SONO GLI ALIMENTI Si definisce alimento
Ausilioteca del Comune di Firenze - Piattaforma didattica "Facilefacile" - www.ausiliotecafirenze.org/facilefacile Gli alimenti e la piramide alimentare 1. COSA SONO GLI ALIMENTI Si definisce alimento
CdS Ingegneria Industriale: Corso di Chimica
 CdS Ingegneria Industriale: Corso di Chimica Docente : Informazioni generali Candida MILONE cmilone@ingegneria.unime.it Ricevimento Mar e Gio 15:00-17:00 Struttura del corso: Verifiche: 54 ore di lezioni
CdS Ingegneria Industriale: Corso di Chimica Docente : Informazioni generali Candida MILONE cmilone@ingegneria.unime.it Ricevimento Mar e Gio 15:00-17:00 Struttura del corso: Verifiche: 54 ore di lezioni
+ ε (deschermo) ε (schermo) α β α. B o
 Il fenomeno dell accoppiamento di spin Nuclei non equivalenti possono interagire attraverso i loro momenti di spin Ai fini della indagine strutturale di molecole incognite è necessario sario non solo considerare
Il fenomeno dell accoppiamento di spin Nuclei non equivalenti possono interagire attraverso i loro momenti di spin Ai fini della indagine strutturale di molecole incognite è necessario sario non solo considerare
L equilibrio chimico
 L equilibrio chimico Vi sono molte reazioni chimiche che non procedono fino a completezza, cioè fino a che uno dei reagenti non si esaurisca, ad esempio la reazione di dimerizzazione del diossido di azoto:
L equilibrio chimico Vi sono molte reazioni chimiche che non procedono fino a completezza, cioè fino a che uno dei reagenti non si esaurisca, ad esempio la reazione di dimerizzazione del diossido di azoto:
